-
在我国,肺炎链球菌是引起中国婴幼儿和老年人发病和死亡的重要病因,是社区获得性肺炎(community-acquired pneumonia, CAP)、菌血症、儿童化脓性脑膜炎的常见病原菌[1]。2012年亚太地区病原体耐药监测网络数据显示,肺炎链球菌(Streptococcus pneumoniae, S.p)在亚洲地区总体多重耐药比例为59.3%,而在中国的多重耐药比例高达83.3%[2],且部分地区肺炎链球菌耐药率呈逐年增长趋势[3-4]。
莫西沙星属第四代喹诺酮类抗菌药物,DNA拓扑异构酶抑制剂,抗菌谱广,对常见呼吸道病菌特别是肺炎链球菌抗菌作用强大,2016年中国成人CAP诊治指南推荐可选择莫西沙星等喹诺酮类药物作为初始经验性抗感染药物[5]。莫西沙星所有适应证口服给药的常规剂量均为400 mg/d。随着莫西沙星上市以来临床研究的深入,不良反应事件也有所增加[6]。本研究采用微透析方法获取肺炎大鼠肺组织间液中的游离药物浓度,旨在模拟莫西沙星在感染患者靶器官中的药动学变化,探究正常与感染状态下的靶器官药物分布的差异,分析链球菌感染状态下莫西沙星体内代谢动力学的变化。
HTML
-
取Wistar大鼠24只,雄性,SPF级,4~6周龄,其体质量为200~220g(上海斯莱克实验动物有限公司,合格证编号:2007000514232)。随机分为健康组及肺炎组各12只,两组大鼠体质量分别为(210.92±5.95)g和(208.58±5.33)g,无统计学差异(P>0.05)。实验前各组大鼠禁食12 h过夜,动物饲养遵从中华人民共和国实验动物使用协议。
-
CMA402型微量泵、CMA820型微量收集器、血管探针、肺探针(瑞典 CMA公司);ALC-V8S小动物呼吸机(上海奥尔科特生物科技有限公司);安捷伦1100高效液相色谱仪,配有Chemstation工作站;XW-80型涡旋混合器(其林贝尔);Thermo LEGEND Micro 17高速离心机(赛默飞);METTLER AE240电子天平(梅特勒)。莫西沙星标准品(中国食品药品检定研究院,纯度>99%,批号1448606),莫西沙星片(拜耳医药保健有限公司,批号BJ13520);甲醇(HPLC级,Burdick & Jackson公司),乙腈(HPLC级,Merck公司),甲酸(Fluka公司,瑞士)。
-
肺炎链球菌由第二军医大学附属长海医院微生物实验室提供,于接种前1 d接种于血琼脂平板,置于37 ℃ CO2培养箱中培养24 h,用无菌生理盐水稀释成含细菌浓度为0.6×108 cfu/ml的混悬液,备用。质控菌株为肺炎链球菌标准株(ATCC49619 上海宝米科生物科技有限公司提供)。
-
造模:采用气管穿刺法注入菌液建立肺炎大鼠模型。腹腔麻醉后,切开颈部皮肤暴露气管,经气管软骨环间穿刺,注入肺炎链球菌混悬液 0.2 ml(约0.12×108cfu/只),将大鼠直立位20 s,再使大鼠保持右侧卧位10 min,促使菌液充分流入右肺。于接种后第5~7天建立大鼠右侧肺炎模型。所有大鼠实验结束后行病理解剖及肺组织匀浆培养证实建模成功。
-
取造模成功的肺炎大鼠麻醉后,固定于保温垫,在气管上段做一T型切口,插入气管导管,接小动物呼吸机辅助通气,频率75~80次/min,潮气量2.5 ml。于大鼠右侧胸壁做斜行切口,止血钳离断第5肋骨前肋,充分暴露右肺。用注射器针尖稍刺破右肺中叶脏层胸膜,将肺探针向肺门方向钝性植入肺组织,复位肺叶,固定探针并关闭胸腔。切开左侧股静脉,植入血管探针推送至下腔静脉固定。
-
取莫西沙星1片,刮去包衣后磨成细粉末状,加入0.5%羧甲基纤维素钠无菌注射用水溶解,制成混悬溶液,浓度为10 mg/ml。
两组大鼠分别通过灌胃给药的方式注入莫西沙星混悬液,给药剂量按4 ml/kg计算,5 s内注入完毕,立即开始收集血浆及肺组织透析样品。采用HPLC法分别测定前5 h的莫西沙星浓度。
-
(1)色谱条件 色谱柱:Agilent SB-C18 (250 mm×4.6 mm,5.0 µm),流动相:乙腈: 0.1%甲酸水(25:75,V/V);流速:1.0 ml/min,分析时间10 min,柱温:30 ℃,进样量:5 μl,检测波长295 nm。
(2)透析液处理 精密量取100 μl透析液样品,置1.5 ml塑料离心管中,加入200 μl甲醇,漩涡混合30 s后,12000 r/min离心10 min,取200 μl上清液于进样瓶中,进样5 μl进行HPLC分析。
(3)标准曲线与线性范围 取空白透析液100 μl,精密加入莫西沙星标准对照品溶液20 μl旋涡混匀,配成莫西沙星浓度分别为5.00、2.00、1.00、0.50、0.20、0.10及0.05 µg/ml标准含药肺透析液,除不加200μl醇外,其余按“透析液样品处理方法”项下操作,进样分析,记录色谱图,计算莫西沙星峰面积。莫西沙星以肺透析液中待测物浓度(X)为横坐标,莫西沙星峰面积(Y)为纵坐标,求得回归方程:
Y=14.273X+0.555,r=0.999
结果表明莫西沙星在0.05~5.00 µg/ml浓度范围内线性关系良好。
-
配制莫西沙星浓度为0.05 µg/ml的标准含药透析液5份,进行分析,依照当日标准曲线方程求得实测浓度为(0.051 ± 0.004)µg/ml,准确度90.8%~116.66%。结果表明莫西沙星在血浆中的定量下限为0.05 µg/ml,S/N>10,线性关系良好。经逐级稀释,按S/N>3测得莫西沙星在血浆中的检测限为0.015 µg/ml。
-
制备含莫西沙星的浓度分别为0.05、0.50、5.00 µg/ml的标准含药肺透析液(每个浓度做5份),按“肺透析液样品预处理方法”项下操作,进样分析,连续做3 d,计算日内和日间精密度。测得日内精密度RSD分别为6.6281%、2.6247%、2.8282%;日间精密度分别为2.3793%、1.0271%、2.4221%,均小于10%,符合精密度要求。
-
以相对回收率表示,按“标准曲线制备”项下制备含有莫西沙星浓度分别为0.05、0.50、5.00 µg/ml的标准含药肺透析液,按“肺透析液样品预处理方法”项下操作,进样分析,记录色谱峰面积,代入标准曲线方程,计算实测浓度与实际浓度的比值即为相对回收率。结果分别为105.21%、104.82%、106.45%,均在80%~120%范围内,且RSD<10%,符合要求。
-
莫西沙星浓度分别为0.05、0.5、5.0 µg/ml的肺透析液样品各3份,分别进行室温、4 ℃及冻融稳定性考察,RSD均<10%。结果表明样品在上述条件下保持稳定。
-
采用反向透析法测定探针回收率(Rdial),体内实际药物浓度(Cu)由所得透析液浓度(Cm)按公式计算,Cu=Cm/Rdial转化获得。采用Pksolver 2.0软件,以非房室模型计算以下药动学数据:曲线下面积(AUC)、平均滞留时间(MRT)、药物消除半衰期(t1/2)、药物峰浓度(Cmax)、药物在肺部的穿透率(PR=C肺/C血液)、药物的分布系数(AUC肺/AUC血液)。
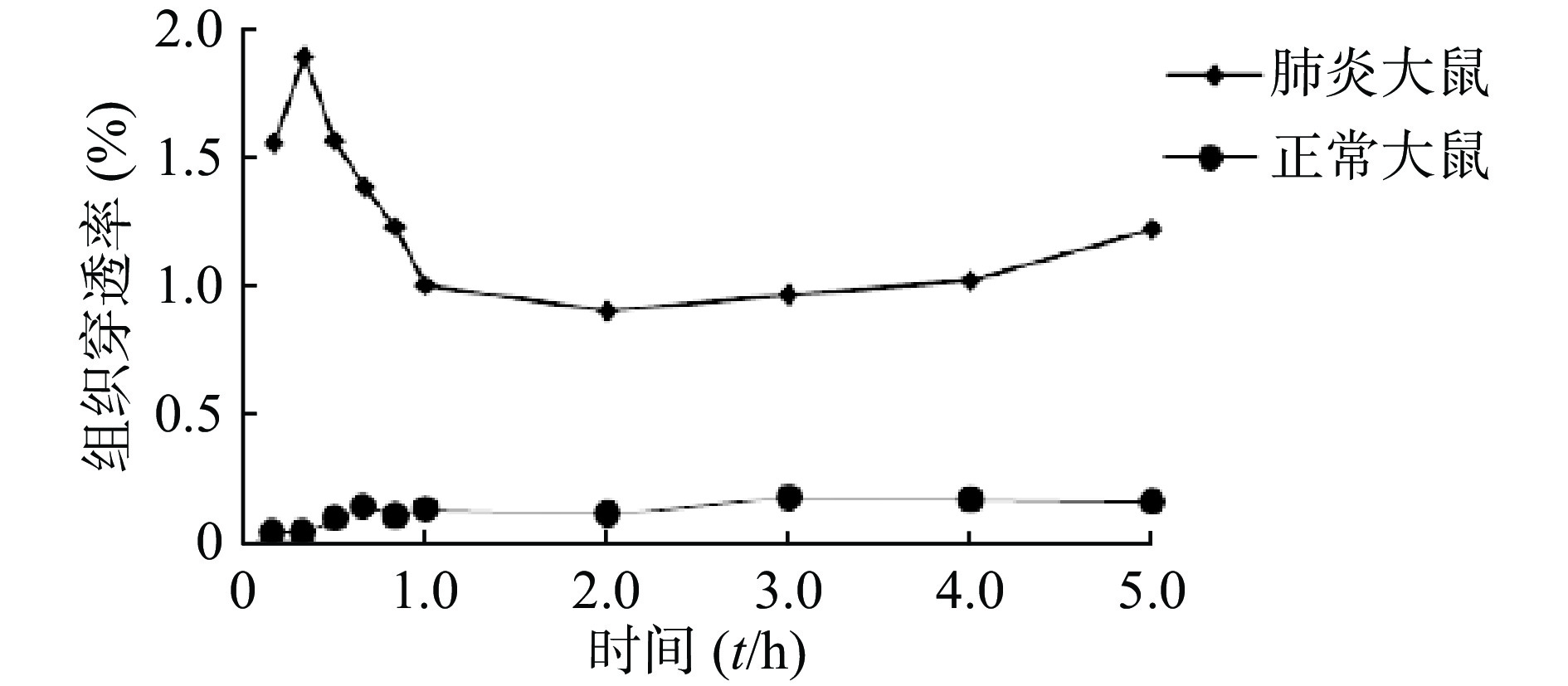
采用SPSS 17.0版统计学软件分析,计量资料采用均值±标准差(
$\bar{x}\pm s$ )表示。药动学参数先经方差齐性分析,符合正态分布者,采用两样本t检验,P<0.05表示其差异有统计学意义。
1.1. 实验动物
1.2. 实验设备与试剂
1.3. 实验菌株
1.4. 实验方法
1.4.1. 动物处理
1.4.2. 探针植入
1.5. 莫西沙星药动学分析
1.5.1. 给药及样本收集
1.5.2. HPLC法测定透析液中莫西沙星含量
1.5.3. 定量限与检测限
1.5.4. 精密度试验
1.5.5. 准确度试验
1.5.6. 稳定性试验
1.6. 数据分析
-
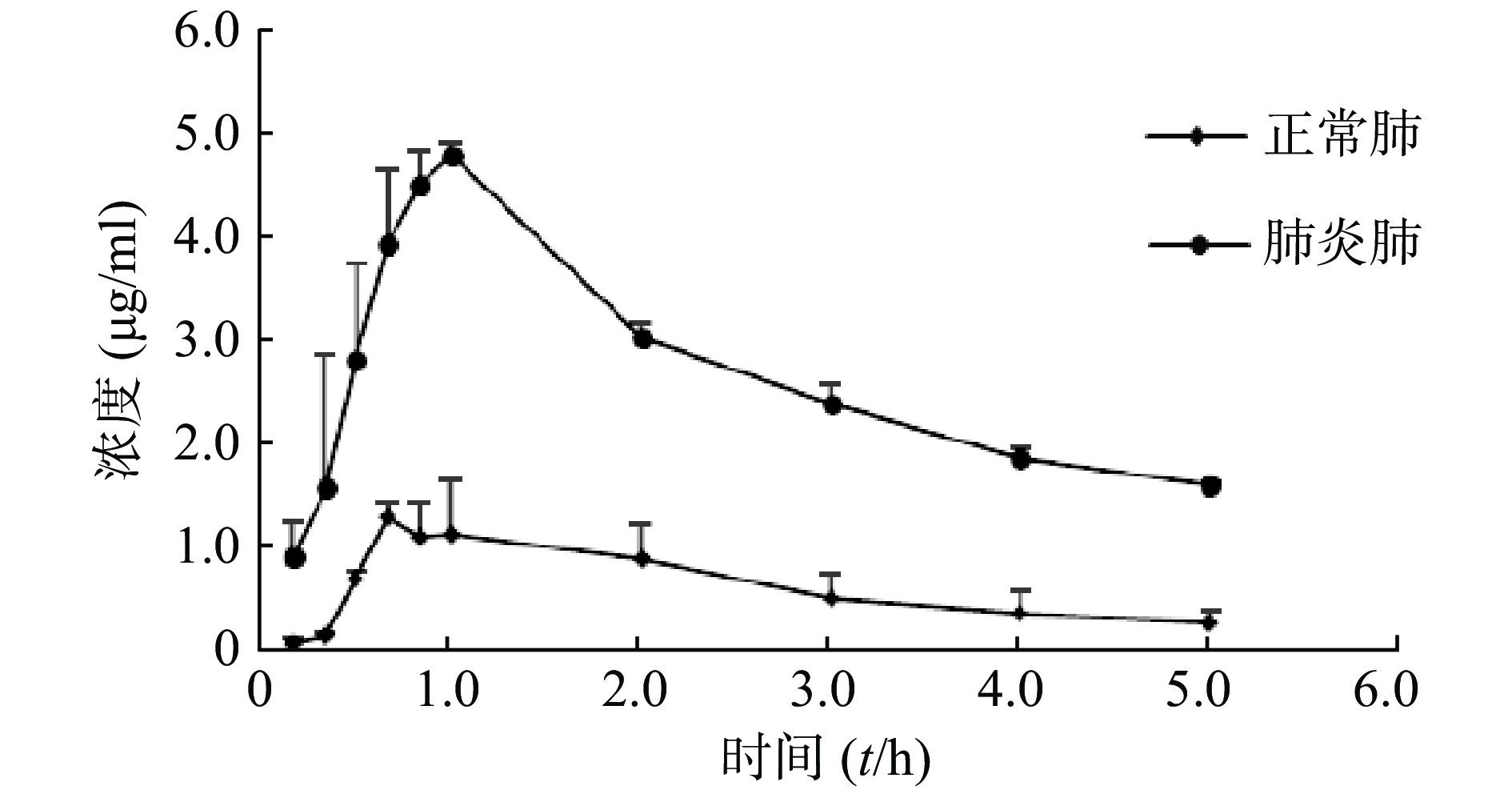
经灌胃给予莫西沙星后,正常大鼠及肺炎大鼠肺组织药物浓度迅速上升,约1 h达峰,随后两者同步下降。整个实验过程肺炎大鼠肺组织浓度均高于正常大鼠,肺炎大鼠肺组织Cmax约为正常大鼠的3.4倍。两组大鼠肺组织中莫西沙星的浓度-时间数据分布情况见图1。
-
灌胃给予莫西沙星后,正常大鼠及肺炎大鼠血浆游离药物浓度明显上升,Cmax无明显差异,两组大鼠血浆中莫西沙星的血药浓度-时间数据分布情况见图2。
-
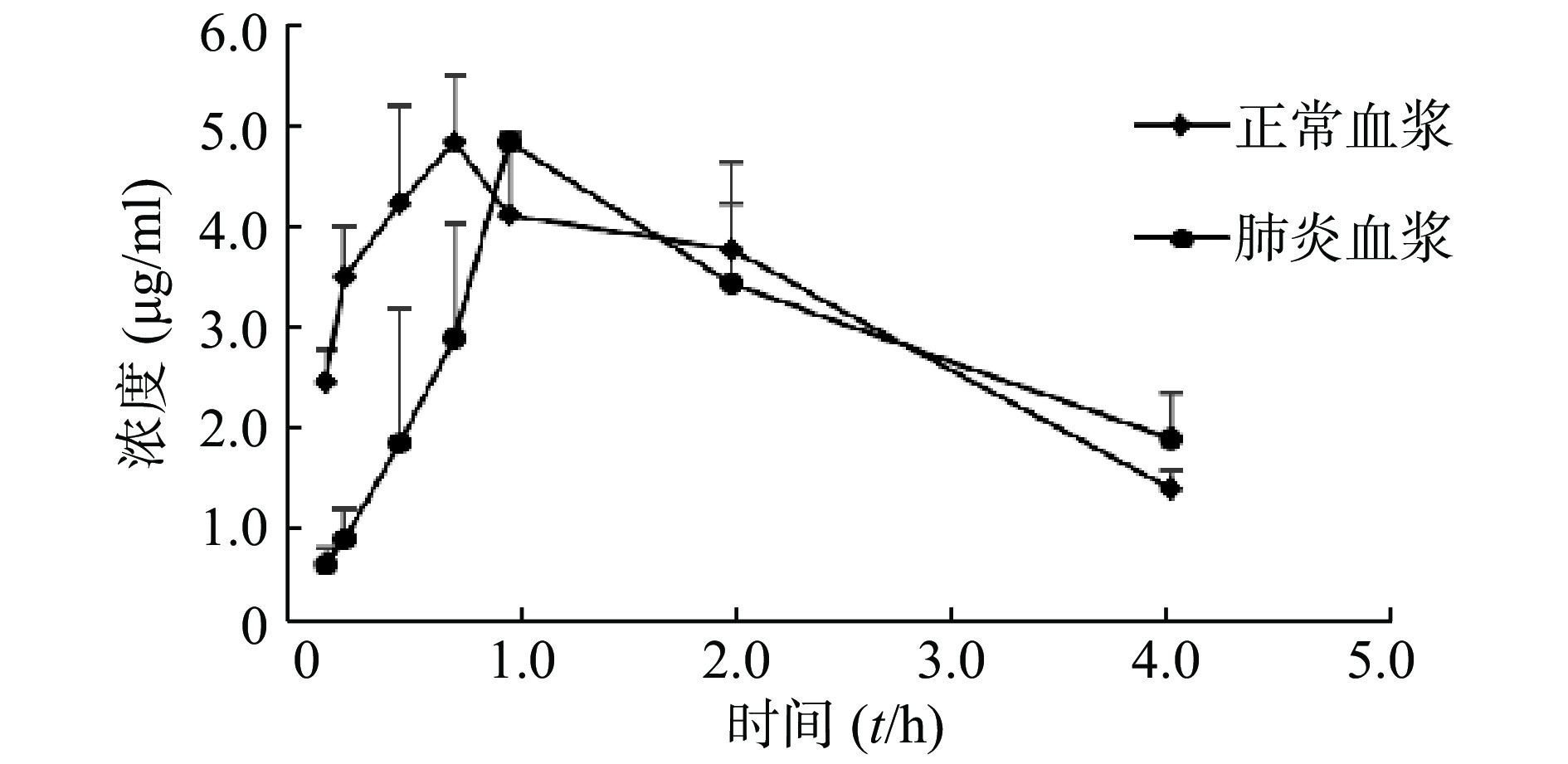
计算各时间点在肺组织中的穿透率(PR值),正常大鼠和肺炎大鼠肺组织穿透率最高分别为0.27和1.87;最低分别为0.16和0.89,平均值分别为0.18±0.10和1.26±0.32(P<0.05),见图3。
-
大鼠灌胃莫西沙星后,正常大鼠及肺炎大鼠药动学参数采用非房室模型进行分析,结果见表1。
参数 单位 血浆 肺组织 正常组 肺炎组 正常组 肺炎组 Lambda_z 1/h 0.2±0.13 0.32±0.01 0.4±0.15 0.21±0.06 t1/2 h 5.27±4.38 2.15±0.07 1.9±0.63 3.39±0.79 Tmax h 0.67±0.14 1±0 0.89±0.2 0.94±0.1 Cmax μg/ml 4.94±0.98 4.83±0.05 1.42±0.05 4.84±0.02## Tlag h 0±0 0±0 0±0 0±0 Clast_obs/Cmax 0.02±0.03 0.27±0.04## 0.18±0.09 0.33±0.01 AUC 0-t μg/ml·h 22.33±2.02 12.88±1.19# 3.06±1.07 13.16±0.53## AUC 0-inf_obs μg/ml·h 23.51±1.41 16.96±1.71 3.77±1.29 20.93±1.35 AUC0-t/0-inf_obs 0.95±0.08 0.76±0.01 0.81±0.09 0.63±0.07# AUMC 0-inf_obs μg/ml·h2 151.89±92.76 62.01±8.56 11.93±5.14 107.01±25.39# MRT 0-inf_obs h 6.41±3.77 3.65±0.14 3.17±0.77 5.07±0.92 Vz/F_obs (mg/kg)/(μg/ml) 13.51±10.9 7.76±0.97 33.98±20.28 9.74±1.72 CL/F_obs (mg/kg)/(μg/ml)·h 1.79±0.11 2.49±0.26# 12.02±3.9 2.01±0.13 #P<0.05,##P<0.01,与正常组比较 正常大鼠及肺炎大鼠肺组织Cmax分别为(1.42±0.05)μg/ml、(4.84±0.02)μg/ml(P<0.01),t1/2分别为(1.9±0.63)h、(3.39±0.79)h(P>0.05),一阶矩曲线下面积AUMC分别为(11.93±5.14)μg/ml·h2、(107.01±25.39)μg/ml·h2(P<0.05),AUC0-t分别为(3.06±1.07)μg/ml·h、(13.16±0.53)μg/ml·h(P<0.01)
-
结合相关报道的最低抑菌浓度(MIC)[7]及防耐药突变浓度(mutant prevention concentration,MPC)[8]值,将本实验结果Cmax和AUC0-∞与之相比,莫西沙星对肺炎链球菌的PK/PD参数见表2 [莫西沙星对肺炎链球菌的MIC90为0.125 mg/L;莫西沙星对肺炎链球菌的MPC90为2 mg/L]。
PK/PD参数 血浆 肺组织 正常组 肺炎组 肺炎组/正常组 正常组 肺炎组 肺炎组/正常组 Cmax/MIC90 39.52 38.64 0.98 11.36 38.72 3.41 AUC0-∞/MIC90 188.08 135.68 0.72 30.16 167.44 5.54 Cmax/MPC90 2.47 2.42 0.98 0.71 2.42 3.41 AUC0-∞/MPC90 11.76 8.48 0.72 1.89 10.47 5.54
2.1. 正常大鼠和肺炎大鼠肺组织药-时曲线
2.2. 正常大鼠和肺炎大鼠血浆药-时曲线
2.3. 肺组织穿透率(PR)
2.4. 主要药动学参数
2.5. 血液中药动学和药效学(PK/PD)参数比较
-
我国的多中心研究结果显示,莫西沙星对肺炎链球菌的敏感度达99%,MIC90为0.125 mg/L[7]。莫西沙星和青霉素类、头孢菌素类、氨基糖苷类、大环内酯类、四环素类抗菌药物均无交叉耐药性,口服生物利用度总计91%,可以被快速吸收并分布到血管外隙,稳态时表观分布容积可以达到21/kg。血浆蛋白结合率为45%,其在肺、窦及炎性损伤组织的药物浓度超过血药浓度。相关研究表明,口服莫西沙星400 mg后,在人肺组织[8]、微支气管镜肺泡灌洗液[9]、痰液[10]中的药时曲线与在血浆中的趋势相似,药物在以上样本中的浓度高于血浆,显示出良好组织穿透性,本研究的前期结果也得出相似的结论[11]。
莫西沙星为浓度依赖性抗菌药,抗生素后效应(PAE)较长,喹诺酮类治疗革兰阳性菌所需的AUC0-24h/MIC靶值为30~40。当PK/PD参数Cmax/MIC≥8~10和AUC0~24h/MIC≥125时可以明显减少氟喹诺酮类药物治疗革兰阴性杆菌、包括铜绿假单胞菌耐药菌出现的危险性[12]。本研究结果表明,莫西沙星在正常及肺炎链球菌感染大鼠血浆和肺组织的Cmax/MIC均远大于8~10,在肺炎大鼠的血浆及肺组织的AUC0-24h/MIC为135.68和167.44,正常大鼠血浆为188.08,远大于125。
耐药突变选择窗(MSW)是指防耐药突变浓度(MPC)与最低抑菌浓度(MIC)之间的浓度范围;当治疗药物浓度高于MPC时,在保证疗效的同时也能防止耐药突变;药物浓度如果在突变选择窗内,即使抑制了敏感菌生长,临床治疗可能成功,但还可能导致耐药突变。近年来在优化喹诺酮类给药方案的研究中,常需评价抗菌药物在耐药突变窗中的存在时间百分比和MPC值。TMSW<20%是预测防止出现耐药的有效参数,本研究药动学参数显示,莫西沙星在正常大鼠及肺炎大鼠的血浆和肺组织中的浓度基本保持在莫西沙星耐药突变选择窗之外。
药物常规剂量是在群体药动学结果和有限临床实践上建立的,大多数患者按照常规剂量会获得较好的临床疗效和安全性,但患者个体差异,生理病理状态都会对药动学参数产生一定影响。近年来,关于抗菌药物PK/PD的研究进展迅速,研究发现重症感染患者与健康人的PK/PD数据明显不同,例如万古霉素在重症感染患者群体分布相较正常人群快,患者存在高代谢和高循环动力状态,因而需要对治疗药物监测与给药方案的调整[13]。一项大样本临床研究表明莫西沙星最常见的药物不良反应为胃肠道症状,口服剂量400 mg/d,发生恶心、腹泻和头晕不良反应事件概率分别为7.1%、5.2%和2.6%[14]。国内也有莫西沙星不良反应的文献报道[15-16],此外,莫西沙星的中枢神经系统潜在危险与其他喹诺酮类药物一致[17],因此老年人、中枢神经系统损伤的老年患者(如癫痫、明显动脉硬化)应当谨慎使用,必要时减量,但目前尚无莫西沙星剂量调整的相关依据。
机体发生感染后,病原菌释放内毒素和外毒素,诱发的全身炎症反应,大量的细胞因子炎性介质释放,引起机体内环境稳态失衡,血管内皮破坏和毛细血管通透性增加,导致体液向第三间隙渗漏迁移[18],这一过程会使组织间分布的亲水性抗生素药物稀释,血浆和组织药物浓度下降,对亲脂性药物影响不大[19]。此外药物在体内以一定比例与血浆蛋白结合, 感染状态下血管通透性增加,蛋白向血管外间隙渗漏增加,以及肝脏合成减少,血浆白蛋白减低引起药物游离比例增多,这可能会增加组织内抗生素分布而增加抗感染效果,但同时可能增加药物的毒性作用[20],莫西沙星是表观分布容积较高的脂溶性药物,在感染状态肺组织浓度较健康状态增高,可能与血管通透性增加,血浆蛋白结合率降低有关。
有研究表明喹诺酮类抗菌药物马波沙星在感染小鼠肺组织的药物浓度是血浆药物浓度的2~3倍[21],多杀性巴氏杆菌感染显著增加了马波沙星的AUC、Cmax、MRT,这与本研究结论相似。肺炎模型大鼠与正常大鼠相比,莫西沙星在血浆中的浓度没有显著差异,而在肺炎大鼠肺组织中的浓度明显高于正常大鼠,最高为正常大鼠肺组织的3.4倍,这提示在肺炎链球菌感染的病理状态下,莫西沙星的肺组织穿透率升高。
莫西沙星在正常小鼠和肺炎链球菌感染小鼠的血浆和肺组织浓度均能够达到杀灭细菌并防止产生耐药性的要求。在感染状态下机体高敏、肝肾功能减退等病理因素可能增加莫西沙星不良反应的发生概率,而在肺炎病理状态下,莫西沙星肺组织AUC0-24h/MIC达到167.44,目前实验数据表明小鼠肺炎链球菌感染时莫西沙星肺组织浓度远高于健康状态,也远大于MIC和MPC,理论上有一定剂量调整的空间,其机制和具体方案还有待进一步实验研究,为优化特殊病人给药方案,调整药物剂量,减少药物不良反应提供可参考的数据。








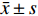
 DownLoad:
DownLoad: