-
防暑清热饮是由广藿香、白茅根、菊花、薄荷、枸杞等药材配伍而成的中药复方制剂。方中广藿香为君药,白茅根、菊花为臣药,薄荷为佐药,枸杞为使药,诸药合用,具有芳香化湿、清热解毒、解渴生津之功效[1]。课题组前期已采用紫外分光光度法对防暑清热饮中总多糖和总黄酮进行质量控制[2]。为了更为全面地控制防暑清热饮的质量,本实验参考现有文献[3-16],采取RP-HPLC法同时测定方中多个活性成分含量,现报道如下。
HTML
-
高效液相色谱仪(AngiLent 1200型,DAD检测器,美国安捷伦科技有限公司),分析天平(AUX220,日本岛津公司)。防暑清热饮(批号:20200120,202002101,202002102,规格:100 ml/瓶,第九〇九医院药剂科),绿原酸对照品(批号:110753-200413)、3,5-O-二咖啡酰奎宁酸(批号:111782-201807)、蒙花苷(批号:111528-201710)和广藿香酮(批号:111822-201904)均购自中国食品药品检定研究院,木犀草素-7-O-β-D-葡糖苷(批号:GZDD-0115,贵州迪大生物科技有限责任公司),甲醇、乙腈为色谱纯,其他试剂为分析纯,水为纯化水。
-
色谱柱ZORBAX-SB-C18 (250 mm ×4.6 mm,5 μm),流动相为0.2%磷酸水溶液(A)-乙腈(B),梯度洗脱0~30 min,88%~82%A;30~45 min,82%~78%A;45~65 min,78%~35%A;65~75 min,35%A;75~78 min,35%~30%A;78~80 min,30%~88%A;80~82 min,88%A;流速为1.0 ml/min,检测波长为327 nm,柱温为30 ℃,进样量20 μl,理论塔板数按3,5-O-二咖啡酰奎宁酸计算应不低于8 000。
-
分别精密称定绿原酸、木犀草素-7-O-β-D-葡糖苷、3,5-O-二咖啡酰奎宁酸对照品适量,置于同一10 ml容量瓶中,加甲醇溶解并定量稀释成每1 ml中含绿原酸2.15 mg、木犀草素-7-O-β-D-葡糖苷1.05 mg、3,5-O-二咖啡酰奎宁酸3.00 mg。分别精密称定蒙花苷和广藿香酮对照品适量置于同一25 ml容量瓶中,加甲醇溶解并定量稀释成每1 ml中含蒙花苷0.21 mg和广藿香酮0.05 mg,作为对照品储备液。精密量取各对照品储备液5 ml,置同一25 ml量瓶中,加甲醇稀释至刻度,摇匀,得混合对照品母液。
-
精密量取防暑清热饮5 ml,置10 ml容量瓶中,加水稀释至刻度,摇匀,即得供试品溶液。
-
按处方量制备不含广藿香、白茅根、菊花和薄荷的阴性样品,按“2.2.2”项下供试品方法制备阴性对照溶液。
-
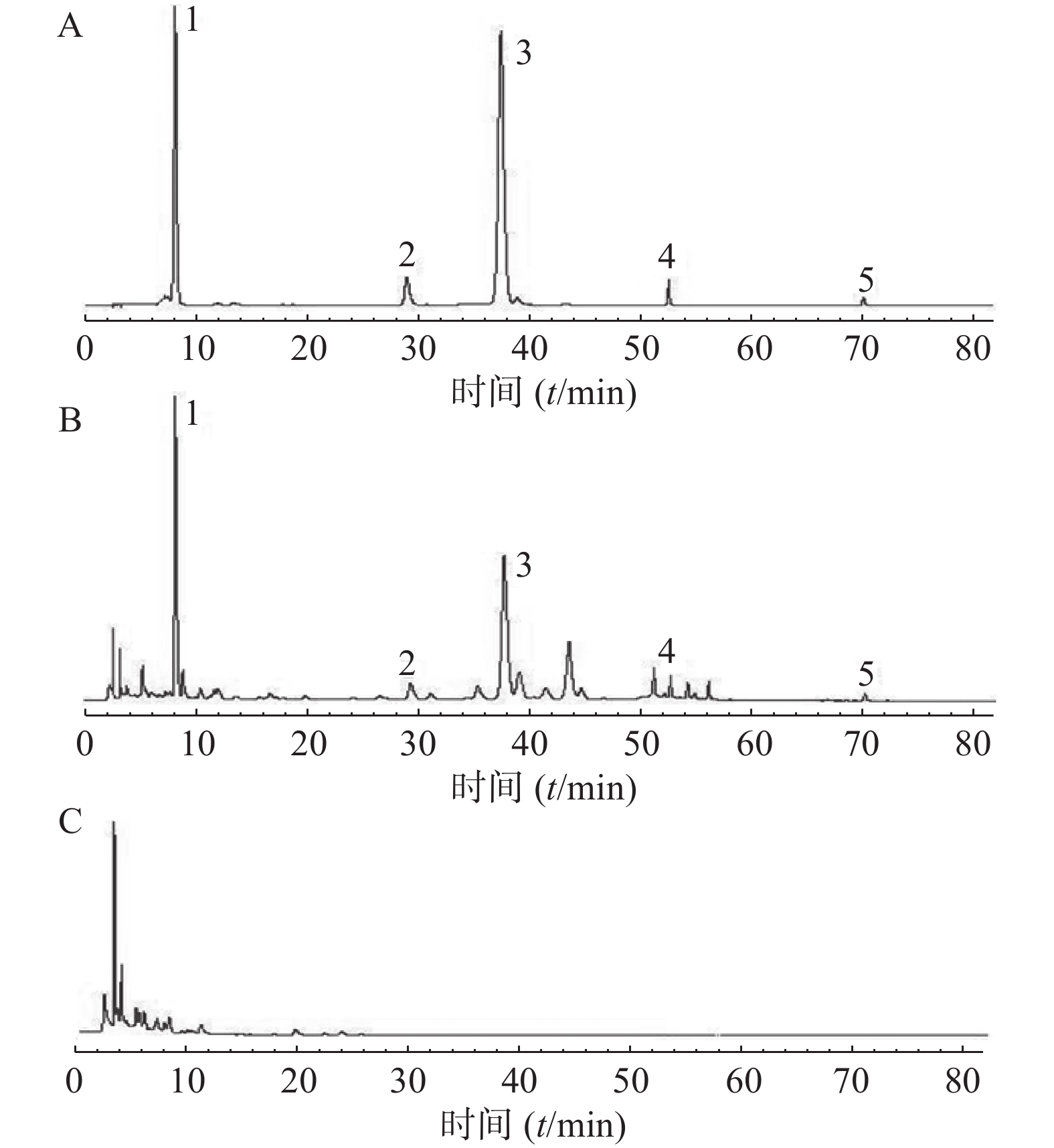
分别取对照品溶液、供试品溶液、阴性对照溶液,按“2.1”项下色谱条件下进样,记录色谱图。结果阴性溶液无干扰,方法专属性良好,见图1。
-
分别精密吸取对照品母液按比例稀释,在上述色谱条件下,分别进样20 μl,以质量浓度X(μg/ml)为横坐标、峰面积Y为纵坐标绘制标准曲线,得线性回归方程,见表1。
化合物名称 回归方程 r 线性范围(μg/ml) 绿原酸 Y=13.496X-63.194 0.999 9 43.00~430.00 木犀草素-7-O-β-D-葡糖苷 Y=19.707X-169.310 0.999 7 21.00~210.00 3,5-O-二咖啡酰奎宁酸 Y=4.659X-0.895 0.999 7 60.00~600.00 蒙花苷 Y=6.5862X+6.154 0.999 6 4.20~42.00 广藿香酮 Y=11.788X+2.109 0.999 6 1.02~10.20 -
取混合对照品溶液,连续进样6次,记录色谱峰面积,绿原酸、木犀草素-7-O-β-D-葡糖苷、3,5-O-二咖啡酰奎宁酸、蒙花苷、广藿香酮峰面积的RSD分别为0.29%、0.30%、0.32%、0.45%、0.45%,表明仪器精密度良好。
-
按“2.2.2”项下方法制备供试品溶液6份(批号:20200120),并按“2.1”项下色谱条件进行含量测定。结果显示,防暑清热饮中绿原酸、木犀草素-7-O-β-D-葡糖苷、3,5-O-二咖啡酰奎宁酸、蒙花苷、广藿香酮峰面积的RSD分别为0.56%、0.68%、0.70%、0.94%、1.75%,表明方法重复性良好。
-
将供试品溶液在室温下放置,分别于0、2、4、8、12、24 h进样20 μl,记录色谱峰面积,结果显示,防暑清热饮中绿原酸、木犀草素-7-O-β-D-葡糖苷、3,5-O-二咖啡酰奎宁酸、蒙花苷、广藿香酮峰面积的RSD分别为0.64%、1.16%、0.71%、0.59%、1.36%,结果表明供试品溶液在24 h内稳定性良好。
-
精密量取已知含量的防暑清热饮2.5 ml,共6份,置10 ml容量瓶中,再分别精密加入对照品适量,加水稀释至刻度,按“2.1”项下色谱条件操作,进样20 μl,记录峰面积,测定其含量,计算平均加样回收率,结果见表2。
成分 样品含量(m/μg) 加入量(m/μg) 测得量(m/μg) 回收率(%) 平均回收率(%) RSD(%) 绿原酸 369.44 376.00 745.10 99.91 102.03 1.63 369.44 376.00 748.25 100.75 369.44 376.00 756.12 102.84 369.44 376.00 749.80 101.16 369.44 376.00 764.27 105.01 369.44 376.00 754.89 102.51 木犀草素-7-O-β-D-葡糖苷 209.79 210.00 425.37 102.65 102.38 1.51 209.79 210.00 428.48 104.14 209.79 210.00 425.15 102.55 209.79 210.00 419.79 100.00 209.79 210.00 428.48 104.14 209.79 210.00 421.50 100.81 3,5-O-二咖啡酰奎宁酸 452.68 484.00 939.25 100.53 102.39 1.23 452.68 484.00 947.23 102.18 452.68 484.00 956.31 104.06 452.68 484.00 942.56 101.22 452.68 484.00 949.64 102.68 452.68 484.00 954.57 103.70 蒙花苷 42.88 42.00 85.58 101.67 103.14 1.87 42.88 42.00 85.42 101.30 42.88 42.00 87.42 106.05 42.88 42.00 87.13 105.37 42.88 42.00 85.42 101.30 42.88 42.00 86.21 103.16 广藿香酮 7.91 8.20 16.10 99.86 104.01 2.33 7.91 8.20 16.40 103.52 7.91 8.20 16.56 105.47 7.91 8.20 16.43 103.89 7.91 8.20 16.76 107.91 7.91 8.20 16.39 103.40 -
取3个批号的防暑清热饮样品(批号:20200120,202002101,202002102),各3份,按“2.2.2”项下方法制备防暑清热饮供试品溶液,按“2.1”项下色谱条件操作,进样20 μl,记录峰面积,计算含量,结果见表3。
批号 绿原酸 木犀草素-7-O-β-D-葡糖苷 3,5-O-二咖啡酰奎宁酸 蒙花苷 广藿香酮 20200120 147.97±0.73 83.61±0.53 181.99±0.15 17.26±0.48 3.16±0.30 202002101 142.35±0.15 75.19±1.07 162.42±0.16 14.16±0.86 1.74±0.54 202002102 163.00±0.06 80.24±0.88 215.19±0.04 17.63±0.78 2.09±2.38
2.1. 色谱条件及系统适用性
2.2. 溶液的制备
2.2.1. 对照品溶液
2.2.2. 供试品溶液
2.2.3. 阴性对照溶液
2.3. 专属性考察
2.4. 线性关系考察
2.5. 精密度试验
2.6. 重复性试验
2.7. 稳定性试验
2.8. 加样回收率试验
2.9. 样品测定
-
现代药理学研究表明广藿香酮具有抗菌、抗炎、抗氧化、杀虫以及抑制肿瘤细胞的生长等多种生物活性;绿原酸、3,5-O-二咖啡酰奎宁酸属于苯丙素类化合物,具有解热镇痛、抗氧化作用;木犀草素-7-O-D-葡糖苷和蒙花苷属于黄酮类化合物,具有免疫调节、抗氧化、抗炎、抑菌抗病毒等作用。对单味药材进行分析,广藿香中含有广藿香酮;菊花、广藿香、白茅根和薄荷均含有绿原酸;菊花中含有3,5-O-二咖啡酰奎宁酸;菊花和薄荷中含有蒙花苷。中药复方制剂成分复杂,在保证达到检测要求的条件下,综合考虑选择绿原酸、木犀草素-7-O-β-D-葡糖苷、3,5-O-二咖啡酰奎宁酸、蒙花苷、广藿香酮作为液相色谱法检测的指标性成分[17-21]。
本实验分别考察了甲醇-0.1%磷酸、甲醇-0.2%磷酸、乙腈-0.1%磷酸、乙腈-0.2%磷酸4个洗脱溶剂系统作为流动相,结果发现乙腈-0.2%磷酸作为流动相色谱峰时,峰形和分离效果较好,梯度洗脱比等度洗脱分离更好。由于本品为水溶性溶液,被测活性成分极性相对较大,故使流动相起始和结束比例保持一致,即乙腈-0.2%磷酸(12∶88),以确保所测成分在正确的保留时间出峰。
在190~400 nm范围内进行全波长扫描,广藿香酮、3,5-O-二咖啡酰奎宁酸、蒙花苷、绿原酸和木犀草素-7-O-β-D-葡糖苷最大吸收波长分别为308、327、330、325和348 nm,综合考虑选择327 nm作为检测波长。
本实验供试品溶液制备简便,由于本品为液体制剂,用水稀释后直接进样,在该色谱条件下无干扰,故考虑稀释后直接进样。
本实验建立的含量测定方法简便、准确、灵敏,可作为防暑清热饮的质控方法,因不同批次有效成分含量相差较大,考虑可能是药材受产地或采收季节的影响,也可能是该制剂提取工艺稳定性的问题,还需进一步考察,后续需要经过多批次测定以确定质控标准。







 DownLoad:
DownLoad: