-
动脉粥样硬化以慢性血管炎症及大中动脉内皮下脂质斑块形成为主要特征,内皮细胞、平滑肌细胞、免疫细胞等均参与动脉粥样硬化的过程,随着斑块的积累,累及多种器官导致其病变[1]。动脉粥样硬化是由多种因素共同作用而形成,由脂质代谢紊乱所引起的血脂异常发挥着重要的作用,其中低密度脂蛋白胆固醇(LDL-c)升高已被证实是动脉粥样硬化的独立危险因素,低密度脂蛋白氧化后可诱导内皮细胞激活和功能障碍,促进泡沫细胞形成等[2]。随着现代生活方式及膳食营养结构的改变,高脂血症的发病率呈逐年上升,并加重了动脉粥样硬化等心脑血管疾病的进展[3]。因此,进一步研究高脂饮食所引起的动脉粥样硬化性心血管疾病具有极其重要的意义。与以人体为研究对象相比,动物具有易于管理、饮食和环境危险因素可控的优点。动脉粥样硬化的动物模型是基于高脂饮食,同时操纵胆固醇代谢的相关基因,并且引入动脉粥样硬化的额外危险因素,加速动脉斑块形成。各种动物模型现均已被用于动脉粥样硬化研究,其中鼠类和兔子的模型使用最多,其次是猪和非人灵长类动物,每种模型都有优点和局限性。由于小鼠繁殖速度快、经济成本较低以及较为容易监测动脉粥样硬化的发生,它已成为研究动脉粥样硬化的优势物种[4]。目前,高脂饲料已被广泛用于包括肥胖症、糖尿病等多种代谢性疾病的研究中,高脂饮食也可造成高脂血症,进而促进脂质在血管内膜堆积形成动脉粥样硬化。市场上存在着不同配方的高脂饲料,造模效果参差不齐,主要作用需进一步探讨。我们首先验证了一种较为常用的由普路腾公司生产的动脉粥样硬化高脂饲料对ApoE-/-小鼠动脉斑块形成的作用,并且在正常C57BL/6J小鼠上研究其对血糖血脂的影响,最后分析了不同禁食时间对正常饮食条件下血脂检测结果的影响。通过对高脂饲料对血糖血脂作用的深入研究,为小鼠动脉粥样硬化模型提供理论基础。
HTML
-
SPF级10周龄雄性C57BL/6J及ApoE-/-小鼠,购于西普尔-必凯实验动物有限公司。动物自由饮水进食,在明暗交替、温度(25±1)℃、相对湿度40%~60%、噪音≤60 dB的环境饲养。动物实验方案与操作均按照国家规定进行,符合动物福利及“3R”原则。
国产鼠用动脉粥样硬化高脂饲料购于普路腾公司,配方:基础饲料(58.1%)、猪油(16.6%)、蔗糖(10.6%)、麦芽糖糊精(3%)、胆固醇(1.3%)、胆盐(0.3%)、预混料(1.6%)。
正常鼠用饲料配方:水分(≤10%)、蛋白质(≥20.5%)、粗脂肪(≥4%)、蛋氨酸+胱氨酸(≥0.78%)、精氨酸(≥1.32%)、钙(1.0%~1.8%)、粗纤维(≥5%)、粗灰分(≤8%)、磷(0.6%~1.2%)、氯化钠(0.4%)。
-
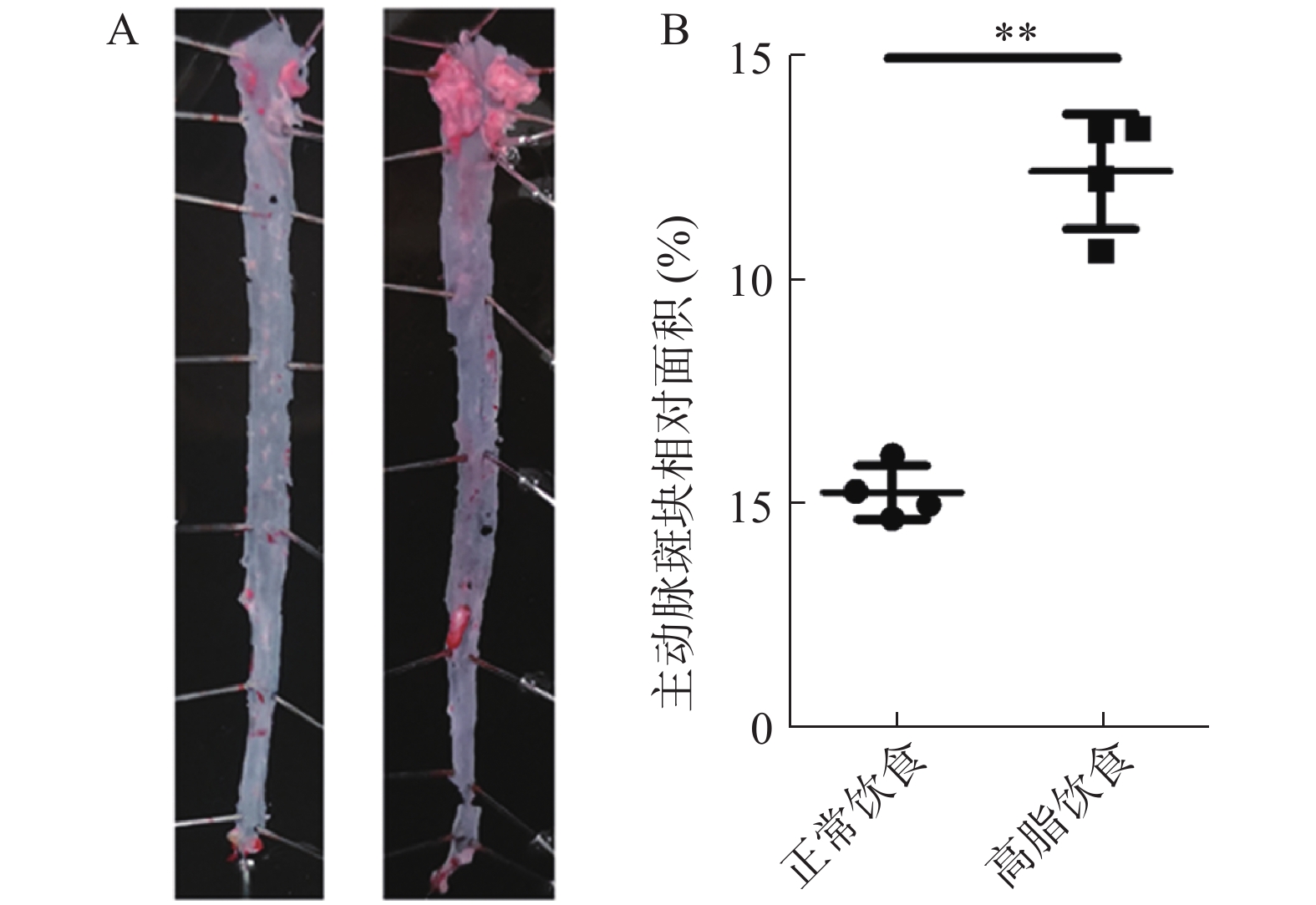
取雄性ApoE-/-小鼠8只,分为2组,每组4只,分别给予动脉粥样硬化高脂饲料和普通饲料喂养,4个月后观察动脉粥样硬化斑块形成情况。
-
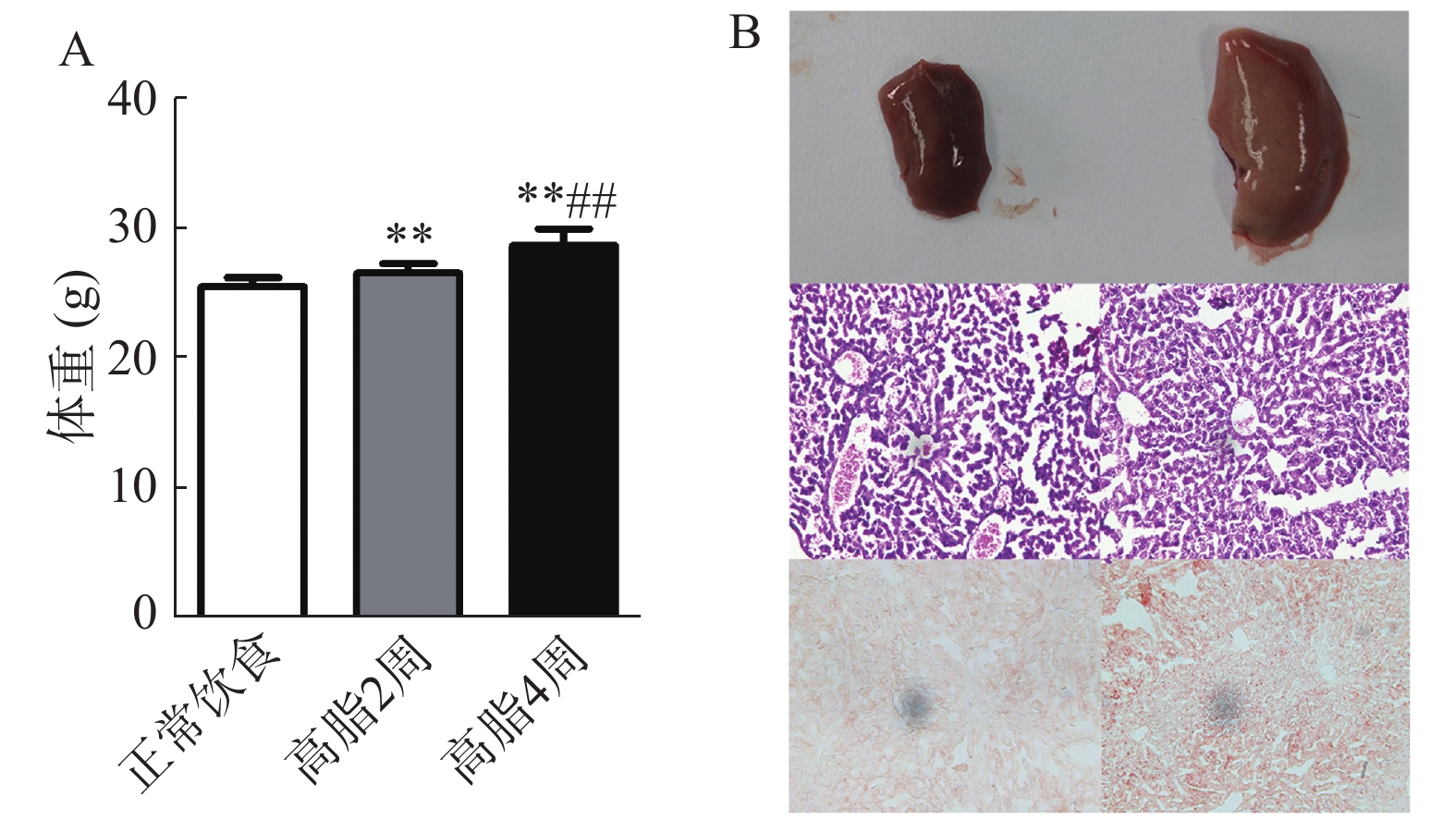
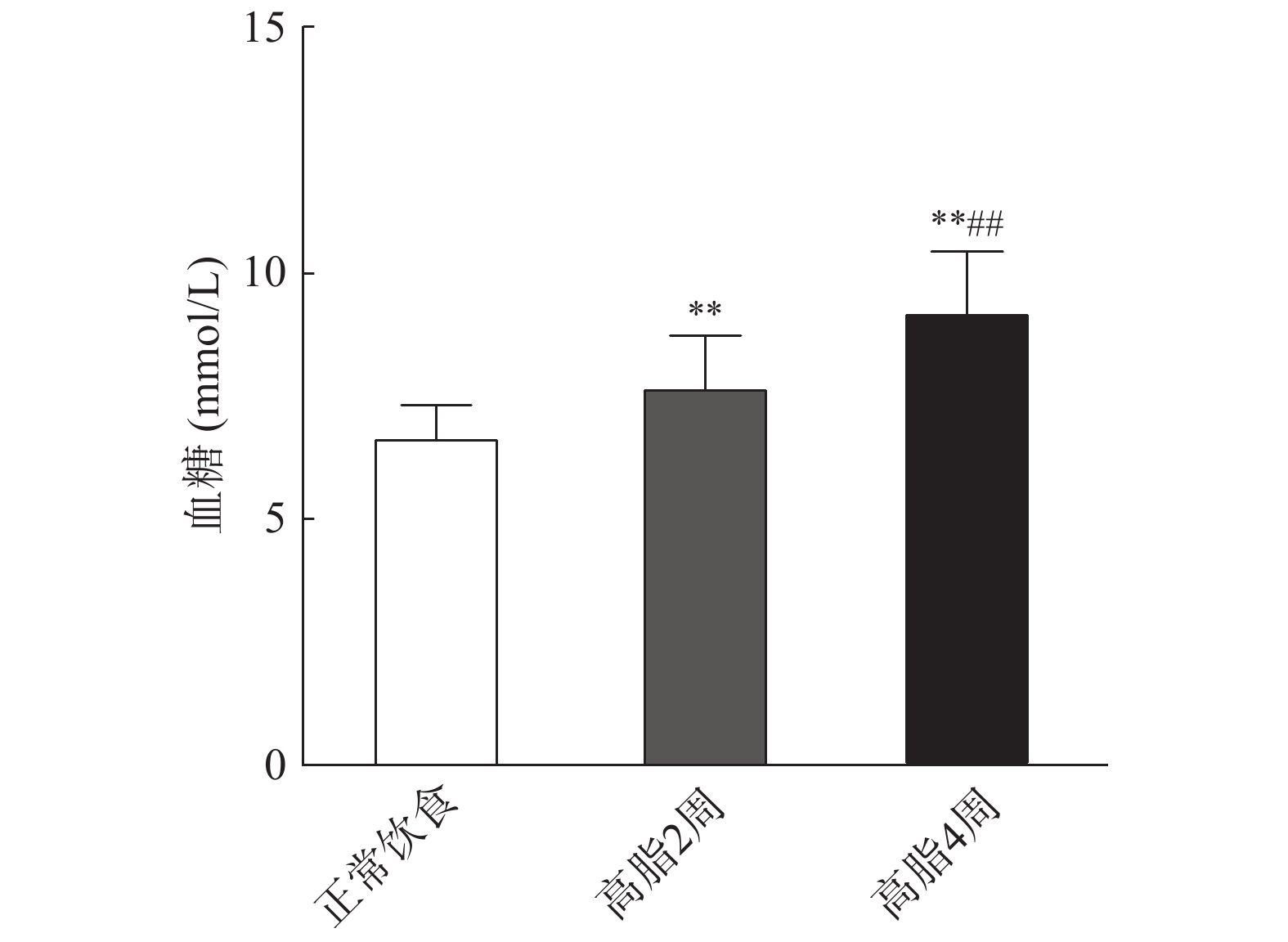
取雄性C57BL/6J小鼠50只,随机分为5组,每组10只,即:①普通饲料4周,不禁食组;②普通饲料4周,禁食6 h(8:00至14:00)组;③普通饲料4周,禁食12 h(20:00至次日8:00)组;④高脂饲料2周(HFD 2W)组,先以普通饲料喂食2周,再喂食高脂饲料2周,禁食12 h(20:00至次日8:00)⑤高脂饲料4周(HFD 4W)组,以高脂饲料喂食4周,禁食12 h(20:00至次日8:00)。分别考察禁食时间对正常饮食(ND)条件下血脂检测结果的影响,以及高脂饲料饮食(HFD)对小鼠体重、肝脏及血糖血脂水平的影响。
-
①主动脉分离:小鼠称量体重(g),1%戊巴比妥钠(100 mg/kg)腹腔注射完全麻醉,打开胸腔,暴露心脏,用1 ml注射器自上下腔静脉汇合处缓慢抽取血液。冰水混合物灌流心脏,分离主动脉及与其相连的心脏和双肾,用直径0.2 mm的不锈钢针固定于装满冰浴PBS的硅胶皿中,剪去心脏和双肾及多余脂肪组织。
②主动脉油红O染色:取两根钢针固定住头尾,开始慢慢地沿主动脉纵向剪开,边剪边增加固定钢针,最终使主动脉整个内腔面平铺朝上。用现配好的油红O溶液对主动脉内腔面进行染色:倒掉皿中PBS溶液,加入油红O溶液浸没主动脉,静置15 min,倒掉油红O溶液,加入75%乙醇浸没主动脉,再静置10~15 min,倒掉75%乙醇,用数码相机拍摄图像。使用ImageJ软件测量整个主动脉内腔面的面积和斑块面积。每个样品的粥样斑块比例=粥样斑块总面积/主动脉内腔面积×100%。
-
实验前将动物单笼饲养于安静无打扰的环境中,自由活动,2 h后开始禁食(可自由饮水),禁食时间为12 h(20:00至次日8:00)。测血糖时,剪去尾巴末端1~2 mm,轻轻挤出两滴血,采用GA-3型血糖仪及试纸条进行血糖测定,取两次测量的平均值。
-
麻醉方法同上,打开胸腔,用1ml注射器自上下腔静脉汇合处缓慢抽取血液收集至EP管中,血液室温静置2 h后,离心取血清。用干冰冻存送至武汉塞维尔生物科技有限公司,应用Chemray240全自动生化分析仪检测三酰甘油(TG)、血清总胆固醇(TC)、低密度脂蛋白(LDL-c)、高密度脂蛋白(HDL-c)、游离脂肪酸(NEFA)水平。
打开腹腔,取小块肝组织用4%多聚甲醛溶液固定,固定好的肝组织用于制作冰冻切片,分别进行HE及油红O染色。
-
使用GraphPad Prism-5软件对数据进行统计分析。所有的计量资料均以
$\bar x \pm s$ 表示,两样本均数的比较采用t检验,P<0.05为差异有统计学意义。
1.1. 动物与饲料配方
1.2. 动物分组与造模
1.2.1. 考察高脂饲料对ApoE-/-小鼠动脉粥样硬化斑块形成的作用
1.2.2. 其他指标考察
1.3. 取材方法及检测指标
1.3.1. ApoE-/-主动脉粥样硬化斑块面积测定
1.3.2. 血糖测量
1.3.3. C57BL/6J小鼠肝脏取材及血脂检测
1.4. 统计方法
-
如图1所示,ApoE-/-小鼠在高脂饮食4个月后,其主动脉产生的粥样斑块面积比例明显高于正常饮食组(P<0.01),说明高脂饮食可显著加速ApoE-/-小鼠动脉粥样硬化斑块的形成。
-
如图2所示,C57BL/6J小鼠高脂饮食2周及4周后,其体重高于正常饮食组(P<0.01),相比于高脂2周组,高脂4周后体重显著升高(P<0.01)。高脂4周后肝脏外观呈脂肪样变,有油腻感,镜下显示肝细胞内充满脂肪空泡。表明高脂饲料可以升高小鼠体重并造成肝脏脂肪堆积。
-
如图3所示,C57BL/6J小鼠在高脂饮食2周后,其空腹血糖高于正常饮食组(P<0.01)。相比于高脂饮食2周组,高脂饮食4周后空腹血糖显著升高(P<0.01)。表明动脉粥样硬化高脂饲料具有一定的升血糖作用。
-
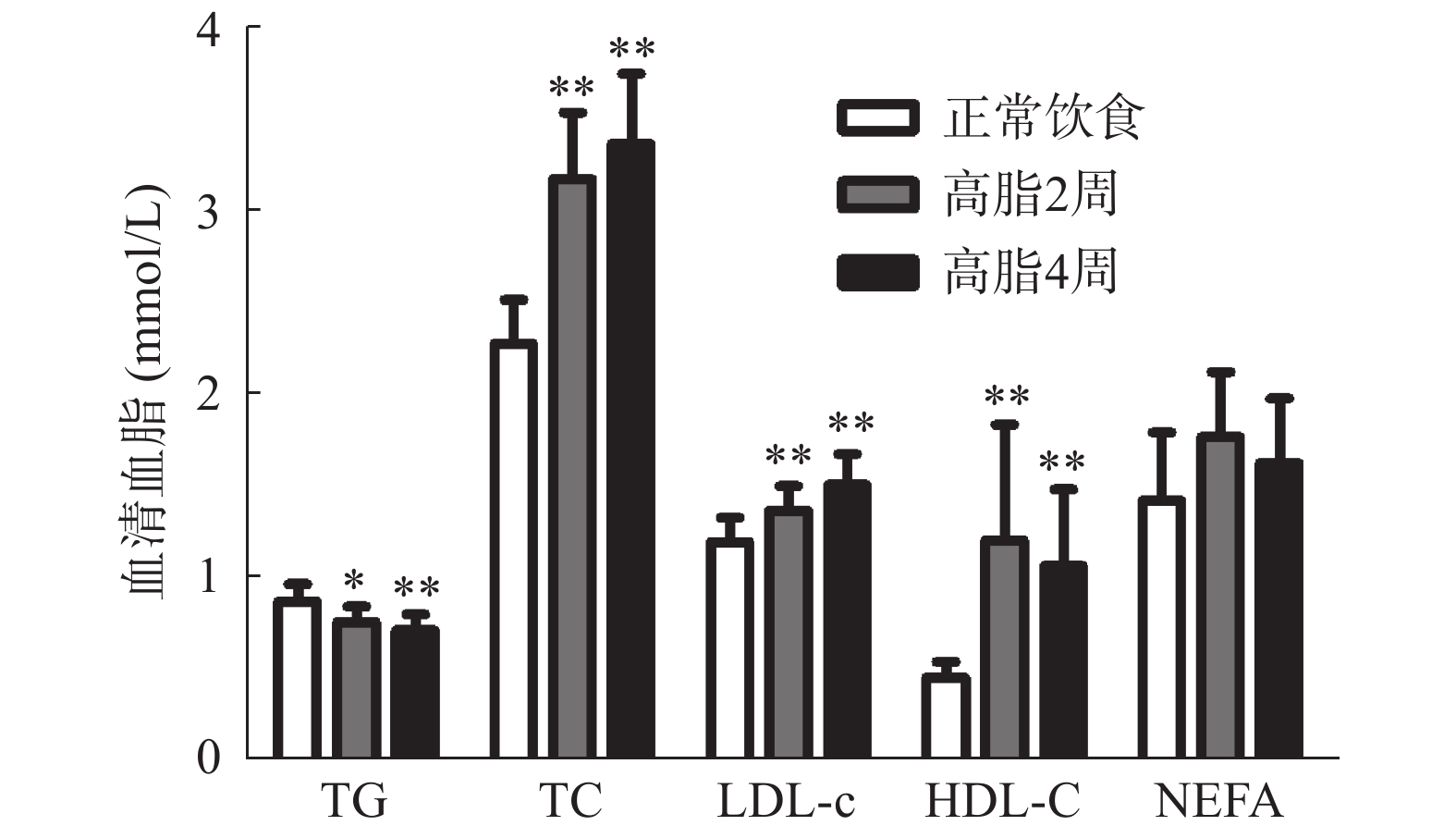
如图4所示,小鼠经过高脂饮食2周及4周后,其血清总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-c)、高密度脂蛋白胆固醇(HDL-c)水平均明显高于正常饮食组(P<0.01),但三酰甘油(TG)水平均明显下降(P<0.05),而游离脂肪酸(NEFA)均未见明显改变(P>0.05)。此外,相比于高脂饮食2周组、高脂饮食4周组的血清TG、TC、LDL-c、HDL-c、NEFA均未见明显改变(P>0.05)。以上结果表明,动脉粥样硬化高脂饲料主要提高血清胆固醇的含量,但同时降低血清TG水平。
-
如图5所示,在正常饮食条件下,取材前禁食6 h组及不禁食组的血清TG值明显高于取材前禁食12 h组(P<0.01),其余指标均无统计学差异(P>0.05)。另外,相比于禁食6 h组,不禁食组的血脂水平无明显差别(P>0.05),这表明取材前禁食时间可影响血清TG水平。
2.1. 高脂饮食加速ApoE-/-小鼠动脉粥样硬化斑块的形成
2.2. 高脂饮食对C57BL/6J小鼠体重及肝脏的影响
2.3. 高脂饮食不同时间对C57BL/6J小鼠血糖的影响
2.4. 高脂饮食不同时间对C57BL/6J小鼠血脂的影响
2.5. 正常饮食条件下取材前不同禁食时间对血脂检测结果的影响
-
血脂异常是心血管疾病常见的致病危险因素。调查我国北方农村人口血脂异常患病率发现,血脂异常患病率约占45.8%,高胆固醇血症的存在主要与动脉粥样硬化相关,而三酰甘油的异常主要与非酒精性脂肪肝、糖尿病相关[5]。他汀类降脂药可抑制体内胆固醇生物合成,是预防和治疗高脂血症患者导致的动脉粥样硬化的一线药物,已被证实可以稳定甚至逆转已建立的动脉斑块,其主要目的已经由单纯降低LDL-c转向关注心血管风险[6]。在动物模型中,由于C57BL/6J小鼠血浆不含血浆胆固醇酯转移蛋白,自然生长条件下不能形成动脉粥样硬化[7]。随着基因工程动物的进展,具有动脉粥样硬化易感性的载脂蛋白E (ApoE)敲除小鼠逐渐被广泛应用。ApoE基因敲除小鼠可以自发升高血脂水平,约在8~10周龄时可见泡沫细胞形成,15~20周龄可见自发性的动脉粥样硬化斑块,通过高脂饲料喂养,可大大加速斑块形成过程[8]。
高脂饲料通常是在基础饲料上添加不同成分的辅食逐渐发展而来,添加胆汁酸可以促进胆固醇的吸收,添加丙硫氧嘧啶可以有效地抑制甲状腺的功能,升高血浆TC和LDL-c浓度,但是会造成肝脏、淋巴损伤等副作用,使用需谨慎[9-10]。根据实验目的不同,所造成的动物模型的高脂饲料配方也不同,如肥胖模型使用的超高脂饲料猪油占较高比例,能够大大增加动物体重并造成体脂堆积,富含高糖类的高脂饲料则可造成糖尿病动物模型。本实验中使用的动脉粥样硬化高脂饲料轻微升高动物体重及血糖。在动脉粥样硬化高脂饲料的发展过程中,Paige等[11]首先发明了“西方型”饮食饲料,随着制作工艺的不断完善,逐渐制作出1.25%高胆固醇饲料,用于动脉粥样硬化的动物模型制备。实验用高脂饲料为42%脂肪供能,从上述结果可以看出,该高脂饲料的主要特点是造成高胆固醇血症,尤其是提高LDL-c浓度,这种作用在短时间内(2周)即可形成显著性差异。随着高脂时间的逐渐延长,可使小鼠血清LDL-c稳定在高水平。但是动脉粥样硬化高脂饲料会使TG值显著下降,有研究认为这可能是由于小鼠三酰甘油被高胆固醇饲料造成的大量外来胆固醇摄入所抑制,并且导致了肝脏来源的三酰甘油被抑制,从而导致血清三酰甘油水平降低[9]。此外,高脂饮食2周及4周后C57BL/6J小鼠HDL-c水平显著升高,目前许多研究认为HDL-c水平与心血管风险呈负相关,经典学说中HDL-c的保护作用主要机制是与胆固醇的逆向转运有关 [12]。但是最近的研究对HDL-c水平和心血管疾病之间的负相关的假设提出了质疑,认为两者之间的关系是U型的,血清高HDL-c不再被认为具有保护作用,来自动脉粥样硬化患者的HDL不仅表现出保护动脉粥样硬化的功能受损,而且还有促动脉粥样硬化的作用,与此相一致的是,以提高HDL-c浓度的治疗方法的药物临床试验并不能显示心血管疾病的降低[13]。
通常情况下,临床检测血脂要求在空腹情况下进行,即禁食10~12 h。随着临床研究的不断深入,越来越多的专家共识和建议表明,血脂检测可能无需空腹进行[14]。更多的证据表明,在一般人群中,正常的食物摄入对脂质水平影响较小,可能主要对三酰甘油有所影响,但对胆固醇影响较小[15]。多项实验表明虽然非空腹TG水平在统计学上高于空腹TG水平,但这种差异的临床意义尚不清楚,到目前为止,在评估血脂预测心血管风险时,没有可靠的科学证据表明禁食优于不禁食,选择非空腹血脂谱是一种简化测量手段,对心血管疾病的诊断和治疗没有任何负面影响[16]。有研究指出禁食与非禁食状态下的TG水平均可以预测红斑狼疮患者的心血管疾病风险以及可用非空腹血脂检测结果评估孕妇等特殊群体的脂质代谢等[17-18]。脂质的变化需要一定的时间,通常是在早餐前几小时,相比较而言,非空腹状态条件主导大部分时间,更能反映真实的生理状态。对于临床医生与患者来说,非禁食样本比禁食样本有许多明显的优势,比如简化实验室的血液采样,避免了空腹的不便,有效避免糖尿病患者因禁食所造成的低血糖等。随着研究的不但深入,未来一旦制定相应的标准,非禁食状态下的血脂检测也必将得到越来越多的认可,从而大大方便医生及患者。









 DownLoad:
DownLoad: