-
海拔高于3000米的地区在医学上定义为高原地区。高原地区寒冷干燥、多风少雨、紫外线强、大气中氧含量和氧分压均低于平原地区,且随着海拔高度增加而递减。因高原低氧环境引起的肺部疾病统称为高原肺部疾病,通常有胸闷、气短、头痛、失眠等生理反应[1],严重的造成肺水肿,危及生命。我国高原地区广阔,占国土总面积1/6以上[2],因此,高原肺部疾病对高原人民的生存和发展带来严峻挑战。本文综述近年来在高原肺部疾病方面的研究进展。
-
高原肺水肿(HAPE)是指从平原急进高原后,由于低压缺氧环境导致肺动脉压突然升高、肺毛细血管容量增加、膜通透性改变,使血管中液体渗出至肺间质及肺泡,从而引起的特发性疾病,是一种可危及生命的非心源性肺水肿[3]。HAPE是高原病中较常见的急性病,临床上会出现头痛、呼吸困难、咳嗽、活动受限等一系列症状,病情发展迅速,严重威胁进入高原人员的生命安全[4]。HAPE 发病主要取决于上升速度、运动强度和绝对海拔高度。假如上升速度过快、海拔过高,每个人都可能患HAPE[5]。
HAPE病理特征[6]主要为:肺动脉压和肺血管阻力增加,毛细血管通透性改变,血管内液体流入胞间。治疗后临床症状改善,血流动力学恢复正常,细胞因子数量恢复正常。
-
HAPE 患者缺氧后,血管内压力增加,导致微循环过度充盈,毛细血管压力增加,非炎性介质致毛细血管损伤,气血屏障通透性升高,膜通透性功能改变,使蛋白和红细胞漏出到肺间质和肺泡,导致O2和CO2在肺泡和肺毛细血管间交换时受到阻碍,血液得不到充足氧气,支气管肺泡液中红细胞数量及蛋白浓度增加。炎症是否是HAPE的主要机制还不明确。有研究证明IL-1、TNF-α、IL-8、前列腺素E2 和白三烯B4等炎性因子含量增加,说明炎症反应参与了肺水肿形成[7];但也有研究发现早期HAPE特征表现为肺动脉压升高,导致肺间质及肺泡中富含液体并有轻度出血的水肿,但白细胞、细胞因子等水平正常[4, 6]。笔者认为HAPE是一种急性反应,主要由肺动脉压力升高所致,炎症反应是其结果,反过来可进一步加重HAPE。
-
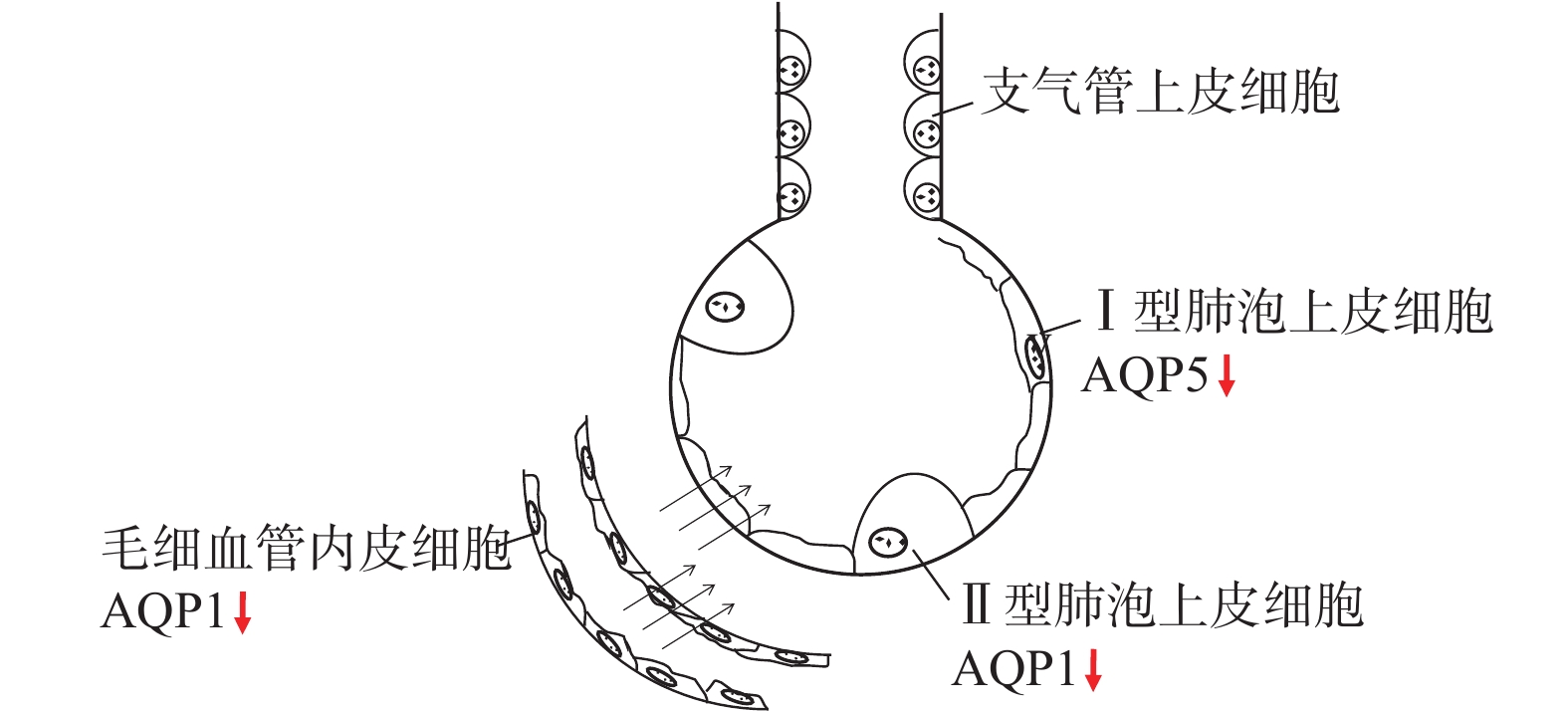
水通道蛋白(AQP)广泛分布于大部分生物的细胞膜上,其中肺组织AQP有6种,包括AQP1、3、4、5、8、9。AQP1主要位于肺毛细血管内皮细胞和II型肺泡上皮细胞上,可主动重吸收肺血管及间质的体液,可调节肺间质水肿[8]。AQP5主要位于I型肺泡上皮细胞,可清除肺泡腔内液体,主要调节肺泡水肿。AQP3位于II型肺泡上皮细胞。AQP4位于肺泡上皮细胞[9]。肺水肿的形成和消除包括被动和主动机制:被动机制由肺组织、体液及滤过机制等物理特性决定;主动机制是机体主动清除肺泡聚集的体液,其中AQP可能起到主要作用[10],见图1。
-
在低氧环境下,氧化应激引起自由基增加,可抑制肺组织细胞膜Na+-K+-ATP酶功能。正常Na+-K+-ATP 酶将胞内Na+转移到胞外,如果功能受到抑制将引起Na+的胞内蓄积,缺氧时肺内液体的清除能力下降,导致肺水肿[11]。
-
预防高原病的最好方法是渐进性缓慢上升到高海拔地区[12-14],但在特殊情况下,如急进高原或乘坐飞机直达高海拔地区,无法做到逐渐上升。此时如发生肺水肿,最有效的方法是高压氧治疗,吸入氧气可迅速提高血氧饱和度和动脉血氧分压,缓解肺血管收缩,降低肺动脉压,从而改善机体缺氧状态。高原病药物可分为预防和治疗用药,高原病的预防重于治疗。预防药物主要包括乙酰唑胺、地塞米松和银杏提取物等。
-
乙酰唑胺是预防急性高原病的首选药物。它是一种碳酸酐酶抑制剂,能增加重碳酸盐的排出,促进利尿,同时刺激呼吸道,增加动脉氧分压,并减少脑脊液生成,促进血脑屏障的离子转运[12]。乙酰唑胺可能是通过抑制缺氧状态下肌浆网释放Ca2+,进而影响平滑肌收缩发挥作用[15]。预防性使用乙酰唑胺可增加低压低氧情况下血清和肺组织中一氧化氮合酶的活性,促进NO合成和释放,降低肺动脉压力,达到预防高原肺水肿的目的[16]。
-
地塞米松是一种强效长效皮质类固醇药物[17],用于防治大鼠高原肺水肿可能包括以下机制[16, 18-20]:①减轻氧化应激所致的急性肺损伤;②减轻炎症反应;③增强肺组织Na+-K+-ATP 酶活力,进而增强肺内液体清除能力,防止蛋白渗出;④增加肺组织内皮型一氧化氮合酶表达,进而增加NO合成及释放;⑤调节肺组织 AQP1 表达,促进体液重吸收。
-
布地奈德是一种具有抗炎作用的糖皮质激素,属于长效三环类抗组胺药物,起效快、作用强,能竞争性结合组胺H1受体,起到抗外周H1受体的作用,增强平滑肌细胞、内皮细胞和溶酶体膜的稳定性,抑制免疫反应,抑制支气管收缩物质的合成与释放,有效拮抗白三烯、前列腺素和血小板激活因子,减少组胺、细胞生长因子和趋化因子等过敏活性介质的释放并降低活性,缓解抗原抗体结合时激发的酶促过程,达到减轻平滑肌收缩反应和改善临床症状的目的[21-22]。目前,临床上布地奈德主要用于治疗哮喘,提高哮喘患者的肺功能,也用于预防高原肺水肿。
-
硝苯地平是一种钙通道阻滞剂,可与Ca2+竞争Ca2+载体系统,从而阻滞心肌和血管平滑肌细胞外Ca2+通过细胞膜上Ca2+通道进入细胞内,并可干扰Ca2+利用,直接舒张血管平滑肌,扩展外周小动脉,使外周阻力降低[21]。
-
银杏叶提取物主要成分是黄酮类、萜类内酯、氨基酸、微量元素等多种化学成分,具有抗氧化、保护微血管平滑肌细胞、抑制血小板聚集和血栓形成、改善微循环的药理作用,定喘止咳、益肾润肺,补心养气疗效显著[23]。银杏叶提取物可抑制TNF-α、IL-6表达[24];同时作为一种抗氧化成分,可清除氧自由基,阻断血小板活化因子,起到预防急性高原病的作用[25]。银杏内酯B是银杏叶提取物中一组具有较强生物活性的萜类化合物,是一种强血小板活化因子拮抗剂,有神经保护作用,可改善急性高原缺氧致大鼠认知功能损伤[26]。
-
血管活性肠肽(VIP)是肺组织和鼻黏膜中最丰富的神经多肽之一。它可直接作用于血管平滑肌细胞。VIP 由血管壁外膜与肌层之间的神经释放,与平滑肌VIP受体结合后,使细胞内环状单磷酸腺苷、环磷酸鸟苷增加,导致平滑肌舒张。VIP还可抑制肺内肥大细胞释放多种细胞因子,与T淋巴细胞相互作用参与气道局部免疫调节。同时,VIP可清除肺内自由基,预防肺水肿造成的肺部损伤[11]。
-
肺动脉高压(PAH)是一种进行性疾病,特征是肺小动脉重塑导致肺动脉压升高。该疾病的血液动力学定义是静息时平均肺动脉压≥25mmHg,运动时正常左心室充盈压≥30mmHg。PAH是由于不受控制的肺血管重塑,导致肺血管阻力增加, 高肺血管阻力会导致肺动脉压进行性升高和持续血管收缩,导致适应性差的右心室肥大,最终会因心力衰竭而死亡[27]。
-
2013年第五届世界肺动脉高压研讨会将PAH分为5类,其中高原肺动脉高压(HAPH)属于第3类[28]。HAPH是由于高原低压低氧条件下,生理代偿性增加肺换气、肺动脉压力增加引起的高原地区特有疾病[29],其发病率、死亡率在世居人群、长期移居高原人群中均较高,且男性高于女性。随海拔高度的升高及居住年限延长而增加,在同一海拔地区,移居汉族人的发病率显著高于藏族[30]。
在长期慢性缺氧条件下,肺血管重构会逐渐发展,成为导致肺动脉高压的主要因素,其病理特征主要表现为:①血管内皮细胞损伤及增殖;②血管平滑肌细胞的增殖与表型转换;③无肌性小动脉肌化;④外膜成纤维细胞增生及胞外基质沉积[10]。这些改变都会导致肺血管管腔狭窄、顺应性下降、阻力升高,最终因右心负荷增加、右心衰竭而死亡。
-
前列环素即前列腺素I2,是血管内皮花生四烯酸通过前列环素合酶的作用得到的产物[31],是一种全身性和肺血管扩张剂,通过促进细胞内cAMP生成,引起肺血管平滑肌舒张,抑制平滑肌生长及血小板聚集[31-32]。前列环素在抗增殖、抗血栓形成、抗有丝分裂和免疫调节中发挥重要作用[33]。从PAH患者体内分离出的肺动脉PGI2合酶活性及其代谢产物均减少[34]。因此前列环素类似物可用于PAH患者。依泊汀醇是1995年被FDA批准用于治疗PAH的首个前列环素类似物。其他前列环素类似物还有伊洛前列素、曲前列环素等。
-
内皮型一氧化氮是在内皮型一氧化氮合酶(eNOS)作用下将L-精氨酸转化为瓜氨酸得到。随后 NO结合并激活可溶性鸟苷酸环化酶,生成cGMP,cGMP则通过激活cGMP蛋白激酶导致血管松弛,抑制肺动脉平滑肌细胞增殖和血小板聚集,充当调节平滑肌收缩力的第二信使[35-36]。
-
磷酸二酯酶(PDEs)可通过水解将cGMP转化为5′-GMP并使其失活,导致肺动脉血管收缩[11]。磷酸二酯酶抑制剂通过抑制cGMP裂解,增加血管平滑肌细胞内cGMP含量使血管扩张。磷酸二酯酶3、4、5型是在肺动脉收缩细胞中发现的三种主要类型,其中 PDE-5是肺循环中表达最丰富的同工型。西地那非于2005年在欧洲上市,是口服PDE-5抑制剂,在加拿大和美国已获许可用于II~IV级PAH患者。其他PDE-5抑制剂还有他达拉非、伐地拉非等。
-
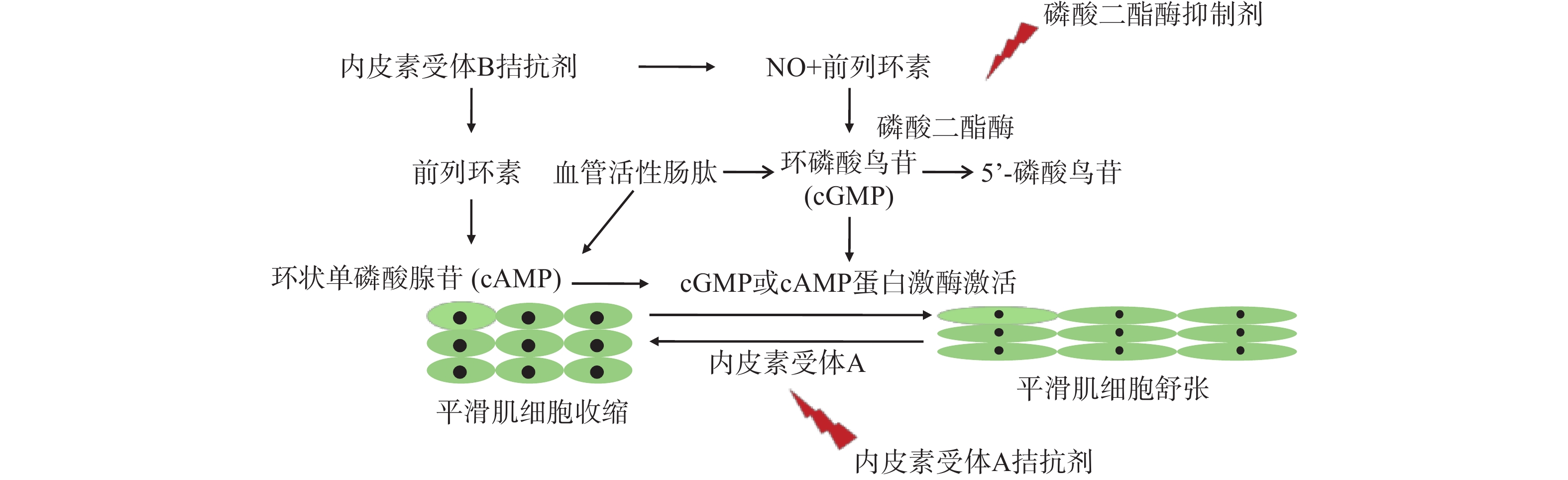
内皮素(ET)是一种有效的肺血管收缩剂,与ET受体(ETR)相互作用后,对血管平滑肌细胞具有增生作用。ETRA主要位于肺动脉平滑肌细胞;ETRB主要分布于血管肺动脉上皮细胞,而在肺动脉平滑肌细胞上较少分布[37]。ETA激活会诱导血管平滑肌细胞的血管收缩和增殖[13]。ETB拮抗剂则可能通过从上皮细胞释放NO和前列环素来诱导血管舒张[38]。PAH患者血浆和肺动脉ET-1表达较高,这与疾病严重程度(包括血管重塑程度)直接相关[39]。波生坦是第一个被批准用于PAH治疗的口服ETRA和ETRB拮抗剂。安立生坦是一种口服选择性ETRA拮抗剂。马西替坦是FDA新批准的口服ETRA、ETRB拮抗剂。此外, VIP也是肺动脉高压的重要靶标(图2)。
-
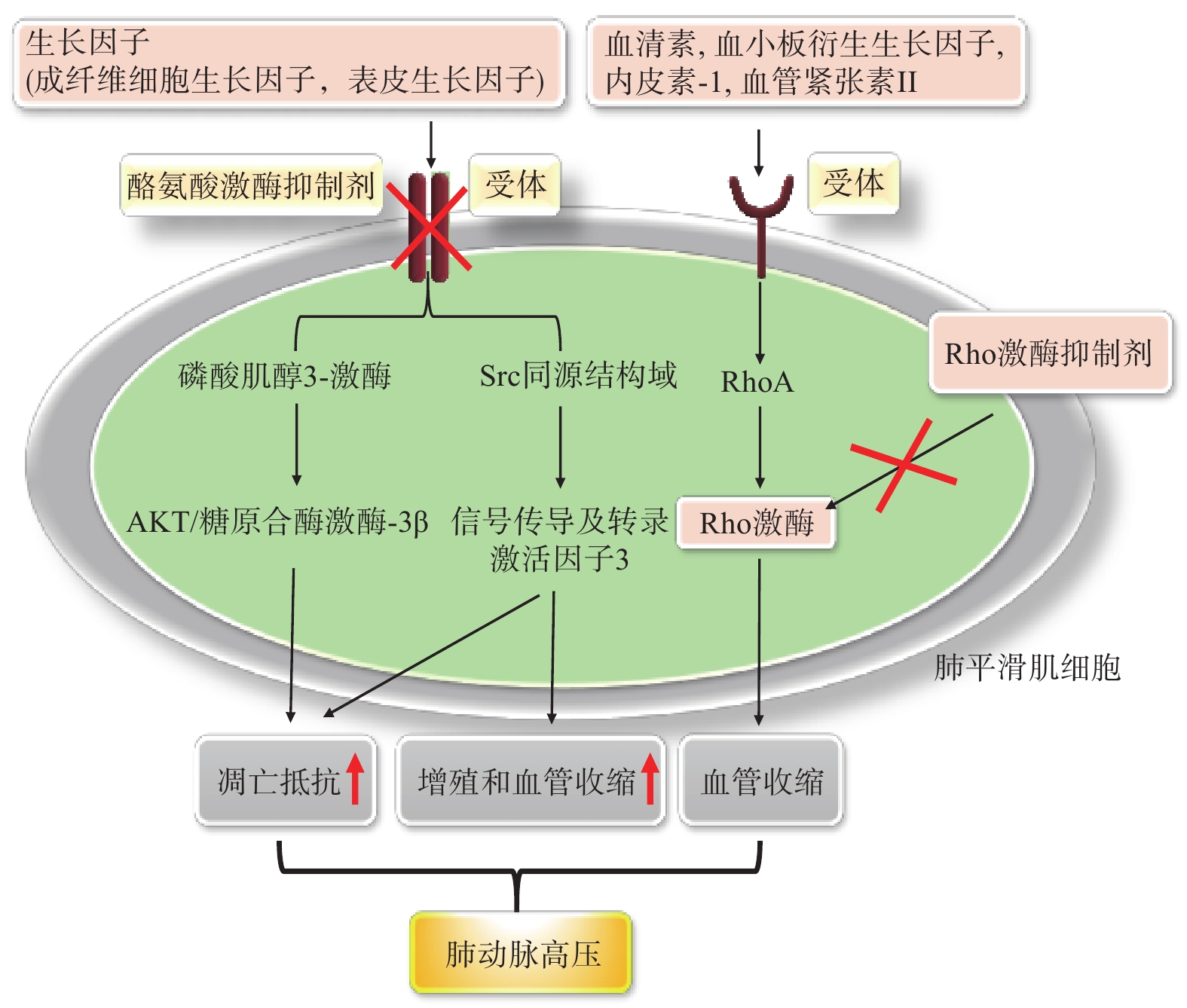
酪氨酸激酶是一种普遍存在的蛋白质家族。某些血小板源性生长因子(如血小板衍生生长因子、成纤维细胞生长因子2、血管内皮生长因子等)与其受体结合后会诱导细胞内酪氨酸残基自磷酸化,继而作用于信号转导途径,诱导肺动脉平滑肌的异常增殖和迁移,使肺血管重塑,从而导致肺动脉高压[40]。抑制酪氨酸激酶可逆转肺血管重塑、降低肺血管阻力,成为治疗PAH的新策略,代表药物有伊马替尼[41]。
-
Rho激酶(ROCK)是调节血管收缩和细胞增殖的重要细胞内信号分子。 ROCK有两种亚型:ROCK1主要分布于肺和肝,而ROCK2主要分布于心脏、大脑[42]。慢性缺氧致大鼠肺动脉高压模型和野百合碱致严重肺动脉高压患者中肺组织和肺动脉中Rho激酶活性均显著增高[43-44]。因此可通过抑制Rho激酶来治疗PAH。法舒地尔是目前唯一临床使用的Rho激酶抑制剂,它可渗透进入血管平滑肌细胞,在正常或病理条件下与ATP竞争Rho激酶催化区的ATP结合位点,特异性阻断Rho激酶活性获得治疗(图3)。
治疗肺动脉高压常用药物及其优缺点见表1。
药物类别 代表药物 优点 缺点 NO 气态NO 全身性副作用最小,仅用于住院的PAH儿科患者 成本高,与血红蛋白结合后快速失活,可产生有毒代谢产物 磷酸二酯酶抑制剂 西地那非 改善心脏衰竭症状,达到纽约心脏功能第II、III度患者的 6 min步行距离,肺血流动力学和生存率 半衰期短,不良反应包括头痛、消化不良及全身性血管舒张等;儿科患者使用受限,单次给药剂量大,给药间隔短 ETR拮抗剂 波生坦 改善患者运动能力及血流动力学 肝药酶增加,因此需要对服用波生坦的患者每月进行肝转氨酶监测 血管活性肠肽 VIP PAH治疗的新靶标 易被内源蛋白酶降解,半衰期短 Rho激酶抑制剂 法舒地尔 改善肺动脉高压患者的血流动力学 仅有极少数蛛网膜下腔出血和局部缺血性休克病例中出现肝功能异常和低血压 -
高原脱适应症也称为“氧中毒综合征”或“低海拔反应”。急进高原后再次重返平原,因氧气含量增高,机体对高原的适应被打乱,机体重新调节,产生一系列生理反应和临床表现,即为高原脱适应或高原脱习服[21]。久居高原者进入平原时,大概50%~80%人群会出现一系列临床症状,如心悸、头昏、嗜睡、乏力、腹泻、心慌、胸部紧缩、心律失常等,恢复至正常的过程极慢[22, 25],这对于需要快速适应新环境的职业带来不便。因此,迅速改善高原脱适应症状亦十分重要。
-
当进入低压低氧高原环境时,机体通过加深加快呼吸频率、增加肺通气量、调整通气血流比等变化满足对氧的需求;当返回大气压、氧分压高的平原时,不能立即适应该环境,机体通过负反馈机制和皮肤表面氧张力感受器调节,反射性引起脏器血管收缩,使重要脏器血供减少,会出现胸闷、气短甚至缺氧状态,引起咳嗽、哮喘、胸闷甚至低氧血症等症状[28, 45]。
-
高原脱适应症最有效的治疗方式是高压氧治疗,它对组织缺血缺氧性损伤具有明显保护作用[46-47]。高压氧治疗高原脱适应症的机制可能与以下因素有关[48-49]:①高压氧可提高红细胞携氧能力,增加血氧含量,红细胞需求减少,数量和黏度降低,有利于改善微循环;②增加神经细胞对葡萄糖的利用,有助于维持神经细胞的能量代谢,减轻炎症反应,减少缺血组织的细胞死亡,实现神经保护作用[27];③改善血流动力学,可明显提高右心室功能、改善冠状动脉循环、保护心肌结构[50]。但该疗法只能短暂改善患者的高原脱适应症状,不能彻底恢复机体功能及生活能力。
除了高压氧治疗外,有很多中药可用于治疗高原脱适应症,如三七、银杏叶提取物和红景天等。它们可以清除自由基,改善炎症反应,从而改善高原脱适应症状[51]。
-
治疗高原肺部疾病常见给药途径为口服和注射,缺乏针对肺部疾病的靶向性。肺部给药系统作为非侵入性药物递送技术已成为新的研究热点,是治疗肺部疾病最直接有效的给药途径。肺部约有3~4亿个肺泡,总面积可达70~100 m2,吸收面积大,有丰富的毛细血管,血流量大,药物易通过肺泡表面快速吸收。肺部的化学降解和酶降解反应能力弱,对药物破坏性小。药物经肺吸收后直接进入血液循环,可避免肝脏首过效应,提高药物生物利用度[20]。更重要的是,肺吸入的药物大部分沉积在肺部,可避免或减少对其他组织的毒副作用。相反,通常口服或注射途径到达肺的实际药量较低,以致肺中药物与血浆中药物比例较低,导致药效不足[52]。肺部给药剂型主要有三种:气雾剂、雾化吸入剂、干粉吸入剂或粉雾剂。脂质体、纳米粒、胶束、仿生载体等新技术可进一步制备成上述三种肺部给药制剂,实现局部靶向给药,提高药物的选择性和特异性,进而改善患者预后和提高治疗效果(表2)。
药物载体 药物 模型及给药途径 与游离药物相比优势 参考文献 脂质体 伊洛前列素 体外吸入 雾化过程中脂质体稳定 [53] 法舒地尔 气管 PASMC的摄取增加 [54] 伊马替尼 体外和离体研究 适合肺部药物递送 [55-56] 聚合物纳米粒 PGE1 静脉注射 延长半衰期,增加血液药物积累 [57] 贝前列素 静脉注射 延长半衰期,增加血药积累,可治疗MCT和低氧诱导的肺动脉重塑和右心室肥厚 [58] 西地那非 体外吸入 雾化对粒径、粒径分布和载药率无影响 [59] 伊马替尼 气管内 通过抑制PASMC增殖,抑制MCT诱导的PAH [60] 红细胞膜纳米载体 法舒地尔 气管内 体外细胞摄取量增加,半衰期延长 [61] 注: PASMC. 肺动脉平滑肌细胞;PGE1.前列腺素E1 ; MCT.野百合碱
Mechanisms and therapeutic drugs of high-altitude lung diseases
doi: 10.12206/j.issn.1006-0111.202111025
- Received Date: 2021-11-04
- Rev Recd Date: 2022-06-19
- Available Online: 2022-07-27
- Publish Date: 2022-07-25
-
Key words:
- high-altitude pulmonary edema /
- high-altitude pulmonary artery hypertension /
- high-altitude de-adapted reaction
Abstract: The heavily harsh plateau environment including low pressure, hypoxia, cold, dryness and strong ultraviolet radiation, seriously threatens the physical and mental health of those who quickly enter the plateau area. Lungs are the sensitive organs for high altitude injury. High-altitude lung diseases include the acute high-altitude lung disease (i.e., high-altitude pulmonary edema), the chronic high-altitude lung disease (i.e., high-altitude pulmonary artery hypertension) and the high-altitude de-adapted reaction. This review summarizes the pathogenic mechanisms and the main therapeutic drugs of high-altitude lung diseases based on the recent research. Moreover, the related formulations and administration routes are also reviewed here. It will provide support and counsel for the diagnosis and treatment of high-altitude lung diseases.
| Citation: | HUANG Yueqi, HU Jinglu, LI Qi, LI Miao, XIE Fei, DU Lina, JIN Yiguang. Mechanisms and therapeutic drugs of high-altitude lung diseases[J]. Journal of Pharmaceutical Practice and Service, 2022, 40(4): 289-295. doi: 10.12206/j.issn.1006-0111.202111025 |







 DownLoad:
DownLoad: