-
创伤敷料的应用为伤口的修复愈合提供了保障,各种新型敷料层出不穷,液体创可贴即是近年出现的一种新型液体创伤敷料。相较于传统的绷带创可贴,液体创可贴适用于关节活动处等不规则的伤口,形成的透明薄膜具有方便观察伤口情况以及防水效果好等优势[1]。有报道指出,硝化纤维能用于密封小型伤口甚至保护烧烫伤创面[2]。低含氮量硝化纤维广泛用作成膜材料,具有较好的抑菌效果和稳定性。本课题组以含氮量低的硝化纤维为成膜材料研制了一种新型液体创可贴,前期通过细胞毒性实验与小鼠创伤愈合实验发现其具有良好的生物相容性与促进伤口愈合效果[3-4]。对于液体创可贴相关市售产品,目前尚无统一的质量标准对其进行质量评价,导致产品质量参差不齐。因此有必要建立权威可靠的质量标准,以加强此类产品的质量控制。本文对自制液体创可贴的质量品质与安全性进行考察,并对相关市售产品进行质量检查,以期为液体创可贴与同类产品的进一步开发及质量标准的建立提供参考。
-
AL204型电子天平(上海梅特勒-托利多仪器有限公司);HS-3000A型拉力试验机(上海和晟仪器有限公司);Best-S30FV型纯水/超纯水机(上海芷昂仪器有限公司);NDJ-8S型数字式黏度计(上海精密仪器仪表有限公司);数显千分测厚规(浙江德清盛泰芯电子科技有限公司);岛津LC-20AD/T型高效液相色谱仪(日本岛津株式会社)。
-
自制液体创可贴(自制,批号:20210106、20201222、20201130);小林液体创可贴(日本小林株式会社,批号:E0002);美愈液体创可贴(太原爱乐医疗器械有限公司,批号20200901);伤口一抹得(天津一抹得医疗用品有限公司,批号:2020111011);3M液体敷料(3346E,美国3M Health Care);苯甲醇对照品(99.9 %,中国食品药品检定研究院,批号:190019-201903);苯扎氯铵对照品(中国食品药品检定研究院,批号:100549-201805);利多卡因对照品(99.8 %,上海远慕生物科技有限公司,批号:YM-BZ0342);乙酸乙酯(上海联试试剂有限公司,批号:160801);乙腈(色谱纯,国药集团化学试剂有限公司,批号:20200507);乙酸铵(西陇化工股份有限公司,批号:140420);三乙胺(上海科丰化学试剂有限公司,批号:20101026);0.9 %氯化钠注射液(福州海王福药有限公司,批号:200816A43); 2,4-二硝基氯代苯(国药集团化学试剂有限公司,批号:201506181)。
-
家兔,体重2.0~2.5 kg,雄性;白化豚鼠,体重300~350 g,雌雄各半。皆由上海斯莱克实验动物有限公司提供,生产许可证号:SCXK(沪)2017-0005,实验许可证号:SYXK(闽)2018-0005。动物实验前在联勤保障部队第九〇〇医院动物实验中心环境适应7 d。
-
根据前期研究[3]制备自制液体创可贴及其薄膜,苯甲醇、利多卡因与苯扎氯铵的用量分别为4 %、2 %和0.2 %,同时制备不含这3种成分的液体创可贴空白基质。
-
本品为具有一定黏稠度的无色或微黄色的透明液体敷料,均匀细腻,涂展性良好,具有一定刺激性气味,成膜之后为无色透明薄膜,具有一定的薄荷清新香味。
-
(1)成膜时间:将液体创可贴按10 μl/cm2涂于人手臂皮肤上,以不沾手为成膜标准,记录成膜时间[5]。
(2)舒适性:采用拉力试验机测定所制薄膜的抗张强度与断点伸长百分率[6-7],评价液体创可贴薄膜的机械强度,方法如下:将制备的薄膜裁剪成统一规则长条形,保证边缘光滑,垂直地面夹于拉力试验机受力夹两端,调整试验夹使薄膜处于自然拉伸状态,测量此时两端夹子之间的距离记为L0;以5 mm/min的速度,1 000 N的载荷量运行试验机,当薄膜断裂时立即停止试验,并记下此时的拉力F和两端夹子的距离Lmax;重复其他两个样品,按公式T=F/S计算抗张强度,S为薄膜横截面积,按公式PS(%)=Lmax/L0×100%计算断点伸长百分率,计算至少3个样品的平均值。
(3)防水性:液体创可贴薄膜的防水性能通过24 h前后的水损失率评价,采用倒杯法进行,即采用口径为12 mm的西林瓶,加入5 ml蒸馏水,记录蒸馏水重量MW;将薄膜平整覆盖在西林瓶表面,用封口膜沿着瓶口边缘将薄膜与西林瓶密封,倒置,确保水不会沿着瓶口渗出,并避免水和薄膜之间有气泡;记录初始西林瓶和蒸馏水总重量M0;重复制备5个样品;记录24 h后西林瓶和蒸馏水的总重量M24h,按下式计算水损失率:LR=(M0−M24h)/MW×100%,计算至少3个样品的平均值。
(4)透气性:液体创可贴所成薄膜的透气性以单位时间内通过单位薄膜面积的水蒸气质量即水蒸气透过率(MVTR)进行评价[8]。方法如下:10 ml的西林瓶中加入足量的纯化水,使液面距瓶口5 mm左右,将略大于瓶口的圆形薄膜精确地盖在西林瓶口上,用封口膜沿着瓶口边缘将薄膜与西林瓶密封,记录西林瓶、薄膜和蒸馏水的总重W1,然后置于干燥箱中,24 h后再称量西林瓶、薄膜和蒸馏水的总重W2,按MVTR=(W1−W2)/(s×t)计算水蒸气透过率,至少计算3个样品的平均值。
按上述方法测得3批自制液体创可贴的检测结果如表1。
样品批号 成膜时间(t/s) 伸长率(%) 抗张强度(MPa) 水损失率(%) MVTR(mg/cm2·h) 20201130 92.6±2.35 167.2±3.07 7.04±0.65 1.73±0.25 2.78±0.43 20201222 87.4±4.71 172.5±2.14 6.38±1.21 2.02±0.37 2.35±0.19 20210106 101.7±2.02 165.4±4.93 5.99±2.47 1.86±0.08 1.98±0.84 采用类似方法制得各市售产品的薄膜,按上述4个检查项目对相关市售液体创可贴及其所成薄膜进行质量检测,结果如表2。
产品
名称成膜时间(t/s) 伸长率(%) 抗张强度(MPa) 水损失率(%) MVTR
(mg/cm2·h)3M 125.7±3.05 — — 2.53±0.84 2.38±0.45 一抹得 194.7±5.13 175.45±2.52 2.89±0.10 0.43±0.01 1.79±0.17 美愈 226.7±4.04 246.89±16.15 2.35±1.00 0.47±0.03 0.58±0.18 小林 114.7±7.77 159.43±3.44 6.89±0.39 0.36±0.05 1.94±0.35 注:“—”表示未检测。 由表2可知市售产品的质量相差较大,与成膜材料及处方成分的性质有一定关系。3 M液体敷料为喷雾型用药,以丙烯酸盐共聚物为成膜材料,异辛烷等为溶剂,所成薄膜过于脆弱,无法测定伸长率和抗张强度,可认为其机械强度较差。
-
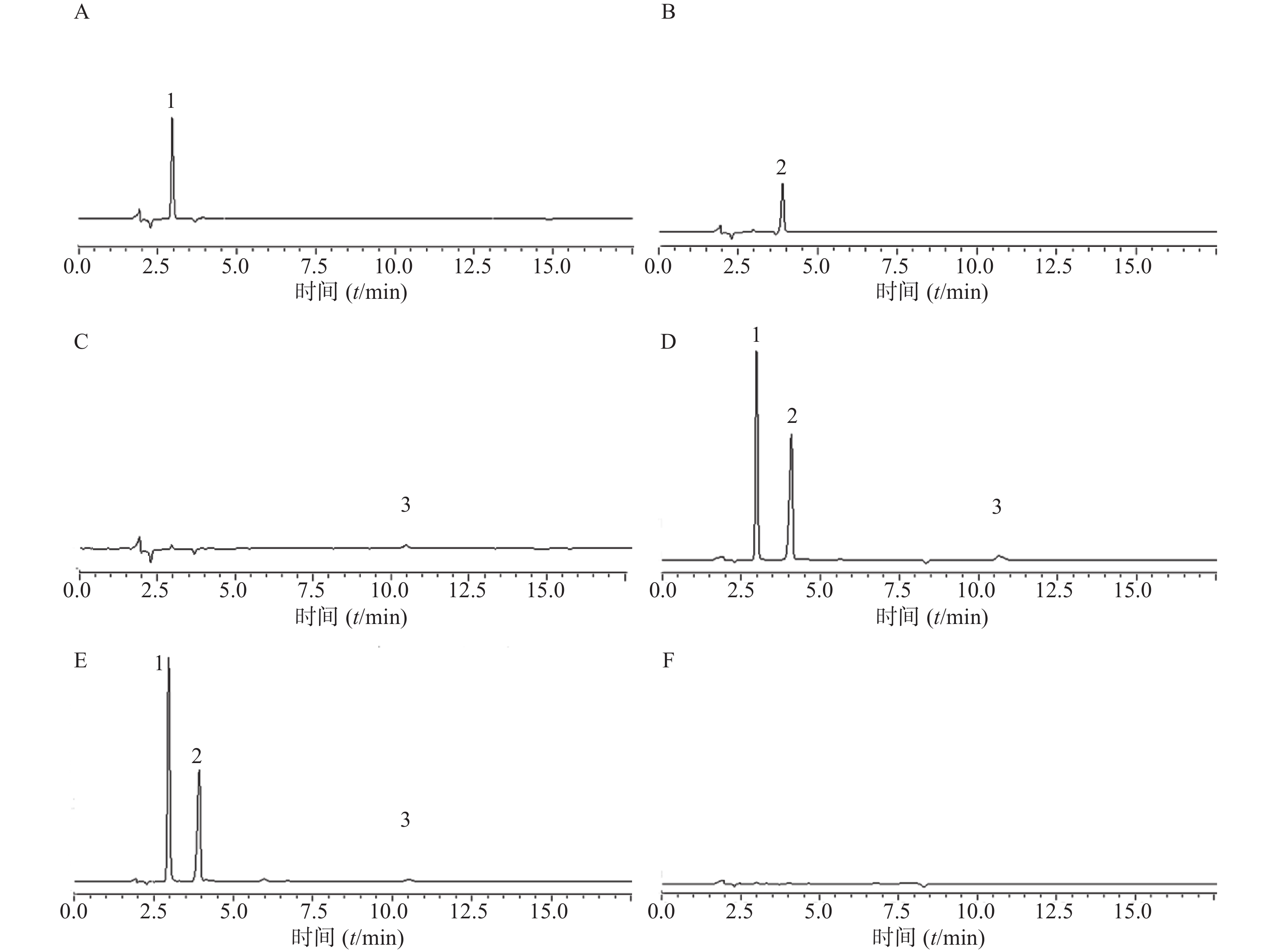
采用HPLC法对自制液体创可贴进行鉴别,即比较供试品溶液与对照品溶液主峰的保留时间。结果如表3,表明液体创可贴的3个主要药效成分的保留时间与其对照品的保留时间一致。
样品 苯甲醇 利多卡因 苯扎氯铵 混合对照品 2.991 4.068 10.678 液体创可贴 2.983 4.080 10.698 -
(1)色谱条件:色谱柱:Welch Ultimate®XB-C18柱(4.6 mm×200 mm,5 μm);流动相:乙腈:5 mmol/L醋酸铵,含1%三乙胺,冰醋酸调节pH至4.8±0.2,体积比为60∶40;检测波长:262 nm;流速:1.0 ml/min;柱温:35℃;进样量:20 μl。
(2)样品溶液的制备:①苯甲醇对照品溶液:精密量取苯甲醇对照品(1 g/ml)10 μl置于25 ml容量瓶中,加乙腈稀释至刻度,摇匀,即得苯甲醇对照品溶液,4℃保存备用。②利多卡因对照品溶液:精密称取利多卡因对照品5 mg置于25 ml容量瓶中,加适量乙腈超声溶解,加乙腈稀释至刻度,摇匀,即得利多卡因对照品溶液,4℃避光保存。③苯扎氯铵对照品溶液:精密量取苯扎氯铵对照品(12.5 mg/ml)50 μl置于25 ml容量瓶中,加乙腈稀释至刻度,摇匀,即得苯扎氯铵对照品溶液,4℃避光保存。④混合对照品溶液:精密量取苯甲醇对照品50 μl、苯扎氯铵对照品400 μl,精密称取利多卡因对照品25 mg置于同一25 ml容量瓶中,加入适量乙腈,超声使利多卡因完全溶解,加乙腈稀释至刻度,振摇混匀,即得混合对照品储备液,4℃保存。精密量取上述储备液1 ml置于10 ml容量瓶,加乙腈稀释至刻度,混匀,即得含苯甲醇200 μg/ml、利多卡因100 μg/ml、苯扎氯铵20 μg/ml的混合对照品溶液。⑤供试品溶液:精密称取自制液体创可贴0.5185 g,置于25 ml容量瓶中,加适量乙腈,超声溶解后加乙腈稀释至刻度,摇匀,经0.22 μm微孔滤膜过滤,即得供试品溶液。⑥阴性对照溶液:精密称取空白基质0.4953 g,置于25 ml容量瓶中,加适量乙腈,超声溶解后加乙腈稀释至刻度,摇匀,经0.22 μm微孔滤膜过滤,即得阴性对照溶液。
(3)专属性试验:取上述对照品溶液、供试品溶液和阴性对照溶液分别按上述色谱条件进样,记录色谱图与相关参数如图1与表4,表明专属性良好。
成分 保留时间(t/min) 理论塔板数 分离度 对称因子 苯甲醇 2.999 6705 4.670 0.989 利多卡因 4.059 8069 6.482 0.826 苯扎氯铵 10.764 12652 23.794 0.954 (4) 精密度试验:取液体创可贴供试品溶液(批号:20210106)按前述色谱条件连续进样6次,计算各指标成分色谱峰的保留时间与峰面积的相对标准偏差RSD值。苯甲醇、利多卡因与苯扎氯铵保留时间RSD值分别为0.21%、0.38%、0.20%,峰面积RSD值分别为1.39%、2.72%、2.56%,表明仪器精密度良好。
(5)重复性试验:取同一份液体创可贴样品(批号:20210106),同法制备6份供试品溶液,按前述色谱条件进样测定,记录苯甲醇、利多卡因和苯扎氯铵色谱峰的保留时间和峰面积,并计算RSD值。保留时间RSD分别为0.20%、0.14%、0.06% ,峰面积RSD分别为1.52%、1.49%、2.22%,说明方法重复性良好。
(6)稳定性试验:取液体创可贴供试品溶液(批号:20210106)一份,室温放置,分别于0、1、2、4、8、12、24 h取样按前述色谱条件进样测定,计算苯甲醇、利多卡因与苯扎氯铵色谱峰的保留时间与峰面积的RSD值,保留时间RSD分别为0.19%、0.11%、0.43%,峰面积RSD分别为0.62%、0.19%、1.47%,表明供试品溶液在24 h内稳定。
(7)线性关系考察:分别精密量取混合对照品储备液1、2、3、4、5、6 ml置10ml容量瓶中,用乙腈稀释至刻度,配制成苯甲醇浓度为200、400、600、800、1 000、1 200 μg/ml,利多卡因浓度为100、200、300、400、500、600 μg/ml,苯扎氯铵浓度为20、40、60、80、100、120 μg/ml的混合对照品溶液,按前述色谱条件进样测定,以峰面积(Y)对质量浓度(X)进行线性回归,回归方程如表5所示,3种有效成分在一定范围内线性关系良好。
成分 回归方程 r 线性范围(μg/ml) 苯甲醇 Y=1325.9X+4755.5 0.999 7 200~1200 利多卡因 Y=2366.9X−11591 0.999 6 100.24~601.44 苯扎氯铵 Y=771.6X+2025.5 0.999 7 20~120 (8)回收率试验:精密称取利多卡因对照品8、10 、12 mg,精密量取苯甲醇对照品16 、20 、24 μl,苯扎氯铵对照品64 、80 、96 μl(相当于标示量的80%、100%、120%),分别置于0.5 g空白基质中,加适量乙腈超声溶解,置于25 ml容量瓶中,加入乙腈至刻度,摇匀,即得低、中、高浓度的溶液,每个浓度平行操作3份,经0.22 μm微孔滤膜过滤后续滤液按前述相同色谱条件进样,记录各目标成分色谱峰面积。根据回归方程计算相应的含量,并计算回收率、平均回收率及RSD值如表6所示,各成分的回收率在95%~105%之间,RSD值均小于2%,表明此方法准确性良好。
药物 加入量
(μg/ml)测得量
(μg/ml)回收率
(%)平均回收率
(%)RSD
(%)苯甲醇 640.00 662.13 103.46 103.04 0.35 640.00 658.32 102.86 640.00 657.96 102.81 800.00 817.55 102.19 102.68 0.46 800.00 825.14 103.14 800.00 821.74 102.72 960.00 989.25 103.05 102.89 0.35 960.00 983.76 102.48 960.00 990.18 103.14 利多卡因 320.00 310.25 96.95 96.56 0.40 320.00 307.76 96.18 320.00 308.96 96.55 400.00 387.37 96.84 97.02 0.70 400.00 385.75 96.44 400.00 391.06 97.77 480.00 460.57 95.95 96.63 0.93 480.00 468.73 97.65 480.00 462.18 96.29 苯扎氯铵 32.00 30.76 96.13 96.81 0.80 32.00 31.25 97.66 32.00 30.93 96.66 40.00 38.69 96.73 96.63 1.09 40.00 39.05 97.63 40.00 38.21 95.53 48.00 46.68 97.25 97.11 1.83 48.00 45.73 95.27 48.00 47.43 98.81 (9)含量测定:取不同批次的液体创可贴样品按“(2)”项下方法配制供试品溶液,按前述色谱条件测定,测得3个成分的含量结果如表7。根据《中国药典》2020年版(二部)相关规定,确定本品含苯甲醇、利多卡因和苯甲醇应为标示量的95.0%~105.0%,由表7可知液体创可贴中3种主要成分的含量均符合要求。
批号 苯甲醇(%) 利多卡因(%) 苯扎氯铵(%) 20201130 99.74±0.23 97.39±0.16 100.57±0.07 20201222 98.92±0.19 97.06±0.35 101.23±0.14 20210106 98.48±0.05 96.59±0.04 96.83±0.12 -
4只健康家兔于试验前24 h在背部脊柱两侧划定呈对称的两块区域,面积均为约3 cm×3 cm。将划定区域的毛发脱净,给药前检查去毛皮肤是否受损伤,剔除受损皮肤。采用自身对照法,一侧为实验组,另一侧为空白组。取自制液体创可贴约0.5 g均匀涂覆于一侧脱毛区域,先用两层纱布和一层玻璃纸覆盖,再用胶布固定;另一侧不涂任何样品作为空白对照,其他操作同实验组。
(1)单次刺激性试验:进行封闭实验,贴敷4 h后除去受试物,用温水清洗给药皮肤表面,在清洗后的1、24、48、72 h在自然光环境下观察皮肤状况。根据表8对皮肤刺激反应评分,以受试动物积分的平均值按表9判断皮肤刺激强度,结果见表10。
红斑和焦痂 分值 水肿 分值 无 0 无 0 非常轻的红斑,勉强可见 1 非常轻度的水肿,勉强可见 1 明显的红斑 2 轻度水肿(边缘清晰) 2 中度至重度的红斑 3 中度水肿(皮肤隆起约1mm) 3 重度红斑(鲜红色)至轻度焦痂形成(深层损伤) 4 重度水肿(皮肤隆起大于1mm,并超过涂受试物的区域) 4 平均积分 强度 0.0 ~ 0.5 无刺激性 0.5 ~ 2.0 轻刺激性 2.0 ~ 6.0 中刺激性 6.0 ~ 8.0 强刺激性 时间(t/h) 空白区 受试区 No.1 No.2 No.3 No.4 总积分 平均分 No.1 No.2 No.3 No.4 总积分 平均分 1 0 0 0 0 0 0 0 0 0 0 0 0.00 24 0 0 0 0 0 0 0 0 0 0 0 0.00 48 0 0 0 0 0 0 0 1 0 0 1 0.25 72 0 0 0 0 0 0 0 1 0 0 1 0.25 结果给药区和空白区皮肤均未观察到红斑、充血、水肿等刺激症状,皮肤刺激反应平均分<0.5,表明自制液体创可贴对皮肤无刺激性。
(2)多次刺激性试验:初次给药操作同单次试验,之后每2 d涂抹1次,持续2周。从第2 天开始,每次涂抹前应脱毛,用无刺激性溶剂清除残留受试物1 h后观察皮肤情况,根据表8评分。以平均积分=红斑和水肿积分/(受试动物数×14)计算每天每只兔子平均积分,根据表9判断皮肤刺激强度,结果见表11。
时间(t/d) 空白区 受试区 No.1 No.2 No.3 No.4 总积分 平均分 No.1 No.2 No.3 No.4 总积分 平均分 1 0 0 0 0 0 0.00 0 0 0 0 0 0.00 2 0 0 0 0 0 0.00 0 0 0 0 0 0.00 3 0 0 0 0 0 0.00 0 0 0 0 0 0.00 4 0 0 0 0 0 0.00 0 0 0 0 0 0.00 5 0 0 0 0 0 0.00 0 0 0 0 0 0.00 6 0 0 0 0 0 0.00 0 0 0 0 0 0.00 7 0 0 0 0 0 0.00 0 0 0 0 0 0.00 8 0 0 0 0 0 0.00 0 0 1 0 1 0.25 9 0 0 0 0 0 0.00 0 0 0 0 0 0.00 10 0 0 0 0 0 0.00 0 0 0 0 0 0.00 11 0 0 0 0 0 0.00 0 1 0 0 1 0.25 12 0 0 0 0 0 0.00 0 0 0 1 1 0.25 13 0 0 0 0 0 0.00 0 0 0 0 0 0.00 14 0 0 0 0 0 0.00 0 0 0 1 1 0.25 结果显示空白区皮肤未出现刺激症状,偶有一只家兔受试区在第8、11、12、14 天出现很轻的红斑或水肿,平均积分值<0.5,表明自制液体创可贴多次用药对皮肤无明显刺激性。
-
选用50只健康成年豚鼠进行试验,随机分为3组,其中实验组与阳性对照组各20只,阴性对照组10只。试验前24 h在豚鼠背部左侧约5 cm2区域内脱毛,在试验过程中切忌损伤表皮。
试验分为诱导接触与激发接触,根据文献[10-11]方法依次进行。激发接触24和48 h之后观察皮肤变化,按表8评分,当实验动物出现皮肤反应积分≥2时,判定该动物发生皮肤变态反应,根据表12确定受试物的致敏强度。
致敏率(%) 分级 过敏反应强度 0~8 Ⅰ 弱致敏 9~28 Ⅱ 轻度致敏 29~64 Ⅲ 中度致敏 65~80 Ⅳ 强致敏 81~100 Ⅴ 极强致敏 实验组给药为自制液体创可贴;阳性对照为2,4-二硝基氯代苯;阴性对照在诱导接触时进行与实验相同的处理但不涂任何样品,激发接触时给予自制液体创可贴。
结果观察到实验组与阴性对照组豚鼠皮肤均未见红斑、水肿等过敏症状,而阳性对照组激发接触后24 h均出现明显过敏症状,如表13所示,自制液体创可贴致敏率为0,无皮肤变态反应发生。
组别 动物数
(n)观察时间
(t/h)皮肤反应
强度评分阳性
动物数致敏率
(%)0 1 2 3 4 实验组 20 24 20 0 0 0 0 0 0 48 20 0 0 0 0 0 0 阳性对照组 20 24 4 2 12 2 0 14 70 48 2 3 14 1 0 15 75 阴性对照组 10 24 10 0 0 0 0 0 0 48 10 0 0 0 0 0 0 -
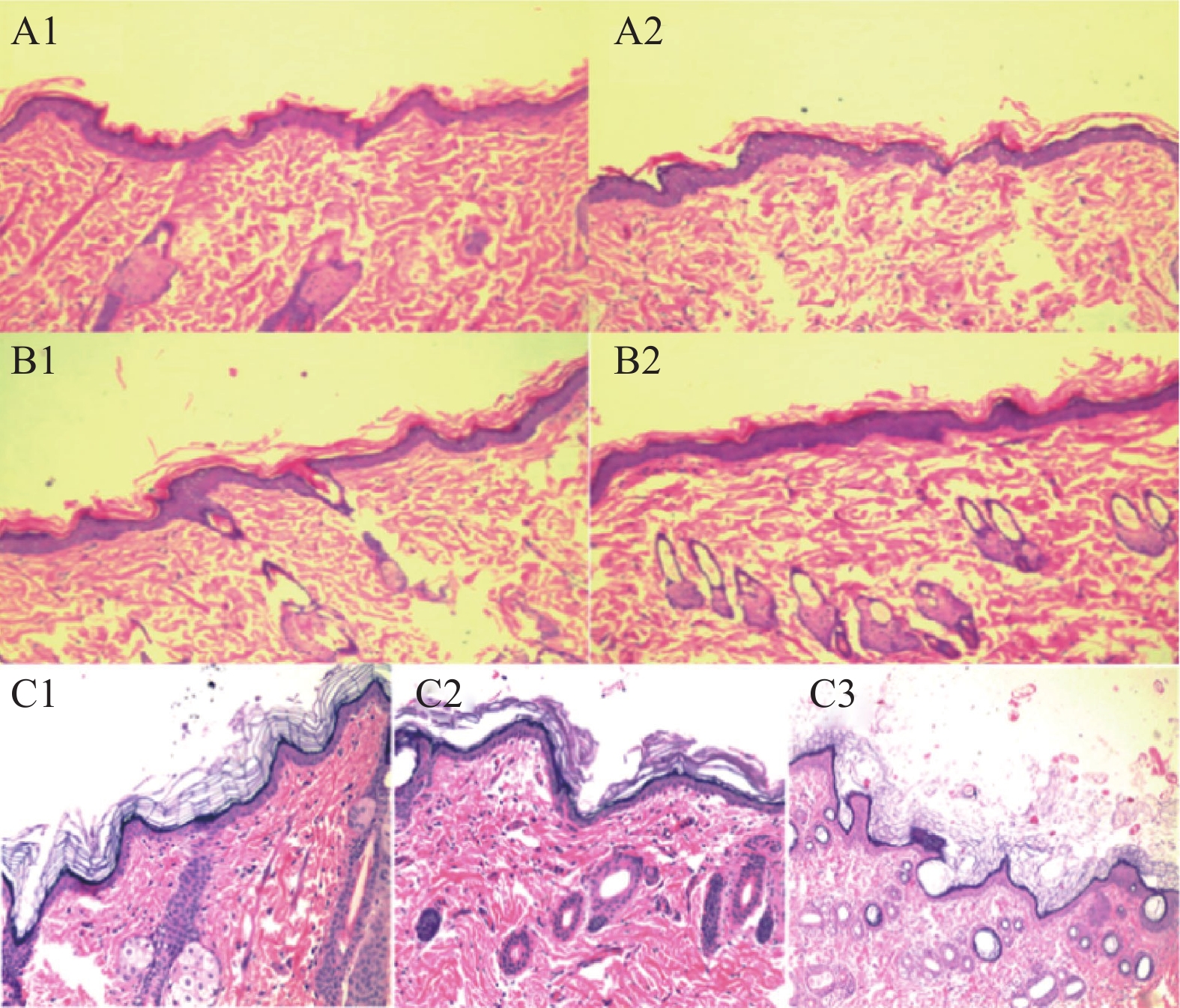
在皮肤刺激性和变态反应试验之后,取各组皮肤进行HE染色切片观察。如图2所示,刺激性试验和变态反应试验中使用液体创可贴后,动物皮肤结构完整,与空白组正常皮肤组织基本一致。
-
液体创可贴属于新型的药械产品,目前尚无相关国家标准及行业标准对其质量进行统一控制。本研究根据《中华人民共和国医药行业标准YY/T 0471.3-2004接触性创面敷料试验方法》及《中国药典》(2020年版)涂膜剂等相关标准对液体创可贴的质量进行了较全面的考察,结合市售产品考察结果,制定本品的质量标准如下:成膜时间应不大于5 min,断点伸长百分率不低于130%,抗张强度不低于3 MPa, 水损失率不得高于3.5%,MVTR(水蒸气透过率)不得小于0.6 mg/(cm2·h),相关功能性成分含量应为标示量的95.0%~105.0%,其他如装量、鉴别等项目应符合相关规定。此质量标准适用于大部分涂抹型液体创可贴产品,可为同类产品的质量控制提供一定参考。
关于HPLC法测定自制液体创可贴的含量,通过紫外扫描发现苯甲醇、利多卡因和苯扎氯铵在210 nm处具有最大吸收波长,初步采用210 nm作为检测波长,发现液体创可贴中其他成分产生的杂峰对目标成分的测定存在干扰。另外,因为采用醋酸铵缓冲溶液为流动相,其在酸性条件下形成醋酸浓度远高于苯扎氯铵,在210 nm处有强吸收,会掩盖苯扎氯铵的紫外吸收,导致其无法出峰。同时因供试品中苯甲醇和利多卡因的浓度是苯扎氯铵的20倍和10倍,为保证3种药物能准确测定,选择相关报道常用的苯扎氯铵第2个吸收峰波长262 nm作为检测波长。
苯甲醇、利多卡因和苯扎氯铵这3种物质被同时测定的方法尚未见报道,参考有关文献[12-14],最初尝试几个能同时测定多个成分中含上述3种成分之一的方法,均无法满足能同时测定这3个物质。后考虑到苯扎氯铵是季铵盐类阳离子表面活性剂,以纯水-乙腈或甲醇为流动相时苯扎氯铵成分吸收较小,且峰形杂乱。最终参考文献[15-16]方法选择乙酸铵缓冲液-乙腈为流动相,以l%三乙胺改善色谱峰拖尾问题,用冰醋酸调节流动相pH为4.8,苯扎氯铵能得到较好分离并且峰形良好。关于流动相比例,首先以高比例的水相梯度洗脱苯甲醇和利多卡因,发现基线太不稳定使后续出峰的苯扎氯铵峰形无法辨认计算,后采用等度洗脱并不断调整至醋酸铵缓冲液-乙腈比例为40∶60,能在20 min内使三者得到满足要求的分离。苯扎氯铵主要由n-C12H25、n-C14H29与n-C16H33 3种正烷烃基取代二甲基苄基氯化铵组成的同系物组成[16]。因为液体创可贴中苯扎氯铵与另2个成分浓度相差太大,苯扎氯铵中2种同系物(n-C14H29与n-C16H33取代物)含量则更低,无法同时测定,因此本文只以1个峰对苯扎氯铵定量。
安全性试验结果显示自制液体创可贴对皮肤没有明显的刺激性,无变态反应发生,该制剂应用安全。综上所述,本研究对自制液体创可贴的质量品质与安全性进行了考察,从性状、鉴别、检查和含量测定4个方面建立了自制液体创可贴的质量控制方法,并对相关市售产品进行了检查,检查方法简便可靠,含量测定方法准确灵敏,可用于液体创可贴的质量控制,为液体创可贴质量标准的建立提供了一定参考依据。
Research on quality control standard and safety of liquid bandage
doi: 10.12206/j.issn.2097-2024.202103063
- Received Date: 2021-03-22
- Rev Recd Date: 2021-06-05
- Available Online: 2023-07-14
- Publish Date: 2023-02-25
-
Key words:
- liquid bandage /
- quality control /
- security
Abstract:
| Citation: | XU Hang, WANG Tianyu, ZHANG Lingna, SONG Hongtao. Research on quality control standard and safety of liquid bandage[J]. Journal of Pharmaceutical Practice and Service, 2023, 41(2): 106-112, 129. doi: 10.12206/j.issn.2097-2024.202103063 |







 DownLoad:
DownLoad: