-
骨质疏松症是一种全身性骨代谢疾病,其典型特征是骨密度下降、骨脆性增加和骨微环境被破坏[1]。骨稳态失衡是其发生的主要病理学基础。骨稳态是指成骨细胞行使的骨形成功能和破骨细胞行使的骨吸收功能处在一个相对平衡的过程[2]。破骨细胞分化及其功能的过度活化是导致骨稳态失衡的重要因素[3]。中国骨质疏松症流行病学调查显示,我国50岁以上人群骨质疏松发病率为19.2%,65岁以上人群发病率为32%[4]。目前临床上治疗骨质疏松症的药物主要是骨吸收抑制剂,其在抑制骨吸收的同时,也干扰骨形成进程。因而发掘更好的治疗骨质疏松的药物是迫切需要的。
骨髓来源的巨噬细胞(BMMs)向破骨细胞分化需要重组小鼠巨噬细胞集落刺激因子(M-CSF)和核因子κB受体活化因子配体(RANKL)的持续刺激[5]。M-CSF增加了早期BMMs的增殖,RANKL与受体RANK结合激活肿瘤坏死因子受体相关因子6(TRAF6),进而激活细胞凋亡信号调节激酶1(ASK1)和NF-κB抑制物激酶(IKKs),活化的ASK1和IKKs磷酸化JNK、ERK和P38以及NF-κB特异性抑制因子IκB特定部位的丝氨酸,激活MAPK和NF-κB信号。活化的MAPK和NF-κB使c-Fos、NFATc1表达增加,促进DC-STAMP、ATP6V0d2、TRAP、CTSK等破骨细胞特异性基因的转录与表达,导致破骨细胞分化[6]。研究表明,减弱破骨细胞分化及功能,能够有效地治疗骨质疏松症[7]。
冬虫夏草是一味传统中药,有增强免疫、抗炎、抗氧化和延缓衰老等作用[8]。先前的研究表明,富含锶的冬虫夏草菌丝发酵液对去卵巢骨质疏松大鼠有良好的治疗效果,其机制是提高了血清中的雌二醇水平,但是该研究仅基于整体水平解释了冬虫夏草作用于骨质疏松症的机制,对冬虫夏草的菌种也未作鉴定,并且野生的冬虫夏草提取液在骨质疏松症中的作用也未见报道[9-11]。本研究旨在探讨冬虫夏草提取液(CSE)对去卵巢小鼠的治疗作用以及对破骨细胞分化和功能的影响,为CSE防治骨质疏松症提供实验依据。
-
SPF级雌性C57BL/6小鼠(上海西普尔-必凯实验动物有限公司),12周龄24只,6周龄7只,体质量20~22 g,合格证号:SCXK(沪)2018-0006。本实验经江西中医药大学实验动物伦理委员会批准(批号JZLLSC2019-0194),且遵循中国伦理委员会指导原则。
-
α-MEM培养基(美国Hyclone,批号:SH30265.01);胎牛血清(美国Gbico,批号:10099-141);重组小鼠RANKL、M-CSF蛋白(美国R&D,批号:462-TEC-010、416-ML-010);TRAP染色试剂盒(浙江卓腾生物公司);RNAiso Plus、TB Green(日本Takara,批号:9109、RR420B);p-JNK、JNK、p-ERK1/2、ERK1/2、p-P38、P38和GAPDH兔单克隆抗体(美国CST,批号:4668、9252、4370、4695、4511、8690、5174);山羊抗兔IgG H&L (IRDye® 800CW)预吸附二抗(美国Abcam,批号:ab216773);冬虫夏草(上海雷允上药业有限公司);羟基磷灰石涂板/96孔板(美国Corning,批号:3989);小鼠抗酒石酸酸性磷酸酶、骨钙素、骨碱性磷酸酶ELISA试剂盒(上海生工,批号:D721140、D721126、D721049)。
-
371型细胞培养箱(美国Thermo);Cytation 5多功能酶标仪(美国Bio-Tek);CFX96型实时荧光定量PCR仪(美国Bio-Rad);SA型近红外双色激光成像系统(美国odyssey);TI-SR型倒置显微镜(日本Nikon);RM2016型病理切片机(上海徕卡仪器有限公司);JB-P5型包埋机(武汉俊杰)。
-
冬虫夏草(Cordyceps sinensis)药材产地为青海玉树,购自上海雷允上药业有限公司,经海军军医大学黄宝康教授鉴定。提取详情见引文[12]。
-
选取6周龄C57BL/6小鼠,使用颈椎脱臼法处死,取双侧股骨和胫骨,使用PBS将骨髓从骨髓腔中冲出,收集PBS并离心,弃上清液,使用α-MEM培养基重悬,于T75培养瓶内(含10%血清,1%青霉素-链霉素溶液及30 ng/ml M-CSF完全培养基)培养3 d。使用PBS清洗去除未贴壁细胞,加入适量新鲜完全培养基,直至细胞数量达到5×106个[13]。
-
在96孔板中,BMMs以8×103个/孔的密度接种,孵育过夜;分别加入0、0.125、0.25、0.5、1、2、4 mg/ml CSE干预处理,培养48 h或96 h,加入CCK-8检测液,37 ℃孵育1 h后在波长480 nm处检测吸光度。
-
在96孔板中,BMMs以6×103个/孔的密度接种,孵育过夜;分别加入0、0.5、1、2 mg/ml CSE干预处理,同时加入50 ng/ml RANKL和30 ng/ml M-CSF,阴性对照组不加入RANKL;每2 d更换一次培养基,直至第5天对破骨细胞进行TRAP染色。
将同样密度的BMMs接种于96孔板,孵育过夜;记过夜后为第1天,分别于第1、3、5天加入1 mg/ml CSE干预处理,每2 d更换一次培养基至第7天(仅加药1次,之后更换培养基均不加CSE),进行TRAP染色[14]。
-
在96孔板中,BMMs以6×103个/孔的密度接种,孵育过夜;分别加入0、0.5、1、2 mg/ml CSE干预处理,同时加入50 ng/ml RANKL和30 ng/ml M-CSF,每2 d更换一次培养基。第5天用鬼笔环肽和DAPI分别对F-actin环和细胞核进行染色。
骨吸收实验:BMMs以5×105个/孔的密度接种于6孔板,孵育过夜;加入含50 ng/ml RANKL和30 ng/ml M-CSF完全培养基,每2 d换液,至第4天出现小的破骨样细胞,胰酶消化以8×103个/孔密度重新接种至羟基磷灰石涂板内,并且加入0、0.5、1、2 mg/ml CSE处理。培养3 d后,用次氯酸钠洗去细胞,PBS清洗后晾干,于光学显微镜下拍照,统计每个孔的骨陷窝面积[15]。
-
在12孔板中,BMMs以5×104个/孔的密度接种,孵育过夜;分别加入0、0.5、1、2 mg/ml CSE干预处理,同时加入50 ng/ml RANKL和30 ng/ml M-CSF,每2 d更换一次培养基至第5天。抽提RNA,逆转录后使用q-PCR检测DC-STAMP、ATP6V0d2、TRAP、CTSK、NFATc1基因的表达,引物序列详情见引文[16]。
-
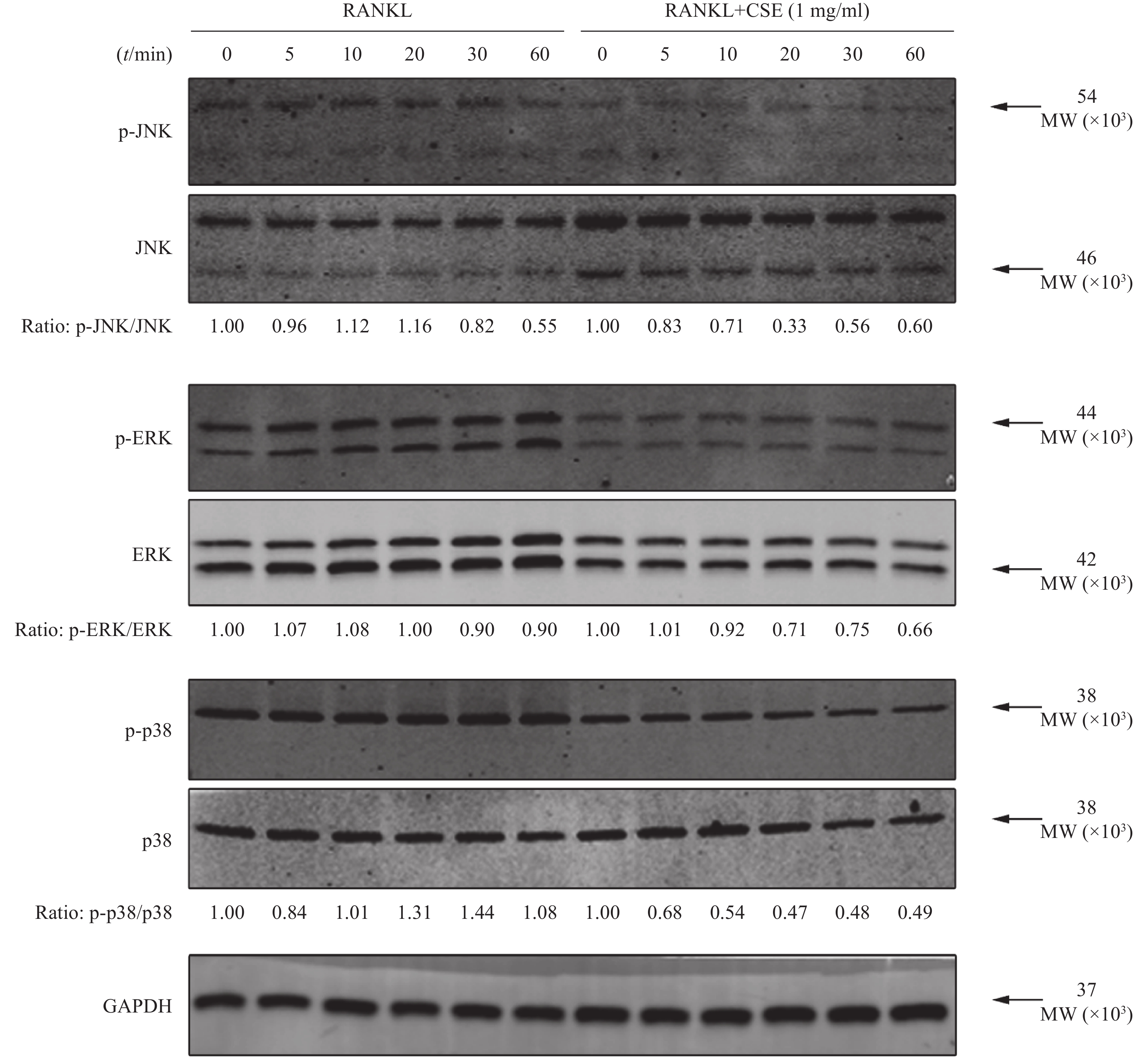
在6孔板中,BMMs以5×105个/孔的密度接种,孵育过夜;使用无血清的α-MEM培养基饥饿细胞1 h,实验组更换含1 mg/ml的CSE的完全培养基,对照组更换含相同体积PBS的完全培养基,孵育3 h;均使用50 ng/ml RANKL刺激5、10、20、30、60 min,未被刺激的细胞作为0 min。刺激完成后,抽提总蛋白。经SDS-PAGE凝胶电泳、转膜、5%脱脂奶粉封闭1 h,4 ℃下一抗孵育过夜,室温下荧光素偶联的二抗孵育1 h,用odyssey成像系统扫膜,分析JNK(1∶2000)、p-JNK(1∶2000)、ERK(1∶2000)、p-ERK(1∶2000)、P38(1∶2000)、p-P38(1∶2000)的表达。
-
在24只12周龄小鼠中随机挑选6只作为假手术组(Sham组),其余小鼠使用异氟烷气麻,去除背部毛发,切开皮肤和背膜,使卵巢暴露,切除双侧卵巢并使用可吸收缝合线结扎、缝合(假手术组仅切开背部皮肤和腹膜)[14]。术后1周,按照文献报道方法[17],将卵巢切除小鼠随机分为3组:模型组(OVX组)、CSE低剂量组、CSE高剂量组,每组6只。术后7 d开始给药,由预实验确定给药浓度为312.5和625 mg/kg,按照每只200 μl/d连续灌胃给药6周。
-
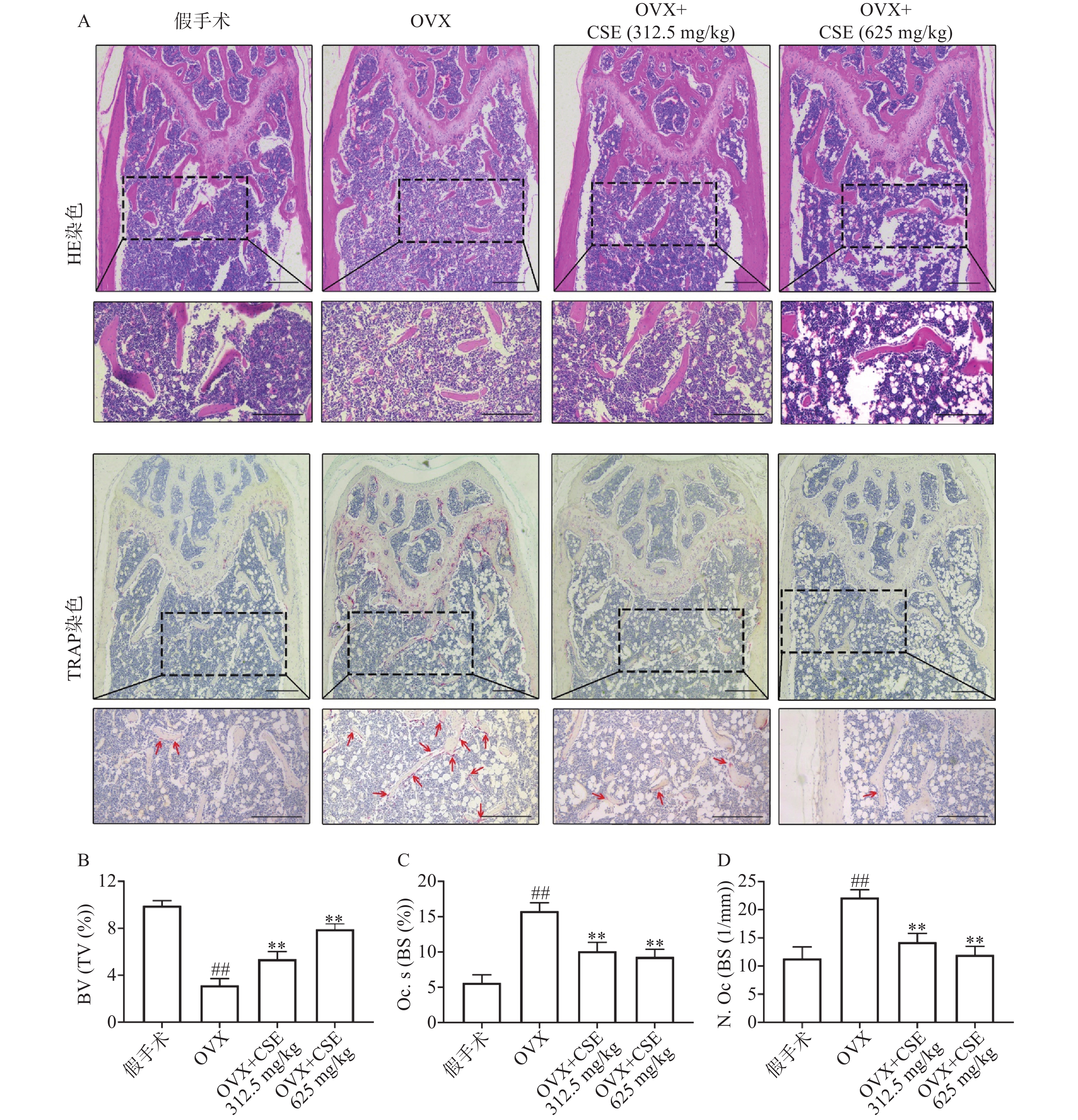
小鼠处死后取双侧股骨,4%多聚甲醛固定后进行脱钙处理,之后常规脱水、石蜡包埋,切成4 μm切片,分别进行HE染色和TRAP染色。统计破骨细胞数量/骨表面积(N. Oc/BS)、破骨细胞面积/骨表面积(Oc. S/BS)和骨体积/组织体积(BV/TV)。
-
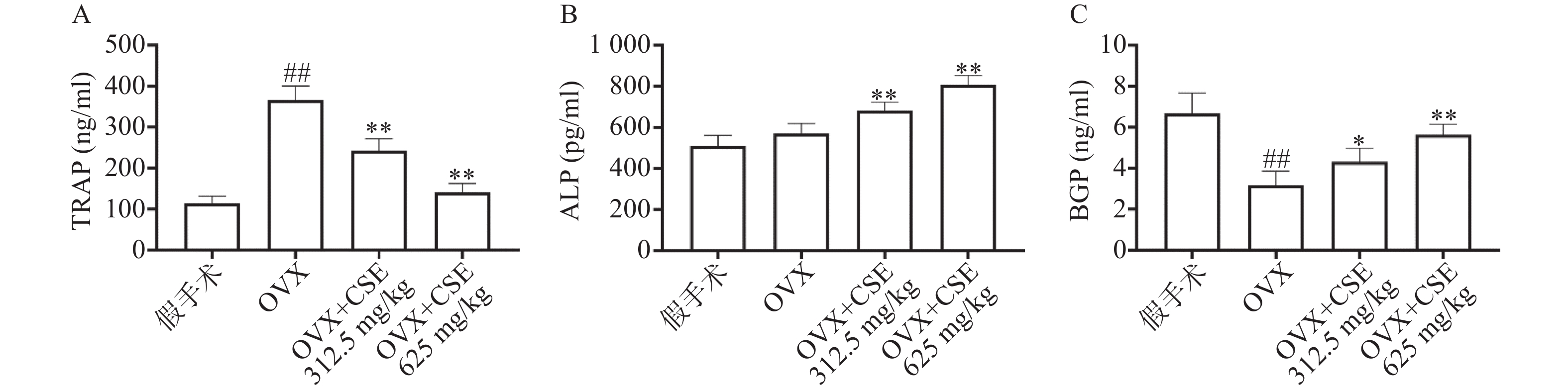
小鼠处死前统一摘除小鼠左眼取血,将全血收集并在4 ℃静置30 min,之后在4 ℃下2 000 r/min离心20 min,吸取上清液置于−80 ℃冰箱中保存。按照Elisa试剂盒《用户操作手册》检测血清中TRAP、ALP、BGP含量。
-
使用Image J统计破骨细胞面积和个数、F-actin环面积和环内核数、骨陷窝面积、蛋白条带灰度值、N. Oc/BS、Oc. S/BS和BV/TV。使用SPSS 21.0统计学软件对数据进行分析。计量资料用均数±标准差(
$\bar x $ ±s)表示,多组间比较使用方差分析,以P<0.05认为差异具有统计学意义。 -
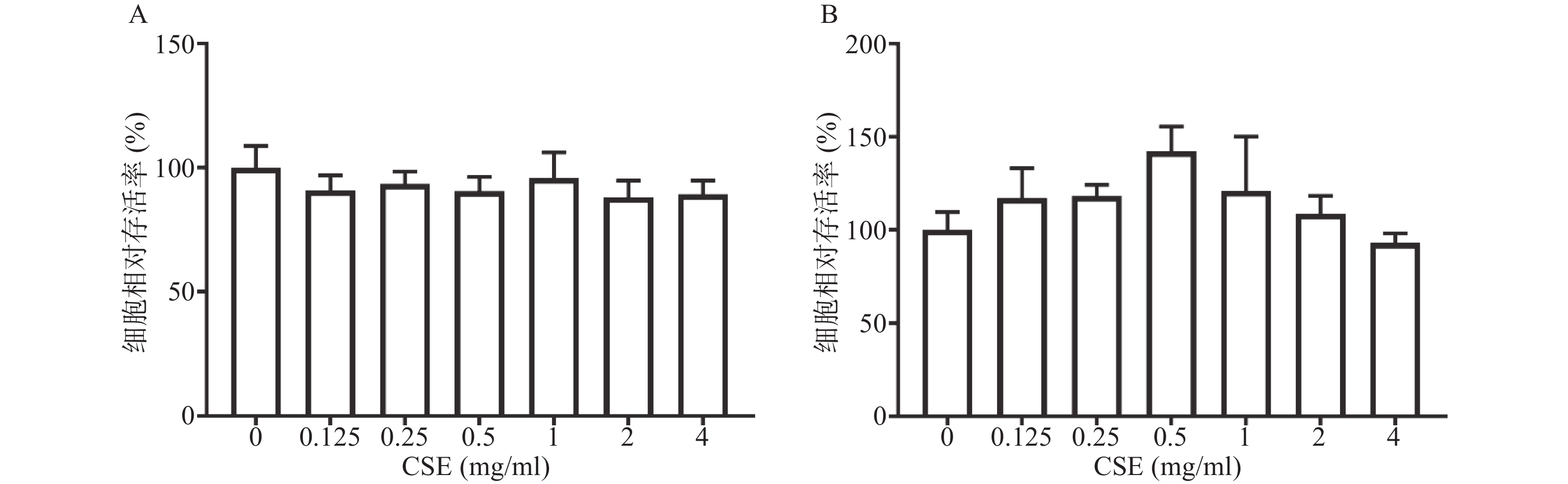
CCK-8结果显示,与空白组比较,CSE浓度范围在0.125~4 mg/ml时,48 h内和96 h内CSE对BMMs无细胞毒性(图1)。据此结果选择0.5、1、2 mg/ml作为之后的细胞实验浓度。
-
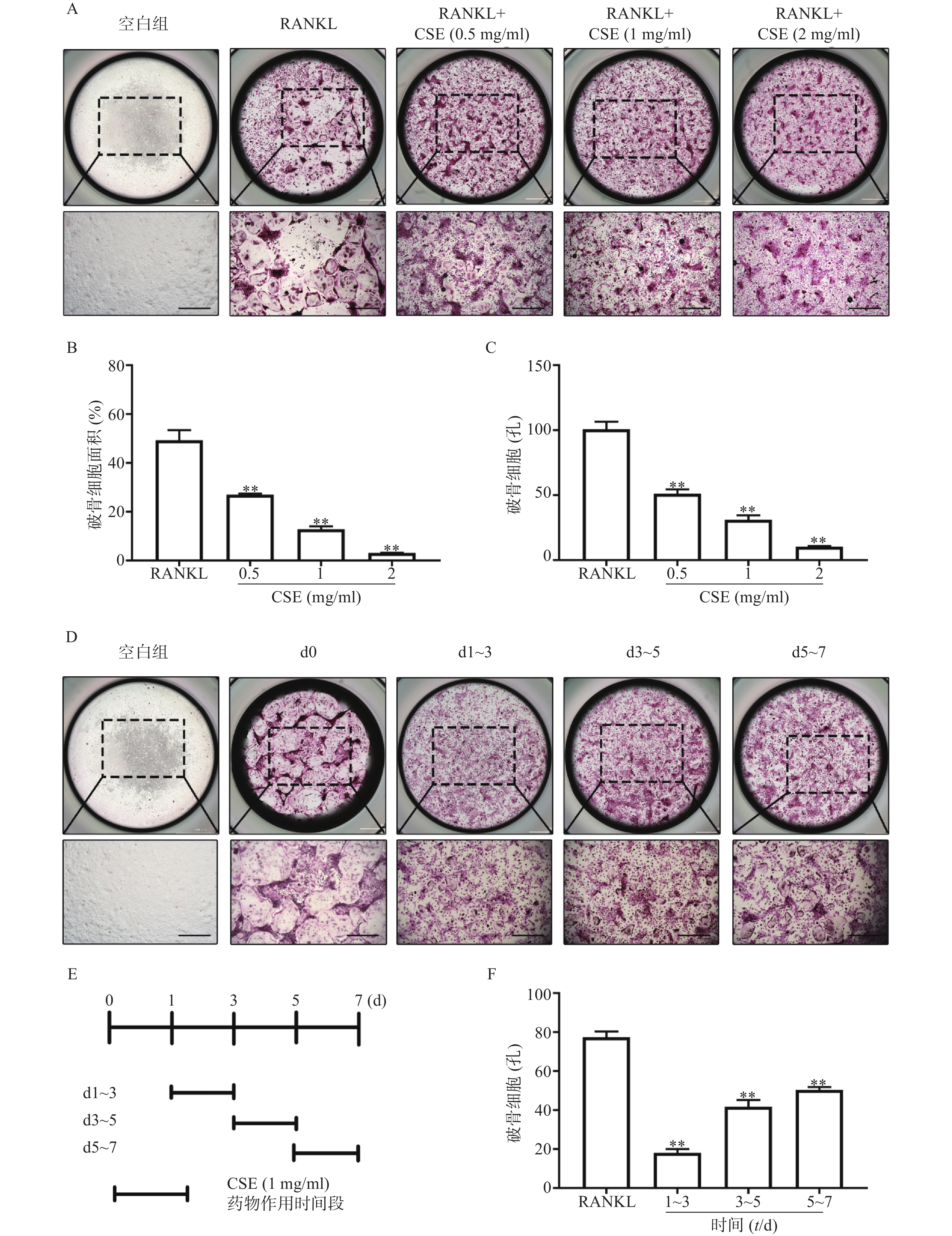
TRAP染色显示,与空白组比较,RANKL组的BMMs分化为成熟的TRAP阳性多核巨噬细胞(有完整的圆形状细胞形态且细胞核数目≥3)。与RANKL组比较,CSE不同剂量组的TRAP阳性多核巨噬细胞数量明显减少,且呈剂量依赖的方式下降,并且破骨细胞的大小也被显著抑制(图2A-C)。结果表明CSE不仅抑制破骨细胞的分化也阻碍了破骨细胞前体细胞的融合。
在RANKL持续刺激的BMMs中按时段加入CSE。染色结果显示,与空白组比较,0 d组的BMMs几乎全部分化为成熟的破骨细胞,数量多,且形状完整。与0 d组比较,给予CSE1~3 d组的BMMs分化为成熟破骨细胞的数量最少,3~5 d组其次,5~7 d组最多(图2D、2E、2F)。结果表明CSE对破骨细胞生成的任一阶段均有作用,在早期阶段作用最为明显。
-
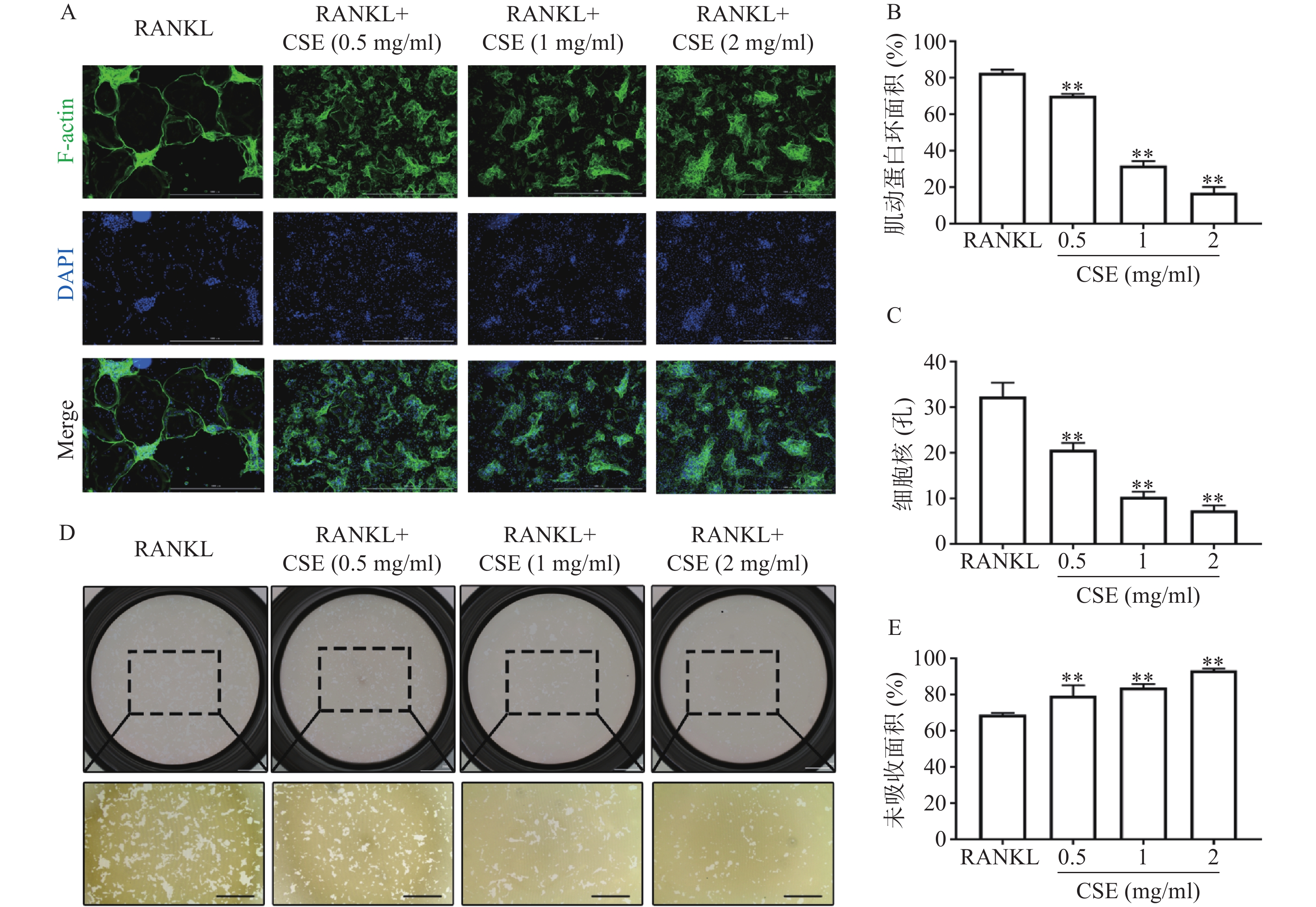
鬼笔环肽和DAPI染色显示,RANKL组的F-actin环形成完整,数量多且面积大,环内细胞核数量多。与RANKL组比较,CSE不同剂量组的F-actin环数量和大小均下降,环内细胞核数量也明显减少(图3A、3B、3C)。
骨板吸收显示,RANKL组未被吸收面积为70%, 1 mg/ml CSE组未被吸收面积为85%,2 mg/ml CSE组为95%,与RANKL组比较,不同剂量的CSE均有效的减少了骨板吸收的面积(图3D、3E)。结果表明CSE显著抑制了成熟破骨细胞骨吸收的功能。
-
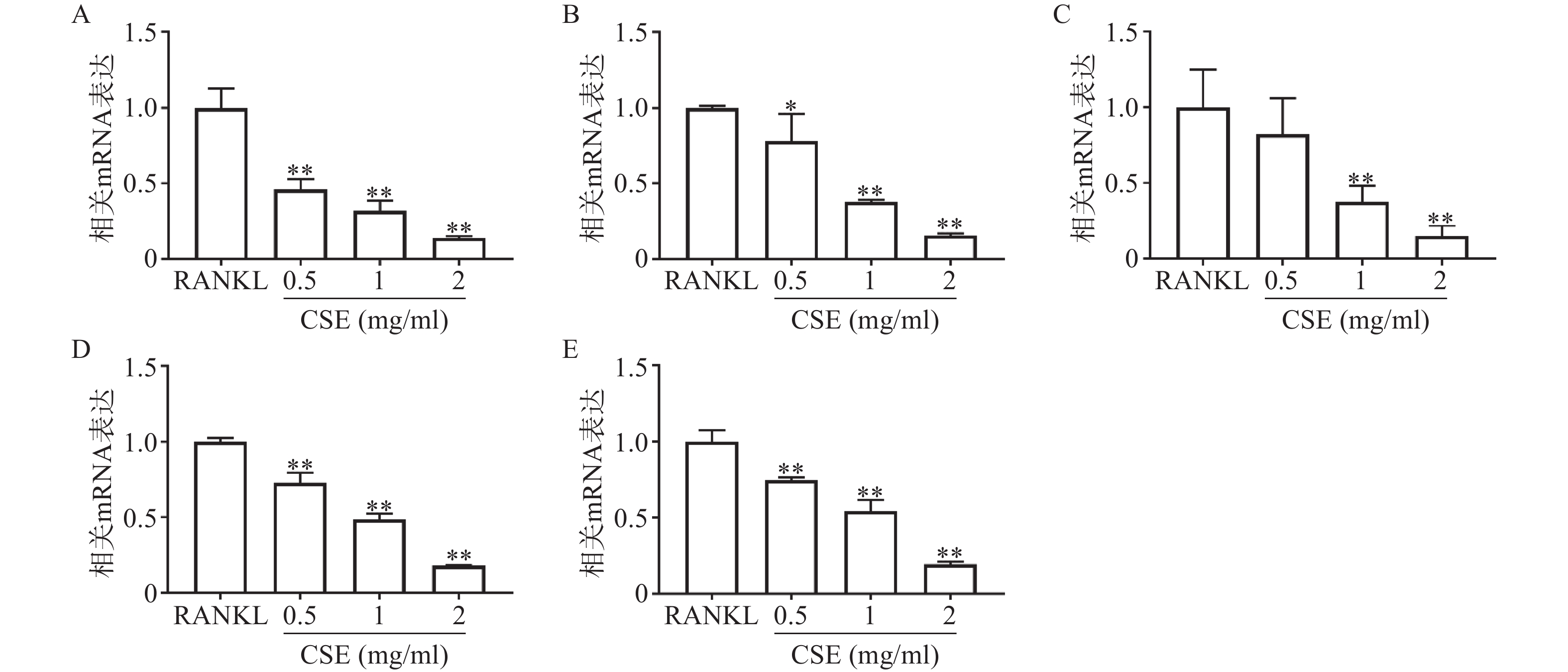
q-PCR结果显示,与RANKL组比较,CSE中、高剂量组显著性地抑制了破骨细胞特异性基因TRAP、CTSK、ATP6V0d2、DC-STAMP和NFATc1的表达,且呈剂量依赖性(图4)。这与CSE抑制破骨细胞分化及功能的结果相一致。
-
Wsetern-blot结果显示,RANKL组各时间段JNK、ERK和P38蛋白磷酸化显著。与RANKL组比较, CSE组p-JNK蛋白表达在第10~30 min明显下降,p-ERK蛋白表达在第20~60 min明显下降和p-P38蛋白表达在第10~60 min明显下降,见图5。结果表明在破骨细胞的分化过程中,CSE作用于MAPK通路JNK、ERK和P38的磷酸化。
-
HE和TRAP染色显示,与假手术组比较,OVX组小鼠的骨小梁数目和面积明显减少(BV/TV值下降)且间距变大,骨小梁表面破骨细胞数量增多、面积变大(N. Oc/BS、Oc. S/BS值上升)。与OVX组比较,CSE低剂量和高剂量组小鼠的骨小梁数目和面积均增加(BV/TV值上升)且间距减小,骨小梁表面破骨细胞数量减少、面积变小(N. Oc/BS、Oc. S/BS值下降),见图6。结果表明,CSE可以增加卵巢切除小鼠骨小梁数目,抑制破骨细胞活性,缓解骨量流失。
-
ELISA结果显示,与假手术组比较,OVX组小鼠血清中的TRAP含量明显增加,BGP含量明显减少,ALP含量无明显变化;CSE高剂量组小鼠血清中的TRAP、BGP含量无明显变化, ALP含量明显增加。与OVX组比较,CSE低剂量和高剂量组小鼠血清中的ALP、BGP含量明显增加,TRAP含量明显减少(图7)。结果表明,CSE可以调节骨代谢相关指标,具有平衡骨稳态作用。
-
骨质疏松症是一种与年龄相关的骨代谢疾病,骨重建失衡是其发生的主要原因,因绝经造成的骨质疏松占骨质疏松症的绝大部分。研究表明,雌激素对骨骼的生长、发育和维持至关重要,因雌激素缺失致使RANKL介导的信号通路过度活化,进而使破骨细胞功能异常,是绝经后骨质疏松症主要原因[18]。因而抑制破骨细胞的分化及其功能是治疗骨质疏松的有效途径[19]。在本研究中,我们发现CSE通过抑制MAPK信号通路的激活来抑制RANKL介导的破骨细胞生成,同时对OVX小鼠的骨质流失具有良好的保护作用。
研究表明,在RANKL的刺激下,BMMs中的MAPK通路被激活,进而刺激破骨细胞特异性基因的表达,促进BMMs分化为破骨细胞[19-21]。NFATc1和DC-STAMP是破骨细胞分化和前体破骨细胞融合的主要调控者,TRAP、CTSK、ATP6V0d2是反映破骨细胞活性和骨吸收状态的特异性指标[22-23]。本研究表明,CSE显著抑制RANKL介导的破骨细胞分化,而且在破骨细胞分化的早期阶段作用最为明显。其机制是抑制JNK、ERK和P38的激活,进而抑制破骨细胞特异性基因的表达。
F-actin环是分化成熟的破骨细胞在骨面上极化,使骨架重排,F-actin紧密排列形成的一个环,是破骨细胞进行骨吸收的先决条件。因而阻碍破骨细胞前体细胞的融合,能够有效抑制F-actin环的形成和骨吸收功能[24]。本研究发现CSE显著性地抑制F-actin环的形成,并降低了环内细胞核数以及骨陷窝面积,这表明CSE阻碍了破骨细胞前体细胞的融合和骨吸收功能,与CSE抑制破骨细胞分化及其特异性基因表达的结果相一致。
我们构建了去卵巢小鼠模型模拟绝经后的骨质疏松症,经CSE灌胃给药6周后,采用HE和TRAP染色对小鼠股骨进行骨组织形态学分析以及ELISA检测血清中ALP、TRAP、BGP含量。TRAP是酸性磷酸酶的同工酶,其血清浓度可反映破骨细胞的活性[25]。ALP是一种磷酸单酯酶,由成骨细胞分泌,能有效地反映成骨细胞的活性[27]。BGP由成骨细胞合成及分泌,绝大部分的BGP随成骨细胞矿化在骨基质中沉积,仅有一小部分进入到血液循环[14]。血液中的BGP是成骨细胞分泌完成后直接进入血液,并非是破骨细胞降解骨基质而进入血液,因而检测血液中的BGP含量,对评判机体经药物治疗后变化有较大的参考价值。结果显示,CSE能有效缓解骨量丢失,表现在CSE各剂量组小鼠的骨小梁数量增多,间距减少,以及骨表面破骨细胞数量和面积减少,表明了CSE对去卵巢小鼠的骨量流失具有良好的保护作用。同时CSE提高了血清中ALP含量,使BGP和TRAP含量回归正常水平,说明其可抑制破骨细胞分化,减弱骨吸收功能,具有缓解骨量流失和调节骨代谢作用。
总之,本研究发现CSE在体外抑制了RANKL诱导的破骨细胞分化及其骨吸收功能,其可能机制部分归因于CSE抑制了级联信号中ERK、JNK和P38的激活,在体内有效的缓解了因卵巢切除造成的骨量丢失,这为CSE防治骨质疏松症提供了初步的药理学证据。
Cordyceps sinensis extract protects against the ovariectomy-induced bone loss via the action on osteoclasts
doi: 10.12206/j.issn.2097-2024.202105037
- Received Date: 2021-05-12
- Rev Recd Date: 2021-09-22
- Available Online: 2023-07-14
- Publish Date: 2023-02-25
-
Key words:
- Cordyceps sinensis extract /
- osteoclast /
- differentiation /
- function /
- mechanism /
- ovariectomized mice
Abstract:
| Citation: | PENG Weibiao, WANG Ting, FENG Xu, WANG Jiachun, ZHANG Zhenzhen, CHU Zhiyong. Cordyceps sinensis extract protects against the ovariectomy-induced bone loss via the action on osteoclasts[J]. Journal of Pharmaceutical Practice and Service, 2023, 41(2): 97-105. doi: 10.12206/j.issn.2097-2024.202105037 |









 DownLoad:
DownLoad: