-
低压低氧、低温和强紫外线辐射是高原环境的主要特点,脑组织以有氧代谢为主,由于其耗氧量大、贮氧量少、代谢率高的特点,是对缺氧最为敏感的器官,高原缺氧时神经细胞首先出现能量代谢障碍,导致神经细胞的损伤甚至死亡,细胞凋亡是缺氧导致神经细胞损伤的重要机制。5-羟色胺转运体(5-HTT)是由SLC6A4基因编码的一种钠依赖的单胺转运蛋白,在大脑神经元、肺动脉平滑肌细胞、血小板等体细胞中均有表达,主要功能是将细胞外的5-HT再摄取至细胞内发挥生理作用[1]。5-HT作为活性氧化物自身具有细胞毒性,浓度过高则可产生大量的内源性氧化物导致线粒体途径的细胞凋亡[2],前期研究表明,缺氧可以诱导PC12细胞凋亡、5-HTT表达升高,给予一定剂量的5-HTT抑制剂盐酸氟西汀后可以降低PC12细胞5-HTT表达和凋亡,从而保护缺氧诱导的PC12细胞损伤[3-4],另有研究表明,高原缺氧会导致肺组织中5-HTT表达升高,机制与细胞凋亡有关[5-6],为了论证5-HTT的表达变化在缺氧神经细胞中的作用,我们利用RNA干扰(RNAi)的方法构建靶向SLC6A4基因的短发夹RNA (shRNA)重组慢病毒质粒表达载体,建立PC12细胞SLC6A4基因干扰的稳定表达细胞株,抑制PC12细胞中SLC6A4基因表达以及5-HTT蛋白的表达,测定缺氧情况下沉默SLC6A4基因对细胞凋亡的影响,以期为高原神经损伤相关疾病的研究提供理论依据,现报道如下。
-
RNA干扰(RNAi)重组慢病毒载体GV248、病毒包装辅助质粒(pHelper1.0和pHelper2.0载体)、人胚肾上皮细胞系293T细胞、大肠杆菌DH5α、DNA oligo、鉴定引物(R&F)及DNA测序(上海吉凯基因化学技术有限公司);大鼠嗜铬瘤PC12细胞系(美国模式培养物集存库,ATCC);二甲基亚砜(DMSO)(美国Sigma公司);DMEM培养基、0.25%Trypsin-EDTA胰酶(1×)、胎牛血清、BCA蛋白浓度测定试剂盒、0.25%胰酶消化液(美国Gibco公司);CCK-8试剂盒(日本同仁公司);FITC标记Annexin V/PI凋亡试剂盒(美国BD公司);EST-10-02氧浓度测定仪(美国ESTESNROS公司);倒置相差显微镜(日本Olympus公司);三气培养箱(德国Memmert公司);SW-CJ-2FD超净工作台(中国杭州净化工作设备厂);SpectraMaxi3全自动荧光酶标仪(美国Molecular Devices公司);流式细胞仪(美国艾森公司)。
-
将PC12细胞培养于F12-K培养基中,其中含有15%马血清、2.5%的胎牛血清以及1%双抗(100 U/ml青霉素和100 μg/ml链霉素)。293T培养于含10%胎牛血清、100 U/ml青霉素和1%双抗的DMEM培养基中,两种细胞均置于37 ℃、5%CO2饱和湿度培养箱中常规培养,缺氧培养采用1%O2模拟缺氧环境。
-
根据Genbank SLC6A4 基因转录本(NM_013034),利用软件设计3条针对SLC6A4基因干扰靶序列(表1),3条DNA oligo分别包含有21个碱基正义链、6个核苷酸序列的loop环和互补21个碱基的反义链,在5'端分别加上限制性核酸内切酶AgeⅠ和EcoRⅠ的酶切位点,在3'端加入RNA polyⅢ聚合酶转录终止信号TTTTT,反义链5 '加入终止信号互补序列。同时,以一段无关序列作为阴性对照(NC,即干扰对照组)。将DNA oligo复性后配对产生双链,通过其两端所含酶切位点采用T4连接酶与酶切后的慢病毒载体GV248在16 ℃连接过夜,构建3种目的基因的重组慢病毒质粒及对照质粒(SLC6A4-shRNA-GV248-1、SLC6A4-shRNA-GV248-2、SLC6A4-shRNA-GV248-3和NC-shRNA-GV248),转入准备好的感受态大肠杆菌DH5α中,挑取阳性克隆,GV248通用引物进行PCR电泳及测序鉴定。由上海吉凯基因化学技术有限公司构建和包装。
名称 序列 SLC6A4-shRNA-GV248-1F 5′-CCG GTA GCC AAA TAT CCA ATG GGT ACT CGA GTA CCC ATT GGA TAT TTG GCT ATT TTT G-3′ SLC6A4-shRNA-GV248-1R 5′-AAT TCA AAA ATA GCC AAA TAT CCA ATG GGT ACT CGA GTA CCC ATT GGA TAT TTG GCT ATT TTT G-3′ SLC6A4-shRNA-GV248-2F 5′-CCG GTG GCA ACT GCA CCA ACT ACT TCT CGA GAA GTA GTT GGT GCA GTT GCC ATT TTT G-3′ SLC6A4-shRNA-GV248-2R 5′-AAT TCA AAA ATG GCA ACT GCA CCA ACT ACT TCT CGA GAA GTA GTT GGT GCA GTT GCC ATT TTT G-3′ SLC6A4-shRNA-GV248-3F 5′-CCG GAC CCA ACT GGC AGA AAC TCT TCT CGA GAA GAG TTT CTG CCA GTT GGG TTT TTT G-3′ SLC6A4-shRNA-GV248-3R 5′-CCG GAC CCA ACT GGC AGA AAC TCT TCT CGA GAA GAG TTT CTG CCA GTT GGG TTT TTT G-3′ -
重组慢病毒质粒(SLC6A4-shRNA-GV248-1、SLC6A4-shRNA-GV248-2、SLC6A4-shRNA-GV248-3和NC-shRNA-GV248)与辅助质粒(pHelper 1.0 载体质粒、pHelper 2.0载体质粒)重组慢病毒质粒(SLC6A4-shRNA-GV248-1、SLC6A4-shRNA-GV248-2、SLC6A4-shRNA-GV248-3和NC-shRNA-GV248)与辅助质粒(pHelper 1.0 载体质粒、pHelper 2.0载体质粒),当293T的细胞密度达到80%左右,3个重组慢病毒质粒和空慢病毒载体分别与辅助包装载体质粒进行转染实验,用Lipofectamine TM 2000共转染,培养6 h,更换为完全培养基培养,荧光显微镜下观察细胞形态和GFP表达,48 h后收集上清液,20 000r/min超速离心3 h并浓缩病毒,最后包装产生慢病毒,即含有3条SLC6A4基因序列的慢病毒EGFP-shSLC6A4-1、EGFP-shSLC6A4-2、EGFP-shSLC6A4-3。4 ℃,1 500 r/min离心5 min,吸取上清液,再用0.45 μm滤器过滤,离心浓缩,得到重组慢病毒,测定病毒滴度后,分装在−80 ℃冰箱保存。
-
将对数生长期的PC12细胞于感染前24 h接种于6孔板中,接种体积为2 ml/孔,细胞数目同为5×104个/ml。用病毒原液感染状态较好的PC12细胞,实验设SLC6A4干扰组(ShSLC6A4-1/ShSLC6A4-2/ShSLC6A4-3),空载体组(VECTOR)。按预实验确定的感染复数(MOI)感染细胞(MOI=100),加入5 μg/ml的转染增敏剂凝聚胺。12 h后更换为完全培养基,72 h后用倒置荧光显微镜观察绿色荧光即绿色荧光蛋白(GFP)表达情况,用含2 μg/ml嘌呤霉素的新鲜培养基替换病毒感染液。待WT组细胞被嘌呤霉素全部杀死后,将SLC6A4干扰组存活下来的细胞转移至6孔板,继续用含嘌呤霉素的培养基培养,直至细胞密度达70%时,用含嘌呤霉素的培养基持续培养,选取生长状态良好的阳性克隆孔逐级扩大培养,获得敲减SLC6A4基因PC12细胞稳定细胞株。
-
总RNA的提取及其质量和浓度的测定:按照TaKaRa基因提取试剂盒说明书提取基因。使用BiowaveⅡ+紫外仪测定RNA的浓度。反转录反应:将提取的总RNA 反转录为cDNA后,以cDNA为模板实时荧光定量,将样品放入−80 ℃冰箱保存。RT反应液反应体系:(RT-PCR引物的合成F,5'-ACTAGCTGCACGAACTCCTGGAA-3'和R,5'-AGACTGGTGGATCTGCAGGACA-3'),由宝生物有限公司设计合成大鼠mRNA序列,Real-time RT-PCR反应稀释引物,配制PCR反应液,将cDNA和PCR反应液加入八连管后,置于实时荧光定量PCR仪中反应,2 h后可得扩增和溶解曲线、目的基因的Ct值。RT-PCR反应条件:第一步:95 ℃、30 s,第二步:95 ℃、5 s;60 ℃、31 s;40个循环。对PCR阳性克隆片段测序,并在GenBank数据库中将测序出的结果进行Blast比对。
-
干扰对照组(转染 NC-shRNA)、干扰组(转染SLC6A4-shRNA)。对数生长期生长状态良好的3组细胞,培养24 h,收集各组细胞,PBS洗涤2次,离心,弃上清液,加入100 μl预冷的RIPA细胞裂解液,置冰上30 min,4 ℃、12 000×g离心15 min,取上清液并进行蛋白定量(BCA法),加上样缓冲液煮沸10 min,离心后取50 μg蛋白样品进行10% SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,蛋白半干转移至PVDF膜,50 g/L脱脂奶粉的TBST缓冲液室温封闭1 h,加入大鼠SLC6A4的Ⅰ抗,4 ℃孵育过夜。应用TBST反复洗膜3次,加入Ⅱ抗室温孵育1 h,TBST洗膜3次,将胶片拍照后用凝胶图像处理系统分析,实验重复3次。
-
将PC12细胞干扰对照组(转染 NC-shRNA)、干扰组(转染SLC6A4-shRNA-2)分为两组,将对数生长期的各组细胞分别以105的密度接种于6孔板中,24 h后,更换培养液。将NC-shRNA组和SLC6A4-shRNA组细胞分为正常条件和缺氧条件培养,正常组:置于37 ℃、5%CO2饱和湿度培养箱中常规培养;缺氧组:将培养皿置于缺氧小室中,混合气体(体积分数94% N2+体积分数5% CO2+体积分数1%O2 )置换其中的空气,之后将装置放入37 ℃的培养箱中缺氧培养。24 h后用4 ℃预冷的 PBS洗2次,去掉残余培养基,用不含 EDTA 的胰酶消化,室温下1 500×g离心10 min,弃去培养基,收集细胞;用4 ℃预冷的1×PBS洗涤细胞2次,150×g 离心5 min,去上清液,收集细胞;加入1×结合缓冲液 300 μl 悬浮细胞,调整浓度约1×106个细胞/ml;每100 μl细胞悬液加入5 μl Annexin V-FITC混匀,室温避光孵育15 min;上机检测前5 min,加入5 μl PI染色;补加400 μl 1×结合缓冲液轻轻混匀;将细胞转入流式管中,应用流式细胞仪检测。
-
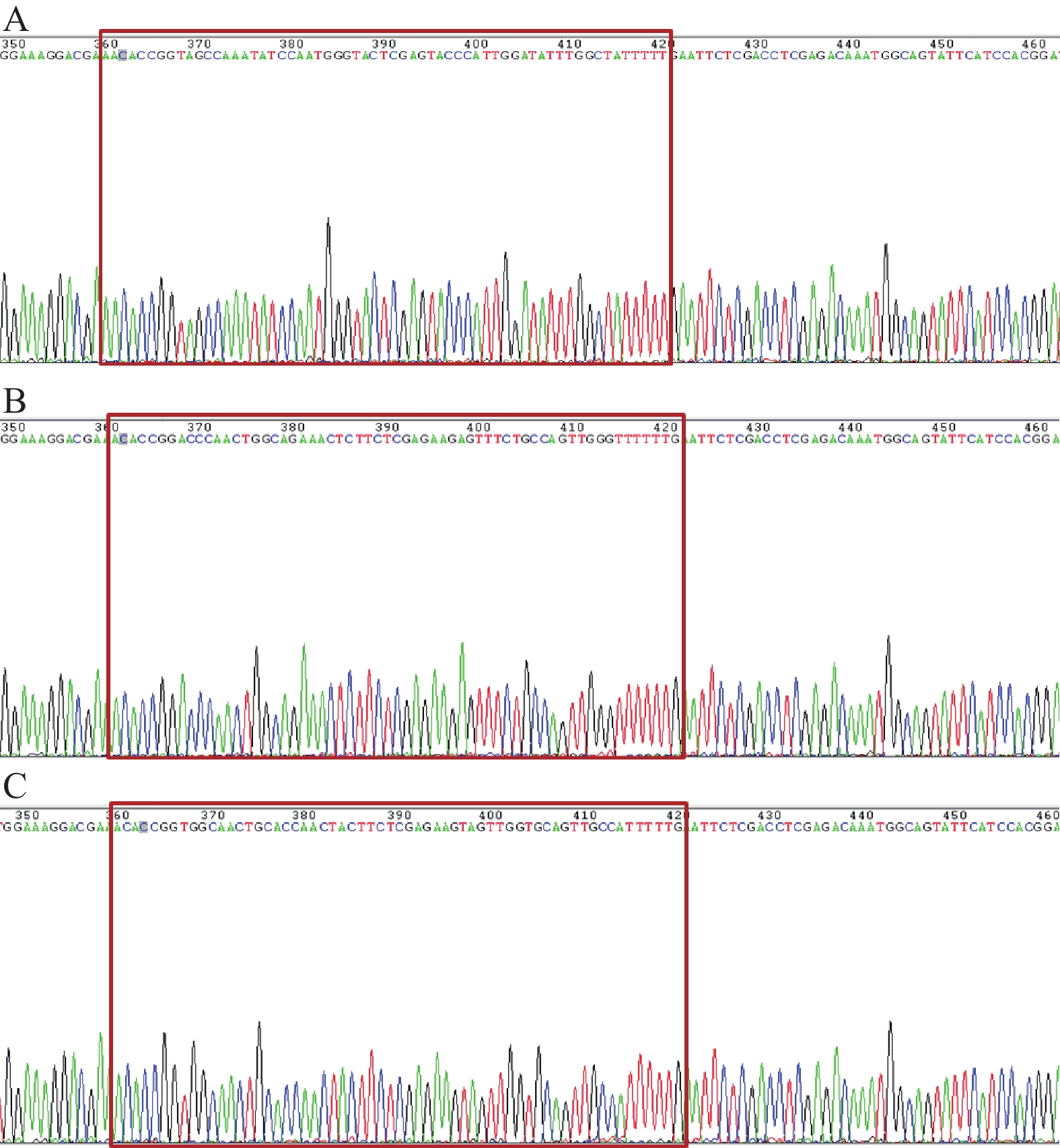
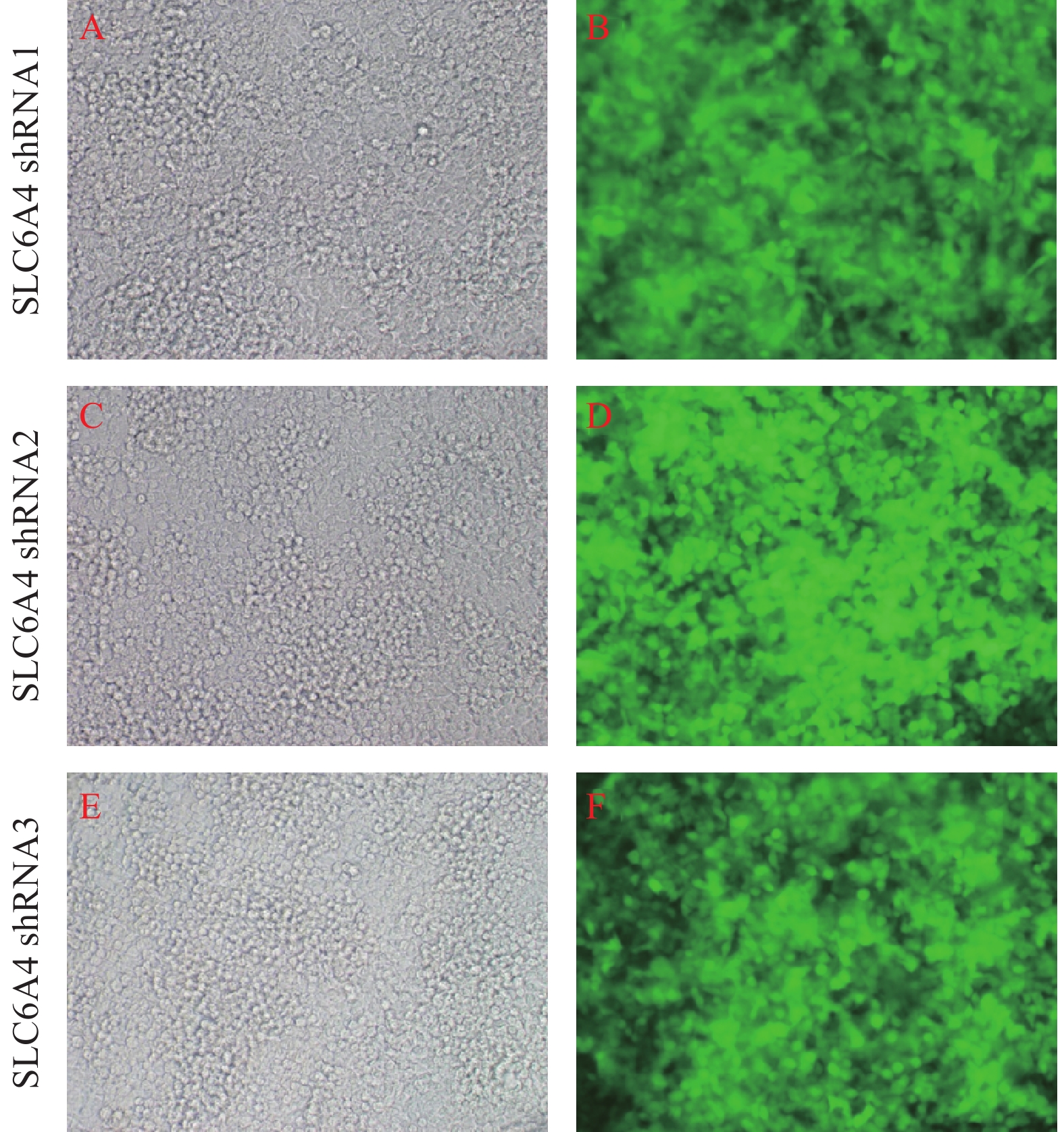
GV248与含特定RNAi靶序列的DNA oligo经酶切后连接,转化大肠杆菌DH5α,挑取重组阳性克隆进行测序鉴定,结果显示阳性克隆测序(图1)显示含有正确的RNAi靶序列,表明shRNA片段已定向插入慢病毒载体质粒。重组shRNA慢病毒载体与慢病毒包装体系混合后感染293T细胞,293T细胞生长状态良好,呈圆形,大小均匀,排列致密整齐,荧光显微镜下观察感染细胞呈明显GFP绿色荧光,感染率超过90%(图2)。
-
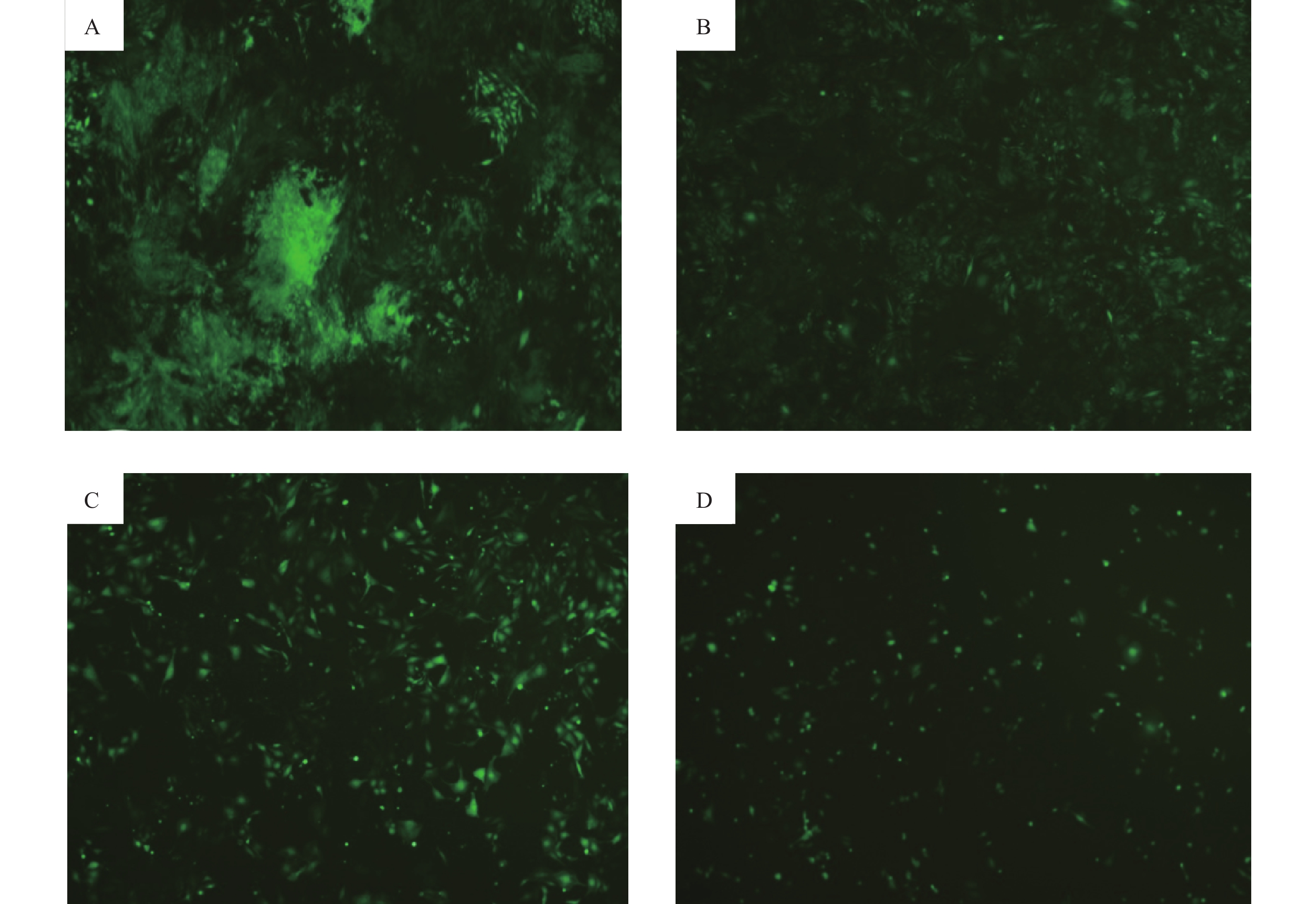
经预实验筛选得到各组的最佳MOI值, 当NC-shRNA的MOI值为100、SLC6A4-shRNA-1的MOI值为100、SLC6A4-shRNA-2的MOI值为20和 SLC6A4-shRNA-3的MOI值为50 时各组PC12细胞转染效率高且细胞状态良好,荧光显微镜下可见4组细胞GFP阳性表达,感染率约为80%以上。如图3所示,应用荧光显微镜观察重组慢病毒的GFP绿色荧光,与SLC6A4-shRNA-1和SLC6A4-shRNA-3相比,SLC6A4-shRNA-2 感染的PC12细胞较其余两组大小均匀,排列致密整齐,荧光显微镜下观察感染细胞GFP绿色荧光更为明显,细胞状态良好。
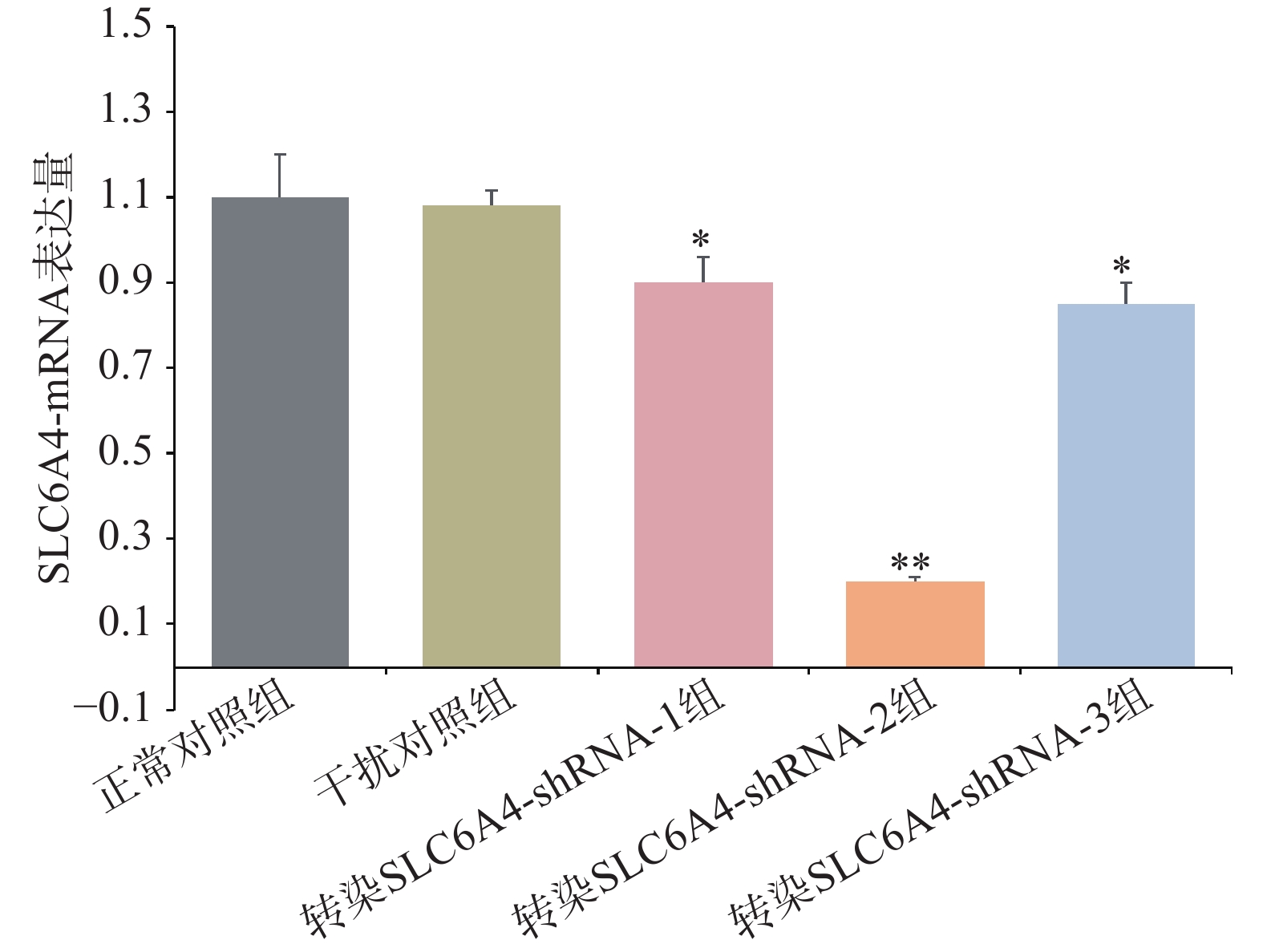
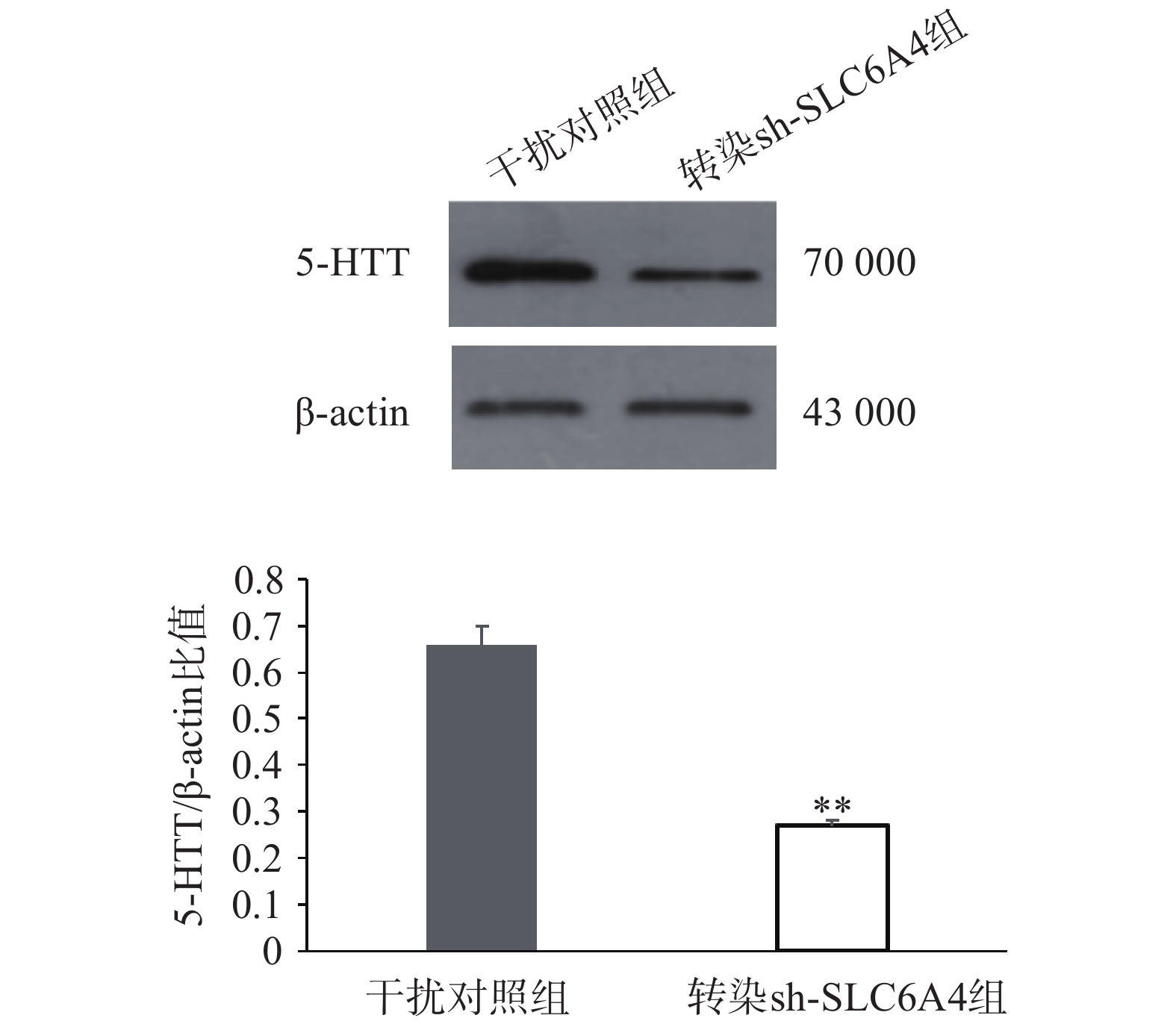
通过RT-PCR验证各组细胞SLC6A4基因表达情况,如图4所示,与正常对照组和干扰对照组比较,慢病毒转染组mRNA表达量均显著降低,其中,SLC6A4-shRNA-1转染组与SLC6A4-shRNA-3转染组SERT的mRNA表达量显著降低(P<0.05);SLC6A4-shRNA-2转染组SLC6A4的mRNA表达量极显著降低(P<0.01)。因此,SLC6A4-shRNA-2可显著干扰SLC6A4基因的表达,在3个干扰靶序列中,干扰效率最佳,在后续实验应用SLC6A4-shRNA-2进一步研究。经嘌呤霉素压力筛选,获得稳定转染细胞株后,Western blot检测目的蛋白5-HTT表达见图5,干扰组(转染SLC6A4-shRNA-2)细胞内5-HTT蛋白条带明显减弱(P<0.01),抑制率在80%以上,表明稳定转染SLC6A4-shRNA 和NC-shRNA的PC12细胞成功建立。
-
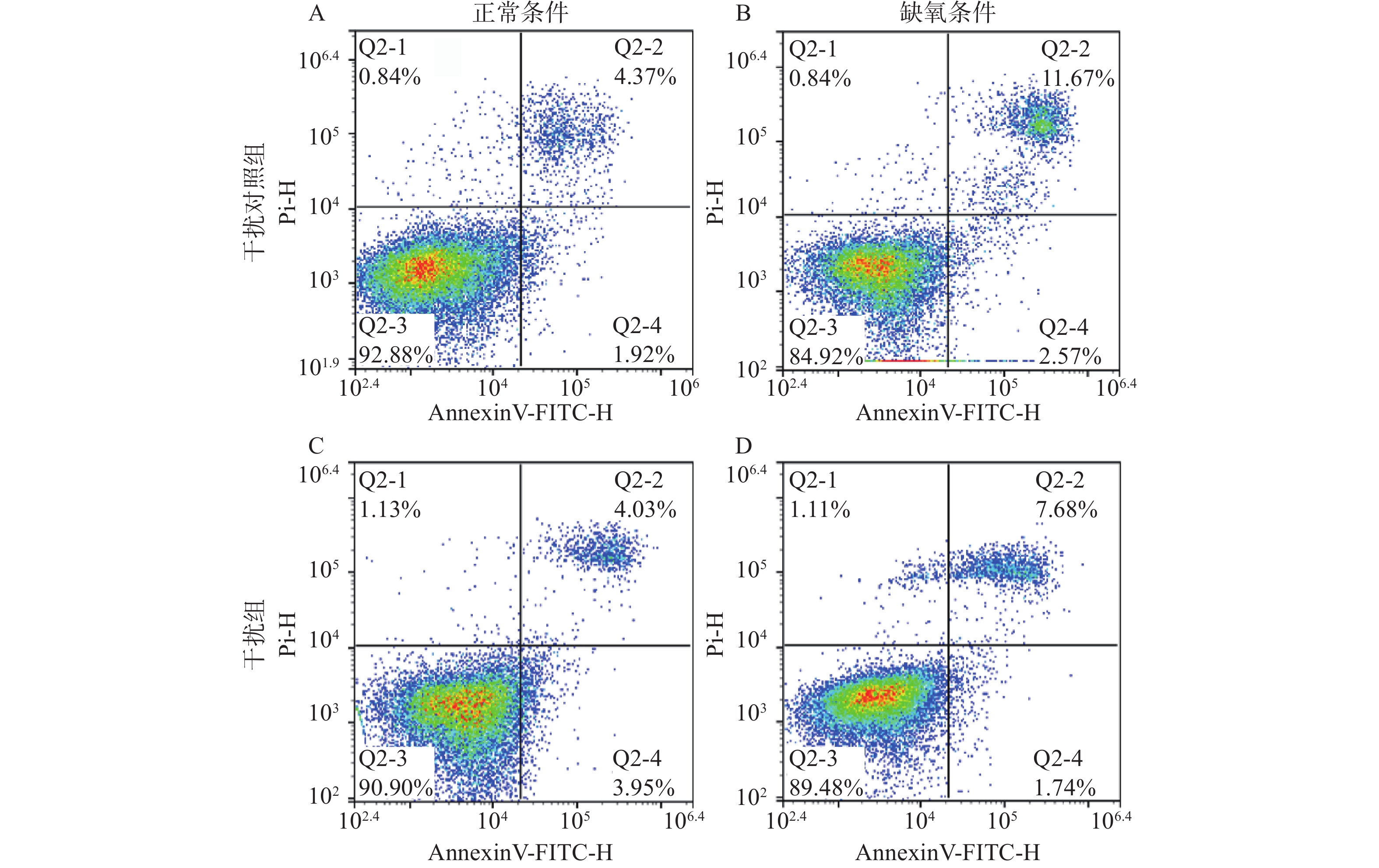
应用流式细胞仪检测SLC6A4沉默对缺氧PC12细胞凋亡的影响,结果如图6所示,干扰对照组(NC-shRNA组)细胞凋亡率(6.30±0.51)较低,缺氧24 h后细胞凋亡率(14.24±0.55)明显提高(P<0.05)。SLC6A4-shRNA组凋亡率(7.98±0.12)较PC12 细胞组无明显差异,SLC6A4-shRNA缺氧组与NC-shRNA缺氧组相比较显著下降(9.10±0.22,P<0.05)。说明正常条件下干扰SLC6A4基因对细胞凋亡无影响,缺氧后沉默SLC6A4基因的PC12细胞早期凋亡和晚期凋亡的比例均明显下降,说明干扰SLC6A4基因可以抵抗缺氧诱导的PC12细胞凋亡。
-
慢病毒载体是在HIV-1的基础上发展起来的基因载体[7],是将外源性基因导入细胞最为有效的工具之一[8-9]。本研究设计合成了3条SLC6A4的shRNA序列,分别将其连接在表达GFP和嘌呤霉素的GV248慢病毒载体上,继而包装病毒并得到了高滴度的SLC6A4 shRNA靶向干扰的慢病毒载体。将其感染PC12 细胞,应用嘌呤霉素进行筛选,成功建立了SLC6A4敲减的PC12细胞稳定转染细胞系,目的是高效沉默PC12细胞的SLC6A4基因,进而降低5-HTT的表达。之后进一步采用实时荧光定量PCR和Western blotting检测 SLC6A4 mRNA和5-HTT蛋白的相对表达量,结果提示SLC6A4 mRNA和5-HTT 的表达被有效抑制,说明其能高效沉默SLC6A4基因。
神经元细胞凋亡是缺氧导致脑组织损伤发生机制中的一个重要环节,其发生受多种促凋亡蛋白的调控,细胞凋亡过程是细胞主动死亡的过程,受到基因严格调控[10]。细胞凋亡过程的异常在亨廷顿病、阿尔兹海默症、脑卒中、抑郁症等多种神经系统疾病的生理、病理过程起到关键作用。细胞在凋亡过程中会出现一系列形态学变化,包括核固缩、核碎裂、凋亡小体形成以及DNA特征性片段化、新基因表达、某些生物大分子合成等生物化学变化等异常[11-12]。5-HTT是5-HT的专属转运蛋白,是5-HT重摄取回神经细胞进行分解代谢的专属载体,5-HT不仅介导脑的情绪的调节等多种神经生理、生化活动,而且在调节脑血管的舒缩功能及血脑屏障(BBB)的通透性和稳定神经细胞内环境等多方面均起着极其重要的作用,5-HTT表达异常与多种疾病相关,抗抑郁药氟西汀的作用靶点是5-HTT[13-14]。近年来研究发现,5-HTT与高原缺氧诱导的肺动脉高压以及高原脑水肿有一定的联系[15],课题组前期研究表明缺氧可诱导PC12凋亡而且氟西汀可逆转缺氧诱导的PC12细胞损伤[4,16],在本研究中通过构建SLC6A4慢病毒表达载体并感染PC12细胞,抑制SLC6A4的表达可以抑制缺氧诱导的PC12细胞凋亡,与5-HTT抑制剂氟西汀逆转缺氧诱导的PC12细胞损伤的结果一致,说明5-HTT可能是缺氧诱导的细胞凋亡损伤的重要调控靶点,但尚有待进一步验证确定。
综上所述,本研究通过构建慢病毒载体感染PC12细胞,敲低SLC6A4基因,建立SLC6A4基因干扰PC12细胞稳转细胞系,通过检测其对缺氧状态下细胞凋亡情况发现SLC6A4基因的沉默可以逆转细胞凋亡,为进一步探究SLC6A4基因及5-HTT蛋白的表达在缺氧致神经细胞损伤中的机制奠定了基础。
Establishment of SLC6A4 gene silencing stable cell line in PC12 cells and the effect of SLC6A4 gene silencing on apoptosis of hypoxia PC12 cells
doi: 10.12206/j.issn.2097-2024.202205093
- Received Date: 2022-05-24
- Rev Recd Date: 2022-09-06
- Available Online: 2022-09-29
- Publish Date: 2022-09-25
-
Key words:
- lentivirus /
- shRNA /
- RNA interference /
- SLC6A4 /
- apoptosis
Abstract:
| Citation: | ZHANG Dongmei, GAO Yingchun, HE Lei, CHEN Keming, LI Wenbin, WANG Rong, MA Huiping. Establishment of SLC6A4 gene silencing stable cell line in PC12 cells and the effect of SLC6A4 gene silencing on apoptosis of hypoxia PC12 cells[J]. Journal of Pharmaceutical Practice and Service, 2022, 40(5): 389-394, 463. doi: 10.12206/j.issn.2097-2024.202205093 |








 DownLoad:
DownLoad: