-
离子导入技术是一种利用低强度电流进行局部或全身给药的非侵入性给药方法,具有高效、安全、患者依从性好等特点 [1-3]。随着离子导入给药研究的不断深入,离子导入不再局限于经皮给药,经黏膜、角膜等其他组织给药的研究增多,其中离子导入辅助口腔麻醉,辅助角膜交联促进眼部药物递送等也是近年来的研究热点 [1, 4]。除了离子导入,微针、超声导入等促透技术在经皮给药领域也引起了广泛关注(表1为各种物理促透方式的比较),纳米载体、水凝胶等新剂型也是研究的热点。并且其他促透技术与离子导入的联合应用,在提高药物渗透率的同时,也减弱了离子导入电流对皮肤和黏膜的刺激性,进一步扩大了离子导入跨生物屏障给药的适用范围 [5]。本文将综述离子导入技术与水凝胶、微针和纳米载体等剂型的联合应用方面的相关研究,并对该研究领域的未来发展方向提出新的思路。
促透技术 驱动力 优点 缺点 离子导入 [5] 微电流 1、 不易造成细胞损伤
2、 大、小分子药物都可递送1、 引起皮肤刺激
2、 少见皮肤灼伤超声导入 [5-6] 治疗性频率(1~3 MHz) 、
低频(20~100 kHz)1、 增加皮肤通透性
2、 大、小分子药物都可递送1、 引起皮肤刺激
2、 少见皮肤灼伤
3、 使用时间较长微针 [7-9] 长度500~1000μm的微针机械穿透皮肤 1、 破坏角质层在皮肤表面产生微通道
2、 可实现系统性给药
3、 大、小分子药物都可递送1、 偶发过敏或炎症
2、 给药剂量有限
3、 针头可能残留于皮肤中无针注射器 [8,10] 高速液体射流 1、 穿透性较强
2、 减少针头恐惧症1、 少见表皮皱纹
2、 偶发凹陷或肥厚性疤痕 -
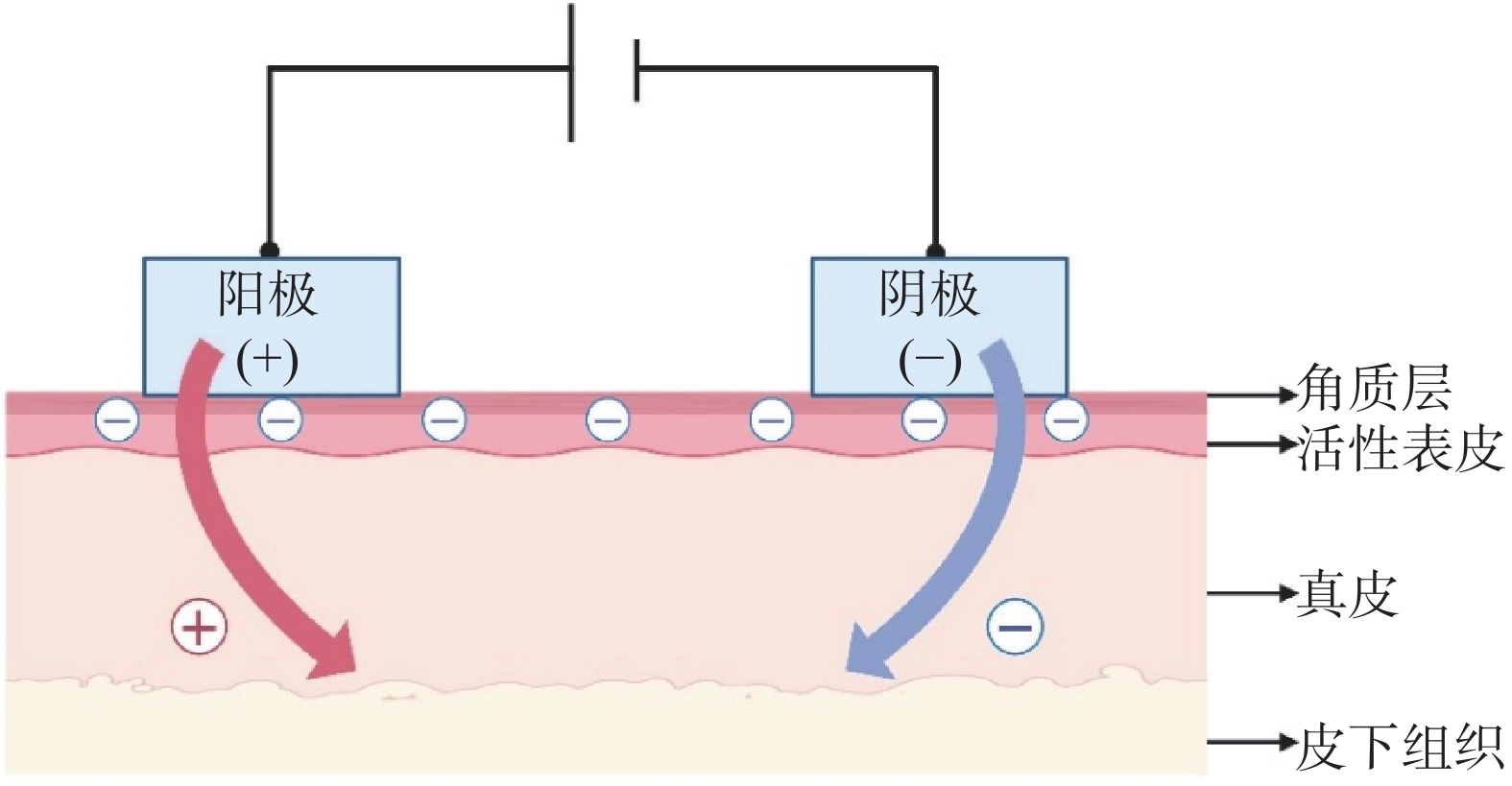
离子导入技术是一种非侵入性促透技术,通过施加低强度电流增强带电药物对组织的渗透。使用带有与药物相同电荷的电极进行给药,而与药物所带电荷相反的电极则被放置在身体的其他地方以形成闭合电路 [11]。与常见的被动给药相比,药物经离子导入可以更高效地释放到皮肤或其他靶组织中,在一定条件下,也可以避免药物的首过代谢 [12]。离子导入给药系统作用示意图如图1所示。
-
离子导入给药技术主要涉及两种物理转运机制:电迁移和电渗透 [2, 12]。电迁移是离子在电场的直接作用下穿过生物膜,其中带负电荷的药物被转移到阴极的皮肤下,而带正电荷的药物则被转移到阳极的皮肤下 [12]。电渗透则是溶剂在外加电场作用下因离子的电迁移而引起的定向运动。人体皮肤的生理等电点在4~4.5左右,因此皮肤在正常生理条件下带负电荷,在皮肤上施加电场有利于阳离子的迁移,有利于带正电荷药物的运输,也可使中性分子扩散至组织中 [5, 12-13]。此外,有研究表明离子导入可在皮肤表面激活细胞内信号通路,导致细胞间隙的开放,从而促进药物跨越皮肤屏障进行迁移。离子导入也打通了细胞间的连接并产生了快速的运输分流,使生物大分子通过细胞旁路途径穿透皮肤屏障 [5]。
-
影响离子导入给药的因素可分为药物因素、电流因素和生理因素。药物因素包括药物浓度、相对分子量、脂水分配系数、所带电荷等。一般来说,在离子导入作用下小的亲水性分子比大的亲脂性分子更易透过皮肤屏障 [12]。药物的解离度也是影响其释放的关键因素,解离度越高,离子导入作用越强 [14-15]。电流因素包括电流给予时间、电流密度和电极材料。通常情况下,药物渗透量随电流密度的增大而增加,但电流密度不宜超过生理阈值0.5 mA/cm2,电流施加时间不宜超过3 min,以免引起烧伤 [5, 14,16-17]。电极材料首选Ag/AgCl电极,因为Ag/AgCl的电极反应不涉及H+和OH−,能够抵抗皮肤pH值的变化。而惰性电极,如铂电极,使用H+和OH−作为电化学反应的来源,易导致溶液pH值的改变,还可能引起蛋白质和多肽的降解 [2]。此外,皮肤的生理因素,包括皮肤完整度、厚度、有无毛发等也会影响给药的效率 [12, 18]。其中紧密排列的上层角质层是离子导入给药的主要障碍,创伤性皮肤损伤以及影响屏障功能或皮肤水合状态的疾病(如牛皮癣)也会影响药物的渗透 [8, 12]。
-
有关离子导入给药研究的文献报道较多,主要集中在局麻药、抗炎药、化疗药、氟化物和维生素等方面 [1]。比如离子导入脸部透皮递送维生素C的临床试验 [19],以及在荷兰开展的离子导入氯胺酮治疗慢性疼痛的全国性调研等 [20]。近年来的研究更多集中在离子导入与其他物理或化学促透方法的联合应用上,相较于单独的离子导入给药,与微针、纳米载体等技术的联用在提高给药效率的同时,还能减弱给药电流从而减少对人体屏障的损害。本文主要介绍离子导入与其他促透技术联合应用的相关研究。
-
水凝胶是一种具有三维网络结构的亲水性高分子聚合物,具有良好的生物相容性与溶胀性,是理想的生物医学材料 [21]。在离子导入给药的研究中,水凝胶常作为一种药物储存库,同时也是一种导电材料 [22-23]。相较于药物溶液,水凝胶可以最大程度地减少皮肤的水合,与离子导入联合应用,在提高药物渗透效率的同时,还可以通过调整水凝胶的结构和载药方式实现药物的控制性释放 [11]。
-
由于水凝胶大多由天然大分子交联而成,具有一定的促进创面愈合功能,因此,近年来,离子导入与水凝胶联合应用于小分子药物的递送主要集中在皮肤创面的给药和黏膜给药 [24-25]。Kanaan等[24]以壳聚糖和离子液体半互穿构建了一种具有网状结构的电响应性生物材料,可用于离子导入给药。在0.56 mA/cm2的电刺激下,该生物材料的动力学释放常数和扩散系数分别是被动释放的1.5倍和2.7倍,且具有较好的止血效果,可用于促进创面愈合与离子导入贴片的制备。Guigui等 [26]证明了局部离子导入曲前列尼尔水凝胶治疗系统性硬化症指端溃疡的可行性与安全性。相较一线疗法静脉注射伊洛前列素,可避免头痛、恶心、呕吐等不良反应。
-
离子导入在小分子药物的递送方面具有显著效果,但对大分子药物以及纳米粒的递送仍然具有挑战性。通常采用增加电流强度的方法来增加药物的渗透,但也容易导致导电材料温度升高,同时伴随皮肤组织不良反应率的增加 [27]。因此开发能用于高强度电流、具有良好热稳定性的导电水凝胶是解决离子导入大分子药物局限性的方向之一。Zhao等 [23]开发了一种基于水凝胶离子回路的离子导入装置,该装置中填充了电导率高达51.31 mS/cm的饱和磷酸盐溶液作为流体通道,其外包裹聚乙二醇水凝胶,共同构建成双水相的分离系统。该水凝胶离子电路可在含水的组织环境中保持稳定,将离子电流引导至生物组织的同时不产生电化学反应,减少组织损伤。该装置可对眼部输出高达87 mA/cm2的电流且不引起不良反应,从而实现眼部大分子药物与纳米粒的有效递送。
-
微针是由多个微米级的细小针尖以阵列的方式连接在基座上形成的,针体直径一般小于300 μm,长度在500 μm到1000 μm之间。微针可以直接穿透角质层,并在皮肤真皮层中释放药物,故可以有效解决传统经皮给药中大分子药物难以透过皮肤角质层的问题 [28]。离子导入可以促进药物分子通过微针产生的低阻通道扩散,从而进一步增强亲水性药物或带电大分子药物的传输 [14]。
-
有关离子导入与微针联合应用进行小分子给药的研究较多,主要集中在一些慢性病的治疗,包括阿尔兹海默症、银屑病以及一些神经系统疾病等。近10年来文献报道的离子导入与微针联用的小分子药物研究见表2。
药物 给药电流与施加时间 微针阵列 组织/模型 研究概况 甲氨蝶呤 0.2 mA/cm2,4 h length=500 μm 新鲜冷冻人体尸体全层皮肤 离子导入加微针组合应用可显著提高给药量。与单独使用微针给药相比,两者结合减少滞后时间,提高治疗效果 [29]。 川芎嗪 0.4 mA/cm2,10 h N=36,
length=500 μmSD大鼠腹部皮肤 微针预处理2 min后,再施加微电流可协同增强川芎嗪在脑内的透皮渗透,且与冰片配伍使用后可明显缩小中脑动脉栓塞大鼠的脑梗塞体积 [30]。 盐酸多奈哌齐 0.4 mA/cm2,2 h N=10×10,
length=415 μm猪耳皮肤 微针的给药渗透量为282.23±8.28 μg /cm2,离子导入的给药渗透量为623.4±21.3 μg /cm2,两者结合高达1000±160.9 μg /cm2 [31]。 枸橼酸托法替尼 0.5 mA/cm2,4 h N=10×10,
length= 395μm新鲜冷冻人体尸体全层皮肤 被动给药的递送量为11.04±1μg/ cm2,微针给药的递送量为314.7±33.32μg/ cm2,微针与离子导入结合可达566.59 μg/ cm2,表明具有协同效应 [32]。 格隆溴铵 0.5 mA/cm2,4 h N=27×3 猪全层皮肤 相较于被动给药与微针给药,离子导入和微针的组合应用显著增加了药物的透皮渗透量,并且发现格隆溴铵对皮肤无刺激性,可用于经皮给药[33]。 琥珀酸舒马曲坦 0.5 mA/cm2,6 h 圆形阵列:S=0.7850 cm2, N= 600,length=500 μm 雌性哥廷根小型猪背部皮肤 离子导入技术可以减少角质层对带电分子运输的阻力。可溶性微针贴片在微电流的辅助下,只需近1/3的原料药就能提供与单独使用微针给药相同的给药剂量 [34]。 二甲双胍 0.2 mA/cm2,0.5 h N=10×10,
length=800 μm肥胖C57BL/6J小鼠模型 离子导入和微针联用能有效将二甲双胍输送到皮下白色脂肪组织,并诱导其褐变,改善能量代谢。与传统的口服或静注相比,此法可明显增加给药剂量 [35]。 -
小分子药物的离子导入递送大多依赖于电斥力,而随着分子量的增大,对于蛋白质和多肽等生物药物而言,则更多依赖于电渗透作用 [36-37]。而渗透作用的增强可能增加皮肤的损伤概率。微针可在皮肤上产生微米级的微通道,因此与离子导入技术的联用对于大分子药物的递送也是研究的热点 [37]。Noh等[37]开发了一种将名为Tappy Tok Tok®的新型微针与离子导入组合应用的大分子药物给药系统,并以重组人生长激素为模型药物进行考察。研究发现微针加离子导入的组合应用相较单独的离子导入给药,药物的经皮吸收增加了近6倍。Bok等[38]将透明质酸微针与超声和离子导入相结合,构建了一种多功能透皮给药系统。可溶性微针在皮肤上产生孔道并溶解,超声波和交流电场促进药物的渗透,从而有利于提高生物大分子药物的经皮递送效果。Kusama等[39]开发了一种基于离子导入的多孔性聚乳酸微针给药系统,可以通过微针产生的微孔道传输较大的分子,在微孔道中产生电渗透流,此外,其内置的酶生物电池可作为集成电源为药物透皮过程供电。Bai等[40]研究了一种将麦芽糖可溶性微针与离子导入相结合的蛋白质透皮给药系统。该装置可将离子导入给药所允许的最大分子量10~12 kDa扩大到66 kDa,在大分子生物药物的递送方面具有巨大的应用潜力。
此外,离子导入与微针的联用在糖尿病的智能给药领域也是研究的热点。在现代医学中,血糖跟踪监测和药物智能释放的集成系统是治疗糖尿病最有发展前景的方向之一。微针阵列与离子导入的组合既可以用于葡萄糖的提取监测,又可用于胰岛素的释放,可对糖尿病患者的血糖实现精准调控。Li等[41]开发了一种集微针和可穿戴电子设备于一体,可同时在线监测血糖和治疗糖尿病的全集成系统。其中介孔微针-反向离子导入葡萄糖传感器可准确监测血糖波动,微针-离子导入胰岛素递送组件可响应性的递送胰岛素来调节血糖,为改善糖尿病患者的生活质量提供了新的可能。Yang等[42]开发了一种由智能手机驱动的离子导入-微针阵列贴片,实现了渗透、扩散、离子导入的一步给药策略。通过施加不同的电流强度来调节胰岛素的给药量,从而实现高效、按需的胰岛素给药。
-
纳米载体是一种纳米级的亚微粒药物载体递送系统,包括脂质体、纳米粒、纳米乳剂等,具有一定的渗透性、滞留性和稳定性 [43]。将纳米载体与离子导入相结合进行经皮给药时,可以更好的实现药物的控制性释放,有效增加渗透量。载药的纳米颗粒可以在皮肤表面或毛囊中形成药物贮库,药物可以从贮库缓慢释放到皮肤表面或进入更深的皮肤层。离子导入电流还可促进已释放的药物透过皮肤进入体循环[44-45]。An等[22]开发了一种用于传递纳米载体的离子导入经皮给药系统,利用便携式一次性反向电渗析电池的离子交换反应为离子导入提供电能,加入导电水凝胶作为药物储存库。Hasan等[46]也发现核酸药物纳米载体可以通过离子导入直接将核酸药物输送到内脏器官,而无需通过血液循环途径。近10年来更多关于离子导入与纳米载体联用的小分子药物递送研究见表3。
药物 给药电流与
施加时间纳米载体 组织/模型 研究概况 吡罗昔康 0.6 mA/cm2,
1 h纳米醇质体 Wistar大鼠皮肤 体外透皮实验表明1 h内,游离药物和纳米醇质体的皮肤渗透率无显著性差异。添加微电流可显著促进醇质体的渗透,但对游离药物无影响 [47]。 氢化可的松 0.5 mA/cm2,
0.5 h醇质体 大鼠皮肤 游离药物和醇质体在120 min的皮肤渗透浓度为0和7.98 μg/cm2;在离子导入的影响下,两者在30 min的渗透浓度为0和19.69 μg/cm2,离子导入对游离药物的渗透无影响 [48]。 奥沙利铂 0.5 mA/cm2,
2 h壳聚糖纳米粒 猪口腔黏膜 将奥沙利铂制成壳聚糖纳米粒后,药物在口腔黏膜渗透率相较被动给药增加3倍,离子导入技术又在此基础上增加1倍 [49]。 姜黄素 0.2 mA/cm2,
20 min脂质金纳米粒 新西兰兔耳皮肤(金黄色葡萄球菌感染) 脂质金纳米粒在离子导入的作用下透过皮肤,而后在红外光照射下诱导姜黄素释放,最后利用姜黄素在蓝光照射下的杀菌作用治疗痤疮 [50]。 盐酸环丙沙星 0.42 mA/cm2,
3 h金纳米粒 猪耳皮肤 大豆油凝胶中的促透剂硬脂酸和离子导入技术联合可使凝胶中的金纳米粒在1 h内渗透猪耳皮肤,并且此设计可开发成导电纳米粒的自我透皮递送装置 [51]。 STAT3 siRNA,甲磺酸伊马替尼 0.5 mA/cm2,
2 h金纳米粒 雌性C57BL/6小鼠黑色素瘤模型 体外实验表明,相较游离药物,双药物纳米颗粒可显著降低黑素瘤细胞的存活率。动物实验中,双药物纳米颗粒的局部离子导入效果与瘤内给药相当,显著降低肿瘤体积百分比,抑制STAT3蛋白的表达 [52]。 阿霉素 0.5 mA/cm2,
6 h固体脂质纳米粒 猪耳皮肤 固体脂质纳米粒在离子导入的作用下可使56%的阿霉素穿过活性表皮层;而被动给药仅有26%的药物保留在活性表皮层。且固体脂质纳米粒使阿霉素对黑色素瘤细胞的杀伤活性增加50% [53]。 洛匹那韦 0.5 mA/cm2,
6 h脂质纳米粒 猪耳皮肤 脂质纳米粒可增加药物在皮肤上的滞留。DSC研究表明,电流可以触发洛匹那韦脂质纳米粒的多态性转变,并增加药物在脂质基质中的溶解度 [54]。 -
超声导入给药是指利用超声波能量打破皮肤屏障,使各种药物进入和穿透皮肤的方法[55-56]。超声导入的频率范围是20~16 MHz,强度可高达14 W/cm2,一般可在低频(20~100 kHz)或治疗性频率(1~3 MHz)下进行超声导入[55]。超声导入经皮给药的主要机制是超声空化打破皮肤屏障,而在超声导入打破皮肤角质层的结构之后,离子导入可以进一步促进药物渗透并提高经皮给药浓度。并且超声波可去除角质层中的脂类,导致角质层流态化,和离子导入的电渗透协同作用,增强药物的渗透性[14]。Park等[57]开发了一种联合给药装置,不仅可以单独进行离子导入或超声导入给药,也可以实现两种物理渗透技术的联用。研究发现超声导入(350kHz)与离子导入(0.2mA/cm2)同时应用时,谷胱甘肽的渗透效率是被动给药的2.4倍,且高于单独应用超声导入或离子导入给药。
-
化学渗透剂是最经典的促进经皮给药的方法之一,其原理是通过与角质层细胞间的脂质相互作用,改变其结构或角质化环境从而增强皮肤的渗透性。但由于化学渗透剂在高剂量下具有一定毒性,因此只有少数应用于市场。常见的渗透剂有氮酮、月桂醇、丙二醇和桂皮烯等 [58]。化学渗透剂与离子导入相结合可以协同增强药物的渗透性,提高经皮给药效率 [14]。Teaima等 [59]发现化学渗透剂与离子导入相结合可增强富马酸比索洛尔的透皮渗透,可作为传统口服片剂的一种替代给药方法,用于吞咽困难人群。虽然化学渗透剂与离子导入联用可促进药物的经皮渗透,但同时应注意监测此类给药方法对皮肤组织的刺激与损伤。
-
离子导入技术可用于局部或全身给药,是经皮给药、跨黏膜给药最有前景的方向之一。但是离子导入技术的推广应用仍然面临较大的挑战,主要是给药装置的设计研发以及电流引起的皮肤不良反应 [14]。相较于常规给药方式,离子导入不仅要考虑药物成本,还要考虑设备成本。而且现在大多数离子导入给药治疗都仅限于在医院进行,患者能够自行装药给药的装置仍然不成熟。因此,开发一种方便携带、操作简便、成本低廉的给药装置是将离子导入技术推向临床应用的最重要的任务之一。而针对离子导入对皮肤产生的瘙痒、刺痛、红肿等不良反应,应当避免长时间、高密度的使用,并且在研发设计时尽量减少金属电极和恒定直流电的使用,优先选择低刺激性的给药基质 [13]。此外,随着其他促透技术的发展,离子导入技术与水凝胶、微针和纳米载体等剂型的联用也具有更广阔的应用前景。未来针对多种给药方式组合应用的装置的设计开发也将进一步推动该技术的发展。
Progress on drug delivery of iontophoresis
doi: 10.12206/j.issn.2097-2024.202208008
- Received Date: 2022-08-02
- Rev Recd Date: 2023-03-15
- Publish Date: 2023-04-25
-
Key words:
- iontophoresis /
- drug delivery system /
- microneedle /
- nano-carrier
Abstract: Iontophoresis is a non-invasive physical permeation technology, which has been widely applied in transdermal and transmucosal administration. Compared with other permeation technologies, iontophoresis have the advantages of high efficacy, high patient compliance and controllable delivery dose. With the development of microneedles and nano-carrier technology, the combination of iontophoresis and other penetration promotion technologies has gradually become a research hotspot. The penetration mechanism and influencing factors of iontophoresis, and the study on the combination of iontophoresis with hydrogel, microneedles or nano-carrier were reviewed in this paper.
| Citation: | JIANG Weiwei, YANG Feng. Progress on drug delivery of iontophoresis[J]. Journal of Pharmaceutical Practice and Service, 2023, 41(4): 212-217, 233. doi: 10.12206/j.issn.2097-2024.202208008 |








 DownLoad:
DownLoad: