-
胰腺癌是一种发病隐匿且进展迅速的消化系统恶性肿瘤。胰腺癌发病与吸烟、肥胖、遗传、糖尿病和饮酒等多种危险因素相关,其首次确诊时通常已是晚期,预后极差[1]。尽管过去10年内全球癌症的生存率不断提高,但胰腺癌的发病率在不断提高的同时,其5年生存率在我国胰腺癌患者中却并未提高,仅为7%左右[2]。晚期胰腺癌的治疗主要以化疗为主,其中,FOLFIRINOX化疗方案与白蛋白结合型紫杉醇联合吉西他滨的治疗方案对胰腺癌患者的生存率有一定的提高[3]。尽管联合化疗方案对胰腺癌的治疗有一定效果,但化疗药物的毒副作用与肿瘤细胞的耐药性限制了其在胰腺癌治疗中的应用。
中医秉承整体调理与辨证论治的治疗理念,在胰腺癌的治疗方面具有独特的优势,如缓解临床症状,提高抗癌药物的临床效果,改善患者的生活质量以及延长患者的生命等[4]。研究表明,在中医治疗胰腺癌的用药规律中,白术-半夏-茯苓是最常用且置信度最高的药组。三药协同可产生健脾益气、燥湿化痰等功效[5]。中药白术是将菊科植物白术的根茎干燥后制得,具有健脾益气、除湿益燥的功效。其活性成分可以促进肿瘤细胞凋亡,抑制胰腺肿瘤细胞生长与转移,调节免疫代谢等[6]。中药半夏为天南星科植物半夏的干燥块茎,具有燥湿化痰、消痞散结的作用效果。半夏的化学成分包括生物碱类、 有机酸类、黄酮类和糖类等,具有抗肿瘤、 抗炎等药理活性[7]。中药茯苓是真菌茯苓的干燥菌核,其多糖与三萜类化合物成分可以通过增强机体免疫力、增加其他化疗药物的抗肿瘤效果以及降低其他化疗药物的毒副作用等机制发挥抗肿瘤效果[8]。尽管临床上白术-半夏-茯苓药组常用于胰腺癌的配伍治疗,但其包含的活性成分复杂,具体分子作用机制尚未系统阐述。
网络药理学可以利用药物疾病相关数据库以及生物系统分析方法来预测药物、疾病、靶点间的联系,从而了解药物成分对机体的潜在调控机制[9]。分子对接技术则利用计算机模拟配受体间的相互结合模式,通过一系列参数筛选出能相互结合的药物活性成分与靶点蛋白,从而提高药物开发与分子机制验证的成功率[10]。本研究利用网络药理学与分子对接技术分析验证白术-半夏-茯苓配伍治疗胰腺癌的潜在分子机制,以期为临床使用该药组提供理论参考依据。
-
通过中药系统药理学数据库和分析平台(Traditional Chinese Medicine Systems Pharamacology Database and Analysis Platform,TCMSP;https://www.tcmsp-e.com/)检索白术-半夏-茯苓药组的活性成分及作用靶点,并设定筛选条件:口服生物利用度(OB)≥30%,类药性(DL)≥0.18。同时通过TCMSP平台下载药组活性成分的化学结构式,保存为mol2格式文件。将格式文件上传至PharmMapper平台(http://www.lilab-ecust.cn/pharmmapper/)进行靶点预测, 预测靶点范围设置为Human Protein Targets Only (v2010,2241),其余参数为默认设置。预测结果按照“Normalized Fit Score≥0.9,z'-score>0”进行筛选。将TCMSP 平台与PharmMapper平台搜集的活性成分作用靶点合并去重后,通过UniProt数据库(https://www.uniprot.org/)对活性成分的靶点名称进行标准化规范。
-
利用GeneCards(https://www.genecards.org/)、OMIM(Online Mendelian Inheritance in Man; https://omim.org/)两个数据库,以“pancreatic cancer”为关键词进行检索, 筛选评分大于>10的GeneCards数据库内与胰腺癌相关的基因靶点数据,并与OMIM数据库的检索结果去重汇总。
-
通过Venny 2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/)制作白术-半夏-茯苓药组靶点和胰腺癌靶点的韦恩图,并通过韦恩图提取交集靶点。
-
将药物、活性成分、交集靶点相关数据导入Cytoscape 3.9.1软件构建白术-半夏-茯苓治疗胰腺癌的药物-成分-靶点网络。
-
将所获取的药组与疾病的交集靶点导入在线STRING 11.5 平台 (https://cn.string-db.org/),将物种设定为 Homo sapiens,minimum required interaction score >0.9,其余设置为默认值,获取PPI网络数据,并将其导入Cytoscape 3.9.1软件构建蛋白质-蛋白质相互作用(PPI)网络并进行分析,筛选出白术-半夏-茯苓配伍治疗胰腺癌的核心靶点。
-
将药组与胰腺癌交集靶点导入DAVID数据库 (https://david.ncifcrf.gov/),将物种选择为Homo sapiens后进行GO功能富集分析及KEGG通路富集分析,分别筛选出前10个生物过程(BP)、细胞组成(CC)、分子功能(MF)条目,前20条KEGG通路以及胰腺癌相关的靶点通路,并用作图平台(http://www.bioinformatics.com.cn/)对数据进行可视化。
-
将上述KEGG的前20条显著差异的信号通路与相应靶点导入 Cytoscape 3.9.1软件,构建白术-半夏-茯苓治疗胰腺癌的靶点-通路网络。
-
以药物-成分-靶点网络中每种中药度值排名前三的核心成分和胰腺癌相关靶点为研究对象,进行分子对接验证。具体操作如下:① 利用TCMSP数据库,Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov/),Chem3D 20.0软件和Open Babel软件得到能量最小化的活性成分pdb格式文件;② 从RCSB PDB数据库(https://www.rcsb.org/)下载网络度值较高的疾病靶点蛋白3D结构,并将其导入PyMOL软件对蛋白进行去水、去配体等操作,导出为 pdb文件;③ 运用Autodock Tools 1.5.7软件将靶点蛋白添加非极性氢后计算Gasteiger电荷,而原始配体添加非极性氢后检测扭转键,分别保存为pdbqt文件。用 Autogrid模块获得对接活性的位点,用Autodock模块进行药组核心成分与胰腺癌关键靶点的分子对接;④ 采用PyMOL软件将结合能最佳的前三结果进行可视化处理。
-
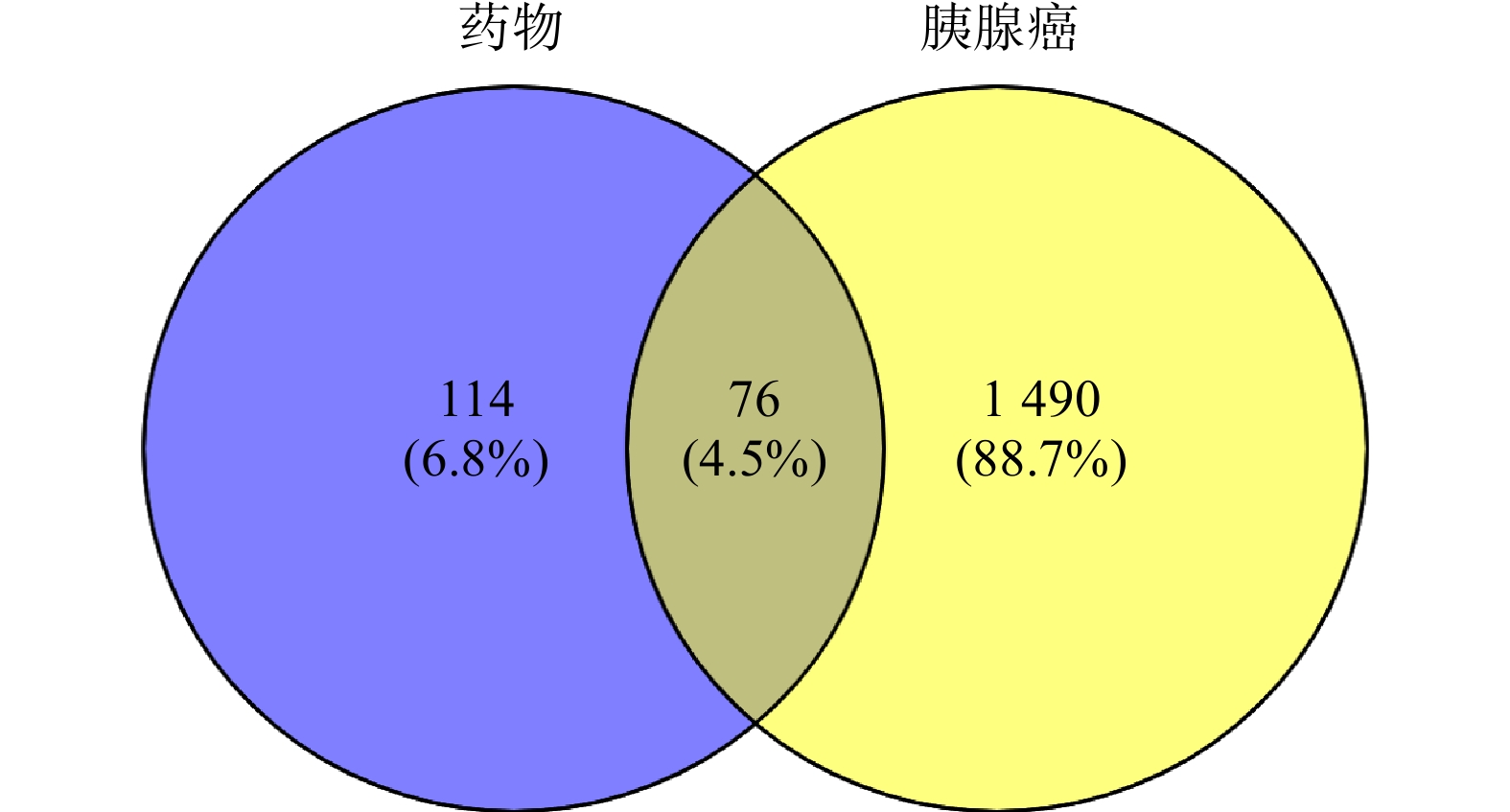
在TCMSP数据库中检索到白术55个化合物,半夏116个化合物,茯苓34个化合物。在OB≥30%,DL≥0.18的筛选条件下,共得到35 个活性成分化合物,其中,白术 7个, 半夏13个,茯苓15 个。通过 PharmMapper平台对 35个化合物的靶点进行预测,将得到的结果与TCMSP搜集的靶点汇总去重后,经 UniProt 数据库标准化后得到190个潜在作用靶点。通过检索OMIM和GeneCards数据库,筛选汇总后共获得1 566个胰腺癌相关靶点。通过绘制韦恩图,得到白术-半夏-茯苓配伍治疗胰腺癌的交集靶点共76个(图1)。
-
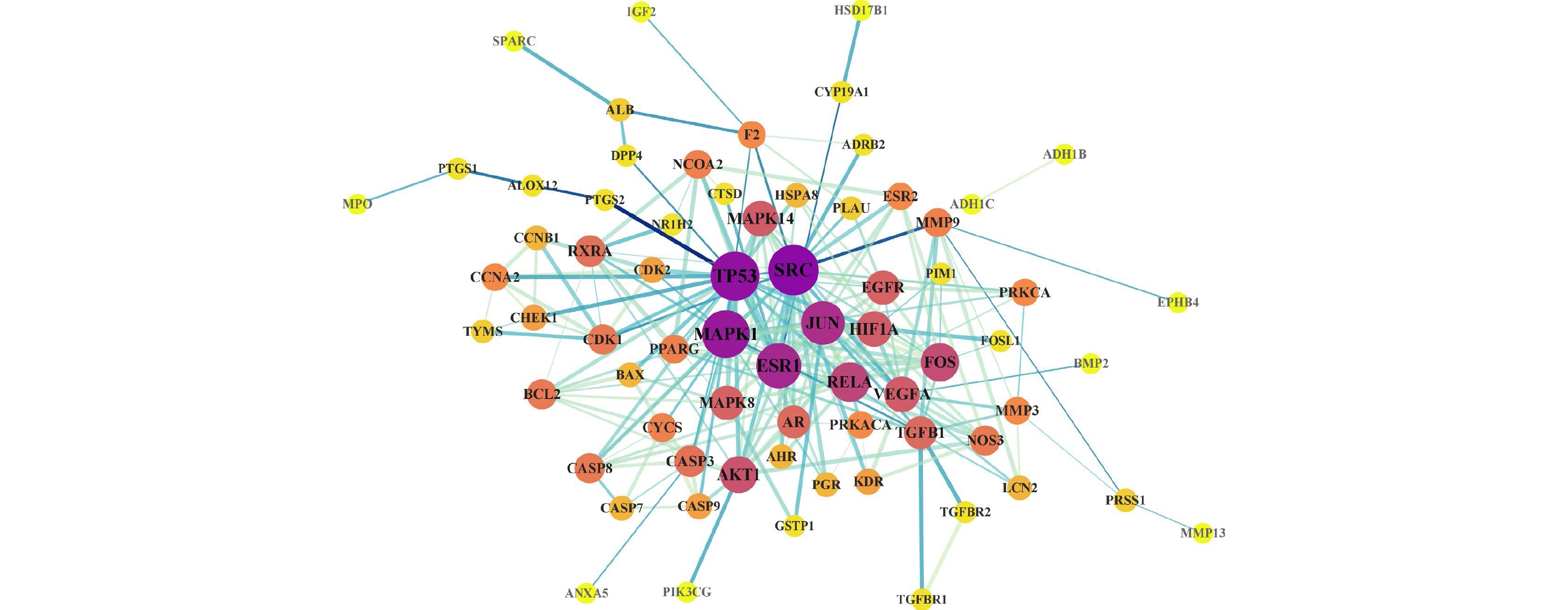
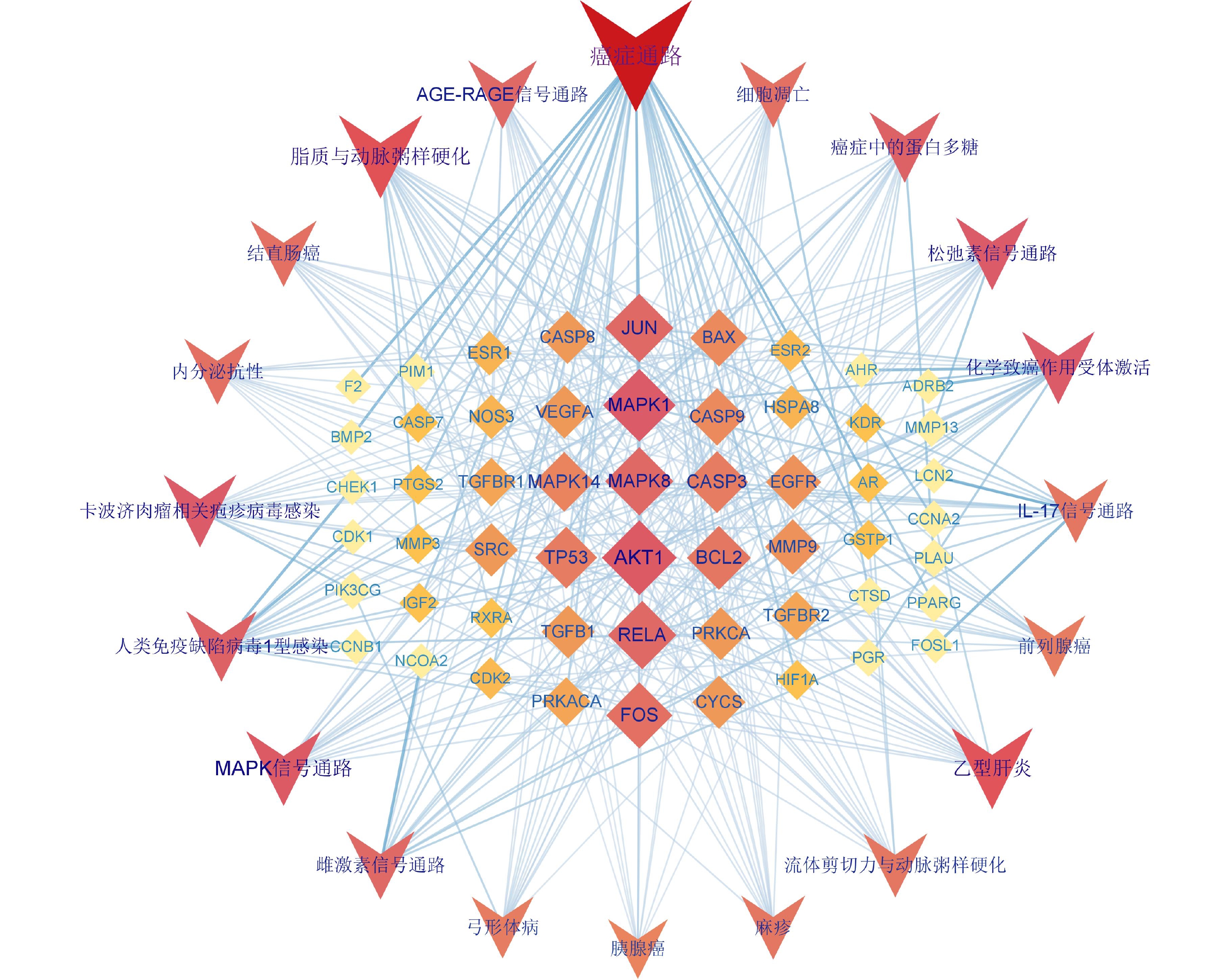
在Cytoscape 3.9.1软件中导入白术-半夏-茯苓配伍治疗胰腺癌的活性成分与交集靶点数据,构建药物-成分-交集靶点的关系网络(图2),包括114个节点(3个中药节点、35个活性成分节点、76个交集靶点节点)和516条边。其中,用拼音首字母BZ、BX、FL分别代表白术、半夏、茯苓;首字母+数字代表每种药物的活性成分。从图2 可以看出,同一活性分子可作用多个靶点,而不同活性分子可作用同一靶点,说明该药组配伍治疗胰腺癌可能是通过多成分、多基因靶点发挥作用的。在网络中,节点越大,节点相连的线条数越多,则节点的度值越大,其在网络中发挥的作用也相对越大。所有活性成分中,白术活性成分度值排名前三的是12-千里光酰基-8-反式白术三醇(12-senecioyl-2E,8E,10E-atractylentriol,度值15),14-乙酰基-12-千里光酰基-8-反式白术三醇(14-acetyl-12-senecioyl-2E,8E,10E-atractylentriol,度值15),3β-乙酰氧基苍术酮(3β-acetoxyatractylone,度值9);半夏活性成分度值排名前三的是黄芩素(baicalein,度值31),12,13-环氧-9-羟基十九碳-7,10-二烯酸(12,13-epoxy-9-hydroxynonadeca-7,10-dienoic acid,度值23),β-谷甾醇(beta-sitosterol,度值22);茯苓活性成分度值排名前三的是茯苓酸A(poricoic acid A,度值22),茯苓酸B(poricoic acid B,度值22),3β-羟基-24-亚甲基-8-羊毛甾烯-21-酸(3beta-Hydroxy-24-methylene-8-lanostene-21-oic acid,度值21)。度值排名前10的靶点分别为CA2(度值32),PIM1(度值27),ALB(度值25),MAPK1(度值21),AR(度值20),GSTP1(度值20),CASP3(度值19),PGR(度值17),BMP2(度值17),CASP7(度值15)。
-
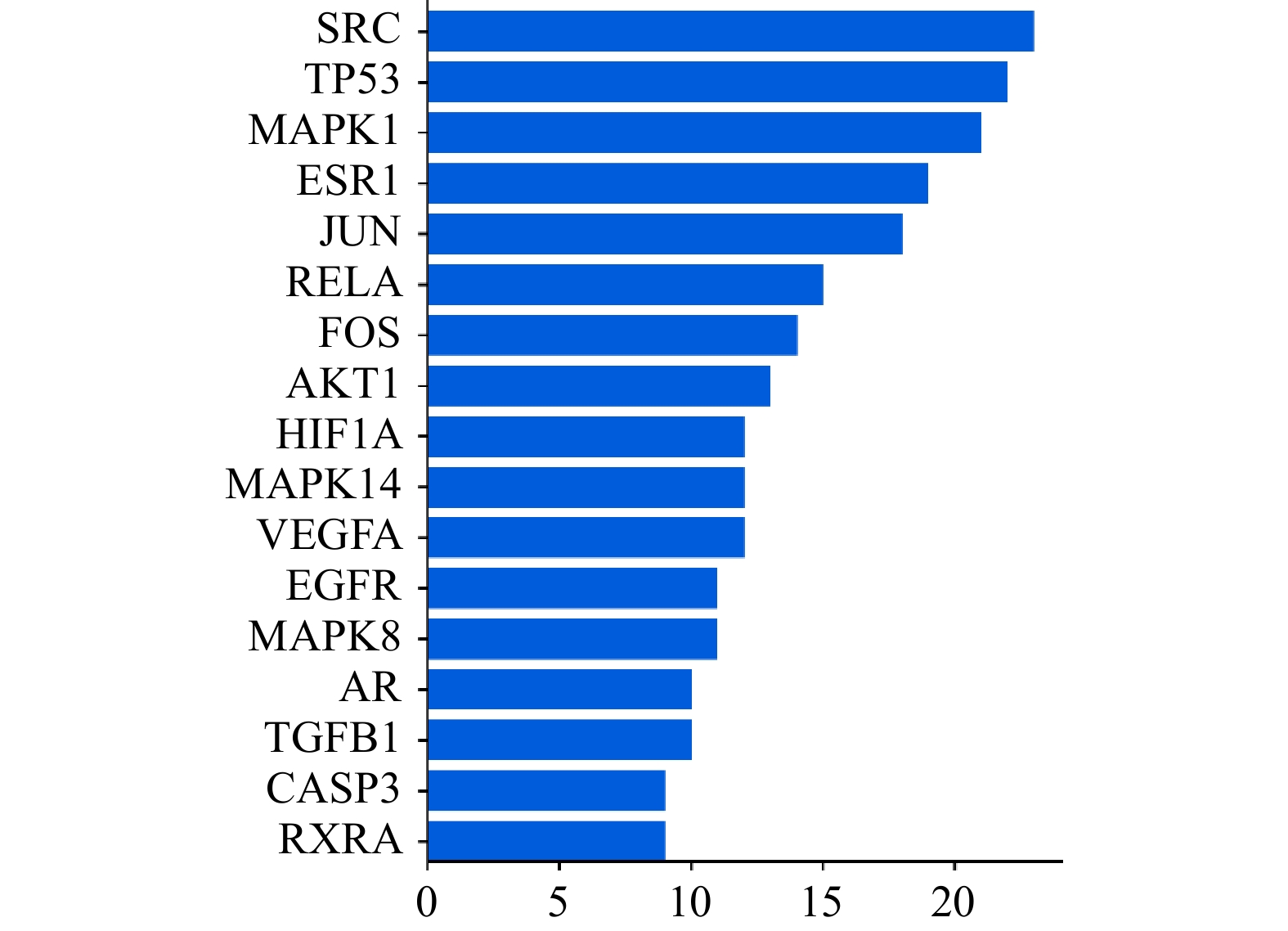
使用STRING 11.5平台对交集靶点进行分析,并将结果数据导入Cytoscape 3.9.1构建PPI网络(图3)。其中,节点颜色越深、直径越大代表它与其他靶点的相关性越大,在蛋白相互作用的网络中处于越中心的位置。对PPI网络进行拓扑分析,筛选得到网络中degree值>2倍中位数值的17个核心靶点蛋白基因(图4),degree值排名前十的靶点蛋白基因分别是SRC、TP53、MAPK1、ESR1、JUN、RELA、FOS、AKT1、HIF1A、MAPK14。在PPI网络中,靶点degree值越大,说明该靶点与其他靶点的相互作用越强。因此,上述10个靶点基因可能是白术-半夏-茯苓配伍治疗胰腺癌的核心靶点。
-
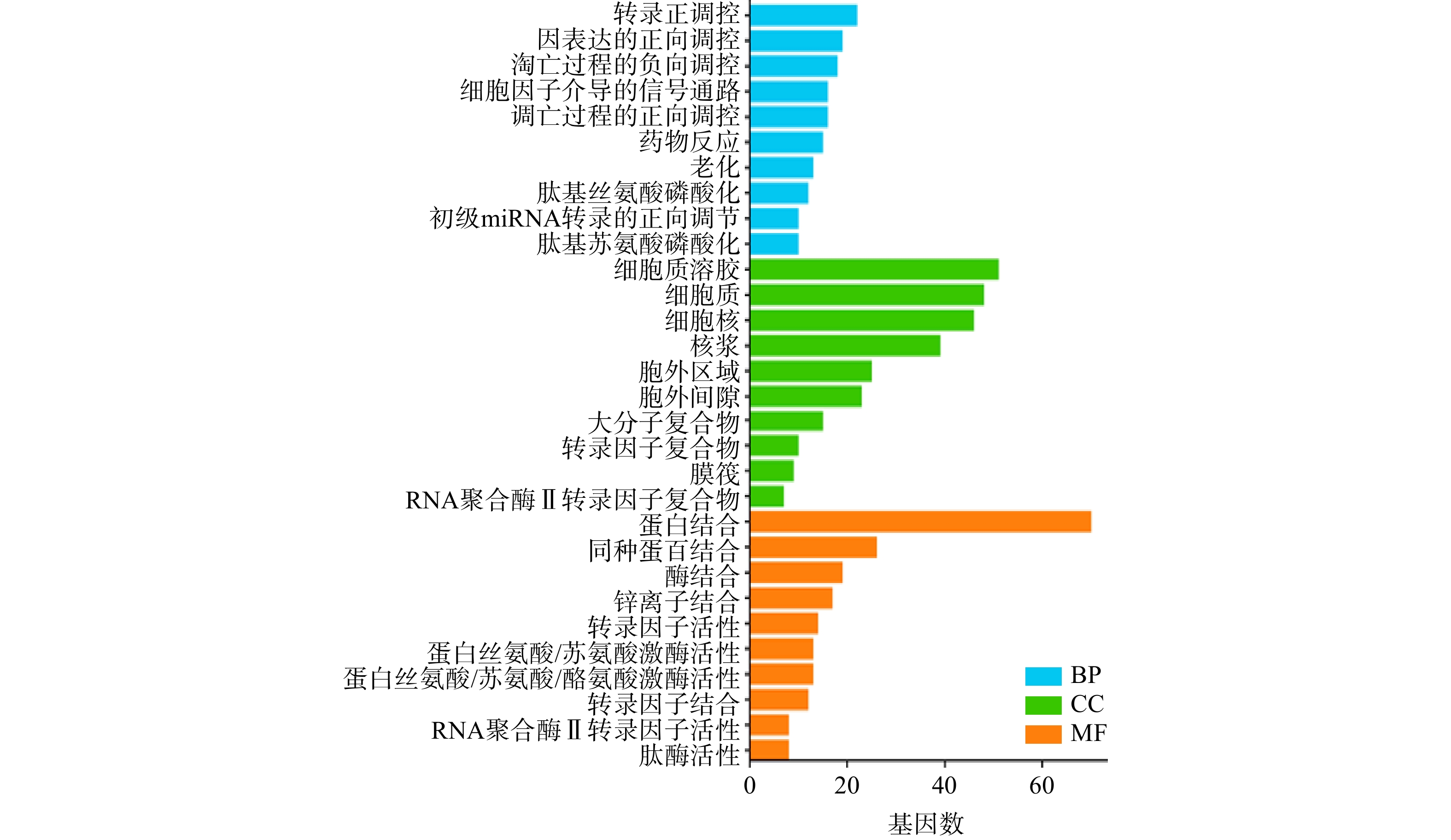
将白术-半夏-茯苓与胰腺癌的交集靶点基因导入DAVID数据库进行GO富集分析,得到P<0.05的结果共计498个。其中,包含生物过程(BP)条目373个,细胞组成(CC)条目36个,分子功能(MF)条目89个。将生物过程、细胞组成和分子功能排名前十的分析结果绘制成柱状图(图5)。
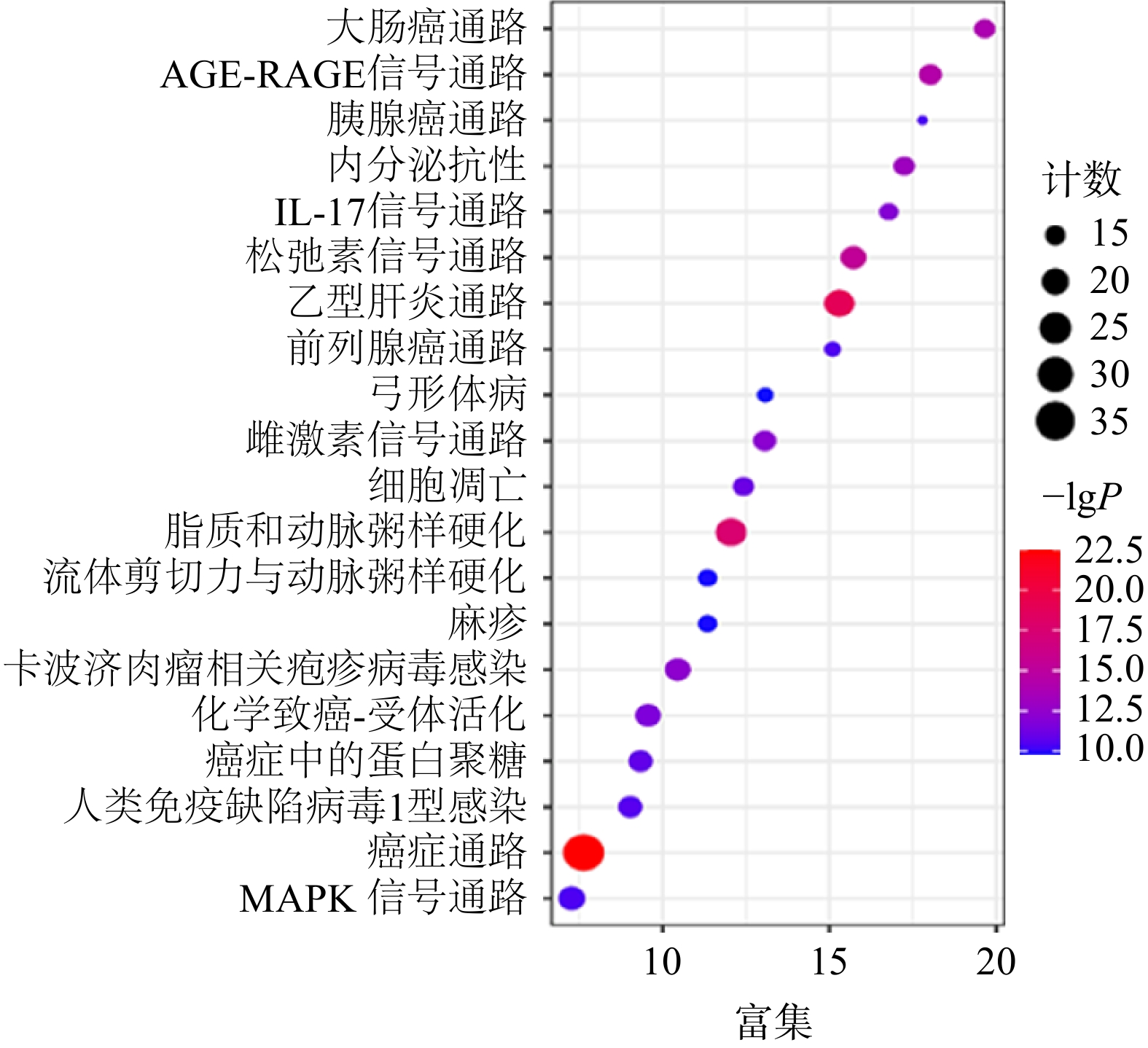
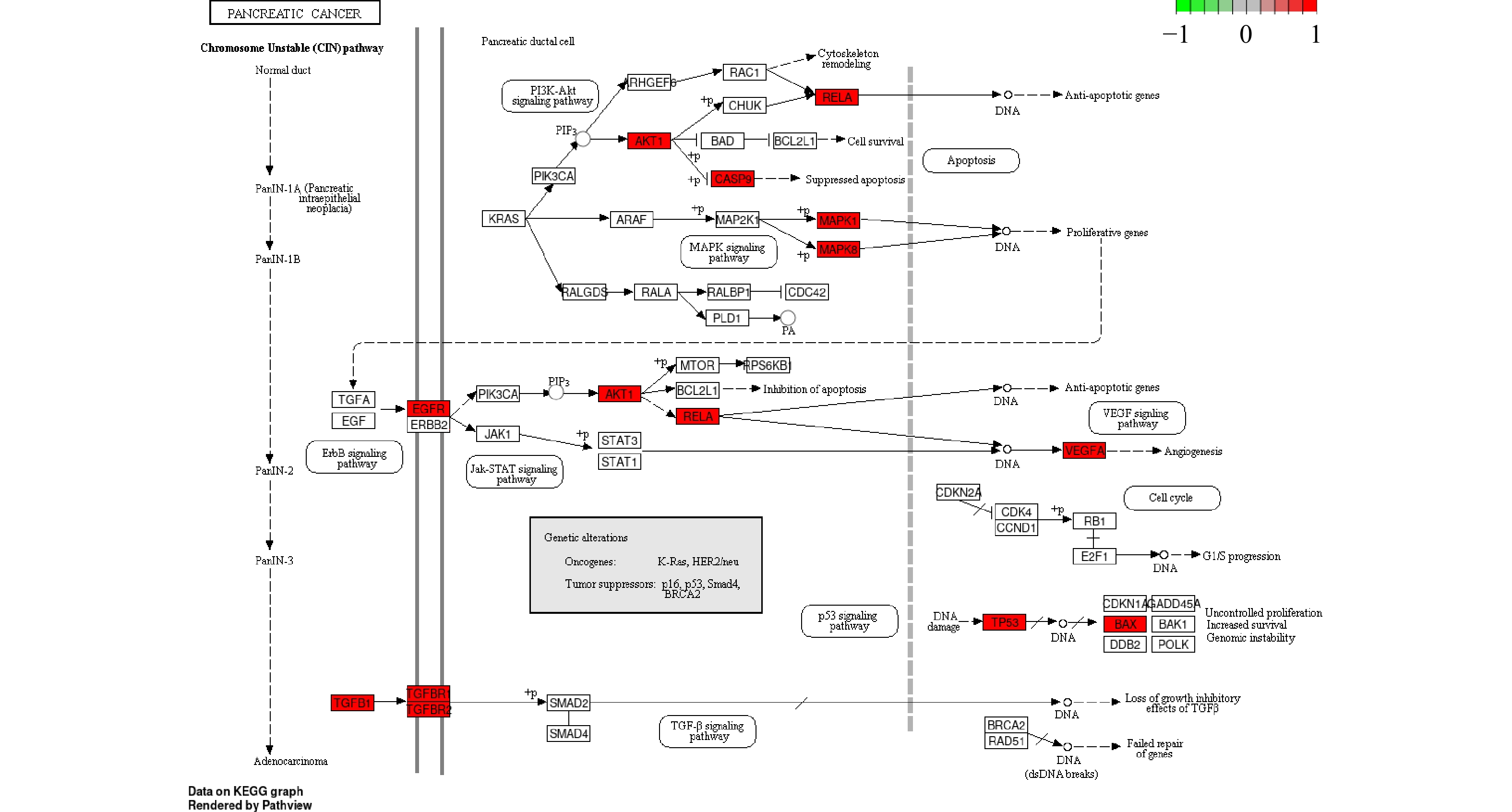
通过KEGG分析筛选出P<0.05的通路共134条,前20条通路见图6。其中,胰腺癌信号通路的潜在靶点有AKT1,MAPK1,MAPK8,RELA,TP53,CASP9,TGFB1,BAX,EGFR,TGFBR1,TGFBR2,VEGFA。通过进一步分析,白术-半夏-茯苓配伍治疗胰腺癌是通过影响KRAS下游的PI3K-Akt信号通路、MAPK信号通路、ErbB信号通路、VEGF信号通路、p53信号通路以及TGF-β信号通路发挥作用的(图7)。
-
将KEGG富集分析得到的前20条显著差异的信号通路与相应靶点导入 Cytoscape 3.9.1软件构建白术-半夏-茯苓治疗胰腺癌的靶点-通路网络(图8)。该网络中共75个节点,其中 55个菱形节点为药组治疗胰腺癌的潜在作用靶点,20个V形节点代表信号通路。度值排名前10的靶点为AKT1(度值19)、MAPK1(度值18)、MAPK8(度值16)、RELA(度值16)、JUN(度值16)、FOS(度值15)、BCL2(度值14)、TP53(度值13)、CASP3(度值13)、MAPK14(度值12)。
-
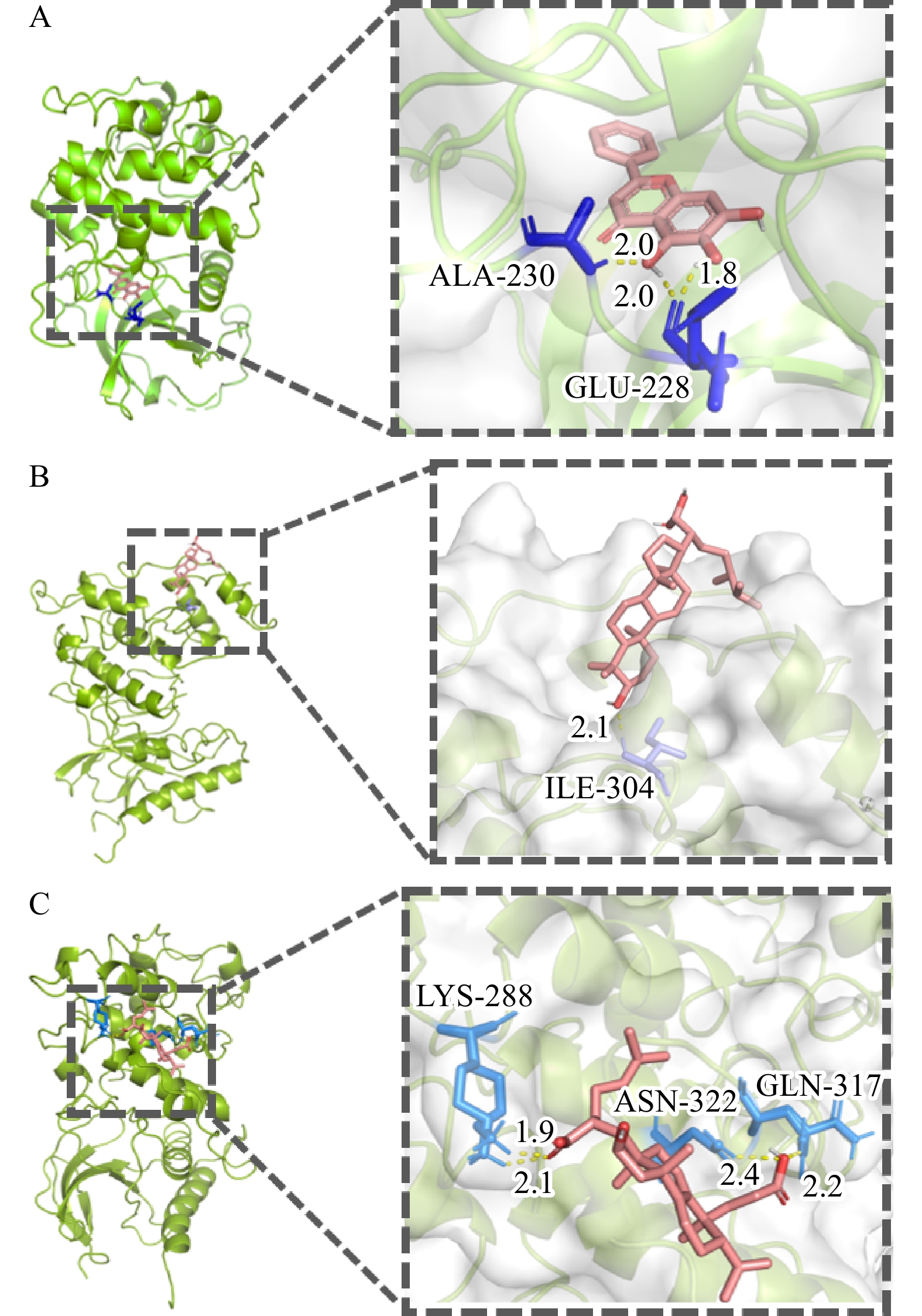
一般而言,配受体间的结合能越小,结合越稳定。结合能≤−20.93 kJ/mol,表明配受体间有较好的结合活性[11]。为了能更好地阐述白术-半夏-茯苓配伍治疗胰腺癌的可能作用机制,选取靶点-通络网络中胰腺癌通路相关的关键靶点AKT1,MAPK1,MAPK8,RELA和TP53,并筛选出与胰腺癌通路关键靶点相关的位于药物-成分-交集靶点网络图中度值排名前三的核心活性成分进行分子对接验证,结果见表1。其中,茯苓酸A与靶点AKT1,3β-羟基-24-亚甲基-8-羊毛甾烯-21-酸与靶点MAPK8,茯苓酸B与靶点MAPK8的结合能≤−20.93 kJ/mol,表明它们与靶点间有较好的结合活性。利用PyMOL软件将稳定结合排名前三的对接结果进行可视化处理(图9)。茯苓酸A与靶点AKT1的氨基酸残基ALA-230/GLU-228形成3个氢键,3β-羟基-24-亚甲基-8-羊毛甾烯-21-酸与靶点MAPK8的氨基酸残基ILE-304形成1个氢键,茯苓酸B与靶点MAPK8的氨基酸残基LYS-288/ASN-322/GLN-317形成4个氢键,这些氢键可能是配体结合到相应靶蛋白位点的主要作用力。
序号 活性分子 靶点 结合能(kJ/mol) 1 黄芩素 AKT1 −26.87 2 3β-羟基-24-亚甲基-8-羊毛甾烯-21-酸 MAPK8 −21.64 3 茯苓酸 B MAPK8 −21.39 4 黄芩素 RELA −19.46 5 黄芩素 TP53 −19.38 6 茯苓酸 A MAPK1 −19.30 7 3β-羟基-24-亚甲基-8-羊毛甾烯-21-酸 MAPK1 −18.71 8 茯苓酸 A MAPK8 −18.59 9 14-乙酰基-12-千里光酰基-8-反式白术三醇 MAPK8 −13.44 10 茯苓酸 B MAPK1 −11.13 11 12-千里光酰基-8-反式白术三醇 MAPK8 −8.58 12 12,13-环氧-9-羟基十九碳-7,10-二烯酸 MAPK1 −8.33 13 12-千里光酰基-8-反式白术三醇 MAPK1 −6.15 14 12,13-环氧-9-羟基十九碳-7,10-二烯酸 MAPK8 −3.10 -
胰腺癌是一种预后极差的消化系统恶性肿瘤。目前临床上治疗胰腺癌倡导综合姑息性手术、放化疗、分子靶向治疗等多学科疗法[12]。中医在治疗晚期胰腺癌的目标并不只是消灭肿瘤,其注重整体调理与辨证论治的治疗方式能显著提高患者的生活质量与5年生存率[13]。多数中医认为,胰腺癌总体属于正虚邪实的病证,其疾病的机制可以归纳成脾虚、肝郁、痰瘀等。中医治疗胰腺癌时注重攻补兼施,常以健脾益气的中药为主,并且用疏肝理气、利水渗湿、燥湿化痰等中药辅助。白术-半夏-茯苓三药协同施用可产生健脾化湿的功效,对相应病证的胰腺癌患者具有良好的效果[14]。
本研究通过网络药理学方法,筛选出白术-半夏-茯苓3种中药的主要活性成分共35个,包括黄芩素、β-谷甾醇、茯苓酸A、茯苓酸B、3β-乙酰氧基苍术酮等。黄芩素又称黄芩苷元,是半夏的主要活性成分之一,具有抗肿瘤、抗氧化、抗菌消炎等生理活性[15]。黄芩素能通过Hedgehog通路有效抑制胰腺癌干细胞的增殖,并通过转录机制降低抗凋亡基因Mcl-1的表达,促进线粒体细胞色素 C的释放以及激活半胱氨酸蛋白酶来诱导细胞的凋亡[16]。此外,黄芩素还可通过抑制巨噬细胞相关的炎症反应来降低肿瘤微环境的炎症, 从而抑制大鼠胰腺腺泡的导管样化生[17]。β-谷甾醇是一种植物甾醇类成分,能诱导活化淋巴细胞来提高机体免疫力并发挥靶细胞杀伤作用,进而抑制乳腺癌、胃癌、大肠癌等肿瘤细胞的生长[18]。它能抑制人胰腺癌的增殖、诱导其凋亡,抑制其迁移与侵袭,并通过 AKT/GSK-3β信号通路抑制上皮间质转化[19]。茯苓酸A是中药茯苓表层的主要三萜类化学成分,可以通过Akt/mTOR 通路温和地抑制多种癌细胞的生长。茯苓酸A通过降低mTOR 和 p70s6K 的磷酸化来调节 mTOR/p70s6k 通路,从而诱导卵巢癌细胞凋亡和自噬,极大地抑制卵巢癌细胞的增殖、迁移和侵袭[20]。茯苓酸 B能诱导巨噬细胞中NO的产生,降低炎性细胞因子,产生比茯苓酸A更高的抗炎活性[21]。白术药用成分挥发油的主要成分是苍术酮。MTT 法检测发现,它能对肝癌细胞、肺癌细胞、乳腺癌细胞及结肠癌细胞均产生不同程度的抑制活性[22]。
本研究中, 通过STRING数据库获取了白术-半夏-茯苓配伍治疗胰腺癌潜在作用靶点蛋白相互关系的数据,构建 PPI 网络后分析数据得到degree值排名前十的核心靶点蛋白,分别是SRC、TP53、MAPK1、ESR1、JUN、RELA、FOS、AKT1、HIF1A、MAPK14。SRC基因编码人原癌基因酪氨酸蛋白激酶Src。Src作为一种非受体细胞质酪氨酸激酶参与多种细胞活动,如细胞分化、增殖、黏附和迁移等。Src活性增加可促进癌细胞的过度增殖、迁移、侵袭和上皮间质转化。SRC基因过表达与激活促进了胰腺癌细胞的转移,而对胰腺癌应用酪氨酸蛋白激酶Src 抑制剂能产生一定的临床治疗效果[23]。TP53 是一种肿瘤抑制基因,编码一种在细胞中具有调节活性的抑癌蛋白。TP53在75%的胰腺癌中发生突变,而这种突变会促进肿瘤细胞的生长和远处转移[24]。MAPK1与MAPK14是MAPK家族的成员,它们编码的蛋白激酶1主要调节各种细胞活动,如细胞增殖、分化、侵袭和转移。胰腺癌中存在 MAPK通路的异常激活,而这与胰腺癌的远处转移密切相关[25]。ESR1编码的人雌激素受体是类固醇核受体超家族的成员,作为转录因子发挥作用,在促进各种癌症的生长过程中起关键作用。它在胰腺癌细胞中表现出增强的转录活性,从而促进胰腺癌细胞的增殖和迁移[26]。JUN基因编码的转录因子Jun是JNK信号通路的下游靶标,其与87%胰腺肿瘤的进展相关[27]。RELA 基因编码的蛋白是经典的核因子-κB通路的信号转导因子,其与胰腺癌的发生发展相关。相比于正常小鼠,RELA 敲除小鼠在胰腺癌前病变过程中出现了更多的 DNA 损伤,而这种损伤会促进胰腺癌的进展[28]。FOS基因编码的蛋白c-Fos是激活蛋白复合物的成员,它是其他癌基因的重要效应物,参与细胞增殖、迁移、细胞凋亡等过程的调节。致癌因子c-Fos的异常表达会促进胰腺癌的进展,并与其预后相关[29]。AKT1 基因编码一种丝氨酸/苏氨酸蛋白激酶。活化的Akt激酶可磷酸化多种蛋白底物,引起胰腺肿瘤的发生与转移。Akt激酶抑制剂与吉西他滨联用可以显著抑制胰腺癌细胞的转移,诱导癌细胞凋亡[30]。HIF1A基因编码的缺氧诱导因子1α是一种机体对低氧应答的核蛋白,参与血管形成,能量代谢,细胞凋亡等生物学过程。胰腺导管腺癌基质中缺乏血管与氧气,导致缺氧诱导因子1α的上调,从而促进癌细胞在低氧环境中存活。缺氧诱导因子1α可通过抑制蛋白磷酸酶1调节因子亚基1B的表达以及p53 蛋白的降解来发挥肿瘤抑制作用。胰腺癌细胞中HIF1A 基因缺失将增加肿瘤细胞的侵袭性和转移活性[31]。
GO与KEGG 富集分析显示,白术、半夏和茯苓主要通过参与基因表达的调控,细胞因子介导的信号通路,蛋白质的磷酸化以及细胞凋亡等生物过程,从多方面影响胰腺癌的进展。通过对作用机制的进一步研究,白术-半夏-茯苓通过影响KRAS下游的PI3K-Akt信号通路、MAPK信号通路、ErbB信号通路、VEGF信号通路以及p53信号通路发挥治疗胰腺癌作用。PI3K-Akt信号通路是KRAS下游的重要信号通路,能调节肿瘤细胞的增殖与凋亡。研究表明,通过下调 PI3K/Akt 信号通路可抑制胰腺癌细胞 [32]。MAPK信号通路在胰腺癌的多种信号传递过程中起关键作用,参与调控基因的表达、细胞的增殖与凋亡。MAPK信号通路主要包括细胞外信号调节蛋白激酶(ERK)、p38丝裂原活化蛋白激酶(p38 MARK)和c-Jun氨基末端激酶(JNK)。其中,ERK主要调节细胞的生长与分化,而p38 MAPK与JNK信号通路在调节机体炎症和细胞凋亡等方面发挥作用[33]。ErbB 信号通路在多种类型的实体瘤中表现出异常的信号转导,包括胰腺癌、乳腺癌、膀胱癌和直肠癌等。ErbB信号通路不仅参与细胞增殖,还能调节肿瘤进展的其他活动,如细胞运动、黏附、血管生成以及免疫抑制等。ErbB 信号通路的EGF 受体过表达或活性失调通常与癌症的恶性程度和预后不良有关[34]。VEGF信号通路是通过血管内皮生长因子(vVEGF)与相应受体结合来激活酪氨酸激酶介导的信号网络来发挥其血管生成功能。胰腺癌组织中,VEGF信号通路异常激活,导致胰腺癌基质血管的异常增生,这与肿瘤的转移和进展有密切联系[35]。p53肿瘤抑制信号通路通过控制有丝分裂,脂肪酸的β氧化、葡萄糖与氨基酸代谢等致癌信号来抑制肿瘤的生长。在胰腺癌中,p53信号通路功能的缺失普遍存在。p53 基因的错义突变或截短突变导致信号通路的异常,以致于机体缺失促进细胞凋亡、触发DNA 损伤反应以及维持细胞极性等反应,促进了胰腺癌的发生与发展[36]。TGF-β信号通路由多种功能性细胞因子,受体以及信号转导分子构成,能调节基因的表达,影响细胞的增殖、黏附、转移以及凋亡等过程。它在癌症发生发展过程中起到双重作用。在癌症形成早期,TGF-β 信号通路通过启动细胞停滞与凋亡程序来抑制肿瘤的生长;在癌症发展中晚期,它对癌细胞的抑制作用会降低,反而成为癌细胞生长的助力[37]。
为了进一步验证白术-半夏-茯苓配伍治疗胰腺癌的作用机制,采用分子对接技术对核心活性成分与关键靶点蛋白进行分子对接。对接结果显示,茯苓酸A与靶点AKT1,3β-羟基-24-亚甲基-8-羊毛甾烯-21-酸与靶点MAPK8,茯苓酸B与靶点MAPK8有较好的结合活性。因此,白术-半夏-茯苓可能主要通过KRAS下游的PI3K-Akt信号通路与MAPK信号通路发挥胰腺癌的治疗作用。
综上所述,本文通过网络药理学方法对白术-半夏-茯苓配伍治疗胰腺癌的作用机制进行分析,发现白术-半夏-茯苓通过多靶点、多通路对胰腺癌进行调控,为阐述白术-半夏-茯苓配伍治疗胰腺癌的作用机制提供了初步的理论依据,但后续仍然需要进一步基础与临床实验来验证白术-半夏-茯苓配伍治疗胰腺癌的作用机制与效果。
Research on the mechanism of Atractylodes-Pinellia-Poria in the treatment of pancreatic cancer based on network pharmacology and molecular docking
doi: 10.12206/j.issn.2097-2024.202306022
- Received Date: 2023-06-12
- Rev Recd Date: 2023-09-21
- Available Online: 2023-10-23
- Publish Date: 2023-10-25
-
Key words:
- network pharmacology /
- molecular docking /
- Atractylodes-Pinellia-Poria /
- pancreatic cancer
Abstract:
| Citation: | WANG Jirong, SHI Xiaofei, CHONG Yuhui, JIA Lingru, WAN Xueying, LI Ruimin. Research on the mechanism of Atractylodes-Pinellia-Poria in the treatment of pancreatic cancer based on network pharmacology and molecular docking[J]. Journal of Pharmaceutical Practice and Service, 2023, 41(10): 616-624. doi: 10.12206/j.issn.2097-2024.202306022 |









 DownLoad:
DownLoad: