-
脑胶质瘤是最常见的原发性脑肿瘤类型之一,占所有原发性脑肿瘤的近30%,所有恶性脑肿瘤的80%,中位生存时间约为12.5~15.0个月,手术切除、放疗、烷化剂化疗或靶向治疗是脑胶质瘤治疗主要手段[1-2]。尽管近年来脑胶质瘤的生物学研究取得了很多进展,但并没有显著改善患者的治疗效果[3]。目前,多数研究采用传统的细胞模型、肿瘤球体模型、以啮齿类动物为代表的体内模型评估药物的有效性,但这些模型不能真实预测药物在临床治疗的疗效,候选药物在Ⅰ期临床试验中的成功概率仅为3.4%,由于有效性不足和安全性差,最终阶段的失败率为54%[4]。因此,迫切需要能够真实反映人类脑胶质瘤疾病特征、微环境及其对治疗药物的反应等特点的临床前模型。
微流控芯片技术能实现在特定形状的通道中精确操纵各种流体和化学参数,例如,营养物质、流速、压力、氧气和pH值,提供可控的培养条件,从而仿真模拟人体组织和器官的微观结构和功能特征[5],在脑胶质瘤相关研究如循环分离肿瘤细胞、药物筛选、胶质母细胞瘤进展和细胞定位、模拟肿瘤与血流、缺氧和血管生成之间的相互作用等具有广泛的应用[6]。笔者应用脑胶质瘤细胞构建了一种模拟肿瘤微环境的脑胶质瘤微流控芯片模型,用两种抗肿瘤药物进行药效验证和模型评价,并进一步探究中药半枝莲提取液抗脑胶质瘤的疗效,以期为寻找治疗脑胶质瘤中药及其活性成分筛选提供技术支撑。
-
SC-1B匀胶机、BP-2B型烘胶台(北京创世威纳科技有限公司);JKG-2A光刻机(上海学泽光学机械有限公司);ZWF-334多功能摇床(上海智诚);PDC-32G-2型等离子清洗机(美国Harrick公司);Harris Uni-Corel 15072型打孔器(美国Harris公司);Synergy 4多功能酶标仪(美国Bio-TEK公司);Olympus IX-71倒置显微镜(日本OLYMPUS公司);XW-80A型涡旋混悬仪(上海医大仪器厂);milli-q advantage超纯水系统(美国Millipore公司);无菌注射器(江苏恒康公司);Harvard蠕动泵p-70(美国Harvard仪器公司);十万分之一电子分析天平(日本A&D公司);超低温冰箱(−80℃)、生物安全柜、CO2细胞培养箱、离心机(美国Thermo Fisher公司)。
-
替莫唑胺(TMZ,批号:131966,上海陶素生化科技有限公司);多西他赛(DOC,批号:S0904AS,大连美仑生物有限公司);半枝莲(批号:2021031203,上海雷允上有限公司),经海军军医大学药学系蒋益萍副教授鉴定为唇形科植物半枝莲Scutellaria barbata D.Don的干燥全草;DMEM高糖培养基(南京森贝伽生物技术有限公司);磷酸盐缓冲液(PBS,武汉塞维尔生物科技有限公司);胎牛血清(FBS,加拿大Multi Cell公司);青霉素-链霉素溶液、0.25 %胰蛋白酶(美国Gibco公司);T25培养瓶(美国Corning公司);96孔培养板、10 cm细胞培养皿(上海秦尼实业有限公司);SU-8 2075光刻胶(美国Microchem公司);硅单面抛光片和显影液(苏州汶颢芯片科技有限公司);聚二甲基硅氧烷(PDMS)预聚体和固化剂(美国Dow Corning公司);10×多聚赖氨酸(北京索莱宝科技有限公司);Calcein-AM/PI染色试剂盒(东仁化学科技有限公司);DAPI染色液、线粒体膜电位检测试剂盒(JC-1)、Tween-20溶液(碧云天生物技术公司);基质胶(美国R&D Systems公司);缺氧诱导因子-1α(HIF-1α)、抗兔IgG(H+L)(英国Abcam公司);75%乙醇(国药集团化学试剂有限公司)。
-
人神经胶质细胞瘤细胞(U251)购自于美国ATCC公司细胞库,用含有10% FBS和1%青霉素-链霉素溶液的DMEM高糖培养基培养,置于37℃、5%CO2培养箱中培养,取对数生长期的细胞用于后续实验。
-
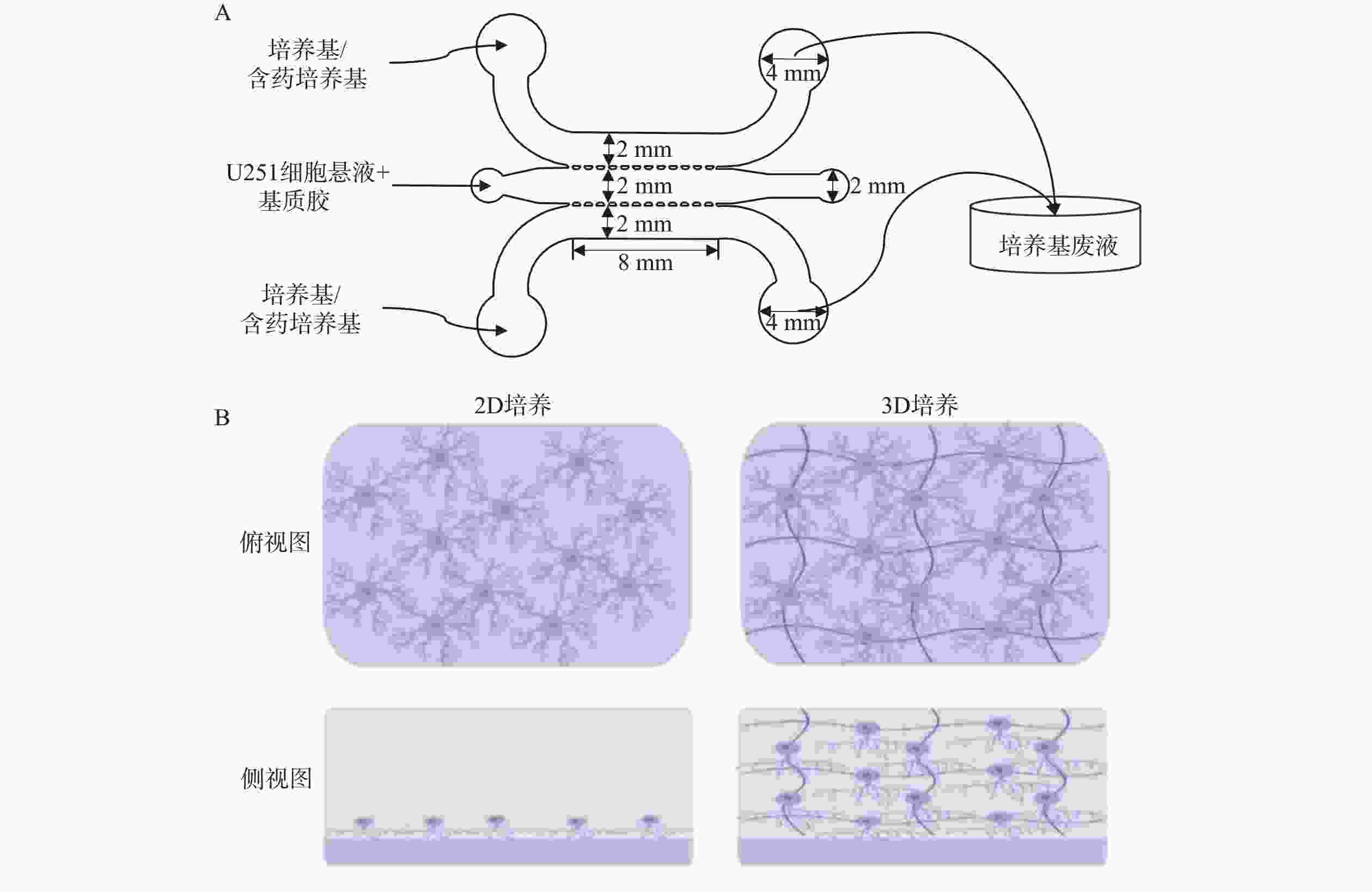
使用Auto CAD软件设计、标准光刻法制作了3个并列平行微流控通道结构的U251微流控芯片模型,各通道间由微梯形柱结构隔开,中间通道为脑胶质细胞瘤通道,两侧为培养基或含药物培养基通道,如图1A所示。将密度为2×107 cells/ml的U251细胞混悬液加入脑胶质瘤通道中,两侧通道加入培养基或含药培养基,构成2D培养的脑胶质瘤模型;3D培养的脑胶质瘤模型则与等体积的基质胶(4℃)进行混合后,迅速将混合液加入脑胶质瘤通道中,并将芯片置于培养箱中孵育30 min后,分别取20 μl预热后的培养基加入两侧的微通道中。24 h后模型内2D和3D培养的细胞状态如图1B所示,模型内2D培养的细胞在芯片通道的底部贴壁生长,而3D培养的细胞则嵌在3D基质中不规则地生长。
-
采用Calcein AM/PI染色试剂盒评价芯片模型内细胞的活力。首先,向介质通道中加入PBS溶液,洗涤3次,每次持续5 min,以去除模型内潜在的干扰物质。在避光条件下,按照1 000∶2∶3(V/V/V)的比例将PBS、Calcein-AM和PI混合,制备成Calcein AM/PI染色工作液。取20 μl的染色工作液加入通道内,将芯片放入温度为37℃的恒温箱中,孵育2 h。孵育结束后,使用PBS溶液轻柔冲洗通道,去除未与细胞结合的染色剂,重复3次,每次持续5 min。将处理好的芯片放置在荧光显微镜下进行观察并拍照记录(在490 nm的激发波长下观察呈现绿色荧光的活细胞,545 nm的激发波长下观察呈现红色荧光的死细胞)。
-
室温下用PBS轻柔冲洗芯片模型内的细胞5 min,重复3次;加入4%的多聚甲醛固定细胞,静置10 min。用PBS轻柔冲洗通道内的多聚甲醛5 min,重复3次;使用0.1% Triton X-100对细胞通透处理5 min,PBS洗涤细胞3次,每次5 min。室温下用5%牛血清白蛋白(BSA)封闭细胞内非特异性结构1 h,使用重组HIF-1α抗体(1∶500)4℃孵育过夜,孵育完成后,使用PBS去除芯片模型内残留一抗。采用含Alexa Fluor 488荧光基团的二抗(稀释比1∶1 000)室温避光孵育1 h,用PBS冲洗残留的二抗后,加入DAPI避光孵育3 min,再用PBS冲洗通道3次,置于荧光显微镜观察并拍照记录。
-
分别取适量阳性药储备液,使用完全培养基分别稀释成浓度为2.5、5、10、20 μmol/L的DOC工作液和100、200、300、400 μmol/L的TMZ工作液。在芯片两侧培养基通道中分别加入20 μl药物工作液,24 h后采用Calcein AM/PI染色试剂盒评价阳性药在2D培养和3D培养条件下对芯片内细胞活力的影响,具体步骤详见“2.3”项。
-
采用线粒体膜电位检测试剂盒考察不同浓度的阳性药物对芯片模型内细胞凋亡的影响。取20 μl的PBS加入培养基微通道,轻柔洗涤3次,每次间隔5 min。在避光条件下,将超纯水、JC-1、JC-1染色液以160∶1∶40(V/V/V)的比例配制JC-1染色工作液。向介质通道侧加入20 μl染色工作液,将芯片放入细胞培养箱中,孵育2 h。孵育结束后,使用PBS溶液冲洗通道,去除未结合的JC-1染料,重复3次,每次间隔5 min。将芯片放置在荧光显微镜下进行观察并拍照记录,在490 nm的激发波长下,可以观察到JC-1单体的荧光信号;525 nm的激发波长下,可以观察到JC-1聚合物的荧光信号。
-
精密称取半枝莲药材细粉25 g(过5号筛),将其置于500 ml 75%乙醇中浸泡30 min,90℃加热回流2次,分别提取2 h和1 h。合并2次的提取液,减压浓缩,使用50%乙醇将浓缩液转移至50 ml的容量瓶中,定容至刻度,即得浓度为500 mg/ml(药材质量/ml)的提取物浓缩液,备用。
-
取200 μl过滤后的半枝莲提取浓缩液(500 mg/ml),加入DMEM完全培养基,混匀得10 mg/ml含药培养基溶液,依次稀释得8、6、4、2、1、0.5、0.25 mg/ml含药培养基溶液。
将细胞悬液按5 000个/孔接种到96孔板中,空白组不加细胞,置于培养箱孵育24 h,弃去各孔中的旧培养基,实验组各孔中分别加入含有不同浓度的半枝莲溶液0.25、0.5、1、2、4、6、8 mg/ml,每孔100 μl;对照组各孔中均只加入细胞培养液,每孔100 μl,每个组5个平行。培养箱孵育24 h后,向各组每孔中加入10 μl的CCK-8试剂,于培养箱中避光孵育1 h,酶标仪检测450 nm波长处各孔的A值。
-
模型内细胞活力评价:采用“2.7.2”项下毒性实验得到的浓度,模型内加入2 mg/ml半枝莲提取液培养24 h后,采用Calcein AM/PI染色试剂盒考察2D培养和3D培养条件下半枝莲提取液对模型内细胞活力的影响,实验步骤详见“2.3”项。
模型内细胞凋亡评价:模型内加入2 mg/ml半枝莲提取液培养24 h后,采用线粒体膜电位检测试剂盒考察2D培养和3D培养条件下半枝莲提取液对模型内细胞凋亡的影响,实验步骤详见“2.6”项。
-
采用Image J软件计算荧光强度,GraphPad Prism 8软件进行统计学分析,组间比较采用单因素方差分析,当P<0.05时,表示差异具有统计学意义。
-
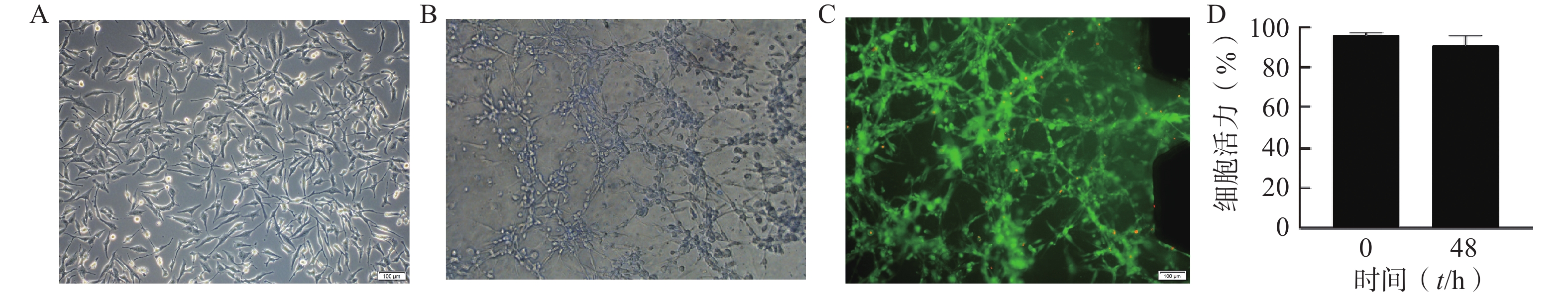
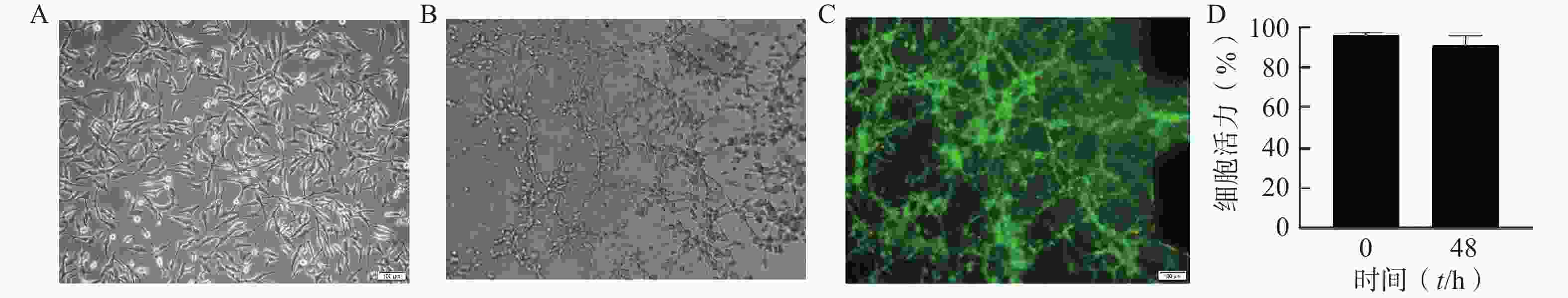
通过分析U251芯片模型中培养的细胞的表型和活力,评估该模型内脑胶质细胞瘤细胞的活性。在不改变培养条件的情况下,以1×107个/ml细胞密度接种构建芯片模型,培养48 h后进行活力和表型分析。图2A为明场下细胞形态,图2B为模型内的细胞形态,U251细胞在芯片内呈不规则的3D结构生长。图2C为培养48 h后U251细胞活/死评估的荧光图像,绝大多数为呈现绿色荧光的活细胞,表明模型内大部分细胞存活。与0 h芯片内U251细胞活力相比,U251细胞在芯片中培养48 h后仍显示出较高的活力水平(>91%),说明细胞在芯片内培养48 h后生长状态良好,可以用于后续的药效评价研究(图2D)。
-
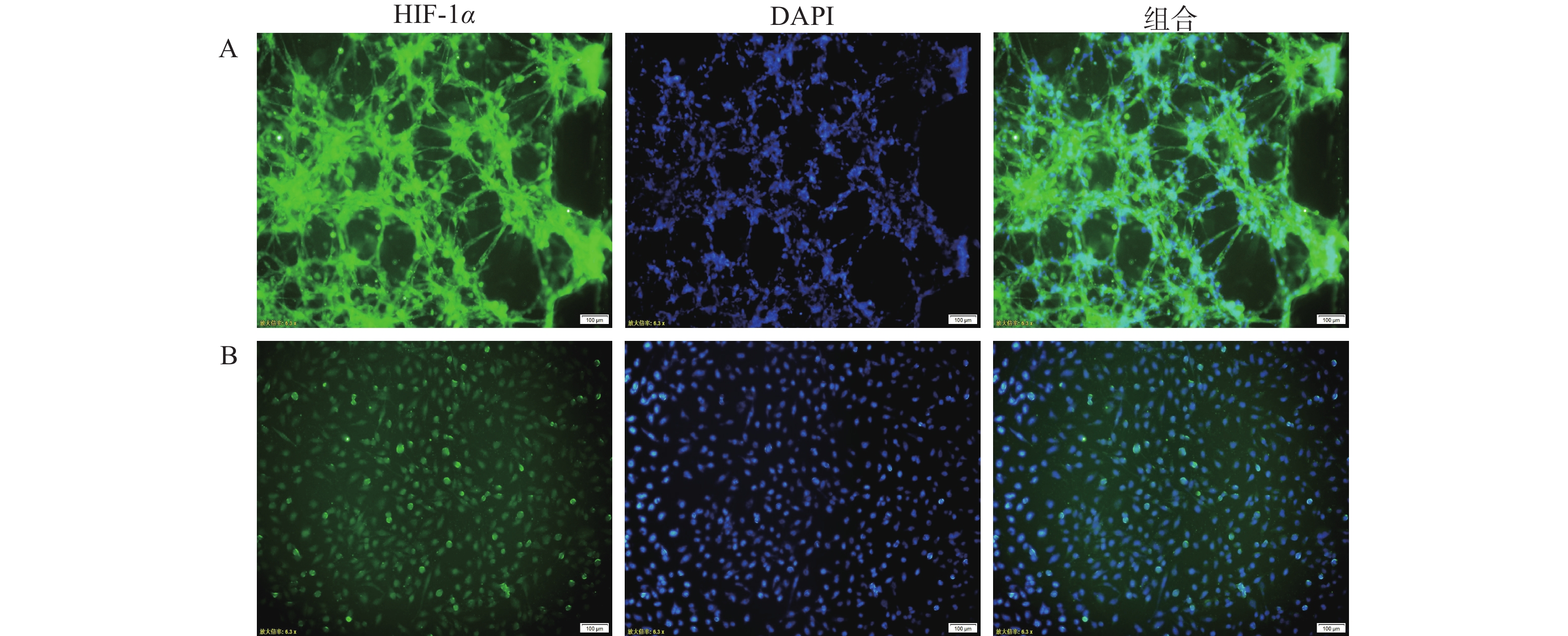
在肿瘤细胞高速生长与增殖的过程中,往往会伴随缺氧环境的形成。为确定芯片模型中U251细胞是否处于低氧环境,通过免疫荧光染色,对2D培养和3D培养模型中的U251细胞进行HIF-1α的表征。如图3所示,在3D培养的芯片模型中,缺氧状态标记物HIF-1α的荧光强度高于2D细胞培养模型,说明在3D培养条件形成的立体环境中,部分区域细胞处于相对缺氧状态,可能产生更强的缺氧反应;而在2D培养条件下,细胞间相互作用和信号传导较为简单,氧气分布比较均匀,细胞的缺氧反应相对较弱。
-
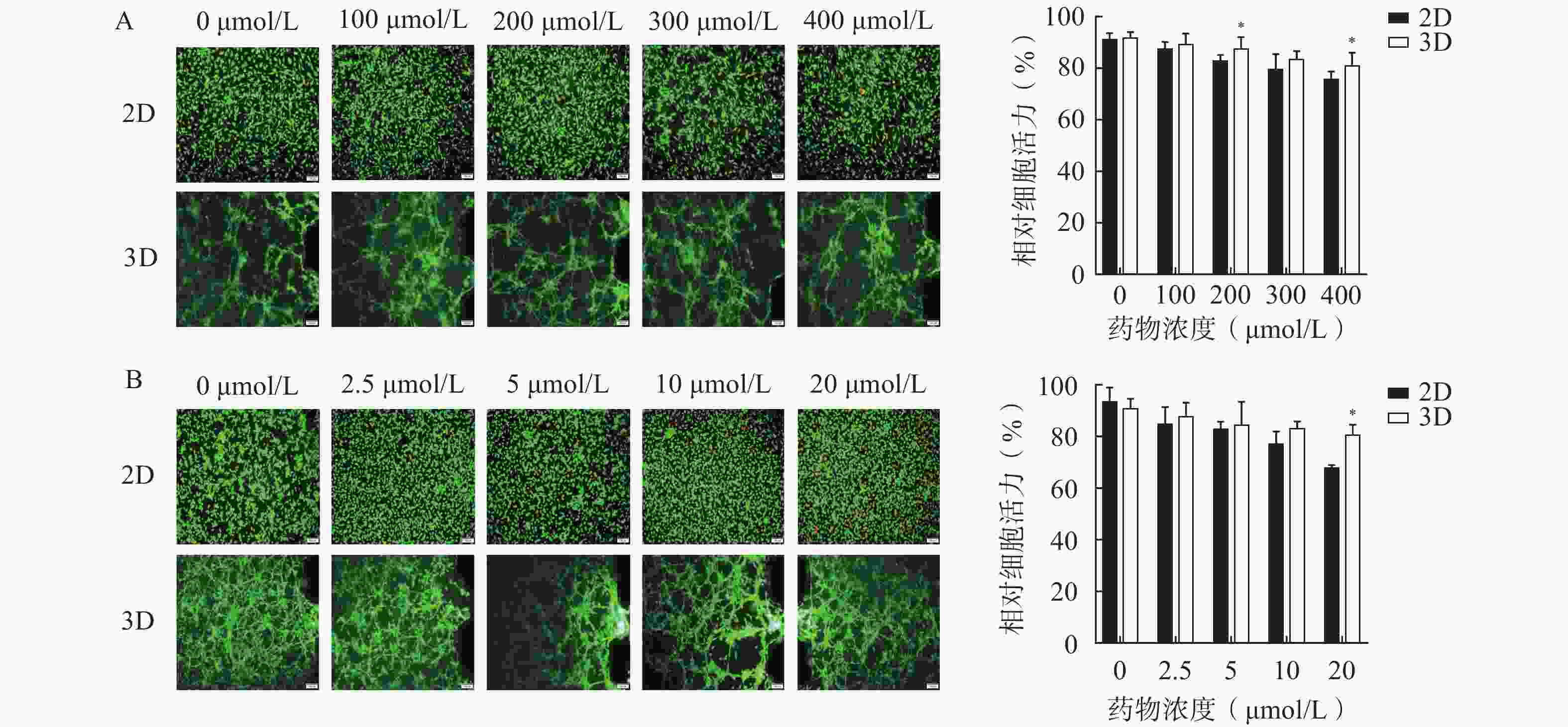
为了评估该芯片模型在研究药物抗脑胶质瘤活性的适用性,分别考察了两种抗脑胶质瘤阳性药物,即TMZ和DOC,在2D培养和3D培养条件下对细胞活力的影响,结果如图4所示。阳性药TMZ和DOC对U251细胞具有一定程度的杀伤作用,随着浓度的升高,细胞存活率逐渐降低;与2D培养相比,3D培养芯片模型内的U251细胞在暴露于不同浓度TMZ(100、200、300、400 µmol/L)和DOC(2.5、5、10、20 μmol/L)的细胞活力均较高,其中,200 μmol/L和400 μmol/L的TMZ组(图4A)和20 μmol/L的DOC组(图4B)细胞活力均显著高于相应的2D培养组(P<0.05)。表明在相同浓度条件下,3D条件培养的芯片内缺氧微环境或细胞外基质能为细胞生长提供更稳定的条件,促进肿瘤细胞生长,从而表现出模型内细胞活力更高。
-
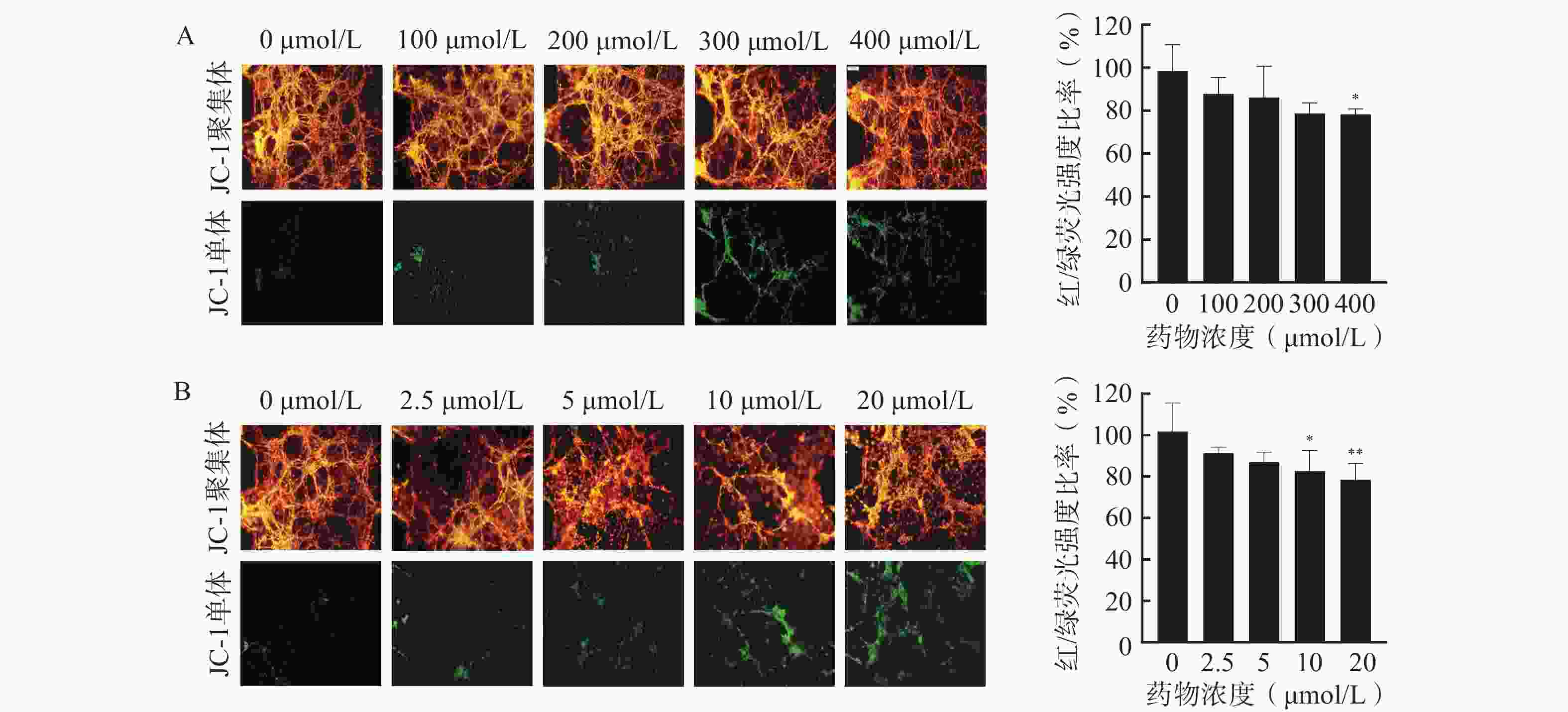
通过JC-1荧光探针监测细胞线粒体膜电位,评估芯片模型内细胞凋亡情况,以细胞活力更高的3D培养芯片模型作为研究平台,并选择阳性药TMZ和DOC评价该芯片模型用于研究药物抗脑胶质瘤活性的可行性,结果如图5所示。通常在健康细胞的线粒体内,JC-1以高膜电位的红色荧光聚集体形态存在;在不健康或发生凋亡的细胞线粒体中,JC-1则以绿色荧光的单体形式呈现。分别使用TMZ和DOC处理后,3D芯片模型内U251细胞的红/绿荧光强度比率随着药物浓度的增加而降低,说明细胞内线粒体膜电位随着阳性药浓度的升高而下降,其中,400 μmol/L的TMZ组(图5A)、10 μmol/L和20 μmol/L的DOC组(图5B)与对照组相比,对U251细胞凋亡的影响有显著性差异,说明这两种阳性药均可通过诱导细胞凋亡杀伤U251细胞。以上结果表明本研究所构建的U251细胞微流控芯片模型具有评价药物抗肿瘤药效的能力,可以应用于胶质瘤细胞的毒性评价和凋亡评价,为后续应用于中药抗脑胶质瘤药效评价奠定基础。
-
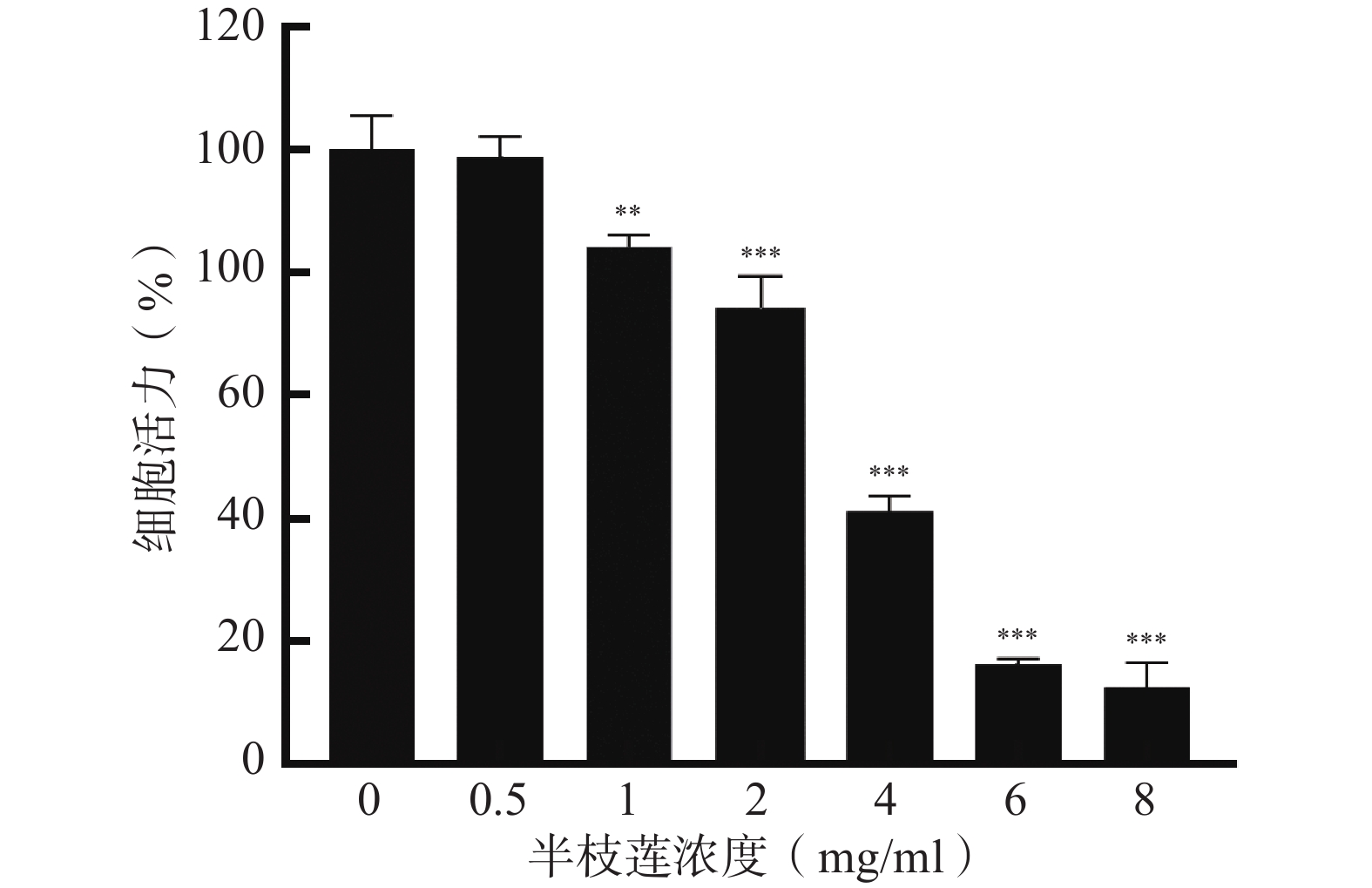
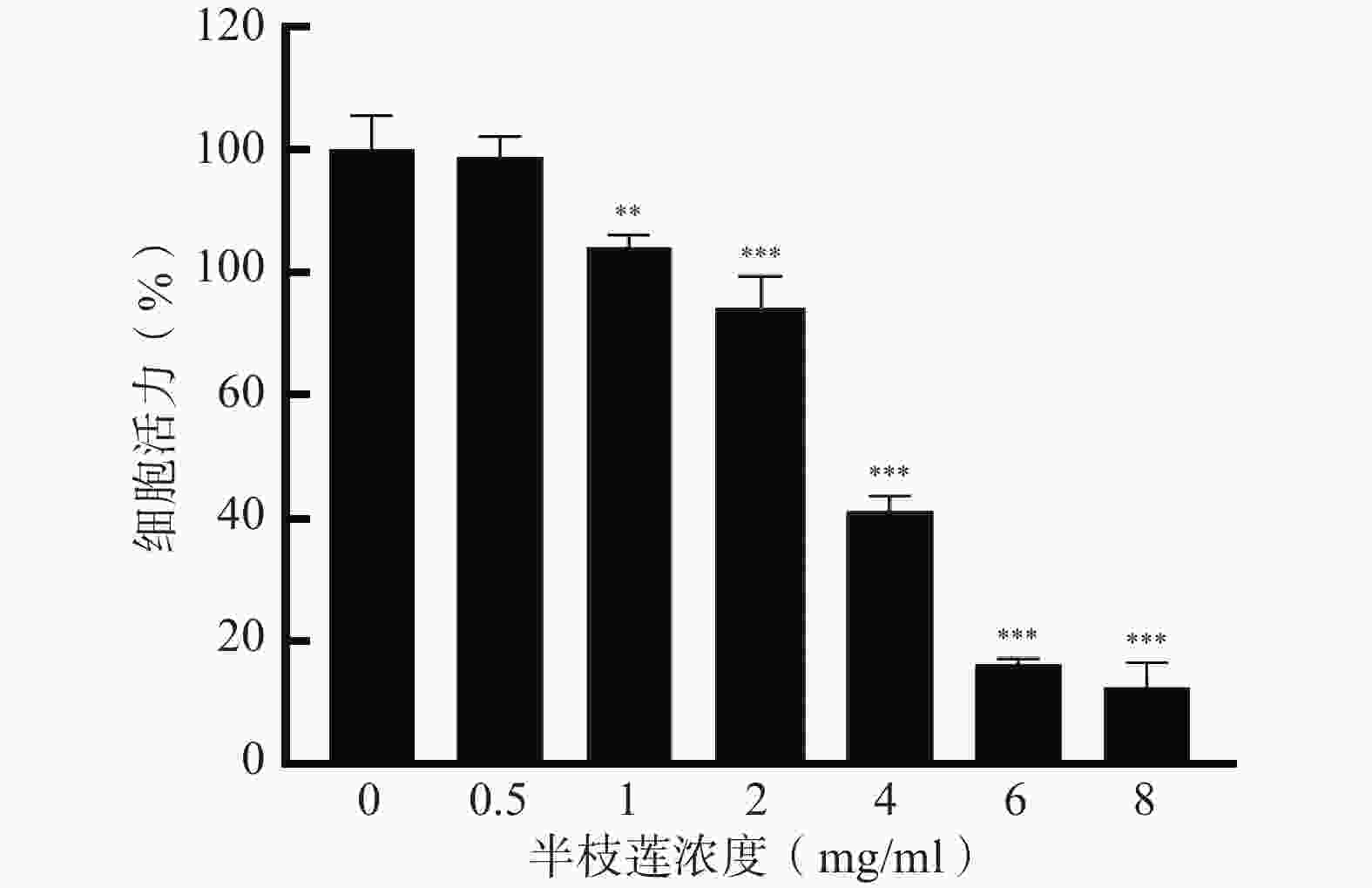
采用CCK-8法考察不同浓度的半枝莲提取液对U251细胞的毒性,确定适宜的给药浓度。结果如图6所示,在0.5~8 mg/ml的浓度范围内,U251细胞的存活率随着半枝莲提取液浓度的增加而降低。为确保所选药物浓度能够有效杀伤U251细胞,同时避免浓度过高导致的非特异性毒性,本研究选择2 mg/ml的半枝莲提取液进行后续实验。
-
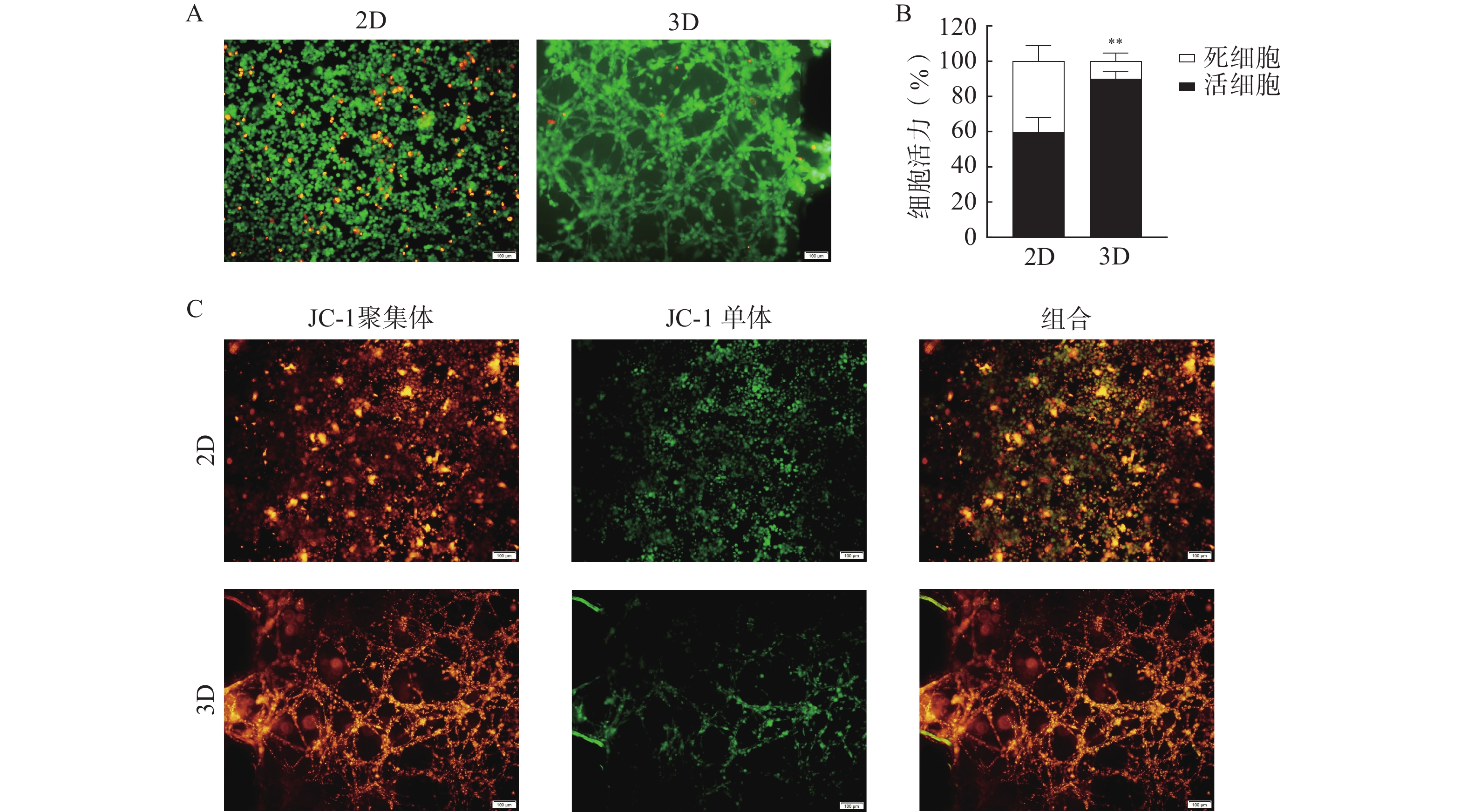
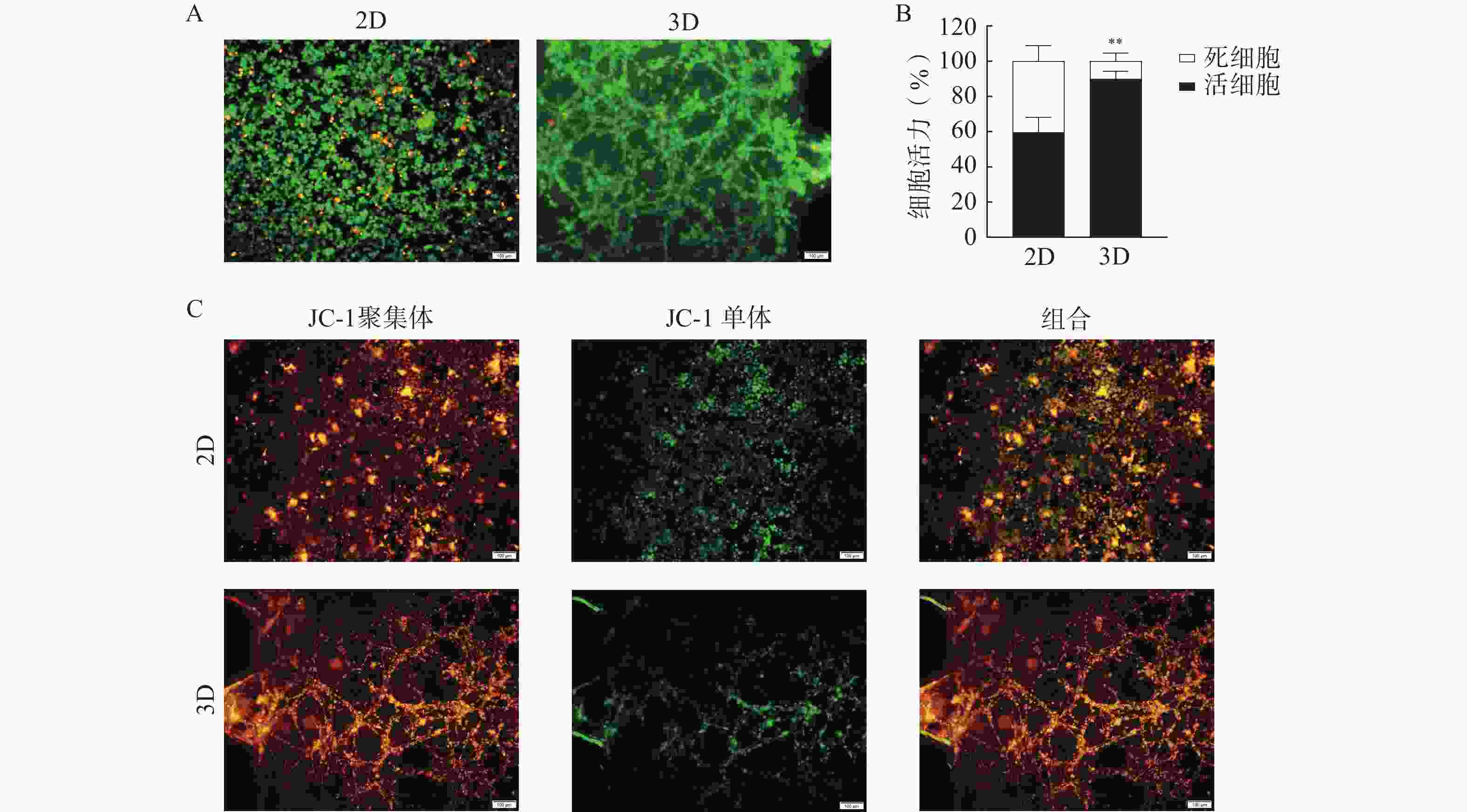
在所建立的U251芯片模型上考察半枝莲提取液对U251细胞的杀伤作用,通过活/死细胞染色和凋亡实验评价半枝莲提取液的药效,结果如图7所示。2 mg/ml的半枝莲提取液能在一定程度上降低细胞活力,与2D培养(平均细胞活力为64.82%)相比,3D培养的芯片上细胞活力更高(平均细胞活力为90.52%),提示在3D培养条件下可能需要更大剂量的半枝莲提取液才能对脑胶质瘤细胞产生杀伤效果。此外,凋亡实验结果显示,2D培养条件下有更多的细胞出现了线粒体膜电位降低的情况,而3D培养条件下呈绿色荧光的JC-1单体较少,说明3D培养的细胞发生凋亡的较少。综上表明半枝莲提取液在一定程度上可以杀伤U251细胞,诱导细胞凋亡,同时提示基于传统2D培养模型的药物筛选或药效评价结果与更接近体内肿瘤微环境的3D培养系统之间存在一定差距。
-
神经胶质瘤的侵袭性和肿瘤细胞对化疗药物的耐受性使治疗面临重大的挑战。尽管医学科学研究取得了重大进步,但神经胶质瘤的预后仍然较差,手术、放疗和化疗等传统治疗方法效果不佳[7]。目前,体外研究采用的细胞模型仅提供微观层面的信息,无法模拟脑和脑肿瘤的解剖、功能和微环境状况[8]。因此,近年来的研究专注于开发更先进的细胞培养模型,能够更好地模拟肿瘤细胞与复杂微环境之间的相互作用,以肿瘤球体、类器官、3D打印和微流控芯片模型等为代表的3D培养方式可构建较为理想的模拟肿瘤微环境的模型,为肿瘤细胞的增殖提供了合适的环境,并可作为体内肿瘤诱导的载体,从而可以研究肿瘤生长、侵袭以及与免疫系统的相互作用[9]。
肿瘤微环境的细胞和非细胞成分都有助于神经胶质瘤的发生,肿瘤微环境的改变可以促进神经胶质瘤的发生、进展、侵袭和治疗耐药性[10]。基质胶作为一种用于体外培养和模拟生物组织环境的生物材料,其物理性质和功能上高度模拟天然细胞外基质的关键特征,为肿瘤细胞提供支撑和3D结构,有助于细胞黏附、生长和分化,可以更完整地在体外模拟肿瘤微环境[11]。PDMS具有透气性、透光性、生物相容性以及易加工和成本低等特征[12],本研究使用的微流控芯片模型集PDMS应用优势和微流控在时空间维度精确控制的特点,实现模拟体内肿瘤微环境的细胞培养,为脑胶质瘤体外模型构建、药效评价和药物筛选提供灵活可控的研究平台。
脑胶质瘤动物模型因其存在基因和分子水平特征、肿瘤微环境等与人类存在差异、低通量、耗时长以及伦理问题等问题,细胞模型仅由肿瘤细胞组成,易发生遗传变异和缺乏肿瘤微环境等缺点,导致脑胶质瘤候选治疗药物在临床前试验评估的失败率极高[6]。与动物模型和传统的贴壁培养的细胞模型相比较,本研究采用人源的U251细胞构建的脑胶质瘤微流控芯片模型在形态、结构以及缺氧微环境的表达等方面更接近真实的肿瘤生长环境。作为体外研究模型,肿瘤细胞在该微流控芯片模型内的存活率、凋亡和对治疗的反应等方面表现出更接近体内的行为,更真实地评估模型内肿瘤细胞对药物或其他外界刺激产生的反应。因此,本研究中建立的微流控芯片模型在研究肿瘤生长、侵袭、药物评价和筛选具有一定优势。
脑胶质瘤的标准治疗包括最大限度的手术切除、随后的放疗和TMZ同步化疗[13],但许多小分子抑制剂和免疫治疗策略都未能改善预后[14]。中医药治疗脑胶质瘤具有一定优势,包括改善临床症状、减轻放疗和化疗的不良反应、提高患者生存质量等[15]。目前认为中医药防治脑胶质瘤的作用机制主要与改善脑胶质瘤免疫抑制微环境,促进脑胶质瘤细胞凋亡及抑制其增殖、侵袭、迁徙,抑制脑胶质瘤组织内血管生成,调节BBB通透性,促进氧化应激相关,同时还能够提高肿瘤细胞对放化疗的敏感性,减轻其不良反应,降低肿瘤耐药性和复发的风险[16-17]。中药半枝莲具有清热解毒,化瘀利尿的功效[18],现代药理研究表明半枝莲具有抗肿瘤、抗病毒、抑菌、消炎等作用[19],可通过抑制血管内皮生长因子、缺氧诱导因子、基质金属蛋白酶的表达等,调控相关信号通路的相互作用,抑制脑胶质瘤血管生成网络机制的形成,发挥抗胶质瘤发生和发展的作用[20]。有研究发现半枝莲80%乙醇提取物对人胶质瘤细胞具有明显的抑制迁移、侵袭作用,并具有浓度相关的抑制细胞存活率、促凋亡活性[21]。He等[22-23]研究发现半枝莲活性成分野黄芩苷对人胶质瘤细胞U251和LN229的增殖、迁移和凋亡均有抑制作用,其作用机制可能与抑制PSEN 1/PI 3 K-AKT信号通路有关。相比之下,本研究利用所构建的更具生理相关性的脑胶质瘤微流控芯片模型评价半枝莲抗脑胶质瘤作用。结果显示,2 mg/ml的半枝莲提取液能降低U251细胞的活力,通过降低线粒体膜电位诱导细胞凋亡,为进一步探究半枝莲治疗脑胶质瘤及其作用机制提供实验基础。
综上,本研究采用2D和3D培养方式构建了模拟肿瘤微环境的脑胶质瘤微流控芯片模型。综合芯片上细胞活力评价、肿瘤微环境表征以及两种抗肿瘤阳性药物对该模型进行表征并验证。该模型成功应用于中药半枝莲的抗脑胶质瘤药效评价,阐释了半枝莲通过诱导脑胶质瘤细胞的凋亡发挥抗脑胶质瘤作用,为中药抗脑胶质瘤药效评价、机制研究以及活性成分快速筛选提供研究平台。
Construction of glioma microfluidic chip model and its application research on evaluation the medicinal efficacy of the Chinese medicine Scutellaria barbata
doi: 10.12206/j.issn.2097-2024.202409034
- Received Date: 2024-09-12
- Rev Recd Date: 2024-11-26
- Available Online: 2025-02-21
- Publish Date: 2025-02-25
-
Key words:
- glioma /
- microfluidic chips /
- tumor microenvironment /
- medicinal efficacy evaluation /
- Scutellaria barbata
Abstract:
| Citation: | YOU Piaoxue, CHEN Lan, SHI Yiwei, WANG Hui, CHAO Liang, HONG Zhanying. Construction of glioma microfluidic chip model and its application research on evaluation the medicinal efficacy of the Chinese medicine Scutellaria barbata[J]. Journal of Pharmaceutical Practice and Service, 2025, 43(2): 59-66. doi: 10.12206/j.issn.2097-2024.202409034 |









 DownLoad:
DownLoad: