-
夏枯草消瘤合剂由中药夏枯草、牡蛎、生地黄、莪术、苍术、白术组成,是中医肿瘤学专家钱伯文教授的经验方。方中诸药配伍,以达化痰软坚,活血化瘀,补养气血的功效。其临床实验研究已证实,该药配合一线化疗方案治疗中晚期非小细胞肺癌患者,有助于提高患者的生存治疗和减少化疗所产生的毒副作用[1]。由该方制成的合剂在我院临床使用多年,前期研究对于组方中化学成分的研究仍限于迷迭香酸、咖啡酸的稳定性研究[2]。尽管方中一些单味药的化学成分已有报道[3-18],但是整个复方制剂的化学成分未见报道。由于组分的复杂性,复方的成分分析比单味药更具有挑战性,明确夏枯草消瘤方色谱图中各个色谱峰归属对于该复方的质量控制及体内深入研究具有重要意义。
高效液相-高分辨飞行时间质谱(HPLC-TOF/MS)串联技术对于中药复杂体系中化学成分分析和鉴定非常有效。其灵敏度高、操作简便、耗时短,可以在短时间获得化合物准确的相对分子质量,通过与所建立的已知化学成分数据库比对,可以快速的对被测成分进行分析鉴别[19-20]。因此,本文采用HPLC-TOF/MS技术,首次对夏枯草消瘤方中化学成分进行鉴别,并且对各成分进行药材归属,以进一步阐明夏枯草消瘤方的化学物质基础。
HTML
-
Agilent 1100系列高效液相色谱仪(美国安捷伦公司),配有在线脱气机、四元泵、自动进样器、柱温箱和二级管阵列检测器;Agilent 6220高分辨飞行时间质谱仪(美国安捷伦公司),配有标准电子喷雾离子源(ESI);分析软件为 MassHunter 数据采集在线工作站和Qualiative Analysis 离线分析软件。
-
咖啡酸(批号:110885-200102,纯度>98.5%)、迷迭香酸(批号:111871-201505,纯度>98.5%)对照品,均购自中国食品药品检定研究院,甲醇和甲酸为色谱纯(Fisher,USA),其余试剂均为分析纯,水为纯水。
夏枯草、生地黄、莪术、麸炒苍术、麸炒莪术、牡蛎、煅牡蛎均由上海中医药大学附属岳阳中西医结合医院中药房提供(见表1)。药材及饮片均经第二军医大学药学院生药学教研室黄宝康教授鉴定。
药材名称 批号 药材来源 夏枯草 180207 上海康桥药业有限公司 生地黄 180302 上海同济堂药业有限公司 莪术 180306 上海虹桥中药饮片有限公司 麸炒白术 2018031001 上海上药华宇药业有限公司 麸炒苍术 180407 上海虹桥中药饮片有限公司 牡蛎 2017102006 上海上药华宇药业有限公司 煅牡蛎 180301 上海同济堂药业有限公司
1.1. 仪器
1.2. 药品与试剂
-
分别精密称取咖啡酸、迷迭香酸对照品3.22、5.68 mg置10 ml量瓶中,加甲醇稀释定容,配成浓度分别为322、568 μg/ml的母液,精密吸取母液 1 ml 置于 10 ml 量瓶,加甲醇定容后,即得对照品溶液。
-
精密称取夏枯草4.2 g、牡蛎8.4 g、煅牡蛎8.4 g、地黄4.2 g、莪术4.2 g、白术(麸炒)2.1 g、苍术(麸炒)2.1 g,以上七味,充分润湿,分别加8倍量与4倍量水煎煮两次,每次煮沸后于85 ℃保温20 min,煎液滤过,合并滤液,滤液浓缩至相对密度1.10以上(80 ℃),离心,取上清液;精密吸取夏枯草消瘤方溶液上清液5 ml,置于50 ml容量瓶中,加甲醇定溶,摇匀,经0.22 μm微孔滤膜滤过,取续滤液,即得夏枯草消瘤方样品溶液。
-
色谱柱:ACE C18(3.0 mm×150 mm),流动相A相为甲醇,B相为水(含0.1%甲酸),梯度洗脱:0~5 min:5%A,5~10 min:5%~15%A,10~30 min:15%~45%A,30~40 min:45%~70%B,40~50 min:70%~90%B;进样量2 μl,流速为0.4 ml/min;柱温为25 ℃;运行时间为50 min。
-
采用ESI离子源,正、负离子模式均进行检测,雾化器为高纯氮气,具体参数如下:正离子模式:毛细管电压3500 V,干燥器温度350 ℃,干燥器流速10L/min,雾化器压力40 psig,碎片电压160 V;参比离子m/z121.9856,1033.9881;扫描范围m/z100-1200。测定样品之前,使用调谐液校准质量轴,以保证质量精度误差小于1×10-6。
-
根据国内外专业数据库中科院化学专业数据库、Pubmed、Chemspider等,以及国内外相关研究文献,收集了夏枯草消瘤合剂方中六味中药化学成分名称及分子式共760个。采用安捷伦“formula-database generator”软件(含各元素精确质量数),根据各成分碳、氢、氧的个数,计算精确相对分子质量、M+H和M-H准分子离子峰相对分子质量的相应的化学成分数据库。
2.1. 对照品溶液的制备
2.2. 供试品溶液的制备
2.3. 色谱条件
2.4. 质谱条件
2.5. 夏枯草消瘤方化学成分数据库的建立
-
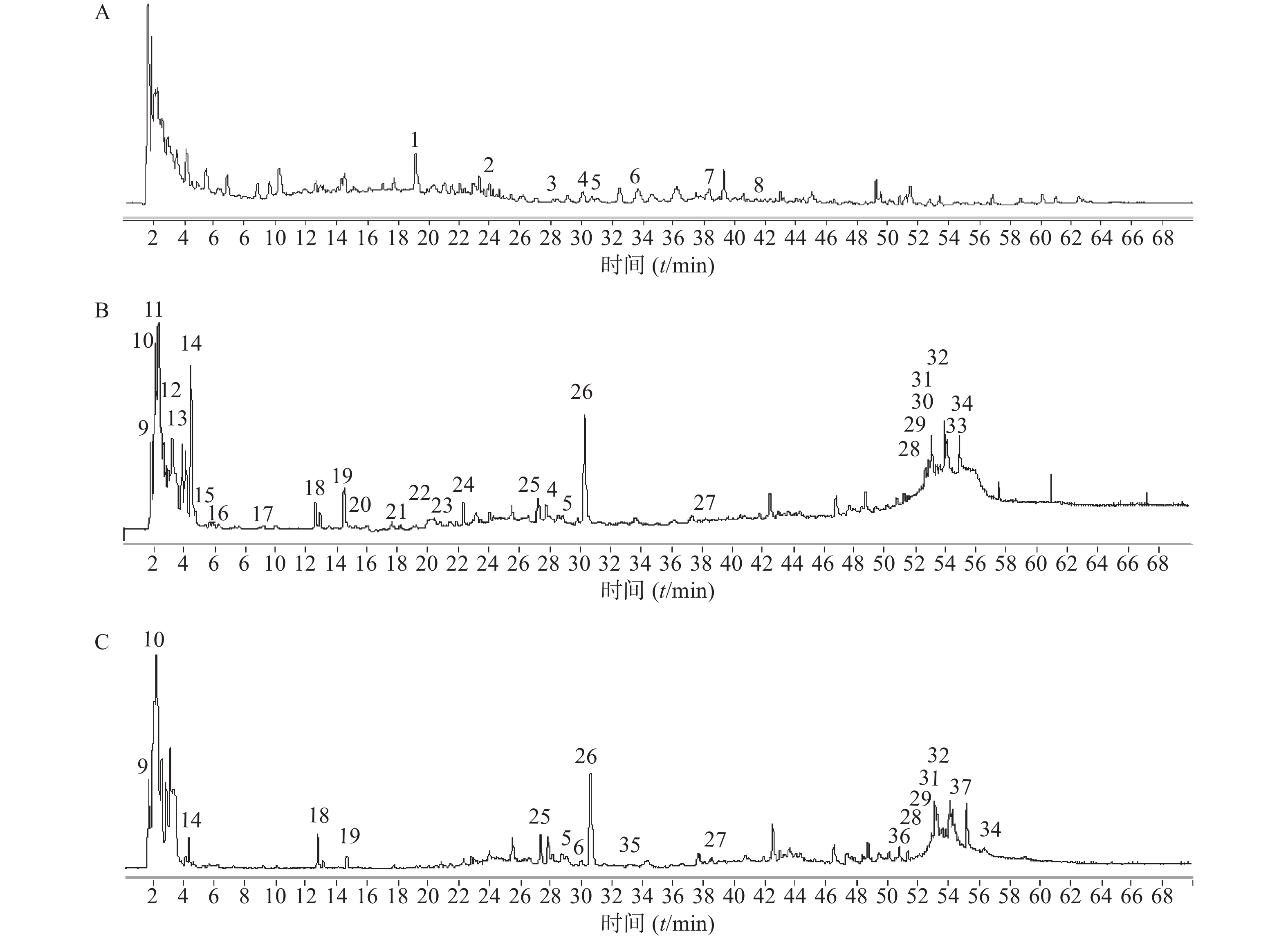
夏枯草消瘤方样品溶液的总离子流图见图1。其中图1A为正离子160 V模式,图1B为负离子160 V模式,图1C为负离子260 V模式。
-
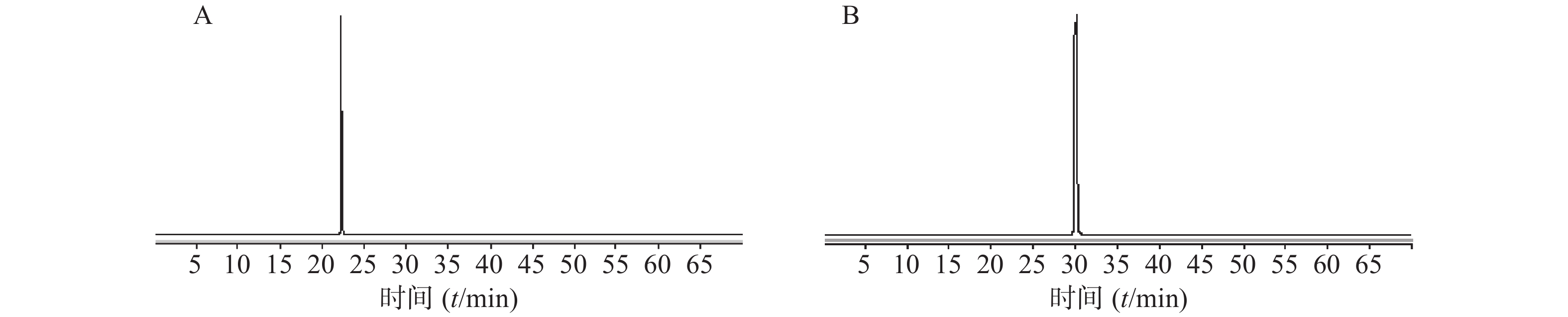
实验中利用已有的2个对照品,在负离子模式、碎片电压160 V条件下,无偏差的鉴别出咖啡酸、迷迭香酸,对照品总离子流图见图2。
-
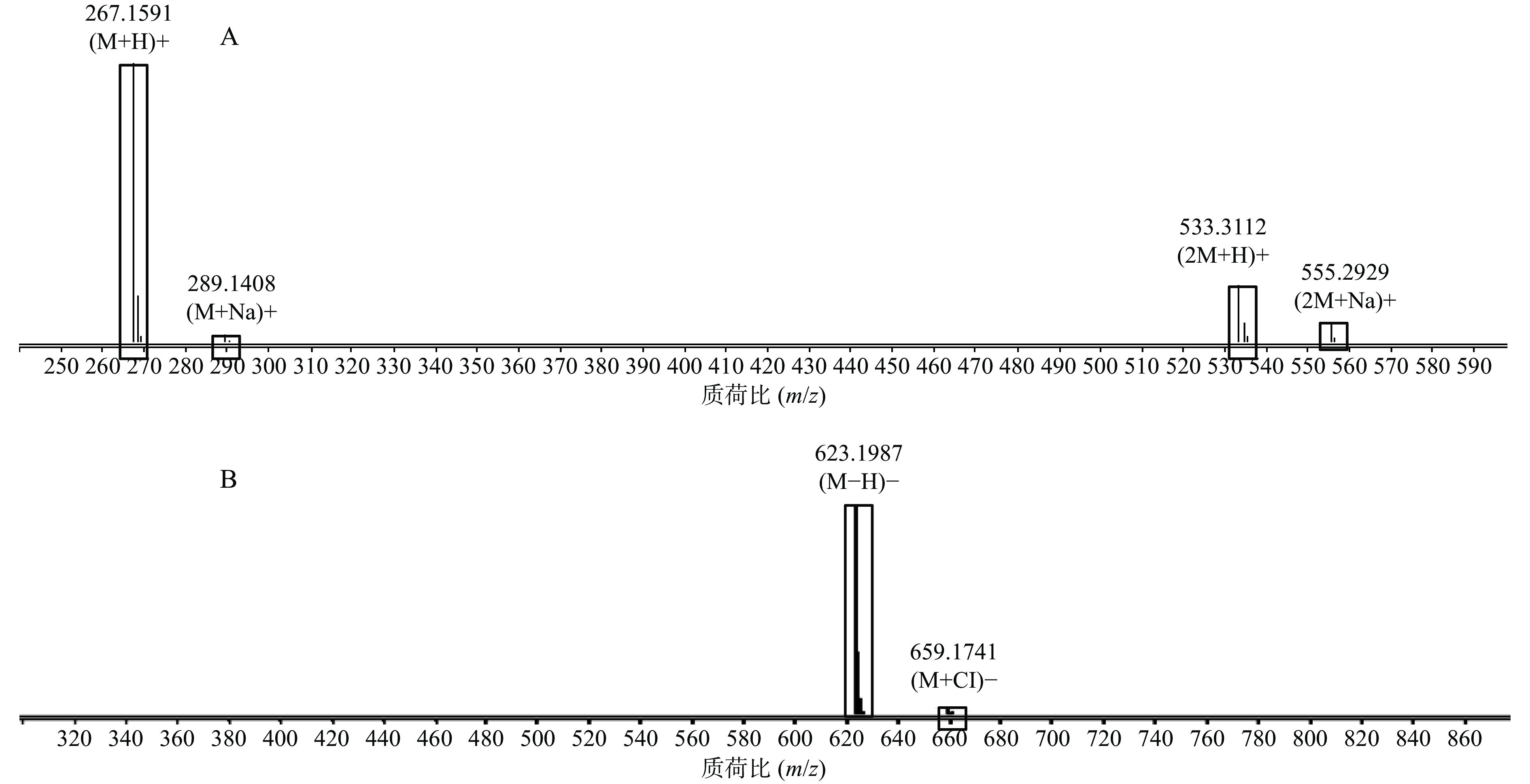
正离子模式下以图1中2号峰疣孢酚为例,说明夏枯草消瘤方色谱峰的鉴别过程。保留时间为24.032 min,色谱图中的准分子离子为267.1591。利用Qualiative Analysis数据分析软件的计算功能计算精确质量数的可能元素组成(5×10−6),并比对数据库中已知化合物的质荷比,初步确定元素组成为C15H22O4,为疣孢酚的(M+H)+。计算该准分子离子的核素分布情况,从图3A可以看出同位素分布的理论值(方框所示)与实际值(方框内峰所示)吻合良好,确定此峰为疣孢酚。同理可得负离子模式下图1中18号峰,地黄苷D的解析过程(图3B)。
-
根据飞行时间质谱测得精确的相对分子质量,比对所建立的数据库,应用Qualiative Analysis 质谱分析软件计算分子组成,将理论值与实测值进行比对,结合上述对照品鉴别结果及相关文献报道,对夏枯草消瘤合剂中药材在正、负离子模式下所得色谱图中色谱峰进行分析,初步鉴别出37个化学成分,结果见表2、表3。对于部分未见区分的同分异构体,后期可考虑调节碎片电压获得化合物的裂解规律进行区分。
序号 相对时间(min) 化合物 分子式 M+H 实验值(m/z) 理论值(m/z) 误差(×10–6) 来源 1 19.174 7-羟基异喹啉 C9H7NO [M+H]+ 146.060 8 146.052 8 –0.72 地黄. 2 24.032 Verrucarol C15H22O4 [M+H]+ 267.159 1 267.151 8 0.06 莪术 3 28.388 白术内酯Ⅱ C15H20O2 [M+H]+ 233.153 3 233.146 3 1.49 白术. 41) 30.653 芦丁 C27H30O16 [M+H]+ 611.160 8 611.153 4 –0.27 夏枯草 51) 30.703 槲皮素-3-O-β-D-葡萄糖苷 C21H20O12 [M+H]+ 465.102 9 465.095 5 –0.25 夏枯草 61) 33.713 伞形酮 C9 H6 O3 [M+H]+ 163.038 7 163.031 7 1.54 夏枯草 7 38.337 白术内酯Ⅲ C15H20O3 [M+H]+ 249.148 2 249.141 2 2.05 白术 81) 41.969 十四烷基柠檬酸 C20H36O7 [M+H]+ 389.252 9 389.246 1 1.31 白术 注:1)表示正负模式下测得 序号 相对时间(min) 化合物 分子式 M+H 实验值(m/z) 理论值(m/z) 误差(×10–6) 来源 91) 1.999 精氨酸 C6H14N4O2 (M-H)– 173.104 3 173.111 7 0.56 地黄 101) 2.109 葡萄糖酸 C6H12O7 (M-H)– 195.051 1 195.058 3 –0.23 夏枯草 11 2.789 苹果酸 C4H6O5 (M-H)– 133.014 3 133.021 5 –0.61 夏枯草 12 2.842 柠檬酸 C7H12O6 (M-H)– 191.019 5 191.027 0 1.04 夏枯草 13 3.305 二氢梓醇 C15H24O10 (M+CHO2)– 409.134 8 409.136 9 0.88 地黄 141) 4.441 梓醇 C15H22O10 (M+CHO2)– 407.118 8 407.121 2 2.01 地黄 15 4.724 尿嘧啶核苷 C9H12N2O6 (M-H)– 243.062 2 243.069 5 0.43 地黄 16 5.869 络氨酸 C9H11NO3 (M-H)– 180.066 4 180.073 9 1.28 地黄 17 9.186 鸟苷 C10H13N5O5 (M-H)– 282.084 1 282.091 7 1.12 地黄 181) 12.586 地黄苷D C27H42O20 (M+CHO2)– 731.225 6 731.226 9 –0.57 地黄 191) 14.46 丁香酸 C9H10O5 (M-H)– 197.045 3 197.052 8 1.48 地黄 20 14.562 益母草苷 C15H24O9 (M+Cl)– 383.111 1 383.642 0.88 地黄 21 18.189 原儿茶酸 C7H6O3 (M-H)– 137.024 5 137.031 7 –0.75 夏枯草 22 19.253 2, 3-二氢 -7-甲氧基-4 -甲基 -1H-1,
5 -苯并二氮卓 -2-酮C11H12N2O2 (M-H)– 203.082 5 203.089 9 0.52 苍术 23 21.839 地黄苦苷 C16H26O8 (M-H)– 345.155 3 345.162 8 0.41 地黄 24 22.327 咖啡酸 C9H8O4 (M-H)– 179.035 1 180.049 5 –0.9 白术 251) 27.255 异迷迭香酸苷 C24H26O13 (M-H)– 521.130 8 521.137 3 –1.42 夏枯草 42) 28.487 芦丁 C27H30O16 (M-H)– 609.146 1 609.153 4 0.08 夏枯草 52) 28.61 槲皮素-3-O-β-D-葡萄糖苷 C21H20O12 (M-H)– 463.088 1 463.095 5 0.26 夏枯草 261) 30.296 迷迭香酸 C18H16O8 (M-H)– 359.077 2 359.084 5 0.18 夏枯草 271) 38.237 异地黄苷 C31H40O15 (M-H)– 651.229 1 651.236 7 0.59 地黄 281) 52.394 表莪术酮 C15H28O2 (M-H)– 239.201 4 239.208 9 1.07 莪术 291) 52.687 肉豆蔻酸 C14H28O2 (M-H)– 227.201 7 227.208 9 –0.12 夏枯草 301) 52.748 熊果酸 C30H48O3 (M-H)– 455.353 455.306 3 0.17 夏枯草 311) 53.606 亚油酸 C18H32O2 (M-H)– 279.232 8 279.240 2 0.55 夏枯草 321) 53.911 软脂酸 C16H32O2 (M-H)– 255.233 4 255.240 2 –1.71 夏枯草 33 54.095 油酸 C18H34O2 (M-H)– 281.249 0 281.255 9 –1.43 夏枯草 341) 54.92 硬脂酸 C18H36O2 (M-H)- 283.264 5 283.271 5 –0.93 苍术 35 33.114 6-0-E阿魏酰基筋骨草醇 C25H32O12 (M-H)– 523.181 7 523.189 4 0.73 地黄 36 51.355 麝香草酚 C10H14O (M-H)– 149.097 1 149.104 5 0.28 夏枯草 37 54.305 11-十八烯酸- C18H34O2 (M-H)– 281.248 6 282.225 9 0.09 夏枯草 注:1)表示负模式下碎片电压160V和260V测得;2)表示正负模式下测得。 -
对色谱条件的摸索,考察了甲醇-水、乙腈-水系统,发现甲醇的洗脱效果优于乙腈,且各色谱峰分离效果更好,加入0.1%甲酸可以改善峰型,并提高质谱响应,故采用甲醇-0.1%甲酸水为流动相。由于本组方含有药材较多,组方内所含成分比较复杂,因此选择大梯度洗脱,以期最大程度地得到其中的化合物保留。质谱检测比较了正、负离子两种扫描模式,由于组方中所含多种化合物响应模式各有不同,因此,选择正、负离子两种扫描模式同时进行监测。对于碎片电压的选择,本方中大部分化学成分在160 V时以准分子离子峰形式稳定存在,有少量化学成分在负离子模式下260V时以准分子离子峰形式稳定存在,图谱本底较低,因此选择160 V、260 V的碎片电压可以最大限度地对复方中的成分进行鉴别。
3.1. 夏枯草消瘤合剂的相关图谱
3.2. 利用对照品鉴别化合物
3.3. 利用精确质量数和同位素分布鉴别化合物
3.4. 夏枯草消瘤合剂化学成分鉴别结果
3.5. 讨论
-
本研究运用 HPLC-TOF/MS 技术快速鉴别夏枯草消瘤合剂中37种化学成分,其中正离子模式碎片电压160 V条件下8个;负离子模式碎片电压160 V条件下28个,碎片电压260 V条件下19个;正负离子均有响应4个,负离子模式两种碎片电压下均有响应16个,并对成分进行了药材归属。该方法在传统的植物化学分离提取基础上对色谱峰进一步明确化,为夏枯草消瘤方的质量控制、体内的深入研究及临床应用奠定了良好的基础。








 DownLoad:
DownLoad: