-
雀梅藤Sageretia thea(Osbeck)Johnst又名雀梅刺、对角刺、碎米子等,为鼠李科雀梅藤属植物,主要分布地区包括云南、安徽、江苏等[1-2]。根、茎、叶均可入药,其性甘、淡、平,具有降气化痰、祛风利湿等功效[3]。民间常用雀梅藤药材煎汤或浸酒内服治疗乳腺肿瘤、淋巴结肿大和水肿等疾病,具有较好效果[4]。现代药理研究表明,雀梅藤具有抗结直肠癌、抗炎、抗氧化、抗病毒、抗菌和肝保护等活性[5-6],但尚未见雀梅藤对乳腺癌等其他肿瘤影响的报道。该研究通过多种体外实验观察雀梅藤对乳腺癌细胞增殖及凋亡的影响,并初步探索其作用机制,以证实民间应用该药材治疗乳腺肿瘤的合理性,为进一步的药物开发奠定基础。
-
CCK8 试剂盒(大连美仑生物技术有限公司);Spark酶标仪(瑞士Tecan公司);二氧化碳培养箱(Thermo Fisher);96孔培养板(泰坦);电子分析天平(塞多利斯 BSA2245-CW);细胞计数仪(Corning 6749);倒置相差显微镜(奥林巴斯 IX73)。
-
雀梅藤药材购自昆明井田药业有限公司,生产许可证号:滇20160155。经海军军医大学药学系生药学教研室辛海量教授鉴定为鼠李科雀梅藤属植物雀梅藤Sageretia thea(Osbeck)Johnst.的茎。取雀梅藤干燥药材660 g,粉碎后用8倍量75%乙醇回流提取3次,每次1.5 h。合并提取液,过滤后回收溶剂,得乙醇提取物。乙醇提取物用水溶解混悬,加入等体积的石油醚萃取3次,收集萃取液,通过旋转蒸发得到石油醚萃取部位。进一步采用真空冷冻干燥机在−80 ℃下冻干,分别称重,获得乙醇和石油醚提取物质量为57 g和0.91 g,提取得率分别为8.63%和0.13%。
-
称取20 mg雀梅藤石油醚提取物溶于1 ml的DMSO溶剂中,然后用培养液稀释成不同药物浓度,药物最高剂量下的DMSO浓度不超过0.3%。同时,对照组培养液中添加0.3%的DMSO作为阴性对照。
-
三阴性人乳腺癌细胞株MDA-MB-231、BT549购自中国科学院上海细胞库;人脐静脉血管内皮细胞株购自上海赋望实业有限公司。
-
分别取对数生长期的人三阴性乳腺癌细胞株MDA-MB-231和BT549及人脐静脉血管内皮细胞株(HUVEC)并计数,以每孔5×103个的细胞密度接种到96孔板,在37 ℃的细胞培养箱中过夜培养至细胞贴壁。实验分为对照组和给药组,对照组以正常培养基培养,给药组以不同浓度含药培养基孵育细胞24 h。随后按试剂盒说明书进行操作,每孔加入10%的CCK8试剂,在培养箱中孵育2 h后,用酶标仪在450 nm处检测各孔的吸光度(OD)值。对照组细胞活力换算为100%,其余各给药组按以下公式计算:细胞增殖抑制率(%)=[(对照组A值−实验组A值)/(对照组A值−空白组A值)]×100%。
-
取上述对数生长期的人三阴性乳腺癌细胞株,以每孔500个细胞的密度均匀接种在12孔板内,过夜,使细胞贴壁,随后加入雀梅藤提取物孵育24 h。吸弃培养基,用含10%的胎牛血清培养基继续培养,当培养皿中出现肉眼可见的克隆形成时,终止培养。吸弃上清液,用PBS小心浸洗,然后甲醇固定。去除固定液,加入适量的结晶紫染色液进行染色,采用PBS多次轻轻洗去周边染色液,干燥后拍照,随后用Image J软件进行统计分析。
-
将两种乳腺癌细胞接种于96孔板,放置培养箱中过夜,随后加入提取物孵育24 h。吸弃培养基,用PBS温和洗涤细胞一次,每孔加入100 μl的Calcein AM/PI染色工作液,放入37 ℃培养箱中避光孵育15 min后,用高内涵系统采集图像。
-
取对数生长期乳腺癌细胞株,以每孔40万个细胞接种于6孔板,培养箱中过夜,待细胞贴壁后,用含不同浓度提取物的培养基处理24 h,消化,离心收集细胞,以预冷的70%乙醇混悬固定过夜。离心,去除乙醇,用PBS清洗一次,加入500 μl的碘化丙啶染色工作液,避光染色30 min后用流式细胞仪分析细胞周期。
-
将对数生长期的三阴性乳腺癌细胞株以每孔40万个接种于6孔板中,过夜,待细胞贴壁后,用含不同浓度提取物的培养基孵育24 h。消化,离心收集细胞,用100 μl的1×结合缓冲液混悬后加入FITC Annexin V 和PI各5 μl,轻微振荡,室温下避光孵育15 min,流式细胞仪分析凋亡率。
-
将上述对数生长期的人三阴性乳腺癌细胞株以每孔20万个接种于6孔板,过夜,待细胞贴壁后,用含不同浓度提取物的培养基孵育24 h,吸弃培养基,每孔加入1 ml稀释过的DAPI染液孵育细胞10 min,PBS清洗2遍后采用Cytation 5拍照。
-
将对数生长期的人三阴性乳腺癌细胞株以每孔20万个接种于6孔板,过夜,待细胞贴壁后,用含不同浓度提取物的培养基孵育细胞24 h。吸弃培养液,PBS洗涤细胞之后每孔加入1 ml的JC-1染液,在37 ℃培养箱中孵育20 min。吸除上清液,用缓冲液洗涤细胞3次后加入2 ml细胞培养液,高内涵系统拍照。
-
取上述对数生长期细胞株,以每孔20万个的细胞密度接种于6孔板,过夜,待细胞贴壁后,用含不同浓度提取物的培养基孵育24 h。吸弃培养基,每孔加入1 ml含DCFH-DA的新鲜培养基孵育细胞20~30 min,DAPI复染,采用高内涵系统拍照。
-
使用Graphpad Prism 8.0.1分析软件对所获得的实验数据进行统计学分析,组间比较采用单因素方差分析,两组比较采用t检验,以P<0.05为差异有统计学意义。
-
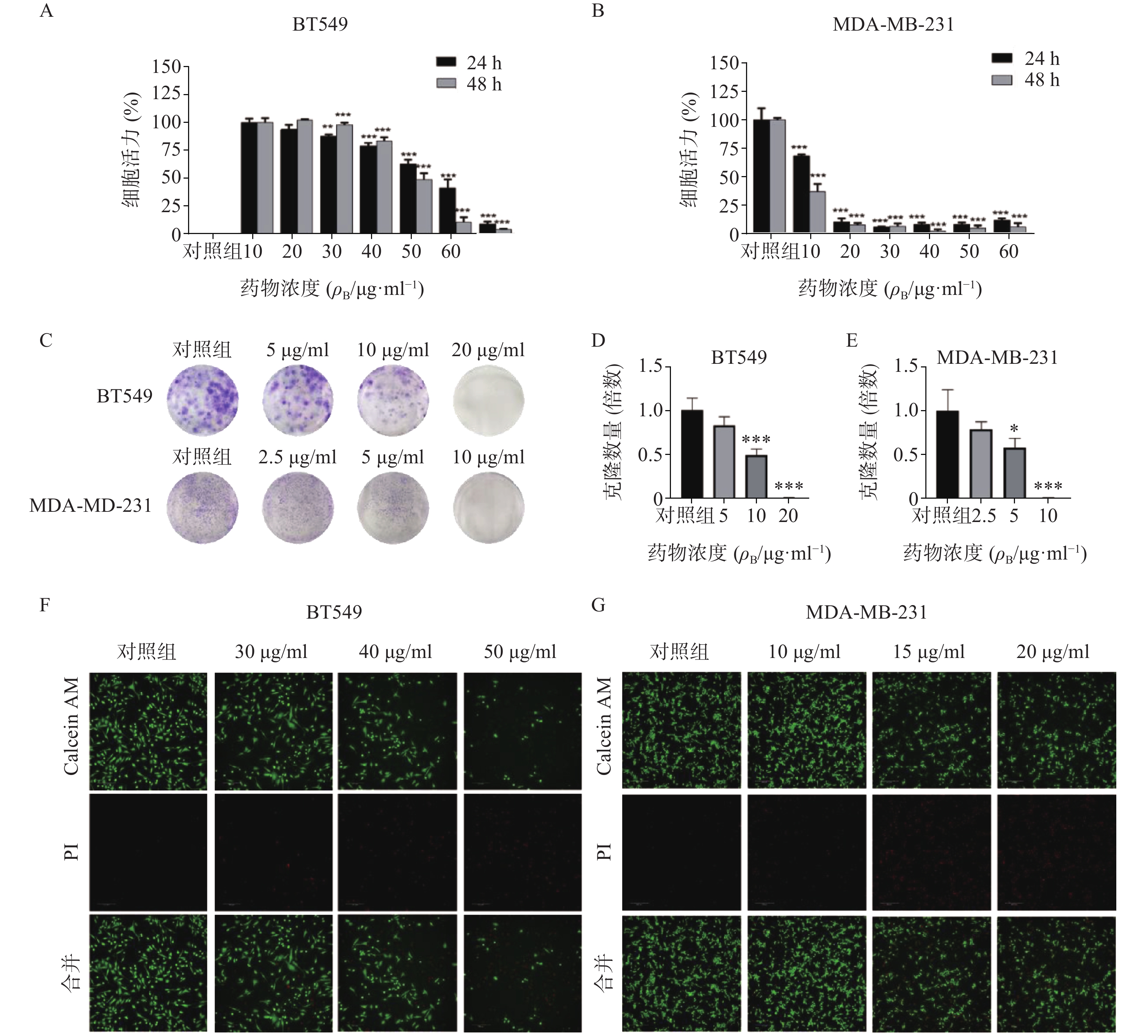
通过细胞活力分析发现,雀梅藤石油醚提取部位对多种癌细胞均有明显细胞毒性,其中对乳腺癌细胞株抑制作用最强,而且明显强于乙醇提取物。结合临床应用,实验选择两种人三阴性乳腺癌系(BT549和MDA-MB-231)进一步研究(见图1)。CCK8结果表明(图1A-B),雀梅藤石油醚提取物以剂量和时间依赖的方式抑制乳腺癌细胞活力,作用24 h和48 h的IC50值分别为45.40、12.23 μg/ml和38.87、7.60 μg/ml。平板克隆实验结果显示(图1C-E),随着雀梅藤石油醚提取物剂量的增加,两种乳腺癌细胞生长均被显著抑制。浓度分别在10 μg/ml和20 μg/ml时,MDA-MA-231和BT549细胞株的生长被完全抑制。Calcein AM/PI活死细胞染色显示(图1F-G),随着药物剂量增加,活细胞(绿色)数量较对照组显著减少,而死亡细胞(红色)数量则显著增加,与对照组比较有极显著差异。
-
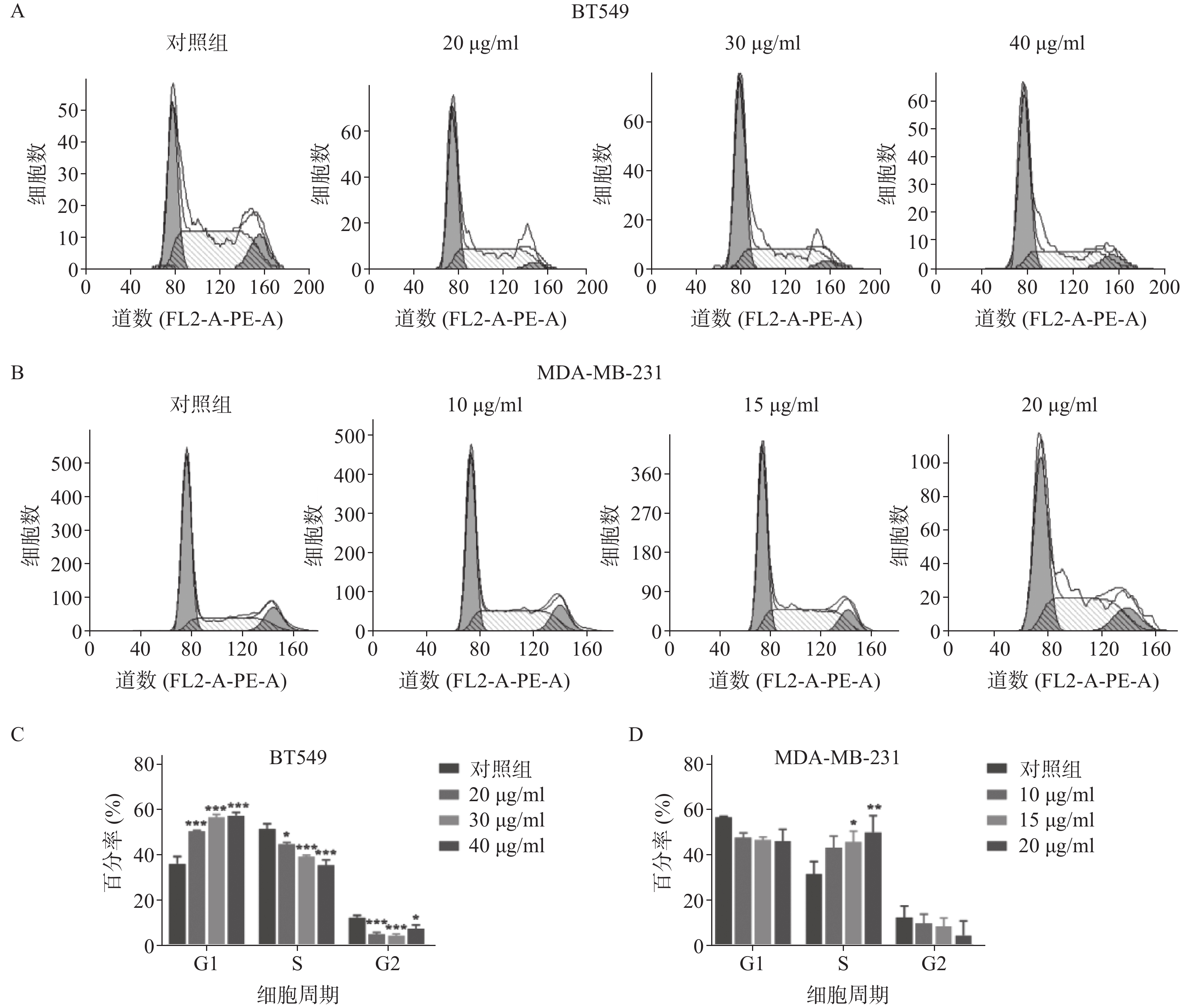
雀梅藤石油醚提取物孵育乳腺癌细胞24 h后,采用流式细胞仪测定细胞的增殖周期情况(见图2)。结果显示,药物明显阻滞两种乳腺癌细胞株的细胞周期,但对两种细胞阻滞周期不同,BT549细胞阻滞在G1期(图2A和2C,给药组G1期细胞比率较对照组显著升高),MDA-MA-231细胞阻滞在S期(图2B和2D,给药组S期细胞比率较对照组显著升高),提示石油醚提取物对两种细胞株的细胞周期阻滞可能存在不同机制。
-
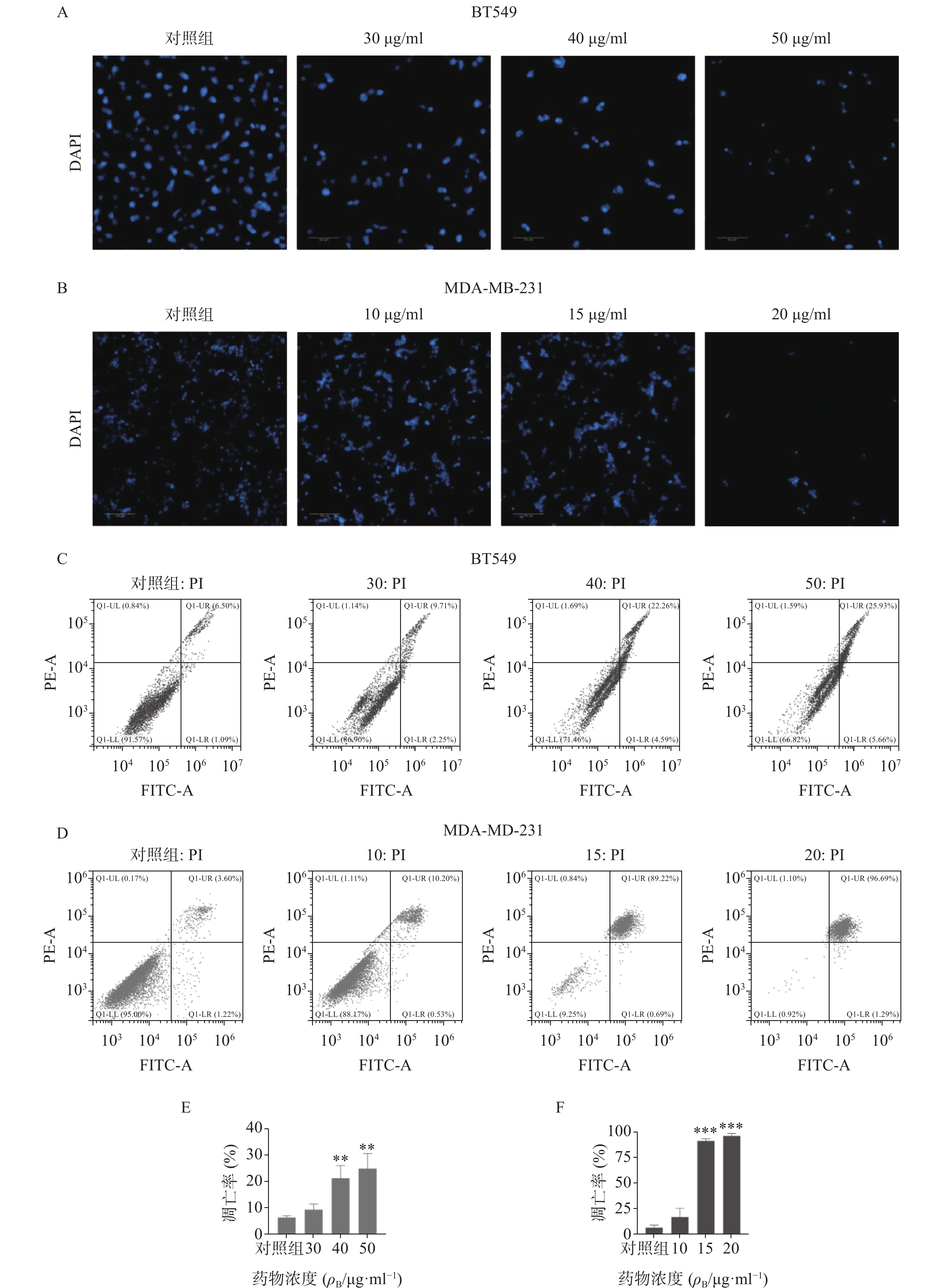
采用DAPI染色方法对细胞核形态进行分析(见图3)。如图3A-B所示,正常对照组乳腺癌细胞核呈均匀的圆形浅蓝色,药物处理后细胞核质固缩或碎裂成凋亡小体,且呈剂量依赖性。流式细胞仪凋亡定量分析显示(图3C-F),石油醚提取物显著增加两种乳腺癌细胞的凋亡率,与对照组比较有显著性差异,其中尤以MDA-MA-231细胞株明显,20 μg/ml浓度下几乎诱导细胞全部凋亡。
-
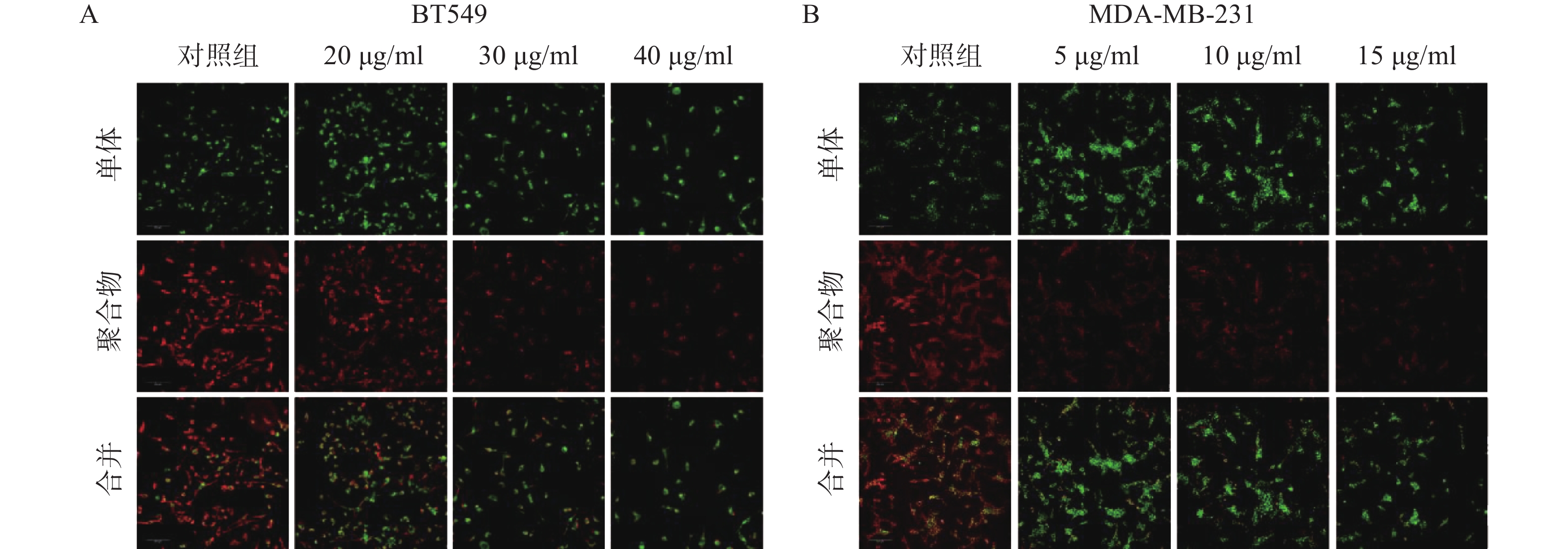
线粒体通路是肿瘤细胞最常见的凋亡途径,最典型的特征是线粒体膜电位(MMP)水平显著下降。因此,研究采用JC-1免疫荧光染色检测线粒体膜电位水平。结果如图4所示,给药组红色荧光随剂量增加明显减弱,绿色荧光则明显增强,说明给药组线粒体膜电位显著下降。实验结果提示,雀梅藤石油醚提取物可能通过损伤线粒体而促进了乳腺癌细胞凋亡。
-
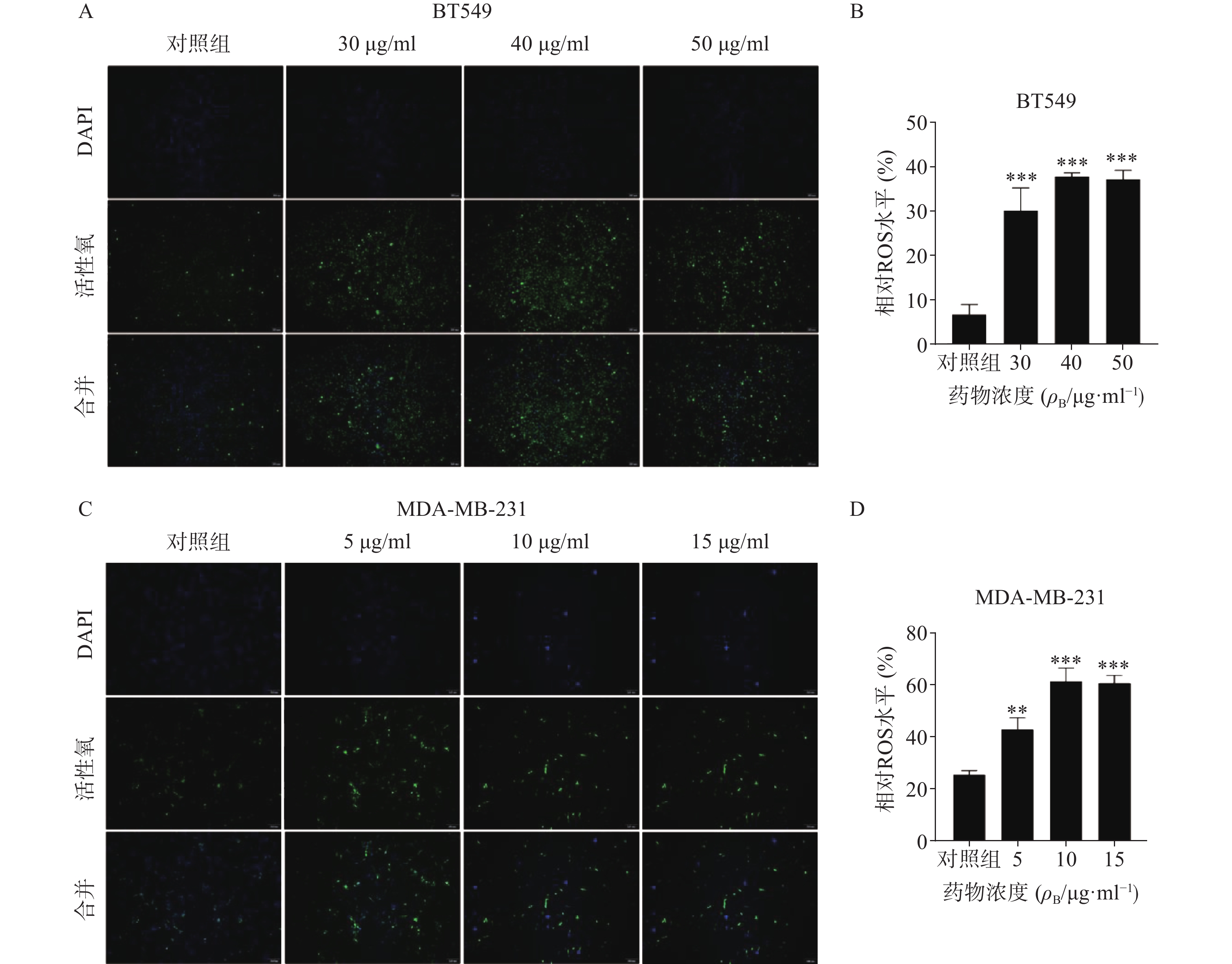
ROS升高是激活线粒体通路诱导肿瘤细胞凋亡的重要原因之一,因此进一步检测了药物处理24 h后ROS含量变化(图5)。结果代表ROS水平的绿色荧光在对照组仅有少量表达,而在给药组则显著增加,经统计学处理有显著性差异,其中尤以BT549细胞株明显,提示药物可能通过促进ROS生成而诱导了乳腺癌细胞凋亡。
-
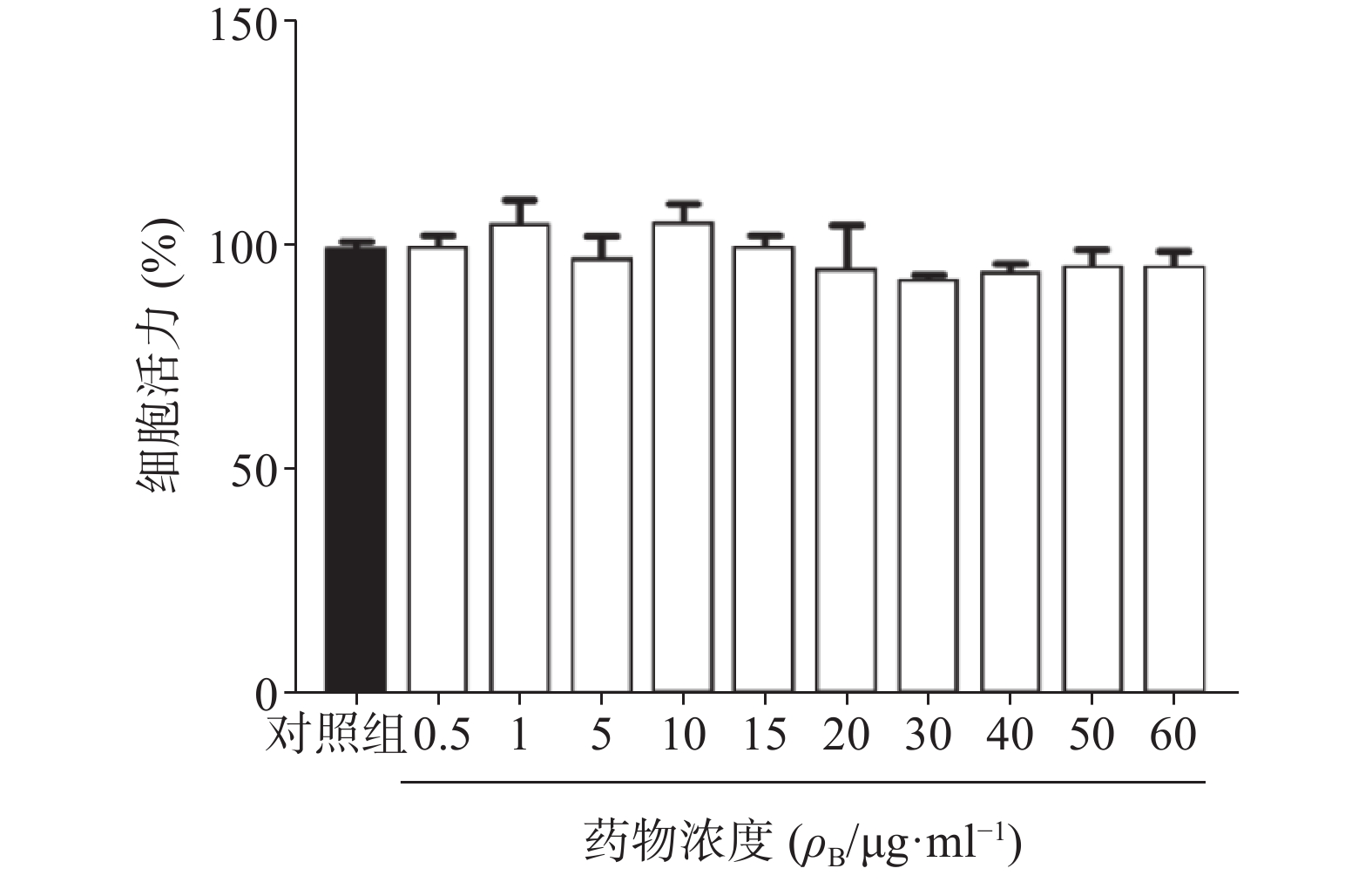
为了确定雀梅藤提取物是否对正常细胞产生毒性,进一步采用同样剂量对人正常脐静脉血管内皮细胞(HUVEC)进行CCK8细胞活力分析。结果提取物孵育24 h后,即使在60 μg/ml的最高浓度下亦未观察到内皮细胞活力受到影响,与对照组比较无明显差异(图6),提示雀梅藤石油醚提取物对正常细胞并不产生毒性,具有较好的安全性。
-
雀梅藤为云南等地民间常用中药,临床观察发现其对乳腺瘤生长有明显抑制作用[7],且毒性较小[4, 8]。研究前期对雀梅藤的乙醇、石油醚、乙酸乙酯、二氯甲烷、正丁醇等5个部位提取物进行了多种肿瘤细胞活性筛选,结果显示,对多数癌细胞,如乳腺癌、结肠癌、肝癌等,都具有明显杀伤作用,其中以石油醚部位提取物对癌细胞作用最为显著。进一步实验发现,雀梅藤石油醚提取物时间和剂量依赖地抑制乳腺癌细胞活力,显著减少细胞克隆形成率,阻滞细胞周期在G1/S期,明显增加癌细胞凋亡率,但并不影响正常血管内皮细胞活力,提示其细胞毒性具有明显的选择性。
引起细胞凋亡的途径包括线粒体通路、死亡受体通路和内质网应激通路,其中线粒体通路是药物诱导肿瘤细胞凋亡的最常见途径[9],因此研究人员进一步观察了雀梅藤石油醚提取物是否通过损伤线粒体诱导乳腺癌细胞凋亡。结果通过JC-1染色发现,两种乳腺癌细胞的线粒体膜电位均显著降低,提示雀梅藤提取物诱导了细胞线粒体途径的凋亡。
ROS的主要来源之一是线粒体内膜的呼吸链底物端,ROS升高会引起线粒体内膜损伤,造成细胞毒性,从而促进肿瘤细胞凋亡[10]。研究人员用荧光探针方法检测雀梅藤石油醚提取物孵育BT549和MDA-MB-231细胞后的ROS水平,结果发现代表ROS的绿色荧光逐渐增强,表明石油醚提取物显著升高了线粒体内ROS水平。这些结果提示,石油醚提取物可能通过升高线粒体内ROS水平,造成ROS累积,损伤了线粒体,导致线粒体内容物如细胞色素c等流出到细胞质,进而激活caspase级联瀑布反应,从而诱导了细胞凋亡[9,11]。
虽然雀梅藤提取物在体外研究中表现出较好的抗乳腺癌细胞生长作用,但是凋亡信号转导通路和作用靶点尚不明确,线粒体中蛋白表达的变化犹未可知,因此具体作用机制尚需进一步研究。此外,已有研究人员从雀梅藤药材中鉴定出43种化学成分,可分为有机酸类、黄酮类及其他类,有机酸类包括儿茶素及其衍生物等,黄酮类包括异槲皮素等[12]。但是雀梅藤提取物中究竟何种成分发挥主要抗癌作用仍需进一步证实。
Induction of apoptosis in triple-negative breast cancer cells by petroleum ether extract of Sageretia thea
doi: 10.12206/j.issn.2097-2024.202311055
- Received Date: 2023-11-29
- Accepted Date: 2024-05-13
- Rev Recd Date: 2024-04-17
- Available Online: 2024-06-24
- Publish Date: 2024-06-25
-
Key words:
- Sageretia thea /
- Breast cancer /
- Proliferation /
- Apoptosis /
- Mitochondrion /
- ROS
Abstract:
| Citation: | FENG Zhihui, DENG Yiqing, YE Bing, AN Pei, ZHANG Hong, ZHANG Haijun. Induction of apoptosis in triple-negative breast cancer cells by petroleum ether extract of Sageretia thea[J]. Journal of Pharmaceutical Practice and Service, 2024, 42(6): 253-259. doi: 10.12206/j.issn.2097-2024.202311055 |








 DownLoad:
DownLoad: