-
白蔹为葡萄科蛇葡萄属植物白蔹的干燥块根,首载于《神农本草经》。白蔹是最早用于疮痈、烫伤[1]治疗的药物,具有解毒、生肌的功效。资料显示,白蔹在皮肤创伤治疗中的使用频率较高。随着白蔹药理研究的不断深入,发现白蔹还具有抗菌、抗病毒[2-6]、免疫调节及促进溃疡快速愈合等作用。
在2015版《中国药典》中,白蔹的质量标准只有定性分析而无定量分析。白蔹成分检测中发现其含大黄素等蒽醌类活性成分[7],且白蔹中大黄素的定量测定方法文献资料[8-9]较少。本实验采用反相高效液相色谱法,建立白蔹药材中大黄素含量测定方法,为白蔹的质量控制标准提供方法和依据。
-
大黄素对照品(中国食品药品检定研究院,批号:110756-201512,经面积归一化法计算含量为99.1%);甲醇(烟台远东精细有限公司,批号:160706)为色谱纯,水为超纯水,磷酸(莱阳市双双化工有限公司,批号:2010246)为分析纯,硫酸(淄博市淄川区张庄化学试剂厂,批号:950626)为分析纯。白蔹饮片(安国市弘发中药材饮片有限公司,批号:131001),经淄博市中医院药品供应科主任魏星教授鉴定为葡萄科蛇葡萄属植物白蔹Ampelopsis japonica(Thunb.) Makino的干燥块根。
-
Lab Alliance PC 3000 高效液相色谱仪(美国科学系统公司),紫外检测器(北京普析通用仪器有限责任公司);LD310-2R电子天平(沈阳龙腾电子有限公司);FA/JA系列电子天平(上海上平仪器有限公司);RE-201D型恒温水浴锅、RE-201D型旋转蒸发器(郑州博科仪器设备有限公司);766-3型远红外快速干燥箱(江苏省南通县金余电器配件厂)。
-
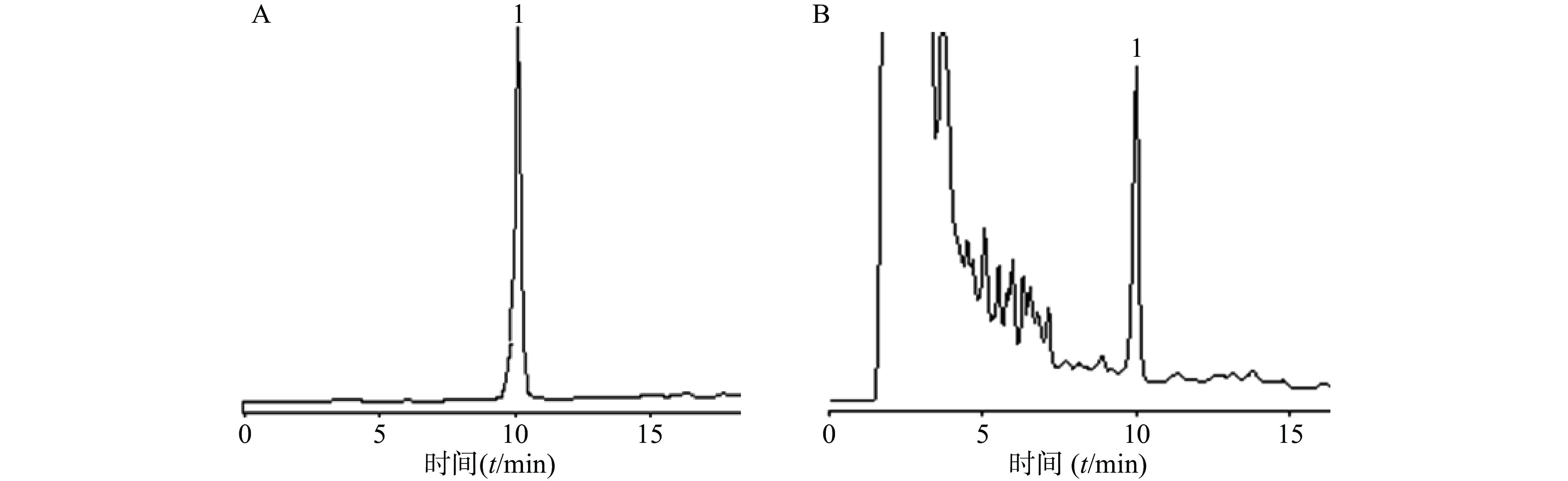
Apollo-C18色谱柱(4.6 mm×250 mm,5 μm);流动相为甲醇−0.2%磷酸溶液(85:15),流速1.0 ml/min,检测波长220 nm,进样量20 μl。在此条件下,大黄素与相邻色谱峰分离度良好,无干扰,理论塔板数为2 000。对照品与供试品色谱图见图1。
-
取大黄素对照品(含量为99.1%)约10 mg,精密称定,置于1 000 ml 容量瓶中,加甲醇溶解并稀释至刻度,摇匀,得浓度为9.91 μg /ml 的大黄素对照品储备液,备用。
-
取过5目筛的白蔹药材粉末,置烘箱内(70±2)℃,2 h烘干。精密称量30 g,用10倍量质量分数20%的硫酸在50 ℃条件下回流水解2 h。过滤,取滤渣。滤渣用纯化水洗至中性(pH=7),烘干。称其质量,记录。再以8倍量体积的95%乙醇在82 ℃条件下回流提取2次,每次1 h,过滤,合并乙醇提取液,减压蒸馏,浓缩至无醇味,加乙醇溶解并定容于10 ml容量瓶中,即得供试品溶液。
-
分别精密量取“2.2.1”项下制备的大黄素对照品溶液各125、250、500、1 000、2 000、4 000 μl,分别置10 ml容量瓶中,加甲醇稀释至刻度,配制成6种不同浓度的对照品溶液。依次精密吸取对照品溶液各20 μl注入高效液相色谱仪中,记录峰面积。以峰面积Y为纵坐标,对照品溶液浓度X为横坐标,进行线性回归,得回归方程为Y = 53 962X − 966. 46,r = 0.999 7;结果表明大黄素在0.124~3.968 μg/ml浓度范围内线性关系良好。
-
精密量取对照品溶液20 μl,按“2.1”项下色谱条件连续进样6次,测定峰面积。大黄素峰面积RSD为1.7%。仪器精密度良好,符合要求。
-
精密称取同一批号样品6份,按“2.2.2”项下方法平行制备样品溶液,在“2.1”项色谱条件下,分别进样,测定大黄素的峰面积,RSD为1.2%(n= 6),结果表明本方法重复性良好。
-
按“2.1”项下色谱条件,分别精密量取在室温(10~30 ℃)下放置0、2.5、5、7.5、10、24 h的同一份供试品溶液各20 μl进样测定,记录大黄素的峰面积,6次进样结果表明,供试品溶液在24 h内基本稳定,RSD为1.5%。
-
取同一批次(批号:20170704)已知含量的白蔹药材样品9份,分别按相当于样品溶液中大黄素含量的80%(n=3)、100%(n=3)、120%(n=3)加入“2.3.1”项下制备的对照品溶液,按“2.2”项下色谱条件进行测定。计算回收率,结果见表1。
表 1 白蔹药材样品加样回收率试验结果
样品含有量(m/mg) 加样量(m/mg) 测得量(m/mg) 回收率(%) 平均回收率(%) RSD
(%)0.225 0.180 0.399 96.7 99.7 2.5 0.225 0.180 0.403 98.9 0.225 0.180 0.409 102.0 0.225 0.225 0.446 98.2 0.225 0.225 0.458 103.6 0.225 0.225 0.447 98.7 0.225 0.270 0.503 103.0 0.225 0.270 0.494 99.6 0.225 0.270 0.487 97.0 -
取不同批次白蔹药材样品,分别按“2.3.2”项下方法制备样品溶液,按“2.2”项下色谱条件测定峰面积,连续进样3次,以外标法计算含量,测定结果见表2。
表 2 白蔹样品大黄素含量测定结果(n=3)
批号 含量(μg/g) RSD(%) 20170622 17.845 1.16 20170626 19.113 2.07 20170704 15.002 2.50 -
笔者所查文献[8-10]中,测量大黄素所用波长有254、290 nm等。通过实验发现,不同的波长影响其重现性及灵敏度。通过对大黄素标准品甲醇溶液全波段(200~400 nm)紫外扫描可见:其在220、254、260、272、278 nm处均具有特征吸收。通过综合比较上述波长处大黄素峰的峰形及峰面积,220 nm处波长的峰形较好、干扰少、峰面积较大,故选定220 nm作为白蔹药材中大黄素的测定波长。
-
大黄素的化学名为1'3'8-三羟基-6-甲基蒽醌,具有一定的极性和酸性。所查文献中,大黄素含量测定的流动相体系有多种。在实验过程中发现,流动相对色谱峰的保留时间及分离度有较大影响。故本实验在选择流动相时,考察了不同比例的甲醇-水,乙腈-水,甲醇:0.1%磷酸溶液[8-10],甲醇:0.5%磷酸溶液[11],甲醇:0.2%磷酸溶液,甲醇:0.02%磷酸溶液,甲醇:1% 冰醋酸[12]等不同溶剂系统,结果表明,相同条件下,甲醇:0.2%磷酸溶液(85:15)为流动相时,可以达到基线分离,出峰时间较短,峰形较好。
-
在流动相及波长选定的条件下,考察了不同流速(0.5~2.0 ml/min)对出峰时间的影响,当流速小于1.0 ml/min时,保留时间延长,使流动相的用量增加,会造成试剂的浪费;当流速大于1.0 ml/min时,保留时间缩短,但大黄素的峰会与杂质峰产生重叠,影响分离度及重现性。本实验选择1.0 ml/min作为流速。
在样品浓度一定的条件下,考察了不同进样体积(10~30 μl)的影响。实验结果表明,进样体积小于20 μl时,重现性及灵敏度均下降;大于20 μl时,杂质峰明显。当进样量为20 μl时,峰的对称性得到保证。因此,本实验选择20 μl为进样量。
-
已有文献[8]对白蔹中大黄素的提取方法采用甲醇提取及三氯甲烷萃取法。通过实验发现这种方法稳定性差、步骤烦琐,且所用试剂毒性较大。本实验在上述提取方法的基础上,参照大黄药材中大黄素的提取方法[10],通过4因素(粒度、溶剂剂量、溶剂浓度、提取时间)3水平的正交设计确定了白蔹中大黄素的提取方法。结果表明,采用过5目筛的白蔹粉末,先用20%的硫酸在50 ℃条件下回流酸水解2 h,滤渣用纯化水洗至中性。再用8倍量体积的95%乙醇,水浴回流2 h能够达到较好的提取效果。白蔹中含大黄素等游离蒽醌,还含有结合型蒽醌[13-14]。先进行酸水解,使结合型蒽醌水解,结果大黄素的含量有所提高。白蔹具有的抗菌性与其中的大黄素[15-16]有关,大黄素是白蔹的活性成分。本提取方法克服了以往相关文献报道方法的不足,分离度好、重现性好、结果准确,因此大黄素作为白蔹药材中指标成分有一定可行性,为完善白蔹药材的质量控制标准提供了方法和依据。新药临床试验的质量是药品上市后安全、有效的保障[17],所以临床试验过程中的质量控制尤为重要。包括相似性评价(外观检测和观感评估测试)、安全性评价(常规安全性检测)、适用性评价(薄层鉴别、HPLC、指标成分测定和药理实验)和最终制剂的质量标准。临床试验过程中的质量控制所要评价的范围更广、要求更为严格,是为了确保临床数据的真实、准确、完整和可靠,为下一步临床应用提供依据,对提高医疗水平具有重大意义。
Emodin assay in Ampelopsis radix by RP-HPLC
-
摘要:
目的 建立白蔹药材中大黄素含量的测定方法,为完善白蔹药材的质量控制标准提供方法和依据。 方法 采用反相高效液相色谱法,色谱柱:Apollo-C18柱(4.6 mm×250 mm,5 μm);流动相:甲醇-0.2%磷酸(85:15);流速:1.0 ml/min;柱温:室温;检测波长:220 nm。 结果 在选定的色谱条件下,白蔹药材中大黄素在0.124~3.968 μg/ml范围内线性关系良好,直线回归方程为Y=53 962X–966.46,r=0.999 7,平均回收率为99.7%,RSD为2.5%(n=9)。 结论 该方法所测结果准确、灵敏度高、重现性好,适用于白蔹药材中大黄素的含量测定。 Abstract:Objective To establish a method for Emodin assay in Ampelopsis radix, and to improve the quality control of Ampelopsis radix. Methods Reversed phase high performance liquid chromatography was used. The column: Apollo-C18 (4.6 mm×250 mm, 5 μm); mobile phase: methanol:0.2% phosphoric acid (85:15); flow rate: 1.0 ml/min; column temperature: room temperature; detection wavelength: 220 nm. Results With the specified chromatographic conditions, there was a good linear relationship for Emodin in Ampelopsis radix in the range of 0.124-3.968 μg/ml. The linear regression equation was Y= 53 962X–966.46, r=0.999 7. The average recovery was 99.7%. RSD=2.5% (n=9). Conclusion This method is accurate, sensitive and repeatable. It is suitable for the determination of emodin in Ampelopsis radix. -
Key words:
- Ampelopsis radix /
- emodin /
- HPLC
-
侵袭性念珠菌病(invasive candidiasis)是院内血液感染的第四大原因[1]。由于各类疾病导致的免疫力低下病人增多,光滑念珠菌(Candida glabrata)的感染率逐年递增,引起败血症的数量也随之增加。除白念珠菌外,光滑念珠菌已成为部分国家和地区侵袭性感染中第二常见的念珠菌种类[2]。光滑念珠菌是一种条件致病菌,它广泛存在于自然界,也在人体皮肤黏膜、消化道寄生。当人体免疫功能降低或皮肤黏膜环境发生改变时,光滑念珠菌即可大量繁殖,引起深部脏器感染。与其他念珠菌相比,光滑念珠菌对于抗真菌药物显著耐受[3],它可以在抗真菌治疗过程中迅速产生耐药性,最终导致治疗失败[4-5]。我国侵袭性真菌耐药监测网(CHIF-NET)2020年统计结果显示,临床常用抗真菌药物氟康唑和伏立康唑对光滑念珠菌的最低抑菌浓度(MIC90)分别32 μg/ml和1 μg/ml。目前治疗光滑念珠菌的药物主要包括广谱三唑类、棘白菌素类以及多烯类抗真菌药。本文对光滑念珠菌的耐药机制进行综述。
1. 对唑类药物的耐药机制
1.1 麦角甾醇合成通路中基因改变
针对念珠菌属使用最广泛的药物当属唑类抗真菌药物。唑类药物通过作用14ɑ-去甲基化酶系统中的细胞色素P450,使环上氮原子与P450的血红素铁结合,阻碍麦角甾醇生物合成,同时致使其合成前体24-甲烯二氢羊毛甾醇累积,从而使念珠菌细胞膜损伤。麦角甾醇是保证念珠菌细胞膜稳定和流动性的重要成分,而ERG11编码的羊毛甾醇14ɑ-去甲基化酶作为关键酶,催化羊毛甾醇生成麦角甾醇。唑类药物通过结合14ɑ-去甲基化酶,阻碍催化过程,而麦角甾醇不足最终导致细胞膜结构改变,念珠菌增殖减少。
1.1.1 ERG11基因突变
ERG11基因突变导致唑类药物作用靶酶羊毛甾醇14ɑ-去甲基化酶的结构发生变化,其与唑类药物的结合位点消失,无法结合,从而产生耐药性。Hull等[6]在临床耐药分离株中发现ERG11基因G315D突变位点,这导致菌株对唑类药物敏感性降低。Zhang等[7]在念珠菌血流分离株中发现6株光滑念珠菌耐药株,并在其中2株中检测到ERG11基因I166S突变位点,其他4株耐药株并未出现ERG11基因的突变,但仍能产生耐药。由此推测,ERG11基因突变或许不能作为光滑念珠菌耐药的主要原因。
1.1.2 ERG11基因高表达
ERG11基因高表达导致唑类药物的靶酶生成增加,药物无法完全抑制靶酶活性。Upc2A和Rpn4是光滑念珠菌ERG11表达的关键调节因子,RPN4与UPC2A的基因突变是ERG11高表达的主要原因[8-9]。Wang等[10]研究2株耐药分离株,其中1株的CDR1和ERG11高表达,而另1株只有CDR1高表达,尽管验证ERG11高表达确实会导致光滑念珠菌产生耐药,但由于耐药株均存在CDR1高表达,因而ERG11高表达不能作为光滑念珠菌耐药的唯一原因。
1.1.3 AUS1基因高表达
当麦角甾醇生物合成在缺氧或由于甾醇合成缺陷而受到抑制时,甾醇流入转运蛋白基因(AUS1和TIR3)和麦角甾醇生物合成通路中相关基因(ERG2、ERG3、ERG6等)在真菌细胞中表达明显上调。在低氧条件或唑类作用下,细胞中的AUS1表达增加,通过输入外源性胆固醇和麦角甾醇,可使光滑念珠菌得以存活[11]。
1.2 药物外排增强
与其他念珠菌不同,光滑念珠菌细胞膜上与耐药性相关的外排泵主要是ABC转运蛋白家族(由念珠菌耐药性CDR1、CDR2、SNQ2基因编码),这类外排泵通过水解ATP获得能量,并通过细胞膜主动外排药物。
1.2.1 ABC转运蛋白家族表达增加
CDR1、CDR2及SNQ2基因高表达导致光滑念珠菌内药物被快速排出,从而对唑类药物产生耐药性。Zhang等[6]在念珠菌血流分离株中发现,光滑念珠菌耐药分离株的CDR1、CDR2基因表达显著增加。Wang等[10]研究两株耐药分离株,发现CDR1基因均高表达。有研究发现[12],CDR1、CDR2在16种耐药分离株中分别有12及8株高表达,且其中有4株耐药株CDR1、CDR2同时高表达;而有8株耐药株SNQ2表达仅相对升高,这可能说明SNQ2没有单独表达或并非主要外排泵,表明这些ABC转运蛋白之间可能存在相互作用。
1.2.2 PDR1基因突变
PDR1是ABC转运蛋白家族的上游调节基因。研究发现,Pdr1和Pdr3是酿酒酵母中两种密切相关的蛋白同系物,作用与光滑念珠菌中的Pdr1相似。Yao[13]等在耐药菌株中发现PDR1中的新错义突变位点A848V。Khakhina [14]等发现光滑念珠菌PDR1的作用是酿酒酵母PDR1和PDR3自调节转录作用的结合,PDR1自调节在光滑念珠菌耐药性产生中起重要作用。PDR1基因的功能获得性突变(GOF),会导致CDR1表达上调。Hou[15]等对PDR1多态性进行研究,发现唑类耐药分离株的PDR1多态性比率(14个中的13个,92.9%)明显高于唑类敏感分离株(144个中的28个,19.4%)。
1.3 DNA错配修复系统缺陷
真菌耐药性产生大多缘于基因突变。DNA错配修复(MMR)系统纠正DNA聚合酶在DNA复制过程中产生的错误,以及修复由环境因素或内源性因素引起的DNA损伤。MSH2为该修复系统的关键基因之一。
Healey[16]等发现有55%携带MSH2功能丧失的突变(LOF),导致体外和体内抗真菌药物耐药性的加速出现,这些突变在氟康唑处理后更为常见。但也有研究表明MSH2序列与氟康唑耐药性或基因型增加之间无明确关联,在这些研究中MSH2被认为是光滑念珠菌的管家基因,即该基因的多态性可能与遗传复合物的差异有关,而与抗真菌药物耐药性不直接相关[15,17]。尽管如此,不能否认MSH2功能丧失的突变引起错误的不匹配修复,进而参与真菌耐药性的发展,其相关性仍有待进一步研究。
2. 对棘白菌素类药物的耐药机制
β-葡聚糖是念珠菌细胞壁的基本成分,棘白菌素类药物通过抑制β-1,3-葡聚糖的合成,对念珠菌属发挥杀真菌活性。
多项研究表明,FKS基因突变导致其结合位点改变是棘白菌素耐药性产生的主要原因。Wang[10]等研究2株耐药分离株,对FKS测序显示,2种分离株在FKS2中都含有S663P突变且存在4个单核苷酸多态性(SNP),而FKS1则无突变。同时,FKS1和FKS2的表达均上调。Al-Baqsami[18]等在5种耐米卡芬净的分离株中,发现4株分离株FKS2含有非同义(S663P)突变,1株分离株含有FKS2热点-1(HS1)中的三核苷酸缺失(对应于F659;ΔF659)。Pham[19]等在1037株耐棘白菌素光滑念珠菌中进行FKS测序,检测出47株具有FKS突变。其中,检测出12种独特的突变:FKS1中的5种(15株)和FKS2中的7种(35株)。所有突变都发生在HS1中,没有检测到HS2突变。通过以上研究结果,可推测影响光滑念珠菌对棘白菌素易感性的大多数突变位于FKS1 HS1和FKS2 HS1区域,且FKS2的突变多于FKS1。
3. 对多烯类药物的耐药机制
多烯类药物是广泛运用于临床的抗真菌感染的广谱抗菌药。两性霉素B是多烯类的代表药物,通过结合念珠菌细胞膜上的麦角甾醇,形成孔道,以改变念珠菌细胞膜通透性从而使念珠菌死亡。
3.1 自身合成替代甾醇
真菌能够自身合成甾醇中间体完成代谢,但麦角甾醇缺乏,导致两性霉素B无作用靶点。Hull等[6]在多种临床耐药分离株中发现CG156分离株内仅可检测到14α-甲基化甾醇中间体这一种甾醇,即这种分离株内缺乏麦角甾醇,但该耐药株仍可以在没有外源性供应甾醇的情况下,用14α-甲基化甾醇中间体合成细胞所需的甾醇。
3.2 麦角甾醇生物合成基因突变
由ERG6中密码子Tyr192、Trp286或Leu341无义突变导致Erg6蛋白的过早终止;由ERG2中含有的G122S和G119S无义突变导致Erg2蛋白功能受损,最终均导致突变株细胞膜缺乏麦角甾醇,进而破坏细胞膜通透性和流动性[20-23]。
4. 小结
综上所述,光滑念珠菌作为临床上较为重要的致病菌之一,由于抗真菌药物种类有限,临床应用重复率高,导致的耐药问题日益严重。因此,一方面需要临床合理用药、联合用药,尽量避免耐药性的产生;另一方面,需要研发新型抗真菌药物。有研究表明[24-28],阿魏酸与卡泊芬净,薄荷醇、百里酚、替加环素、绒毛钩藤不溶性成分与唑类药物的协同作用,通过损伤念珠菌生物被膜等方式,可以有效降低唑类耐药菌的MIC。也有研究开辟新的思路,寻找新的药物靶点:合成的铋纳米颗粒可以潜在地用于改善氧化应激和各种微生物感染,对念珠菌病病例有强大抗真菌能力[29];4种双鸟胍衍生物(BG1-BG4)对光滑念珠菌和白念珠菌的MIC在2~15.6 μg/ml之间,其中BG3作用于DNA,扰乱复制转录过程,导致在细胞质膜外层的磷脂酰丝氨酸暴露,半胱氨酸蛋白酶活化,促进真菌细胞凋亡[30]。药物研发和探索是漫长的过程,需要一代代人的验证和实践,但可以预见,在不久的将来,这些药物最终会有一部分应用于临床实践中,为缓解临床耐药问题提供新的选择。
-
表 1 白蔹药材样品加样回收率试验结果
样品含有量(m/mg) 加样量(m/mg) 测得量(m/mg) 回收率(%) 平均回收率(%) RSD
(%)0.225 0.180 0.399 96.7 99.7 2.5 0.225 0.180 0.403 98.9 0.225 0.180 0.409 102.0 0.225 0.225 0.446 98.2 0.225 0.225 0.458 103.6 0.225 0.225 0.447 98.7 0.225 0.270 0.503 103.0 0.225 0.270 0.494 99.6 0.225 0.270 0.487 97.0 表 2 白蔹样品大黄素含量测定结果(n=3)
批号 含量(μg/g) RSD(%) 20170622 17.845 1.16 20170626 19.113 2.07 20170704 15.002 2.50 -
[1] 俞琦, 蔡琨, 田维毅. 白蔹醇提取物可影响免疫功能[J]. 中国医药报, 2005, 5(7):20-21. [2] 贾敏, 张寒. 白蔹、乌头单用及合用对人胃腺癌细胞SGC-7901增殖、凋亡的影响[J]. 现代中西医结合杂志, 2011, 20(27):3388-3390. doi: 10.3969/j.issn.1008-8849.2011.27.004 [3] 杭佳, 张梦美, 叶晓川, 等. 白蔹药效成分没食子酸抑制人肝癌HepG2 细胞生长及作用机制研究[J]. 中国实验方剂学杂志, 2013, 19(1):291-295. [4] 张梦美, 叶晓川, 黄必胜, 等. 白蔹抗肿瘤活性部位的筛选研究[J]. 湖北中医药大学学报, 2012, 14(2):40-42. doi: 10.3969/j.issn.1008-987x.2012.02.16 [5] 张波, 周芳亮, 卢芳国, 等. 96种中药材对流感病毒神经氨酸酶活性的影响[J]. 中华中医药杂志, 2014, 29(9):2788-2792. [6] 朱长俊, 朱红薇. 白蔹正丁醇提取物抗菌作用研究[J]. 中国民族民间医药杂志, 2011, 20(1):67-68. [7] 赫军, 羡冀, 宋莹莹, 等. 白蔹化学成分的研究[J]. 沈阳药科大学学报, 2008, 25(8):636-638. [8] 陈爱军, 刘运美, 曾雷, 等. 反相高效液相色谱法测定白蔹药材中大黄素的含量[J]. 湖南中医杂志, 2014, 30(12):147-148. [9] 汪兴军, 张寒, 王娜娜. 高效液相色谱法检测白蔹中大黄素的含量[J]. 中国药师, 2011, 14(8):1235-1236. doi: 10.3969/j.issn.1008-049X.2011.08.069 [10] 杨世颖, 刘淑聪, 杜冠华, 等. 大黄中药材及其醇、水提取物中大黄素成分分析标准物质研究[J]. 中国中药杂志, 2016, 41(3):456-462. [11] 汤丽昌. 保健食品逢泰胶囊中大黄素和大黄酚的含量测定[J]. 食品安全导刊, 2019(31):62-63. [12] 贾文江, 李春, 曹望弟, 等. 商洛野生牛耳大黄中 3 种成分含量测定及影响因素研究[J]. 中国药业, 2019, 28(22):13-15. doi: 10.3969/j.issn.1006-4931.2019.22.005 [13] 赫军, 畅晓兵, 杨旭, 等. 白蔹化学成分(II)[J]. 沈阳药科大学学报, 2009, 26(3):188-190. [14] 梁国华. HPLC法测定舒痔丸中大黄素与大黄酚的含量[J]. 中国药师, 2010, 13(1):66-68. doi: 10.3969/j.issn.1008-049X.2010.01.028 [15] 沈爱娟, 蔡宛如. 大黄素抗炎作用及对急性肺损伤治疗作用研究进展[J]. 浙江中医药大学学报, 2013, 37(10):1261-1264. doi: 10.3969/j.issn.1005-5509.2013.10.040 [16] 陈海龙, 杨晓燕. 大黄素治疗脓毒症的研究进展[J]. 山东中医杂志, 2018, 37(5):435-438. [17] 陈舒茵, 梁春才, 韦斌, 等. 谈药物临床试验的质量控制[J]. 中国医药导报, 2011, 8(31):154-156. doi: 10.3969/j.issn.1673-7210.2011.31.065 -





 下载:
下载:


