-
超多孔水凝胶(SPF)是一种三维结构的亲水性高分子聚合网格,在水中能够溶胀但不溶解,且因其具有良好的生物相容及生物可降解性,被广泛应用于医学、药学等领域。与传统水凝胶相比,超多孔水凝胶通过致孔剂、模板等方法调整孔隙率,从而改变溶胀速率以及释药速率[1-3]。胰岛素等生物大分子类药物不仅体内稳定性差、易被酶解、生物半衰期短、不易透过生理屏障,故现有给药方式多以注射为主,患者依从性差[4]。有研究显示[5],超多孔水凝胶承载胰岛素灌胃后可以显著降低大鼠血糖:给药2 h后血糖显著下降,4~6 h降至最低,但12 h即回至最初血糖的80%,说明该制剂起效快但持续时间短,血糖波动大,需频繁给药,患者依从性差。上述情况,结合胃肠道对胰岛素的灭活等原因,本实验拟合成具有缓释作用的聚(丙烯酸-丙烯酰胺)/O-羧甲基壳聚糖[P(AA-co-AM)/O-CMC]互穿网络聚合物超多孔水凝胶(SPH-IPN),以期通过皮下给药包载胰岛素的SPH-IPN后,实现长效、减小血糖波动的目的。
-
丙烯酰胺(AM)、丙烯酸(AA)、N,N′-亚甲基-双丙烯酸胺(Bis)、过硫酸铵(APS)、N,N,N′,N′-四甲基乙二胺(TEMED)均购自上海阿拉丁生化科技股份有限公司;泊洛沙姆127(PF127,北京化工厂);O-羧甲基壳聚糖(O-CMC,大连美仑生物技术有限公司);戊二醛(GA,上海阿拉丁生化科技股份有限公司);姜黄素(宝鸡国康生物科技有限公司);牛胰岛素(上海源叶生物有限公司);十二烷基硫酸钠(SDS)、乙二胺四乙酸二钠(EDTA)、碳酸氢钠、盐酸、乙醇、甲醇、乙酸乙酯、氢氧化钠均为分析纯,实验用水为去离子水。
-
85-2型恒温磁力搅拌器(上海司乐仪器有限公司);恒温水浴锅(余姚市东方电工仪器厂);透析袋(Viskase,美国);Nicolet iS50傅里叶变换红外光谱仪(Thermo,美国);AVANCE III 400核磁共振谱仪(Bruker,德国);FE28型pH计(Mettler Toledo,美国);Waters UPLC:二元溶剂管理系统、在线脱气机、自动进样器、PDA检测器(Waters公司,美国);TTL-DC型多功能氮吹仪(北京同泰联科技发展有限公司);SHA-B双功能恒温水浴振荡器(常州金坛良友仪器有限公司)。
-
雄性SD大鼠,体重范围(220±20)g,合格证号:SCXK(京)2017-0002,购自北京斯贝福实验动物科技有限公司,饲养于北京中医药大学动物房。
-
依次向西林瓶中加入50% AM和AA溶液,以10 mol/L NaOH调节pH至5.0。随后再加入2.5% Bis溶液、10% PF 127溶液、20%APS溶液和50 μl 16.7% TEMED溶液,磁力搅拌混匀。室温放置15 min后,逐滴加入 6% O-CMC溶液,使溶液中O-CMC/单体比(w/w)为0.144,迅速加入NaHCO3粉末,搅拌约20 s使其产生气泡,将其置于40 ℃水浴加热5 min,室温固化30 min,即得半互穿网络水凝胶(semi-IPN)。将所得semi-IPN置于GA/O-CMC比(w/w)为2∶10的GA溶液(用0.2 mol/L的盐酸溶液调节pH至1.0)中至将其吸干,室温放置1 h,得粗P(AA-co-AM)/O-CMC超多孔水凝胶(SPH-IPN)。将SPH-IPN置于0.1 mol/L盐酸溶液中,透析5 d,无水乙醇中脱水透析2 d,30 ℃烘干至恒重,干燥密闭保存,即得纯化后的SPH-IPN。
-
将样品充分干燥,KBr压片法制样,使用傅里叶变换红外光谱仪测定500~4 000 cm−1波数的SPH-IPN的IR谱。将样品置于氧化锆样品管(A=4 mm),转速5 000 Hz,固体碳谱测定。
-
取干燥的SPH-IPN,室温下浸于过量水中(pH 7.0),于不同时间点用筛网取出SPH-IPN,吸去表面残余水后称重,根据以下公式计算SPH-IPN在不同时间点的溶胀比(QS):
$$ {Q_{\rm{S}}} = \frac{{{W_{\rm{S}}} - {W_{\rm{d}}}}}{{{W_{\rm{d}}}}} $$ 其中,WS为溶胀后SPH-IPN质量(g);Wd为干SPH-IPN质量(g)。
-
采用乙醇替代法测定SPH-IPN的孔隙率[6]。取干燥的SPH-IPN,置无水乙醇中浸泡12 h,取出后吸去表面残余乙醇,称重,根据以下公式计算孔隙率:
$$ {\text{孔隙率}}=\frac{{M}_{2}-{M}_{1}}{\rho V}\times 100\;\text{%}$$ 其中,M1为干SPH-IPN质量(g);M2为乙醇浸泡后的SPH-IPN质量(g);ρ为乙醇密度(g/cm),V为SPH-IPN体积(cm3,以游标卡尺测量长方体SPH-IPN的长、宽、高后计算而得)。
-
取胰岛素15 mg,精密称定,置10 ml量瓶中,加0.1 mol/L pH 7.4 PBS溶解并定容至刻度,得1.5 mg/ml的胰岛素溶液。称取50 mg SPH-IPN置装有10 ml胰岛素溶液的西林瓶中,37 ℃温浴放置2 h,取出,置烘箱内,30 ℃恒温干燥。
-
取胰岛素SPH-IPN适量,研磨粉碎,取20 mg,精密称定,置10 ml量瓶中,加入0.1 mol/L pH 7.4 PBS,定容至刻度。37 ℃温浴2 h,超声10 min,精密量取上清液20 μl注入HPLC仪,记录色谱图,计算胰岛素含量,并根据以下公式计算载药量:
$$ {\text{载药量}}(\%)=\frac{cV}{M}\times 100$$ 其中,c为测得胰岛素的浓度(mg/ml),V为量瓶体积(ml),M为SPH-IPN的质量(mg)。
-
按“2.5.1”项下方法制备载胰岛素SPH-IPN,采用冷冻干燥法将其冻干即得含胰岛素的冻干SPH-IPN。称取空白凝胶200 mg置于1.5 mg/ml的胰岛素溶液37 ℃中溶胀2 h,备用,即得含胰岛素的预溶胀SPH-IPN。
-
给大鼠喂食高脂饲料(88.8%基础饲料、1%胆固醇、10%猪油和 0.2%胆盐[7])喂养4周,动物自由进食和饮水,每周记录体重。于喂养的第28天晚禁食,在第29天一次性腹腔注射链脲佐菌素(STZ)35 mg/kg,将一次性注射STZ 3 d后大鼠空腹血糖≥11.1 mmol/L或随机血糖≥16.7 mmol/L作为成模标准[8]。对照组大鼠则腹腔注射无菌生理盐水(0.3 ml/100 g)。注意测血糖前应禁食12 h,空腹测血糖。造模期间要防止感染,注意消毒。未造模成功的大鼠再次注射STZ35 mg/kg,3 d后测血糖验证是否造模成功。
-
取糖尿病大鼠12只,按随机数字表分为2组,即模型1组和模型2组;取正常大鼠12只,按随机数字表分为2组,即正常1组和正常2组。模型组1组和正常1组皮下埋植含胰岛素的预溶胀SPH-IPN,模型2组和正常2组皮下埋植含胰岛素的冻干SPH-IPN。给药后分别于1、2、4、6、8、10、12、24、28、32、36、48、60、72 h不同时间间隔大鼠尾部取血0.02 ml,用血糖仪测定血糖值,考察不同时间血糖值的变化情况。
-
图1为SPH-IPN的FTIR图。在1 651 cm−1处有-COOH的伸缩振动峰,且1 615 cm−1附近无AA和AM的C=C双键吸收峰,说明已聚合成P(AA-co-AM),SPH-IPN中存在P(AA-co-AM),图中3 335和2 922 cm-1处分别为-O-H和-C-H的伸缩振动峰;1 604和1 416 cm−1处分别为羧酸盐-COO-的反对称伸缩振动峰和对称伸缩振动峰;1 086、1 044和1 171 cm−1处分别为O-CMC中糖环羟基-CH-OH、一级羟基-CH2-OH和醚基C-O-C中的C-O伸缩振动峰。以上结果表明SPH-IPN中存在P(AA-co-AM),还存在的一些杂峰可能是还有一些未反应单体未被除尽。
-
图2为SPH-IPN的13C-NMR图。图中41.926×10−6为P(AA-co-AM)上主链碳原子的化学位移峰;179.499处为羧基碳原子的化学位移峰,说明结构中含有羧基官能团,AA与AM已聚合形成P(AA-co-AM)。
由于制得的水凝胶未找到合适的溶液将其溶解,因此在测定核磁共振图谱时,采用的是固体核磁技术[9]。
综合红外和碳谱结果可知,通过该方法可聚合形成P(AA-co-AM)结构,而该结构又是超多孔水凝胶SPH-IPN的主要结构,由此可说明已成功聚合SPH-IPN。
-
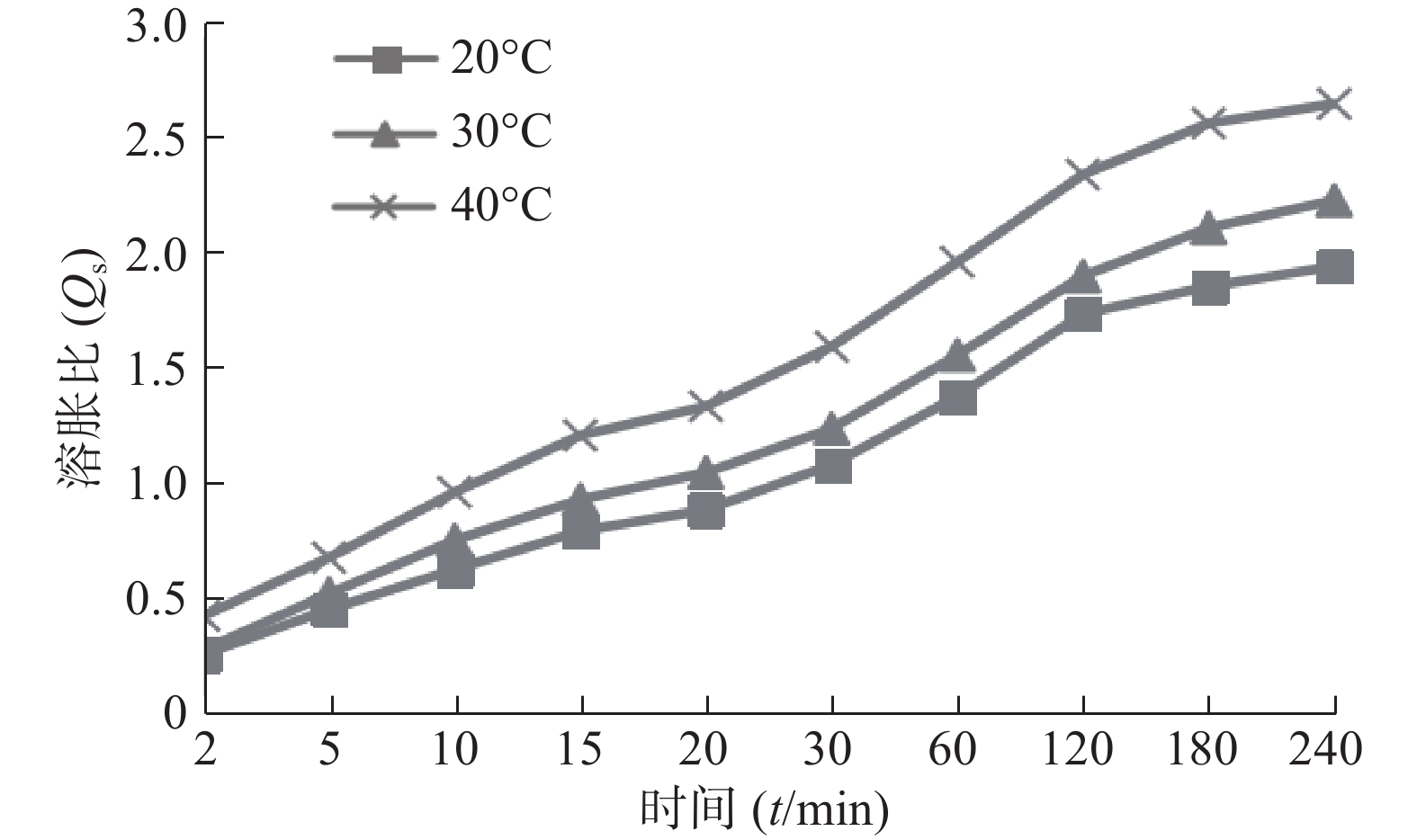
图3为不同温度介质中SPH-IPN的溶胀曲线,可见随着温度升高,SPH-IPN的溶胀速率加快,平衡溶胀比增大,原因是温度较高时相互缠绕的聚合物链松开,破坏分子间的氢键,增加链运动,水分子在凝胶骨架内外的扩散速率加快,从而促进了聚合物的溶胀[10]。
-
表1为SPH-IPN孔隙率测定结果,所制SPH-IPN超多孔水凝胶空隙分布均匀。除此之外,与传统水凝胶相比[11],孔隙率高,更利于药物的释放。
表 1 SPH-IPN的孔隙率测定结果
干重M1
(m/g)湿重M2
(m/g)乙醇密度
(g/cm3)体积
(V/cm3)孔隙率
(%)平均值
(%)RSD
(%)0.5425 0.6327 0.816 0.13 85.03 81.63 3.88 0.5751 0.6779 0.816 0.16 78.74 0.5628 0.6621 0.816 0.15 81.13 -
37 ℃时SPH-IPN溶胀比较大,温度过高易引起胰岛素变性,故选择37 ℃温度载药,胰岛素的载药量试验结果见表2。
表 2 SPH-IPN对胰岛素的载药量
试验组 载药量(w/w,%) 平均值(w/w,%) RSD(%) 1 3.13 3.19 1.88 2 3.25 3 3.20 -
图4是含胰岛素的预溶胀SPH-IPN和冻干SPH-IPN对糖尿病大鼠和正常大鼠降糖作用的比较。图中预溶胀模型组在10 h时血糖值才有所降低,最低值为10 h的16.8 mmol/L,之后血糖又开始慢慢升高;预溶胀正常大鼠组在给药4 h后血糖开始降低,到24 h时血糖达到7.3 mmol/L,之后维持平稳状态;冻干模型组在包埋1 h后血糖便开始下降,血糖值降到6.7 mmol/L,在24 h后血糖开始慢慢升高,冻干正常大鼠组在1 h后血糖降至5.3 mmol/L,之后虽有起伏,但也一直在正常范围内。说明冻干凝胶的降糖作用较预溶胀组好,冻干凝胶在1~24 h时间段内的降糖作用较平稳。
-
本实验选用了能够迅速聚合的水溶性原料AA、AM为聚合反应单体;以APS/TEMED为引发体系;PF127为泡沫稳定剂,使产生的泡沫稳定时间更长;NaHCO3为起泡剂;O-CMC在合成过程中作为增稠剂,维持合适的起泡速率,使产生的气泡均匀、稳定,不致产生的气泡过快逸散[12]。采用溶液聚合法制备了含semi-IPN的水凝胶。因为该聚合反应在反应过程中会产生大量热量,这对泡沫的稳定极为有利,因此在常温条件下便能进行聚合反应,条件温和。以pH 1.0的GA溶液交联O-CMC时,可避免过度溶胀对孔隙结构的破坏,且pH 1.0时GA的交联能力较好。除此之外,相较于参考文献[5],本实验中O-CMC/单体比较高,当O-CMC/单体比为0.144时,虽然可形成具有大量相互贯通孔隙的聚合物,但会导致其溶胀速率减慢,溶胀比降低,从而影响载药量和释药速率。随着溶胀速率减慢,药物溶出速率也相应减慢;随着溶胀比的降低,吸收的药物溶液减少,载药量随之降低。本实验提高O-CMC/单体的目的是希望通过减慢SPH-IPN的溶胀速率,从而尝试制备缓释制剂。
-
水凝胶的载药方法通常有2种:一是将药物与单体溶液混合,随着单体聚合、交联将药物包埋于水凝胶中[13];另一种方法为吸附载药,即凝胶在被载药液中溶胀,将载药水凝胶干燥,实现药物包埋[14]。姜黄素属于脂溶性药物,课题组前期研究结果表明,0.5%的SDS对姜黄素有一定的增溶效果;0.1 mol/L pH 7.4 PBS中SPH-IPN的溶胀比较大,对胰岛素具有一定的增溶作用,故分别选用这两种溶剂配制胰岛素溶液。
-
文献[5]表明,超多孔水凝胶载药后的释药性能与O-CMC的含量、pH、离子强度、温度等多个因素有关,同时也有可能与载药SPH-IPN的制备过程有关。
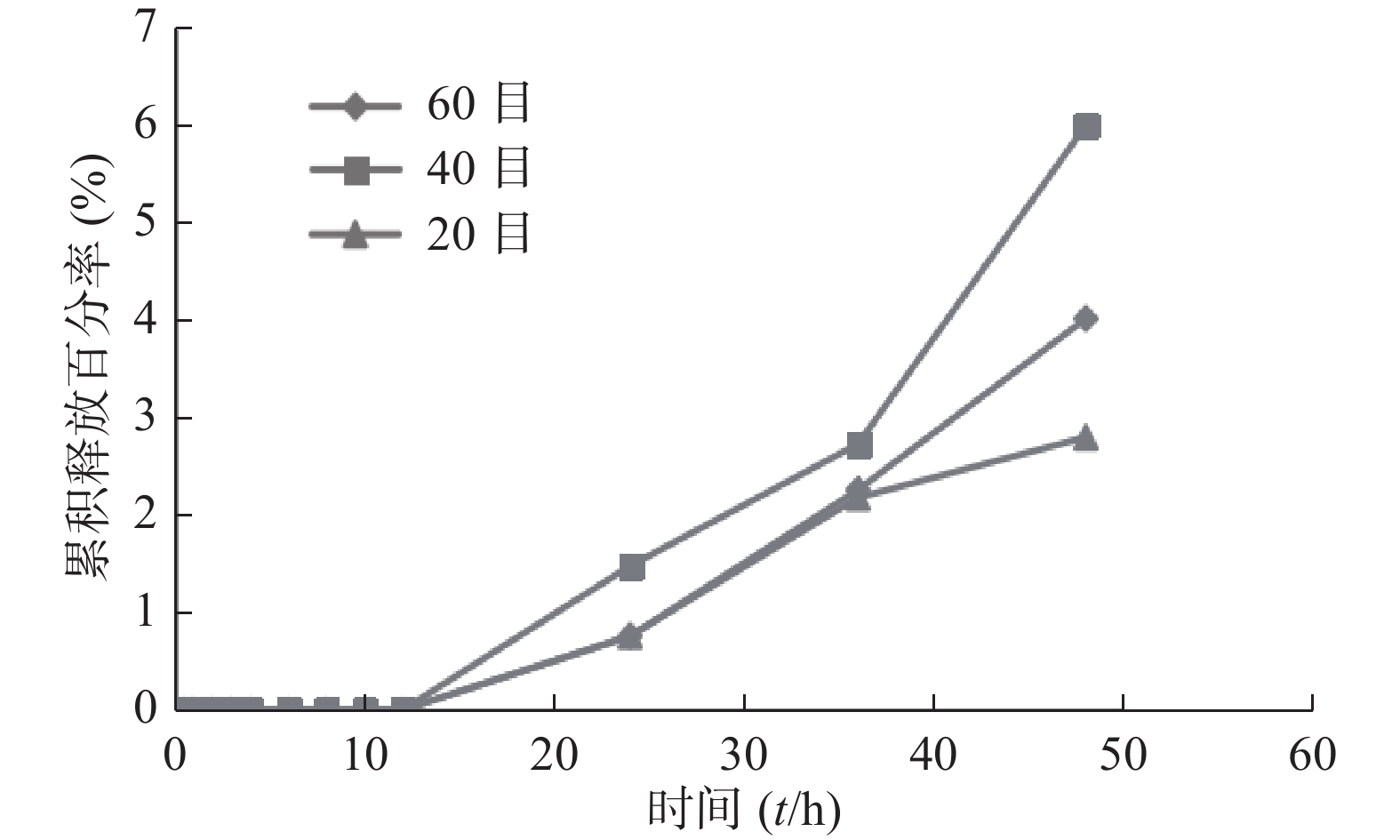
笔者曾用SPH-IPN包载姜黄素,并开展探索性实验。结果发现20、40、60目不同粒径的凝胶累积释放率不同,前13 h三者的累积释放率均几乎一样(接近0),13 h后累积释放率逐渐增加,以40目凝胶的效果最佳,48 h后达到6.00%,明显高于其他组,但其释放速度慢,见图5。灌胃给予载姜黄素SPH-IPN后,部分大鼠排泄物中可见载姜黄素SPH-IPN,说明SPH-IPN在体内溶胀速率很慢;而载姜黄素SPH-IPN组和姜黄素原药组,灌胃后大鼠眼眶血中均未检出姜黄素,也进一步体现SPH-IPN未促进姜黄素的吸收。
将载胰岛素SPH-IPN予灌胃给药溶胀很慢,降糖效果极不明显,为延长SPH-IPN溶胀时间,最终考虑将其进行皮下包埋给药。
载胰岛素SPH-IPN皮下包埋给药发现,载胰岛素冻干SPH-IPN组的降糖效果优于载胰岛素溶胀SPH-IPN组,表明载药SPH-IPN的释放性能除与溶胀比有关外,其制备过程也会一定程度影响被载药物的疗效,与文献[5]报道一致。实验中将冻干组和溶胀组均进行包埋,均可延长溶胀时间,但冻干SPH-IPN组的降糖效果优,皮下包埋2 h后表现出明显的降糖作用,相比溶胀组而言,起效时间快(8 h左右)且持续时间长,24 h之内均具有良好的降糖作用。提示我们在制备载药SPH-IPN的过程中应该时刻关注被载药物的活性及稳定性,应在适当的条件下对药物进行包载以提高药物疗效,同时也说明载胰岛素冻干SPH-IPN可作为控释制剂,实现调节大鼠血糖的目的。结合实验结果分析可知,SPH-IPN能够增强药物的稳定性,提高生物利用度,比较适合作为蛋白质药物给药载体。
-
文献研究发现,胰岛素经皮给药具有不错的疗效,与皮下给药效果几无差异,且依从性好,成为最新、有效、方便的给药方式。Norduist等[15]将微针贴剂用于胰岛素给药,结果发现,血浆胰岛素浓度变化与传统的皮下注射并无太大差异,但微针贴剂能极大地提高实验大鼠的依从性。无痛中空微针皮内胰岛素给药系统已获得 FDA批准,进入II期临床,相关产品有以色列纳米通道技术公司采用MEMS技术开发的中空微针器具,其中包括用于无痛释放胰岛素薄片与胰岛素微型泵相结合。Liu等[16]将可溶性材料透明质酸制备成负载胰岛素的微针阵列。在体实验发现,负载胰岛素的微针能够在1 h内完全溶解,携带的胰岛素快速释放入体内。
与上述研究及应用相比,本实验的载胰岛素SPH-IPN,释放药物无需微型泵,皮下包埋给药可以24 h内保持平稳、正常的血糖浓度,适合作为一日一次给药的控释制剂。为了提高患者的依从性,进一步研究将载胰岛素SPH-IPN制备为微针阵列的形式,以期得到一种方便、快捷、安全的胰岛素缓释递药系统。
Preparation and detection of controlled release insulin ultra-porous hydrogel
-
摘要:
目的 制备一种可实现控释的超多孔水凝胶,以胰岛素为模型药,考察超多孔水凝胶的载药、释药性能,初探给药途径及药效。 方法 采用聚合物互穿网络法制备超多孔水凝胶(SPH-IPN);通过傅立叶变换红外光谱和核磁共振碳谱考察凝胶的结构;通过测定溶胀比、孔隙率考察凝胶的性能;并以胰岛素为模型药研究超多孔水凝胶的载药量及载药后的药效。 结果 所制得的超多孔水凝胶胰岛素的载药量为3.19%。通过动物皮下包埋的预实验结果可以看到,载胰岛素冻干凝胶在1~24 h对糖尿病大鼠的降糖效果较好。 结论 冻干胰岛素超多孔水凝胶皮下包埋,可实现24 h血糖值稳定,具有很好的控释效果。 Abstract:Objective To prepare an ultra-porous hydrogel capable of controlled release and investigate the drug loading, releasing, administration route and efficacy with insulin as a model drug. Methods The polymer interpenetrating network method was used to prepare ultra-porous hydrogels (SPH-IPN). Insulin was selected as a model drug to study the drug loading and efficacy. Fourier transform infrared spectroscopy and nuclear magnetic resonance carbon spectroscopy were used to investigate the structure of the gel. The swelling ratio and porosity were measured to evaluate the gel performance. Results The drug loading capacity of insulin ultra-porous hydrogel was 3.19%. The insulin-loaded freeze-dried gel exhibited good hypoglycemic effect on diabetic rats in 1−24 hours from the experimental results on rats with subcutaneous implantation. Conclusion The subcutaneously embedded lyophilized insulin ultra-porous hydrogel provided good controlled release efficacy. It maintained stable blood glucose levels within 24 hours. -
Key words:
- ultra- porous hydrogel /
- insulin /
- subcutaneous implantation
-
表 1 SPH-IPN的孔隙率测定结果
干重M1
(m/g)湿重M2
(m/g)乙醇密度
(g/cm3)体积
(V/cm3)孔隙率
(%)平均值
(%)RSD
(%)0.5425 0.6327 0.816 0.13 85.03 81.63 3.88 0.5751 0.6779 0.816 0.16 78.74 0.5628 0.6621 0.816 0.15 81.13 表 2 SPH-IPN对胰岛素的载药量
试验组 载药量(w/w,%) 平均值(w/w,%) RSD(%) 1 3.13 3.19 1.88 2 3.25 3 3.20 -
[1] WICHTERLE O, LÍM D. Hydrophilic gels for biological use[J]. Nature,1960,185(4706):117-118. doi: 10.1038/185117a0 [2] 张少园. 白芨多糖超多孔水凝胶的制备及其性能研究[D]. 长春: 吉林大学, 2017. [3] LIANG W H, KIENITZ B L, PENICK K J, et al. Concentrated collagen-chondroitin sulfate scaffolds for tissue engineering applications[J]. J Biomed Mater Res A,2010,94(4):1050-1060. [4] 李寒梅, 王瑶, 谢娜, 等. 胰岛素缓控释制剂的研究进展[J]. 成都大学学报(自然科学版), 2019, 38(3):242-246. [5] 殷黎晨. 用于改善生物大分子药物功效的超多孔水凝胶、纳米粒新型给药载体[D]. 上海: 复旦大学, 2010. [6] MING J F, ZUO B Q. A novel silk fibroin/sodium alginate hybrid scaffolds[J]. Polym Eng Sci,2014,54(1):129-136. doi: 10.1002/pen.23542 [7] 王洪莹. 2型糖尿病动物模型的建立[D]. 长春: 吉林大学, 2007. [8] 王林龙. 糖尿病所致骨关节炎易感及发生机制研究[D]. 武汉: 武汉大学, 2014. [9] 戎晨亮, 侯立峰, 黄海龙, 等. 温敏性SA/P(NIPAM-co-AM)水凝胶分子运动的固体核磁共振研究[J]. 功能高分子学报, 2018(10):1-9. [10] 李芮. 基于壳聚糖大分子交联剂的双交联温敏性高强度水凝胶的制备与性能[D]. 青岛: 青岛大学, 2017. [11] 陈可可. 胶原/聚甲基丙烯酸-2-羟乙酯多孔水凝胶的研究[D]. 郑州: 郑州大学, 2018. [12] 赵爱杰, 原续波, 常津. O-羧甲基壳聚糖的制备及应用研究进展[J]. 高分子通报, 2004(4):59-63. doi: 10.3969/j.issn.1003-3726.2004.04.006 [13] 郎轶咏, 王强, 姜同英, 等. 温敏接枝共聚物瓜耳胶-g-异丙基丙烯酰胺水凝胶胰岛素埋植剂[J]. 沈阳药科大学学报, 2009, 26(11):845-848. [14] 高凤苑, 关欣, 韩良亮, 等. 木薯淀粉水凝胶负载姜黄素及缓释[J]. 食品与发酵工业, 2019(2):1-9. [15] NORDQUIST L, ROXHED N, GRISS P, et al. Novel microneedle patches for active insulin delivery are efficient in maintaining glycaemic control: an initial comparison with subcutaneous administration[J]. Pharm Res,2007,24(7):1381-1388. doi: 10.1007/s11095-007-9256-x [16] LIU S, JIN M N, QUAN Y S, et al. The development and characteristics of novel microneedle arrays fabricated from hyaluronic acid, and their application in the transdermal delivery of insulin[J]. J Control Release,2012,161(3):933-941. doi: 10.1016/j.jconrel.2012.05.030 -






 下载:
下载: