-
在中医,脑卒中属于中风范畴,“气虚血瘀、痰瘀互结、毒损脑络”是中风的核心病机[1]。雷公藤系卫矛科雷公藤属藤本植物,又名震龙根、水莽子、断肠草、红紫根,以根茎入药,首载于《神农本草经》,味苦性寒,具有清热解毒、祛风通络、舒筋活血等功效,常用于免疫和炎性疾病的治疗。现代医学研究发现,炎症反应及缺血半暗带神经元凋亡在脑缺血再灌注损伤(CIRI)进展中发挥着重要作用,可作为防治CIRI新药研究的靶点[2-4]。雷公藤甲素为雷公藤的主要活性成分之一,化学结构属于二萜内酯类化合物,具有抗炎、抗凋亡等药理学作用[5-6]。Toll样受体4/核转录因子-κB(TLR4/NF-κB)通路是CIRI后炎症反应及神经元凋亡的重要调控机制[7]。有文献[8-9]报道雷公藤甲素能够抑制TLR4/NF-κB通路对大鼠类风湿关节炎、鼻炎具有一定抑制作用。然而,雷公藤甲素是否能够通过调控TLR4/NF-κB通路抑制CIRI仍需深入研究。因此,本实验将探讨雷公藤甲素对大鼠CIRI的影响及其机制,以期为雷公藤甲素应用于CIRI防治提供理论依据。
-
清洁级健康雄性7周龄Wistar大鼠144只,体质量210~240 g,购自杭州子源实验动物科技有限公司,实验动物生产许可证号SCXK(浙)2019-0004。饲养环境维持室温23~25 ℃、相对湿度45%~65%,自由饮水进食。动物实验遵守实验动物福利伦理审查指南。
-
雷公藤甲素(上海源叶生物科技有限公司,纯度≥98%);丁苯酞氯化钠注射液(恩必普药业有限公司,规格100 ml∶25 mg,国药准字H20100041);生理盐水(石家庄四药有限公司,规格500 ml,国药准字H13023200);注射用异戊巴比妥钠(上海上药新亚药业有限公司,规格0.1 g,国药准字H21021725);红四氮唑(TTC)、伊文思蓝(EB)(北京博奥森生物技术有限公司);4%多聚甲醛溶液(北京索莱宝生物技术公司);末端标记法(TUNEL)染色试剂盒和肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)检测试剂盒(南京建成生物工程研究所);甲酰胺(天津科密欧化学试剂有限公司);TLR4、NF-κB、p-NF-κB、激活型半胱氨酸蛋白酶-3(cleaved Caspase-3)、B细胞淋巴瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、β-actin抗体和IgG二抗(北京博奥森生物技术有限公司);二喹啉甲酸法(BCA)蛋白浓度检测试剂盒、增强化学发光液(ECL)(武汉三鹰生物技术有限公司)。
-
TKY-BMB型石蜡包埋机(湖北康泰医疗设备有限公司);S7220型石蜡切片机(沈阳恒松科技有限公司);JY300C型电泳仪(美国Wealtec公司);Semi-Day型转膜仪(美国Bio-Rad公司);FluorChem HD2型凝胶成像仪(美国Protein Simple公司);BioTek Epoch型全波长酶标仪(美国伯腾仪器有限公司);BX53型显微镜(日本Olympus日立公司)。
-
将144只Wistar大鼠按照随机数字表法平均分为假手术组、模型组、雷公藤甲素低、中、高剂量组(0.2、0.4、0.8 mg/kg)[10]和丁苯酞组(6 mg/kg)[11],每组24只。造模前3 d开始1次/d腹腔注射(ip)给药,假手术组和模型组ip给予生理盐水,注射体积均为5 ml/kg。除假手术组外,其余5组均参照杨丽等[12]报道方法构建CIRI大鼠模型。
-
再灌注24 h后,分别随机取各组6只大鼠,参照文献[13]报道的方法进行神经功能缺失评分,无症状为0分、前肢不能伸展为1分、行走时转圈为2分、行走时跌倒为3分、不能行走或意识丧失为4分。ip戊巴比妥钠(40 mg/kg)进行麻醉后,颈椎脱臼处死,取大脑组织、-20 ℃冻存15 min后均匀厚度切为5片,2% TTC溶液恒温37 ℃避光染色30 min,每5 min翻转一次,正常组织呈红色、梗死组织呈苍白色,通过图像分析软件计算脑梗死率。
-
分别随机取各组6只大鼠,经尾静脉注射2% EB溶液4 ml/kg,30 min后实施麻醉,开胸后经“左心室-右心耳”灌注生理盐水至流出液清亮,取脑称重,1 ml/100 mg加入甲酰胺后60 ℃水浴24 h,4 ℃匀浆后15000 rpm离心20 min取上清液,通过酶标仪检测620 nm处吸光度值,对照标准曲线测定EB含量。
-
分别随机取各组6只大鼠,ip戊巴比妥钠(40 mg/kg)进行麻醉后,颈椎脱臼处死,取缺血侧大脑皮层组织,经4%多聚甲醛溶液固定、脱水、石蜡包埋、切片、烤片等处理后,按照HE试剂盒和TUNEL试剂盒操作说进行染色处理后,通过光学显微镜观察缺血半暗带皮层神经元病理学改变。显微镜下计数TUNEL染色切片5个视野内细胞数和凋亡细胞数,计数缺血半暗带皮层神经元凋亡率。
-
取各组剩余的6只大鼠,ip戊巴比妥钠(40 mg/kg)进行麻醉后,颈椎脱臼处死,剥取缺血侧大脑皮层组织。①取部分缺血侧大脑皮层组织,加入5倍量4 ℃生理盐水研磨匀浆,3 500 r/min离心5 min分离上清液,按照试剂盒操作说明通过ELISA法检测缺血侧大脑皮层组织TNF-α、IL-1β含量。②取剩余部分缺血侧大脑皮层组织,加入适量蛋白裂解液后研磨匀浆,冰上静置30 min使其充分裂解,4 ℃、12 000 r/min离心25 min分离上清液,检测总蛋白浓度并配平后,30 μg等量上样,经10 % SDS-PAGE凝胶电泳分离蛋白、转膜和5%脱脂牛奶封闭1.5 h后,加入一抗稀释液TLR4(1∶800)、NF-κB(1∶1000)、p-NF-κB(1∶1000)、cleaved Caspase-3(1∶800)、Bcl-2(1∶500)、Bax(1∶500)和内参β-actin(1∶1500)4 ℃避光孵育过夜,洗膜后二抗稀释液(1∶3 000)室温孵育1.5 h,洗膜后ECL显影,通过Image J软件分析蛋白条带灰度值。
-
运用SPSS 20.0软件进行数据统计分析,计量资料符合正态分布以(
$ \bar x \pm s $ )表示,多组间比较采用单因素方差分析,方差齐时两两比较采用LSD-t检验,方差不齐时两两比较采用Dunnett's T3检验,P<0.05为差异有统计学意义。 -
与假手术组比较,模型组大鼠神经功能缺失评分和脑梗死率显著升高(P<0.05)。与模型组比较,雷公藤甲素中、高剂量组和丁苯酞组神经功能缺失评分和脑梗死率显著降低(P<0.05)。与丁苯酞组比较,雷公藤甲素高剂量组神经功能缺失评分和脑梗死率显著降低(P<0.05)。见图1、表1。
表 1 各组大鼠神经功能缺失评分、脑梗死率、BBB通透性的比较(
$ \bar x \pm s $ ,n=6)组别 神经功能缺失
评分(分)脑梗死率
(%)EB含量
(μg/g)假手术组 0.00±0.00 0.00±0.00 0.49±0.06 模型组 2.84±0.39* 48.17±7.39* 1.54±0.27* 丁苯酞组 1.31±0.17△ 16.28±2.15△ 0.79±0.09△ 雷公藤甲素低剂量组 2.50±0.34 42.93±5.74 1.42±0.23 雷公藤甲素中剂量组 1.85±0.26△ 27.54±3.48△ 1.10±0.16△ 雷公藤甲素高剂量组 1.09±0.15△# 11.38±1.65△# 0.70±0.08△# *P<0.05,与假手术组比较;#P<0.05,与丁苯酞组比较;△P<0.05,与模型组比较。 -
与假手术组比较,模型组大鼠脑组织EB含量显著升高(P<0.05)。与模型组比较,雷公藤甲素中、高剂量组和丁苯酞组脑组织EB含量显著降低(P<0.05)。与丁苯酞组比较,雷公藤甲素高剂量组脑组织EB含量显著降低(P<0.05)。见表1。
-
假手术组大鼠皮层神经元呈圆形或椭圆形,形态饱满,着色均匀,胞核居中。模型组大鼠缺血半暗带皮层神经元呈现形态不规则,胞体萎缩呈空泡样变,着色较深,核膜边界不清,炎性细胞浸润等病理学改变。与模型组比较,雷公藤甲素各剂量组和丁苯酞组缺血半暗带皮层神经元明显改善,其中雷公藤甲素高剂量组效果优于雷公藤甲素低、中剂量组和丁苯酞组,见图2。
-
与假手术组比较,模型组大鼠缺血半暗带皮层神经元凋亡率显著升高(P<0.05)。与模型组比较,雷公藤甲素中、高剂量组和丁苯酞组凋亡率显著降低(P<0.05)。与丁苯酞组比较,雷公藤甲素高剂量组凋亡率显著降低(P<0.05),见表2。
表 2 各组大鼠缺血半暗带皮层神经元凋亡率的比较(
$ \bar x \pm s $ ,n=6)组别 凋亡率(%) 假手术组 2.68±0.35 模型组 53.07±8.42* 丁苯酞组 17.69±2.90△ 雷公藤甲素低剂量组 45.93±7.67 雷公藤甲素中剂量组 31.52±5.08△ 雷公藤甲素高剂量组 12.88±1.74△# *P<0.05,与假手术组比较;#P<0.05,与丁苯酞组比较;△P<0.05,与模型组比较。 -
与假手术组比较,模型组缺血侧大脑皮层组织TNF-α、IL-1β含量显著升高(P<0.05)。与模型组比较,雷公藤甲素中、高剂量组和丁苯酞组TNF-α、IL-1β含量显著降低(P<0.05)。与丁苯酞组比较,雷公藤甲素高剂量组TNF-α、IL-1β含量显著降低(P<0.05)。见表3。
表 3 各组大鼠缺血侧大脑皮层组织TNF-α、IL-1β含量的比较(
$ \bar x \pm s $ ,n=6)组别 TNF-α(ng/g) IL-1β(pg/g) 假手术组 1.41±0.22 37.06±4.81 模型组 2.76±0.35* 68.42±7.79* 丁苯酞组 1.85±0.23△ 46.93±5.62△ 雷公藤甲素低剂量组 2.54±0.32 63.81±6.54 雷公藤甲素中剂量组 2.07±0.25△ 55.74±5.91△ 雷公藤甲素高剂量组 1.62±0.21△# 40.27±5.39△# *P<0.05,与假手术组比较;#P<0.05,与丁苯酞组比较;△P<0.05,与模型组比较。 -
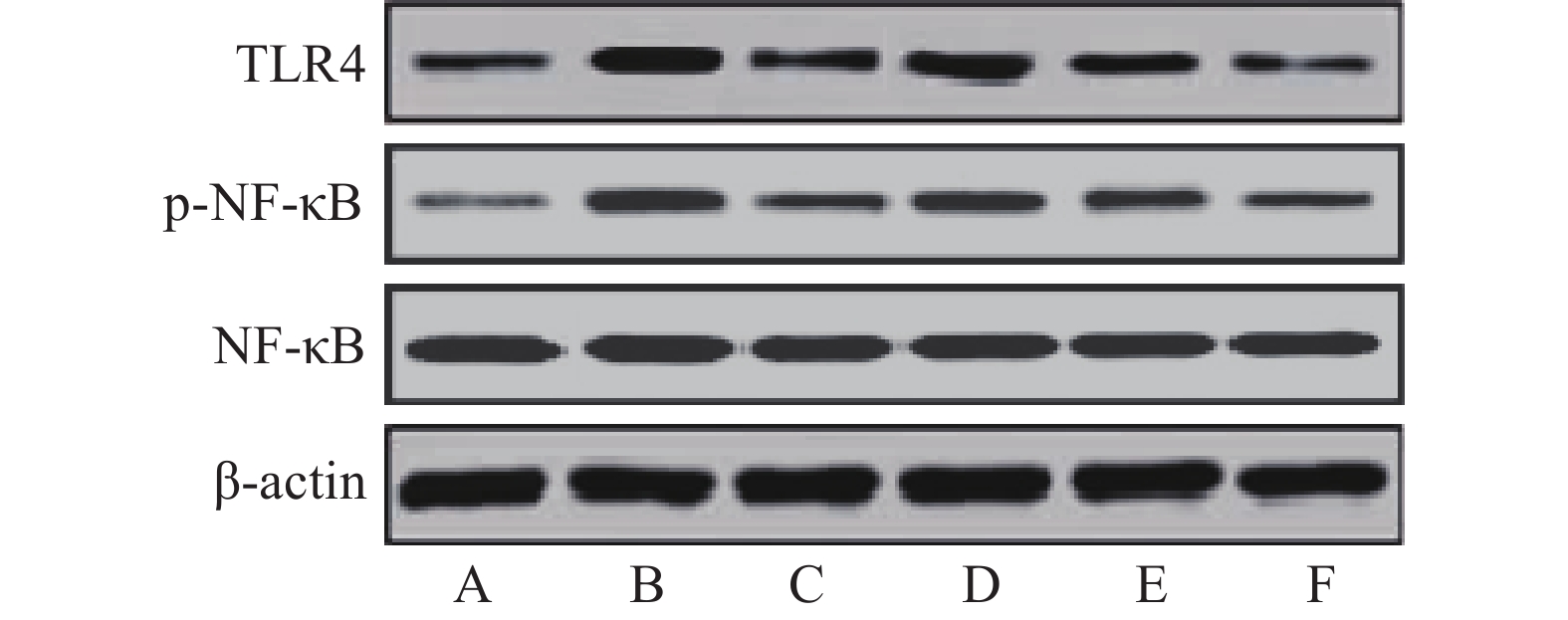
与假手术组比较,模型组大鼠缺血侧大脑皮层组织TLR4、p-NF-κB蛋白相对表达量和p-NF-κB/NF-κB比值显著升高(P<0.05)。与模型组比较,雷公藤甲素中、高剂量组和丁苯酞组TLR4、p-NF-κB蛋白相对表达量和p-NF-κB/NF-κB比值显著降低(P<0.05)。与丁苯酞组比较,雷公藤甲素高剂量组TLR4、p-NF-κB蛋白相对表达量和p-NF-κB/NF-κB比值显著降低(P<0.05),见图3、表4。
表 4 各组大鼠缺血侧大脑皮层组织TLR4、NF-κB、p-NF-κB蛋白表达及p-NF-κB/NF-κB比值的比较(
$\bar x \pm s$ ,n=6)组别 TLR4/β-actin NF-κB/β-actin p-NF-κB/β-actin p-NF-κB/NF-κB 假手术组 0.08±0.02 0.83±0.15 0.10±0.02 0.12±0.03 模型组 1.03±0.21* 0.78±0.14 0.81±0.15* 1.04±0.22* 丁苯酞组 0.20±0.04△ 0.84±0.15 0.29±0.06△ 0.35±0.08△ 雷公藤甲素低剂量组 0.87±0.16 0.79±0.16 0.68±0.13 0.86±0.18 雷公藤甲素中剂量组 0.65±0.13△ 0.78±0.15 0.35±0.07△ 0.45±0.10△ 雷公藤甲素高剂量组 0.16±0.03△# 0.74±0.14 0.14±0.03△# 0.19±0.04△# *P<0.05,与假手术组比较;#P<0.05,与丁苯酞组比较;△P<0.05,与模型组比较。 -
与假手术组比较,模型组大鼠缺血侧大脑皮层组织cleaved Caspase-3、Bax蛋白相对表达量显著升高,Bcl-2相对表达量显著降低,Bax/Bcl-2比值显著升高(P<0.05)。与模型组比较,雷公藤甲素中、高剂量组和丁苯酞组cleaved Caspase-3、Bax相对表达量显著降低,Bcl-2相对表达量显著升高,Bax/Bcl-2比值显著降低(P<0.05)。与丁苯酞组比较,雷公藤甲素高剂量组cleaved Caspase-3、Bax相对表达量显著降低,Bcl-2相对表达量显著升高,Bax/Bcl-2比值显著降低(P<0.05)。见图4、表5。
表 5 各组大鼠缺血侧大脑皮层组织cleaved Caspase-3、Bcl-2、Bax蛋白表达及Bax/Bcl-2比值的比较(
$ \bar x \pm s $ ,n=6)组别 cleaved Caspase-3/
β-actinBcl-2/β-actin Bax/β-actin Bax/Bcl-2 假手术组 0.09±0.02 0.92±0.19 0.15±0.03 0.16±0.03 模型组 0.61±0.11* 0.18±0.04* 0.97±0.18* 5.39±1.07* 丁苯酞组 0.16±0.03△ 0.29±0.06△ 0.20±0.04△ 0.69±0.10△ 雷公藤甲素
低剂量组0.55±0.09 0.21±0.04 0.88±0.16 4.19±0.75△ 雷公藤甲素
中剂量组0.42±0.08△ 0.32±0.06△ 0.47±0.09△ 1.47±0.20△ 雷公藤甲素
高剂量组0.12±0.02△# 0.56±0.11△# 0.26±0.5△# 0.46±0.07△# *P<0.05,与假手术组比较;#P<0.05,与丁苯酞组比较;△P<0.05,与模型组比较。 -
线栓法是CIRI动物模型制备的经典方法,具有操作简便、重复率高、与人类临床病理接近等优点。本实验结果显示,CIRI模型大鼠呈现明显的神经功能障碍,BBB通透性异常升高,缺血半暗带大脑皮层神经元呈现形态不规则、胞体萎缩呈空泡样变、着色较深、核膜边界不清、炎性细胞浸润等病理学改变,与杨欢欢等[15]研究结果一致。本研究发现,经雷公藤甲素中、高剂量或丁苯酞预处理能够明显改善CIRI大鼠神经功能,降低脑梗死率和BBB通透性,改善缺血半暗带大脑皮层神经元病变并降低其凋亡率,并且雷公藤甲素高剂量组效果优于丁苯酞组;而雷公藤甲素低剂量组上述作用并不显著。说明雷公藤甲素具有抑制大鼠CIRI的作用,该作用具有一定的剂量依赖性。
CIRI病理机制非常复杂,其中炎症损伤和神经元凋亡发挥着关键作用。熊莉等[16]报道CIRI可诱导小胶质细胞活化而释放TNF-α、IL-1β等促炎因子,引发脑组织炎症反应发生。TNF-α和IL-1β具备炎性趋化属性,其中TNF-α可刺激促炎因子大量释放,IL-1β可诱导炎性细胞浸润,加重炎症反应[17]。Bcl-2和Bax是定位于线粒体膜的两种蛋白,二者均属于bcl蛋白家族,在细胞线粒体凋亡途径中发挥着重要作用。Bax可诱导细胞色素C由线粒体通过膜孔道进入细胞质,活化位于细胞质的Caspase-3,cleaved Caspase-3能够切割破坏膜蛋白、结构蛋白等引发细胞凋亡[18]。Bcl-2能够抑制Cyt C释放而表现为抑凋亡作用,并且Bcl-2与Bax能够结合形成无活性的二聚体。TLR4是定位于小胶质细胞的一种跨膜识别受体,TLR4能够诱导NF-κB磷酸化,p-NF-κB核转位后与DNA特定位点结合而诱导TNF-α、IL-1β等炎症因子转录与表达,进而加重炎症损伤[19]。此外,p-NF-κB可通过调控Bcl-2、Bax表达而诱导细胞凋亡[20]。Zhai Y等[21]发现抑制TLR4/NF-κB通路介导的炎症反应和凋亡可减轻大鼠CIRI。本实验结果显示,经雷公藤甲素中、高剂量或丁苯酞预处理能够明显降低CIRI大鼠缺血侧大脑皮层组织TNF-α、IL-1β含量和TLR4、cleaved Caspase-3蛋白相对表达量,降低p-NF-κB/NF-κB、Bax/Bcl-2比值,并且雷公藤甲素高剂量组效果优于丁苯酞组,而雷公藤甲素低剂量组上述作用并不显著。说明雷公藤甲素对CIRI大鼠炎症反应缺血半暗带大脑皮层神经元凋亡具有抑制作用,其机制可能与抑制TLR4/NF-κB通路活化有关,本结果与李晓蕾等[22]报道的药物抑制TLR4/NF-κB通路对局灶性脑缺血再灌注大鼠神经具有保护作用的结果相似。
综上所述,雷公藤甲素能够保护BBB通透性,减轻CIRI大鼠神经功能缺失和神经元病变,降低脑梗死率,作用机制可能与抑制TLR4/NF-κB通路及其介导的炎症反应和神经元凋亡有关。本研究结果为雷公藤甲素用于防治CIRI提供了理论依据。
Effects and mechanism of Triptolide on cerebral ischemia-reperfusion injury in rats
-
摘要:
目的 探讨雷公藤甲素对大鼠脑缺血再灌注损伤(CIRI)的影响并初探其分子机制。 方法 将144只Wistar大鼠随机分为假手术组、模型组、雷公藤甲素低、中、高剂量组和丁苯酞组,每组24只。通过阻断大脑中动脉2 h构建CIRI大鼠模型,各组均于造模前3天开始1次/天ip给药。再灌注24 h后,行神经功能缺失评分,TTC染色法检测脑梗死率; EB渗透实验检测血脑屏障(BBB)通透性; HE 、TUNEL染色观察缺血半暗带皮层神经元病理学改变;ELISA法检测缺血侧大脑皮层炎症因子含量,Western blot法检测TLR4/NF-κB通路相关蛋白表达。 结果 与模型组比较,雷公藤甲素中、高剂量组和丁苯酞组神经功能缺失评分、脑梗死率、EB含量显著降低(P<0.05);缺血半暗带皮层神经元病理学改变明显改善,凋亡率显著降低(P<0.05);炎症因子TNF-α、IL-1β含量和TLR4、p-NF-κB、cleaved Caspase-3、Bax相对表达量显著降低,Bcl-2相对表达量显著升高,p-NF-κB/NF-κB和Bax/Bcl-2比值显著降低(P<0.05)。雷公藤甲素高剂量组对各检测指标的调控作用优于丁苯酞组(P<0.05)。 结论 雷公藤甲素能够保护BBB通透性,减轻CIRI大鼠神经功能缺失和神经元病变,降低脑梗死率,作用机制可能与抑制TLR4/NF-κB通路及其介导的炎症反应和神经元凋亡有关。 -
关键词:
- 雷公藤甲素 /
- 脑缺血再灌注 /
- TLR4/NF-κB通路 /
- 炎症 /
- 凋亡
Abstract:Objective To investigate the effect of Triptolide on cerebral ischemia- reperfusion injury (CIRI) and explore its molecular mechanism. Methods One hundred and forty-four Wistar rats were randomly divided into sham operation group, model group, low, medium, high dose of triptolide group and butylphthalide group, with 24 rats in each group. The CIRI rat model was established by blocking the middle cerebral artery for 2 hours. 3 days before modeling, the rats in each group were ip administration once a day. 24 hours after reperfusion, the neurological deficit score was detected, the rate of cerebral infarction was measured by TTC staining, the blood brain barrier (BBB) permeability was detected by EB penetration test. The pathological changes neurons in the ischemic penumbra cortex were observed by HE and TUNEL staining. The content of inflammatory factors in ischemic cerebral cortex were detected by ELISA method. The expression of TLR4/NF-κB pathway related proteins were detected by Western blot. Results Compared with the model group, the neurological deficit score, cerebral infarction rate and EB content in the Triptolide middle, high dose groups and the Butylphthalide group were significantly decreased (P<0.05). The pathological changes of cortical neurons in the ischemic penumbra were significantly improved, and the apoptosis rate of neurons was significantly decreased (P<0.05). The content of TNF-α, IL-1β and the expression of TLR4, p-NF-κB, cleaved Caspase-3, Bax were significantly decreased, the expression of Bcl-2 was significantly increased, the ratio of p-NF-κB/NF-κB and Bax/Bcl-2 were significantly decreased (P<0.05). The regulatory effect of the high dose triptolide group on various detection indexes were better than that of the Butylphthalide group (P<0.05). Conclusion Triptolide could protect the permeability of BBB, improve the neurological deficit and neuropathy in CIRI rats, and reduce the rate of cerebral infarction, its mechanism may be related to the inhibition of TLR4/NF-κB pathway and which mediated inflammatory response and neuronal apoptosis. -
Key words:
- triptolide /
- cerebral ischemia-reperfusion /
- TLR4/NF-κB pathway /
- inflammation /
- apoptosis
-
在中医,脑卒中属于中风范畴,“气虚血瘀、痰瘀互结、毒损脑络”是中风的核心病机[1]。雷公藤系卫矛科雷公藤属藤本植物,又名震龙根、水莽子、断肠草、红紫根,以根茎入药,首载于《神农本草经》,味苦性寒,具有清热解毒、祛风通络、舒筋活血等功效,常用于免疫和炎性疾病的治疗。现代医学研究发现,炎症反应及缺血半暗带神经元凋亡在脑缺血再灌注损伤(CIRI)进展中发挥着重要作用,可作为防治CIRI新药研究的靶点[2-4]。雷公藤甲素为雷公藤的主要活性成分之一,化学结构属于二萜内酯类化合物,具有抗炎、抗凋亡等药理学作用[5-6]。Toll样受体4/核转录因子-κB(TLR4/NF-κB)通路是CIRI后炎症反应及神经元凋亡的重要调控机制[7]。有文献[8-9]报道雷公藤甲素能够抑制TLR4/NF-κB通路对大鼠类风湿关节炎、鼻炎具有一定抑制作用。然而,雷公藤甲素是否能够通过调控TLR4/NF-κB通路抑制CIRI仍需深入研究。因此,本实验将探讨雷公藤甲素对大鼠CIRI的影响及其机制,以期为雷公藤甲素应用于CIRI防治提供理论依据。
1. 材料
1.1 动物
清洁级健康雄性7周龄Wistar大鼠144只,体质量210~240 g,购自杭州子源实验动物科技有限公司,实验动物生产许可证号SCXK(浙)2019-0004。饲养环境维持室温23~25 ℃、相对湿度45%~65%,自由饮水进食。动物实验遵守实验动物福利伦理审查指南。
1.2 实验药物与试剂
雷公藤甲素(上海源叶生物科技有限公司,纯度≥98%);丁苯酞氯化钠注射液(恩必普药业有限公司,规格100 ml∶25 mg,国药准字H20100041);生理盐水(石家庄四药有限公司,规格500 ml,国药准字H13023200);注射用异戊巴比妥钠(上海上药新亚药业有限公司,规格0.1 g,国药准字H21021725);红四氮唑(TTC)、伊文思蓝(EB)(北京博奥森生物技术有限公司);4%多聚甲醛溶液(北京索莱宝生物技术公司);末端标记法(TUNEL)染色试剂盒和肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)检测试剂盒(南京建成生物工程研究所);甲酰胺(天津科密欧化学试剂有限公司);TLR4、NF-κB、p-NF-κB、激活型半胱氨酸蛋白酶-3(cleaved Caspase-3)、B细胞淋巴瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、β-actin抗体和IgG二抗(北京博奥森生物技术有限公司);二喹啉甲酸法(BCA)蛋白浓度检测试剂盒、增强化学发光液(ECL)(武汉三鹰生物技术有限公司)。
1.3 主要仪器
TKY-BMB型石蜡包埋机(湖北康泰医疗设备有限公司);S7220型石蜡切片机(沈阳恒松科技有限公司);JY300C型电泳仪(美国Wealtec公司);Semi-Day型转膜仪(美国Bio-Rad公司);FluorChem HD2型凝胶成像仪(美国Protein Simple公司);BioTek Epoch型全波长酶标仪(美国伯腾仪器有限公司);BX53型显微镜(日本Olympus日立公司)。
2. 方法
2.1 分组、给药与CIRI大鼠模型制备
将144只Wistar大鼠按照随机数字表法平均分为假手术组、模型组、雷公藤甲素低、中、高剂量组(0.2、0.4、0.8 mg/kg)[10]和丁苯酞组(6 mg/kg)[11],每组24只。造模前3 d开始1次/d腹腔注射(ip)给药,假手术组和模型组ip给予生理盐水,注射体积均为5 ml/kg。除假手术组外,其余5组均参照杨丽等[12]报道方法构建CIRI大鼠模型。
2.2 神经功能缺失评分和脑梗死率检测
再灌注24 h后,分别随机取各组6只大鼠,参照文献[13]报道的方法进行神经功能缺失评分,无症状为0分、前肢不能伸展为1分、行走时转圈为2分、行走时跌倒为3分、不能行走或意识丧失为4分。ip戊巴比妥钠(40 mg/kg)进行麻醉后,颈椎脱臼处死,取大脑组织、-20 ℃冻存15 min后均匀厚度切为5片,2% TTC溶液恒温37 ℃避光染色30 min,每5 min翻转一次,正常组织呈红色、梗死组织呈苍白色,通过图像分析软件计算脑梗死率。
2.3 血脑屏障(BBB)通透性检测[14]
分别随机取各组6只大鼠,经尾静脉注射2% EB溶液4 ml/kg,30 min后实施麻醉,开胸后经“左心室-右心耳”灌注生理盐水至流出液清亮,取脑称重,1 ml/100 mg加入甲酰胺后60 ℃水浴24 h,4 ℃匀浆后15000 rpm离心20 min取上清液,通过酶标仪检测620 nm处吸光度值,对照标准曲线测定EB含量。
2.4 缺血半暗带皮层神经元病理学改变的观察
分别随机取各组6只大鼠,ip戊巴比妥钠(40 mg/kg)进行麻醉后,颈椎脱臼处死,取缺血侧大脑皮层组织,经4%多聚甲醛溶液固定、脱水、石蜡包埋、切片、烤片等处理后,按照HE试剂盒和TUNEL试剂盒操作说进行染色处理后,通过光学显微镜观察缺血半暗带皮层神经元病理学改变。显微镜下计数TUNEL染色切片5个视野内细胞数和凋亡细胞数,计数缺血半暗带皮层神经元凋亡率。
2.5 缺血侧大脑皮层组织生化指标检测
取各组剩余的6只大鼠,ip戊巴比妥钠(40 mg/kg)进行麻醉后,颈椎脱臼处死,剥取缺血侧大脑皮层组织。①取部分缺血侧大脑皮层组织,加入5倍量4 ℃生理盐水研磨匀浆,3 500 r/min离心5 min分离上清液,按照试剂盒操作说明通过ELISA法检测缺血侧大脑皮层组织TNF-α、IL-1β含量。②取剩余部分缺血侧大脑皮层组织,加入适量蛋白裂解液后研磨匀浆,冰上静置30 min使其充分裂解,4 ℃、12 000 r/min离心25 min分离上清液,检测总蛋白浓度并配平后,30 μg等量上样,经10 % SDS-PAGE凝胶电泳分离蛋白、转膜和5%脱脂牛奶封闭1.5 h后,加入一抗稀释液TLR4(1∶800)、NF-κB(1∶1000)、p-NF-κB(1∶1000)、cleaved Caspase-3(1∶800)、Bcl-2(1∶500)、Bax(1∶500)和内参β-actin(1∶1500)4 ℃避光孵育过夜,洗膜后二抗稀释液(1∶3 000)室温孵育1.5 h,洗膜后ECL显影,通过Image J软件分析蛋白条带灰度值。
2.6 统计学分析
运用SPSS 20.0软件进行数据统计分析,计量资料符合正态分布以(
$ \bar x \pm s $ )表示,多组间比较采用单因素方差分析,方差齐时两两比较采用LSD-t检验,方差不齐时两两比较采用Dunnett's T3检验,P<0.05为差异有统计学意义。3. 结果
3.1 各组大鼠神经功能缺失评分和脑梗死率的比较
与假手术组比较,模型组大鼠神经功能缺失评分和脑梗死率显著升高(P<0.05)。与模型组比较,雷公藤甲素中、高剂量组和丁苯酞组神经功能缺失评分和脑梗死率显著降低(P<0.05)。与丁苯酞组比较,雷公藤甲素高剂量组神经功能缺失评分和脑梗死率显著降低(P<0.05)。见图1、表1。
表 1 各组大鼠神经功能缺失评分、脑梗死率、BBB通透性的比较($ \bar x \pm s $ ,n=6)组别 神经功能缺失
评分(分)脑梗死率
(%)EB含量
(μg/g)假手术组 0.00±0.00 0.00±0.00 0.49±0.06 模型组 2.84±0.39* 48.17±7.39* 1.54±0.27* 丁苯酞组 1.31±0.17△ 16.28±2.15△ 0.79±0.09△ 雷公藤甲素低剂量组 2.50±0.34 42.93±5.74 1.42±0.23 雷公藤甲素中剂量组 1.85±0.26△ 27.54±3.48△ 1.10±0.16△ 雷公藤甲素高剂量组 1.09±0.15△# 11.38±1.65△# 0.70±0.08△# *P<0.05,与假手术组比较;#P<0.05,与丁苯酞组比较;△P<0.05,与模型组比较。 3.2 各组大鼠BBB通透性的比较
与假手术组比较,模型组大鼠脑组织EB含量显著升高(P<0.05)。与模型组比较,雷公藤甲素中、高剂量组和丁苯酞组脑组织EB含量显著降低(P<0.05)。与丁苯酞组比较,雷公藤甲素高剂量组脑组织EB含量显著降低(P<0.05)。见表1。
3.3 各组大鼠缺血半暗带皮层神经元病理学改变的比较
假手术组大鼠皮层神经元呈圆形或椭圆形,形态饱满,着色均匀,胞核居中。模型组大鼠缺血半暗带皮层神经元呈现形态不规则,胞体萎缩呈空泡样变,着色较深,核膜边界不清,炎性细胞浸润等病理学改变。与模型组比较,雷公藤甲素各剂量组和丁苯酞组缺血半暗带皮层神经元明显改善,其中雷公藤甲素高剂量组效果优于雷公藤甲素低、中剂量组和丁苯酞组,见图2。
3.4 各组大鼠缺血半暗带皮层神经元凋亡率的比较
与假手术组比较,模型组大鼠缺血半暗带皮层神经元凋亡率显著升高(P<0.05)。与模型组比较,雷公藤甲素中、高剂量组和丁苯酞组凋亡率显著降低(P<0.05)。与丁苯酞组比较,雷公藤甲素高剂量组凋亡率显著降低(P<0.05),见表2。
表 2 各组大鼠缺血半暗带皮层神经元凋亡率的比较($ \bar x \pm s $ ,n=6)组别 凋亡率(%) 假手术组 2.68±0.35 模型组 53.07±8.42* 丁苯酞组 17.69±2.90△ 雷公藤甲素低剂量组 45.93±7.67 雷公藤甲素中剂量组 31.52±5.08△ 雷公藤甲素高剂量组 12.88±1.74△# *P<0.05,与假手术组比较;#P<0.05,与丁苯酞组比较;△P<0.05,与模型组比较。 3.5 各组大鼠缺血侧大脑皮层组织TNF-α、IL-1β含量的比较
与假手术组比较,模型组缺血侧大脑皮层组织TNF-α、IL-1β含量显著升高(P<0.05)。与模型组比较,雷公藤甲素中、高剂量组和丁苯酞组TNF-α、IL-1β含量显著降低(P<0.05)。与丁苯酞组比较,雷公藤甲素高剂量组TNF-α、IL-1β含量显著降低(P<0.05)。见表3。
表 3 各组大鼠缺血侧大脑皮层组织TNF-α、IL-1β含量的比较($ \bar x \pm s $ ,n=6)组别 TNF-α(ng/g) IL-1β(pg/g) 假手术组 1.41±0.22 37.06±4.81 模型组 2.76±0.35* 68.42±7.79* 丁苯酞组 1.85±0.23△ 46.93±5.62△ 雷公藤甲素低剂量组 2.54±0.32 63.81±6.54 雷公藤甲素中剂量组 2.07±0.25△ 55.74±5.91△ 雷公藤甲素高剂量组 1.62±0.21△# 40.27±5.39△# *P<0.05,与假手术组比较;#P<0.05,与丁苯酞组比较;△P<0.05,与模型组比较。 3.6 各组大鼠缺血侧大脑皮层组织TLR4、NF-κB、p-NF-κB蛋白表达的比较
与假手术组比较,模型组大鼠缺血侧大脑皮层组织TLR4、p-NF-κB蛋白相对表达量和p-NF-κB/NF-κB比值显著升高(P<0.05)。与模型组比较,雷公藤甲素中、高剂量组和丁苯酞组TLR4、p-NF-κB蛋白相对表达量和p-NF-κB/NF-κB比值显著降低(P<0.05)。与丁苯酞组比较,雷公藤甲素高剂量组TLR4、p-NF-κB蛋白相对表达量和p-NF-κB/NF-κB比值显著降低(P<0.05),见图3、表4。
表 4 各组大鼠缺血侧大脑皮层组织TLR4、NF-κB、p-NF-κB蛋白表达及p-NF-κB/NF-κB比值的比较($\bar x \pm s$ ,n=6)组别 TLR4/β-actin NF-κB/β-actin p-NF-κB/β-actin p-NF-κB/NF-κB 假手术组 0.08±0.02 0.83±0.15 0.10±0.02 0.12±0.03 模型组 1.03±0.21* 0.78±0.14 0.81±0.15* 1.04±0.22* 丁苯酞组 0.20±0.04△ 0.84±0.15 0.29±0.06△ 0.35±0.08△ 雷公藤甲素低剂量组 0.87±0.16 0.79±0.16 0.68±0.13 0.86±0.18 雷公藤甲素中剂量组 0.65±0.13△ 0.78±0.15 0.35±0.07△ 0.45±0.10△ 雷公藤甲素高剂量组 0.16±0.03△# 0.74±0.14 0.14±0.03△# 0.19±0.04△# *P<0.05,与假手术组比较;#P<0.05,与丁苯酞组比较;△P<0.05,与模型组比较。 3.7 各组大鼠缺血侧大脑皮层组织cleaved Caspase-3、Bcl-2、Bax蛋白表达的比较
与假手术组比较,模型组大鼠缺血侧大脑皮层组织cleaved Caspase-3、Bax蛋白相对表达量显著升高,Bcl-2相对表达量显著降低,Bax/Bcl-2比值显著升高(P<0.05)。与模型组比较,雷公藤甲素中、高剂量组和丁苯酞组cleaved Caspase-3、Bax相对表达量显著降低,Bcl-2相对表达量显著升高,Bax/Bcl-2比值显著降低(P<0.05)。与丁苯酞组比较,雷公藤甲素高剂量组cleaved Caspase-3、Bax相对表达量显著降低,Bcl-2相对表达量显著升高,Bax/Bcl-2比值显著降低(P<0.05)。见图4、表5。
表 5 各组大鼠缺血侧大脑皮层组织cleaved Caspase-3、Bcl-2、Bax蛋白表达及Bax/Bcl-2比值的比较($ \bar x \pm s $ ,n=6)组别 cleaved Caspase-3/
β-actinBcl-2/β-actin Bax/β-actin Bax/Bcl-2 假手术组 0.09±0.02 0.92±0.19 0.15±0.03 0.16±0.03 模型组 0.61±0.11* 0.18±0.04* 0.97±0.18* 5.39±1.07* 丁苯酞组 0.16±0.03△ 0.29±0.06△ 0.20±0.04△ 0.69±0.10△ 雷公藤甲素
低剂量组0.55±0.09 0.21±0.04 0.88±0.16 4.19±0.75△ 雷公藤甲素
中剂量组0.42±0.08△ 0.32±0.06△ 0.47±0.09△ 1.47±0.20△ 雷公藤甲素
高剂量组0.12±0.02△# 0.56±0.11△# 0.26±0.5△# 0.46±0.07△# *P<0.05,与假手术组比较;#P<0.05,与丁苯酞组比较;△P<0.05,与模型组比较。 4. 讨论
线栓法是CIRI动物模型制备的经典方法,具有操作简便、重复率高、与人类临床病理接近等优点。本实验结果显示,CIRI模型大鼠呈现明显的神经功能障碍,BBB通透性异常升高,缺血半暗带大脑皮层神经元呈现形态不规则、胞体萎缩呈空泡样变、着色较深、核膜边界不清、炎性细胞浸润等病理学改变,与杨欢欢等[15]研究结果一致。本研究发现,经雷公藤甲素中、高剂量或丁苯酞预处理能够明显改善CIRI大鼠神经功能,降低脑梗死率和BBB通透性,改善缺血半暗带大脑皮层神经元病变并降低其凋亡率,并且雷公藤甲素高剂量组效果优于丁苯酞组;而雷公藤甲素低剂量组上述作用并不显著。说明雷公藤甲素具有抑制大鼠CIRI的作用,该作用具有一定的剂量依赖性。
CIRI病理机制非常复杂,其中炎症损伤和神经元凋亡发挥着关键作用。熊莉等[16]报道CIRI可诱导小胶质细胞活化而释放TNF-α、IL-1β等促炎因子,引发脑组织炎症反应发生。TNF-α和IL-1β具备炎性趋化属性,其中TNF-α可刺激促炎因子大量释放,IL-1β可诱导炎性细胞浸润,加重炎症反应[17]。Bcl-2和Bax是定位于线粒体膜的两种蛋白,二者均属于bcl蛋白家族,在细胞线粒体凋亡途径中发挥着重要作用。Bax可诱导细胞色素C由线粒体通过膜孔道进入细胞质,活化位于细胞质的Caspase-3,cleaved Caspase-3能够切割破坏膜蛋白、结构蛋白等引发细胞凋亡[18]。Bcl-2能够抑制Cyt C释放而表现为抑凋亡作用,并且Bcl-2与Bax能够结合形成无活性的二聚体。TLR4是定位于小胶质细胞的一种跨膜识别受体,TLR4能够诱导NF-κB磷酸化,p-NF-κB核转位后与DNA特定位点结合而诱导TNF-α、IL-1β等炎症因子转录与表达,进而加重炎症损伤[19]。此外,p-NF-κB可通过调控Bcl-2、Bax表达而诱导细胞凋亡[20]。Zhai Y等[21]发现抑制TLR4/NF-κB通路介导的炎症反应和凋亡可减轻大鼠CIRI。本实验结果显示,经雷公藤甲素中、高剂量或丁苯酞预处理能够明显降低CIRI大鼠缺血侧大脑皮层组织TNF-α、IL-1β含量和TLR4、cleaved Caspase-3蛋白相对表达量,降低p-NF-κB/NF-κB、Bax/Bcl-2比值,并且雷公藤甲素高剂量组效果优于丁苯酞组,而雷公藤甲素低剂量组上述作用并不显著。说明雷公藤甲素对CIRI大鼠炎症反应缺血半暗带大脑皮层神经元凋亡具有抑制作用,其机制可能与抑制TLR4/NF-κB通路活化有关,本结果与李晓蕾等[22]报道的药物抑制TLR4/NF-κB通路对局灶性脑缺血再灌注大鼠神经具有保护作用的结果相似。
综上所述,雷公藤甲素能够保护BBB通透性,减轻CIRI大鼠神经功能缺失和神经元病变,降低脑梗死率,作用机制可能与抑制TLR4/NF-κB通路及其介导的炎症反应和神经元凋亡有关。本研究结果为雷公藤甲素用于防治CIRI提供了理论依据。
-
表 1 各组大鼠神经功能缺失评分、脑梗死率、BBB通透性的比较(
$ \bar x \pm s $ ,n=6)组别 神经功能缺失
评分(分)脑梗死率
(%)EB含量
(μg/g)假手术组 0.00±0.00 0.00±0.00 0.49±0.06 模型组 2.84±0.39* 48.17±7.39* 1.54±0.27* 丁苯酞组 1.31±0.17△ 16.28±2.15△ 0.79±0.09△ 雷公藤甲素低剂量组 2.50±0.34 42.93±5.74 1.42±0.23 雷公藤甲素中剂量组 1.85±0.26△ 27.54±3.48△ 1.10±0.16△ 雷公藤甲素高剂量组 1.09±0.15△# 11.38±1.65△# 0.70±0.08△# *P<0.05,与假手术组比较;#P<0.05,与丁苯酞组比较;△P<0.05,与模型组比较。 表 2 各组大鼠缺血半暗带皮层神经元凋亡率的比较(
$ \bar x \pm s $ ,n=6)组别 凋亡率(%) 假手术组 2.68±0.35 模型组 53.07±8.42* 丁苯酞组 17.69±2.90△ 雷公藤甲素低剂量组 45.93±7.67 雷公藤甲素中剂量组 31.52±5.08△ 雷公藤甲素高剂量组 12.88±1.74△# *P<0.05,与假手术组比较;#P<0.05,与丁苯酞组比较;△P<0.05,与模型组比较。 表 3 各组大鼠缺血侧大脑皮层组织TNF-α、IL-1β含量的比较(
$ \bar x \pm s $ ,n=6)组别 TNF-α(ng/g) IL-1β(pg/g) 假手术组 1.41±0.22 37.06±4.81 模型组 2.76±0.35* 68.42±7.79* 丁苯酞组 1.85±0.23△ 46.93±5.62△ 雷公藤甲素低剂量组 2.54±0.32 63.81±6.54 雷公藤甲素中剂量组 2.07±0.25△ 55.74±5.91△ 雷公藤甲素高剂量组 1.62±0.21△# 40.27±5.39△# *P<0.05,与假手术组比较;#P<0.05,与丁苯酞组比较;△P<0.05,与模型组比较。 表 4 各组大鼠缺血侧大脑皮层组织TLR4、NF-κB、p-NF-κB蛋白表达及p-NF-κB/NF-κB比值的比较(
$\bar x \pm s$ ,n=6)组别 TLR4/β-actin NF-κB/β-actin p-NF-κB/β-actin p-NF-κB/NF-κB 假手术组 0.08±0.02 0.83±0.15 0.10±0.02 0.12±0.03 模型组 1.03±0.21* 0.78±0.14 0.81±0.15* 1.04±0.22* 丁苯酞组 0.20±0.04△ 0.84±0.15 0.29±0.06△ 0.35±0.08△ 雷公藤甲素低剂量组 0.87±0.16 0.79±0.16 0.68±0.13 0.86±0.18 雷公藤甲素中剂量组 0.65±0.13△ 0.78±0.15 0.35±0.07△ 0.45±0.10△ 雷公藤甲素高剂量组 0.16±0.03△# 0.74±0.14 0.14±0.03△# 0.19±0.04△# *P<0.05,与假手术组比较;#P<0.05,与丁苯酞组比较;△P<0.05,与模型组比较。 表 5 各组大鼠缺血侧大脑皮层组织cleaved Caspase-3、Bcl-2、Bax蛋白表达及Bax/Bcl-2比值的比较(
$ \bar x \pm s $ ,n=6)组别 cleaved Caspase-3/
β-actinBcl-2/β-actin Bax/β-actin Bax/Bcl-2 假手术组 0.09±0.02 0.92±0.19 0.15±0.03 0.16±0.03 模型组 0.61±0.11* 0.18±0.04* 0.97±0.18* 5.39±1.07* 丁苯酞组 0.16±0.03△ 0.29±0.06△ 0.20±0.04△ 0.69±0.10△ 雷公藤甲素
低剂量组0.55±0.09 0.21±0.04 0.88±0.16 4.19±0.75△ 雷公藤甲素
中剂量组0.42±0.08△ 0.32±0.06△ 0.47±0.09△ 1.47±0.20△ 雷公藤甲素
高剂量组0.12±0.02△# 0.56±0.11△# 0.26±0.5△# 0.46±0.07△# *P<0.05,与假手术组比较;#P<0.05,与丁苯酞组比较;△P<0.05,与模型组比较。 -
[1] 康利高阁, 孔令博, 高颖. 基于毒邪和玄府理论探析急性缺血性中风早期神经功能恶化的中医病机[J]. 北京中医药大学学报, 2021, 44(7):625-630. [2] 任靓明, 田红旗. 炎症因子及其抑制剂对脑缺血再灌注损伤作用的研究进展[J]. 中国医药导报, 2021, 18(12):61-64. [3] 谢明, 钟朕, 欧阳训彦, 等. 川芎嗪防治大鼠脑缺血/再灌注损伤后炎症反应与细胞凋亡的作用[J]. 解剖学报, 2021, 52(6):845-854. [4] 侯家保, 袁泉, 万杏, 等. 曲古抑菌素A预处理对小鼠脑缺血再灌注损伤皮质炎症反应和凋亡的影响[J]. 中国现代医学杂志, 2019, 29(9):1-5. [5] SHEN J Y, MA H L, WANG C Q. Triptolide improves myocardial fibrosis in rats through inhibition of nuclear factor kappa B and NLR family pyrin domain containing 3 inflammasome pathway[J]. Korean J Physiol Pharmacol, 2021, 25(6):533-543. doi: 10.4196/kjpp.2021.25.6.533 [6] LI Y Y, JIANG X E, SONG L T, et al. Anti-apoptosis mechanism of triptolide based on network pharmacology in focal segmental glomerulosclerosis rats[J]. Biosci Rep, 2020, 40(4):BSR20192920. doi: 10.1042/BSR20192920 [7] 刘磊, 卫昊, 陈丹丹, 等. 银杏叶提取物调控TLR4/NF-κB通路减轻急性脑缺血小鼠脑皮质缺血研究[J]. 中草药, 2019, 50(21):5282-5288. [8] 陈颖婷, 何柯新, 王云秀, 等. 雷公藤内酯醇对类风湿关节炎大鼠TLR4/NF-κB信号通路的调控作用研究[J]. 国际检验医学杂志, 2019, 40(17):2053-2057. doi: 10.3969/j.issn.1673-4130.2019.17.002 [9] 杨春治. 雷公藤内酯醇对大鼠变应性鼻炎TLR2-NF-κB信号通路的干预作用[J]. 山西医科大学学报, 2015, 46(7):636-640. [10] 潘发福, 梁明春, 刘卉芳, 等. 雷公藤内酯醇对慢性脑缺血模型大鼠海马突触素和突触后致密物95的影响[J]. 中国老年学杂志, 2012, 32(14):2964-2967. [11] 唐冰雪, 张源文, 吴雅晨, 等. 淫羊藿苷对脑缺血再灌注大鼠的神经保护及小胶质细胞TLR4/NF-κB通路的影响[J]. 中国实验方剂学杂志, 2020, 26(22):47-52. [12] 杨丽, 陈阳. 线栓法大鼠脑缺血再灌注损伤模型的实验研究[J]. 皖南医学院学报, 2017, 36(4):318-321. [13] LONGA E Z, WEINSTEIN P R, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1):84-91. doi: 10.1161/01.STR.20.1.84 [14] 周红军, 王彬, 沈光建, 等. 大鼠局灶性脑缺血再灌注血脑屏障通透性变化及对Occludin、ZO-1和PKCδ蛋白水平的影响[J]. 中国老年学杂志, 2021, 41(22):5067-5070. [15] 杨欢欢, 段毅. 藏红花素通过Nrf2/HO-1通路对脑缺血再灌注大鼠血脑屏障的保护作用[J]. 天津中医药, 2022, 39(8):1069-1076. [16] 熊莉, 彭丽佳, 邵建林. 小胶质细胞在脑缺血再灌注损伤中的治疗作用和进展[J]. 局解手术学杂志, 2020, 29(11):932-936. [17] 李萍, 王静, 戴成祥, 等. 移植前输注间充质干细胞对脑死亡供鼠移植肾炎症细胞浸润及TNF-α和IL-1β表达的影响[J]. 成都医学院学报, 2020, 15(1):40-45. [18] WANG H J, ZHU J, JIANG L P, et al. Mechanism of Heshouwuyin inhibiting the Cyt c/Apaf-1/Caspase-9/Caspase-3 pathway in spermatogenic cell apoptosis[J]. BMC Complement Med Ther, 2020, 20(1):180-193. doi: 10.1186/s12906-020-02904-9 [19] CHEN X W, YAO Z J, PENG X, et al. Eupafolin alleviates cerebral ischemia/reperfusion injury in rats via blocking the TLR4/NF-κB signaling pathway[J]. Mol Med Rep, 2020, 22(6):5135-5144. doi: 10.3892/mmr.2020.11637 [20] 任娟, 覃宏伟, 周冬亮, 等. 原花青素通过抑制Toll样受体4/核因子-κB信号通路对大鼠脑缺血再灌注损伤的保护作用[J]. 安徽医药, 2021, 25(3):431-435,637. [21] ZHAI Y Y, ZHU Y L, LIU J Y, et al. Dexmedetomidine post-conditioning alleviates cerebral ischemia-reperfusion injury in rats by inhibiting high mobility group protein B1 group (HMGB1)/toll-like receptor 4 (TLR4)/nuclear factor kappa B (NF-κB) signaling pathway[J]. Med Sci Monit, 2020, 26: e918617-918628. [PubMed [22] 李晓蕾, 朱海生, 麻瑞娟, 等. 基于TLR4/NF-κB通路探讨藏红花素对局灶性脑缺血再灌注损伤大鼠的神经保护作用[J]. 康复学报, 2022, 32(6):518-526. -






 下载:
下载:







 下载:
下载:


