-
积雪草酸,是一种乌苏烷型三萜化合物,是积雪草中的主要药用成分,具有保肝、抗肿瘤、改善认知、降血糖、抗炎、抗菌、护肤等药理作用[1-2]。但是积雪草酸溶解度小,口服生物利用度低,较难通过血脑屏障,使得积雪草酸的使用受到一定限制,已有研究人员对积雪草酸进行了多种化学修饰,获得了一系列不同特性的积雪草酸衍生物[1-5]。由于积雪草酸结构的特殊性,化学修饰位点较少,生物修饰是对天然药物进行结构修饰的重要方法,已有研究报道通过微生物对积雪草酸进行生物修饰[6-8]。本实验通过总状共头霉CGMCC 3.2500对积雪草酸进行结构修饰,采用高分辨质谱(HR-ESI-MS)以及多种核磁共振(NMR)波谱:氢谱(1H NMR)、碳谱(13C NMR)、1H-13C异核单量子相干谱(1H-13C HSQC)、1H-13C异核多键相关谱(1H-13C HMBC)、1H-1H 核Overhauser效应谱(1H-1H NOESY)等技术对其结构进行确证,获得了一个新的化合物,为积雪草酸的应用与开发提供参考依据。
-
总状共头霉CGMCC 3.2500(中国普通微生物菌种保藏管理中心),4 ℃斜面保藏。
-
马铃薯培养基(PDA):将200 g马铃薯去皮切块置于1000 ml蒸馏水中,煮沸1 h,用纱布过滤,加葡萄糖20.0 g,琼脂15.0 g,将滤液补足至1.0 L,分装,121 ℃、30 min灭菌后,将试管倾斜放置,冷凝后即得固体马铃薯培养基。液体培养基的制备不加琼脂,其余步骤同上。
-
DRX-600光谱仪(德国Rheinstetten公司);Agilent 6538 VAD Accurate-Mass QTOF液质联用系统(美国安捷伦);Agilent 1260高效液相色谱仪(含G1311C 1260 VL型四元泵、G1316A 1260柱温箱、G1315D 1260 VL型全波长扫描检测器、G1364C 1260 FC-AS,美国安捷伦),ZORBAX Eclipse XDB-C18色谱柱;氘代吡啶(剑桥同位素实验室);积雪草酸(广西昌洲天然药业有限公司)。
-
将已经恢复培养的菌种接种至无菌的250 ml三角瓶(装有100 ml液体培养基)中,180 r/min、27 ℃下震荡培养72 h后取出,每瓶加入500 μl的积雪草酸乙醇溶液(4 mg/ml),相同条件继续培养10 d。设两组对照,一组接种微生物后只加入等体积的乙醇溶液(无底物);另一组加入等量的底物到空白培养基中,在相同条件下培养。发酵完成后过滤菌丝体,滤液用等体积的乙酸乙酯萃取3次,菌丝体用500 ml乙酸乙酯超声提取3次,每次30 min,合并乙酸乙酯萃取液及提取液,在60 ℃下真空浓缩至小体积,薄层色谱法(TLC)比较实验组与空白组的显色斑点,以氯仿/甲醇(9∶1)为展开剂,10%的硫酸乙醇溶液显色。
-
在10个1000 ml三角瓶中(每瓶装有400 ml培养基)以2%的接种量接入已恢复培养的总状共头霉CGMCC 3.2500菌种,置恒温振荡器中,180 r/min、27 ℃培养72 h后加入200.0 mg底物积雪草酸(溶于20 ml乙醇,每瓶加入2 ml),继续培养10 d。发酵完成后过滤菌丝体,滤液用等体积的乙酸乙酯萃取3次,将乙酸乙酯萃取液置旋转蒸发仪上浓缩至小体积,干燥,分别获得转化反应提取物0.4 g;转化反应提取物经凝胶柱纯化后,用半制备型高效液相色谱仪制备,流动相:甲醇/水/甲酸(60:40:0.05,V/V/V),流速3 ml/min,检测波长:210 nm,得到化合物1(10.5 mg,转化率5.25%)。
-
化合物1为白色固体粉末,高分辨质谱显示出[M-H]-分子离子峰m/z 501.3240,结合1H NMR谱和13C NMR谱推断确定分子式为C30H46O6。1H NMR(600 MHz, pyridine-d5)中,高场处有6组甲基氢信号δ 1.47 (3H, s)、δ 1.18 (3H, s)、δ 1.03 (3H, d, 6.6)、δ 0.98 (3H, s)、δ 0.92 (3H, d, 6.0)、δ 0.82 (3H, s);低场处有一活泼氢信号:δ 5.61 (t, 3.6),推测为双键上的氢。13C NMR谱检测结果显示两个不饱和碳原子δ 127.04和δ 140.86,一个羧基碳原子δ 180.36,一个羰基碳原子δ 213.29,综合以上信息可以推断该化合物为乌苏烷型五环三萜酸类化合物。
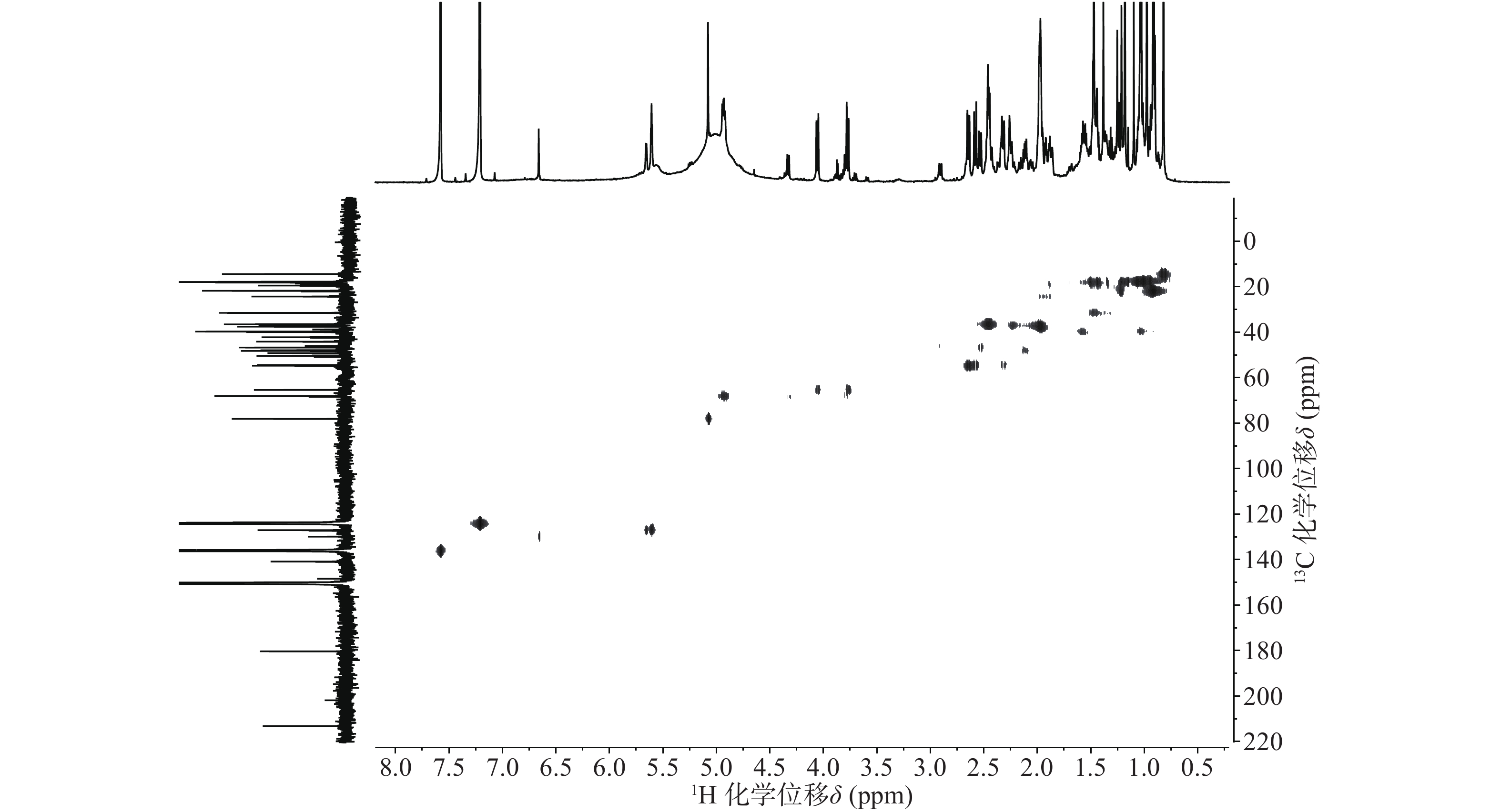
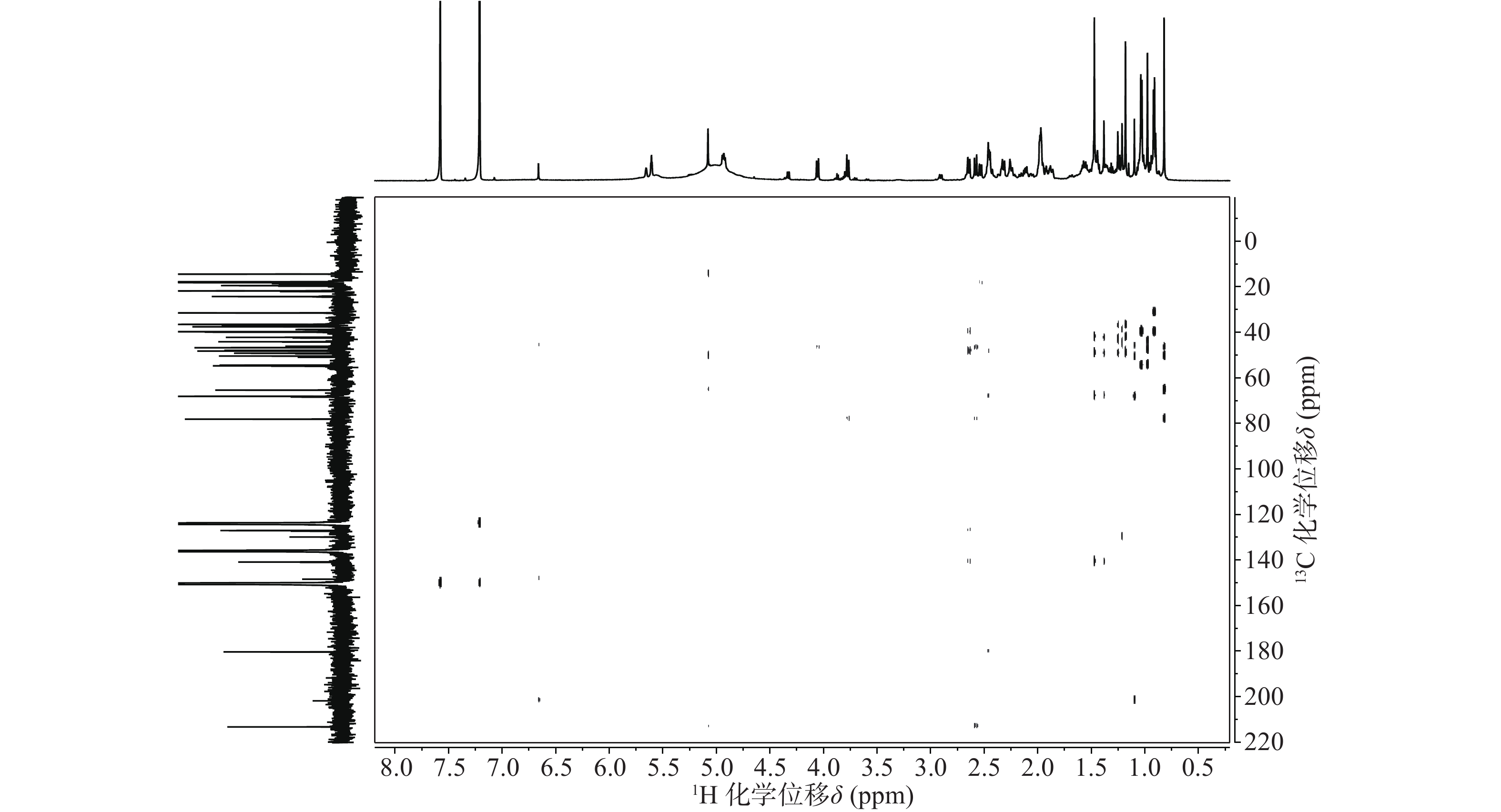
依据1H-13C HSQC谱(图1)、1H-13C HMBC谱(图2)可以对该化合物的碳氢作进一步的归属。
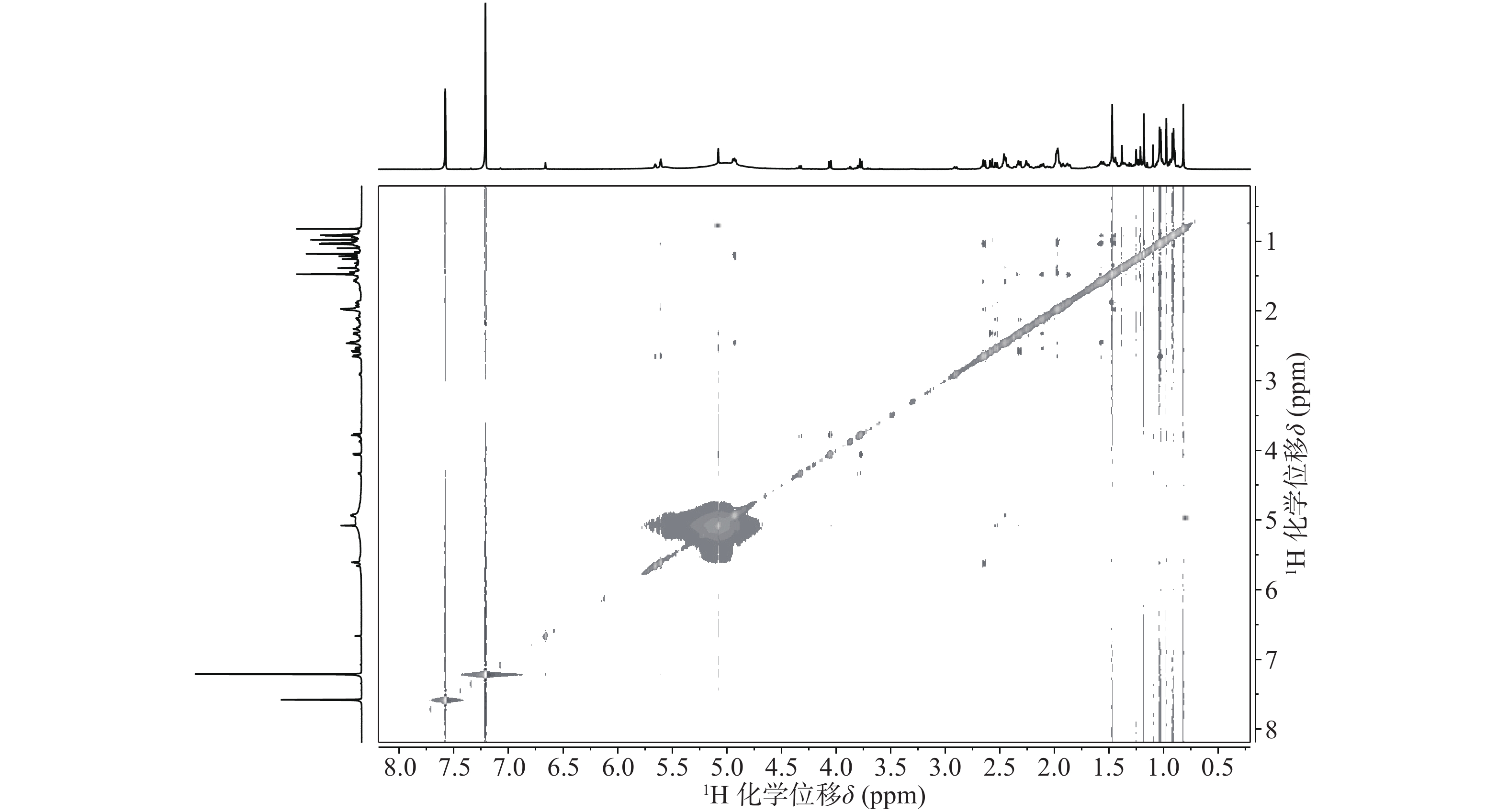
与底物积雪草酸比较,在13C NMR谱中,213.29 ppm出现一个羰基碳信号,该羰基碳与H-1 (δ 2.58, d, 12.0)、H-3 (δ 5.08, s) 远程相关,说明C-2位的羟基被氧化成羰基。H-3 (δ 5.08, s)和C-3 (δ 78.14)的化学位移未发生显著变化,但是在1H-1H NOESY(图3)中,可以观察到H-3 (δ 5.08, s)和H-24 (δ 0.82)之间的NOE效应,说明3位的羟基构型发生了变化,由β构型转变为α构型。
在13C NMR谱中,68.12 ppm处出现一个连氧碳信号,在1H NMR谱中,4.93 ppm(1H, dd, J=6.6, 9.6 Hz) 出现一个氢原子信号,二者在1H-13C HSQC谱中可观察到相关信号。在1H-13C HMBC谱中,可观察到H-27 (δ 1.47, s)、H-16 (δ 2.45, m)和δ 68.12的相关信号,说明15位发生了羟基化反应。同时H-15ax与H-16ax的耦合常数为9.6 Hz,确定该羟基为α型。
具体的1H NMR 和13C NMR 数据及归属见表1。
表 1 化合物1的NMR数据
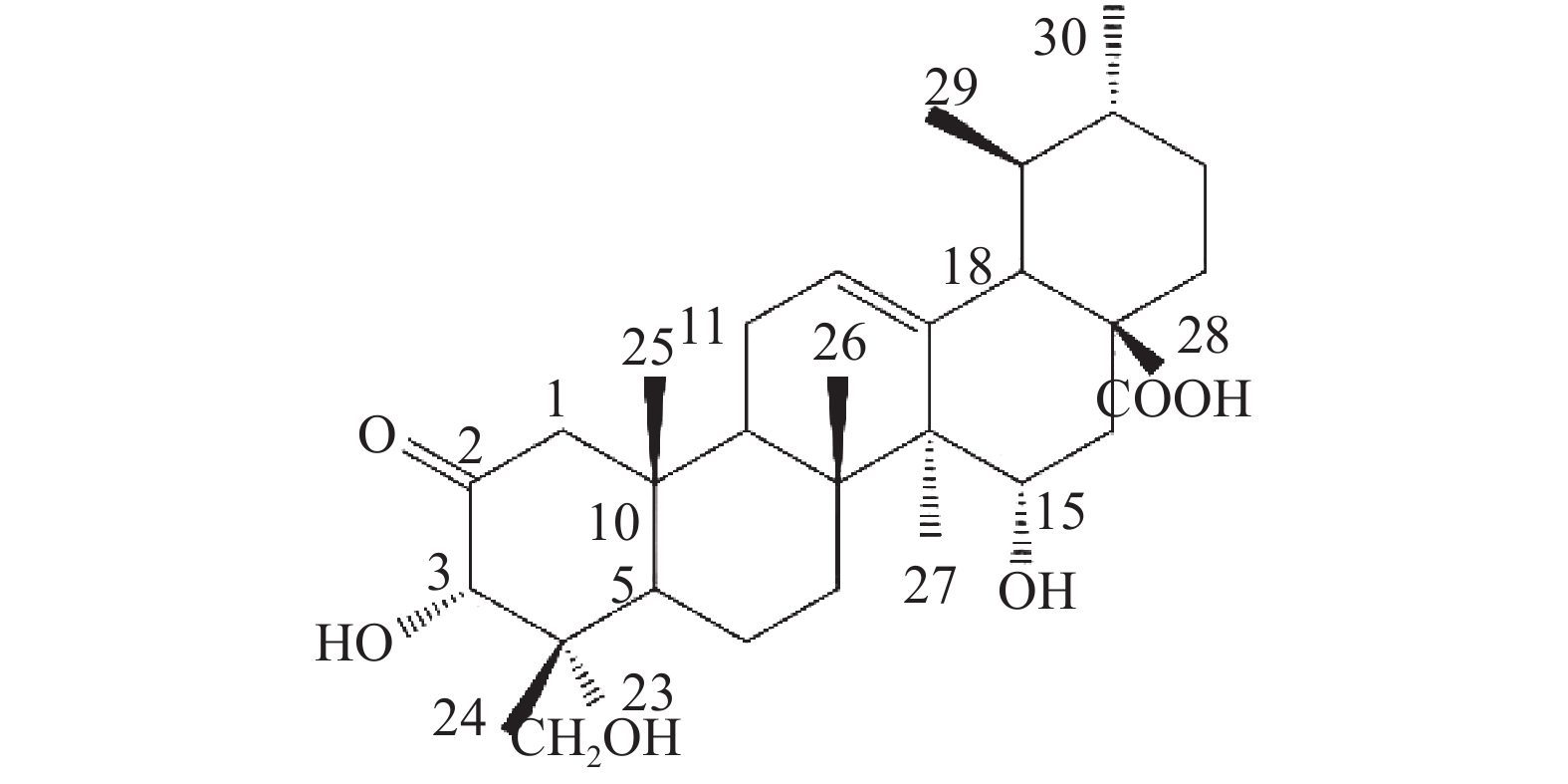
位点 C H HMBC 1 54.41 2.58 (d, 12.0); 2.31 (o) 2, 3, 5, 10, 25 2 213.29 / 3 78.14 5.08 (s) 2, 23, 24, 4 4 50.42 / 5 46.73 2.53 (d, 10.8) 4, 10, 7, 25, 24 6 19.48 1.87 (m), 1.97 (m) 7 36.52 2.46 (m); 2.33 (o) 8 42.19 / 9 48.22 2.12 (m) 1, 14, 8, 26 10 44.13 / 11 24.29 1.92 (t, 4.2); 1.96 (m) 8, 9, 13, 12 12 127.04 5.61 (t, 3.6) 14 13 140.86 / 14 49.18 / 15 68.12 4.93 (dd, 9.6, 6.6) 16 36.83 2.45 (m); 2.44 (m) 15, 18, 17, 28 17 47.89 / 18 54.70 2.64 (d, 11.4) 28, 13, 12, 17, 19, 22, 29 19 39.92 1.57 (m) 20 39.71 1.55 (m) 21 31.49 1.44 (m); 1.38 (s) 22 37.55 1.98 (m); 1.99 (m) 17, 20, 21, 28 23 65.38 4.06 (d, 11.4); 3.77 (d, 11.4) 3, 4, 5 24 14.43 0.82 (s) 3, 23, 4, 5 25 18.14 0.98 (s) 1, 5, 10 26 17.91 1.18 (s) 14, 8, 7 27 18.17 1.47 (s) 13, 15, 14, 8 28 180.36 / 29 17.78 1.03 (d, 6.6) 19, 20 30 21.79 0.92 (d, 6.0) 20, 21 综上,化合物1的结构确定为2-氧-3α,15α, 23-三羟基-12-烯-28-油酸(图4)。经文献检索,未发现与该化合物结构相同的报道,确定该化合物为新化合物。
Microbial transformation of Asiatic acid by Syncephalastrum racemosum CGMCC 3.2500
-
摘要:
目的 积雪草酸是积雪草中的主要药用成分,为乌苏烷型三萜化合物,具有多种生物活性,通过对其进行结构修饰,以获得活性更好的积雪草酸类似物。 方法 使用总状共头霉CGMCC 3.2500对积雪草酸进行生物转化,通过高分辨质谱(HR-ESI-MS)、核磁共振波谱(包括1H NMR、13C NMR、1H-13C HSQC、1H-13C HMBC、1H-1H NOESY)鉴定其结构。 结果 获得一个化合物,最终确定化合物的结构为2-氧-3α, 15α, 23-三羟基-12-烯-28-油酸,该化合物为新化合物。 结论 总状共头霉CGMCC 3.2500能够对积雪草酸进行结构修饰,获得积雪草酸类似物。 Abstract:Objective Asiatic acid is the main medicinal component of aursane pentacyclic triterpene and possessed various biological activities. In order to obtain better active Asiatic acid analogues, microbial transformation was used for structural modification. Methods Asiatic acid was biotransformed by Syncephalum racemosum CGMCC 3.2500. The structure of the compound was identified by high resolution electrospray ionization mass spectroscopy (HR-ESI-MS) and nuclear magnetic resonance spectroscopy (i.e., 1H NMR、13C NMR、1H-13C HSQC、1H-13C HMBC、1H-1H NOESY). Results The structure of the compound was determined as 2-oxo-3α, 15α, 23-trihydroxyurs-12-en-28-oic acid which was a new compound. Conclusion Syncephalum racemosum CGMCC 3.2500 can modify the structure of Asiatic acid and obtain Asiatic acid analogues. -
Key words:
- asiatic acid /
- microbial transformation /
- Syncephalastrum racemosum
-
积雪草酸,是一种乌苏烷型三萜化合物,是积雪草中的主要药用成分,具有保肝、抗肿瘤、改善认知、降血糖、抗炎、抗菌、护肤等药理作用[1-2]。但是积雪草酸溶解度小,口服生物利用度低,较难通过血脑屏障,使得积雪草酸的使用受到一定限制,已有研究人员对积雪草酸进行了多种化学修饰,获得了一系列不同特性的积雪草酸衍生物[1-5]。由于积雪草酸结构的特殊性,化学修饰位点较少,生物修饰是对天然药物进行结构修饰的重要方法,已有研究报道通过微生物对积雪草酸进行生物修饰[6-8]。本实验通过总状共头霉CGMCC 3.2500对积雪草酸进行结构修饰,采用高分辨质谱(HR-ESI-MS)以及多种核磁共振(NMR)波谱:氢谱(1H NMR)、碳谱(13C NMR)、1H-13C异核单量子相干谱(1H-13C HSQC)、1H-13C异核多键相关谱(1H-13C HMBC)、1H-1H 核Overhauser效应谱(1H-1H NOESY)等技术对其结构进行确证,获得了一个新的化合物,为积雪草酸的应用与开发提供参考依据。
1. 材料与方法
1.1 材料
1.1.1 菌株
总状共头霉CGMCC 3.2500(中国普通微生物菌种保藏管理中心),4 ℃斜面保藏。
1.1.2 培养基
马铃薯培养基(PDA):将200 g马铃薯去皮切块置于1000 ml蒸馏水中,煮沸1 h,用纱布过滤,加葡萄糖20.0 g,琼脂15.0 g,将滤液补足至1.0 L,分装,121 ℃、30 min灭菌后,将试管倾斜放置,冷凝后即得固体马铃薯培养基。液体培养基的制备不加琼脂,其余步骤同上。
1.1.3 试剂和仪器
DRX-600光谱仪(德国Rheinstetten公司);Agilent 6538 VAD Accurate-Mass QTOF液质联用系统(美国安捷伦);Agilent 1260高效液相色谱仪(含G1311C 1260 VL型四元泵、G1316A 1260柱温箱、G1315D 1260 VL型全波长扫描检测器、G1364C 1260 FC-AS,美国安捷伦),ZORBAX Eclipse XDB-C18色谱柱;氘代吡啶(剑桥同位素实验室);积雪草酸(广西昌洲天然药业有限公司)。
1.2 方法
1.2.1 菌种的筛选
将已经恢复培养的菌种接种至无菌的250 ml三角瓶(装有100 ml液体培养基)中,180 r/min、27 ℃下震荡培养72 h后取出,每瓶加入500 μl的积雪草酸乙醇溶液(4 mg/ml),相同条件继续培养10 d。设两组对照,一组接种微生物后只加入等体积的乙醇溶液(无底物);另一组加入等量的底物到空白培养基中,在相同条件下培养。发酵完成后过滤菌丝体,滤液用等体积的乙酸乙酯萃取3次,菌丝体用500 ml乙酸乙酯超声提取3次,每次30 min,合并乙酸乙酯萃取液及提取液,在60 ℃下真空浓缩至小体积,薄层色谱法(TLC)比较实验组与空白组的显色斑点,以氯仿/甲醇(9∶1)为展开剂,10%的硫酸乙醇溶液显色。
1.2.2 扩大培养及产物分离
在10个1000 ml三角瓶中(每瓶装有400 ml培养基)以2%的接种量接入已恢复培养的总状共头霉CGMCC 3.2500菌种,置恒温振荡器中,180 r/min、27 ℃培养72 h后加入200.0 mg底物积雪草酸(溶于20 ml乙醇,每瓶加入2 ml),继续培养10 d。发酵完成后过滤菌丝体,滤液用等体积的乙酸乙酯萃取3次,将乙酸乙酯萃取液置旋转蒸发仪上浓缩至小体积,干燥,分别获得转化反应提取物0.4 g;转化反应提取物经凝胶柱纯化后,用半制备型高效液相色谱仪制备,流动相:甲醇/水/甲酸(60:40:0.05,V/V/V),流速3 ml/min,检测波长:210 nm,得到化合物1(10.5 mg,转化率5.25%)。
2. 结果与分析
2.1 转化产物的结构鉴定
化合物1为白色固体粉末,高分辨质谱显示出[M-H]-分子离子峰m/z 501.3240,结合1H NMR谱和13C NMR谱推断确定分子式为C30H46O6。1H NMR(600 MHz, pyridine-d5)中,高场处有6组甲基氢信号δ 1.47 (3H, s)、δ 1.18 (3H, s)、δ 1.03 (3H, d, 6.6)、δ 0.98 (3H, s)、δ 0.92 (3H, d, 6.0)、δ 0.82 (3H, s);低场处有一活泼氢信号:δ 5.61 (t, 3.6),推测为双键上的氢。13C NMR谱检测结果显示两个不饱和碳原子δ 127.04和δ 140.86,一个羧基碳原子δ 180.36,一个羰基碳原子δ 213.29,综合以上信息可以推断该化合物为乌苏烷型五环三萜酸类化合物。
依据1H-13C HSQC谱(图1)、1H-13C HMBC谱(图2)可以对该化合物的碳氢作进一步的归属。
与底物积雪草酸比较,在13C NMR谱中,213.29 ppm出现一个羰基碳信号,该羰基碳与H-1 (δ 2.58, d, 12.0)、H-3 (δ 5.08, s) 远程相关,说明C-2位的羟基被氧化成羰基。H-3 (δ 5.08, s)和C-3 (δ 78.14)的化学位移未发生显著变化,但是在1H-1H NOESY(图3)中,可以观察到H-3 (δ 5.08, s)和H-24 (δ 0.82)之间的NOE效应,说明3位的羟基构型发生了变化,由β构型转变为α构型。
在13C NMR谱中,68.12 ppm处出现一个连氧碳信号,在1H NMR谱中,4.93 ppm(1H, dd, J=6.6, 9.6 Hz) 出现一个氢原子信号,二者在1H-13C HSQC谱中可观察到相关信号。在1H-13C HMBC谱中,可观察到H-27 (δ 1.47, s)、H-16 (δ 2.45, m)和δ 68.12的相关信号,说明15位发生了羟基化反应。同时H-15ax与H-16ax的耦合常数为9.6 Hz,确定该羟基为α型。
具体的1H NMR 和13C NMR 数据及归属见表1。
表 1 化合物1的NMR数据位点 C H HMBC 1 54.41 2.58 (d, 12.0); 2.31 (o) 2, 3, 5, 10, 25 2 213.29 / 3 78.14 5.08 (s) 2, 23, 24, 4 4 50.42 / 5 46.73 2.53 (d, 10.8) 4, 10, 7, 25, 24 6 19.48 1.87 (m), 1.97 (m) 7 36.52 2.46 (m); 2.33 (o) 8 42.19 / 9 48.22 2.12 (m) 1, 14, 8, 26 10 44.13 / 11 24.29 1.92 (t, 4.2); 1.96 (m) 8, 9, 13, 12 12 127.04 5.61 (t, 3.6) 14 13 140.86 / 14 49.18 / 15 68.12 4.93 (dd, 9.6, 6.6) 16 36.83 2.45 (m); 2.44 (m) 15, 18, 17, 28 17 47.89 / 18 54.70 2.64 (d, 11.4) 28, 13, 12, 17, 19, 22, 29 19 39.92 1.57 (m) 20 39.71 1.55 (m) 21 31.49 1.44 (m); 1.38 (s) 22 37.55 1.98 (m); 1.99 (m) 17, 20, 21, 28 23 65.38 4.06 (d, 11.4); 3.77 (d, 11.4) 3, 4, 5 24 14.43 0.82 (s) 3, 23, 4, 5 25 18.14 0.98 (s) 1, 5, 10 26 17.91 1.18 (s) 14, 8, 7 27 18.17 1.47 (s) 13, 15, 14, 8 28 180.36 / 29 17.78 1.03 (d, 6.6) 19, 20 30 21.79 0.92 (d, 6.0) 20, 21 综上,化合物1的结构确定为2-氧-3α,15α, 23-三羟基-12-烯-28-油酸(图4)。经文献检索,未发现与该化合物结构相同的报道,确定该化合物为新化合物。
3. 讨论
积雪草酸是中药积雪草中的主要有效成分,具有多种生物活性[9]。微生物转化具有专一性强、条件温和等优点[10]。本研究通过总状共头霉CGMCC 3.2500对积雪草酸的生物转化,获得一个新化合物:2-氧-3α15α, 23-三羟基-12-烯-28-油酸。从催化反应的位置看,2位的羟基发生氧化生成了羰基,3位的羟基的立体结构由β变成α,15位发生羟基化反应。这些结构的变化由化学反应很难实现,也体现了生物转化高度的位置选择性和立体选择性。化合物1的转化率为5.25%,需要进一步优化转化条件,以提高转化效率。
-
表 1 化合物1的NMR数据
位点 C H HMBC 1 54.41 2.58 (d, 12.0); 2.31 (o) 2, 3, 5, 10, 25 2 213.29 / 3 78.14 5.08 (s) 2, 23, 24, 4 4 50.42 / 5 46.73 2.53 (d, 10.8) 4, 10, 7, 25, 24 6 19.48 1.87 (m), 1.97 (m) 7 36.52 2.46 (m); 2.33 (o) 8 42.19 / 9 48.22 2.12 (m) 1, 14, 8, 26 10 44.13 / 11 24.29 1.92 (t, 4.2); 1.96 (m) 8, 9, 13, 12 12 127.04 5.61 (t, 3.6) 14 13 140.86 / 14 49.18 / 15 68.12 4.93 (dd, 9.6, 6.6) 16 36.83 2.45 (m); 2.44 (m) 15, 18, 17, 28 17 47.89 / 18 54.70 2.64 (d, 11.4) 28, 13, 12, 17, 19, 22, 29 19 39.92 1.57 (m) 20 39.71 1.55 (m) 21 31.49 1.44 (m); 1.38 (s) 22 37.55 1.98 (m); 1.99 (m) 17, 20, 21, 28 23 65.38 4.06 (d, 11.4); 3.77 (d, 11.4) 3, 4, 5 24 14.43 0.82 (s) 3, 23, 4, 5 25 18.14 0.98 (s) 1, 5, 10 26 17.91 1.18 (s) 14, 8, 7 27 18.17 1.47 (s) 13, 15, 14, 8 28 180.36 / 29 17.78 1.03 (d, 6.6) 19, 20 30 21.79 0.92 (d, 6.0) 20, 21 -
[1] 冯旭, 郭飞飞, 赵龙, 等. 积雪草酸药理作用及其结构修饰的研究进展[J]. 中草药, 2014, 45(07):1037-1042. [2] LV J W, SHARMA A, ZHANG T, et al. Pharmacological review on Asiatic acid and its derivatives: A potential compound[J]. SLAS Technol,2018,23(2):111-127. [3] 赖俞瑾, 王胜浩, 曾苏. 积雪草有效成分ADME的特性概述[J]. 中国现代应用药学, 2013, 30(7):805-808. [4] ZHANG L Y, CHEN J, GONG Y C, et al. Synthesis and biological evaluation of Asiatic acid derivatives as inhibitors of glycogen phosphorylases[J]. Chem Biodivers,2009,6(6):864-874. doi: 10.1002/cbdv.200800092 [5] ZHAO L X, PARK H G, JEW S S, et al. Modification of C11, C28, C2, 3, 23 or C2, 23, 28 functional groups on Asiatic acid and evaluation of hepatoprotective effects[J]. Bull Korean Chem Soc,2007,28(6):970-976. doi: 10.5012/bkcs.2007.28.6.970 [6] HE W N, DAI J G, YE M, et al. Microbial transformation of Asiatic acid by Alternaria longipes[J]. J Asian Nat Prod Res,2010,12(9):760-764. doi: 10.1080/10286020.2010.501505 [7] GUO F F, FENG X, CHU Z Y, et al. Microbial transformation of Asiatic acid[J]. J Asian Nat Prod Res,2013,15(1):15-21. doi: 10.1080/10286020.2012.741124 [8] HUANG F X, LIN X H, HE W N, et al. Two new oxidation products obtained from the biotransformation of Asiatic acid by the fungus Fusarium avenaceum AS 3.4594[J]. J Asian Nat Prod Res,2012,14(11):1039-1045. doi: 10.1080/10286020.2012.702761 [9] NAGOOR MEERAN M F, GOYAL S N, SUCHAL K, et al. Pharmacological properties, molecular mechanisms, and pharmaceutical development of Asiatic acid: a pentacyclic triterpenoid of therapeutic promise[J]. Front Pharmacol,2018,9:892. doi: 10.3389/fphar.2018.00892 [10] 王珊珊, 胡萍, 余少文. 天然产物微生物转化的研究进展[J]. 中国新药杂志, 2016, 25(01):71-75. -





 下载:
下载:
 下载:
下载:


