-
RRx-001是一种源于航空工业的肿瘤免疫治疗药物[1],其化学结构中含有溴代乙酰和双硝基氮杂环丁基团,目前处于III期临床试验[2]。RRx-001作为单一药物、放疗增敏剂或免疫增敏剂[3],用于细胞肺癌[4]、转移性结直肠癌[5]、卵巢癌[6]和胶质母细胞瘤[7]等肿瘤的治疗,显示出良好的疗效和安全性。研究发现,RRx-001具有多种作用机制,如靶向CD47-SIRPα信号通路,使肿瘤相关巨噬细胞复极化,由抗炎症M2表型转为促炎症M1表型[8];使肿瘤血管正常化,增加化疗药物渗透,产生代谢产物RONS,导致肿瘤细胞坏死[9];通过表观遗传抑制活性激活抑癌基因[10]等。作为靶向CD47的小分子药物,RRx-001在临床试验中未发现CD47抗体药物常见的嗜血综合征,表现出优于抗体大分子药物的安全性[11]。但RRx-001也存在明显的输注部位反应,因而临床需要采用特殊的注射器材,通过血液共同输注方式给药。
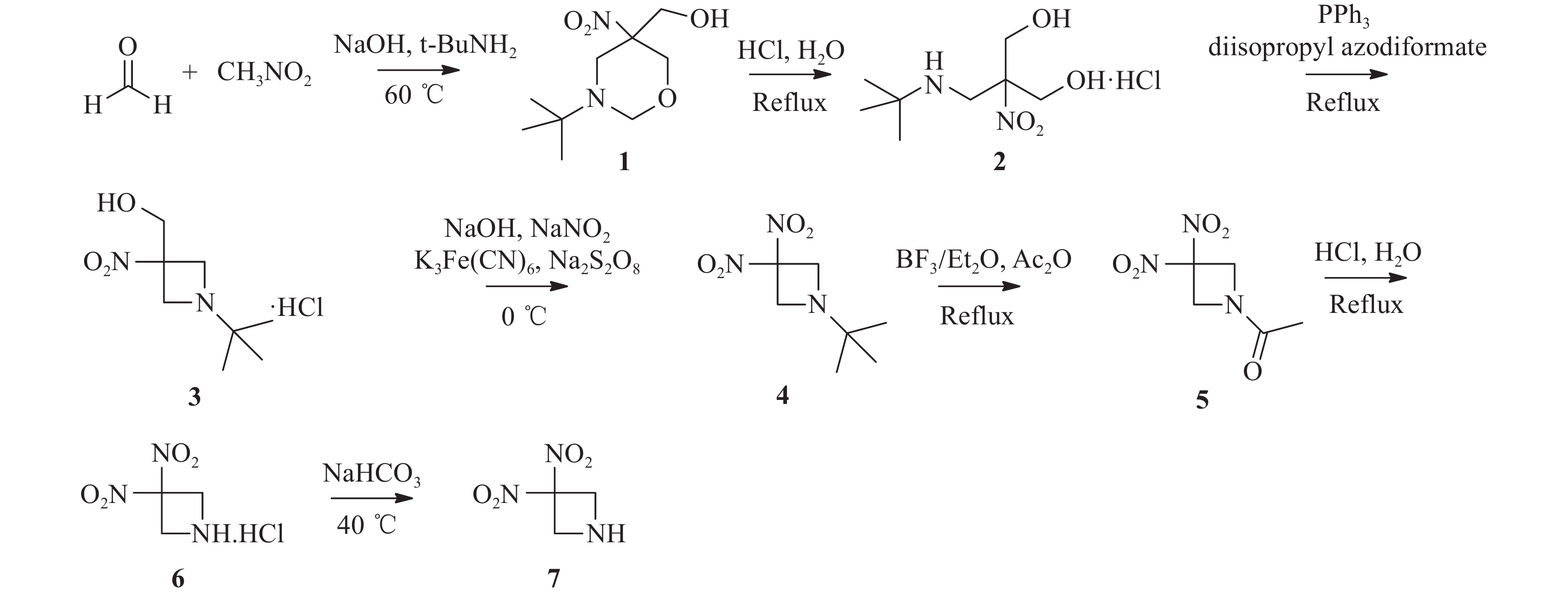
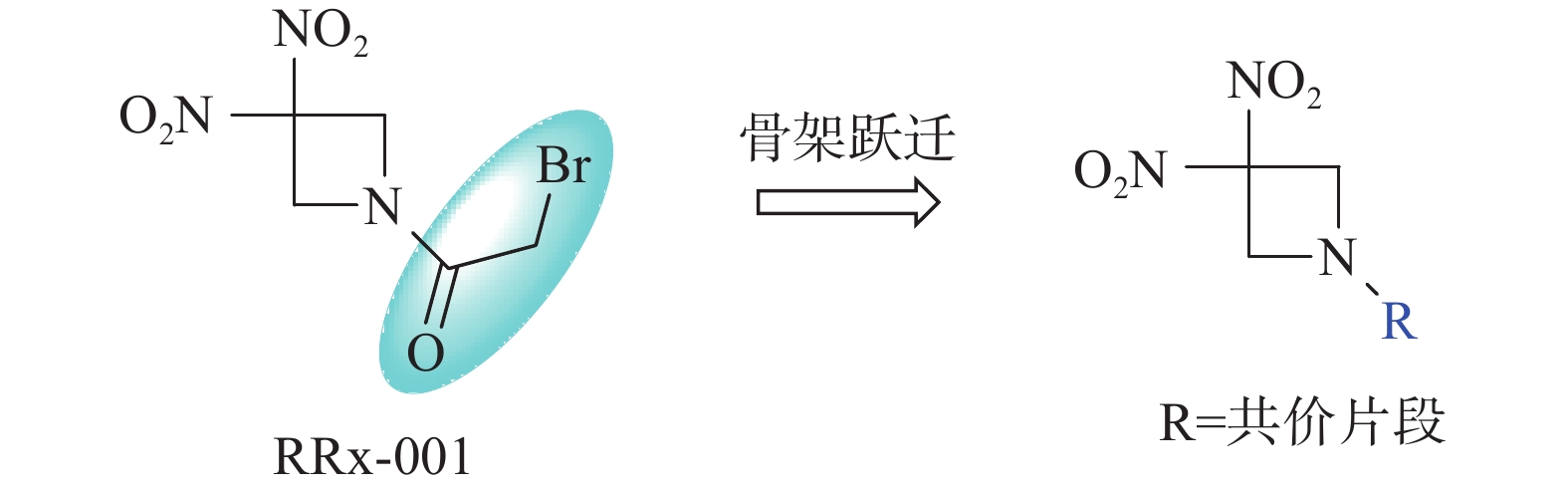
RRx-001结构中的溴代乙酰基为共价结合片段,也是其产生活性的药效基团[1]。为进一步探讨RRx-001的构效关系,本文拟采用骨架跃迁的药物设计策略,以不同的共价结合片段代替溴代乙酰基,分析其对抗肿瘤活性的影响,从而为后续基于RRx-001骨架的药物设计研究提供借鉴(图1)。
-
实验所用试剂分别采购自泰坦、毕得、乐研等公司,各类试剂均为市售分析纯或化学纯。核磁共振仪采用的是德国Bruke的600、400和300 MHz型,采用TMS作为内标,DMSO-d6、CDCl3或D2O等为溶剂。耦合常数(J)和化学位移(δ)单位分别用Hz和ppm来表示。高分辨质谱为德国Bruke micrOTOF
10257 ,抗肿瘤活性测试所用仪器为Biotek Synergy H2多功能酶标仪。薄层色谱(TLC)使用的硅胶板为GF254(中国青岛海洋化学),柱层析使用的是200~300目硅胶(中国青岛海洋化学)。 -
将多聚甲醛(24.1 g,0.8 mol)加入250 ml三颈烧瓶中,然后加入0.16 %氢氧化钠水溶液(40 ml),升温至40 ℃。缓慢滴加硝基甲烷(10.6 ml,0.2 mol),滴加结束后升温至60 ℃,滴加叔丁胺(21.2 ml,0.2 mol),滴加结束后继续反应10 min。反应液冷却至室温后过滤,水洗,干燥得38.8 g白色固体1,收率89.4 %,mp:136.1~138.2 ℃。1H NMR(400 MHz, DMSO-d6)δ:5.35(t, J=5.8 Hz, 1 H),4.42(t, J=10.0 Hz, 2 H),3.81(d, J=7.9 Hz, 1 H),3.63–3.51(m, 4 H),2.59(d, J=12.3 Hz, 1 H),0.95(s, 9 H)。
-
两颈烧瓶中依次加入500 ml无水乙醇、12 ml浓盐酸和化合物1(20.0 g,0.09 mol),加热回流反应6 h。反应结束后,减压蒸去溶剂,加入异丙醇搅拌0.5 h,过滤,洗涤,干燥得17.0 g白色晶体2,收率78.2 %,mp:175.5~178.3 ℃。1H NMR(400 MHz, D2O)δ:4.12(d, J=12.5 Hz, 2 H), 3.88(d, J=12.5 Hz, 2 H), 3.76(s, 2H), 1.36(s, 9 H)。
-
在氮气保护下,将化合物2(5.0 g,0.02 mol)加入到250 ml三颈烧瓶中,分别加入50 ml无水四氢呋喃和偶氮二甲酸二异丙酯(5.6 g,0.03 mol),升温至60 ℃。然后,将溶有三苯基磷(7.4 g,0.03 mol)的四氢呋喃溶液(15 ml)滴加到反应液中,滴加结束后继续反应5 h。反应液冷却至室温后过滤,洗涤,干燥得3.9 g白色固体3,收率86.6 %,mp:165.3~174.0 ℃。1H NMR(400 MHz, D2O)δ:4.74(s, 2 H), 4.43(s, 2 H), 4.16(s, 2 H), 1.26(s, 9 H)。
-
将化合物3(7.0 g,0.03 mol)和氢氧化钠水溶液(4.3 g,90 ml H2O)加入到250 ml两颈烧瓶中,室温搅拌2 h,冰浴冷却到10 ℃以下后,滴加亚硝酸钠(8.6 g,0.12 mol)、K3Fe(CN)6(1.0 g,0.003 mol)和水(5 ml)配成的溶液。控制反应温度为10~15 ℃下,分批次加入过硫酸钠(10.3 g,0.04 mol),然后升温至室温,反应过夜。反应液用20 ml二氯甲烷萃取3次,有机相用无水硫酸钠干燥,过滤,滤液减压蒸去溶剂得5.5 g黄色液体4,收率88.1 %。1H NMR(400 MHz, CDCl3)δ:4.12(s, 4 H), 1.05(s, 9 H)。
-
25 ml两颈烧瓶中依次加入化合物4(5.0 g,0.03 mol)、醋酸酐(9.8 ml,0.11 mol)和三氟硼酸乙醚溶液(0.5 ml,3.88 mmol),加热至120 ℃,回流反应12 h。减压蒸去溶剂,柱层析纯化(二氯甲烷 : 甲醇=100 : 1)得2.8 g淡黄色固体5,收率60.0 %,mp:110.1~113.9 ℃。1H NMR(600 MHz, CDCl3)δ:4.98(s, 2 H), 4.82(s, 2 H), 2.02(s, 3 H)。
-
将化合物5(1.0 g,5.29 mmol)加入到50 ml单颈烧瓶,然后加入6.3 ml 的5 %盐酸溶液,回流反应4 h。反应液冷却至室温,过滤,滤液减压蒸去溶剂得0.6 g黄色固体6,收率58.2 %,mp:150.3~155. 2 ℃。1H NMR(600 MHz, DMSO-d6)δ:4.98(s, 4 H), 3.42(s, 2 H)。
-
将化合物6(0.6 g,3.16 mmol)和15 ml水加入到50 ml两颈烧瓶中,升温至40 ℃,再滴加5 %碳酸氢钠溶液至pH为8。反应液用10 ml二氯甲烷萃取3次,有机相用无水硫酸钠干燥,过滤,减压蒸去溶剂得0.4 g黄色油状液体7,收率84.7 %。1H NMR(600 MHz, CDCl3)δ:4.51(s, 4 H), 2.20(s, 1 H)。
-
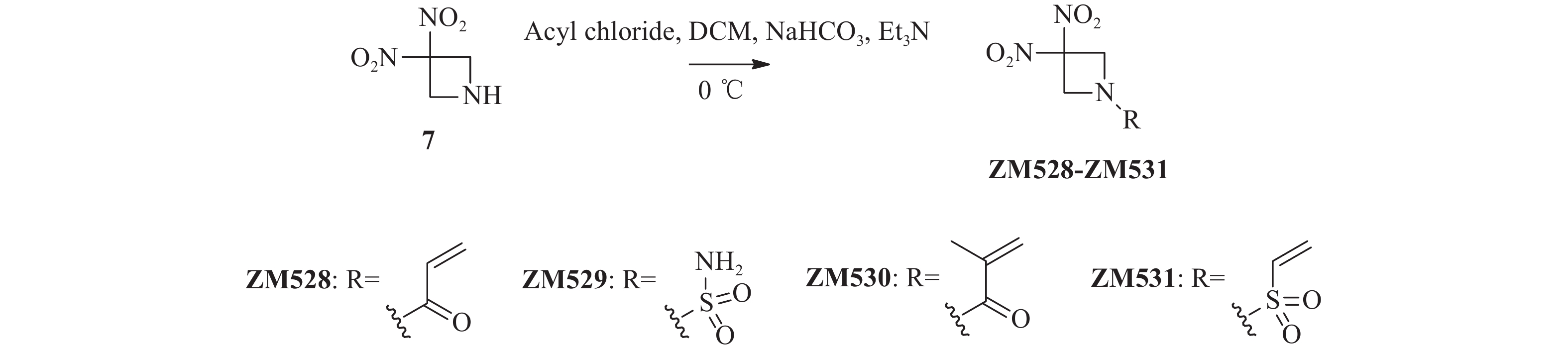
将关键中间体3, 3-二硝基氮杂环丁烷7(74.0 mg,0.50 mmol)加入到25 ml单颈烧瓶后,分别加入干燥的二氯甲烷(4 ml)和碳酸氢钠(42.0 mg,0.50 mmol),冰浴冷却至0 ℃后,滴加各种酰氯或磺酰氯(0.55 mmol),完全反应后减压蒸去溶剂,柱层析纯化(二氯甲烷 : 甲醇=100 : 1)得化合物ZM528~ZM531。
ZM528,白色固体,83 mg,收率61.3%。1H NMR(300 MHz, CDCl3) δ: 6.46(dd, J=16.9, 1.2 Hz, 1 H), 6.16(dd, J=16.9, 10.4 Hz, 1 H), 5.88(dd, J=10.4, 1.2 Hz, 1 H), 4.96(s, 4 H). HRMS(ESI, positive)m/z calcd for C5H7N3O5 [M + H]+:
202.0464 ; found 202.0458。ZM529,白色固体,77 mg,收率60.2%。1H NMR(300 MHz, DMSO-d6)δ: 7.47(s, 2 H), 4.77(s, 4 H). HRMS(ESI, positive)m/z calcd for C3H6N4O6S [M + H]+:
226.0008 ; found 226.0013。ZM530,白色固体,54 mg,收率50.1%。1H NMR(600 MHz, CDCl3)δ: 5.63–5.61(m, 1 H), 5.45(s, 1 H), 4.93(s, 4 H), 1.97(dd, J=1.6, 1.1 Hz, 3 H)。HRMS(ESI, positive)m/z calcd for C7H9N3O5 [M + H]+:
216.0620 ; found 216.0615。ZM531,淡黄色固体,81 mg,收率69.6%。1H NMR(600 MHz, CDCl3)δ: 6.58(dd, J=16.5, 9.8 Hz, 1 H), 6.46(d, J=16.6 Hz, 1 H), 6.27(d, J=9.8 Hz, 1 H), 4.75(s, 4 H)。
-
选用人结肠癌细胞HCT-116和人非小细胞肺癌细胞A549,于海军军医大学药物化学教研室冻存和传代。96孔板边缘每孔加入100 μl的PBS溶液防止边缘效应,内部每孔加入浓度为7×104个/ml的细胞悬液100 μl,置于37 ℃、5%二氧化碳培养箱内。24 h后,弃去96孔板内培养液,每孔分别加入100 μl受试化合物样品液和对照品液,设三复孔。将96孔板置于37 ℃、5%二氧化碳培养箱中培养72 h。实验采用CCK-8法[14-16]。在基础培养基中加入10 % CCK-8试剂制成混合液,弃去96孔板内旧培养基,加入混合液,100 μl/孔,将96孔板置于37 ℃、5 %二氧化碳培养箱中孵育2~4 h。使用酶标仪于450 nm波长处测定荧光OD值。细胞生长抑制率IC%=(空白对照孔OD值-给药孔OD值)/空白对照孔OD值×100%。根据各个浓度的IC%值,用GraphPad软件进行线性回归,算出各受试化合物抑制细胞生长50%的药物浓度,即IC50。
-
参考文献[12-13]设计了关键中间体3, 3-二硝基氮杂环丁烷的合成路线,合成路线见图2。以多聚甲醛和硝基甲烷为起始原料,通过环合、开环、Mistunobu、反向Henrry、脱叔丁基/乙酰化、脱乙酰基、碱化等7步反应合成出关键中间体7,总收率为14.9 %。其中,反向Henrry反应对催化剂的用量和反应温度较为敏感,经过反应条件优化,反应温度为10~15 ℃时,亚硝酸钠和K3Fe(CN)6的用量分别为化合物3的4倍和10%时,该步反应收率达88.1%,相比原有路线提升了6.3%。
将关键中间体7与各种酰氯或磺酰氯在三乙胺和碳酸氢钠催化下发生酰胺化反应,以较高收率合成得到目标化合物ZM528~ZM531(图3)。
-
采用CCK-8法测定目标化合物对肿瘤细胞株HCT-116和A549的体外抗肿瘤活性,以多柔比星(DOX)和RRx-001为阳性对照药,结果见表1。从表中可以看出,4个化合物均能保持一定的抗肿瘤活性,但相比RRx-001,均出现明显下降,其中丙烯酰基类化合物ZM528活性最高,对HCT-116和A549的IC50分别为(6.0±2.7)和(5.1±4.8)μmol/L。当丙烯酰基的2位引入甲基后活性明显下降,以磺酰基代替酰基后,活性也呈现下降趋势。以磺酰胺基代替丙烯酰基后,对HCT-116和A549肿瘤细胞株的活性分别下降了6.4和5.4倍,但当以磺酰基代替磺酰胺基后活性基本保持。以上研究结果初步表明,RRx-001的溴代乙酰基对抗肿瘤活性影响较大,以其他共价结合片段代替后活性出现明显下降。
表 1 RRx-001衍生物体外抗肿瘤活性
化合物IC50(μmol/L) HCT-116细胞株 A549细胞株 RRx-001 0.94±0.7 <0.2 ZM528 6.0±2.7 5.1±4.8 ZM529 38.1±19.7 27.3±10.4 ZM530 >50 14.4±3.0 ZM531 34.5±13.5 36.3±5.3 DOX <0.2 <0.2 -
采用骨架跃迁药物设计策略,设计合成出4个RRx-001衍生物。体外抗肿瘤活性研究发现,所有新化合物对HCT-116和A549细胞株的抑制活性均显示出明显的下降,但能保持一定的抗肿瘤活性,其中丙烯酰基类化合物ZM528活性最高,对两种肿瘤细胞株的IC50分别为(6.0±2.7)和(5.1±4.8) μmol/L,其原因可能是RRx-001的共价结合片段为溴乙酰基,结合活性高于其他共价结合片段。初步构效关系显示,氮杂环丁烷的氨基上溴代乙酰基取代后活性最高,丙烯酰基取代活性次之。研究结果和初步构效关系为以RRx-001为骨架的新型靶向CD47药物的进一步优化设计研究提供了理论指导。
Synthesis and Antitumor Activity of Novel RRx-001 Derivatives
-
摘要:
目的 研究引入共价结合片段后的RRx-001衍生物的抗肿瘤活性。 方法 设计合成了4个目标化合物,其结构通过1H NMR和HRMS等确证;选择人肺癌细胞株A549和人结肠癌细胞株HCT116进行体外抗肿瘤活性测试。 结果 所有化合物均显示出一定的抗肿瘤活性,其中化合物 ZM528 活性最高,对两种肿瘤细胞株的IC50值分别为(5.1±4.8)和(6.0±2.7)μmol/L。 结论 以新的共价结合片段代替RRx-001的溴代乙酰基后可保持抗肿瘤活性。 Abstract:Objectives To study the antitumor activities of RRx-001 derivatives with novel covalent fragments Methods Four targeted compounds were designed and synthesized. The structures were confirmed by 1H NMR and HRMS. A549 and HCT116 cancer cell lines were selected for antiproliferative activity assays. Results All the compounds revealed antitumor activities and compound ZM528 showed the best antitumor activity against these two cell lines with IC50 values of (5.1±4.8) and (6.0±2.7) μmol/L, respectively. Conclusions The result indicated that bromoacetyl group of RRx-001 could be substituted with other covalent fragments. -
Key words:
- RRx-001 /
- immuno-oncology /
- covalent inhibitor /
- synthesis /
- antitumor
-
随着经济的发展和人民生活水平的提高,糖尿病的患病率仍在逐年上升,血管并发症是导致患者残疾和死亡的主要原因,并给社会和经济的发展带来了沉重负担。内皮祖细胞(endothelial progenitor cells, EPCs)在各种因素刺激下,从骨髓动员到外周血,参与损伤内皮的修复,在血管新生中具有重要作用[1-3]。但是高血糖会导致EPCs数量减少及功能受损[4-5]。研究表明,雌激素降低是心血管疾病发病的危险因素。因此,本实验通过研究雌激素对糖尿病大鼠EPCs功能的改善作用并探讨可能的作用机制,为探讨糖尿病血管并发症提供理论依据。
1. 材料
1.1 实验动物
SPF 级 Wistar大鼠,雄性,体重(180±10)g(上海斯莱克实验动物有限公司)。实验期间,保持动物房室温在22 ℃左右,相对湿度70%左右,早8点至晚8点自动照明。动物自由进食,自由饮水,所有实验动物均符合实验动物伦理学要求。
1.2 药物与主要试剂
雌激素(Abcam公司);链脲佐菌素(Sigma aldrich公司);FITC标记的荆豆凝集素I(FITC-UAE-I)(美国Sigma公司);Dil 标记的乙酰化低密度脂蛋白(Dil-ac-LDL)(Molecular Probe公司);甲醛溶液(国药集团化学试剂有限公司);基质胶(matrigel)(Thermo Fisher公司);EGM-2 培养基(LON-ZA 公司);CCK-8试剂盒(日本Dojindo公司);NO检测试剂盒(美国Abcam公司)。
2. 方法
2.1 动物模型的制备
Wistar雄性大鼠,10~12周,适应性地喂养1周后,连续7 d空腹腹腔注射新鲜配制的链脲佐菌素(streptozotocin, STZ)55 mg/(kg·d),对照组大鼠腹腔注射等体积枸橼酸钠缓冲液。7 d后测空腹血糖(禁食12 h),将血糖值为13.5~25 mmol/L的大鼠作为糖尿病大鼠进行实验。注射STZ后,每周称体重,观察体重变化。大鼠给药、饲养过程中勤换垫料,勤补水。
2.2 大鼠骨髓来源EPCs的分离培养
大鼠麻醉后处死,将大鼠整体置于75%乙醇浸泡10 min。取出大鼠,使用吸水纸吸干动物身上水分后转移至超净工作台,剥离胫骨,使用无菌剪刀减去骨头两端,使用1ml PBS通过注射器冲洗骨髓并将冲洗液转移至15 ml无菌离心管,冲洗过程重复操作3次。用密度梯度离心法获取单核细胞,将单核细胞重悬于培养基EGM-2并调整细胞浓度至1×106个/ml,接种于预先包被好纤维连接蛋白的细胞培养皿,置于细胞培养箱37 ℃和5%CO2条件下培养。培养3 d后洗去未贴壁细胞,以后每3 d换培养液培养至7 d。PBS洗去未贴壁细胞,贴壁细胞供实验用。
2.3 大鼠骨髓来源EPCs的鉴定
培养7 d的EPCs用0.25%胰蛋白酶消化后收集于15 ml离心管中,将细胞用PBS 1000r/min离心5 min,清洗3次。用PBS 100 μl重悬细胞,每管加入CD34和CD133抗体各2 μl,4 ℃避光孵育30 min后用PBS清洗离心,将细胞重悬于300 μl PBS中避光保存待上机检测;同时将消化的细胞采用DiI-Ac-LDL 和FITC-UAE-I双染,倒置荧光显微镜观察染色结果,双染色阳性细胞为正在分化的EPCs。
2.4 实验分组
实验分3组:①对照组;②糖尿病组:M199培养基;③雌激素组:含雌激素10 nmol/L的M199培养基。在37 ℃,5% CO2培养箱中孵育24 h 后进行实验。
2.5 大鼠骨髓来源EPCs功能测定[6-7]
2.5.1 细胞迁移实验
3组EPCs用0.25%胰酶消化,将细胞重悬于EBM-2 培养基中,调整细胞密度为5×105个/ml,并取100 μl接种于Transwell 上室,在下室中加入600 μl含50 ng/ml 血管内皮生长因子的EGM-2 培养基。37 ℃、5% CO2孵育24 h 后,取出上室,用棉球轻轻擦拭上室底部膜内上表面的细胞,下室上表面用甲醛室温固定20 min,于37 ℃用0.1%结晶紫染色30 min,用PBS多次冲洗晾干后在160倍光学显微镜下观察并拍照,随机选取5个视野计算迁移细胞数并计算平均值。
2.5.2 EPCs小管形成实验
在冰上将48 孔板预冷,然后加入150 μl的基质胶Matrigel,放置于37 ℃孵育30 min。3组EPCs用0.25%胰酶消化,将5×104个细胞接种于Matrigel上,在37 ℃、5% CO2培养箱中孵育24 h 后,于160倍光学显微镜下观察并拍照,随机选取5个视野计算形成小管的数目并计算平均值。
2.6 骨髓来源EPCs中NO水平的测定
3组EPCs用0.25%胰酶消化,经PBS清洗2次,制成细胞悬液,采用NO检测试剂盒测定EPCs中NO的水平。按照说明书的操作方法,完成后置于酶标仪在540 nm波长处测定吸光度(A)。
2.7 EPCs增殖能力的测定
3组EPCs用0.25%胰酶消化,将100 μl细胞悬液接种于96孔培养板中并置于37 ℃、5% CO2培养箱培养24 h。每孔加入CCK-8溶液10 μl培养4 h,置于酶标仪于450 nm处测A值。
2.8 Western blotting测定EPCs中MnSOD水平
收集3组EPCs并提取蛋白,应用BCA法进行蛋白质定量。蛋白样本经煮沸变性、SDS-PAGE电泳后加入兔抗人锰超氧化物歧化酶(MnSOD)和肌动蛋白(β-actin)多克隆抗体(1∶1500稀释),蛋白质湿法转移至硝基纤维素膜,羊抗兔二抗(1∶2000稀释)室温孵育2 h,用ECL化学发光法显色,Image J凝胶成像分析系统扫描成像,测定目标条带的A值,以β-actin为内参比较同一条带与β-actin的灰度值进行分析。
2.9 ELISA检测EPCs上清液中TSP-1蛋白水平
收集3组EPCs上清液,按照说明书步骤进行操作。取各组细胞上清液各100 μl加入酶标板中37 ℃孵育90 min,然后加入100 μl生物素标记抗体工作液37 ℃孵育60 min。洗涤3次,加入100 μl酶结合物工作液在37 ℃孵育30 min后,洗涤5次。加入90 μl底物溶液37 ℃孵育15 min,最后加入终止液50 μl后,立即在450 nm波长处测量A值。
2.10 统计学处理
实验数据以(
$ \overline{\text{x}}\text{±}\text{s} $ )表示,采用GraghPad Prism软件进行统计处理,采用单因素方差分析(One-way ANOVA)检验差异的显著性。以P<0.05为差异有统计学意义。3. 实验结果
3.1 各组大鼠体重和血糖的变化
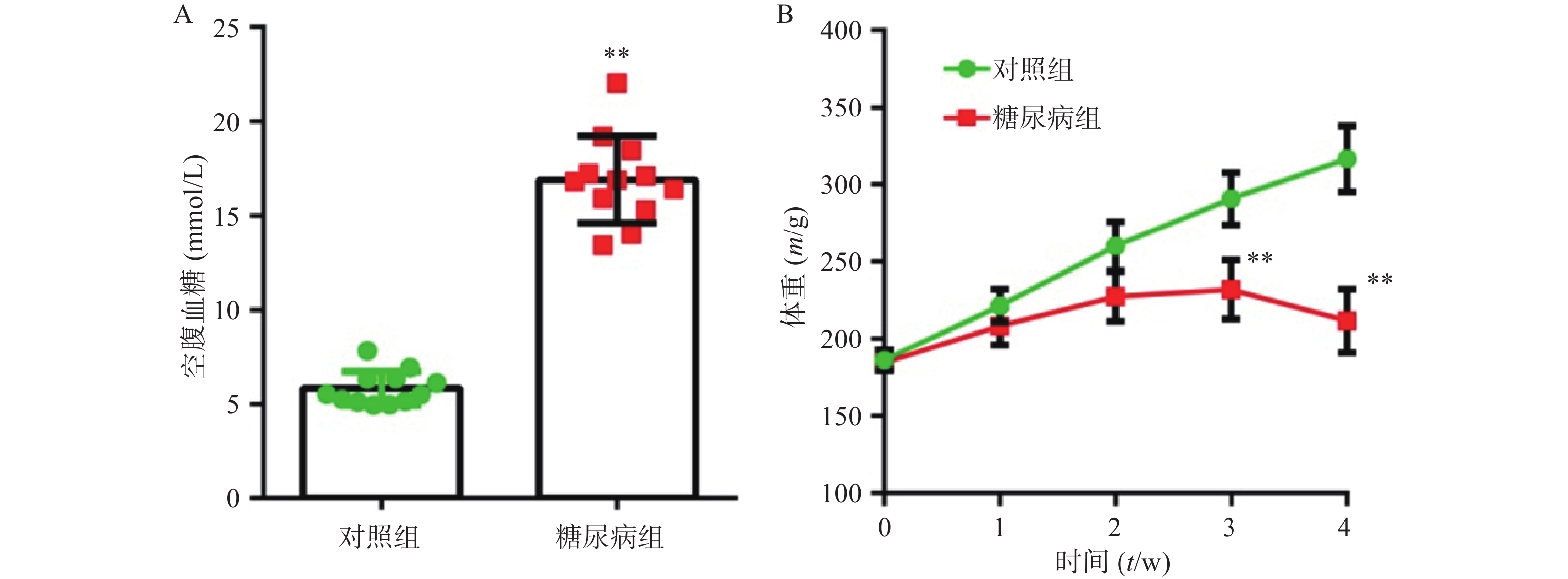
正常组大鼠,精神状态良好,动作自如,反应灵敏,毛发平伏有光泽。而糖尿病大鼠体重变轻,精神萎靡,反应迟钝,毛杂乱无光泽,动作迟缓,弓背捲体,尿量显著增加。在建模4周后,糖尿病模型组空腹血糖值(23.33±3.61)mmol/L明显高于对照组(16.91±2.30)mmol/L,组间差异有统计学意义(P<0.01) (图1A) 。对照组动物体重随时间增加而增加,模型组在前3周随时间缓慢增加,但最后1周出现体重下降趋势。在第3、4周,两组动物体重有显著差异(P<0.01) (图1B) 。
3.2 大鼠骨髓来源EPCs的分离培养和鉴定
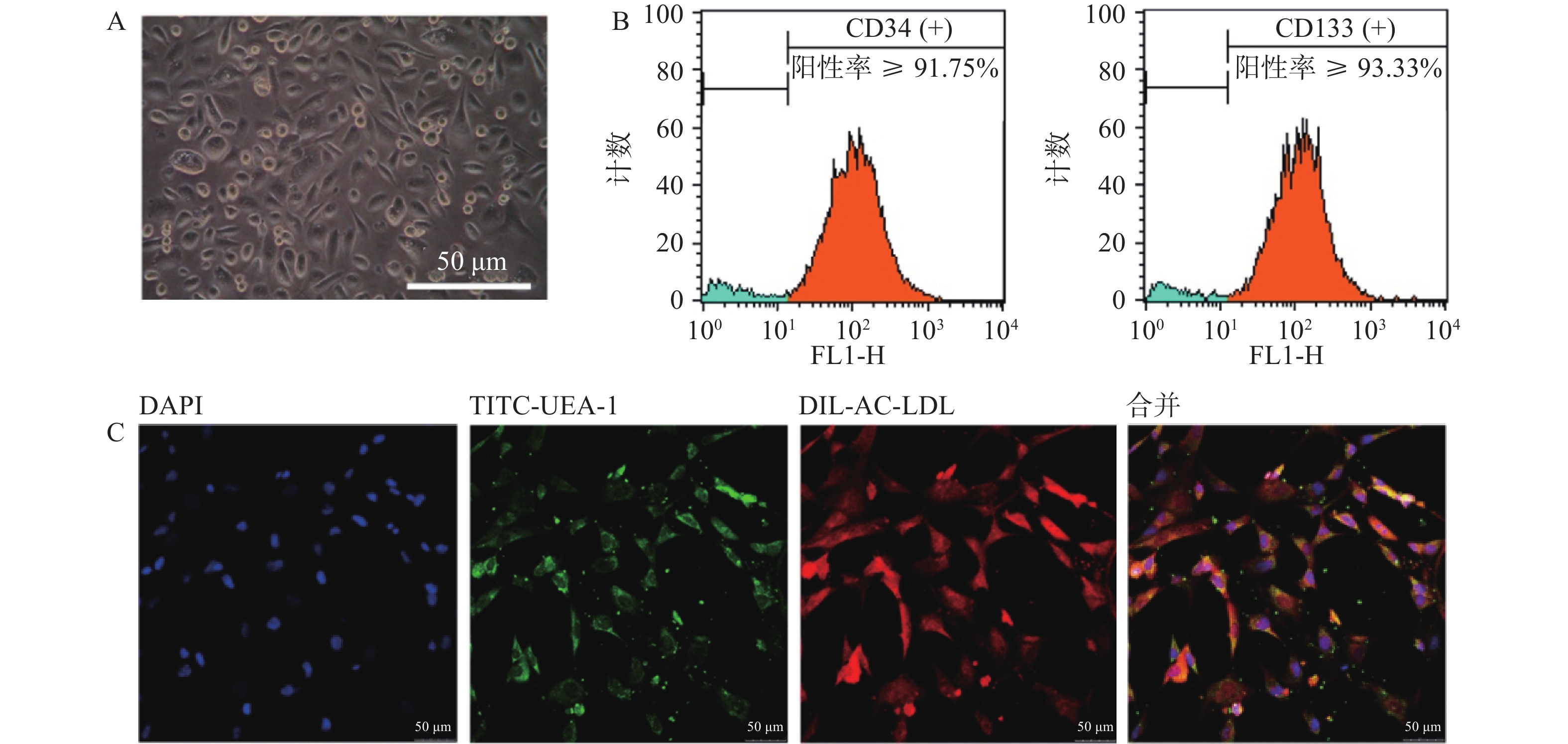
以EGM-2培养基定向诱导培养5 d后,镜下观察可见贴壁细胞形态由圆形逐渐向梭形转化(图2A)。流式细胞仪检测结果显示,CD34与CD133双阳性细胞占比不小于总细胞数的85.63%(图2B)。采用Dil-Ac-LDL和TITC-UEA-1双染细胞,显示红绿荧光双阳性细胞占视野中细胞的绝大多数(图2C)。上述结果表明,我们成功地制备了大鼠骨髓来源EPCs细胞,且细胞具有较高纯度。
3.3 雌激素孵育改善糖尿病大鼠EPCs的增殖和功能
与对照组比较,糖尿病大鼠EPCs的对数期增殖活性明显降低(P<0.01),而雌激素孵育后其增殖活性明显改善(P<0.01)(图3A)。与对照组比较,糖尿病大鼠EPCs的小管形成功能明显下降(P<0.01),而雌激素能够明显改善其小管形成功能(P<0.01)(图3B)。细胞迁移实验表明,与对照组比较,糖尿病大鼠EPCs细胞迁移能力明显受损(P<0.01),而雌激素孵育能够明显改善受损的细胞迁移能力(P<0.01)(图3C)。
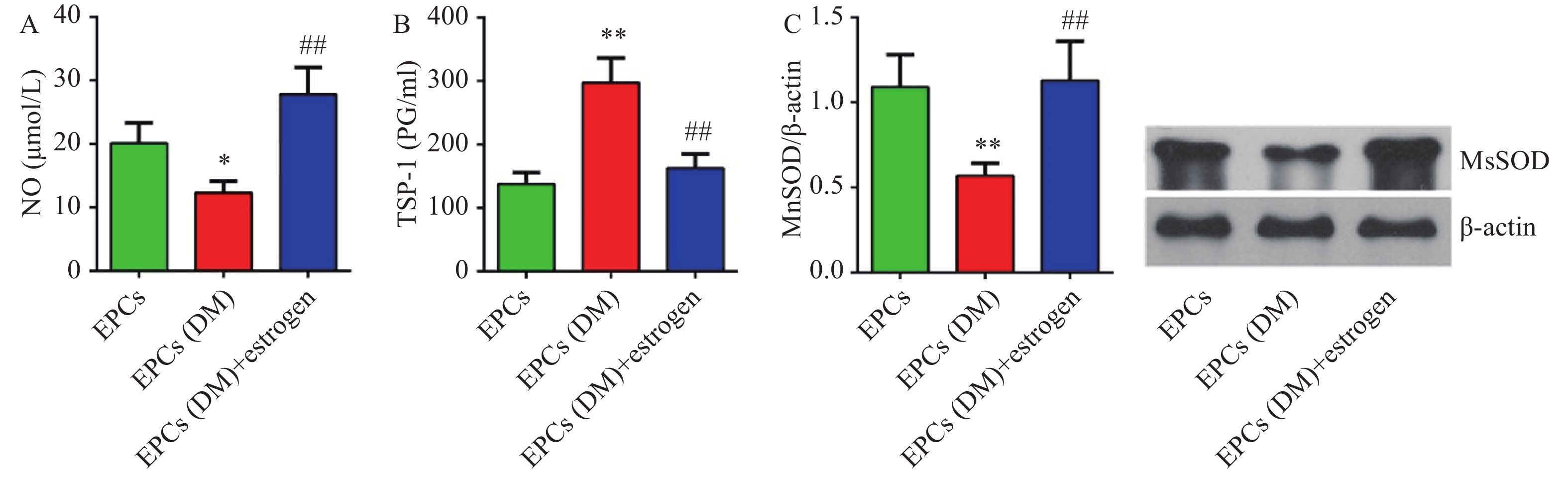
3.4 雌激素孵育上调糖尿病EPCs细胞内NO含量
糖尿病大鼠EPCs细胞中NO含量较对照组明显降低(P<0.05),而雌激素孵育能够明显上调NO的含量(P<0.01)(图4A)。
3.5 雌激素孵育上调EPCs细胞中MnSOD的表达并下调上清液中TSP-1的表达
糖尿病组大鼠EPCs细胞上清液中TSP-1含量明显高于对照组(P<0.01),而给与雌激素孵育后细胞上清液中TSP-1含量明显降低(P<0.05,图4C)。Western blotting检测显示,糖尿病组大鼠EPCs中MnSOD蛋白表达较对照组明显降低(P<0.01),而雌激素孵育能够明显上调细胞中MnSOD蛋白表达(P<0.01)(图4D)。
4. 讨论
EPCs主要来源于骨髓,在血管新生中具有重要作用。1997年Asahara等[1]首次将其命名为内皮祖细胞,而后其在心血管方面的研究越来越多。EPCs与心血管疾病存在密不可分的联系。研究表明,EPCs的数量和功能与高血压、糖尿病、血脂等呈负相关[8-11]。此外,EPCs在脑缺血、阿尔茨海默症治疗中表现出较好的疗效[12-13]。故改善EPCs功能及增加其数量可作为改善糖尿病血管并发症的新靶点。并将能表达CD34、CD133 等干细胞特征或血管内皮生长因子受体2 (VEGFR2)等细胞标志物定义为EPCs[14]。用密度梯度离心法获取骨髓单核细胞,经培养并采用流式细胞术和荧光显微镜法对细胞进行鉴定,结果表明本实验成功制备大鼠骨髓来源EPCs细胞,且细胞具有较高纯度。
流行病学提示雌激素为心脑血管疾病的保护因素。绝经后女性卒中发生风险明显高于绝经前女性[15]。美国的调查数据显示,年龄在18~39岁的成年男性发生高血压的风险高于同龄女性,但是在年龄大于60岁成人中男性风险低于女性[16]。不同性别发生高血压及靶器官损伤的差异与雌激素相关[17]。此外,杨莹莹[18]等的研究表明雌激素对急性期高血压脑出血患者的EPCs功能有改善作用且与雌激素浓度呈正相关。但是雌激素对糖尿病EPCs功能改善作用及相关机制的研究较少。
本实验采用腹腔注射链脲佐菌素制作大鼠糖尿病模型,提取其骨髓来源的EPCs进行实验,结果发现糖尿病大鼠骨髓EPC的增殖能力较正常EPCs明显下降,而雌激素体外孵育能明显促进其增殖活力;除增殖活力受到抑制外,糖尿病大鼠EPCs的迁移能力和小管形成功能也明显受损,而在体外给予雌激素10 nmol/L孵育后细胞功能得到明显改善。说明雌激素能促进糖尿病大鼠EPCs的增殖并改善其功能。
研究表明氧化应激可导致血管内皮损伤。MnSOD是一种存在于线粒体并能清除机体新陈代谢中产生的过多的氧自由基(O2·−)等有害物质的一种酶[19,]。MnSOD在一定程度上能抵抗高糖所增加线粒体中的活性氧(ROS)细胞的伤害[20]。本实验采用Western blotting检测EPCs细胞中MnSOD蛋白表达,糖尿病组大鼠EPCs细胞中MnSOD蛋白表达明显低于对照组,而给与雌激素体外孵育后能明显上调细胞中MnSOD蛋白表达,说明雌激素通过上调EPCs中MnSOD水平而改善细胞功能。
一氧化氮(NO)与血管健康密切相关。NO通过促进EPCs向内皮细胞分化进而修复受伤的内皮,而抑制内源性NO的合成对EPCs的迁移能力有不良影响[21]。有文献报道,高血糖通过增加活性氧积聚、降低一氧化氮生物利用度及抑制内皮依赖性血管舒张功能,导致严重的血管内皮功能障碍[22-23]。凝血酶敏感蛋白-1(TSP-1)属细胞外基质糖蛋白,其过表达能抑制EPCs的功能[24],而NO含量降低能诱导TSP-1的表达[25]。本实验发现,糖尿病组大鼠EPCs中NO含量明显降低而细胞上清中TSP-1含量明显升高,雌激素处理能够逆转上述改变,说明雌激素通过增加EPC内NO水平并降低TSP-1含量进而改善糖尿病EPCs功能。
综上所述,本研究证实雌激素能改善受损的糖尿病大鼠EPCs功能并促进其增殖,作用机制可能与其降低细胞内的氧化应激及下调TSP-1的表达相关。本研究为将来进一步进行雌激素在糖尿病血管并发症方面的研究提供了深入的实验与理论依据。
-
表 1 RRx-001衍生物体外抗肿瘤活性
化合物IC50(μmol/L) HCT-116细胞株 A549细胞株 RRx-001 0.94±0.7 <0.2 ZM528 6.0±2.7 5.1±4.8 ZM529 38.1±19.7 27.3±10.4 ZM530 >50 14.4±3.0 ZM531 34.5±13.5 36.3±5.3 DOX <0.2 <0.2 -
[1] ORONSKY B, GUO X N, WANG X H, et al. Discovery of RRx-001, a myc and CD47 downregulating small molecule with tumor targeted cytotoxicity and healthy tissue cytoprotective properties in clinical development[J]. J Med Chem, 2021, 64(11):7261-7271. doi: 10.1021/acs.jmedchem.1c00599 [2] ORONSKY B, REID T R, LARSON C, et al. REPLATINUM Phase III randomized study: RRx-001 + platinum doublet versus platinum doublet in third-line small cell lung cancer[J]. Future Oncol, 2019, 15(30):3427-3433. doi: 10.2217/fon-2019-0317 [3] JURGENSEN K J, SKINNER W K J, ORONSKY B, et al. RRx-001 radioprotection: enhancement of survival and hematopoietic recovery in gamma-irradiated mice[J]. Front Pharmacol, 2021, 12:676396. doi: 10.3389/fphar.2021.676396 [4] MORGENSZTERN D, ROSE M, WAQAR S N, et al. RRx-001 followed by platinum plus etoposide in patients with previously treated small-cell lung cancer[J]. Br J Cancer, 2019, 121(3):211-217. doi: 10.1038/s41416-019-0504-8 [5] REID T R, ABROUK N, CAROEN S, et al. ROCKET: phase II randomized, active-controlled, multicenter trial to assess the safety and efficacy of RRx-001 + irinotecan vs. single-agent regorafenib in third/fourth line colorectal cancer[J]. Clin Colorectal Cancer, 2023, 22(1):92-99. doi: 10.1016/j.clcc.2022.11.003 [6] REID T, ORONSKY B, CAROEN S, et al. Phase 1 pilot study of RRx-001 + nivolumab in patients with advanced metastatic cancer(PRIMETIME)[J]. Front Immunol, 2023, 14:1104753. doi: 10.3389/fimmu.2023.1104753 [7] FINE H, REID T, CAROEN S, et al. A multicenter, phase 1, dose escalation clinical trial(G-FORCE-1)of XRT, RRx-001 and temozolomide followed by temozolomide +/- RRx-001 in newly diagnosed glioblastoma[J]. Front Oncol, 2023, 13:1176448. doi: 10.3389/fonc.2023.1176448 [8] ORONSKY B, PAULMURUGAN R, FOYGEL K, et al. RRx-001: a systemically non-toxic M2-to-M1 macrophage stimulating and prosensitizing agent in Phase II clinical trials[J]. Expert Opin Investig Drugs, 2017, 26(1):109-119. doi: 10.1080/13543784.2017.1268600 [9] JANI V P, ASARO R, ORONSKY B, et al. RRx-001 increases erythrocyte preferential adhesion to the tumor vasculature[J]. Int J Mol Sci, 2021, 22(9):4713. doi: 10.3390/ijms22094713 [10] ZHAO H J, NING S C, SCICINSKI J, et al. Epigenetic effects of RRx-001: a possible unifying mechanism of anticancer activity[J]. Oncotarget, 2015, 6(41):43172-43181. doi: 10.18632/oncotarget.6526 [11] ORONSKY B, CABRALES P, CAROEN S, et al. RRx-001, a downregulator of the CD47- SIRPα checkpoint pathway, does not cause anemia or thrombocytopenia[J]. Expert Opin Drug Metab Toxicol, 2021, 17(4):355-357. doi: 10.1080/17425255.2021.1876025 [12] 李洪珍, 舒远杰, 刘世俊, 等. N-乙酰基-3, 3-二硝基氮杂环丁烷的合成[J]. 化学研究与应用, 2004, 16(3):393-395. [13] 李洪珍, 舒远杰, 黄奕刚, 等. 3, 3-二硝基氮杂环丁烷和1, 1'-亚甲基-双(3, 3-二硝基-1-氮杂环丁烷)的合成研究[J]. 有机化学, 2004, 24(7):775-777. [14] TANG W M, ZHANG Y M, YANG K L, et al. Discovery of novel 3, 11-bispeptide ester arenobufagin derivatives with potential in vivo antitumor activity and reduced cardiotoxicity[J]. Chem Biodivers, 2023, 20(2):e202200911. doi: 10.1002/cbdv.202200911 [15] ZHANG Y M, YANG K L, YE S, et al. Application of a fluorine strategy in the lead optimization of betulinic acid to the discovery of potent CD73 inhibitors[J]. Steroids, 2022, 188:109112. doi: 10.1016/j.steroids.2022.109112 [16] 罗川, 马建江, 缪震元, 等. 沙蟾毒精酯类衍生物的合成和抗肿瘤活性研究[J]. 药学实践杂志, 2021, 39(1):35-37,57. -






 下载:
下载:

 下载:
下载: