-
紫苏为重要的药食两用中药,来源于唇形科植物紫苏Perilla frutescens(L.)Britt,干燥叶与成熟果实分别作为紫苏叶与紫苏子入药,历版《中国药典》均有收载,紫苏子能降气化痰,止咳平喘,润肠通便,用于痰壅气逆,咳嗽气喘,肠燥便秘[1]。紫苏叶有解表散寒,行气和胃的功效,用于风寒感冒,咳嗽呕恶,妊娠呕吐,鱼蟹中毒。
紫苏在我国栽培极广,紫苏叶除了供药用外,还可作蔬菜、香料以及代茶。紫苏叶和肉类煮熟可增加后者的香味。日本人多用于料理,作为生鱼片佐料。紫苏子榨出的油(苏子油)也可供食用。由于紫苏应用历史悠久,形态变异大,栽培品种多,通常将叶背腹面均绿色者称为白苏,叶背为紫色者称为紫苏。紫苏与白苏的分类处理至今仍存在较大争议。如《中国植物志》[2]与《中国药典》[1]均将紫苏与白苏合为一种。而《中药志》[3]《中药辞海》[4]《新编中药志》[5]以及《中药品种理论与应用》[6]等均认为紫苏为白苏的变种。
研究表明,紫苏与白苏的形态差别并非由于栽培条件差异导致,其化学成分方面也存在明显区别,紫苏的挥发油类成分主为紫苏醛型,而白苏为紫苏酮型[7],本文对药食两用中药紫苏的名称、形态和功效进行本草考证,以正本清源,为临床安全合理应用提供科学依据。
-
紫苏原名苏,始载于《名医别录》,列为中品。李时珍在《本草纲目》中也记载:“苏性舒畅,行气和血,故谓之苏”[8]。陶弘景所著的《本草集经注》记载,“苏,味辛,温。主下气,除寒中,子尤良。叶下紫色而气甚香,其无紫色不香似荏者,名野苏,不堪用”。
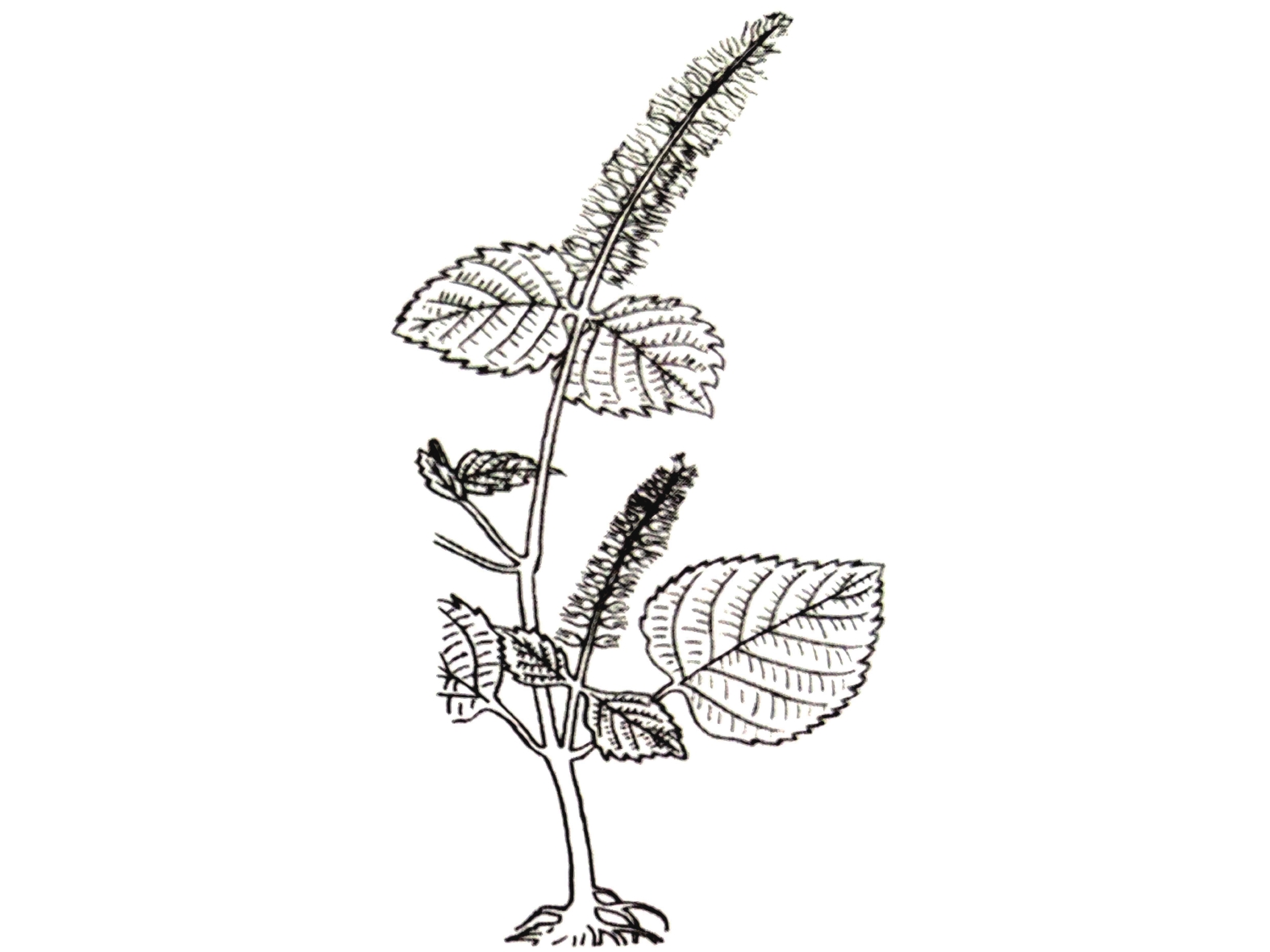
宋代苏颂所著的《图经本草》记载:“苏,紫苏也。谨按《尔雅》谓苏为桂荏。盖以其味辛,而形类荏,乃名之。然而苏有数种,有水苏、白苏、鱼苏、山鱼苏,皆是荏类”[9]。根据其形态描述及附图(图1),并为后来的本草文献支持,苏为现代唇形科植物紫苏Perilla frutescens (Linn.) Britt.。《救荒本草》记载:紫苏一名桂荏,又有数种,有勺苏、鱼苏、山苏,出简州及无为军,今处处有之[10]。这里提到的桂荏即紫苏,李时珍在《本草纲目》 解释到:“苏乃荏类,而味更辛如桂,故《尔雅 》谓之桂荏”。产地简州及无为军,《宋史》载:“无为军,同下州。太平兴国三年,以庐州巢县无为镇建为军,以巢、庐江二县来属。”《图经本草》有附图简州苏、无为军苏,与此也相符。
苏(舒)的名称来源于其功效。《尔雅义疏》也云:“苏之为言舒也”。紫苏则是指苏之茎叶之色为紫色。《本草求真》记载,紫苏专入肺,兼入心 、脾。背面俱紫,辛温香窜,凡风寒偶伤,气闭不利,心膨气胀,并暑湿泄泻,热闭血衄、崩淋,喉腥口臭,俱可用此调治。取其辛能入气,紫能入血,香能透外,温可暖中,使其一身舒畅,故命其名曰苏[11]。紫苏又称紫舒,相传还与东汉名医华佗有关。一次华佗在某地水边采药,无意中发现一只水獭因吃了螃蟹,难受在地上打滚,找到一种紫色的草吃了后竟安然无事。后来华佗用这种紫色的草熬汤救治了因多食螃蟹腹痛的患者。因该草紫色,患者喝后病痛解除,顿觉舒服,故称之为“紫舒”[12]。
古代本草中提到的“荏”即“白苏”,桂荏则指紫苏。李时珍《本草纲目》载:“曰紫苏者,以别白苏也。其面背皆白者即白苏,乃荏也”。《植物名实图考》中对荏也有解释,“荏,别录中品,白苏也”[13]。至于现代紫苏名称较多,紫苏又称野苏、红苏、香苏,青苏等名字。白苏又称白紫苏、青苏、臭苏等。
-
紫苏与白苏形态方面的差异目前争议颇多,分类上多被作为同一种处理,认为其形态的差异是由栽培条件不同导致。然而古代本草记载以及现代研究均表明紫苏、白苏在形态与成分方面存在明显差异。《图经本草》记载:“紫苏,叶下紫色,而气甚香,夏采茎叶,秋采实。《本草纲目》曰:“紫苏,其茎方,其叶圆而有尖,四围有锯齿;肥地者面背皆紫,瘠地者面青背紫”,并有附图(图2)。据此有人认为紫苏与白苏的形态差异由于生长环境导致。《本草崇原》也记载:紫苏,其叶面青背紫,气甚辛香,开花成穗,红紫色,穗中有细子,其色黄赤,入土易生,后人于壤土莳植,面背皆紫者名家紫苏。野生瘠土者,背紫面青。《别录》首次提到野生与栽培紫苏的区别。此外,还提到一种面背皆青,气辛臭香者,为荠。一种面背皆白者,名白苏,俱不堪入药。这里提到的“荠”应为现唇形科植物荠苧Mosla grosseserrata Maxim.,又称臭苏,青白苏。而《植物名实图考》记载紫苏并有附图(图3),形态特征十分清晰,与现代文献描述的紫苏形态特征相符。
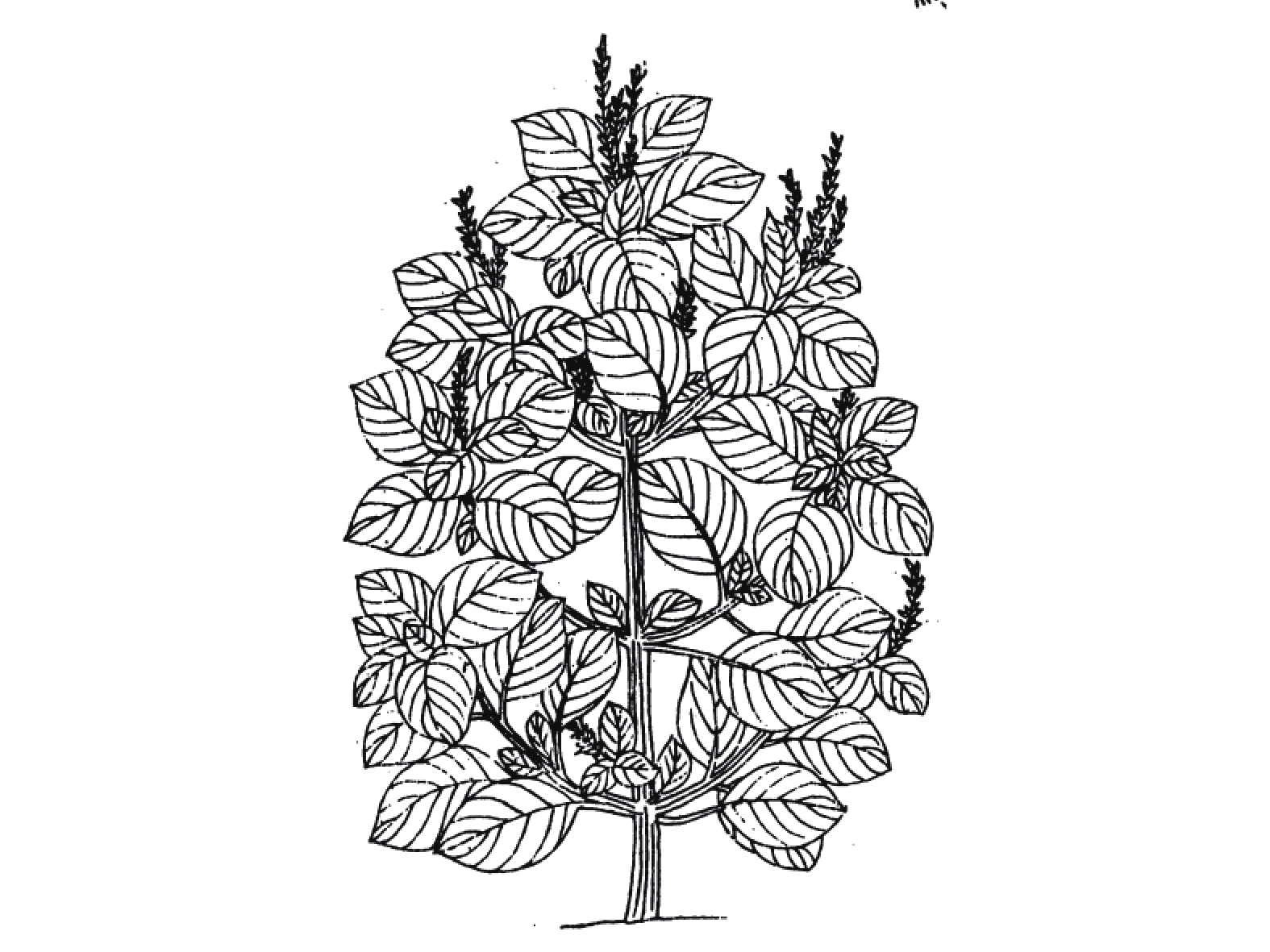
白苏又称为荏,最大区别为叶不为紫色,历代本草对此均有记载,如《本草经集注》载:“荏,状如苏,高大白色,不甚香”;而《本草图经》载:“苏有数种,有水苏、白苏、鱼苏、山鱼苏,皆为荏类。白苏,方茎圆叶,不紫,亦甚香,实亦入药。事实上无论紫苏,白苏皆含挥发油,具有特殊香气,不过紫苏味更辛如桂。《本草纲目》 :“其面背皆白者即白苏,乃荏也”。《救荒本草》记载:“(荏)苗高一二尺,茎方。叶似薄荷叶,极肥大。开淡紫色花,结穗似紫苏穗,其子如黍,其枝茎对节生”(图4)。苏与荏形态上较为相似,主要为叶面颜色差异。
-
紫苏叶、紫苏梗、紫苏子均可入药,紫苏叶具有解表散寒,行气和胃的功效,紫苏梗具有理气宽中,止痛,安胎的功效。紫苏子具有降气化痰,止咳平喘,润肠通便的功效。在历代本草中均有详细记载,如《别录》:“主下气,除寒中。”《食疗本草》:“除寒热,治冷气”[14] 。《日华子本草》:“补中益气。治心腹胀满,止霍乱转筋,开胃下食,并一切冷气,止脚气,通大小肠。”《履巉岩本草》:“止金疮出血,疗痔疾,煎汤洗之”。紫苏叶入药始见于南北朝时期的《雷公炮炙论》[15]。《图经本草》记载,其茎并叶,通心经,益脾胃,煮饮尤甚,与橘皮相宜,气方中多用之。 实主上气咳逆,……,若欲宣通风毒,则单用茎,去节良。
《滇南本草》:“苏叶,发汗,解伤风头疼,定吼喘,下气,宽臌,消胀、消痰。苏子,止咳嗽,降痰,定吼喘,下气,消痰涎。” 明代《本草汇言》则记载:“紫苏,散寒气,清肺气,宽中气,下结气,化痰气,乃治气之神药也”,突出强调其治气功效。明代《本草纲目》也记载:“(紫苏)行气宽中,消痰利肺,和血,温中,止痛,定喘,安胎。其味辛,入气分,其色紫,入血分。” 清代《本经逢原》则认为紫苏可“散血脉之邪。”[16]。
关于紫苏梗的功效,明代《医学入门·本草》记载:“(紫苏)治风寒湿痹,及筋骨疼痛,脚气” [17]。明代《本草通玄》认为其“能行气安胎”。清代《本草崇原》:“主宽中行气,消饮食,化痰涎。治噎膈反胃,止心腹痛”。清代《得配本草》记载:“疏肝,利肺,理气,和血,解郁,安胎” [18]。 明代《本草蒙筌》[19]:“下诸气略缓,体虚者用宜”。
清代张志聪的《侣山堂类辩》曾有详细记载[20]:“庭前植百合、紫苏各数茎,见百合花昼开夜合,紫苏叶朝挺暮垂,因悟草木之性,感天地阴阳之气而为开阖者也,……,苏色紫赤,枝茎空通,其气朝出暮入,有如经脉之气,昼行于阳,夜行于阴,是以苏叶能发表汗者,血液之汗也(白走气分,亦走血分)。枝茎能通血脉,故易思兰先生常用苏茎通十二经之关窍,治咽膈饱闷,通大小便,止下利赤白。予亦常用香苏细茎,不切断,治反胃膈食,吐血下血,多奏奇功”。详细描述了紫苏不同部位的功效,紫苏长于解表理气之功效,紫苏叶与紫苏茎功效各有不同。
紫苏与白苏均有食用记载,《证类本草》将紫苏列为菜部中品,将荏列为菜部上品[21]。紫苏多以叶食用,《救荒本草》记载,“紫苏一名桂荏,今处处有之,苗高二尺许,茎方叶似苏子叶微小,茎叶背面皆紫色而气甚……,救饥采叶炒食,煮饮亦可,子研汁煮粥食之皆好。叶可生食与鱼作羹味佳”。白苏的食用主要为种子,“子可炒食;又研杂米作粥,甚肥美。亦可笮油用”[10]。《食物本草》也记载:“(紫苏)子,研汁煮粥长食,令人肥白身香”[22]。紫苏食用沿袭至今,许多地区仍有紫苏叶生食并与生鱼片同食习惯。
紫苏子作药用,秦、汉时期《别录》就有记载:“主下气,除寒中”。南北朝《本草经集注》记载:“苏子,主下气,与橘皮相宜同疗也”。唐代《药性论》则有不同的记载,认为苏子“主上气咳逆,治冷气及腰脚中湿风结气”。五代时期《日华子本草》则认为紫苏子“主调中,益五脏,下气,止霍乱、呕吐、反胃,补虚劳,肥健人,利大小便,破癥结,消五膈,止嗽,润心肺,消痰气”。北宋时期《本草衍义》记载紫苏子“治肺气喘急”[23]。《本草纲目》认为“苏子与叶同功,发散风气宜用叶,清利上下则宜用子也”。
紫苏以种子、叶、梗入药,白苏多以种子、叶和根入药。白苏又称南苏,叶功效与紫苏相似,而白苏根又有洗疮祛风的功效。《别录》记载:“主治欬逆,下气,温中”。《日华子本草》记载:“调气,润心肺,长肌肤,益颜色,消宿食,止上气咳嗽,去狐臭,敷蛇咬”。《滇南本草》则记载:“南苏,治伤寒发热,无汗头痛,其效如神。此草治一切风寒,痰涌结而霍乱转筋,咳嗽吐痰、小儿风症,定痛止喘。梗能补中益气。根能洗疮祛风。子能开胃健脾”。
-
紫苏的毒副作用记载较少,多数不良反应为药物或食物的配伍导致。如《本草纲目》记载:“不可同鲤鱼食,生毒疮”。明代的《神农本草经疏》[24]:“病属阴虚,因发寒热或恶寒及头痛者,慎毋投之,以病宜敛宜补故也。火升作呕者,亦不宜服,惟可用子”。《本草通玄》则记载:“久服泄人真气”。《药性切用》提到“气虚者禁用”。《医学入门·本草》也提到“脾胃气虚常泄者禁用”。《本经逢原》记载:“性主疏泄,气虚久嗽,阴虚喘逆,脾虚便溏者皆不可用”。因紫苏性温,主下气,故阴虚、气虚及温病患者慎用。
我们对紫苏与白苏的形态与化学成分研究结果表明,白苏的挥发油类成分主要为紫苏酮型,具有一定的毒性,存在安全隐患,因此作为食用以紫苏为好,不宜使用白苏。
-
通过对紫苏名称的文献考证结果表明,历代本草所言“紫苏”“苏”“白苏”均属“荏”类,为唇形科紫苏Perilla frutescens及其变种,“紫苏”源于“苏”,为其形态与功效的延伸。李时珍区分“紫苏”与“白苏”,白苏又称为荏,紫苏又称桂荏。通常将叶背腹面均绿色者称为白苏,叶背为紫色称为紫苏。白苏不甚香,不堪入药。紫苏茎、叶、子均入药,主下气,治风寒。
根据历代本草记载,紫苏和白苏为两种不同的植物,现代分类处理尚存在争议,认为紫苏是同种植物因环境不同产生的变异。然而其形态、功效及化学成分均存在明显差别。根据历代草本的紫苏附图、形态描述,紫苏与白苏应作为不同的分类单元。
紫苏茎、叶、子均入药,功效有所不同,对于不同病症注意合理的配伍,以免产生不良反应。此外,气虚、阴虚及温病患者慎用。紫苏作为药食两用的种类,应用较为广泛,为保证临床应用的安全有效,应与白苏加以区分。
Textual research on the name and reality of edible and medicinal Zisu
-
摘要:
目的 对药食两用植物紫苏的名称、基原、形态和功效进行本草考证,以正本清源,为临床应用提供参考依据。 方法 从名称、产地、原植物形态、功效、毒性与副作用等方面进行本草考证。 结果 历代本草所言“紫苏”“苏”“白苏”均属“荏”类,为唇形科紫苏Perilla frutescens及其变种,紫苏叶紫色,茎、叶、子均入药,主下气。白苏叶绿色,治风寒。 结论 紫苏与白苏在形态与功效上均有差别,应加以区分。紫苏作为药食两用中药具悠久的应用历史,白苏不宜作为食用。 Abstract:Objective To make a textual research on Zisu about the name, origin, morphology and efficacy, a dual-purpose medicinal and edible plant, in order to make the original clear and provide reference basis for clinical application. Methods Textual research was carried out from the aspects of synonym, distribution, morphology, efficacy, toxicity and side effects of the plants. Results Zisu, Baisu and Su in the herbal medicine of past dynasties belong to the Ren category, which are species or varieties of Perilla frutescens(L.)Britt. Zisu has purple leaves, and its stems, leaves and seeds are used as medicine to mainly lower Qi. While Baisu has green leaves, which could cure wind cold. Conclusion There are significant differences in botanical morphology and pharmacological efficacy between Zisu and Baisu, which should be distinguished and used separately. Zisu is a dual-purpose traditional Chinese medicine with a long application history. Baisu is not suitable for edible consumption. -
非酒精性脂肪性肝病(NAFLD)是临床常见的肝脏疾病之一,其中,非酒精性脂肪性肝炎(NASH)是非酒精性脂肪肝(NAFL)向非酒精性脂肪性肝硬化转化过程中一个非常重要的环节[1]。非酒精性脂肪性肝炎发展到晚期将导致肝硬化的发生,最终进展为肝细胞癌(HCC),从而影响整体肝功能。因此,NASH的防治具有重要意义。七味脂肝方由垂盆草、豨莶草、牡蛎等七味药组成,处方源于岐黄学者、中医临床肝病专家季光教授临床经验的总结,长期临床应用显示对NASH具有很好的效果。本研究参考常用的NASH动物模型[2-4],选用蛋氨酸和胆碱缺乏(MCD)饮食诱导以及胆碱缺乏的高脂高胆固醇饮食(CDAHFHC)诱导的2个经典NASH的动物模型,研究七味脂肝方对NASH的药效作用,为临床用药提供科学的理论依据。
1. 材料与仪器
1.1 药物与试剂
七味脂肝方供试品(江苏康缘药业股份有限公司提供,批号:Z201001),根据项目组前期制定的提取工艺,将七味脂肝方制备成每1 g含6.19 g生药的浸膏粉;维生素E(VE)软胶囊(上海信谊延安药业有限公司,国药准字H31020237,批号:03210202);罗格列酮片(成都恒瑞制药有限公司,国药准字H20030569,批号:210601);丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、甘油三酯(TG)、胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)测定试剂盒(上海惠中生物科技有限公司,批号:01ALT210107、01AST210329、01ALP210222、02TG210330、01CHOL210226、01HDL210525、01LDL210302);乳酸脱氢酶(LDH)测定试剂盒(上海执诚生物科技有限公司,批号:ZCJULT019);游离脂肪酸(FFA)、总胆红素(TBIL)测定试剂盒(美康生物科技股份有限公司,批号:210609101、190731101);苏木素、伊红染色液(珠海贝索生物技术有限公司,批号:719041、719033);F4/80抗体,(Abcam,批号:1004577-2)。
1.2 仪器
全自动生化分析仪(日本东芝,型号:TBA-40R);全自动样品快速研磨仪(上海净信,型号:Tissuelyser-24);轮转式石蜡切片机、冷冻切片机、组织包埋机(徕卡显微系统(上海)贸易有限公司,型号:RM2235、CM1950、Histocore Amber);正置显微镜(日本OLYMPUS,型号:CX31RTSF)。
1.3 实验动物
Sprague-Dawley大鼠(SD大鼠),雄性,6周龄,体重200~250 g,48只,购自上海市计划生育科学研究所实验动物经营部,生产许可证号:SCXK(沪)2018-0006。C57BL/J小鼠,雌雄各半,6周龄,体重(24±2)g,96只,购置于上海吉辉实验动物饲养有限公司,生产许可证号:SCXK(沪)2017-0012。通过上海中医药大学实验动物中心实验动物伦理(伦理号:PZSHUTCM210625020)审查,实验动物使用许可证号:SYXK(沪)2018-0006,SPF级环境饲养。
2. 方法
2.1 造模与分组
2.1.1 MCD诱导的大鼠NASH模型
48只雄性SD大鼠,饲养于上海中医药大学实验动物中心,正常饮食,自由食水,观察7 d。第8天,根据动物体重按随机数字法随机分为对照组和模型组,除对照组外,其余动物饲料梯度替换为MCD饲料(正常饲料喂养;25%MCD饲料喂养2 d;50%MCD饲料喂养2 d;75%MCD饲料喂养2 d;100%MCD饲料喂养2周),自由食水。造模2周后,对模型组动物根据体重随机分组,分为模型组、七味脂肝方低剂量组(2.8 g/kg生药)、七味脂肝方中剂量组(5.6 g/kg生药)、七味脂肝方高剂量组(11.2 g/kg生药)、阳性对照VE组(40 mg/kg),每组8只。各给药组每天灌胃1次,连续28 d,对照组及模型组灌胃等量的生理盐水。
2.1.2 CDAHFHC诱导的小鼠NASH模型
96只C57BL/J小鼠,雌雄各半,饲养于上海中医药大学实验动物中心,正常饮食,自由食水,观察7 d。第8天,根据动物体重按随机数字法随机分为对照组和模型组,除对照组外,其余动物饲料梯度替换为CDAHFHD饲料(正常饲料喂养;25%CDAHFHC饲料喂养2 d;50%CDAHFHC饲料喂养2 d;75%CDAHFHC饲料喂养2 d;100%CDAHFHC饲料喂养2周),自由食水。造模2周后,对模型组动物根据体重随机分组,分为模型组、七味脂肝方低剂量组(4 g /kg生药)、七味脂肝方中剂量组(8 g/kg生药)、七味脂肝方高剂量组(16 g/kg生药)、阳性对照罗格列酮组(RSG,1.14 mg/kg),每组16只。各给药组每天灌胃1次,连续28 d,对照组及模型组灌胃等量的生理盐水。
2.2 检测方法
2.2.1 血清肝功能和血脂生化指标检测
使用全自动生化分析仪测定ALT、AST、ALP、LDH、TG、TC、HDL-C、LDL-C、TBIL、FFA在血清中的水平。
2.2.2 肝组织脂质水平检测
取新鲜肝脏组织样本,加入1∶9(质量体积比)的匀浆介质(乙醇∶丙酮=1∶1),冰浴条件下匀浆,置于冰箱4 ℃过夜,4 000 r/min离心15 min,收集上清液样本,使用全自动生化分析仪测定TG、TC、HDL-C、LDL-C在肝脏组织中的水平。
2.2.3 肝脏组织病理学评价
肝脏左叶样本固定后,经组织脱水,石蜡包埋,将其切成4 μm的石蜡切片。
(1)HE染色
取肝脏石蜡切片样本,经HE染色,用正置显微镜拍照并评价肝脏病理变化。NASH病理诊断标准采用NAFLD活动度积分(NAS)进行评估(具体评判标准见表1)。
表 1 NAFLD活动度积分(NAS)组织学评分判断标准评分 肝细胞脂肪变(%) 小叶内炎症 肝细胞气球样变 0 <5 无病灶 无 1 5~33 <2 少量气球样细胞 2 34~66 2~4 较多/显著气球样变 3 >66 >4 注:NAS≥5分可明确NASH的诊断;NAS<3分则可排除NASH;两者之间者为NASH可能。 (2)Masson染色
取肝脏石蜡切片样本,经Masson三色染色,通过正置显微镜观察并拍照记录,评价肝组织纤维化程度。Masson染色纤维化诊断评分参照以下评分标准(表2)。
表 2 肝纤维化分期评分判断标准评分 纤维化程度 0 无 1 窦周或汇管区纤维化 2 窦周和汇管区周围纤维化 3 桥接纤维化 4 肝硬化 (3)免疫组织化学染色
取肝脏石蜡切片样本,经F4/80抗体免疫组织化学染色,通过正置显微镜观察并拍照记录,评价肝组织中Kupffer细胞的活化程度。
2.3 统计方法
所有计量资料采用平均值±标准偏差(
$ \bar{x}\pm s $ )表示。计量资料采用单因素方差分析(one-sample Kolmogorov-Smirnov test)进行数据分布判断,正态分布时采用参数检验的单因素方差分析(ANOVA),偏态分布时采用非参数检验(Mann-Whitney test)。所有数据均使用GraphPad Prism 8软件进行统计并进行图表制作。3. 结果
3.1 对肝脏形态、肝重及肝脏指数的影响
3.1.1 MCD诱导的大鼠NASH模型实验结果
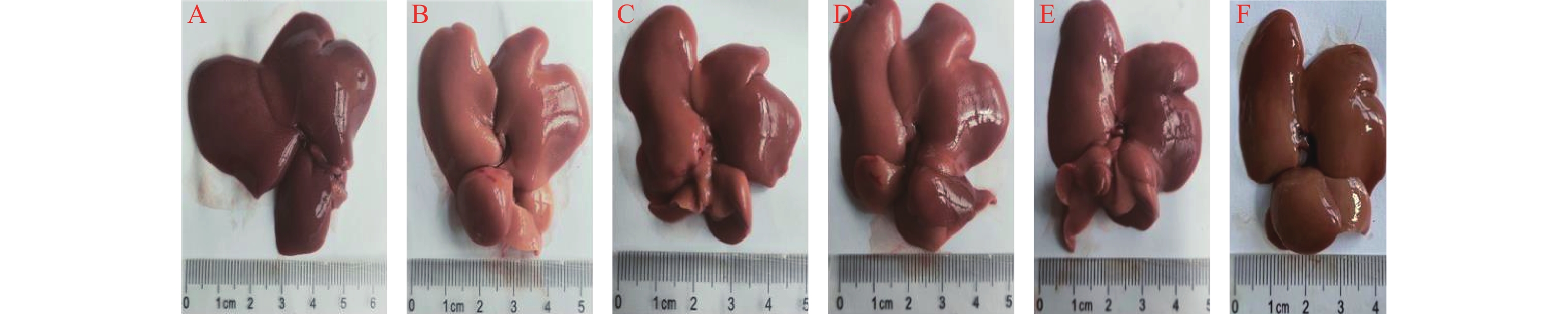
对照组肝脏表面光滑,色深红,质地软,有弹性,肝叶边缘锐利。与对照组相比,模型组肝脏体积增大,颜色变浅;与模型组相比,七味脂肝方各剂量组和阳性对照VE组可以观察到肝脏颜色稍红,各组均可一定程度改善肝脏形态,结果见图1和表3。
表 3 大鼠体重、肝脏重量及肝脏指数($ \bar{{x}}\pm {s} $ )组别 动物数(n) 体重(m/g) 肝重(m/g) 肝指数(%) 对照组 8 397.28±31.15 10.46±1.15 2.63±0.14 模型组 8 202.19±15.56## 6.91±1.10## 3.41±0.42## 七味脂肝方低剂量组 8 202.75±14.72 7.31±1.08 3.59±0.34 七味脂肝方中剂量组 8 202.98±17.39 7.90±1.54 3.88±0.57 七味脂肝方高剂量组 8 201.83±16.04 7.82±0.90 3.88±0.43* 阳性对照VE组 8 201.83±11.16 7.22±0.57 3.59±0.34 *P<0.05,与模型组比较; ##P<0.01,与对照组比较。 3.1.2 CDAHFHC诱导的小鼠NASH模型实验结果
对照组肝脏表面光滑,色深红,质地软,有弹性,肝叶边缘锐利;与对照组相比,模型组肝脏体积增大,颜色变浅;与模型组相比,七味脂肝方各剂量组和阳性对照RSG组可以观察到肝脏颜色稍红,各组均可一定程度改善肝脏形态,结果见图2。
与对照组相比,模型组肝脏重量、肝脏指数显著升高(P<0.01);与模型组相比,七味脂肝方的各剂量组和阳性对照RSG组均能显著降低肝脏重量(P<0.05或P<0.01),七味脂肝方的中、高剂量组和阳性对照RSG组能显著降低肝脏指数(P<0.01),结果见表4。
表 4 小鼠体重、肝脏重量及肝脏指数($ \bar{x}\pm {s} $ )组别 动物数(n) 体重(m/g) 肝重(m/g) 肝指数(%) 对照组 16 22.12±2.00 0.91±0.16 4.11±0.47 模型组 16 18.91±1.36## 1.69±0.15## 8.96±0.62## 七味脂肝方低剂量组 16 18.59±1.01 1.56±0.20* 8.41±1.06 七味脂肝方中剂量组 16 18.48±1.08 1.51±0.18** 8.17±0.72** 七味脂肝方高剂量组 16 18.32±1.03 1.54±0.13** 8.38±0.53** 阳性对照RSG组 16 19.14±1.34 1.56±0.18* 8.16±0.68** *P<0.05,**P<0.01,与模型组比较; ##P<0.01,与对照组比较。 3.2 对血清肝功能、血脂水平的影响
3.2.1 MCD诱导的大鼠NASH模型实验结果
与对照组相比,模型组血清ALT水平显著升高(P<0.01);与模型组相比,七味脂肝方中剂量组血清ALT水平显著降低(P<0.05),七味脂肝方中、高剂量组可改善血清ALP、LDH、HDL水平,结果见表5、表6。
表 5 大鼠血清肝功能数据($ \bar{x}\pm {s}$ )组别 动物数(n) ALT(U/L) AST(U/L) ALP(U/L) LDH(U/L) 对照组 8 45.50±3.38 165.38±24.80 88.50±15.73 1547.50 ±243.04模型组 8 107.25±32.84## 187.50±24.36 93.75±32.65 1250.00 ±235.02#七味脂肝方低剂量组 8 107.00±37.80 195.88±25.90 87.25±24.54 1263.00 ±451.90七味脂肝方中剂量组 8 69.38±16.33* 171.25±19.91 63.13±18.76* 886.88±304.48* 七味脂肝方高剂量组 8 114.13±51.86 177.88±44.05 89.75±34.65 855.88±375.75* 阳性对照VE组 8 111.00±15.76 165.75±16.61 128.50±58.52 1219.63 ±368.75*P<0.05,与模型组比较;#P<0.05,##P<0.01,与对照组比较。 表 6 大鼠血脂4项数据($ \bar{x}\pm {s} $ )组别 动物数(n) TG(mmol/L) TC(mmol/L) HDL(mmol/L) LDL(mmol/L) 对照组 8 0.32±0.10 1.12±0.22 0.28±0.03 0.15±0.02 模型组 8 0.23±0.05# 0.83±0.18# 0.32±0.06 0.14±0.04 七味脂肝方低剂量组 8 0.29±0.07 0.93±0.12 0.38±0.07 0.15±0.03 七味脂肝方中剂量组 8 0.32±0.19 1.25±0.51* 0.49±0.19* 0.21±0.08 七味脂肝方高剂量组 8 0.23±0.06 1.20±0.26** 0.48±0.10** 0.21±0.08 阳性对照VE组 8 0.23±0.05 0.84±0.23 0.33±0.12 0.15±0.04 *P<0.05,**P<0.01,与模型组比较;#P<0.05,与对照组比较。 3.2.2 CDAHFHC诱导的小鼠NASH模型结果
与对照组相比,模型组血清ALT、AST、ALP、LDH、TG、TC、LDL水平显著升高(P<0.01),HDL水平显著降低(P<0.01);与模型组相比,七味脂肝方低剂量组血清ALP、TG水平显著降低(P<0.05或P<0.01),七味脂肝方中剂量组血清LDH、TG水平显著降低(P<0.05),七味脂肝方高剂量组血清ALT、AST、ALP、LDH、TG水平显著降低(P<0.05或P<0.01),阳性对照RSG组血清ALT水平显著降低(P<0.05),结果见表7和表8。
表 7 小鼠血清肝功能数据($\bar{x}\pm {s}$ )组别 动物数(n) ALT(U/L) AST(U/L) ALP(U/L) LDH(U/L) 对照组 16 35.13±6.08 146.06±43.63 88.31±9.41 653.94±145.10 模型组 16 606.06±111.12## 486.31±69.39## 216.19±28.30## 1390.25 ±128.14##七味脂肝方低剂量组 16 561.44±98.43 440.69±67.29 179.06±46.80* 1347.19 ±150.78七味脂肝方中剂量组 16 553.00±116.35 442.94±72.95 198.06±32.64 1261.69 ±122.55*七味脂肝方高剂量组 16 486.63±88.90** 406.25±75.39** 189.94±34.09* 1161.00 ±134.22**阳性对照RSG组 16 513.56±91.17* 441.81±70.00 273.94±43.98** 1328.75 ±160.91*P<0.05,**P<0.01,与模型组比较;##P<0.01,与对照组比较。 表 8 小鼠血脂4项数据($\bar{x}\pm {s}$ )组别 动物数(n) TG(mmol/L) TC(mmol/L) HDL(mmol/L) LDL(mmol/L) 对照组 16 0.82±0.39 2.70±0.42 1.64±0.35 0.18±0.03 模型组 16 1.27±0.26## 3.45±0.55## 0.93±0.29## 0.57±0.17## 七味脂肝方低剂量组 16 1.01±0.25** 3.29±0.61 0.91±0.19 0.55±0.18 七味脂肝方中剂量组 16 1.01±0.31* 3.46±0.52 0.99±0.26 0.59±0.13 七味脂肝方高剂量组 16 1.01±0.29* 3.37±0.34 0.99±0.13 0.57±0.10 阳性对照RSG组 16 1.10±0.28 3.33±0.79 0.94±0.32 0.56±0.15 *P<0.05,**P<0.01,与模型组比较; ##P<0.01,与对照组比较。 与对照组相比,模型组血清TBIL、FFA水平显著升高(P<0.01);与模型组相比,七味脂肝方高剂量组和阳性对照RSG组血清TBIL水平显著降低(P<0.05)。结果见表9。
表 9 小鼠血清TBIL、FFA数据($\bar{x}\pm {s}$ )组别 动物数(n) TBIL(μmol/L) FFA(mmol/L) 对照组 16 3.59±0.55 1.41±0.31 模型组 16 7.77±1.52## 2.16±0.46## 七味脂肝方低剂量组 16 6.95±1.78 2.01±0.43 七味脂肝方中剂量组 16 7.79±3.97 1.98±0.49 七味脂肝方高剂量组 16 6.37±1.72* 2.16±0.49 阳性对照RSG组 16 9.09±1.69* 2.20±0.55 *P<0.05,与模型组比较; ##P<0.01,与对照组比较。 3.3 对肝脏脂质水平的影响
3.3.1 MCD诱导的大鼠NASH模型实验结果
与对照组相比,模型组肝脏TG水平显著升高(P<0.01),HDL水平显著降低(P<0.01);与模型组相比,阳性对照VE组肝脏HDL水平显著升高(P<0.01),结果见表10。
表 10 大鼠肝脏脂质水平($\bar{x}\pm {s}$ )组别 动物数(n) TG(mmol/g) TC(mmol/g) HDL(mmol/g) LDL(mmol/g) 对照组 8 3.93±0.56 1.49±0.16 0.11±0.03 0.67±0.08 模型组 8 5.97±0.53## 1.14±0.13## 0.03±0.02## 0.25±0.13## 七味脂肝方低剂量组 8 5.73±0.82 1.03±0.12 0.02±0.02 0.27±0.10 七味脂肝方中剂量组 8 5.57±0.93 1.14±0.12 0.03±0.03 0.31±0.07 七味脂肝方高剂量组 8 5.93±0.81 1.10±0.14 0.02±0.01 0.27±0.08 阳性对照VE组 8 7.25±1.40* 1.21±0.15 0.08±0.02** 0.34±0.09 *P<0.05,**P<0.01,与模型组比较; ##P<0.01,与对照组比较。 3.3.2 CDAHFHC诱导的小鼠NASH模型实验结果
与对照组相比,模型组肝脏TG、TC水平显著升高(P<0.01);与模型组相比,七味脂肝方高剂量组肝脏TG水平显著降低(P<0.01),结果见表11。
表 11 小鼠肝脏脂质水平($\bar{x}\pm {s}$ )组别 动物数(n) TG(mmol/g) TC(mmol/g) HDL(mmol/g) LDL(mmol/g) 对照组 16 3.54±1.98 1.04±0.15 0.20±0.07 0.35±0.11 模型组 16 8.78±0.89## 2.29±0.21## 0.47±0.13## 0.42±0.21 七味脂肝方低剂量组 16 8.54±1.04 2.20±0.20 0.47±0.08 0.36±0.16 七味脂肝方中剂量组 16 8.69±1.54 2.28±0.31 0.49±0.09 0.43±0.17 七味脂肝方高剂量组 16 7.85±0.79** 2.12±0.39 0.45±0.14 0.39±0.24 阳性对照RSG组 16 8.44±0.97 2.12±0.26 0.47±0.09 0.36±0.16 **P<0.01,与模型组比较; ##P<0.01,与对照组比较。 3.4 对肝脏病理NAS评分的影响
3.4.1 MCD诱导的大鼠NASH模型HE染色实验结果
对照组大鼠肝小叶结构完整,肝细胞排列整齐,肝板以中央静脉为中心呈放射状排列,未见明显病理性改变。
模型组镜下可见广泛的肝细胞空泡变性,中央静脉及汇管区周围可见肝细胞坏死,小叶间炎症细胞浸润,肝小叶结构被破坏。与对照组相比,模型组脂肪变性、小叶内炎症及NAS评分显著升高(P<0.01)。
与模型组相比,七味脂肝方的各给药组和阳性对照VE组可明显减轻小叶内炎症程度。与模型组相比,七味脂肝方低、中、高剂量组和阳性对照VE组小叶内炎症评分显著降低(P<0.05或P<0.01),七味脂肝方的中剂量组和阳性对照VE组NAS评分显著降低,结果见表12。
表 12 大鼠肝脏NAS评分($\bar{x}\pm {s}$ )组别 动物数(n) 脂肪变性 小叶内炎症 气球样变 NAS 对照组 8 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 模型组 8 2.88±0.35## 1.63±0.52## 0.00±0.00 4.50±0.76## 七味脂肝方低剂量组 8 3.00±0.00 1.00±0.00* 0.38±0.52 4.38±0.52 七味脂肝方中剂量组 8 3.00±0.00 0.88±0.35* 0.00±0.00 3.88±0.35* 七味脂肝方高剂量组 7 3.00±0.00 0.86±0.38* 0.00±0.00 3.86±0.38 阳性对照VE组 8 3.00±0.00 0.63±0.52** 0.00±0.00 3.63±0.52* *P<0.05,**P<0.01,与模型组比较; ##P<0.01,与对照组比较。 3.4.2 CDAHFHC诱导的小鼠NASH模型HE染色实验结果
对照组肝小叶结构完整,肝细胞排列整齐,肝板以中央静脉为中心呈放射状排列,未见明显病理性改变。
模型组镜下可见广泛的肝细胞空泡变性,中央静脉及汇管区周围可见肝细胞点状或灶状坏死,小叶间炎性细胞浸润,肝小叶结构被破坏,较多个肝细胞呈气球样变。与对照组相比,模型组脂肪变性、小叶内炎症、气球样变及NAS评分显著升高。
与模型组相比,七味脂肝方中、高剂量组可有效减轻炎性灶数量和肝细胞气球样变,显著降低小叶内炎症程度评分、气球样变评分及NAS评分(P<0.01),阳性对照RSG组可减轻小叶内炎症程度,显著降低小叶内炎症程度评分及NAS评分(P<0.01),结果见表13。
表 13 小鼠肝脏NAS评分($\bar{x}\pm {s}$ )组别 动物数(n) 脂肪变性 小叶内炎症 气球样变 NAS 对照组 16 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 模型组 16 3.00±0.00## 2.81±0.40## 1.88±0.34## 7.69±0.48## 七味脂肝方低剂量组 16 3.00±0.00 2.56±0.51 1.69±0.48 7.25±0.86 七味脂肝方中剂量组 16 3.00±0.00 2.13±0.34** 1.38±0.50** 6.50±0.73** 七味脂肝方高剂量组 16 3.00±0.00 1.88±0.34** 1.31±0.48** 6.19±0.66** 阳性对照VE组 16 3.00±0.00 2.19±0.40** 1.56±0.51 6.75±0.68** **P<0.01,与模型组比较; ##P<0.01,与对照组比较。 3.5 对肝脏Masson染色及纤维化评分的影响
CDAHFHC诱导的小鼠NASH模型Masson染色结果显示,对照组肝小叶结构完整,肝细胞排列整齐,汇管区结构清晰,被染成蓝色的纤维结缔组织分布在肝小叶间血管和胆管周围,汇管区周围的纤维结缔组织呈围管状包绕血管及胆管分支。
模型组可见肝细胞点状或灶状坏死,炎症细胞浸润,镜下多个视野可见小叶内和汇管区周围被染成蓝色的胶原纤维增生。与对照组相比,模型组纤维化评分显著升高(P<0.01)。
与模型组相比,七味脂肝方的中、高剂量组可观察到肝小叶内和汇管区周围胶原纤维增生情况明显减轻,并呈现一定程度的剂量梯度效应;阳性对照RSG组在肝小叶和汇管区周围的胶原纤维增生情况也可得到一定程度的改善。与模型组相比,七味脂肝方的高剂量组纤维化评分显著降低(P<0.05),结果见表14。
表 14 小鼠肝脏纤维化分期评分($\bar{x}\pm {s}$ )组别 动物数(n) 纤维化分期评分 对照组 16 0.00±0.00 模型组 16 1.56±0.51## 七味脂肝方低剂量组 16 1.75±0.45 七味脂肝方中剂量组 16 1.44±0.51 七味脂肝方高剂量组 16 1.19±0.40* 阳性对照RSG组 16 1.25±0.45 *P<0.05,与模型组比较; ##P<0.01,与对照组比较。 3.6 对肝脏Kupffer细胞的影响
MCD诱导的大鼠和CDAHFHC诱导的小鼠NASH模型F4/80免疫组织化学染色结果显示,对照组大鼠肝脏Kupffer细胞处于静息状态,为不规则或树枝状分布。
模型组可观察到在肝小叶炎性灶及汇管区周围大量的被激活的Kupffer细胞,呈现花冠状分布,被F4/80标记的阳性细胞数明显增加。
与模型组相比,七味脂肝方的中、高剂量组显示被F4/80标记的阳性细胞数密度降低,Kupffer细胞活化程度明显减弱,花冠状分布程度明显减轻,呈一定程度的浓度依赖;阳性对照VE组和RSG组同样可减轻Kupffer细胞活化程度,与文献报道一致,结果见图3、图4。
4. 讨论
NASH是在非酒精性肝脂肪变基础上形成的,出现血清生化酶学超过正常值上限,肝穿刺病理组织学显示肝细胞脂肪变>5%,伴有炎症及肝细胞损伤(如气球样变),并除外导致肝脂肪变的其他原因,如大量饮酒、长期应用促脂肪形成药物或单基因遗传紊乱等的疾病[1]。近年来,关于NASH发病机制的研究已取得很大进展,但目前治疗选择非常有限[5-6],FDA、SFDA尚未批准针对该疾病的有效药物。权威指南中推荐使用的药物有维生素E、吡格列酮等,但这些药物的有效性和安全性存在争议[7-8]。目前,防治NASH的主要方法以生活方式干预为主,其他方法包括降糖、降脂和保肝的间接对症治疗,降低导致NASH的高危因素的相关疾病,使患者间接获益。
中医药因具有多因子、多靶点和多环节的协同药理效应,在治疗该类疾病具有独特的优势,在治NASH方面取得了一定进展[9-11]。非酒精性脂肪性肝炎并无确切中医学病名[12],根据其临床表现可归属于“肝癖”、“胁痛”、“黄疸”等范畴。病位主要涉及肝脾,病久及肾。由于过食肥甘厚味,运化失职,使谷精不能尽化气血而凝为膏脂,导致肝失疏泄、脾失健运,痰浊淤积于肝;脾胃为气机升降之枢,湿浊困脾,脾气不升,一身气机运化失常,加剧肝气郁结和肝络失养。
七味脂肝方中酒豨莶草、垂盆草清热解毒、利湿退黄,二药合为君药;煅牡蛎软坚散结,《珍珠囊》谓其可“软痞积”,《本草纲目》谓“化痰软坚,清热除湿”,山楂消食积,散淤血,《本草纲目》认为其可“化饮食,消肉积,癥瘕,痰饮痞满吞酸,滞血痛胀”,海藻消痰软坚散结,利水消肿,三药共为臣药;虎杖协同加强解毒、化瘀、退黄之功效,为佐药;醋五味子收敛固涩、益气生津、补肾宁心,可补五脏气,为使药。全方七味药物相辅相成,达到湿、痰、瘀、毒兼顾,利湿解毒,消痰散结,用于NASH湿热痰瘀互结证。现代药理学表明,方中垂盆草中的槲皮素[13]、虎杖中的虎杖苷等成分均对NASH有一定治疗作用[14-15]。
NASH是一种更严重的NAFLD病理类型,NASH的特征是存在肝细胞损伤、肝脂肪变性、炎症和纤维化,进而发生肝硬化并增加肝细胞癌的风险[16]。在NASH发展过程中,肝脏内脂肪合成量不断上升,代谢功能逐渐下降,肝脏对脂质的摄取和代谢能力随之减弱,导致脂质代谢过程中TC、TG和LDL-c含量升高,同时受损的肝细胞还会释放AST、ALT活力到血液中,导致AST、ALT活力升高,这些指标的异常变化可作为NASH的标志[17]。肝内过量的脂质沉积可导致炎症反应,促使单纯性脂肪肝向NASH的病理进展[18]。肝纤维化是肝细胞外基质的弥漫性过度沉积与异常分布,是肝脏对慢性损伤的病理性修复反应。目前,肝组织病理学检查仍是肝纤维化诊断的“金标准”。目前的科学研究普遍认为,Kupffer细胞对NAFLD的发生和发展至关重要,如果它们被适度激活,可以发挥防御作用,但如果它们被过度激活,将释放大量的促炎细胞因子,这对肝组织和其他细胞会造成一定程度的损伤。已有文献表明,活化的肝脏巨噬细胞可以促进NASH的进展[19]。
本研究在MCD诱导的大鼠和CDAHFD诱导的小鼠两个经典NASH模型的实验结果显示,经过2周的诱导后,模型组的肝脏质量以及ALT、AST、ALP、LDH、TG、TC、LDL、TBIL及FFA水平显著高于对照组,HE、Masson及免疫组化染色显示,肝脏组织炎症和肝细胞脂肪变性严重,NAS评分显著增加,肝小叶内和汇管区周围胶原纤维增生及Kupffer细胞活化程度加重,说明建立NASH模型成功。经4周的给药后,七味脂肝方能显著降低上述指标,此外,HE、Masson及免疫组化染色显示,七味脂肝方能显著减轻肝脏组织炎症程度,降低肝脏组织病理NAS评分,减轻肝纤维化及Kupffer细胞活化程度。说明七味脂肝方能有效降低血脂、调节肝脏脂质代谢紊乱,改善NASH小鼠肝脏炎症损伤向肝纤维化发展的趋势,改善肝脏组织病理损伤,从而有效减缓并改善NASH的进展程度。
NASH的发病机制尚未完全阐明,目前公认的是“多重打击”理论,其认为胰岛素抵抗、脂肪毒性、炎症、氧化应激等多种致病因素共同导致了NASH的发生发展,而炎症在NASH的恶化过程中扮演着至关重要的角色[18]。肝脏具有密集的吞噬细胞网络,在非炎症条件下维持耐受性,并快速感知肝细胞损伤和氧化应激信号,导致促炎级联反应的激活。在损伤后,白细胞迅速渗入肝实质,通过产生可溶性介质激活其他免疫细胞和非实质细胞群,从而促进炎症和纤维化的发生。炎症介质可以激活肝星状细胞(HSCs),HSCs是肝纤维化形成过程中的主要效应细胞,导致细胞外基质过度沉积,形成创伤愈合或瘢痕反应,进一步促进纤维化发展。活化的HSCs产生促炎介质,进而使肝脏炎症持续存在,导致炎症的慢性循环和瘢痕组织的形成,最终导致器官衰竭[20]。因此,抑制炎症对于NASH的预防和治疗具有重要意义,深入理解NASH相关的炎症信号通路(NF-κB和MAPK等),并找到能够有效靶向特定炎症的靶点,将为治疗NASH提供更多的思路和新的策略。已有多次报道NF-κB信号通路参与NASH中炎症反应,损伤相关分子模式(DAMPs)激活Kupffer细胞,诱导细胞内的NF-κB信号激活[21]。本研究病理染色结果证明,七味脂肝方可减少炎性浸润,减轻肝纤维化程度,改善NASH动物肝脏的病理表现,后续将继续探究七味脂肝方药效物质基础作用的炎症通路,进一步阐明其治疗NASH的机制。
本研究结果初步提示,七味脂肝方可能是通过改善NASH肝脏炎症损伤,继而阻碍其向肝纤维化发展的趋势来发挥药效,为其后续机制探究提供研究方向。针对目前的NASH临床需求,七味脂肝方具有较好的临床价值。
-
[1] 国家药典委员会. 中华人民共和国药典(一部)2020年版[S]. 北京: 中国医药科技出版社, 2020: 353. [2] 中国科学院中国植物志编辑委员会. 中国植物志. 第八卷[M]. 北京: 科学出版社, 1992. [3] 中国医学科学院药物研究所. 中药志-第二册[M]. 北京: 人民卫生出版社, 1959: 421. [4] 袁钟. 中药辞海. 第三卷. 北京: 中国医药科技出版社, 1999: 808. [5] 肖培根. 新编中药志-第三卷[M]. 北京: 化学工业出版社, 2002: 499. [6] 谢宗万. 中药品种理论与应用[M]. 北京: 人民卫生出版社, 2008: 906. [7] HUANG B K, LEI Y L, TANG Y H, et al. Comparison of HS-SPME with hydrodistillation and SFE for the analysis of the volatile compounds of Zisu and Baisu, two varietal species of Perilla frutescens of Chinese origin[J]. Food Chem,2011,125(1):268-275. doi: 10.1016/j.foodchem.2010.08.043 [8] (明)李时珍. 本草纲目: 校点本[M]. 2版. 北京: 人民卫生出版社, 2004: 755. [9] (宋)苏 颂撰. 胡乃长, 王致谱辑注. 图经本草: 辑复本[M]. 福州: 福建科学技术出版社, 1988: 515. [10] (明)朱橚原著. 王家葵, 张瑞贤, 李敏校注. 救荒本草校释与研究[M]. 北京: 中医古籍出版社, 2007: 356. [11] (清)黄宫绣. 本草求真[M]. 北京: 人民卫生出版社, 1987: 70. [12] 张小敏. 华佗与紫苏传奇[J]. 求医问药, 2007(3):54. [13] 吴其浚. 植物名实图考. 修订本[M]. 北京: 商务印书馆. 1957: 628. [14] 孟诜, 张鼎著. 食疗本草[M]. 北京: 人民卫生出版社, 1984. [15] 雷敩. 《雷公炮炙论》[M]. 上海: 上海中医学院出版社, 1986: 89. [16] (清)张璐. 本经逢原[M]. 北京: 中国中医药出版社, 1996: 70. [17] (明)李梴著. 金嫣莉等校注. 医学入门[M]. 北京: 中国中医药出版社, 1995: 133. [18] (清)严洁等著. 姜典华等校注. 得配本草[M]. 北京: 中国中医药出版社, 1997: 76. [19] (清)陈嘉谟撰. 王淑民等点校. 本草蒙筌[M]. 北京: 人民卫生出版社, 1988: 102. [20] (清)张志聪(清)高世栻. 侣山堂类辩医学真传[M]. 北京: 人民卫生出版社, 1983: 67. [21] 唐慎微. 重修政和经史证类备用本草[M]. 北京: 人民卫生出版社, 1982: 507. [22] (元)李 杲编辑. (明)李时珍参订. (明)姚可成补辑. 郑金生等校点. 食物本草[M]. 北京: 中国医药科技出版社, 1990: 373. [23] 颜正华等点校. 本草衍义[M]. 北京: 人民卫生出版社, 1990: 144. [24] (明)缪希雍撰. 夏魁周, 赵瑗校注. 神农本草经疏[M]. 北京: 中国中医药出版社, 1997: 147. -





 下载:
下载:
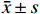
















 下载:
下载: