-
心脏瓣膜病为由多种病因引起的瓣膜狭窄或/和关闭不全所致的心脏病,是引起心力衰竭甚至心源性猝死的一个重要原因。人工瓣膜置换术是中-重度心脏瓣膜病的主要治疗手段之一,获得了良好而持久的临床结果,可有效改善患者心脏功能,提高生活质量[1]。人工心脏瓣膜分为机械瓣和生物瓣两大类。机械瓣具有较高的耐力和持久性,临床应用广泛,但最大的难题是患者必须终身抗凝且易发生血栓栓塞和出血,给患者的工作、生活带来诸多不变;生物瓣置换患者不必终身抗凝,但生物瓣寿命问题未获得满意解决,多数患者需面临二次手术。由于心脏瓣膜置换术后患者易出现血栓、感染、应激性溃疡(SU)等多种并发症,需同时使用多种药物,药物相互作用复杂[2]。患者术后需服用华法林进行抗凝治疗,该药个体用药差异大,需根据凝血指标调整剂量。尤其对于机械瓣膜置换者更要终身进行抗凝治疗,患者常因对抗凝治疗认识不足而影响用药依从性。鉴于此,临床药师通过协助医生对该类患者进行用药方案的制订、调整,及时发现患者出现的并发症、药物不良反应,对患者进行药学监护及抗凝治疗的用药教育对保证患者治疗的有效性及安全性具有重要意义。本文结合典型案例,提出临床药师参与心脏瓣膜置换术后患者药学服务的5个切入点,为临床提供参考。
-
心脏瓣膜置换术后患者需服用抗凝药物华法林,临床药师应协助医师根据凝血酶原时间(PT)和国际标准化比值(INR)监测值对华法林的剂量进行调整,并对患者进行密切的药学监护。关于此类患者的INR目标范围,参考国际相关标准并结合当前我国抗凝研究结果,我们建议:对于机械瓣置换患者的INR监测值,主动脉瓣单瓣置换为1.8~2.2,二尖瓣单瓣置换为2.0~2.5,主动脉瓣与二尖瓣双瓣置换为2.0~2.5,三尖瓣机械瓣置换为2.5~3.0;生物瓣置换患者为1.8~2.2[3-4]。
病例1:患者,男,50岁,因主动脉瓣钙化伴重度狭窄入院后行主动脉瓣置换(机械瓣)+升主动脉成形术,术后予华法林进行抗凝治疗,临床药师协助医师根据PT及INR值监测结果对华法林剂量进行调整。患者主动脉瓣机械瓣置换术,INR目标范围为1.8~2.2,术后PT、INR监测结果及华法林用量见表1。患者术后5天INR为1.04,医师予华法林片4.5 mg qd。根据《华法林抗凝治疗的中国专家共识》[5],中国人华法林的初始剂量为1~3 mg,而该患者初始给予4.5 mg的负荷剂量,初期可能会因过度抗凝而加大栓塞风险,临床药师建议给予华法林片3 mg qd,医师接受。华法林作用发生缓慢,当日PT及INR复查结果反映的是2天前服药的效果,应根据凝血指标监测结果及时调整华法林剂量,INR<目标值下限:华法林加量,每次增加1/4片;INR>目标值上限:华法林减量,每次减少1/4片。该患者术后9天时INR2.65,超过目标值上限,临床药师建议医师将剂量减为2.25 mg qd,继续监测PT和INR,嘱患者住院期间出现皮下瘀斑、紫癜、牙龈出血、鼻衄、便血、黑便等症状及时告知医师及药师,并密切关注患者粪隐血、粪转铁蛋白、血小板计数、血红蛋白含量等化验指标的变化情况。患者术后11天INR2.79,仍未达标,华法林片继续减量至1.5 mg qd,患者术后13天INR2.01达标,抗凝治疗期间未出现出血相关症状。
表 1 病例1凝血功能监测及华法林剂量调整情况
术后天数 剂量(m/mg) PT(t/s) INR d5 4.5 13.8 1.04 d6 3 − − d7 3 21.0 1.85 d8 3 − − d9 2.25 27.9 2.65 d10 2.25 − − d11 1.5 28.6 2.79 d12 1.5 − − d13 1.5 22.5 2.01 病例2:患者,女,69岁,因三尖瓣重度关闭不全;二尖瓣置换术后入院拟行介入下三尖瓣置换术。患者12年前行二尖瓣机械瓣置换术,入院前长期服用华法林抗凝,考虑到此次入院计划行三尖瓣置换术,故入院后停用华法林,根据《华法林抗凝治疗的中国专家共识》[5],行外科手术患者可不采用桥接,华法林停药后术前INR可恢复至接近正常范围(INR<1.5),患者查INR为1.89,因计划次日手术,为减少患者出血风险临床药师建议临时给予维生素K120 mg im,降低INR,医师接受。患者次日行经导管三尖瓣介入置换术,术后予华法林进行抗凝治疗,患者术后PT、INR值监测结果及华法林用量见表2。患者三尖瓣介入置换术,INR目标范围为2.5~3.0,术后8天INR2.19,华法林1.5 mg qd,已使用4 d,仍在目标值下限,临床药师建议医师华法林加量0.75 mg,医师接受,予华法林2.25 mg qd,继续监测PT、INR值及患者抗凝过程中可能出现的出血症状及指标。患者术后10天INR达3.38,考虑到INR>3.0,临床药师协助医师调整抗凝治疗方案:停用华法林2 d,拟于第3天减量0.75 mg,医师按照此方案给药。患者于术后16天INR2.70达标,继续予以华法林1.5 mg qd,至术后18天患者INR维持在目标范围内,患者出院继续予华法林抗凝治疗。
表 2 病例2凝血功能监测及华法林剂量调整情况
术后天数 剂量(m/mg) PT(t/s) INR d4 1.5 13.6 1.04 d5 1.5 − − d6 1.5 15.0 1.17 d7 1.5 − − d8 2.25 24.3 2.19 d9 2.25 − − d10 2.25 28.2 2.67 d11 2.25 − − d12 − 35.0 3.38 d13 − − − d14 1.5 15.5 1.22 d15 1.5 − − d16 1.5 28.5 2.70 d17 1.5 − − d18 1.5 28.0 2.65 -
心脏瓣膜置换术后患者感染预防与控制至关重要,临床药师可从以下几方面进行监护:① 围手术期抗菌药物的合理应用:心脏瓣膜置换术围手术期应预防性应用抗菌药物,可能的污染菌为凝固酶阴性葡萄球菌或金黄色葡萄球菌[6],临床药师应提醒医生于术前0.5~1 h应用第一、二代头孢菌素,预防用药疗程要覆盖整个手术过程,可根据情况延至术后一段时间,如48 h[6]。②术后感染监测:心脏瓣膜置换术后患者易发生肺部感染、手术切口感染、心内膜感染等感染[7],临床药师应关注患者是否有咳嗽、发热、创面脓性分泌物及白细胞、中性粒细胞升高等提示感染发生的症状及指标,及时提醒医师进行相关标本微生物送检、胸部X线等检查,发生感染时在抗菌药物治疗方案制订与调整方面为医师提供建议。③注意抗菌药物联用的影响:某些抗菌药物与华法林合用可能会存在相互作用,如头孢哌酮、红霉素、甲硝唑、喹诺酮类抗菌药可增强华法林的抗凝作用;利福平可抑制其抗凝作用[8],因此临床药师应对患者进行全面的药学监护,减少抗菌药物与华法林联用对抗凝治疗的影响,同时注意应用抗菌药物可能出现的胃肠道反应、皮疹、肝酶升高等不良反应。
病例3:患者,男,60岁,因主动脉瓣重度狭窄入院后行主动脉瓣置换术。患者心脏瓣膜置换术术前1 h,使用第二代头孢菌素类抗菌药物头孢呋辛钠注射剂1.5 g预防感染,围手术期抗菌药物种类选择及给药时机合理。术后1天患者体温37.5 ℃,双肺呼吸音清晰,血白细胞计数18.76×109/L、中性粒细胞计数17.86×109/L、中性粒细胞95.2%,怀疑感染可能,取血、痰标本培养,继续予头孢呋辛钠注射剂1.5 g bid ivgtt。术后3天体温37.8 ℃,血白细胞计数22.65×109/L,中性粒细胞96.8%,考虑头孢呋辛钠已用3 d,白细胞计数、中性粒细胞等指标仍较高,协助医师调整治疗方案,换用头孢美唑钠注射剂1 g bid ivgtt联合盐酸莫西沙星氯化钠注射液0.4 g qd ivgtt,患者术后应用华法林抗凝,临床药师提醒医师盐酸莫西沙星可增强华法林的抗凝作用,需严密监控患者的PT/INR值,同时密切监测患者的感染相关症状及指标变化。术后5天患者体温36.6 ℃,痰培养、血培养结果无致病菌生长,血白细胞计数18.61×109/L、中性粒细胞85.7%,指标有所下降,继续原用药方案。术后6天体温36.6 ℃,血白细胞计数17.97×109/L、中性粒细胞80.4%。术后9天体温36.5 ℃,血白细胞计数9.17×109/L、中性粒细胞64.0%,指标正常。抗菌药物应用期间临床药师对药物不良反应进行监测,同时注意对华法林的抗凝作用的影响,并根据患者情况协助医师适时停用抗菌药物。患者术后13天(出院)无相关感染症状,血常规正常,期间未出现相关不良反应。
-
心脏瓣膜置换术围手术期气道管理可减少并发症、缩短患者住院时间,布地奈德等糖皮质激素雾化吸入给药是常用药之一,与支气管舒张剂联用可协同增效,推荐术前3~7 d、术后3~7 d应用[9]。临床药师应对患者进行用药教育:吸气时手指按住出气口并紧闭口唇以使药液尽可能进入肺部,用力深吸气并屏气3~5 s以吸入完全;呼气时手指从出气口移开,并将喷气口移开口唇以减少痰液喷射到药液中,缓慢呼气。雾化吸入糖皮质激素可能导致患者出现口腔真菌感染、声音嘶哑,临床药师应教育患者注意用药后漱口以减少不良反应的发生。
-
应激性溃疡(SU)为机体在严重创伤,各种困难、复杂的手术,危重疾病等应激状态下发生的急性胃肠道黏膜溃疡病变,严重者可并发消化道出血、甚至穿孔,使病死率增加。机械通气超过48 h或接受体外生命支持、凝血机制障碍或使用抗凝或抗血小板药、原有消化道溃疡或出血病史、大剂量使用糖皮质激素或合并使用非甾体类抗炎药、急性肝肾功能衰竭等危险因素会增加SU发生及并发出血的风险[10]。心脏瓣膜置换术属于复杂手术,且涉及到接受体外生命支持、机械通气超过48 h、使用抗凝药等危险因素,因此心脏瓣膜置换术后患者应进行SU预防,制定合适的SU预防用药方案、及时判断消化道出血发生并选择有效治疗措施是临床药师关注的重点。SU预防方案建议将质子泵抑制剂(PPI)作为首选预防药物,在原发病发生后应用标准剂量,q12h,ivgtt,至少连续3 d[11]。临床药师应嘱患者留意是否有呕血、黑便等消化道出血症状发生,并监测血常规、大便常规等,及时发现消化道出血等提示SU并发出血的情况,以采取及时有效的措施治疗,同时协助医师权衡患者出血及不良事件风险,把握停药指征,避免过度使用SU预防药物。
病例4:患者,男,53岁,因二尖瓣关闭不全入院行二尖瓣置换术+三尖瓣成形术。术后返回监护病房,予注射用泮托拉唑钠40 mg bid ivgtt预防SU。临床药师叮嘱护士注意泮托拉唑钠溶解和稀释后应在4 h内用完,滴注时要求15~60 min内滴完。术后3 d,患者一般情况可,转入普通病房,临床医师继续予注射用泮托拉唑钠40 mg bid ivgtt。根据相关文献及指南,当患者病情好转或转入普通病房,可耐受肠内营养或已进食,应将SU预防药物静脉给药换为口服给药,并逐渐停药[10,12]。考虑到该患者病情平稳,已转至普通病房,能正常进食,经前期监护患者未出现提示SU并发出血的情况,临床药师建议医师将PPI由静脉用药调整为口服用药,医师接受,更改医嘱:停用泮托拉唑钠注射剂,予雷贝拉唑钠肠溶片20 mg qd po,继续监测出血相关症状及指标,至患者出院情况稳定。
-
心脏瓣膜置换术后患者需长期服用华法林,华法林与多种药物、食物存在相互作用,其抗凝作用的个体差异也与患者的依从性相关[8],临床药师对患者进行详尽的用药教育有助于提高患者华法林的正确使用及自我监测意识,可从以下几方面进行教育:①使患者了解术后长期服用华法林抗凝的重要性,强调每天需按时服用华法林,如忘记,当晚12:00之前想起可补吃,若第2天想起则不可再吃。②告知患者需定期监测PT和INR值使其保持在目标范围内,出院后第一周每3天检查一次,以后每周检查一次,结果连续3次在目标范围内可再延长至每2周一次,以此类推,最长不可超过3个月检查一次,若不在目标范围应咨询医师或药师进行剂量调整。③叮嘱患者日常留意是否出现牙龈易出血、皮肤瘀斑、黑便等出血症状及无缘由剧烈头痛、四肢麻木、肢端水肿等血栓症状,如出现上述症状应立即复查PT、INR,并向医师或药师咨询。④使患者知晓华法林与多种药物有相互作用,出现其他疾病需用药时应咨询医师或药师进行药物选择;叮嘱患者避免大量摄入菠菜、西芹、卷心菜、动物肝脏等富含维生素K的食物而影响华法林的抗凝效果。⑤使患者知晓外伤、感染、发热、呕吐、腹泻等异常的生理状态会影响华法林的治疗,若发生上述情况需及时就诊;如需行创伤性手术或检查(如拔牙、胃镜等)需告知医生正在服用华法林。
总之,心脏瓣膜置换术后患者需同时使用多种药物,且华法林等药物个体用药差异大、需根据监测指标调整剂量,临床药学服务十分必要。临床药师可从心脏瓣膜置换术患者PT、INR值监测及华法林的剂量调整,感染监测及抗菌药物的合理应用,围手术期气道管理,应激性溃疡预防与药学监护,出院患者华法林用药教育等方面入手,加强与医生、患者的沟通,对患者进行个体化的药学服务,以促进药物的合理使用,保障患者用药安全、有效。
Practice and experience of clinical pharmacists participating in pharmaceutical care for patients after heart valve replacement
-
摘要:
目的 探讨临床药师对心脏瓣膜置换术后患者实施药学服务的切入点。 方法 结合典型案例阐述临床药师对心脏瓣膜置换术后患者实施药学服务的内容、重点及效果。 结果 临床药师对患者实施抗凝治疗监护及华法林剂量调整方案建议,感染监测及抗菌药物合理应用与监护,围手术期气道管理,应激性溃疡(SU)预防与药学监护,对患者进行华法林用药教育等药学服务,促进了药物的合理使用,改善了患者的治疗效果。 结论 临床药师深入临床对心脏瓣膜置换术后患者实施药学服务有助于提高药物治疗的安全性和有效性。 Abstract:Objective To explore the starting point of pharmaceutical care by clinical pharmacists for patients after heart valve replacement. Methods Combined with typical cases, the content, focus and effects of pharmaceutical care for patients after heart valve replacement were summarized. Results Clinical pharmacists provided pharmaceutical services such as anticoagulant care and warfarin dosage adjustment, infection monitoring and rational use and care of antibacterial, perioperative airway management, stress ulcer (SU) prevention and pharmaceutical care, and warfarin medication education for patients, which had promoted the rational use of drugs and improved the treatment results of patients. Conclusion Pharmaceutical care by clinical pharmacists could be helpful to improve the safety and efficacy of drug treatment for patients after heart valve replacement. -
Key words:
- heart valve replacement /
- clinical pharmacists /
- pharmaceutical care /
- warfarin
-
马兜铃酸(AAs)是存在于马兜铃科植物中结构相似的硝基菲羧酸类化合物,广泛存在于马兜铃属和细辛属植物中。含AAs成分的中药,如青木香、关木通、细辛、马兜铃等都有明确的肾毒性[1-2]。马兜铃酸肾病(AAN)是因服用含有AAs成分的药物而造成的急、慢性肾小管间质疾病,表现为肾小管变性、萎缩、坏死和广泛的肾间质纤维化[3],临床上以夜尿增多、贫血、消化道症状、高血压就诊者居多,易被漏诊和误诊。AAN急性肾损害患者大部分预后良好,慢性肾损害患者预后较差。笔者所在单位是全军肾病中西医结合治疗中心,每年均收治一定数量的AAN患者,但尚未进行全面的回顾性分析。本文就此开展研究,旨在分析AAN临床特点和规律,避免误诊漏诊,提高临床确诊率。
1. 资料与方法
1.1 资料来源
依据2004—2022年该中心收治的因服用含有AAs引起药品不良反应(ADR)报表中患者信息,对患者病历进行回顾性调查。
1.2 调查方法
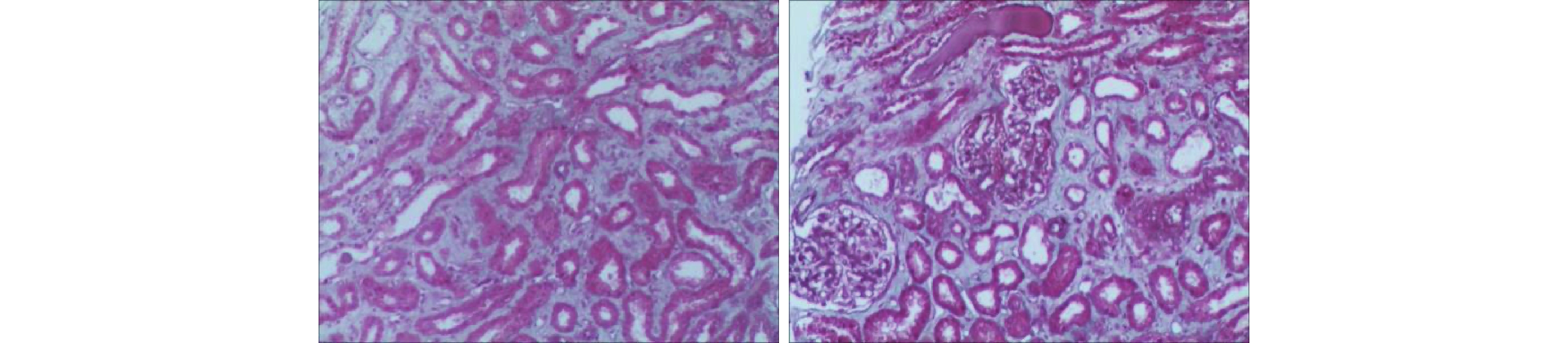
采用Excel 2007进行数据统计调查,内容包括患者性别、年龄、引起AAN临床表现、引起AAN药品、引起AAN药品服用时间、原患疾病、实验室检查等。计量描述以(
$ \bar{x}\pm s $ )表示,计数以频数(构成比/%)表示。1.3 评判ADR标准
拟定评判ADR标准为:①明确有口服AAs成分药物史,临床诊断以间质性肾炎为主要诊断的AAN;②无长期或近期使用引起间质性肾损害的药物史,如解热镇痛药、抗菌药物、利尿剂等;③可排除临床系统性疾病伴发的肾小管间质病变、肾小球疾病、感染相关性间质性肾炎、肾动脉狭窄、高血压肾病及糖尿病肾病等;④典型病理形态学为寡细胞性肾间质纤维化及肾小管萎缩。最终确定AAN患者111例。
2. 结果
2.1 患者年龄、性别分布
111例AAN患者中,男性31例,女性80例,女性多于男性(2.58∶1)。年龄最小者31岁,最大者 88岁,平均年龄(63.70 ± 11.67)岁,大于50岁的101例(90.99%),详见表1。
表 1 111例AAN患者年龄、性别分布情况性别 年龄(岁) 合计 30~39 40~49 50~59 60~69 70~79 80~89 男 1 1 5 4 13 7 31 女 2 6 28 28 13 3 80 合计 3 7 33 32 26 10 111 构成比(%) 2.70 6.31 29.73 28.83 23.42 9.01 100.00 2.2 患者服用含有AAs成分药物持续时间
111例AAN患者中,服用AAs成分药物时间最长的30年,最短20 d,平均服药时间(8.08±6.94)年。107例(96.40%)服用超过1年,其中1~5年病例数最多,超过5年次之,10年以上的累计占36.04%,详见表2。
表 2 111例服用含有AAs成分药物持续时间序号 服用时间(年) 数量(例) 构成比(%) 1 <1.0 4 3.60 2 1.0~<5 41 36.94 3 ≥5.0~<10 26 23.42 4 ≥10.0~<15 21 18.92 5 ≥15~<20 8 7.21 6 ≥20 11 9.91 合计 111 100.00 2.3 患者服用药物情况及原患疾病
111例AAN患者中,服用冠心苏合丸和龙胆泻肝丸共106例(95.50%)。111例患者按药品说明书规定剂量服用62例(55.86%),随意服用45例(40.54%),不详4例(3.60%),111例中单用药103例(92.79%)、联合用药8例(7.21%), 详见表3。
表 3 111例AAN患者服用药物情况及原患疾病序号 药物名称 例数 构成比(%) 原患疾病 1 冠心苏合丸 78 70.27 冠心病(38)、心前区不适(9)、风湿性心脏病(1)、急性心肌梗死(1)、间断胸闷+气短(1)、
口干+心慌(1)、心动过速(1)、心功能Ⅲ级(1)、心慌+气短(1)、心脏病(1)、不详(23)2 龙胆泻肝丸 22 19.82 祛火(7)、身体不适(5)、乙肝(3)、护肝(1)、酒后去肝火(1)、口腔溃疡(1)、
皮肤过敏(1)、眼干(1)、子宫肌瘤(1)、清肝明目(1)3 冠心苏合丸+龙胆泻肝丸 6 5.41 冠心病(3)、不详(3) 4 木通(中药饮片) 2 1.80 心前区不适(1)、不详(1) 5 耳聋丸 1 0.90 内耳眩晕症(1) 6 冠心苏合丸+冠心泰丸 1 0.90 不详(1) 7 龙胆泻肝丸+蛇王贝毒胶囊 1 0.90 不详(1) 合计 111 100.00 2.4 实验室检查及临床表现
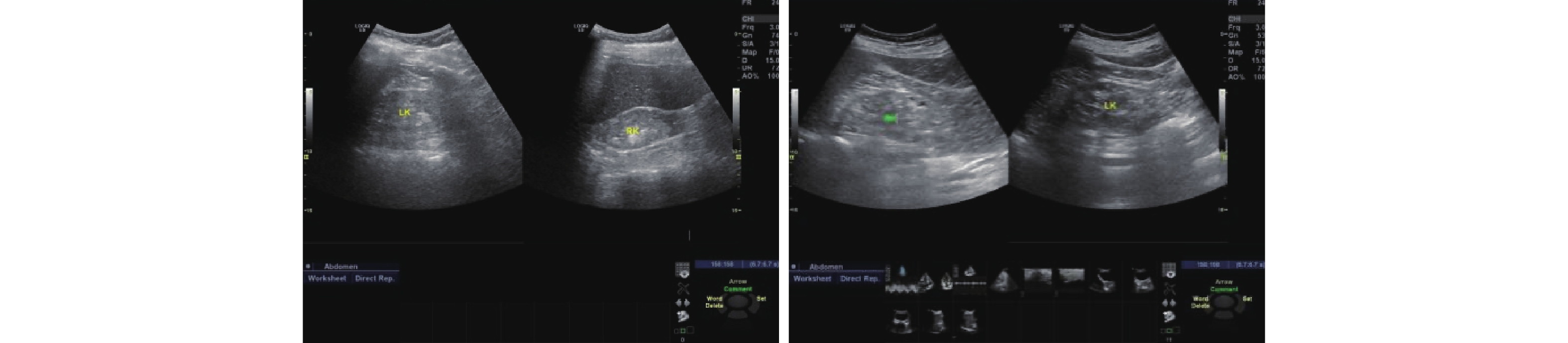
111例AAN患者中,实验室检查:血肌酐升高108例,结果范围为83~1600 μmol/L(514.31±206.48 μmol/L);尿素氮升高106例,结果范围为3.01~65.79 mmol/L(20.23±8.96 mmol/L);血红蛋白降低103例,结果范围为40~168 g/L(84.89±15.56 g/L),无检查结果7例;24 h尿蛋白区间0.1~4.1 g/d(0.48±0.35 g/d),多数为低比重尿,蛋白尿及潜血(±)~(+++)不等。超声检查肾脏均不同程度受损,呈肾体积缩小(大小不对称)、结构不清晰、弥漫性改变、血流不丰富等,详见图1。肾病理形态学多为肾小管上皮细胞脱落变性、肾小管萎缩,有不同程度的肾小管间质损害,典型的为寡细胞性肾间质纤维化,详见图2。多数患者起病隐匿,进展程度不一,与年龄、服药时间不成正比。临床上肾功能呈进行性损害,多数不可逆、预后较差,多表现纳差、夜尿增多,乏力、面色苍白、水肿不明显,多伴有贫血,贫血程度与肾功能减退程度不平行。临床均以AAN或因服用AAs药物引起的间质性肾炎和伴有进行性肾功能减退等原因收住院治疗。
3. 讨论
3.1 AAN患者基本情况
111例AAN患者中,女性多于男性(2.58∶1),与有关报道[4]基本相似,可能因男女解剖和生理上有一定区别,女性较男性更易受药物影响[5]。其次,可能与绝经后女性因体内雌激素水平下降,易患更年期综合征、心血管疾病等,使用冠心苏合丸、龙胆泻肝丸治疗上述疾病会引起AAN的机会增加有关。本研究AAN患者年龄大于50岁共101例,占比90.99%。有报道指出,50~90岁人肾小球滤过率可下降50%,65岁后肝血流量为青年人的40%~50%[6],中老年患者肝、肾功能的降低会影响药物代谢,使半衰期延长,导致药物在体内蓄积,增加患AAN的风险。最新研究证明,肾脏血流动力学的改变及肾小管上皮细胞损伤后重吸收功能的异常也是AAN的致病机制[7]。
3.2 AAs服药时间
111例AAN患者中,服用含AAs药物最长的30年,最短20 d,107例服用超过1年。有研究发现,关木通临床等倍剂量提取物用药持续3周,可明显引起肾损害,证明肾毒性马兜铃酸累积阈剂量与给药剂量具有相关性[8]。中药中的很多成分是小分子物质,肾功能减退时肾脏排泄减少,加重残存肾单位药物负荷,药物在体内蓄积造成肾损害[9]。本研究发现,发生AAN的原因可能与长时间、超剂量服用AAs药物有关,使AAs在肾脏最主要的蓄积场所产生蓄积效应[10],引起肾功能减退,进一步加重肾功能损伤。
3.3 AAN涉及的主要药物
111例AAN患者中,涉及药物有7个品种,冠心苏合丸和龙胆泻肝丸共106例(95.50%)。本研究调查发现,患者服用冠心苏合丸和龙胆泻肝丸多在90 年代中后期,当时两药成分中含有AAs植物青木香和关木通,长期或短期服用可引起AAN。原国家食品药品监督管理局因青木香和关木通能引起AAN,于2003年将处方中的关木通换为木通,2004年将青木香替换为土木香,有效制止了青木香、关木通制剂引起的肾损害[11]。冠心苏合丸常用于冠心病、心绞痛的临床治疗,功效是宽胸、理气、止痛,用于寒凝气滞、心脉不通所致的胸闷、心前区疼痛的症状。龙胆泻肝丸具有泻肝胆实火、清下焦湿热的功效,主治肝胆实火上炎所致的头痛、目赤、胁痛、耳鸣等,以及肝胆湿热下注所引起的外阴瘙痒、小便淋浊、妇女带下等症。本研究调查发现,患者对中药毒副作用普遍存在认知偏差,认为中药没有毒副作用或毒副作用较小,多数患者为自我药疗,服药较随意,存在滥用现象。提示中药制剂应在中医理论指导下辨证施治,不可盲目擅自服用,避免引起药源性损害。
3.4 AAN的临床诊断
本研究调查发现,患者服用AAs时间与肾功能受损情况不相关,服用时间的长短与个体差异有关,与年龄、服药时间不成正比。如78岁男性,服用冠心苏合丸2年,血肌酐1600 μmol /L,尿素氮43.8 mmol/L。81岁男性,服用冠心苏合丸30年,血肌酐721 μmol /L,血尿素氮25.9 mmol /L。61岁男性服用冠心苏合丸6年,血肌酐83 μmol /L,尿素氮6.7 mmol /L。55岁女性,服用含有木通中药汤剂20 d,血肌酐377 μmol /L,尿素氮17.2 mmol/L。AAN目前尚无特异性诊断标准,当服用含有AAs中草药制剂而出现无法解释的进行性发展相对较快的肾脏病时,需对AAN的可能性进行排查[10]。有研究显示,在早期肾小管损伤检测中,黄醇结合蛋白、β2微球蛋白、胱抑素C、尿-乙酰-β氨基葡萄糖苷酶等较血肌酐和尿素氮有一定检测优势[12-13]。提示临床对出现贫血、肾功能损害及肾脏大小改变等的患者,应追问其服药史,以求尽快确诊救治。
3.5 AAN的临床治疗
AAs是一种广泛存在的毒性物质[14],其引起肾损害毒性最大的是马兜铃酸Ⅰ[15-16]。文献通过对急性AAN患者随访1~7年,其中一半的患者因肾衰竭需要透析治疗,另外一半患者进展成4期慢性肾脏病,持续性损伤发展为终末期肾病[17]。AAN的特点是肾功能损害进展迅速,即便停止使用含AAs成分药物,病情依然进展[18]。目前尚无有效针对AAN的治疗方法[10]。有报道低剂量糖皮质激素可延缓AAs诱导的肾功能减退[19];前列腺素E1对AAs诱导的急性肾脏微血管损伤可能有一定的治疗作用[20];AAs诱导的慢性肾损伤通过同基因间充质干细胞移植有治疗肾间质纤维化的作用[21];此外中药大黄附子汤[22]、丹参酮I可减轻AAs诱导的肾损伤等。以上方法因缺乏长期研究及病例数较少,尚难以对AAN疗效作出客观性评价[23]。在本研究中,临床通过中西医结合药物治疗,中药治疗为行益气养血固肾、活血化瘀、和胃降逆、通腑泄浊等辨证治疗,如百令胶囊、肾衰宁片、尿毒清颗粒、肾康注射液、中药汤剂等保肾降氮治疗,丹参川芎嗪注射液、冠心宁注射液、舒血宁注射液等活血化瘀治疗,叶酸、铁剂、促红细胞生成素等纠正贫血,硝苯地平、缬沙坦等降压治疗,对达到尿毒症期的患者行血液透析治疗,多数患者病情好转或稳定出院。
3.6 AAN误诊漏诊情况分析。
多数AAN患者因纳差、夜尿增多、乏力等原因就诊,实验室检查后,多有不同程度的血尿肌酐、尿素氮升高等肾功能损害表现,临床初诊多诊断为慢性肾功能不全、血肌酐升高、肾功能衰竭等,易造成漏诊、误诊。分析原因:①AAN临床表现不典型,最初表现以纳差、乏力、夜尿增多为主,如果检查不全面,易造成误漏诊;②接诊医师对AAN的临床表现及发病特点认识不足,实验室检查血肌酐、尿素氮升高,就草率诊断为肾功能不全、肾功能衰竭、血肌酐升高等;③非专科医师对AAs毒副作用认识不够,接诊医师对AAN的病因、鉴别诊断要点不熟悉或忽视;④医生问诊时对患者服用药物询问不详细,忽略患者曾服用含有AAs的药物;⑤AAN多发生于50岁以上的中、老年人,以女性居多,存在个体差异,有肾脏实质性疾病的患者反应更为敏感[24],初诊中要重点关注特殊人群。
AAs可通过一种或者多种机制导致不同程度的肾损伤[7]。肾损失患者个体差异较大,与服用AAs药物时间长短、剂量不相关,且AAN进展迅速,即使停止使用含AAs药物后病情依然进展。因此,进一步加强药物警戒工作,防范含有AAs成分药物引起的严重肾功能损害具有重要意义。临床诊疗过程中应重视对AAN的诊断,掌握AAN临床特点和规律,在中医药理论指导下辨证施治,进行早期的诊断和有效的干预,有条件的可进行治疗药物监测(TDM),有助于尽快确诊救治,避免误诊漏诊,减少AAN的发生或延缓其发展。
-
表 1 病例1凝血功能监测及华法林剂量调整情况
术后天数 剂量(m/mg) PT(t/s) INR d5 4.5 13.8 1.04 d6 3 − − d7 3 21.0 1.85 d8 3 − − d9 2.25 27.9 2.65 d10 2.25 − − d11 1.5 28.6 2.79 d12 1.5 − − d13 1.5 22.5 2.01 表 2 病例2凝血功能监测及华法林剂量调整情况
术后天数 剂量(m/mg) PT(t/s) INR d4 1.5 13.6 1.04 d5 1.5 − − d6 1.5 15.0 1.17 d7 1.5 − − d8 2.25 24.3 2.19 d9 2.25 − − d10 2.25 28.2 2.67 d11 2.25 − − d12 − 35.0 3.38 d13 − − − d14 1.5 15.5 1.22 d15 1.5 − − d16 1.5 28.5 2.70 d17 1.5 − − d18 1.5 28.0 2.65 -
[1] CHAMBERS J. Prosthetic heart valves[J]. Int J Clin Pract,2014,68(10):1227-1230. doi: 10.1111/ijcp.12309 [2] 汤丹丹, 程明光. 心脏瓣膜病患者人工心脏瓣膜置换术预后分析[J]. 湖南师范大学学报(医学版), 2020, 17(2):52-55. [3] BAUMGARTNER H, FALK V, BAX J J, et al. 2017 ESC/EACTS Guidelines for the Management of Valvular Heart Disease[J]. Eur Heart J,2017,38(36):2739-2791. doi: 10.1093/eurheartj/ehx391 [4] 高申, 陆方林. 血栓栓塞性疾病防治的药学监护[M]. 北京: 人民卫生出版社, 2016. [5] 中华医学会心血管病学分会, 中国老年学学会心脑血管病专业委员会. 华法林抗凝治疗的中国专家共识[J]. 中华内科杂志, 2013, 52(1):76-82. doi: 10.3760/cma.j.issn.0578-1426.2013.01.027 [6] 《抗菌药物临床应用指导原则》修订工作组. 抗菌药物临床应用指导原则(2015年版)[M]. 北京: 人民卫生出版社, 2015: 5-28. [7] 董柱, 曹一秋, 张本, 等. 人工瓣膜置换术后感染的危险因素分析及预防策略[J]. 临床心血管病杂志, 2019, 35(4):300-305. doi: 10.13201/j.issn.1001-1439.2019.04.003 [8] AGENO W, GALLUS A S, WITTKOWSKY A, et al. Oral Anticoagulant Therapy: Antithrombotic Therapy and Prevention of Thrombosis, 9th Ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines[J]. Chest, 2012, 141(2 Suppl): e44S-e88S. [9] 车国卫, 吴齐飞, 邱源, 等. 多学科围手术期气道管理中国专家共识(2018版)[J]. 中国胸心血管外科临床杂志, 2018, 25(7):545-549. doi: 10.7507/1007-4848.201804082 [10] 柏愚, 李延青, 任旭, 等. 应激性溃疡防治专家建议(2018版)[J]. 中华医学杂志, 2018, 98(42):3392-3395. doi: 10.3760/cma.j.issn.0376-2491.2018.42.003 [11] MADSEN K R, LORENTZEN K, CLAUSEN N, et al. Guideline for stress ulcer prophylaxis in the intensive care unit[J]. Dan Med J,2014,61(3):C4811. [12] 中国药学会医院药学专业委员会, 中华医学会临床药学分会, 质子泵抑制剂优化应用专家共识》写作组. 质子泵抑制剂优化应用专家共识[J]. 中国医院药学杂志, 2020, 40(21):2195-2213. doi: 10.13286/j.1001-5213.2020.21.01 -





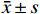
 下载:
下载:
 下载:
下载: 

