-
菊花为菊科植物菊花的干燥头状花序,是一种常见的药食两用的花卉,具有清热、明目、疏风、解毒之功效[1-2]。根据经典的记载,中国栽培菊花历史已有3000多年。汉朝《神农本草经》记载:“菊花久服能轻身延年”。现代药理学研究表明,菊花具有抗菌、抗病毒、抗氧化、抗炎以及保肝等作用[3-12],因此,常作为保健饮品服用。安徽黄山是菊花的重要产地,拥有黄山金丝皇菊、黄山皇菊、黄山贡菊和黄山黄菊等多个品种,其中皇菊的黄酮含量极高,富含多种氨基酸、维生素和微量硒元素,具有重要的药用价值;而道地黄山贡菊更是菊花中的上等品,“白边黄芯绿屁股”,处于四大药菊之首。本研究主要对以上四种菊化品种进行研究,对比其抗氧化及抗炎活性,为菊花抗氧化和抗炎品种的开发提供参考和借鉴。
-
4种菊花(黄山金丝皇菊、黄山皇菊、黄山贡菊和黄山黄菊)来源于黄山市产品质量检验研究院;总抗氧化能力检测试剂盒(ABTS法)、总抗氧化能力检测试剂盒(FRAP法)、1,1-二苯基-2-三硝基苯肼试剂盒(DPPH法)购自Solarbio;双报告基因检测试剂盒购自Promega;LPS购自美国Sigma公司;SD大鼠,雄性,体重180~220g,购自上海斯莱克实验动物中心。
-
4种不同菊花经粉碎机粉碎并过60目筛,各取100 g,加入1000 ml去离子水浸泡12 h,然后加热回流提取2 h,过滤去除滤渣,滤液用旋转蒸发仪(60 ℃)蒸发去除溶剂,然后经真空干燥彻底去除水分[13]。由于4种菊花水提物得率基本一致(约17%),因此后续用相同质量的水提物表征同等质量的菊花。
-
将等体积的ABTS溶液和氧化剂溶液混合配置成ABTS工作母液,室温避光存放24 h。使用前,把ABTS工作液用PBS稀释30~50倍,要求ABTS工作液的吸光度减去相应的PBS空白对照后,A734为0.7±0.05,对应的A405在1.4左右。称取菊花粗提物粉末100 mg,用适量蒸馏水充分溶解。同时,用蒸馏水将10 mmol/L Trolox标准溶液稀释成0.15、0.3、0.6、0.9、1.2和1.5 mmol/L。于96孔板的每个检测孔中加入200 μl ABTS工作液,空白对照孔中加入10 μl蒸馏水;标准曲线检测孔中加入10 μl各浓度Trolox标准溶液;样品检测孔中加入10 μl样品溶液,轻轻混匀。室温孵育2~6 min后测定A734。根据标准曲线计算样品的总抗氧化能力[14]。
-
将TPTZ稀释液与TPTZ溶液充分混匀再加入检测缓冲液,从而配制成FRAP工作液。称取菊花粗提物粉末100 mg,用适量蒸馏水充分溶解。称取27.8 mg本试剂盒提供的 FeSO4•7H2O,溶解并定容到1 ml,此时浓度即为100 mmol/L。取适量100 mmol/L FeSO4溶液用蒸馏水稀释至0.15、0.3、 0.6、 0.9、 1.2和1.5 mmol/L。于96孔板的每个检测孔中加入180 μl FRAP工作液,空白对照孔中加入5 μl蒸馏水;标准曲线检测孔中加入5 μl各浓度FeSO4标准溶液;样品检测孔中加入5 μl样品溶液,轻轻混匀。室温孵育2~6 min后测定A593。根据标准曲线计算样品的总抗氧化能力[14]。
-
称取菊花粗提物粉末100 mg,用适量蒸馏水充分溶解。同时,用蒸馏水将10 mmol/L Trolox标准溶液稀释成0.15、0.3、0.6、0.9、1.2和1.5 mmol/L。于96孔板的每个检测孔中加入190 μl DPPH工作液,空白对照孔中加入10 μl蒸馏水;标准曲线检测孔中加入10 μl各浓度Trolox标准溶液;样品检测孔中加入10 μl样品溶液,混匀后室温避光静置30 min,测定A515。根据标准曲线计算样品的总抗氧化能力[14]。
-
Raw264.7细胞以适当密度接种于96孔板,实验分别设置空白组、LPS刺激组和不同药物浓度处理组,每组分别设置3个复孔。细胞过夜贴壁,利用转染试剂共转染报告基因质粒pNF-κB-Luc 和pRL-SV40,转染6 h后换液。转染24 h后加药,药物孵育2 h后加入LPS(终浓度1 μg/ml)刺激6 h,双报告基因法检测NF-κB转录活性。
-
取SD大鼠48只,随机分为6组,分别为空白组、模型组、菊花水提物给药组(2 g/ kg,相当于菊花11.76 g/kg)。各组大鼠连续灌胃给药3 d,模型组给予相同体积的生理盐水,第4天于每只大鼠右后足垫皮下注射1.0%角叉菜胶100 μl,致炎后灌胃给予相应药物,分别在致炎前和致炎后1、2、4 h,测量大鼠致炎侧足容积,计算足趾肿胀率和肿胀抑制率[15-16]。按下式计算小鼠足趾肿胀率和抑制率:肿胀率=(致炎后足趾体积-致炎前足趾体积)/致炎前足趾体积×100%, 抑制率= (模型组足趾肿胀率-给药组足趾肿胀率)/模型组足趾肿胀率×100%。
-
数据以(
$\bar x $ ±s)表示,单因素方差分析(One way ANOVA)比较各组差异,以P<0.05为差异具有统计学意义。 -
ABTS、FRAP和DPPH线性方程以及相关系数见表1。
表 1 ABTS、FRAP、DPPH的线性方程及相关系数
项目 方程 相关系数 ABTS Y=0.662 4X+0.715 3 r=0.999 5 FRAP Y=0.298 5X+0.060 r=0.999 4 DPPH Y=0.459 8X−0.023 8 r=0.998 9 从表1可以看出,ABTS、FRAP以及DPPH测定方法具有很好的线性。
-
ABTS法检测菊花水提物总抗氧化能力,结果显示,4种菊花的抗氧化能力存在明显差异,其中,黄山金丝皇菊抗氧化能力最强,为(0.481±0.052) mmol/g(总抗氧化能力用TEAC标准溶液表示),其次是黄山皇菊,为(0.402±0.043) mmol/g,然后依次是黄山贡菊(0.369±0.031)mmol/g和黄山黄菊(0.287±0.014)mmol/g。FRAP和DPPH检测以上四种菊花水提物抗氧化能力,结果与ABTS法类似,黄山金丝皇菊抗氧化能力最强,其次依次是黄山皇菊、黄山贡菊和黄山黄菊。综上,可以得出结论:黄山金丝皇菊水提物抗氧化能力最强,其次是黄山皇菊、黄山贡菊和黄山黄菊(表2)。
表 2 4种菊花抗氧化能力
名称/抗氧化
能力FRAP(mmol FeSO4/g) ABTS(mmol Trolox/g) DPPH(mmol Trolox/g) 黄山金丝皇菊 0.504±0.049 0.481±0.052 0.359±0.025 黄山皇菊 0.421±0.036 0.402±0.043 0.305±0.033 黄山贡菊 0.347±0.028## 0.369±0.031 0.277±0.041# 黄山黄菊 0.270±0.017###,** 0.287±0.014## 0.208±0.019##,* *P<0.05,**P<0.01,与黄山皇菊比较;#P<0.05,##P<0.01,###P<0.001,与黄山金丝皇菊比较。 -
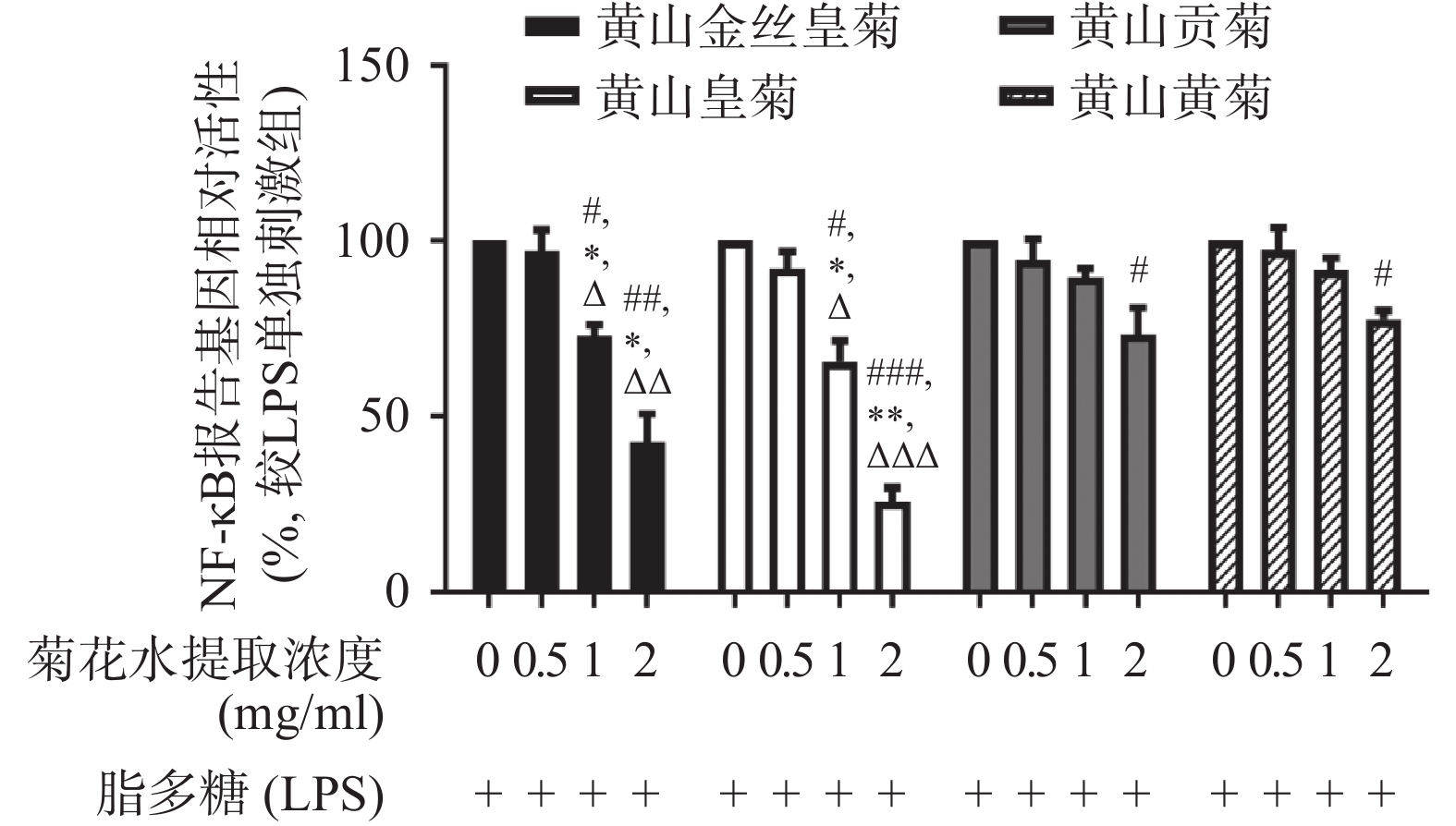
利用双报告基因的方法检测4种菊花水提物对Raw264.7细胞 NF-κB转录活性的影响,结果显示4种菊花水提物均能够一定程度的抑制LPS诱导的NF-κB的转录活性。相同作用浓度下,黄山皇菊NF-κB抑制活性最强,其次依次是黄山金丝皇菊、黄山贡菊和黄山黄菊。结果表明黄山皇菊抗炎作用最强,其次是黄山金丝皇菊、黄山贡菊和黄山黄菊(图1)。
-
为了进一步确认4种菊花提取物的抗炎活性,我们构建了角叉菜胶致大鼠足肿胀模型。大鼠足趾肿胀率和肿胀抑制率如表3所示,1 h时间点,给予菊花水提物处理的各组大鼠足趾肿胀均低于模型对照组,差异具有统计学意义(P<0.05)。2 h时间点,黄山皇菊和黄山金丝皇菊对足趾肿胀仍然具有抑制作用,而黄山贡菊和黄山黄菊抑制作用消失; 组间比较,黄山皇菊足趾肿胀抑制作用优于黄山贡菊和黄山黄菊(P<0.05)。4 h时间点,各组对足趾肿胀的抑制作用消失。综上结果表明,黄山皇菊的抗炎活性最好,其次是黄山金丝皇菊、黄山贡菊和黄山黄菊,该结论与NF-κB报告基因结果一致。
表 3 角叉菜胶致大鼠急性炎症模型结果(x±s,n=8)
组别 1 h 2 h 4 h 肿胀率(%) 抑制率(%) 肿胀率(%) 抑制率(%) 肿胀率(%) 抑制率(%) 模型组 41.6±
4.5− 52.5±
10.7− 45.1±
8.2− 黄山金丝皇菊 31.5±
5.9#24.3 42.3±
7.1#19.5 44.9±
8.80.5 黄山皇菊 28.9±
5.9##30.6 38.9±
7.8#,*,ΔΔ26.0 46.4±
10.0−2.8 黄山贡菊 31.8±
6.3#23.7 50.0±
11.74.8 46.4±
8.3−2.8 黄山黄菊 33.3±
6.2#20.1 51.0±
7.32.9 44.9±
8.80.6 *P<0.05,与黄山贡菊比较;#P<0.05,##P<0.01,与模型组比较;ΔΔP<0.01,与黄山黄菊比较。 -
本研究采用ABTS、FRAP和DPPH 这3种方法测定了4种黄山菊花水提物的抗氧化活性,并通过报告基因法和大鼠足肿胀模型评估了其抗炎活性。结果表明,4种菊花表现出不同的抗氧化活性和抗炎活性,其中黄山金丝皇菊的抗氧化能力最强,其次是黄山皇菊、黄山贡菊和黄山黄菊;而黄山皇菊的抗炎活性最强,其次是黄山金丝皇菊、黄山贡菊和黄山黄菊。菊花中黄酮类化合物具有清除自由基和超氧阴离子的能力,其抗氧化能力与黄酮类化合物含量有关;而菊花中的抗炎成分相对复杂,包含多糖、黄酮类化合物(如木犀草素、槲皮素及黄芩苷等)、有机酸(如绿原酸)和挥发油等,4种不同菊花在抗炎及抗氧化方面的活性差异可能与上述成分的差异有关[2,17-18]。尽管不同菊花品种在抗氧化和抗炎活性方面存在差异,但是均表现出良好的药用及食用价值,人们在日常生活中可以根据使用目的的不同进行选择,如考虑通过饮用菊花茶起到抗氧化目的,可以优先选用金丝皇菊,而如果考虑菊花抗炎作用,则可以考虑黄山皇菊。综之,4种黄山道地菊花提取物均表现出一定的抗氧化活性及抗炎活性,常饮之有保健功效。
Antioxidant and anti-inflammatory activities of four kinds of Huangshan chrysanthemum
-
摘要:
目的 探究4种黄山菊花品种水提物的抗氧化和抗炎活性。 方法 采用ABTS、FRAP和DPPH 3种方法测定黄山金丝皇菊、黄山皇菊、黄山贡菊和黄山黄菊4种菊花水提物的抗氧化活性,并通过NF-κB报告基因法和大鼠足肿胀模型评估其抗炎活性。 结果 ABTS、FRAP和DPPH结果显示,4种菊花水提物均具有抗氧化作用,其中黄山金丝皇菊作用最强,其次是黄山皇菊、黄山贡菊和黄山黄菊。NF-κB报告基因和大鼠足肿胀模型结果显示,4种菊花提取物均能够一定程度的抑制LPS诱导的NF-κB转录活性和缓解角叉菜胶致大鼠足趾肿胀程度,其中,黄山皇菊作用最为显著,其次是黄山金丝皇菊、黄山贡菊和黄山黄菊。 结论 4种黄山菊花品种的水提物均表现出一定的抗氧化及抗炎活性,其抗氧化活性由强到弱依次为黄山金丝皇菊、黄山皇菊、黄山贡菊和黄山黄菊,抗炎活性由强到弱依次为黄山皇菊、黄山金丝皇菊、黄山贡菊和黄山黄菊。 Abstract:Objective To investigate the antioxidant and anti-inflammatory activities of four kinds of Huangshan chrysanthemum. Methods ABTS, FRAP and DPPH were used to detect the antioxidant activities of Huangshan golden silk chrysanthemum, Huangshan chrysanthemum, Huangshan gongju, and Huangshan dendranthema. Their anti-inflammatory activities were evaluated by NF-κB reporter gene assay and rat foot swelling models. Results The outcomes of ABTS, FRAP and DPPH showed that the water extracts of four kinds of chrysanthemum all had certain antioxidant activities and the activities of Huangshan golden silk chrysanthemum were strongest, followed by Huangshan chrysanthemum , Huangshan gongju , and Huangshan dendranthema. Results of NF-κB reporter gene assay and rat foot swelling models showed that four extracts of chrysanthemum morifolium could inhibit the transcription of NF-κB induced by LPS and alleviate foot swelling of rat induced by carrageenan, with the strongest activity of Huangshan chrysanthemum, followed by Huangshan golden silk chrysanthemum, Huangshan gongju, and Huangshan dendranthema. Conclusion The antioxidant activities of Huangshan golden silk chrysanthemum were strongest, followed by Huangshan chrysanthemum, Huangshan gongju, and Huangshan dendranthema. The anti-inflammatory activities of Huangshan chrysanthemum were strongest, followed by Huangshan golden silk chrysanthemum, Huangshan gongju, and Huangshan dendranthema. -
Key words:
- antioxidation /
- anti-inflammation /
- chrysanthemum /
- feet swelling
-
脑血管疾病是仅次于心脑血管疾病和癌症的第三大病症,其中脑缺血是常见的脑血管疾病之一。脑缺血的患病率和死亡率仍处于上升趋势,严重影响人们的健康。目前,西医对于脑缺血的主要治疗方式是溶栓和取栓,但有严格的溶栓时间窗和较大的取栓风险,并且缺血后造成神经功能的损伤没有有效的药物治疗[1]。中医药在脑缺血的预防和治疗中具有潜在作用,以气虚为本、血瘀为标作为主要病因[2]。查阅近几年文献发现,益气活血化瘀方药在防治脑缺血中表现出多方面和整体调节的优势。
参麻颈复方是临床名老中医经验方,临床应用发现具有活血通络,益气养血,宁神安脑,健筋壮骨之效。该方由首乌藤、丹参、山茱萸(制)、天麻、当归、川芎等组成,临床应用广泛。首乌藤有养血安神、祛风通络之效[3],丹参有活血调经、祛瘀止痛、凉血消痈、除烦安神之效[4],当归有补血调经、活血散寒、消肿止痛生肌、润肠通便之效[5],川芎、陈皮的补气之效辅佐以上药物活血功效运行,而且川芎具有活血化瘀之效,是传统中医防治中风选择最多的配方之一[6]。本研究评估参麻颈复方对小鼠脑缺血损伤的改善作用,并进一步探讨其对骨髓来源内皮祖细胞干预发挥防治脑缺血损伤的机制,为中药方剂治疗脑缺血提供新的思路、寻找新的靶点。
1. 材料与方法
1.1 实验仪器及试剂
细胞培养箱(Thermo公司);倒置荧光显微镜(Leica 公司);Odssey红外荧光显像(Li-Cor公司);酶标仪(芬兰 Labsystens Dragon 公司);涡旋混合器(江苏天翎仪器有限公司);超净台(苏州净化设备有限公司);电子天平JA2003(上海天平仪器厂)。 参麻颈复方颗粒(岳阳医院自制制剂,批准文号:沪药制字Z05050324);尼莫地平片(天津市中央药业有限公司);BCA蛋白定量试剂盒(Thermo公司);2,3,5-氯化三苯基四氮唑(TTC,北京西浓科技有限公司);VEGF抗体(abcam公司);BDNF抗体(abcam公司);GAPDH内参抗体(abcam公司);Tubulin内参抗体(abcam公司);内皮细胞培养基(EGM-2 Single Quots,Lonza公司);波连蛋白(vitronection,BD公司)。
1.2 实验动物及分组
实验动物为SPF级C57BL/6雄性小鼠30只(上海吉辉实验动物饲养有限公司,许可证:SCXK(沪)2017-0012),体重为18-20 g,6-7周龄。适应性饲养1周后,将30只小鼠随机分为模型对照组(Control组)、参麻颈组(SMJ组)、尼莫地平组(NMDP组),10只/组。实验过程中对于实验小鼠的所有处理均符合伦理学规定。
1.3 实验方法
1.3.1 制备动物模型
采用电凝法制备局灶性脑缺血模型[7],用浓度为12%的水合氯醛对小鼠进行腹腔注射,剂量控制在350 mg/kg。小鼠麻醉后,仰卧位固定在手术台。借助显微镜,用显微镊沿颞肌纤维束的方向钝性分离肌肉,直到颧骨及麟骨暴露,显微镊夹住颧骨固定小鼠头部,用牙科钻重点打磨颧骨和麟骨的交叉部位,骨壳变薄并有裂缝时,停止打磨,用撬棒沿已暴露的动脉血管剥离骨片,直至小鼠左侧大脑中动脉与伴行的迷走神经分叉暴露;在显微镜下,找准纹状体外侧动脉近心端,用双极电凝器凝断左侧大脑中动脉后,将电凝器缓慢移出,显微镜下再次确认是否凝断。最后用显微镊将皮肤和肌肉归置原位,以便于缝合。小鼠完全苏醒后,观察精神状态,若出现站立不稳、左侧肢体偏瘫、提尾向一侧转圈等神经功能损害症状,即为造模成功。
参麻颈组在手术前通过灌胃方式给予6.88 g∙kg−1的参麻颈复颗粒;尼莫地平组给予2.16 mg/kg溶液灌胃;模型对照组给予等量蒸馏水灌胃,每日1次,共14 d。
1.3.2 神经行为学功能评分
术后第3 d,由观察者在不知分组情况下记录神经行为学表现,并采用参考文献[7]评分方法,如提尾悬空试验等[8],评估神经行为学功能评分。
提尾悬空试验:提起小鼠尾巴末端使其悬空,观察小鼠头部偏转。以小鼠身体的中线为基准,头部偏离中线超过10度记为成功的偏转,每只小鼠重复提尾悬空试验:提起小鼠尾巴末端使其悬空,观察小鼠头部偏转。以小鼠身体的中线为基准,头部偏离中线超过10度记为成功的偏转,每只小鼠测20次,并且每次测定的时间间隔不少于1 min,以保证小鼠得到充足的休息。小鼠的偏转率计算按以下公式:摆动频率(%)=(T−10)/10×100%。
T为实验小鼠头部向手术对侧偏转的次数。
平衡木试验:记录小鼠由木棍一端顺利通过平衡木80%长度所用的时间。在正式试验前对小鼠进行3次训练,正式试验时每只小鼠重复测定3次,对每只小鼠均间隔5 min后进行下一次实验。
1.3.3 脑组织TTC染色
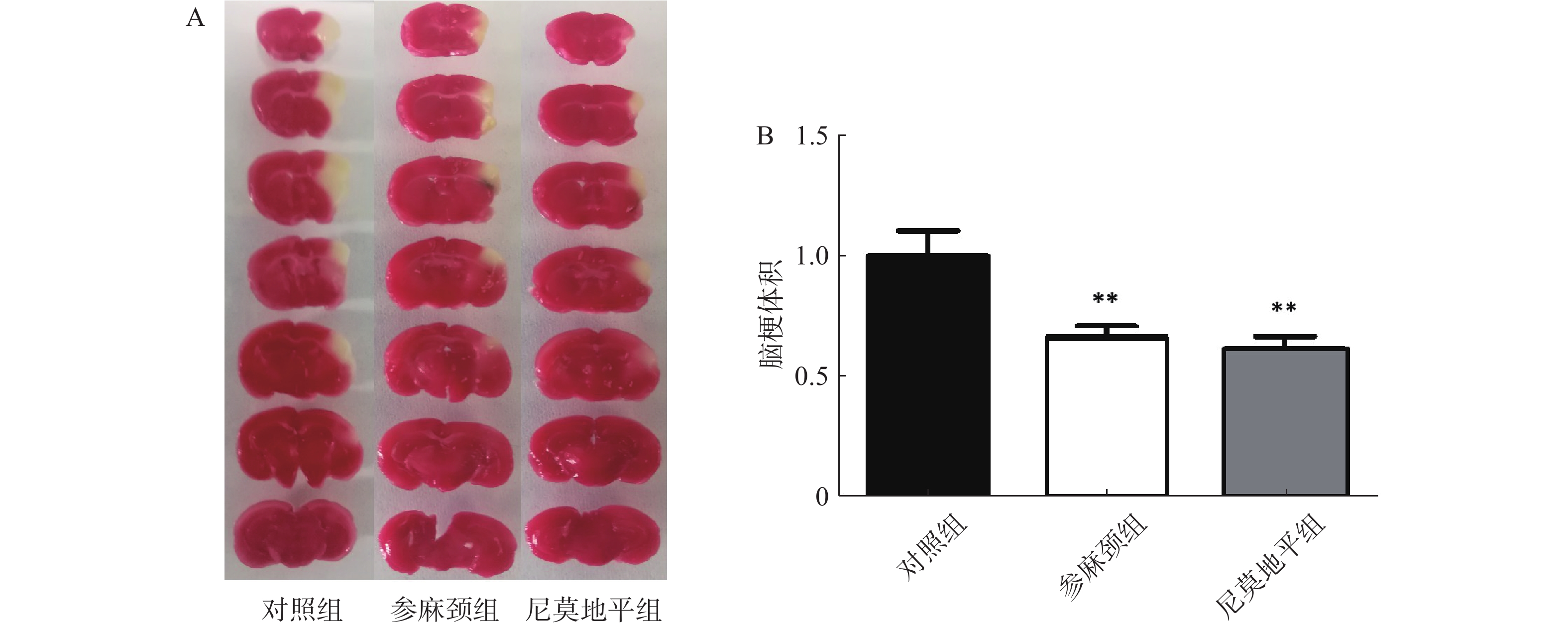
行为学评分测完后,小鼠脱颈处死,取脑组织,放1×PBS中清洗干净,将脑组织放在脑片模具中,共切7片,每片2 mm,放2%的TTC溶液中,并在37 ℃水浴锅中染色10 min,染色结束后放4%多聚甲醛固定6 h,按照脑片大小顺序排好拍照,脑片使用Image J统计软件测定小鼠的脑梗死体积。
1.3.4 细胞功能测定
取脑组织的同时,提取小鼠骨髓来源内皮祖细胞,培养至第7d时,收集和处理细胞,对细胞黏附、迁移及形成小管能力进行测定。
细胞黏附实验:用胰酶消化细胞,按照3×105个/ml细胞接种于预先包被人纤维粘连蛋白的96孔板中,在细胞培养箱中培养5 h后弃掉未黏附细胞,再用4%多聚甲醛固定,以Hochest 33258染料染色后于倒置显微镜下拍照。
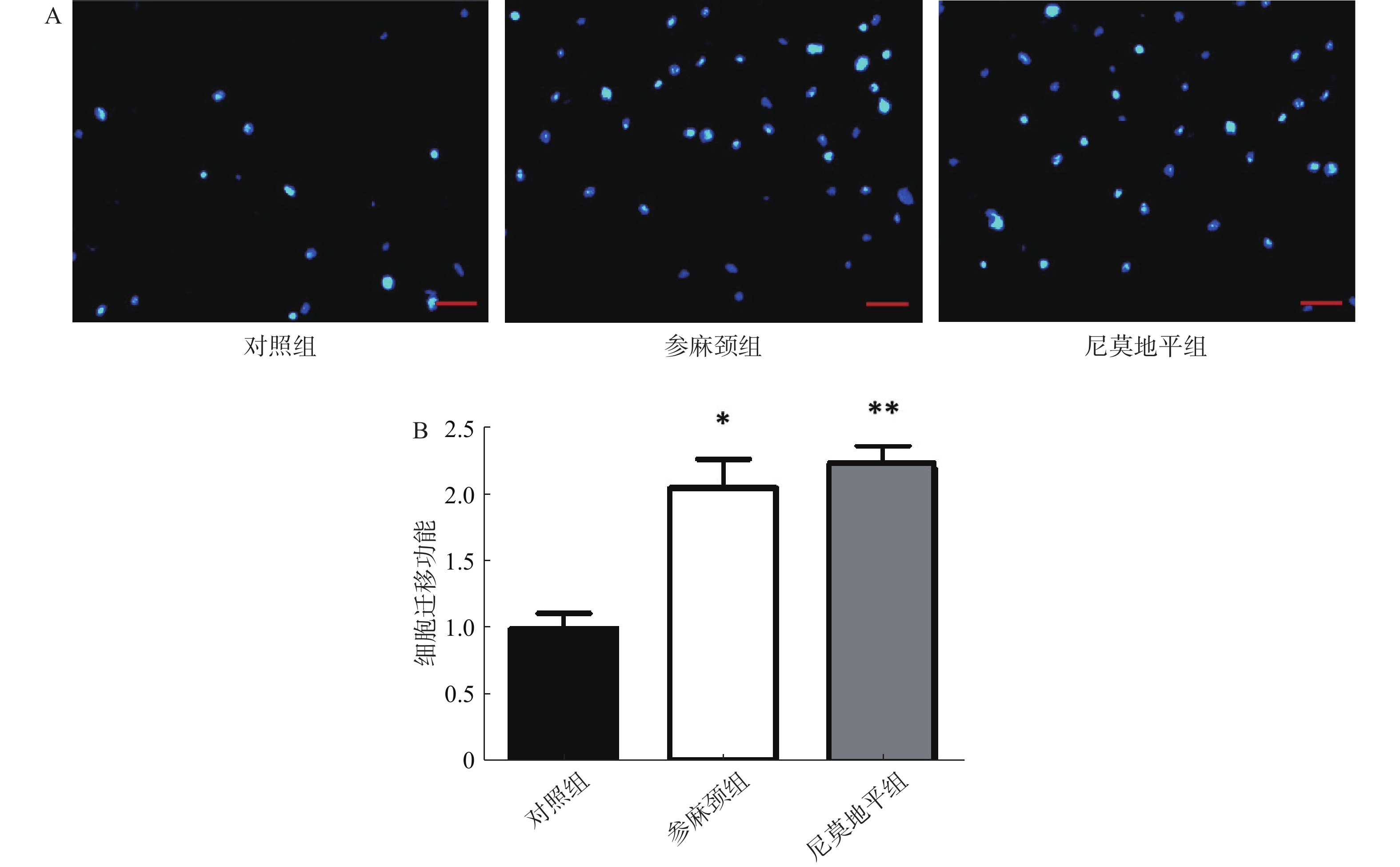
细胞迁移实验:调整细胞浓度3×105个/ml,Transwell小室置于24孔板,按分组下室加600 μl配好的下室溶液,细胞悬液接种于上室各100 μl,置培养箱内培养24 h,用PBS清洗2次,弃上清液,在2%多聚甲醛固定15 min。弃上清,PBS清洗2次,上室转移至含600 μl Hochest 33258染料的孔中,避光染色15 min。弃上清,PBS浸泡5 min,弃上清,光学显微镜下拍照,以Image J软件计算各组迁移细胞数。
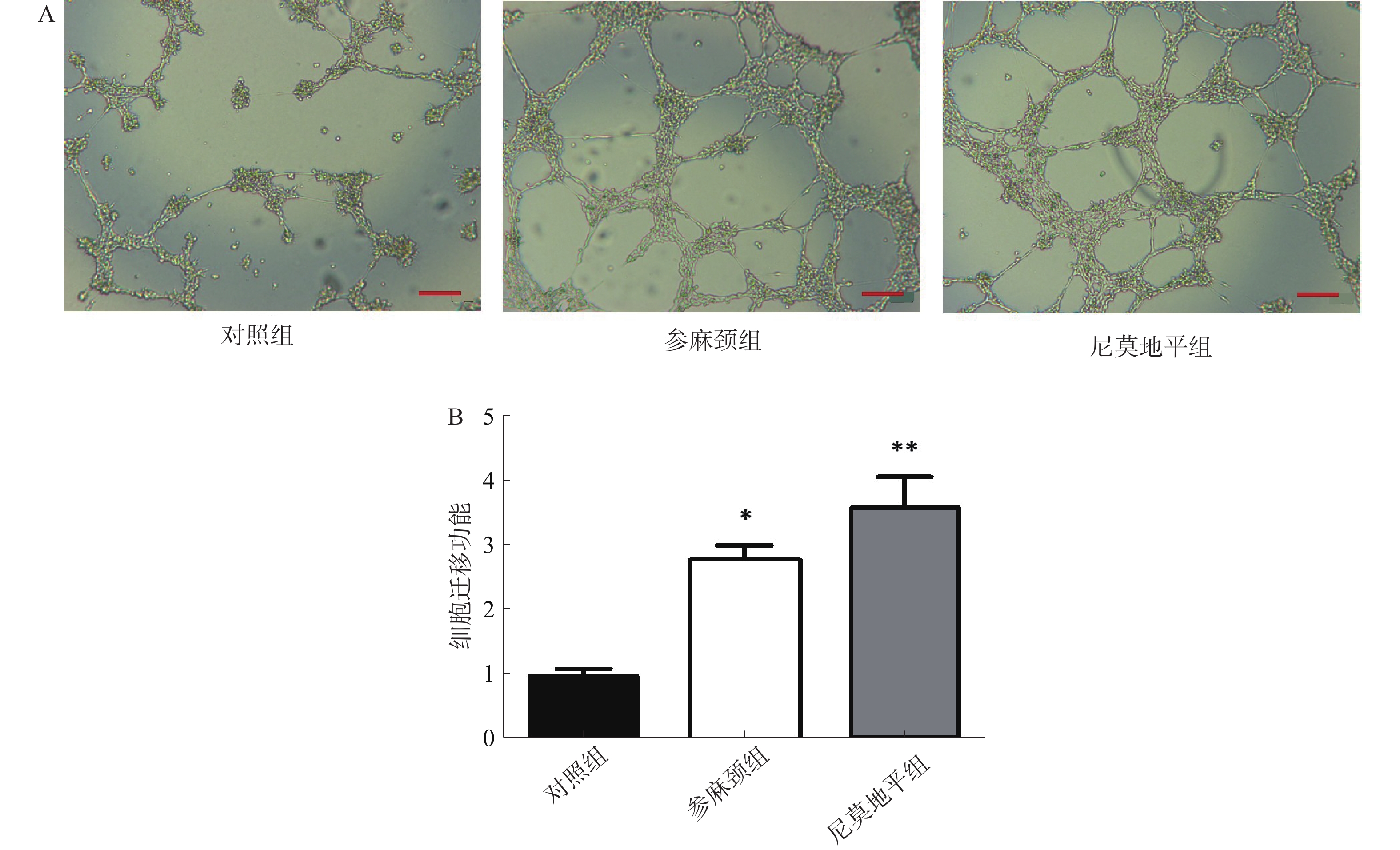
小管形成实验:调整各组细胞至3×105个/ml,每孔100 μl的细胞悬液加到铺有基质胶的孔中,最后将96孔板移至培养箱孵育6 h,在光学显微镜下拍照,以Image J软件计算各组小管形成数量。
1.3.5 Western blot检测
细胞样本同“1.3.4”项中相同来源,六孔板放在冰枕上,用预冷PBS润洗细胞两次,弃上清液;向板内加入60 μl已配置好的细胞裂解液,在冰枕上裂解15 min,收集细胞液转移至1.5 ml EP管中,使用高速离心机在12 000 r/min,4 ℃离心15 min,将离心后的上清液收集到新的离心管中并放到−80 ℃冰箱保存。应用紫外分光光度计测量蛋白浓度后,进行蛋白定量,95 ℃ 5 min蛋白灭活后,−20 ℃保存待用。SDS-PAGE凝胶电泳:初始电压调为50 V,电泳至Marker中红色条带分离出,将电压调为 120 V,直至Marker显示跑到胶的底部时停止电泳。转膜:恒流200 mA转膜,不同目的蛋白按其分子量大小设置转膜时间。封闭:用5%脱脂牛奶封闭1 h。封闭之后用1%牛奶配置的一抗4 ℃孵育过夜。第2天,用1%牛奶配制的二抗室温孵育1 h,NC膜放到Odyssey扫膜仪上进行扫描,保存扫描照片,使用Quantity One软件统计蛋白的灰度值。
1.4 统计学处理
使用Graphpad prism 5.0分析数据。实验数据均以(
$ \bar x $ ±s)表示,两组之间的差异采用非配对T检验进行分析,多组数据间的差异采用单因素方差分析(ANOVA),P<0.05表示差异具有统计学意义。2. 结果
2.1 各组小鼠神经功能学评分
小鼠造模成功后出现明显的神经功能障碍,表现为站立不稳、左前肢屈曲内收,肌张力下降。与对照组比较,尼莫地平组小鼠的神经功能有明显改(P<0.01);与对照组比较,参麻颈组小鼠的爬杆时间(P<0.05)和对侧偏转率(P<0.01)均有显著降低,表明小鼠给予参麻颈复方后,能有效保护缺血后神经功能的缺损(图1)。
2.2 各组小鼠脑梗体积变化
用TTC染色后结果显示:对照组小鼠术后脑组织出现明显的梗死灶。与对照组比较,给参麻颈组小鼠脑缺血后脑梗体积显著减少(P<0.01);给予尼莫地平的小鼠与参麻颈组相比,其脑梗体积虽有减少,但无统计学差异(图2)。 2.3 各组小鼠内皮祖细胞黏附功能比较
细胞黏附实验结果显示:对照组相比于另外两组,黏附细胞数目减少。预先给予参麻颈的小鼠,在发生脑缺血后,小鼠骨髓来源内皮祖细胞黏附于96孔板中细胞数目,明显高于对照组(P<0.01);给予尼莫地平组,其细胞数目也比对照组增多(P<0.01);而尼莫地平组和参麻颈组两组的差异无统计学意义(图3)。 2.4 各组小鼠内皮祖细胞迁移功能比较
迁移实验结果显示:与参麻颈组和尼莫地平组比较,模型对照组细胞迁移至Transwell板上室下面的数目可见减少。与对照组比较,给予参麻颈复颗粒后的脑缺血小鼠,其骨髓来源内皮祖细胞迁移数显著增加(P<0.05);给予尼莫地平的小鼠与对照组比较,其迁移细胞数目增加(P<0.01);参麻颈组和尼莫地平组,两组结果有差异但无统计意义(图4)。 2.5 各组小鼠内皮祖细胞形成小管能力比较
从图中可看出,对照组小鼠内皮祖细胞形成小管的数目减少。与对照组比较,参麻颈组内皮祖细胞形成小管数目有明显增加(P<0.05),尼莫地平组小管形成数目更为突出(P<0.01);尼莫地平组形成的小管状态也优于参麻颈组(图5)。
2.6 各组小鼠内皮祖细胞中相关蛋白的表达水平
Western blot检测结果显示:与对照组比较,参麻颈组(P<0.01)和尼莫地平组(P<0.01)小鼠内皮祖细胞内BDNF蛋白表达增加,而参麻颈组和尼莫地平组之间结果差异无统计学意义(图6)。
3. 讨论
缺血性中风是一种以动脉粥样硬化为基础的中枢系统不可逆损伤;它是由阻塞颈内动脉、椎动脉或者脑血管的血栓形成引起的,这一过程减少了血液供应,导致细胞代谢紊乱和衰老,并进一步导致血管内皮损伤[9-10]。脑缺血后导致严重的脑损伤,并造成神经功能障碍,包括偏瘫、肢体痉挛和认知障碍等,从而降低患者的生活质量[11]。目前,西医临床治疗存在局限性,使得该疾病的残疾率仍然很高,以及带来的社会经济负担也在继续增加。中医药博大精深,很多研究者一直都在致力于寻找改善脑缺血所致神经功能障碍的中医疗法。
中医典籍《伤寒杂病论》早就将活血化瘀中药或中药复方用于缺血性疾病的治疗。活血化瘀中药复方通过多靶点、多途径的作用方式发挥整体性作用。现代研究方法——代谢组学、基因组学、蛋白质组学等为中药复方作用机制的阐述提供强有力的支持。前期相关研究显示,在传统中药中,发现许多成分可以促进血管的生成,如丹参酮,川芎嗪,三七总皂苷等[12-14],这些是方剂中常用的中药,也是活血化瘀类草药的代表。而参麻颈复方中,大部分的中药具有活血化瘀作用,是否能够改善骨髓来源内皮祖细胞功能,又能否促进脑缺血损伤后的新血管的生成,需要进一步验证。
本研究中,参麻颈复方颗粒预处理后,小鼠脑缺血所致的神经行为学功能评分显著改善;TTC染色梗死体积也显著减少(P<0.01)。证明参麻颈复方颗粒对小鼠脑缺血损伤具有保护作用,可改善神经功能和减小缺血梗死体积。
越来越多的临床前研究表明[15],无论是缺血性脑卒中急性期还是慢性期,均会导致炎症和脑组织不可逆转的损伤。因此,为了减轻缺血组织的病理损伤,修复内皮功能障碍引起的血管损伤成为缺血性脑卒中治疗的主要方向。骨髓来源内皮祖细胞是内皮愈合和血管生成的关键效应因子。内皮祖细数量减少、内皮功能障碍与心血管事件风险增加息息相关[16],这与内皮祖细胞介导的血管修复受损致使血管疾病进展是一致的[17]。为了响应缺血信号和血管损伤,骨髓来源的内皮祖细胞被动员到循环中并募集到内皮损伤部位,从而形成新生血管,这也是一种自然的防御机制[18]。
第二部分实验研究了参麻颈复方颗粒对脑缺血损伤小鼠内皮祖细胞的保护作用。结果显示,小鼠脑缺血损伤后,来自骨髓的内皮祖细胞黏附在96孔板和迁移至Transwell板下室的数目有显著减少,给予参麻颈复方颗粒预处理后,黏附细胞数目(P<0.01)和迁移细胞数目(P<0.05)均有明显增加。另外,脑缺血损伤可影响血管新生的速度和质量,表现为内皮祖细胞形成小管的能力,包括形成小管的数量和小管长度。本研究的结果中,参麻颈复方颗粒显著增加脑缺血损伤小鼠的内皮祖细胞形成小管的数量和长度(P<0.05)。
神经营养因子是一组对神经系统的发育、生长、存活和分化至关重要的蛋白质[19]。脑源性神经营养因子(BDNF)是神经系统中含量最丰富、分布最广的神经营养因子。血管内皮细胞合成并分泌BDNF,并通过刺激其原肌球蛋白受体激酶B促进神经系统中的细胞分化、细胞生长、突触形成和神经发生[20-21]。重要的是,BDNF在缺血性和创伤性脑损伤后表现出许多神经保护特性[22]。BDNF通过促进新生血管、调节内皮一氧化氮生成和抑制凋亡来改善内皮细胞功能障碍[23]。
第三部分实验深入探讨了参麻颈复方颗粒保护小鼠脑缺血损伤的作用,结果显示,小鼠脑缺血后,大脑受到损伤,内皮祖细胞中BDNF蛋白表达显著降低,内皮祖细胞功能受损;参麻颈复方颗粒干预后,BDNF蛋白表达水平显著增加(P<0.01),细胞功能得以改善。这与二甲双胍上调人脐静脉内皮细胞(HUVEC)中BDNF的表达逆转高糖状态下的细胞损伤相同[23]。由于BDNF蛋白表达的增加,脑缺血小鼠的神经功能得到改善,脑梗死体积减小。
综上所述,参麻颈复方颗粒对小鼠脑缺血损伤有保护作用,这一作用可能与促进内皮祖细胞中脑源性神经因子BDNF蛋白表达,改善内皮祖细胞功能有关。我们这一研究为参麻颈复方颗粒在心血管疾病的治疗提供了新视角,并进一步验证了在心脑血管疾病治疗领域的应用,这可能减缓疾病的进展和改善预后。
-
表 1 ABTS、FRAP、DPPH的线性方程及相关系数
项目 方程 相关系数 ABTS Y=0.662 4X+0.715 3 r=0.999 5 FRAP Y=0.298 5X+0.060 r=0.999 4 DPPH Y=0.459 8X−0.023 8 r=0.998 9 表 2 4种菊花抗氧化能力
名称/抗氧化
能力FRAP(mmol FeSO4/g) ABTS(mmol Trolox/g) DPPH(mmol Trolox/g) 黄山金丝皇菊 0.504±0.049 0.481±0.052 0.359±0.025 黄山皇菊 0.421±0.036 0.402±0.043 0.305±0.033 黄山贡菊 0.347±0.028## 0.369±0.031 0.277±0.041# 黄山黄菊 0.270±0.017###,** 0.287±0.014## 0.208±0.019##,* *P<0.05,**P<0.01,与黄山皇菊比较;#P<0.05,##P<0.01,###P<0.001,与黄山金丝皇菊比较。 表 3 角叉菜胶致大鼠急性炎症模型结果(x±s,n=8)
组别 1 h 2 h 4 h 肿胀率(%) 抑制率(%) 肿胀率(%) 抑制率(%) 肿胀率(%) 抑制率(%) 模型组 41.6±
4.5− 52.5±
10.7− 45.1±
8.2− 黄山金丝皇菊 31.5±
5.9#24.3 42.3±
7.1#19.5 44.9±
8.80.5 黄山皇菊 28.9±
5.9##30.6 38.9±
7.8#,*,ΔΔ26.0 46.4±
10.0−2.8 黄山贡菊 31.8±
6.3#23.7 50.0±
11.74.8 46.4±
8.3−2.8 黄山黄菊 33.3±
6.2#20.1 51.0±
7.32.9 44.9±
8.80.6 *P<0.05,与黄山贡菊比较;#P<0.05,##P<0.01,与模型组比较;ΔΔP<0.01,与黄山黄菊比较。 -
[1] 国家药典委员会. 中华人民共和国药典[S]. 北京: 中国医药科技出版社, 2022, 323. [2] 王德胜, 黄艳梅, 石岩, 等. 菊花化学成分及药理作用研究进展[J]. 安徽农业科学, 2018, 46(23):9-11,17. doi: 10.3969/j.issn.0517-6611.2018.23.003 [3] 张健, 李友宾, 钱大玮, 等. 菊花化学成分及药理作用研究进展[J]. 时珍国医国药, 2006, 17(10):1941-1942. doi: 10.3969/j.issn.1008-0805.2006.10.107 [4] YANG W S, KIM D, YI Y S, et al. AKT-targeted anti-inflammatory activity of the methanol extract of Chrysanthemum indicum var albescens[J]. J Ethnopharmacol,2017,201:82-90. doi: 10.1016/j.jep.2017.03.001 [5] YANG L, AOBULIKASIMU·NUERBIYE, CHENG P, et al. Analysis of floral volatile components and antioxidant activity of different varieties of Chrysanthemum morifolium[J]. Molecules,2017,22(10):1790. doi: 10.3390/molecules22101790 [6] XUE G M, LI X Q, CHEN C, et al. Highly oxidized guaianolide sesquiterpenoids with potential anti-inflammatory activity from Chrysanthemum indicum[J]. J Nat Prod,2018,81(2):378-386. doi: 10.1021/acs.jnatprod.7b00867 [7] LI Y F, YANG P Y, LUO Y H, et al. Chemical compositions of chrysanthemum teas and their anti-inflammatory and antioxidant properties[J]. Food Chem,2019,286:8-16. doi: 10.1016/j.foodchem.2019.02.013 [8] MING K, CHEN Y, SHI J T, et al. Effects of Chrysanthemum indicum polysaccharide and its phosphate on anti-duck hepatitis a virus and alleviating hepatic injury[J]. Int J Biol Macromol,2017,102:813-821. doi: 10.1016/j.ijbiomac.2017.04.093 [9] ZHAO W H, ZENG C, JIA Q Q, et al. Effects of the Kunlun snow chrysanthemum polysaccharides on acetaminophen-induced oxidative stress, inflammation and apoptosis using animal model[J]. Pak J Pharm Sci,2018,31(3):985-990. [10] KIM K J, KIM Y H, YU H H, et al. Antibacterial activity and chemical composition of essential oil of Chrysanthemum boreale[J]. Planta Med,2003,69(3):274-277. doi: 10.1055/s-2003-38479 [11] KUANG C L, LV D, SHEN G H, et al. Chemical composition and antimicrobial activities of volatile oil extracted from Chrysanthemum morifolium Ramat[J]. J Food Sci Technol,2018,55(7):2786-2794. doi: 10.1007/s13197-018-3203-1 [12] LEE J S, KIM H J, LEE Y S. A new anti-HIV flavonoid glucuronide from Chrysanthemum morifolium[J]. Planta Med,2003,69(9):859-861. doi: 10.1055/s-2003-43207 [13] 宋雷, 绽春蕊, 杨世英, 等. 杭黄菊提取物的体外抗菌活性研究[J]. 天然产物研究与开发, 2015, 27:455-458. doi: 10.16333/j.1001-6880.2015.03.017 [14] 杨璐齐, 陈冠林, 俞憬, 等. 6种菊花抗氧化活性及总酚含量的研究[J]. 食品研究与开发, 2017, 38(18):6-10. [15] 白小军, 杨锋, 呼睿, 等. 消肿止痛膏对足肿胀模型大鼠足肿胀度的影响[J]. 陕西中药, 2017, 38(8):1144-1145. [16] 肖百全, 朱少璇, 杨威, 等. 角叉菜胶致大鼠足肿胀模型探讨及其机制研究[J]. 中国实用医药, 2008, 3(23):63-65. doi: 10.3969/j.issn.1673-7555.2008.23.037 [17] 张晓媛, 段立华, 赵丁. 菊花化学成分及药理作用的研究[J]. 时珍国医国药, 2008, 19(7):1702-1704. doi: 10.3969/j.issn.1008-0805.2008.07.075 [18] 瞿璐, 王涛, 董勇喆, 等. 菊花化学成分与药理作用的研究进展[J]. 药物评价研究, 2015, 1:98-104. -







 下载:
下载:

 下载:
下载:



