-
肥胖是因体内脂肪过度蓄积导致健康损害的一种机体状态。目前已证实与肥胖相关联的疾病多达21种,广泛涉及心血管、消化、呼吸、神经、肌肉骨骼等系统相关疾病甚至传染性疾病[1]。根据2023年3月世界肥胖联盟(WOF)公布的《2023世界肥胖地图》,预计到2035年,肥胖或超重(WHO标准BMI≥25 kg/m2)率将达到51%,引起的经济损失超过4万亿美元[2]。中国同样面临肥胖发病率逐年增高的严峻问题,根据最新报道,按照中国人的BMI分级(BMI≥24 kg/m2),我国目前已有34.8%的人超重,14.1%的人肥胖[3]。而我国上市的关于肥胖的治疗药物却屈指可数,自2007年脂肪酶抑制剂奥利司他获批以来,只有胰高血糖素样肽-1(GLP-1)受体激动剂利拉鲁肽和贝纳鲁肽于2023年7月获批超重(肥胖)适应证[4]。但这两类药物仍存在各自的弊端:奥利司他因严重脂肪泻导致部分患者不耐受,且因减肥效果有限而不被推荐用于合并并发症的肥胖治疗[5];利拉鲁肽和贝纳鲁肽减肥效果优异[6],但需注射给药且价格昂贵,近期还有报道称此类药物胃肠道不良反应远比其公布的要严重[7],并有可能增加肠梗阻风险,甚至使少数使用者产生自杀念头[8]。因此,研发可有效治疗肥胖且不良反应小的药物对治疗肥胖、减少并发症具有重要的意义。
研究人员前期发现,脂肪因子血清类粘蛋白(ORM)可作用于下丘脑瘦素受体,抑制摄食并调控能量平衡[9],是潜在的减重药物研发靶点(专利号:ZL201510230870.2)。但ORM为高度糖基化的大分子蛋白质,制备困难且需注射给药,限制了其药物开发前景。研究人员前期筛选到一个全新小分子化合物HMS-01,该化合物由大环内酯类抗菌药红霉素改造而来,为一种未上市的在研新药,可显著升高ORM并降低肥胖小鼠体质量,且具有可经消化道用药、无抗菌活性的特征,有望为药物治疗肥胖开辟新赛道。
根据创新药物临床前研究的国际国内指导原则[10-11],新药上市前需通过药效学和毒理学研究评估药物的有效性和安全性,其中,遗传毒性研究是毒理学研究的重要部分。遗传毒性是指化合物能直接或间接损伤生物体遗传物质,造成基因改变或突变,危及生物体及其后代健康。近年来,因具有致突变性而引起的药品召回事件时有发生[9]。本研究通过鼠伤寒沙门氏菌回复突变试验(Ames试验)对该化合物的遗传毒性进行实验探究,以期为创新药物的遗传安全性及其临床前毒理学评估提供支持。
-
受试样品:HMS-0(西安秦申嘉合药物研究有限公司,批号20190127,纯度98%)。阴性对照品:二甲基亚砜(DMSO,Sigma-aldrich,CAS:67-68-5)。阳性对照品:吖啶诱变剂ICR-191(Sigma-aldrich,CAS:17070-45-0)、2-硝基芴(Sigma-aldrich,CAS:607-57-8)、叠氮钠(Sigma-aldrich,CAS:26628-22-8)、甲基磺酸甲酯(Sigma-aldrich,CAS:66-27-3)、2-氨基蒽(Sigma-aldrich,CAS:613-13-8)。
-
营养肉汤(赛默飞,CM0067);磷酸盐缓冲液(生工生物);顶层琼脂培养基(Solarbio,货号:LA3080) ;底层培养基(Solarbio,货号:3090);S9混合液溶剂(按照180 ml试验用量配制):氯化钾(生工生物,CAS:7447-40-7)6.6 mmol、氯化镁(生工生物,CAS:7791-18-6)1.6 mmol、葡糖-6-磷酸(Sigma-aldrich,CAS:3671-99-6)1 mmol、辅酶Ⅱ(Sigma-aldrich,CAS:24292-60-2)0.8 mmol、0.2 mol/L磷酸盐缓冲液(20×PBS缓冲液,Solarbio,货号:P1032)120 ml、去离子水定容至180 ml;S9混合液: 代谢活化系统S9是经苯巴比妥/β-萘黄酮诱导的雄性SD大鼠肝匀浆上清液制备而成,购自Molecular Toxicology,使用前与S9溶剂按照1∶9(V/V)的比例配制。
-
全自动 Ames 实验仪(北京慧荣和科技有限公司,型号:HRH-AMES116);全自动菌落分析仪(杭州泽析生物科技有限公司,型号:DTS3);倒置显微镜[徕卡贸易(上海)有限公司,型号:Leica DMi8 M/C/A]。
-
此次试验所使用的组氨酸营养缺陷型(his−)鼠伤寒沙门氏菌TA97a、TA98、TA100、TA102和TA1535,购自Molecular Toxicology公司,符合实验要求。
-
根据毒理学研究的国际标准[12-13],设计制定Ames试验以检测受试药物HMS-01的遗传毒性。Ames试验亦称细菌回复突变实验,是利用伤寒沙门氏菌具有回复突变的特性,以鉴定受试物是否具有致突变性的一种试验方法。his−鼠伤寒沙门氏菌,因不能自主合成组氨酸而不能在缺乏组氨酸的培养基上生长,但在外界致突变因素的作用下可突变为能自主合成组氨酸的原养型沙门氏菌,从而能在无组氨酸的培养基上正常生长。因此,可通过观测其经受试物作用后,在无组氨酸培养基上的菌落生长情况来判定受试物是否具有致突变毒性。
试验结果要求应满足以下条件:①阴性对照组的回复突变菌落均数在历史阴性/溶媒对照范围内;②阳性对照组的回复突变菌落均数为其对应的阴性对照组的3倍以上;③污染平皿数不超过平皿总数的5%。
-
5种试验菌(TA97a、TA98、TA100、TA102、TA1535)应具备表1所示的特性,因此于实验前进行如下生物学特性鉴定 : his−鉴定、脂多糖屏障缺陷(rfa突变)鉴定、氨苄青霉素抗性(菌株R 因子缺失)鉴定、紫外线敏感性(ΔuvrB突变)鉴定、四环素(pAQ1)抗性的鉴定、自发回变菌落数(his+)测定 、对阳性诱变剂的回变敏感性测定,以确定试验菌株符合试验标准。
表 1 各试验菌株生物学特性
菌株名称 组氨酸
缺陷脂多糖
屏障缺损R因子
缺失ΔuvrB
突变抗四
环素自发回
落数TA97a + + + + − 90~180 TA98 + + + + − 30~50 TA100 + + + + − 120~200 TA102 + + + − + 240~320 TA1535 + + − + − 10~35 取鉴定合格试验菌分别接种于装有7 ml营养肉汤培养基的试管中,于(35±2) ℃、(120±25) r/min条件下在空气恒温震荡器中扩增培养16~18 h,使用酶标仪检测菌液光密度并估算活菌浓度,待浓度达1×109 个/ml以上时可用于试验。
-
设置6个HMS-01实验组,最高剂量为HMS-01 5 000 μg/皿,其下等比稀释设置5个剂量组分别为1 666.7、555.6、185.2、61.7、20.6 μg/皿。除此之外,另设置空白对照组及各菌对应的阳性对照组,分组情况见表2。
表 2 各试验菌对应的阳性诱变剂及剂量
代谢活化 菌株名称 阳性诱变剂 剂量(μg/皿) −S9 TA97a ICR-191 1 TA98 2-硝基芴 1 TA100 叠氮钠 2 TA102 甲基磺酸甲酯 1.3 TA1535 叠氮钠 2 +S9 TA97a 2-氨基蒽 3 TA98 2-氨基蒽 3 TA100 2-氨基蒽 3 TA102 2-氨基蒽 30 TA1535 2-氨基蒽 3 -
用全自动Ames实验仪进行试验,即2 ml融溶状态下的顶层琼脂培养基与下列物质混合:0.5 ml S9混合液或0.5 ml磷酸盐缓冲液、0.1 ml对应受试药品、0.1 ml扩增菌液,迅速混匀,室温静置,待平皿凝固后倒置于(37±1) ℃培养箱内培养48~72 h。各组共设置3个平行皿,重复试验1次。
-
培养结束后肉眼或显微镜下观察各皿的受试药品是否有析出以及背景菌斑的生长情况,并计数各平行皿的回变菌落数。每个组分别求均值,并将结果以(
$ \bar{x}\pm s $ )的方式列出,各组平行数表示为$ n $ 。根据中国食品药品检定研究院发布的《细菌回复突变试验技术指导原则(征求意见稿)》制定的结果判断标准,对于TA97a、TA98、TA100及TA102,其诱导的回复突变菌落均数大于各自阴性对照组的2倍,且具有浓度依赖性及可重现性,即可判定为阳性结果;对于TA1535,其诱导的回复突变菌落均数高出各自阴性对照组的3倍,且具有浓度依赖性及可重现性,结果可判定为阳性。受试药品在加S9或不加S9混合液的条件下,经上述5种试验菌株测定后,只要有1种试验菌株为阳性,即可认定该受试药品的细菌回复突变试验为致突变阳性,反之则判断为阴性。
-
受试药品HMS-01在有S9处理条件下的TA97a和TA1535菌株实验中,1 666.7和5 000 μg/皿浓度组有观察到镜下非干扰沉淀,其余所有处理条件均未观察到供试品沉淀,结果见表3。所有试验组均未观察到背景菌斑抑制现象。
表 3 HMS-01细菌回复突变试验结果(n=3)
代谢活化 组别 TA97a TA98 TA100 TA102 TA1535 背景菌斑 沉淀 背景菌斑 沉淀 背景菌斑 沉淀 背景菌斑 沉淀 背景菌斑 沉淀 +S9 阴性对照组 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 20.6 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 61.7 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 185.2 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 555.6 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 1 666.7 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 5 000.0 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 阳性对照组 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 −S9 阴性对照组 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 20.6 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 61.7 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 185.2 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 555.6 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 1 666.7 T0 P1 T0 P0 T0 P0 T0 P0 T0 P1 5 000.0 T0 P1 T0 P0 T0 P0 T0 P0 T0 P1 阳性对照组 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 注:T0.正常; P0.正常;P1.镜下非干扰性沉淀。 -
受试药品HMS-01在所有处理条件下的回复突变菌落平均数均小于各自阴性对照组的2倍,且无浓度依赖性升高,结果见表4。本次试验条件中,在有(或无)代谢活化条件时,受试品HMS-01对组氨酸营养缺陷型(his−)鼠伤寒沙门氏菌TA97a、TA98、TA100、TA102和TA1535均无潜在致突变性。
表 4 HMS-01细菌回复突变试验结果(n=3)
代谢活化 组别 回复突变菌落数 TA97a TA98 TA100 TA102 TA1535 +S9 阴性对照组 157.7±15.5 29.3±3.1 138.3±4.7 326.0±7.5 21.3±4.0 20.6 156.7±17.8 34.7±7.1 119.3±8.0 334.3±16.7 21.0±5.2 61.7 159.0±7.2 31.7±8.5 140.0±9.8 250.0±113.2 19.3±3.1 185.2 147.7±22.7 33.3±4.2 151.7±6.0 319.0±6.2 18.7±0.6 555.6 168.3±7.6 34.7±2.5 130.7±10.0 340.0±6.1 19.3±4.0 1 666.7 157.7±2.1 34.7±5.8 148.7±2.9 287.0±84.1 20.3±4.6 5 000 143.7±19.9 38.3±6.7 122.3±8.1 304.0±22.9 17.0±1.7 阳性对照组 704.0±30.2 122.7±10.1 646.7±46.0 1 758.7±86.3 574.7±9.2 −S9 阴性对照组 171.7±5.1 36.7±3.2 151.3±8.7 340.3±3.8 23.7±1.5 20.6 168.0±11.8 40.0±1.7 125.7±9.1 338.7±7.4 25.3±3.1 61.7 169.7±17.5 42.3±13.7 131.3±15.6 350.0±15.9 21.3±3.1 185.2 152.0±13.1 34.3±5.5 148.0±8.7 366.0±5.0 24.7±3.2 555.6 167.7±1.5 42.0±2.0 161.3±8.6 351.0±24.2 22.7±6.5 1 666.7 163.0±3.6 45.3±3.2 156.0±3.6 376.7±25.7 22.3±3.1 5 000 164.7±22.9 40.3±3.1 153.3±6.7 365.0±26.0 17.3±3.8 阳性对照组 1 384.0±4.0 1 264.0±17.4 504.0±38.6 1 365.3±48.4 188.0±32.7 -
遗传毒性因其对生物体及其后代影响巨大,一直是新药临床前毒理学评价的重要组成部分。细菌回复突变试验由美国加利福尼亚大学B·N·Ames教授于1975年建立并经后来者的不断发展完善,也称为Ames试验,现今已成为全球基因毒性测试中的最为公认的方法之一,通常作为体外毒理学测试的第1步,被广泛应用于药物致突变性的初筛检验。该试验以his−的沙门氏菌为指示生物,试验中包含了加与不加代谢活化系统,通过该菌特定的生物效应能检测基因突变,对受试物的遗传毒性进行分析。本研究利用细菌回复突变试验对受试药物HMS-01遗传毒性进行评价,结果显示,HMS-01在有(或无)代谢活化条件下,均无致突变性,未发现其具有遗传毒性。该结果将为HMS-01的后续新药研发提供有力支撑。
Genotoxicity evaluation of HMS-01
-
摘要:
目的 检测HMS-01的遗传毒性,并对其进行临床前安全评价研究,为后续该药物进入临床试验提供支持。 方法 采用鼠伤寒沙门氏菌进行细菌回复突变试验(Ames试验)评价HMS-01的遗传毒性。 结果 HMS-01在20.6、61.7、185.2、555.6、1 666.7、5 000 μg/皿的6个剂量下,无论有无代谢活化条件,对鼠伤寒沙门氏菌均无致突变性。 结论 在本实验剂量范围内,HMS-01未见致突变性。 -
关键词:
- HMS-01 /
- 细菌回复突变试验Ames /
- 致突变性 /
- 遗传毒性
Abstract:Objective To provide a toxicological basis for HMS-01 in future clinical trials, through genotoxicity testing of safety evaluation. Methods The genotoxicity of HMS-01 was evaluated by Bacterial Reverse Mutation Assay (Ames test) with Salmonella typhimurium. Results HMS-01 was non-mutagenic against Salmonella typhimurium at six doses of 20.6, 61.7, 185.2, 555.6, 1666.7, and 5000 μg/dish with (or without) a metabolic activation system. Conclusion HMS-01 was not found to be mutagenic in the dose range of this experiment. -
Key words:
- HMS-01 /
- bacterial reverse mutation assay /
- mutagenicity /
- genetic toxicity
-
0. 前言
肥胖是因体内脂肪过度蓄积导致健康损害的一种机体状态。目前已证实与肥胖相关联的疾病多达21种,广泛涉及心血管、消化、呼吸、神经、肌肉骨骼等系统相关疾病甚至传染性疾病[1]。根据2023年3月世界肥胖联盟(WOF)公布的《2023世界肥胖地图》,预计到2035年,肥胖或超重(WHO标准BMI≥25 kg/m2)率将达到51%,引起的经济损失超过4万亿美元[2]。中国同样面临肥胖发病率逐年增高的严峻问题,根据最新报道,按照中国人的BMI分级(BMI≥24 kg/m2),我国目前已有34.8%的人超重,14.1%的人肥胖[3]。而我国上市的关于肥胖的治疗药物却屈指可数,自2007年脂肪酶抑制剂奥利司他获批以来,只有胰高血糖素样肽-1(GLP-1)受体激动剂利拉鲁肽和贝纳鲁肽于2023年7月获批超重(肥胖)适应证[4]。但这两类药物仍存在各自的弊端:奥利司他因严重脂肪泻导致部分患者不耐受,且因减肥效果有限而不被推荐用于合并并发症的肥胖治疗[5];利拉鲁肽和贝纳鲁肽减肥效果优异[6],但需注射给药且价格昂贵,近期还有报道称此类药物胃肠道不良反应远比其公布的要严重[7],并有可能增加肠梗阻风险,甚至使少数使用者产生自杀念头[8]。因此,研发可有效治疗肥胖且不良反应小的药物对治疗肥胖、减少并发症具有重要的意义。
研究人员前期发现,脂肪因子血清类粘蛋白(ORM)可作用于下丘脑瘦素受体,抑制摄食并调控能量平衡[9],是潜在的减重药物研发靶点(专利号:ZL201510230870.2)。但ORM为高度糖基化的大分子蛋白质,制备困难且需注射给药,限制了其药物开发前景。研究人员前期筛选到一个全新小分子化合物HMS-01,该化合物由大环内酯类抗菌药红霉素改造而来,为一种未上市的在研新药,可显著升高ORM并降低肥胖小鼠体质量,且具有可经消化道用药、无抗菌活性的特征,有望为药物治疗肥胖开辟新赛道。
根据创新药物临床前研究的国际国内指导原则[10-11],新药上市前需通过药效学和毒理学研究评估药物的有效性和安全性,其中,遗传毒性研究是毒理学研究的重要部分。遗传毒性是指化合物能直接或间接损伤生物体遗传物质,造成基因改变或突变,危及生物体及其后代健康。近年来,因具有致突变性而引起的药品召回事件时有发生[9]。本研究通过鼠伤寒沙门氏菌回复突变试验(Ames试验)对该化合物的遗传毒性进行实验探究,以期为创新药物的遗传安全性及其临床前毒理学评估提供支持。
1. 实验材料
1.1 受试样品及对照品
受试样品:HMS-0(西安秦申嘉合药物研究有限公司,批号20190127,纯度98%)。阴性对照品:二甲基亚砜(DMSO,Sigma-aldrich,CAS:67-68-5)。阳性对照品:吖啶诱变剂ICR-191(Sigma-aldrich,CAS:17070-45-0)、2-硝基芴(Sigma-aldrich,CAS:607-57-8)、叠氮钠(Sigma-aldrich,CAS:26628-22-8)、甲基磺酸甲酯(Sigma-aldrich,CAS:66-27-3)、2-氨基蒽(Sigma-aldrich,CAS:613-13-8)。
1.2 主要试剂及配制方法
营养肉汤(赛默飞,CM0067);磷酸盐缓冲液(生工生物);顶层琼脂培养基(Solarbio,货号:LA3080) ;底层培养基(Solarbio,货号:3090);S9混合液溶剂(按照180 ml试验用量配制):氯化钾(生工生物,CAS:7447-40-7)6.6 mmol、氯化镁(生工生物,CAS:7791-18-6)1.6 mmol、葡糖-6-磷酸(Sigma-aldrich,CAS:3671-99-6)1 mmol、辅酶Ⅱ(Sigma-aldrich,CAS:24292-60-2)0.8 mmol、0.2 mol/L磷酸盐缓冲液(20×PBS缓冲液,Solarbio,货号:P1032)120 ml、去离子水定容至180 ml;S9混合液: 代谢活化系统S9是经苯巴比妥/β-萘黄酮诱导的雄性SD大鼠肝匀浆上清液制备而成,购自Molecular Toxicology,使用前与S9溶剂按照1∶9(V/V)的比例配制。
1.3 主要仪器设备
全自动 Ames 实验仪(北京慧荣和科技有限公司,型号:HRH-AMES116);全自动菌落分析仪(杭州泽析生物科技有限公司,型号:DTS3);倒置显微镜[徕卡贸易(上海)有限公司,型号:Leica DMi8 M/C/A]。
1.4 试验菌株
此次试验所使用的组氨酸营养缺陷型(his−)鼠伤寒沙门氏菌TA97a、TA98、TA100、TA102和TA1535,购自Molecular Toxicology公司,符合实验要求。
2. 方法
根据毒理学研究的国际标准[12-13],设计制定Ames试验以检测受试药物HMS-01的遗传毒性。Ames试验亦称细菌回复突变实验,是利用伤寒沙门氏菌具有回复突变的特性,以鉴定受试物是否具有致突变性的一种试验方法。his−鼠伤寒沙门氏菌,因不能自主合成组氨酸而不能在缺乏组氨酸的培养基上生长,但在外界致突变因素的作用下可突变为能自主合成组氨酸的原养型沙门氏菌,从而能在无组氨酸的培养基上正常生长。因此,可通过观测其经受试物作用后,在无组氨酸培养基上的菌落生长情况来判定受试物是否具有致突变毒性。
试验结果要求应满足以下条件:①阴性对照组的回复突变菌落均数在历史阴性/溶媒对照范围内;②阳性对照组的回复突变菌落均数为其对应的阴性对照组的3倍以上;③污染平皿数不超过平皿总数的5%。
2.1 试验菌鉴定及扩增培养
5种试验菌(TA97a、TA98、TA100、TA102、TA1535)应具备表1所示的特性,因此于实验前进行如下生物学特性鉴定 : his−鉴定、脂多糖屏障缺陷(rfa突变)鉴定、氨苄青霉素抗性(菌株R 因子缺失)鉴定、紫外线敏感性(ΔuvrB突变)鉴定、四环素(pAQ1)抗性的鉴定、自发回变菌落数(his+)测定 、对阳性诱变剂的回变敏感性测定,以确定试验菌株符合试验标准。
表 1 各试验菌株生物学特性菌株名称 组氨酸
缺陷脂多糖
屏障缺损R因子
缺失ΔuvrB
突变抗四
环素自发回
落数TA97a + + + + − 90~180 TA98 + + + + − 30~50 TA100 + + + + − 120~200 TA102 + + + − + 240~320 TA1535 + + − + − 10~35 取鉴定合格试验菌分别接种于装有7 ml营养肉汤培养基的试管中,于(35±2) ℃、(120±25) r/min条件下在空气恒温震荡器中扩增培养16~18 h,使用酶标仪检测菌液光密度并估算活菌浓度,待浓度达1×109 个/ml以上时可用于试验。
2.2 试验分组
设置6个HMS-01实验组,最高剂量为HMS-01 5 000 μg/皿,其下等比稀释设置5个剂量组分别为1 666.7、555.6、185.2、61.7、20.6 μg/皿。除此之外,另设置空白对照组及各菌对应的阳性对照组,分组情况见表2。
表 2 各试验菌对应的阳性诱变剂及剂量代谢活化 菌株名称 阳性诱变剂 剂量(μg/皿) −S9 TA97a ICR-191 1 TA98 2-硝基芴 1 TA100 叠氮钠 2 TA102 甲基磺酸甲酯 1.3 TA1535 叠氮钠 2 +S9 TA97a 2-氨基蒽 3 TA98 2-氨基蒽 3 TA100 2-氨基蒽 3 TA102 2-氨基蒽 30 TA1535 2-氨基蒽 3 2.3 平板渗入法
用全自动Ames实验仪进行试验,即2 ml融溶状态下的顶层琼脂培养基与下列物质混合:0.5 ml S9混合液或0.5 ml磷酸盐缓冲液、0.1 ml对应受试药品、0.1 ml扩增菌液,迅速混匀,室温静置,待平皿凝固后倒置于(37±1) ℃培养箱内培养48~72 h。各组共设置3个平行皿,重复试验1次。
2.4 试验结果观察及判定
培养结束后肉眼或显微镜下观察各皿的受试药品是否有析出以及背景菌斑的生长情况,并计数各平行皿的回变菌落数。每个组分别求均值,并将结果以(
$ \bar{x}\pm s $ )的方式列出,各组平行数表示为$ n $ 。根据中国食品药品检定研究院发布的《细菌回复突变试验技术指导原则(征求意见稿)》制定的结果判断标准,对于TA97a、TA98、TA100及TA102,其诱导的回复突变菌落均数大于各自阴性对照组的2倍,且具有浓度依赖性及可重现性,即可判定为阳性结果;对于TA1535,其诱导的回复突变菌落均数高出各自阴性对照组的3倍,且具有浓度依赖性及可重现性,结果可判定为阳性。受试药品在加S9或不加S9混合液的条件下,经上述5种试验菌株测定后,只要有1种试验菌株为阳性,即可认定该受试药品的细菌回复突变试验为致突变阳性,反之则判断为阴性。
3. 结果
3.1 受试样品析出及背景菌斑生长情况
受试药品HMS-01在有S9处理条件下的TA97a和TA1535菌株实验中,1 666.7和5 000 μg/皿浓度组有观察到镜下非干扰沉淀,其余所有处理条件均未观察到供试品沉淀,结果见表3。所有试验组均未观察到背景菌斑抑制现象。
表 3 HMS-01细菌回复突变试验结果(n=3)代谢活化 组别 TA97a TA98 TA100 TA102 TA1535 背景菌斑 沉淀 背景菌斑 沉淀 背景菌斑 沉淀 背景菌斑 沉淀 背景菌斑 沉淀 +S9 阴性对照组 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 20.6 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 61.7 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 185.2 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 555.6 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 1 666.7 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 5 000.0 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 阳性对照组 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 −S9 阴性对照组 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 20.6 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 61.7 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 185.2 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 555.6 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 1 666.7 T0 P1 T0 P0 T0 P0 T0 P0 T0 P1 5 000.0 T0 P1 T0 P0 T0 P0 T0 P0 T0 P1 阳性对照组 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 注:T0.正常; P0.正常;P1.镜下非干扰性沉淀。 3.2 回复突变菌落数
受试药品HMS-01在所有处理条件下的回复突变菌落平均数均小于各自阴性对照组的2倍,且无浓度依赖性升高,结果见表4。本次试验条件中,在有(或无)代谢活化条件时,受试品HMS-01对组氨酸营养缺陷型(his−)鼠伤寒沙门氏菌TA97a、TA98、TA100、TA102和TA1535均无潜在致突变性。
表 4 HMS-01细菌回复突变试验结果(n=3)代谢活化 组别 回复突变菌落数 TA97a TA98 TA100 TA102 TA1535 +S9 阴性对照组 157.7±15.5 29.3±3.1 138.3±4.7 326.0±7.5 21.3±4.0 20.6 156.7±17.8 34.7±7.1 119.3±8.0 334.3±16.7 21.0±5.2 61.7 159.0±7.2 31.7±8.5 140.0±9.8 250.0±113.2 19.3±3.1 185.2 147.7±22.7 33.3±4.2 151.7±6.0 319.0±6.2 18.7±0.6 555.6 168.3±7.6 34.7±2.5 130.7±10.0 340.0±6.1 19.3±4.0 1 666.7 157.7±2.1 34.7±5.8 148.7±2.9 287.0±84.1 20.3±4.6 5 000 143.7±19.9 38.3±6.7 122.3±8.1 304.0±22.9 17.0±1.7 阳性对照组 704.0±30.2 122.7±10.1 646.7±46.0 1 758.7±86.3 574.7±9.2 −S9 阴性对照组 171.7±5.1 36.7±3.2 151.3±8.7 340.3±3.8 23.7±1.5 20.6 168.0±11.8 40.0±1.7 125.7±9.1 338.7±7.4 25.3±3.1 61.7 169.7±17.5 42.3±13.7 131.3±15.6 350.0±15.9 21.3±3.1 185.2 152.0±13.1 34.3±5.5 148.0±8.7 366.0±5.0 24.7±3.2 555.6 167.7±1.5 42.0±2.0 161.3±8.6 351.0±24.2 22.7±6.5 1 666.7 163.0±3.6 45.3±3.2 156.0±3.6 376.7±25.7 22.3±3.1 5 000 164.7±22.9 40.3±3.1 153.3±6.7 365.0±26.0 17.3±3.8 阳性对照组 1 384.0±4.0 1 264.0±17.4 504.0±38.6 1 365.3±48.4 188.0±32.7 4. 讨论
遗传毒性因其对生物体及其后代影响巨大,一直是新药临床前毒理学评价的重要组成部分。细菌回复突变试验由美国加利福尼亚大学B·N·Ames教授于1975年建立并经后来者的不断发展完善,也称为Ames试验,现今已成为全球基因毒性测试中的最为公认的方法之一,通常作为体外毒理学测试的第1步,被广泛应用于药物致突变性的初筛检验。该试验以his−的沙门氏菌为指示生物,试验中包含了加与不加代谢活化系统,通过该菌特定的生物效应能检测基因突变,对受试物的遗传毒性进行分析。本研究利用细菌回复突变试验对受试药物HMS-01遗传毒性进行评价,结果显示,HMS-01在有(或无)代谢活化条件下,均无致突变性,未发现其具有遗传毒性。该结果将为HMS-01的后续新药研发提供有力支撑。
-
表 1 各试验菌株生物学特性
菌株名称 组氨酸
缺陷脂多糖
屏障缺损R因子
缺失ΔuvrB
突变抗四
环素自发回
落数TA97a + + + + − 90~180 TA98 + + + + − 30~50 TA100 + + + + − 120~200 TA102 + + + − + 240~320 TA1535 + + − + − 10~35 表 2 各试验菌对应的阳性诱变剂及剂量
代谢活化 菌株名称 阳性诱变剂 剂量(μg/皿) −S9 TA97a ICR-191 1 TA98 2-硝基芴 1 TA100 叠氮钠 2 TA102 甲基磺酸甲酯 1.3 TA1535 叠氮钠 2 +S9 TA97a 2-氨基蒽 3 TA98 2-氨基蒽 3 TA100 2-氨基蒽 3 TA102 2-氨基蒽 30 TA1535 2-氨基蒽 3 表 3 HMS-01细菌回复突变试验结果(n=3)
代谢活化 组别 TA97a TA98 TA100 TA102 TA1535 背景菌斑 沉淀 背景菌斑 沉淀 背景菌斑 沉淀 背景菌斑 沉淀 背景菌斑 沉淀 +S9 阴性对照组 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 20.6 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 61.7 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 185.2 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 555.6 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 1 666.7 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 5 000.0 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 阳性对照组 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 −S9 阴性对照组 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 20.6 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 61.7 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 185.2 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 555.6 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 1 666.7 T0 P1 T0 P0 T0 P0 T0 P0 T0 P1 5 000.0 T0 P1 T0 P0 T0 P0 T0 P0 T0 P1 阳性对照组 T0 P0 T0 P0 T0 P0 T0 P0 T0 P0 注:T0.正常; P0.正常;P1.镜下非干扰性沉淀。 表 4 HMS-01细菌回复突变试验结果(n=3)
代谢活化 组别 回复突变菌落数 TA97a TA98 TA100 TA102 TA1535 +S9 阴性对照组 157.7±15.5 29.3±3.1 138.3±4.7 326.0±7.5 21.3±4.0 20.6 156.7±17.8 34.7±7.1 119.3±8.0 334.3±16.7 21.0±5.2 61.7 159.0±7.2 31.7±8.5 140.0±9.8 250.0±113.2 19.3±3.1 185.2 147.7±22.7 33.3±4.2 151.7±6.0 319.0±6.2 18.7±0.6 555.6 168.3±7.6 34.7±2.5 130.7±10.0 340.0±6.1 19.3±4.0 1 666.7 157.7±2.1 34.7±5.8 148.7±2.9 287.0±84.1 20.3±4.6 5 000 143.7±19.9 38.3±6.7 122.3±8.1 304.0±22.9 17.0±1.7 阳性对照组 704.0±30.2 122.7±10.1 646.7±46.0 1 758.7±86.3 574.7±9.2 −S9 阴性对照组 171.7±5.1 36.7±3.2 151.3±8.7 340.3±3.8 23.7±1.5 20.6 168.0±11.8 40.0±1.7 125.7±9.1 338.7±7.4 25.3±3.1 61.7 169.7±17.5 42.3±13.7 131.3±15.6 350.0±15.9 21.3±3.1 185.2 152.0±13.1 34.3±5.5 148.0±8.7 366.0±5.0 24.7±3.2 555.6 167.7±1.5 42.0±2.0 161.3±8.6 351.0±24.2 22.7±6.5 1 666.7 163.0±3.6 45.3±3.2 156.0±3.6 376.7±25.7 22.3±3.1 5 000 164.7±22.9 40.3±3.1 153.3±6.7 365.0±26.0 17.3±3.8 阳性对照组 1 384.0±4.0 1 264.0±17.4 504.0±38.6 1 365.3±48.4 188.0±32.7 -
[1] KIVIMÄKI M, STRANDBERG T, PENTTI J, et al. Body-mass index and risk of obesity-related complex multimorbidity: an observational multicohort study[J]. Lancet Diabetes Endocrinol, 2022, 10(4):253-263. doi: 10.1016/S2213-8587(22)00033-X [2] World Obesity Federation, World Obesity Atlas 2023[EB/OL]. (2023-03) [2023-08]. https://data.worldobesity.org/publications/?cat=19. [3] CHEN K, SHEN Z W, GU W J, et al. Prevalence of obesity and associated complications in China: a cross-sectional, real-world study in 15.8 million adults[J]. Diabetes Obes Metab, 2023, 25(11):3390-3399. doi: 10.1111/dom.15238 [4] 国家药品监督管理局, 2023年07月04日药品批准证明文件送达信息发布[EB/OL]. (2023/07/04) [2023-08]. https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20230704155106142.html. [5] GRUNVALD E, SHAH R, HERNAEZ R, et al. AGA clinical practice guideline on pharmacological interventions for adults with obesity[J]. Gastroenterology, 2022, 163(5):1198-1225. doi: 10.1053/j.gastro.2022.08.045 [6] SHI Q Y, WANG Y, HAO Q K, et al. Pharmacotherapy for adults with overweight and obesity: a systematic review and network meta-analysis of randomised controlled trials[J]. Lancet, 2022, 399(10321):259-269. doi: 10.1016/S0140-6736(21)01640-8 [7] BULIK C M, HARDAWAY J A. Turning the tide on obesity?[J]. Science, 2023, 381(6657):463. doi: 10.1126/science.adj9953 [8] PRILLAMAN M. Four key questions on the new wave of anti-obesity drugs[J]. Nature, 2023, 620(7972):28-30. doi: 10.1038/d41586-023-02445-4 [9] SUN Y, YANG Y L, QIN Z, et al. The acute-phase protein orosomucoid regulates food intake and energy homeostasis via leptin receptor signaling pathway[J]. Diabetes, 2016, 65(6):1630-1641. doi: 10.2337/db15-1193 [10] European Medicines Agency, ICH guideline M3(R2) on non-clinical safety studies for the conduct of human clinical trials and marketing authorisation for pharmaceuticals[S/OL]. 2013, https://www.ema.europa.eu/en/ich-m3-r2-non-clinical-safety-studies-conduct-human-clinical-trials-pharmaceuticals-scientific#current-effective-version-section. [11] 食品药品监管总局, 药物遗传毒性研究技术指导原则[EB/OL]. (2018.03.15) [2023-08]. https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypqtggtg/20180315160901208.html. [12] FAQI A S. Introduction[M]. A Comprehensive Guide to Toxicology in Nonclinical Drug Development. Amsterdam: Elsevier, 2017: 1-4. [13] PROUDLOCK R. Genetic Toxicology testing A laboratory manual [M]. Amsterdam: Elsevier, 2013. -





 下载:
下载:
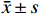
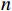
 下载:
下载: 

