-
《药品生产质量管理规范》(2010年版)第250条描述偏差为“任何偏离生产工艺、物料平衡限度、质量标准、检验方法、操作规程等的情况”[1]。人用药品注册协调会(ICH)明确偏差是指偏离已批准的程序(指导文件)或标准的任何情况[2-3]。在医疗机构制剂的偏差管理中,也已逐渐建立在科学的基础上,以可持续发展的视角,运用各种技术手段,查找偏差根本原因,并采取适当的纠正与预防措施(CAPA),确保制剂质量稳定[4]。近年来,第909医院持续加大制剂质量管理力度,取得了较好的成效,所配制的约70个品规在卫勤战备、为部队服务及临床用药保障等方面发挥着重要作用[5-8]。笔者对本院2017−2019年制剂偏差发生情况进行分析,旨在为质量持续改进明确方向,保证制剂质量合格,保障临床用药安全。
HTML
-
回顾分析本院2017−2019年59例次自制制剂偏差情况,运用“头脑风暴”及“鱼骨图”“帕雷托图”等管理工具,使用Minitab软件,从人(人员)、机(机器)、料(物料)、法(方法)、环(环境)5个方面分析偏差根本原因,制订纠正和预防措施,并评估纠正和预防措施的实施效果。
-
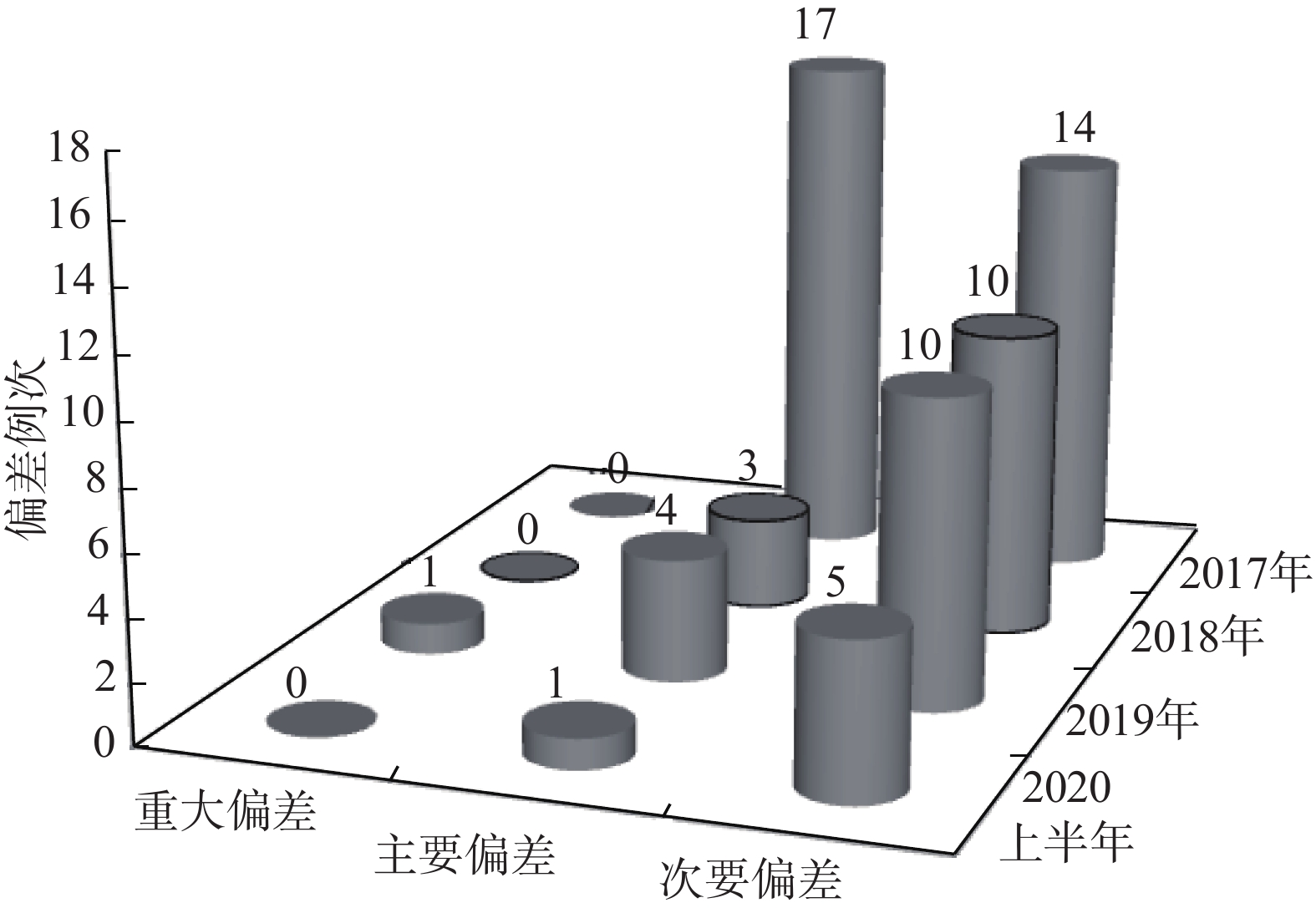
2017−2019年累计发生制剂偏差59例次,其中,2017年31例次(主要偏差17例次,次要偏差14例次,2018年13例次(主要偏差3例次,次要偏差10例次),2019年15例次(重大偏差1例次,主要偏差4例次,次要偏差10例次),见表1。
偏差级别 偏差项目 偏差可能原因 重大偏差 醋酸地塞米松乳膏投料出现错误 c1 对新聘人员和实习轮转人员上岗前培训不到位;双人核对制度未严格执行 主要偏差 洁净区压缩空气含水量异常a1 冷冻干燥机冷媒过滤器堵塞和冷媒不足 制袋灌封间环境动态监测结果超限 a3c1 维修设备人员走动频繁,动作幅度较大;高效过滤器可能存在过滤效能退化的问题;环境动态监测的取样操作不够规范;制袋灌封的操作人员未开启层流罩 注射用水存储分配系统异常 a1c1 总空气开关出现故障;单机械密封和隔膜阀垫片老化破损 灌封时限超标b1 设备故障,维修时间长,超过经验证的灌封时限。 大容量注射剂灭菌工序异常a5 小冷电磁阀和总排水电磁阀、保险丝出现故障;发生突发停水事件。 氯化钠注射液产率偏低及可见异物异常a3 制袋灌封一体机的锁限位杆气缸故障,向上动作限位口管时导致易刮擦,产生塑料异物 普通制剂可见异物、外观性状异常及漏液a3b1 制剂原料、药包材质量问题;制备工艺缺少过滤步骤 醋酸地塞米松乳膏含量测定超标b1 醋酸地塞米松配制过程中受热时间过长,配制工艺待验证 硫酸镁口服溶液长菌a1c2 制备工艺问题,容易受配制环境和包装材料的影响 次要偏差 中间品复调a4c1 pH调节剂配制出错;原料药吸潮;称量方式不合适;液位定容不准 复方薄荷脑滴鼻液外标签利用率异常a1 制剂物料库房发放人员计算错误,请领人员未进行复核 批号、有效期打印错误a1b1c1 未落实双人核对制度 制剂灭菌工序异常a2b1 水浴式灭菌柜的小进电磁阀底座故障;灭菌过程中瓶盖被色水污染 洁净区环境动态监测结果超限 a6b5c2 功能间内操作人员较多;培养皿被污染;维修过程带入污染 产率偏低b1c2 灌装机维修后校准误差;岗位人员操作失误 可见异物b1c1 药包材质量问题;设备发生故障 组合盖破漏b1 制剂的药包材质量问题 输液制剂细菌内毒素检查偏差c1 检验用鲎试剂与内毒素工作标准品不匹配 氯化铵甘草口服溶液控制菌检查异常c2 供应商提供的包装容器PET瓶不够洁净 注:a表示2017年,b表示2018年,c表示2019年,如a1表示2017年发生1例次。 -
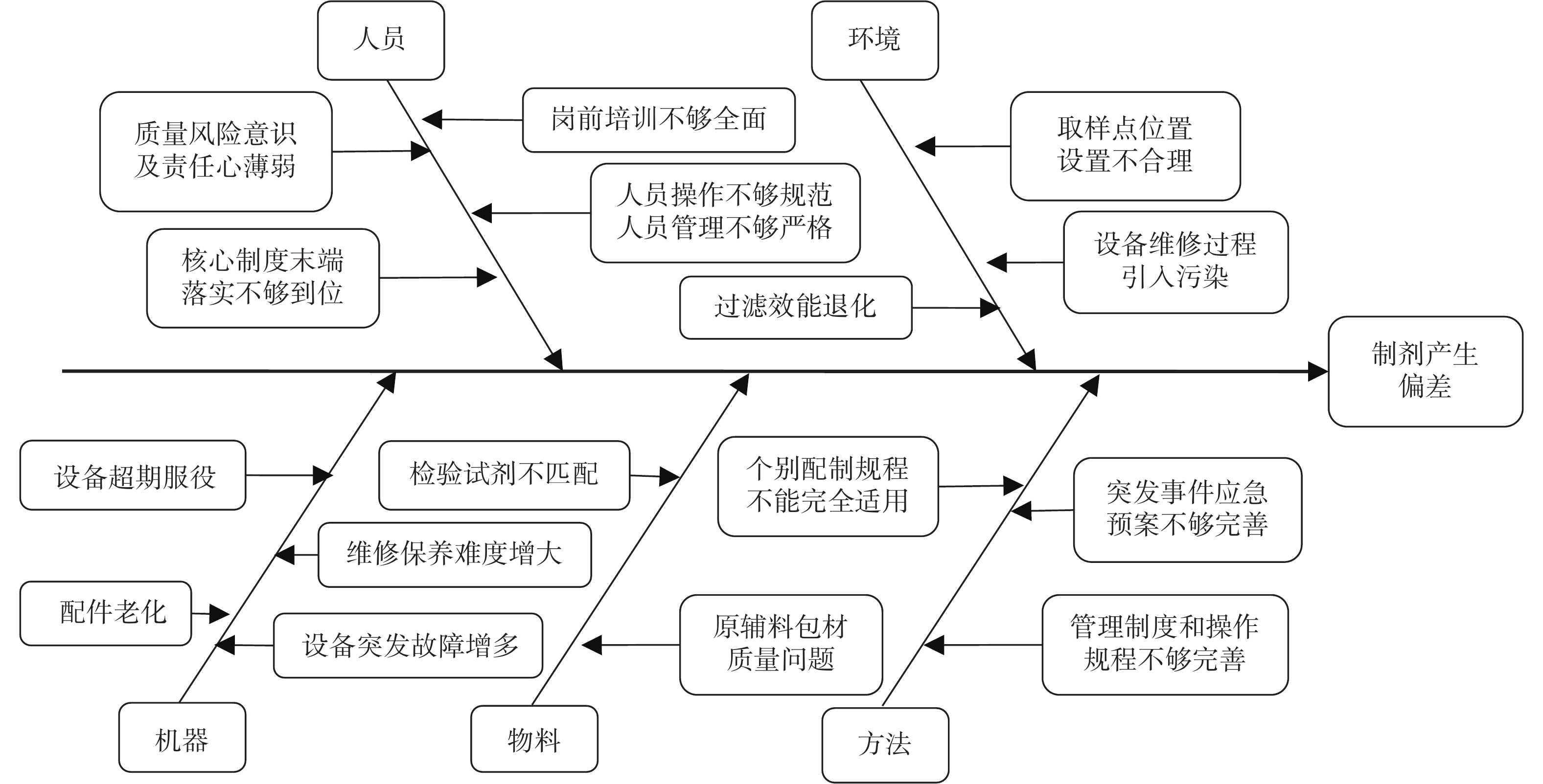
运用“头脑风暴”及“鱼骨图”管理工具,从人员因素、机器因素、物料因素、方法因素及环境因素,分析并查找近3年发生偏差的可能原因,见图1。
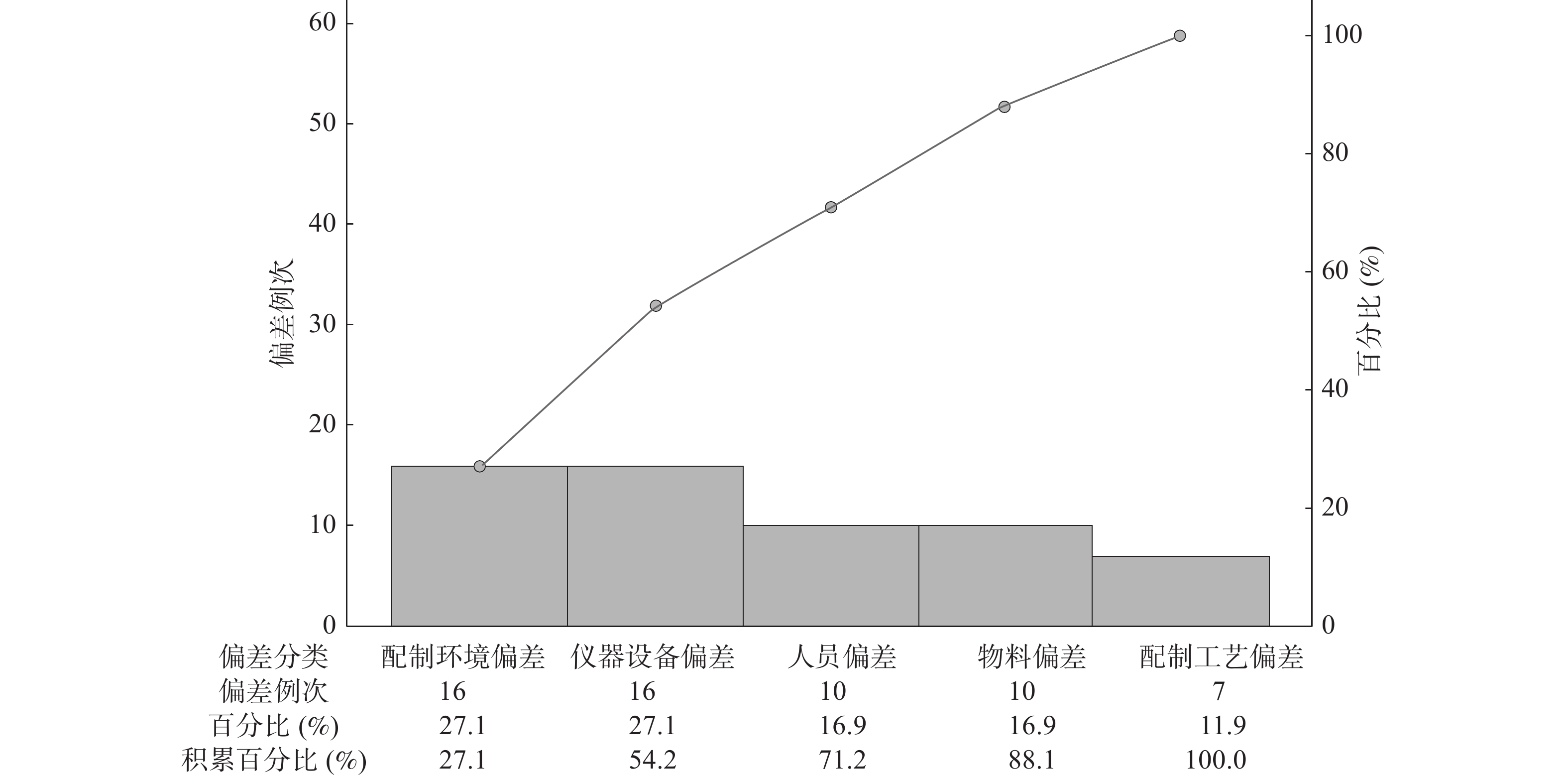
59例次制剂偏差按产生的原因进行分类,其中配制环境偏差、仪器设备偏差、人员偏差、物料偏差及配制工艺偏差的占比依次为27.1%、27.1%、16.9%、16.9%和11.9%。使用Minitab 16.0软件绘制帕雷托(Pareto)图,结果见图2。
-
针对产生偏差的主要原因,结合实际工作,运用“头脑风暴”,从“人、机、料、法、环”5个方面探讨偏差原因,累计拟定了18条纠正和预防措施,见表2。
影响因素 纠正和防措施 人员 ① 加强制剂法规学习及教育引导,提高质量风险意识,增强工作责任心
② 加大岗位技能培训力度,注重新上岗人员培训及实习生的带教管理
③ 严格各岗位核心操作环节的双人核对制度落实
④ 提高一线操作人员偏差识别及应急处置能力机器 ① 结合实际适当增加主要设备的配件库存,必要时申请更新并淘汰老旧的仪器设备
② 完善仪器设备维修保养方案,加强核心部件的维护保养与定期巡检
③ 仪器设备出现故障,及时全面排查原因,尽可能缩短维修时间物料 ① 落实制剂物料(尤其易吸潮、风化、热不稳定的原辅料)库房规范化管理
② 制剂原辅料和内包材领用、发放环节,加强质量检查,发现异常情况及时报告并处置
③ 制剂配制灌装前,加强对包装容器的清洁处理
④ 对于制剂包装容器存在质量缺陷的供应商,必要时进行变更方法 ① 遵循制剂注册备案的配制工艺,必要时综合工艺验证结果及实践经验等实际情况进行修订
② 在风险评估的前提下开展工艺验证,通过验证确定相关工艺参数并进行相应调整
③ 完善制剂配制中的突发事件应急处置预案
④ 优化各岗位的标准操作规程环境 ① 合理设置洁净区环境监测取样点
② 加强洁净区操作人员卫生学知识的培训
③ 维修仪器设备时现场人员应注意避免引入污染源 -
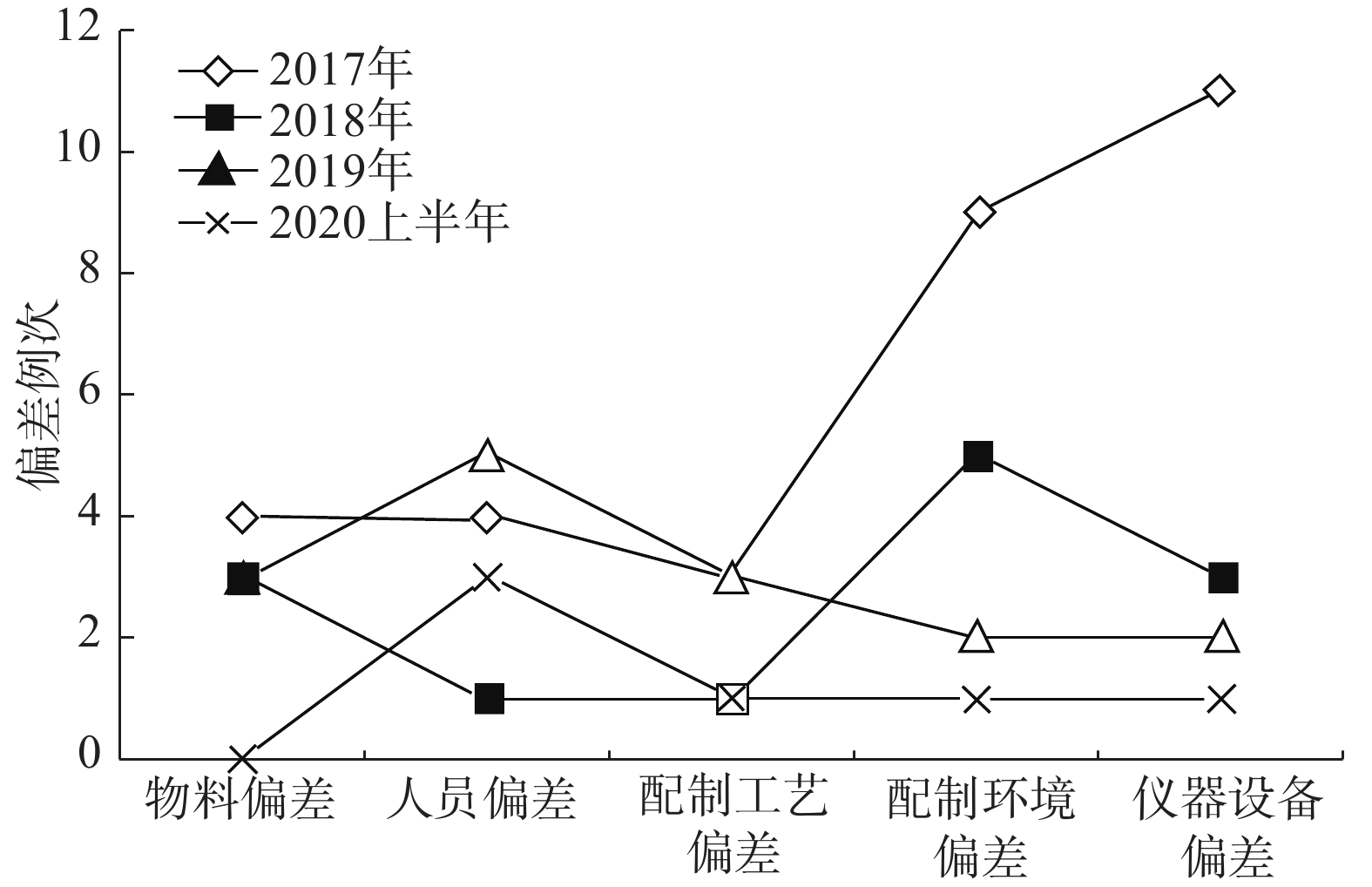
通过制定并实施纠正和预防措施,2018年偏差的总例次较2017年显著减少,2019年偏差的总例次与2018年基本持平,2020年上半年与2018年、2019年相比,总例次有所降低。通过对比分析发现,占比较大的配制环境和仪器设备方面偏差例次下降比较明显,物料和配制工艺偏差变化不明显,而人员偏差存在较大波动,需持续重点关注。总体而言,制剂质量管理系统的运行状态相对平稳,见图3、图4。
2.1. 偏差基本情况
2.2. 偏差原因分析
2.3. 纠正和预防措施
2.4. 实施效果评估
-
制剂的配制过程由于人、机、料、法、环等的综合因素作用,会产生工艺参数不同程度的偏移,从而不同程度地影响制剂内在质量[9-11]。笔者从这5个因素分析归纳偏差产生的可能原因,结果配制环境和仪器设备是偏差产生的主要原因,人员偏差同样的原因反复出现,需重点关注。
偏差发生的原因可分为主观因素和客观因素,主观因素主要是人员的问题,可以通过提升质量风险意识,强化工作责任心,明确人员责任,加大系统培训力度等有效手段进行控制。比如,岗位培训应着重强调偏差管理的重要性,积极鼓励每一项目人员参与讨论发表意见,确保各类人员能正确执行配制工艺、质量标准、检验方法和操作规程,将偏差管理的理念融入岗位工作各个环节。客观因素则需通过制修订相应管理制度和操作规程,为可能发生的偏差做好风险评估,使偏差级别降低。无论是主观因素还是客观因素,需要特别注意的是,强化纠正与预防措施末端落实十分重要。纠正与预防措施的意义是纠正某一个体的缺陷,而且要找到缺陷的根本原因,采取预防措施,防止同类缺陷的重复发生。此外,必要时还可建立适当的奖惩机制,保证预防措施得到更彻底的贯彻执行。
综上所述,偏差管理是制剂质量管理不可或缺的一部分,把质量风险管理理念融入制剂偏差管理,前瞻性地推断未来可能发生的事件,可以最大限度地降低偏差发生的频次,并减少潜在质量安全事件的发生。就军队医疗机构而言,加强制剂偏差管理对于确保卫勤保障、为部队服务及临床用药的安全至关重要。下一步,要巩固现有的偏差管理成果,并参照《药品生产质量管理规范》《药品生产监督管理办法》等法规持续加强改进。









 DownLoad:
DownLoad: