-
姜黄素(Cur)是从姜科姜黄属植物中提取的多酚类化合物,由于安全无毒,被WHO和FDA批准为天然食品添加剂。姜黄素具有抗炎、抗肿瘤、抗抑郁等药理作用[1-2],但由于水中溶解度小,口服难吸收,且在肠道易转化,目前仍处于临床实验阶段。如何提高姜黄素在体内的生物利用度是近年来的研究热点,包括研制新剂型、改变其化学结构及联用生物利用度增强剂[3-4]。胡椒碱(Pip)可作用于P-gp,通过调节胃肠道分泌等机制来增强其他药物的生物利用度[5]。姜黄素与佐剂胡椒碱的联用是近几年的研究热点,胡椒碱不仅能够改善姜黄素生物利用度,还具有药理作用上的协同效果。自乳化药物传递系统(SMEDDS)由药物、油相、表面活性剂和助表面活性剂组成,在体内胃肠道温和蠕动下能够自发形成微乳[6],通过增加难溶性药物的溶解度,从而促进药物在体内的吸收。
姜黄素与胡椒碱比例在各参考文献中不同,本研究项目结合参考文献后尝试不同梯度的质量比,以稳定性和载药量为指标,最终优选姜黄素和胡椒碱的质量比为4∶1。本研究将姜黄素和胡椒碱同时包裹于自微乳制剂中,制备成复方自微乳制剂(Cur+Pip)-SMEDDS,旨在提高姜黄素的溶解度和生物利用度。笔者建立了复方姜黄素自微乳制剂中姜黄素和胡椒碱含量的HPLC测定法,考察药物的体外释放行为,为姜黄素和胡椒碱的新剂型研究提供理论依据。
HTML
-
美国Waters公司高效液相色谱仪;AG285型电子天平(Mettler Toledo公司);KQ32(X)E医用超声波清洗器;HJ-1磁力搅拌器(常州荣华仪器制造有限公司);PHSJ-4F型实验室pH计(上海仪电科学仪器有限公司);SHA-C恒温水浴振荡器(金坛市国旺实验仪器厂)。
-
胡椒碱原料药(含量98%,陕西西安兰草生物科技有限公司);胡椒碱对照品(纯度>99%,中国食品药品检定研究院,批号:110775-201706);姜黄素原料药(含量95%,陕西西安兰草生物科技有限公司);姜黄素对照品(中国食品药品检定研究院,批号:110823-201706,纯度>99%);透析袋(截留分子量14000,西安罗森伯科技有限公司);pH = 4.8、7.5 PBS缓冲液;吐温-80(天津市科密欧化学试剂开发中心);甲醇、乙腈(色谱纯,天津市科密欧化学试剂有限公司);水为超纯水;其他试剂均为市售分析纯。复方姜黄素自微乳制剂及空白自微乳均为自制。
1.1. 仪器
1.2. 药材与试药
-
按照处方称取油酸乙酯∶吐温-80∶二乙二醇单乙基醚(Transcutol P)=30%∶55%∶15%,置于50 ml烧杯中,25 ℃超声混匀后,得到空白自微乳制剂。称取适量空白自微乳制剂,按照姜黄素40 mg/g,胡椒碱10 mg/g加入原料药,于30 ℃超声混合,至药物完全溶解,得到含姜黄素和胡椒碱的复方姜黄素自微乳制剂(Cur+Pip)-SMEDDS,外观见图1。取本品约1.0 g,加水稀释至10 ml,使用pH计测定自乳化制剂pH值。空白自乳化制剂pH值为5.37;载药自乳化制剂pH值为4.97。
-
色谱柱DiamonsilTM C18柱(200 mm×4.6 mm,5 μm);流动相∶乙腈∶4%冰醋酸溶液=48∶52(V:V);流速:1.0 ml/min;柱温:25 ℃;姜黄素检测波长:430 nm;胡椒碱检测波长:343 nm;进样量:20 μl。
-
对照品溶液:取姜黄素和胡椒碱对照品各约10.0 mg,精密称定,置于10 ml量瓶中,用甲醇溶解并定容,配成1.0 mg/ml的标准母液备用。
样品溶液:吸取适量(Cur+Pip)-SMEDDS溶液于10 ml量瓶中,加入甲醇溶解并定容,用0.45 μm微孔滤膜过滤后稀释10倍作为样品溶液。
空白溶液:吸取适量空白自微乳制剂于10 ml量瓶中,按照样品溶液的配制方法处理,作为不含药物的阴性样品溶液。
-
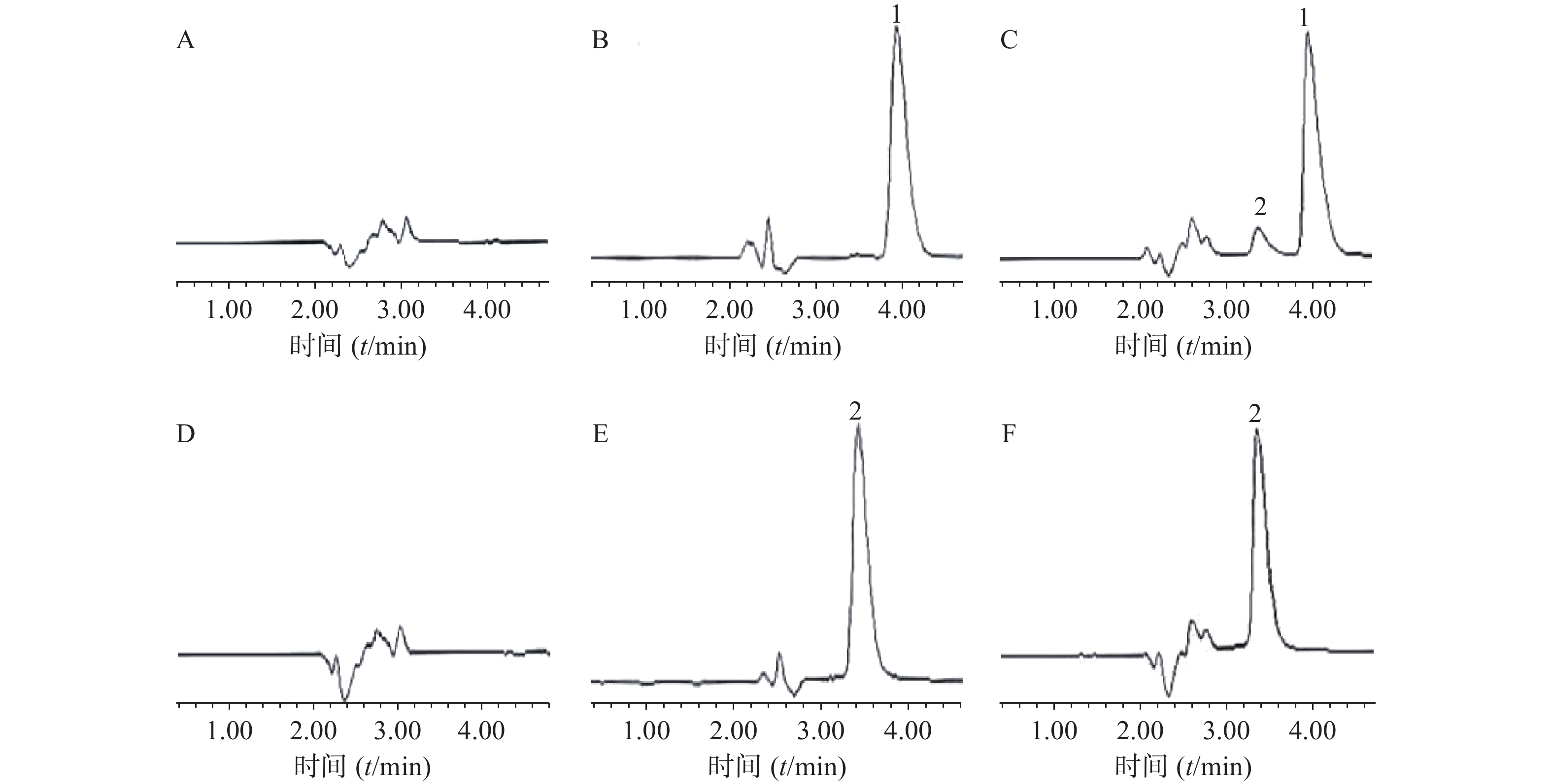
分别精密吸取空白微乳溶液、姜黄素和胡椒碱对照品溶液和(Cur+Pip)-SMEDDS样品溶液各20 μl,按照“2.2”项下依法操作,记录色谱图,考察辅料是否对药物的测定存在干扰。结果表明,在此条件下,高效液相色谱法专属性强,辅料不干扰药物的测定(图2)。
-
姜黄素的线性关系:精密吸取姜黄素母液10、100 μl,1、2、4、6、8 ml于100 ml量瓶中,加流动相定容后混匀,配制成系列浓度为0.1、1.0、10.0、20.0、40.0、60.0、80.0 µg/ml的姜黄素标准液。吸取胡椒碱母液10、20 、100 μl,0.5、1、2、4 ml于100 ml量瓶中,配制成系列浓度为0.1、0.2、1.0、5.0、10.0、20.0、40.0 µg/ml的标准液。按照“2.2.1”项下依法操作,记录姜黄素和胡椒碱峰面积。以峰面积为纵坐标,以浓度为横坐标绘制标准曲线,求得回归方程。
姜黄素:Y=36.07X−12.75,(n=7,r=0.999 8);
胡椒碱:Y=34.296X+4.442 3,(n=7,r=0.999 9)。
结果表明,姜黄素在0.1~80 µg/ml浓度范围内,胡椒碱在0.1~40 µg/ml浓度范围内,峰面积与测定浓度呈良好的线性关系。
-
分别精密吸取适量姜黄素和胡椒碱低、中、高3种浓度的药物溶液,进行HPLC分析。于1 d内重复进样6次,测定峰面积,计算日内精密度。连续进样5 d,测定峰面积,计算日间精密度。姜黄素和胡椒碱的日内、日间精密度RSD均 < 2.0%(n=6)。说明该方法精密度良好,满足测定的要求。
-
取供试品溶液(Cur+Pip)-SMEDDS,分别于0、2、4、6、8、12、24、48 h进样测定,测定峰面积,计算RSD以考察供试品稳定性。结果显示姜黄素和胡椒碱在48 h内RSD分别为1.7%和1.75%,表明供试品溶液在48 h内稳定性良好。
-
取3批样品(批号:20190604、20190608、20190612),按“2.1”项下方法平行制备6份供试品溶液,姜黄素平均含量为81.6 μg/ml,RSD为0.82%(n=6);胡椒碱平均含量为14.58 μg/ml,RSD为0.76%(n=6),结果表明该方法重复性良好。
-
精密称取已知含量的同一批复方姜黄素自微乳样品(批号:20190612)9份,约28 mg,分别准确加入对照品溶液(其中,姜黄素10 μg/ml,胡椒碱5 μg/ml)为5、25、50 ml各3份,稀释定容至100 ml,按照“2.2”项下依法测定。结果显示,低、中、高3个浓度的姜黄素和胡椒碱溶液在空白自微乳中的回收率在98.0%~102.0%之间,结果表明回收率满足分析方法的要求,表明该方法准确性良好。
-
分别取3批不同批号(20190604、20190608、20190612)的样品,按“2.2.2”项下方法制成供试品溶液,依法测定峰面积,计算样品中姜黄素和胡椒碱的含量,见表1。
批号 姜黄素(μg/ml) 胡椒碱(μg/ml) 20190604 81.64 14.52 20190608 80.72 13.78 20190612 81.96 14.95 均值 81.34±0.056 14.42±0.068 RSD(%) 0.96 1.15 -
由于姜黄素和胡椒碱溶解度低,因此选择合适的表面活性剂置于透析液中,通过增加药物的溶解度来建立体外释放的漏槽条件。将不同浓度乙醇、吐温-80、十二烷基硫酸钠(SDS)加到磷酸盐缓冲溶液中,加入过量的药物,放入恒温水浴箱中振荡,72 h后离心取上清液进HPLC仪,计算药物饱和溶解度,见表2。
释放介质 溶解度(mg/ml) 姜黄素 胡椒碱 10% 乙醇 0.104 0.094 20% 乙醇 0.245 0.136 30% 乙醇 0.312 0.198 磷酸盐缓冲液 0.08×10−3 0.03×10−3 0.05%吐温-80 0.016 0.015 0.2%吐温-80 0.085 0.064 0.5%吐温-80 0.199 0.095 0.75%吐温-80 0.332 0.260 0.05%SDS 0.044 0.052 0.2%SDS 0.085 0.092 0.5%SDS 0.108 0.312 0.75%SDS 0.198 0.485 结果显示药物在0.75% 吐温-80中溶解度较大且稳定性良好,故选择加入0.75% 吐温-80的磷酸盐缓冲液作为漏槽条件。
-
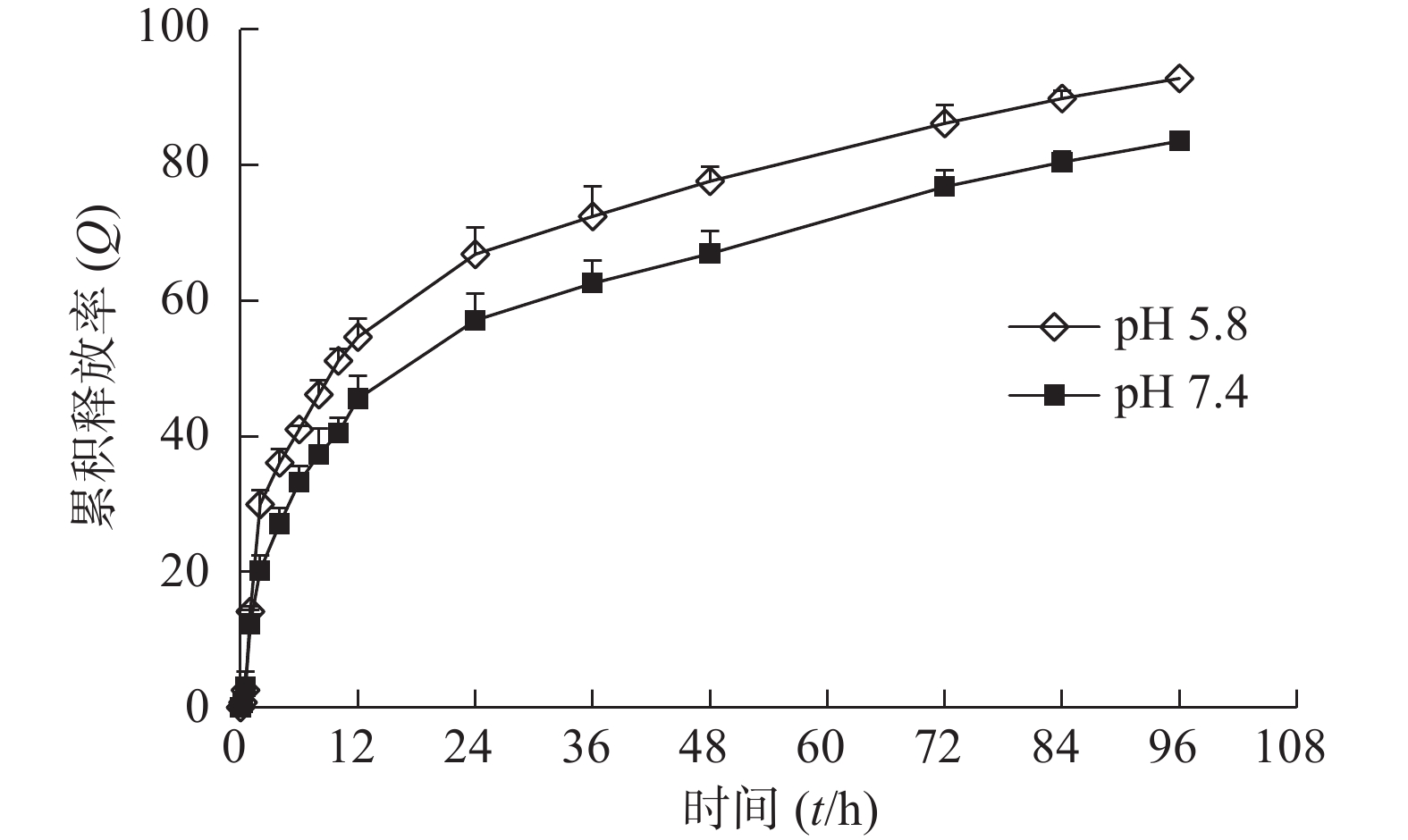
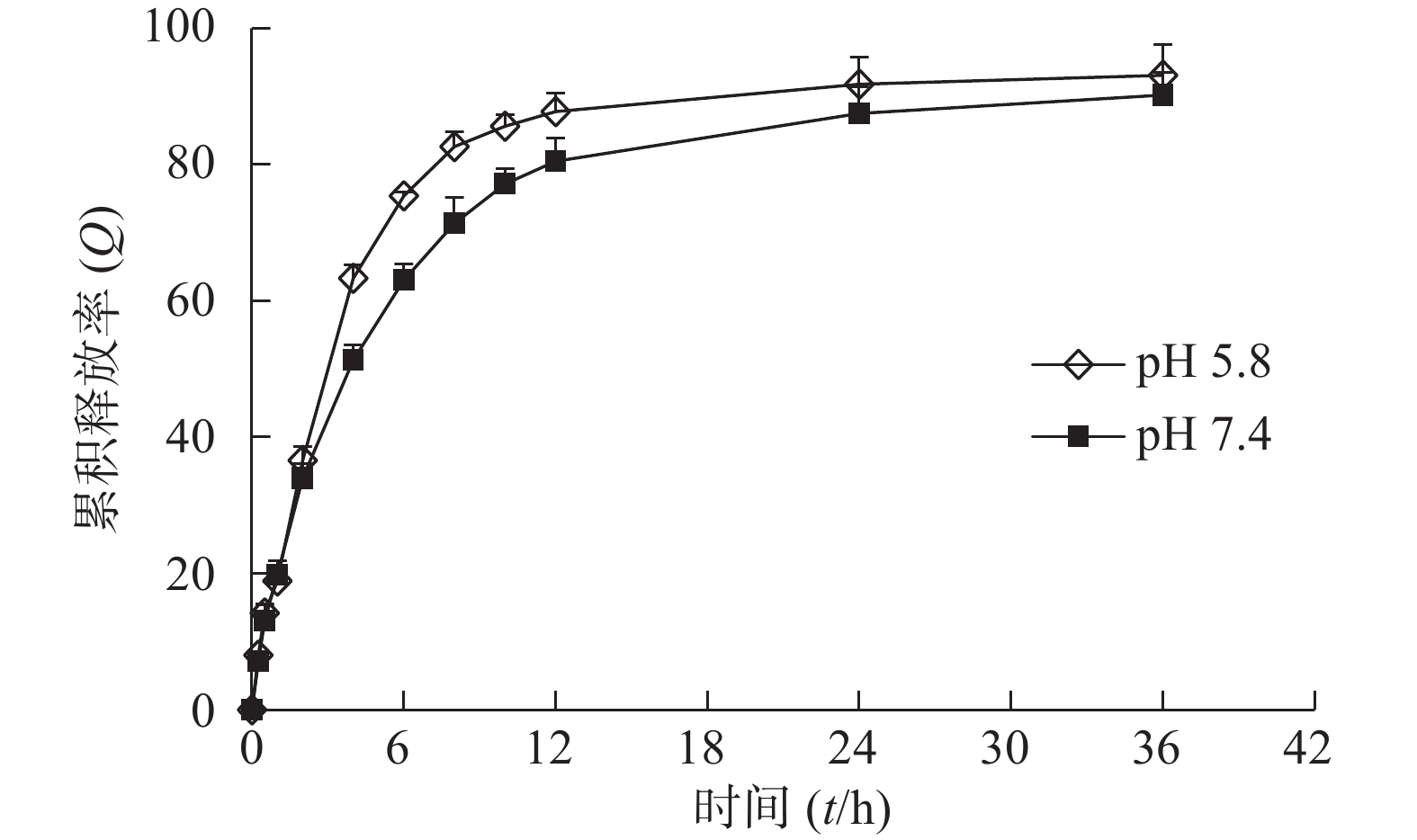
吸取3 ml复方自微乳溶液装于透析袋中,将透析袋置于200 ml释放介质中(n =3),于37.2 ℃,100次/min振荡的条件下进行药物体外释放行为的考察。分别于不同时间点取3 ml释放介质,过滤后使用HPLC测定药物浓度,同时补充相同体积的空白介质。根据HPLC法进行含量测定,计算药物浓度及累积释放率(Q)。结果见图3、图4。
由于肿瘤微环境呈酸性,pH值较低,本研究使用pH 4.8的释放介质来模拟肿瘤环境。由图可知,药物在pH 4.8酸性环境中释放更完全,表明该自微乳制剂中的药物能够在肿瘤部位释放。姜黄素在pH 4.8和pH 7.5释放介质中108 h累积释放率分别为94.85%和84.38%。胡椒碱比姜黄素释放更完全,可能由于胡椒碱在0.75% 吐温-80中的溶解度较高,因此释放量较多。胡椒碱在pH 4.8和pH 7.5释放介质中36 h累积释放率分别为92.85%和90.05%。36 h后,在释放介质中几乎测定不到胡椒碱,而姜黄素能够缓慢释放到108 h。结果表明自微乳制剂具有缓释特性,能够缓慢释放姜黄素。
2.1. 复方姜黄素自微乳制剂的制备
2.2. 复方姜黄素自微乳制剂的含量测定
2.2.1. 色谱条件
2.2.2. 溶液的制备
2.2.3. 专属性试验
2.2.4. 线性范围的考察
2.2.5. 精密度试验
2.2.6. 稳定性试验
2.2.7. 重复性试验
2.2.8. 回收率试验
2.2.9. 样品含量测定
2.3. 复方自微乳制剂的体外释放行为考察
2.3.1. 漏槽条件的建立
2.3.2. 复方自微乳制剂的体外释放行为考察
-
姜黄素具有明确的抗肿瘤效果,但是其水溶性差,体外不稳定等缺点限制了临床应用。本研究将姜黄素和其代谢酶抑制剂胡椒碱制备成自微乳制剂,增加了姜黄素的溶解度以及生物利用度。本研究建立的反相高效液相色谱法能够在同一色谱条件下测定(Cur+Pip)- SMEDDS中姜黄素和胡椒碱的含量,该方法专属性良好、精密度、重复性和准确性均能够满足测定要求。本研究制备的自微乳制剂能够缓慢释放姜黄素和胡椒碱,发挥长效作用,避免突释效应,为进一步体内研究奠定理论基础。
-
本研究中姜黄素和胡椒碱的浓度相差较大及仪器的限制,排除使用紫外分光光度法,选择反相高效液相色谱法同时测定药物含量。为了能够高效检测,本研究采用在同一色谱条件下,不同波长(430和343 nm)条件下对姜黄素和胡椒碱进行测定[7]。本研究考察多种不同流动相后,结合参考文献[8],优选乙腈-4%冰醋酸溶液(48∶52)作为测定两种药物的流动相。结果显示,在该色谱条件下姜黄素衍生物去甲氧基和双去甲氧基姜黄素不干扰姜黄素的测定,同时,姜黄素和胡椒碱的色谱峰可以达到较好的分离,该方法的精密度、回收率等均符合测定要求,可以用来测定自微乳中的药物含量。
-
通过体外释放行为的考察,证实该制剂具有一定的缓释特性。释放结果显示前30 min存在一定的突释效应,可能是微乳表面的游离药物迅速释放到介质中,造成了突释[9],而胡椒碱的体外突释现象更为明显,与其具有较低的载药量相关,胡椒碱载药量低导致微乳表面具有较多的游离药物。两种药物均显示出在酸性环境中释放较完全,由此推测,在进行抗肿瘤疗效研究时,在酸性的肿瘤部位释放药物较多,具有一定靶向作用,从而能够发挥持久的抗肿瘤效果。但体内和体外研究可能具有差异性,需要进一步进行体内研究来证实其缓释以及靶向作用[10]。
3.1. 方法学的建立
3.2. 体外释放的考察
-
本研究建立的HPLC方法学专属性好,精密度和回收率均满足测定方法的要求。制备的(Cur+Pip)-SMEDDS具有缓释特性,且在肿瘤的酸性环境下释放较正常组织中更多,为进一步进行体内试验奠定了理论基础。本实验只对复方自微乳制剂的体外释放做了研究,体内试验还需进一步考察。









 DownLoad:
DownLoad: