-
皮肤是人体最大的器官,日常生活中难免受到损伤形成伤口,如轻微的皮肤擦伤、割伤和烧伤等。对于日常的小伤口,一般可以任其自愈,但若稍不注意沾水或接触外界细菌,则容易造成感染,影响伤口愈合,甚至造成溃烂。我们常用的创面处理方法有:使用创可贴覆盖;双氧水或碘伏消毒处理;纱布包扎等。这些处理方法存在着防水透气性差、撕除时疼痛和使用不便等问题。20世纪60年代,Winter博士的研究证实了湿润的伤口环境有助于上皮组织更快的形成,并以此为依据提出了“湿性愈合”的概念[1]。这一研究提高了人们对伤口护理的认识,也为研发封闭敷料奠定了基础。由于传统的敷料不能在伤口处使用较长时间,也不能为伤口愈合提供一个湿润的环境,因此,各种高科技的湿性疗法的伤口护理产品层出不穷。在日本及美国等发达国家,出现以硝化纤维为主要材料的新型创伤敷料[2-4],可用于密封小型伤口甚至保护烧伤创面。此类创伤敷料在使用前为液体形态,涂抹在伤口后有机溶剂迅速挥发,短时间覆盖伤口形成保护膜,具有防水、杀菌、预防伤口感染等优点[5-7]。本研究拟以市售小林液体创可贴为基础,以硝化纤维为膜材,优化处方,制备一种性能更为优良的液体创伤敷料。
-
Agilent 1200高效液相色谱仪(美国Agilent公司);Shimadzu HS-20气相色谱仪(日本Shimadzu公司);拉力试验机(上海和晟仪器有限公司);AL204型电子天平(上海梅特勒-托利多仪器有限公司);D2400型纯水/超纯水一体机(美国明澈公司);25型无极调速电动搅拌机(江苏江阴科技器械厂)。
-
小林液体创可贴(日本小林制药株式会社);硝化纤维(衡水东方化工有限公司);蓖麻油、樟脑、苯甲醇、乙酸丁酯、异丙醇、N,N-二甲基甲酰胺、甲醇(均为国药集团化学试剂有限公司);棕榈酸异丙酯(IPP,青岛优索化学科技有限公司);乙酸乙酯(上海联试试剂有限公司)。
-
采用高效液相色谱法测定,色谱条件:采用Agilent 1200高效液相色谱仪;色谱柱:ODS-C18色谱柱;流动相:甲醇-水(50∶50 V/V);流速:1.0 ml/min;进样量:20 μl;柱温:40 ℃;检测波长:257 nm。
标准曲线的绘制:精密称定苯甲醇对照品151.3 mg置于100 ml容量瓶中,用甲醇稀释至刻度;精密量取上述溶液1、2、2.5、3、4 ml于25 ml容量瓶中,用甲醇稀释至刻度。市售产品(供试品)溶液的配制:精密称定244.3 mg市售产品于50 ml容量瓶中,用甲醇稀释至刻度。
实验结果:色谱图良好,苯甲醇对照品及市售产品均在5.87 min附近有峰且峰型良好。标准曲线回归方程为:Y = 13040X + 212.7 (r=0.999);经计算得市售产品苯甲醇的使用量为4.0%。
-
采用气相色谱法测定,色谱条件:采用 HS-20气相色谱仪;色谱柱:DB-624毛细管柱;载气:H2 50 ml/min;空气450 ml/min;进样量:1 μl;柱温:40 ℃/min持续3 min,10 ℃程序升温至200 ℃,持续1 min;检测器温度:250 ℃;气化室温度:220 ℃;FID检测器。
标准曲线的绘制:精密称定异丙醇1.0077 g,乙酸乙酯0.9933 g,乙酸丁酯1.0014 g于100 ml容量瓶中,加入适量N,N-二甲基甲酰胺(DMF)混合均匀,用DMF稀释至刻度。分别取上述溶液0.1、0.25、0.5、0.75、1.0 ml置于25 ml容量瓶中,用DMF稀释至刻度。
市售产品(供试品)溶液的配制:精密称定1.186 0 g市售产品于100 ml容量品中,加入适量的DMF超声溶解,用DMF稀释至刻度,精密量取1 ml上述液体于10 ml容量瓶中,用DMF稀释至刻度。
实验结果:色谱图良好,异丙醇对照品及市售产品均在6.84 min附近有峰且峰型良好,乙酸乙酯对照品及市售产品均在9.25 min附近有峰且峰型良好,乙酸丁酯对照品及市售产品均在14.07 min附近有峰且峰型良好;苯甲醇标准曲线、乙酸乙酯标准曲线和乙酸丁酯标准曲线的回归方程分别为:
Y = 20152X + 2.692, r=1.000
Y = 15311X + 33.45 ,r=0.999
Y = 24428X – 17.33, r=0.999
经计算得市售产品中异丙醇的使用量为35.1%,乙酸乙酯的使用量为21.4%,乙酸丁酯的使用量为5.3%。即三者使用比例为:6.6∶4∶1。
-
采用硝化纤维(4%~8%)作为成膜材料,蓖麻油(1%~9%)为增塑剂,苯甲醇(4%)为抑菌剂,棕榈酸异丙酯(IPP,2%)为皮肤柔润剂,樟脑(0.3%)为芳香剂,以异丙醇、乙酸乙酯、乙酸丁酯(三者比例为6.6∶4∶1)作为溶剂制备创伤敷料。制备方法如下:于50 ml烧杯中精密称定处方量蓖麻油、苯甲醇、IPP、樟脑,加入上述3种混合溶剂使混合均匀,加入处方量硝化纤维,密封静置过夜待硝化纤维充分溶解,过夜后搅拌使硝化纤维混合均匀,超声除气泡即得。
-
精密称定2 g按“2.2.1”项制备的液体创伤敷料,加入20 ml乙酸乙酯稀释使之混合均匀、黏度下降并充分溶解。将此液体置于90 mm培养皿中待溶剂挥干后可见均一透明无色薄膜。所制薄膜外观如图1所示。
-
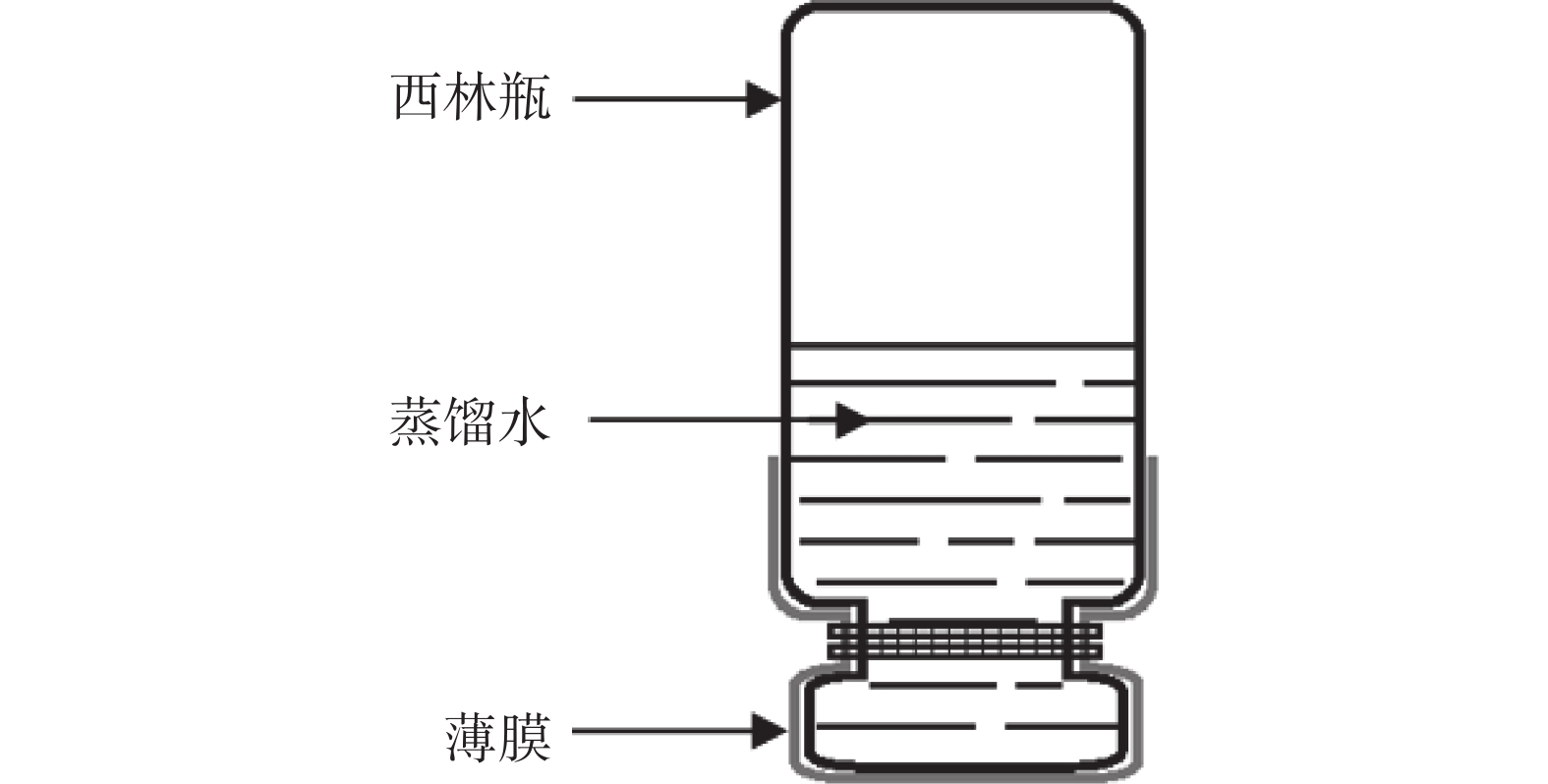
按照中华人民共和国医药行业标准YY/T 0471-2004对直接接触类创伤敷料,进行舒适性、防水性、透气性的考察。舒适性考察主要为考察敷料薄膜的抗张强度及断点伸长百分率[8-9];防水性考察薄膜的防水能力;透气性考察薄膜的水蒸气透过率(MVTR)[10]。抗张强度及断点伸长百分率的考察运用拉伸试验机,并采用公式1、公式2进行计算;防水性的考察采用倒杯法,记录24 h后的重量差异,如图2所示,以公式3进行计算;MVTR的考察方法:在西林瓶中加入蒸馏水,用薄膜覆盖密封,使水液面距薄膜(5±1)mm,置干燥器中,记录24 h后的重量差异,以公式4进行计算。
$$ {\text{抗张强度}}= {\rm{F}}/{\rm{S}}\quad\quad\quad\quad\quad\quad\quad\;\;\;\;\; $$ (1) $$ {\text{断点伸长百分率}} = {{\rm{L}}_{{\rm{max}}}}/{{\rm{L}}_{\rm{o}}} \times 100 {\text%} $$ (2) $$ {\text{水分损失率}}= \left( {{{\rm{M}}_{\rm{0}}} - {{\rm{M}}_{24{\rm{h}}}}} \right)/{{\rm{M}}_{\rm{W}}}\quad\;\;\; $$ (3) $$ {\text{水蒸气透过率}} = \left( {{{\rm{M}}_{\rm{0}}} - {{\rm{M}}_{24{\rm{h}}}}} \right)/\left( {{\rm{s}} \times t} \right) $$ (4) 式中,F为拉伸力;S为薄膜面积;Lmax为拉伸最大距离;L0为初始膜长;M0为初始西林瓶重量;M24h为24 h后西林瓶重量;MW为西林瓶内水重量;s为瓶口面积;t为时间24 h。
-
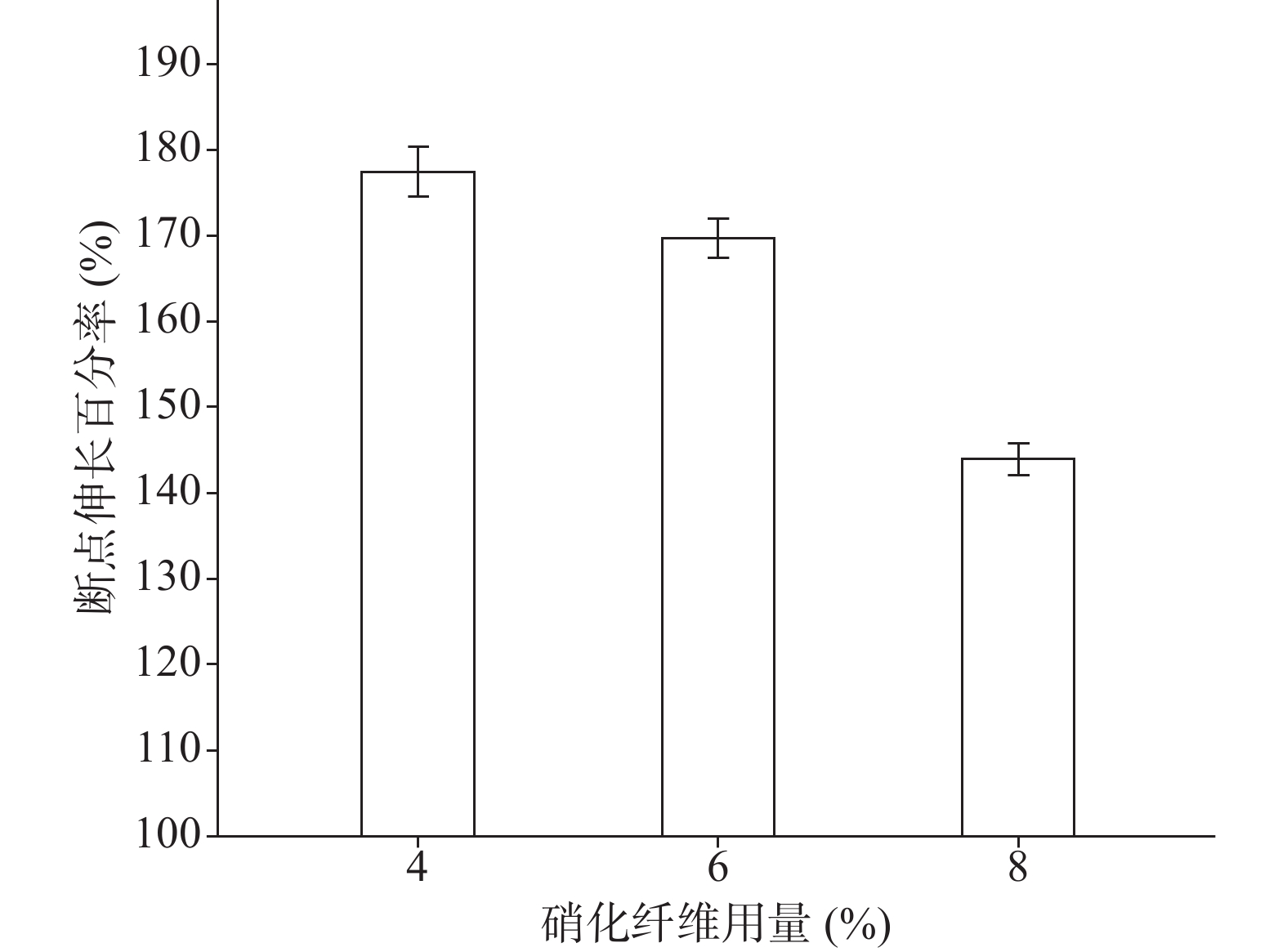
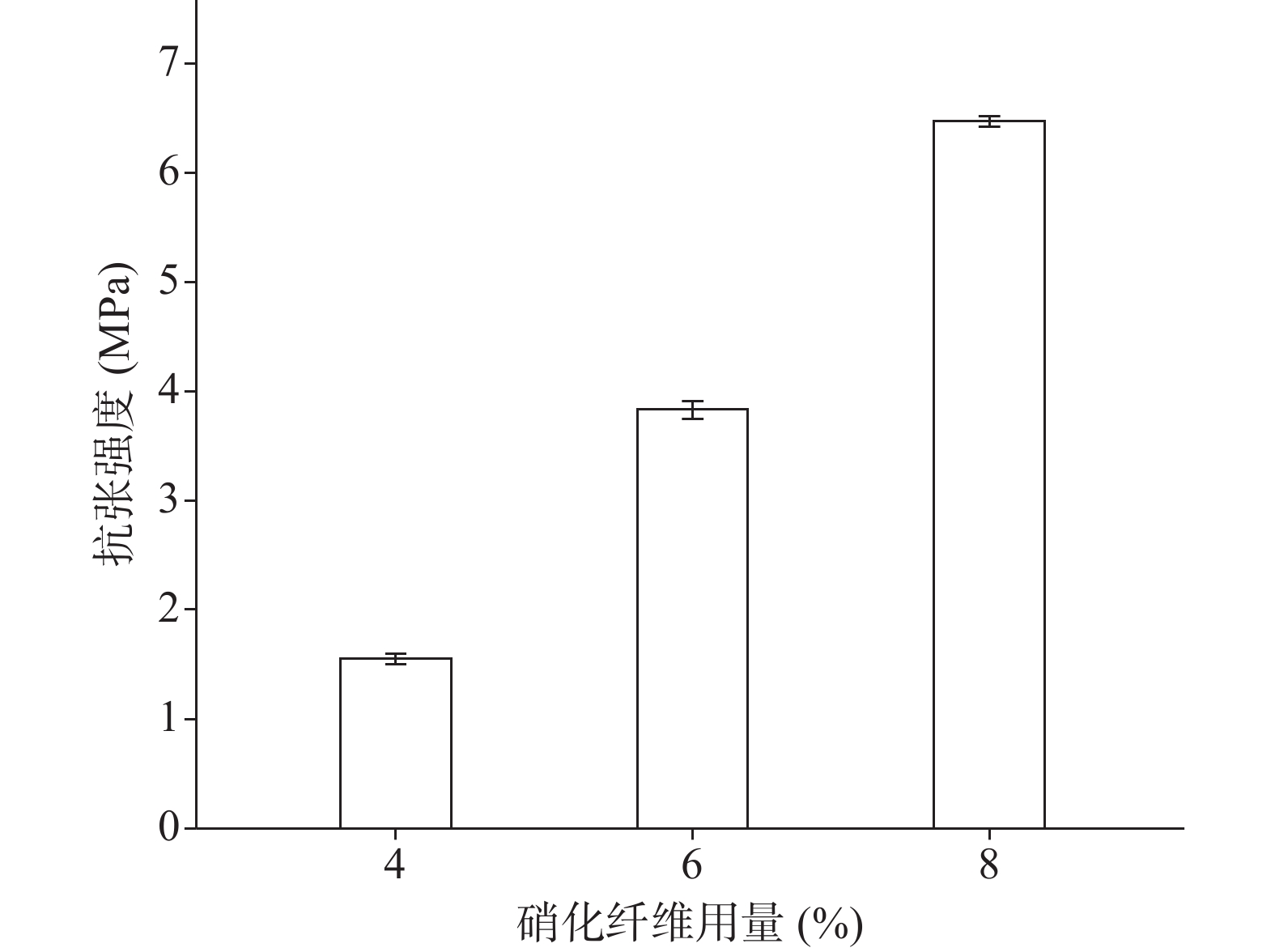
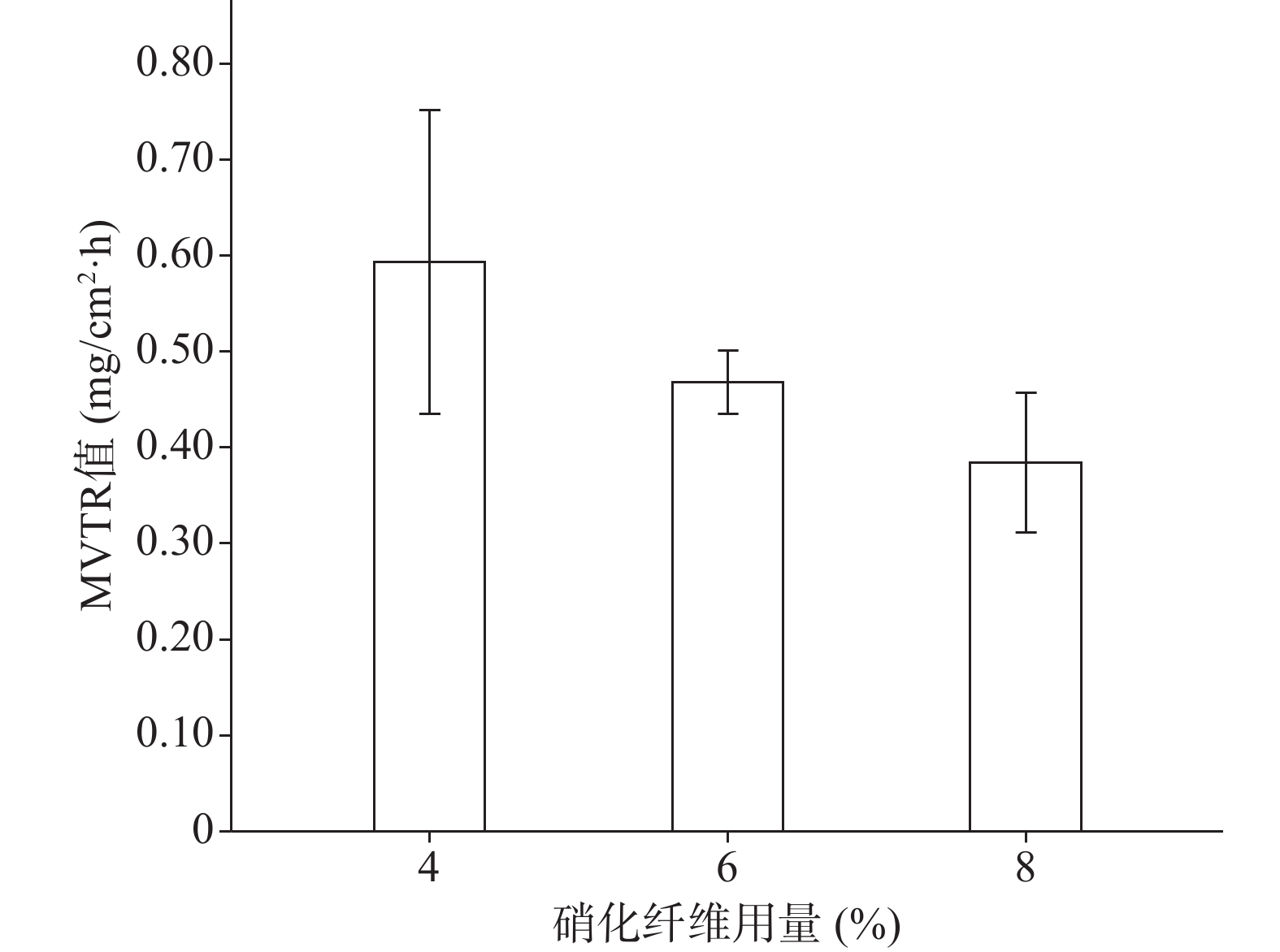
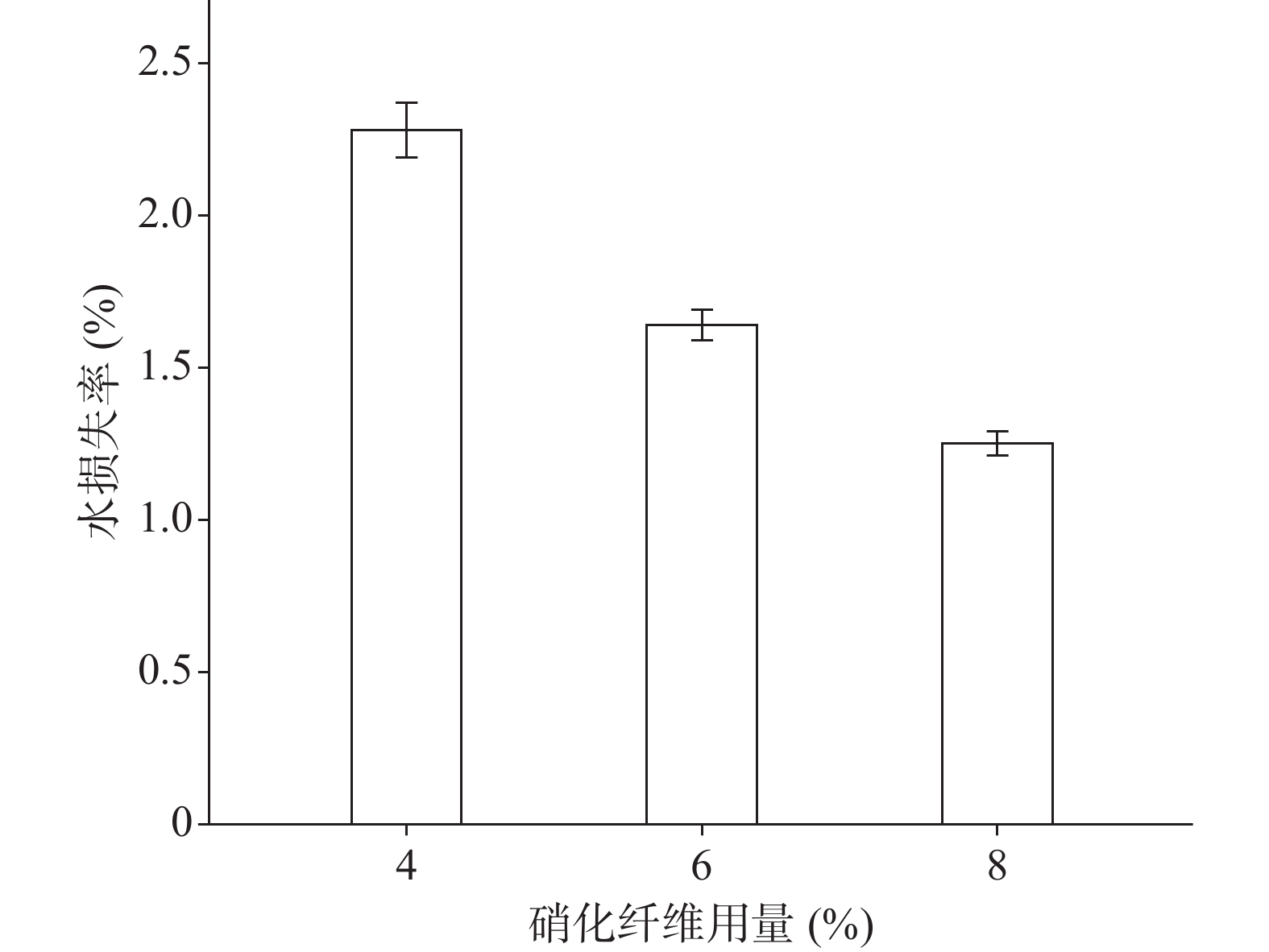
分别采用4%、6%、8%的硝化纤维制备液体创伤敷料,对所制的薄膜进行评价,其断点伸长百分率、防水性能考察的水透过率及MVTR值随着硝化纤维用量的增加呈下降趋势,抗张强度随着硝化纤维用量的增加呈上升趋势。其考察结果如图3~图6所示:
由图3、图4可知,硝化纤维的用量为4%、6%时,断点伸长百分率在170%以上,可认为薄膜韧性较好,在伤口表面有较好的舒适性,而硝化纤维用量为8%时,其断点伸长百分率较低,不足150%;在硝化纤维用量为4%时,所制薄膜过薄,导致其抗张强度较差,不及2.0 MPa。从图5可知,MVTR值在0.3~0.6 mg/(cm2·h)之间,随硝化纤维用量增加而减小,但均具有一定的透气性;由图6可知,三个不同梯度的硝化纤维在24 h内其水损失率均在2.5%以下,可认为防水性良好。综上考察结果,本次采用的硝化纤维用量为6%。
-
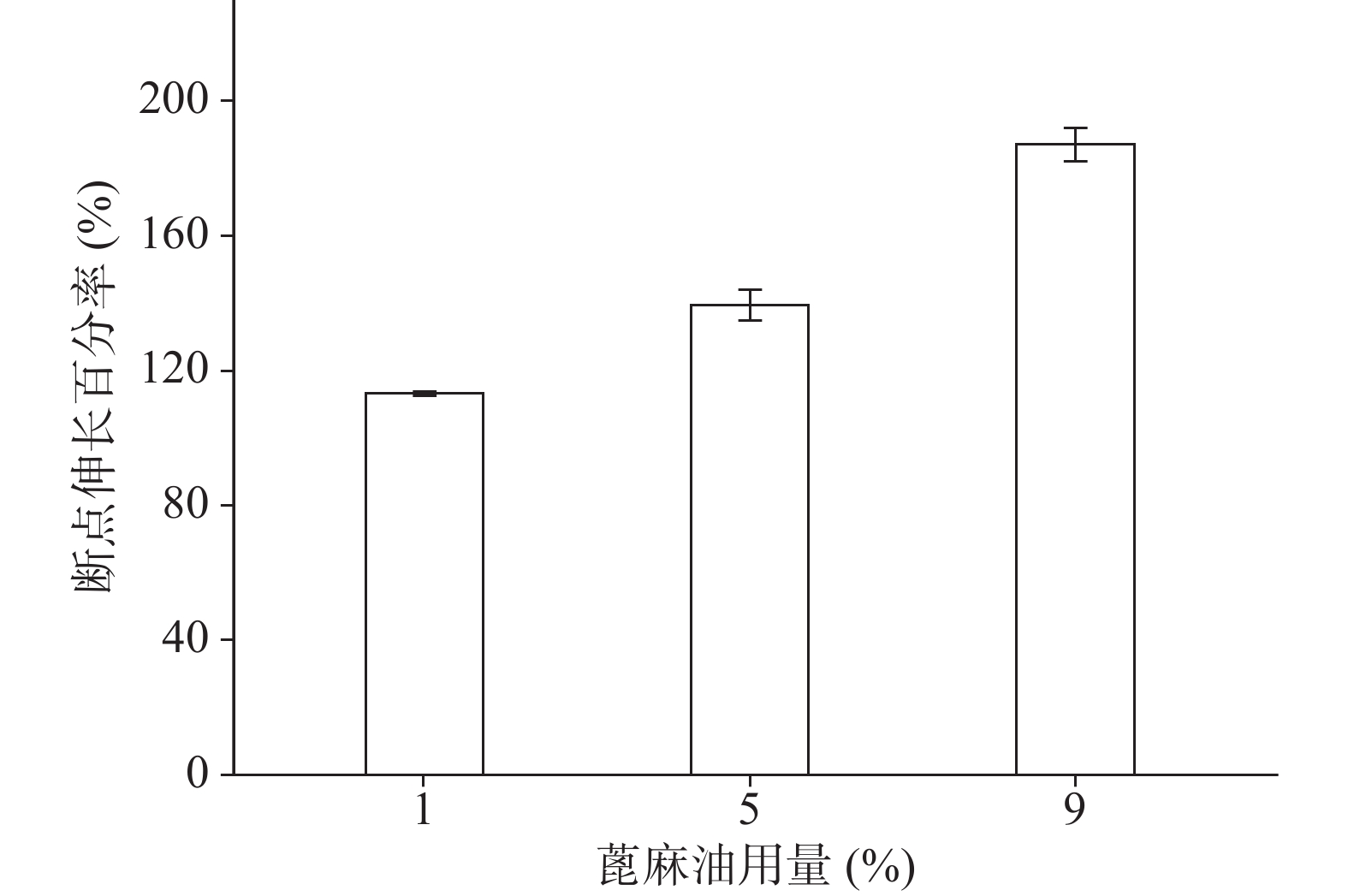
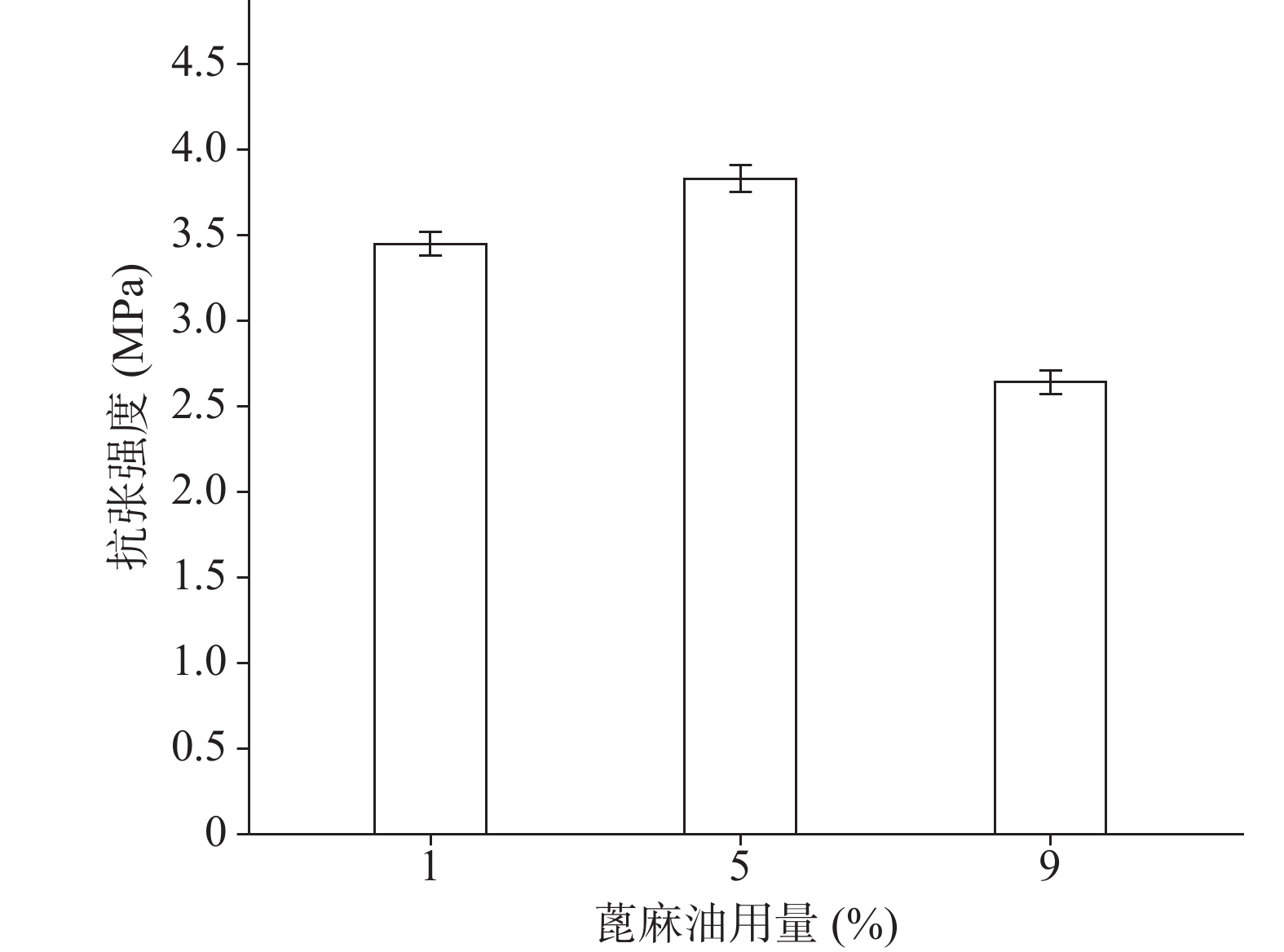
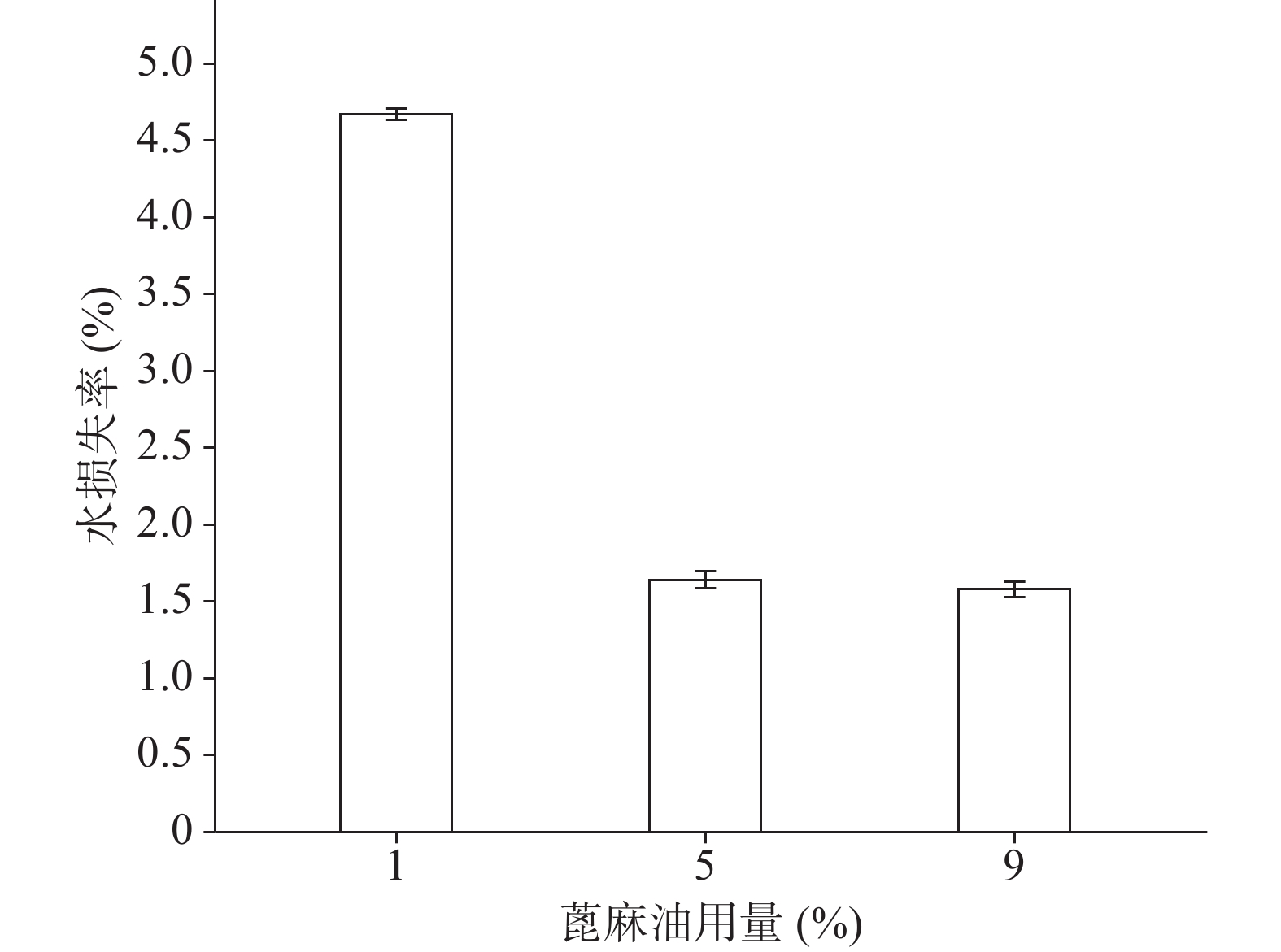
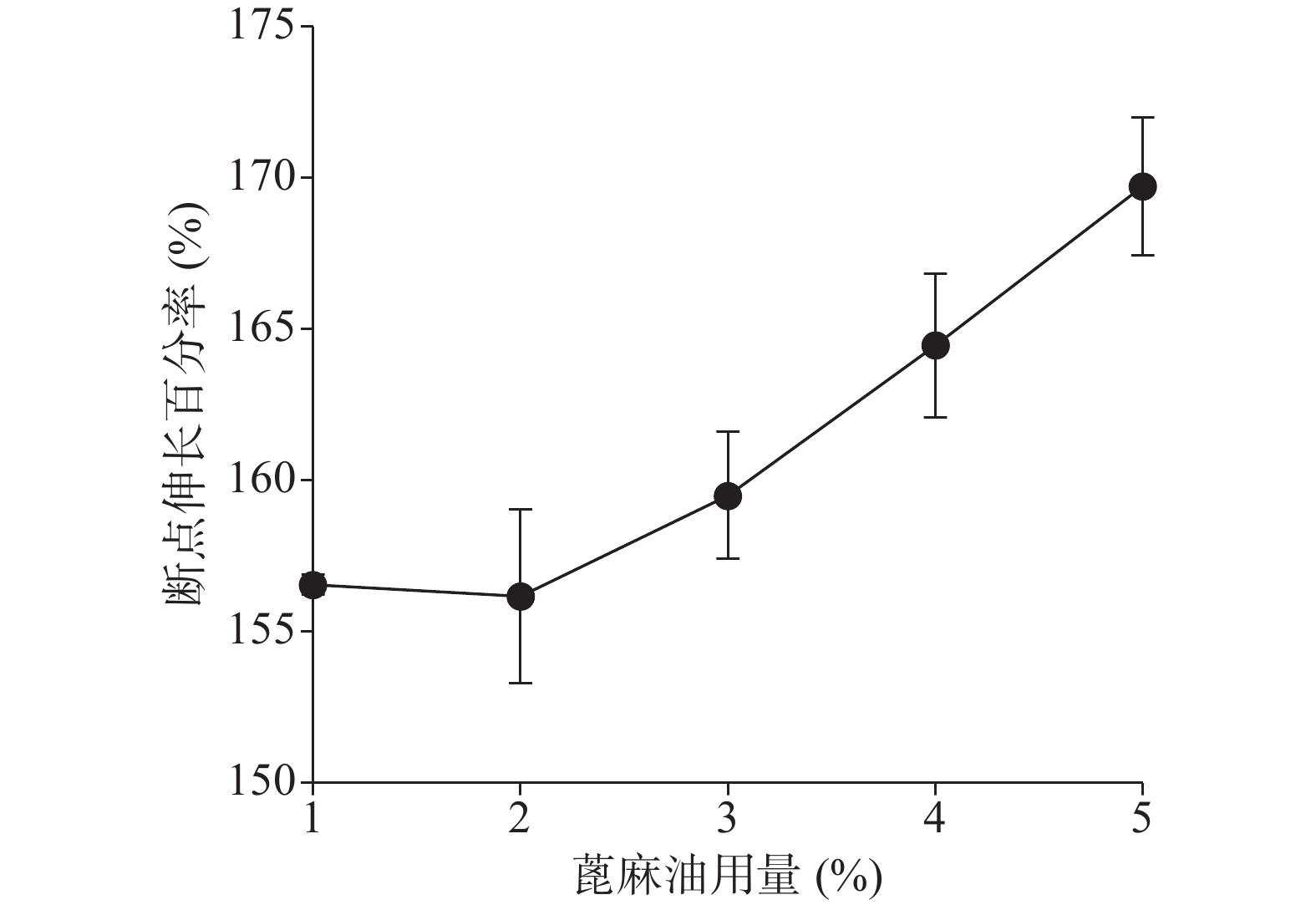
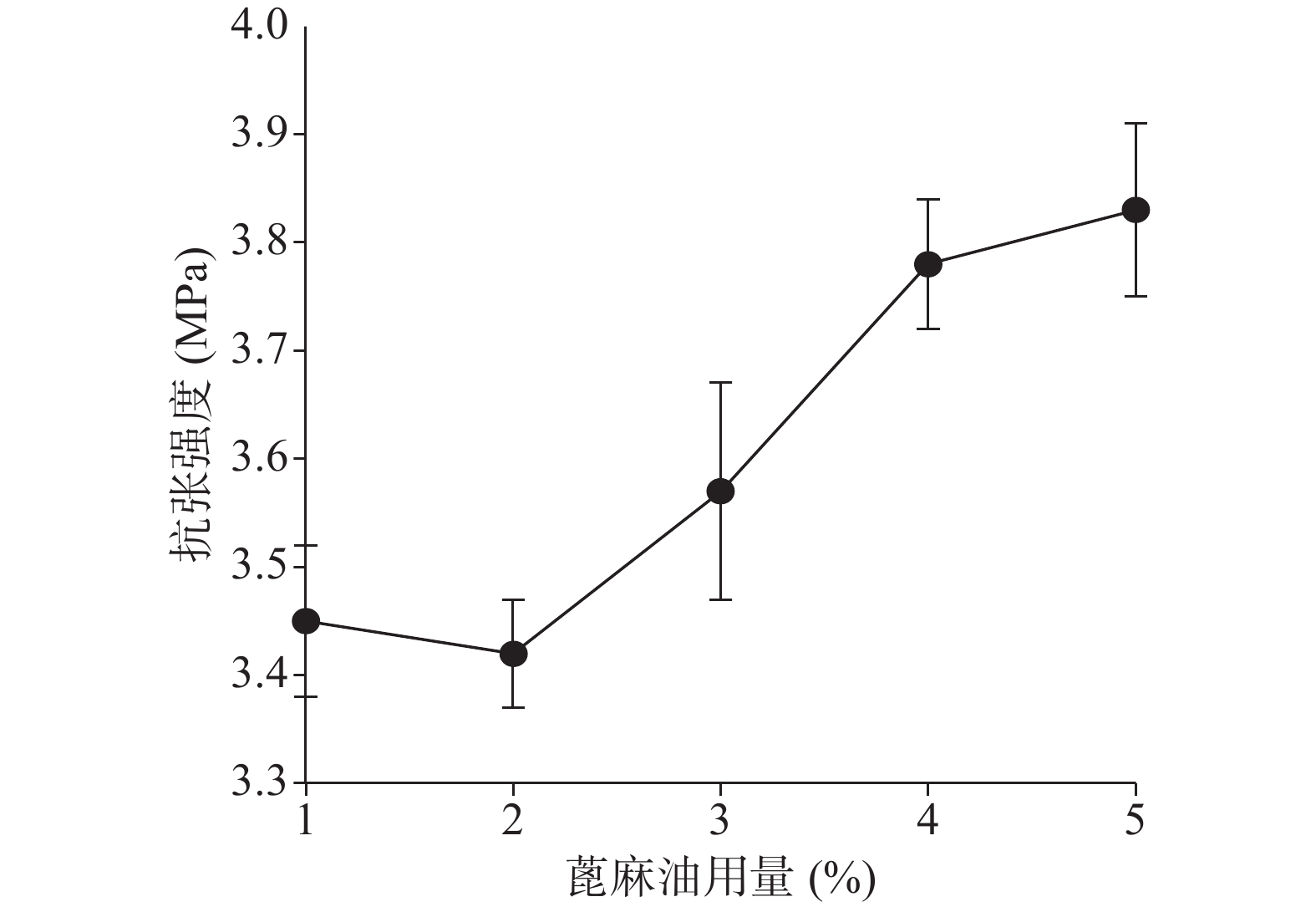
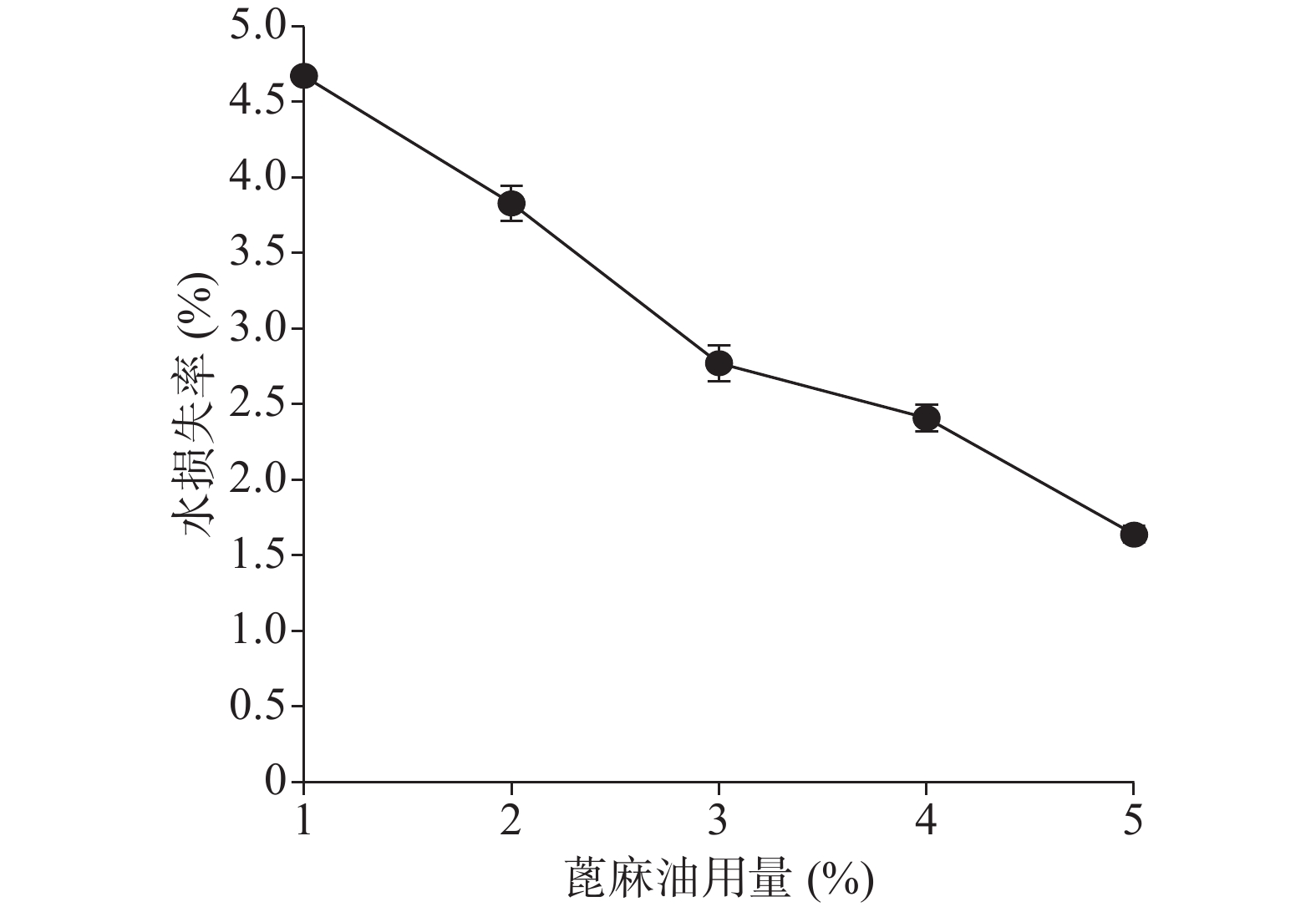
确定硝化纤维使用量为6%后,分别采用1%、5%、9%用量的蓖麻油制备液体创伤敷料,对所制的薄膜进行评价,由图7、图8可知,其断点伸长百分率随蓖麻油用量增加呈上升趋势,在蓖麻油使用量为1%时断点伸长百分率较差,不及150%,在5%~9%上升趋势明显且在蓖麻油用量为9%时达到190%,断点伸长百分率值数据较为理想;抗张强度随蓖麻油用量未呈明显下降趋势,反而是在蓖麻油使用量为5%时具有最大的抗张强度,而伸长率较好的9%用量蓖麻油处方抗张强度明显较小,在2.5 MPa左右,故蓖麻油用量选用浓度为5%。
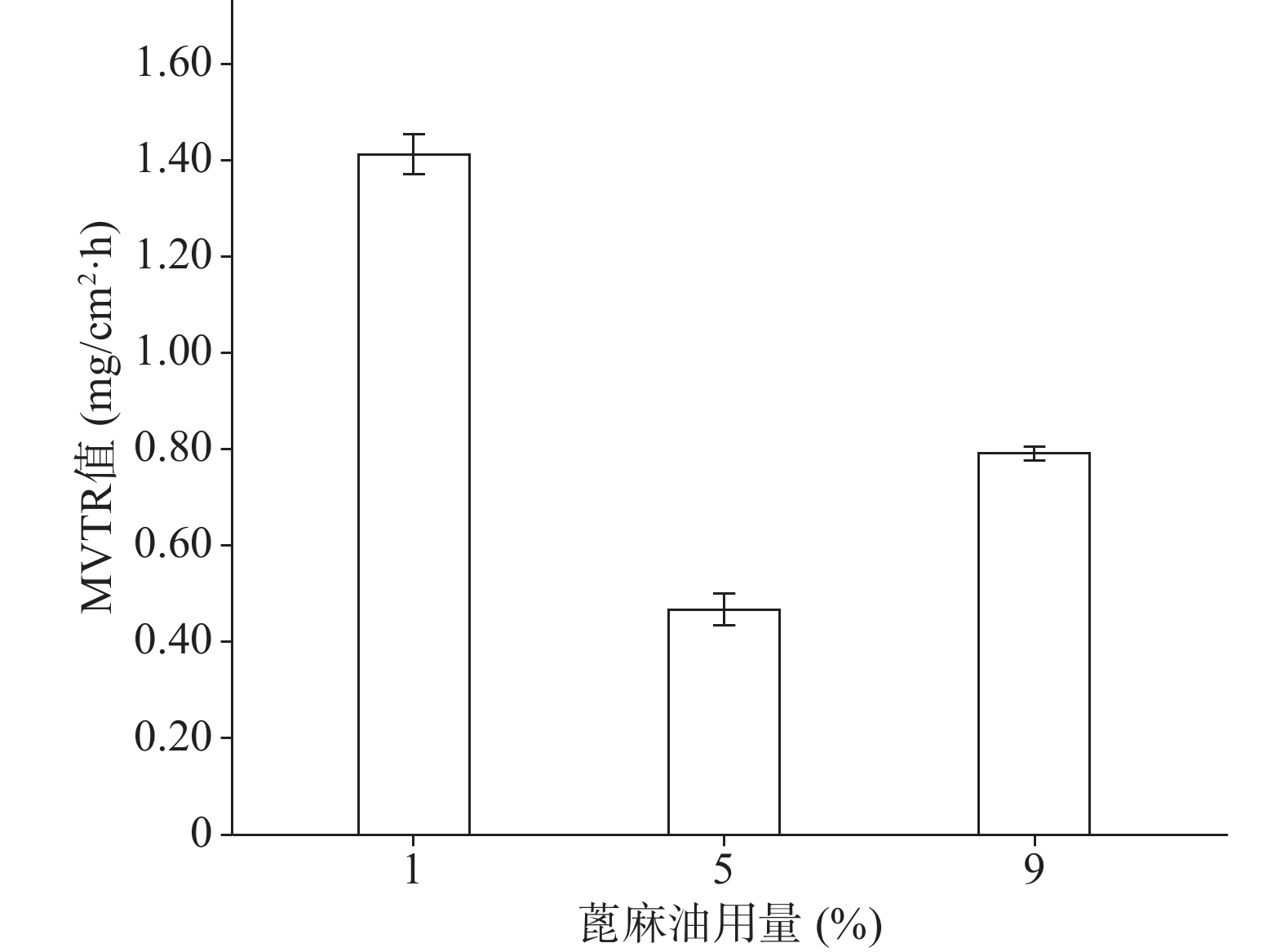
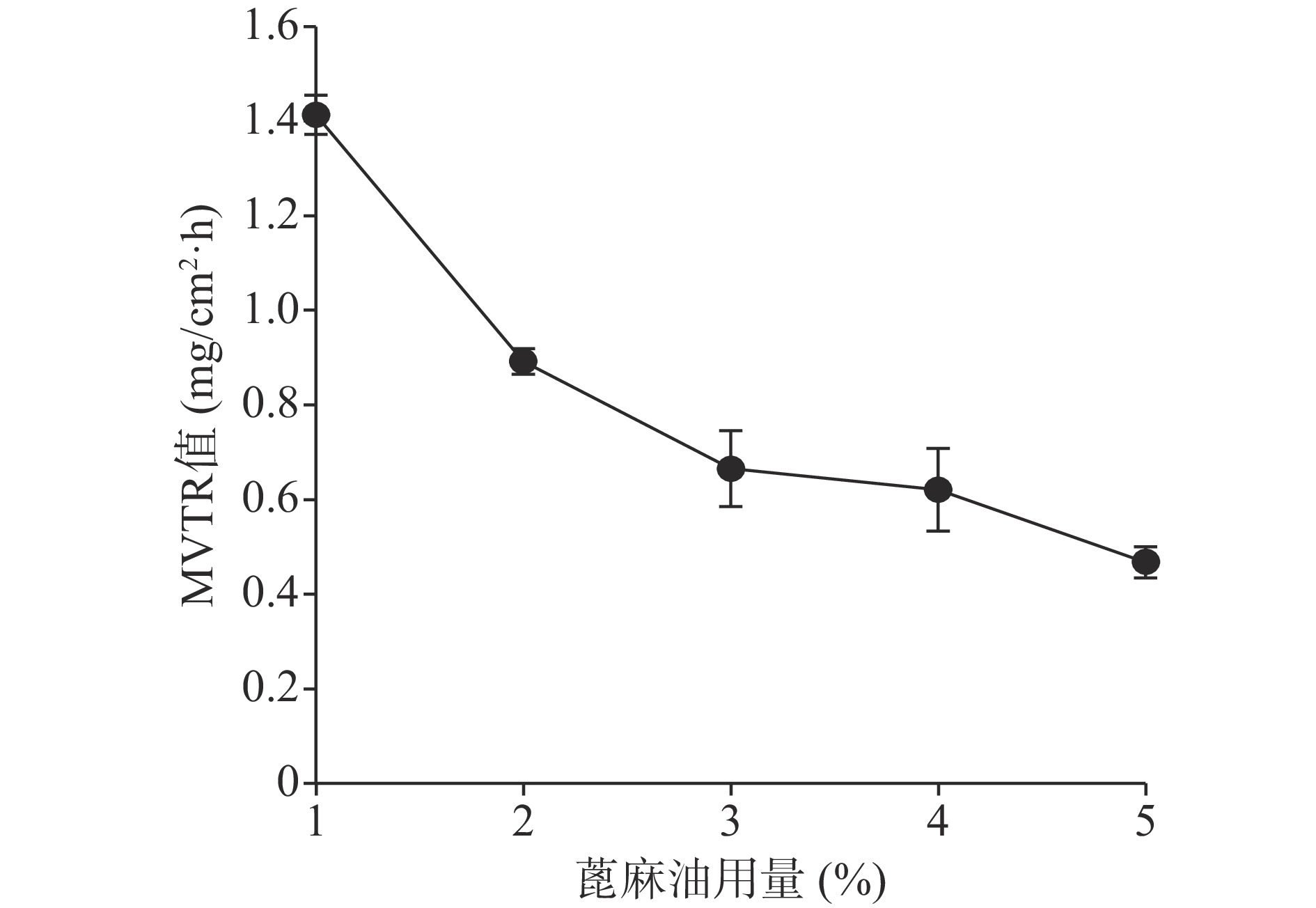
关于蓖麻油对防水性能和透气性能的影响如图9、图10所示,蓖麻油用量为1%时其MVTR值明显高于5%和9%时,且其水损失率也高于5%和9%时,由于5%与9%的防水性没有太大的差异。由此可以得出的结论是,随着蓖麻油的加入,创伤敷料的透气性变差,同时其防水性能却有所增强,1%用量蓖麻油透气性能极佳,但机械性能及防水性相对较差,又因其水损失率24 h也没有达到5%,也可以认为其防水性能良好。所以下一步的考察尽量满足透气性的需求。
综合断点伸长百分率、抗张强度、MVTR值、水损失率,在保证机械强度的同时尽量满足其透气性的要求。拟在1%~5%之间再另设梯度进行考察。拟定蓖麻油使用量为2%、3%、4%时对上述指标再行考察。
由图11、图12可知处方断点伸长百分率及抗张强度在1%~5%范围内随蓖麻油用量的增加总体上均有一定的上升趋势。断点伸长百分率在蓖麻油用量为1%、2%时相差不大,在2%~5%时有明显的上升趋势;抗张强度在蓖麻油用量1%、2%时和4%、5%时相差不大,在蓖麻油用量从2%~4%时有明显的上升趋势。
由图13、图14可知在蓖麻油用量为1%~5%范围内MVTR值及水损失率随处方中蓖麻油用量的增加而呈下降趋势。
综合以上几个因素对处方中的蓖麻油用量进行考察,从所制薄膜的机械性能来看,在蓖麻油用量为1%~3%时,断点伸长百分率不及160%,抗张强度较差,不及3.60 MPa,故此用量不予考虑,从所制薄膜的防水透气效果来看,4%、5%用量均有一定的透气效果,且防水性测试结果显示二者水损失率均不超过2.50%。综上考虑,确定蓖麻油的使用量为4%。
-
本文对市售产品的抑菌剂含量及溶剂组成进行了分析,以此作为基础对自制的液体创伤敷料进行单因素考察,确定了硝化纤维的最终用量为6%,蓖麻油的使用量为4%,所成薄膜具有良好的机械性能,具有透气性的同时又有着良好的防水效果。硝化纤维为主要的成膜材料,其用量对几个评价指标均有影响,其主要原因是其使用量的不同可造成所成薄膜的厚度不同,即创伤敷料薄膜厚度与硝化纤维用量成正比,其膜的厚度必然影响各项指标性能。蓖麻油作为增塑剂,对处方的影响主要在于:蓖麻油的加入能改变硝化纤维聚合物链之间的结构,使链与链之间的作用力产生变化从而在一定程度上影响薄膜的塑性。其次,蓖麻油的加入,可能堵塞了硝化纤维薄膜的纳米孔道,故呈现出其用量增加透气性能下降的趋势。
皮肤创伤,在临床和日常生活中都较为常见,伤口愈合的速度一定程度上取决于创伤表面环境,创伤表面环境需保持一定的潮湿性,即湿润表面可以加速伤口愈合,因此良好的创伤敷料,应具有一定的透气性,对于日常伤口来说,由于伤口表面的复杂,使用在创伤表面的敷料也应具有一定的机械性能。本实验主要探讨了硝化纤维和蓖麻油的用量对创伤敷料性能的影响,为下一步制备性能更加优良的创伤敷料提供研究基础。
Preparation and formulation optimization of wound dressings with nitrocellu-lose as membrane material
-
摘要:
目的 制备一种以硝化纤维为膜材的创伤敷料,并对其处方进行优化。 方法 对市售产品进行部分分析,采用硝化纤维作为成膜材料,以苯甲醇为抑菌剂,蓖麻油为增塑剂,棕榈酸异丙酯为皮肤柔润剂,樟脑作为芳香剂,以异丙醇、乙酸乙酯、乙酸丁酯为挥发溶剂制备创伤敷料。分别对所成膜的抗张强度、断点伸长百分率、透气防水性能等进行考察评价。 结果 所制备液体创伤敷料成膜性能良好,确定硝化纤维的最终使用量为6%、蓖麻油的使用量为4%。 结论 研究所制得的液体创伤敷料成膜性好,有良好的机械性能,并具备较好的防水能力及一定的透气性能。 Abstract:Objective To prepare a wound dressing using nitrocellulose as a membrane and optimize its formulation. Methods Partial analysis was performed on commercial available products. The wound dressings were prepared by using nitrocellulose as a film-forming material, benzyl alcohol as a bacteriostatic agent, castor oil as a plasticizer, isopropyl palmitate as a skin emollient, camphor as a fragrance, and isopropyl alcohol, ethyl acetate and butyl acetate as volatile solvent. The tensile strength, breakpoint elongation percentage, breathability and waterproof performance were tested and evaluated. Results The film-forming performance of the prepared liquid wound dressing was good. The final use amount of nitrocellulose was determined to be 6%. The use amount of plasticizer castor oil was determined to be 4%. Conclusion The prepared liquid wound dressing has good film-forming property, good mechanical property, good waterproof and certain breathability. -
Key words:
- wound dressing /
- nitrocellulose /
- , formulation optimization
-
免疫介导的炎性眼前段疾病(immune-mediated inflammatory anterior ocular diseases,IIAODs)如春季结膜炎、前葡萄膜炎等是临床上较常见的眼科疾病。局部或全身性使用类固醇是控制这类疾病炎症的主要手段。然而,长期使用类固醇可能会导致白内障、青光眼等,从而存在失明的可能。因此,眼科临床越来越频繁地局部使用免疫抑制剂来治疗这类疾病。
他克莫司(tacrolimus,FK506)作为第二代免疫抑制剂代表性药物,是治疗IIAODs的主要方式之一[1-3]。目前国内上市的FK506眼用制剂为日本千寿药业生产的Talymus®,其药效容易受到泪液冲刷的影响而降低。因此,本研究研制了他克莫司阳离子微乳凝胶(FK506-loaded cationic nanoemulsion-based in-situ gel, FK506 CNE GEL),旨在利用该剂型的特性,延长药物在眼部的滞留时间,提高生物利用度,减少给药频次。本文通过HE染色处理的兔眼组织病理切片观察FK506 CNE GEL的眼部刺激性,并通过建立HPLC-MS测定兔眼房水药物浓度的方法,考察其房水药动学。
1. 材料
1.1 仪器
Agilent 1100型高效液相色谱系统(美国安捷伦公司);AL204 电子天平(梅特勒托利多仪器有限公司);DF-101S集热式恒温加热磁力搅拌器(上海精密试验设备有限公司);NS1001L型高压均质机(意大利Niro Soavi公司);85-1型磁力搅拌器(上海志成电器有限公司);CX31光学显微镜(Olympus Corporation);JY92-2D超声波细胞粉碎机(宁波新芝生物科技股份有限公司);H1850R型台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司);SCIEX QTRAP® 5500 型高压快速液相色谱-三重串联四级杆质谱联用仪(美国AB SCIEX公司)。
1.2 药物与试剂
他克莫司对照品(含量99.3%,福建科瑞药业有限公司);子囊霉素对照品(含量99.5%,上海齐奥化工有限公司);蓖麻油(湖南宏康制药股份有限公司);中链脂肪酸甘油酯(铁岭北亚药用油有限公司);吐温-80(四川金山制药有限公司);泊洛沙姆407、泊洛沙姆188(德国BASF提供);西他氯胺(Sigma-Aldrich);甘油(湖南尔康制药有限公司);注射用水(明澈D24UV);甲醇(上海科丰实业有限公司);他克莫司滴眼液(Talymus®,日本千寿制药株式会社);0.9%氯化钠注射液(国药集团化学试剂有限公司);戊巴比妥钠(Merck 分装);盐酸丙美卡因滴眼液(爱尔凯因®,美国爱尔康眼药厂比利时分厂);其他药品和试剂均为药用规格或分析纯。
1.3 动物
新西兰白兔,雌雄兼用,2.5~3.0 kg,上海斯莱克实验动物有限公司。实验前24 h自由进食、饮水,进行眼部检查以确保无任何眼病。
2. 方法与结果
2.1 FK506 CNE GEL的配制
根据本研究前期报道制备FK506 CNE GEL[4]。首先以蓖麻油(4 %,W/V)、中链脂肪酸甘油酯(6 %,W/V)作为混合油相,西他氯胺(0.02 %,W/V)作为阳离子表面活性剂,吐温−80(1 %,W/V)、泊洛沙姆188(0.1 %,W/V)作为非离子表面活性剂,甘油(2.2 %,W/V)作为渗透压调节剂,通过高压均质制得FK506 CNE(0.1 %,W/V)。而后以26 %泊洛沙姆407和12 %泊洛沙姆188共同作为凝胶基质,将FK506 CNE进一步制备成FK506 CNE GEL(0.1 %,W/V)。
2.2 FK506 CNE GEL的眼部刺激性考察[5-6]
2.2.1 分组给药设计
取实验兔8只,随机分为A、B两组。采用动物同体左右侧自身对比法,A组实验兔左眼滴入FK506 CNEGEL 50 μl,右眼滴入生理盐水50 μl作为对照。B组实验兔左眼滴入市售Talymus® 50 μl,右眼滴入生理盐水50 μl作为对照。给药后使兔眼被动闭合10 s,使药液与局部有充分接触。每日给药3次,连续给药2周。
2.2.2 眼球组织病理切片
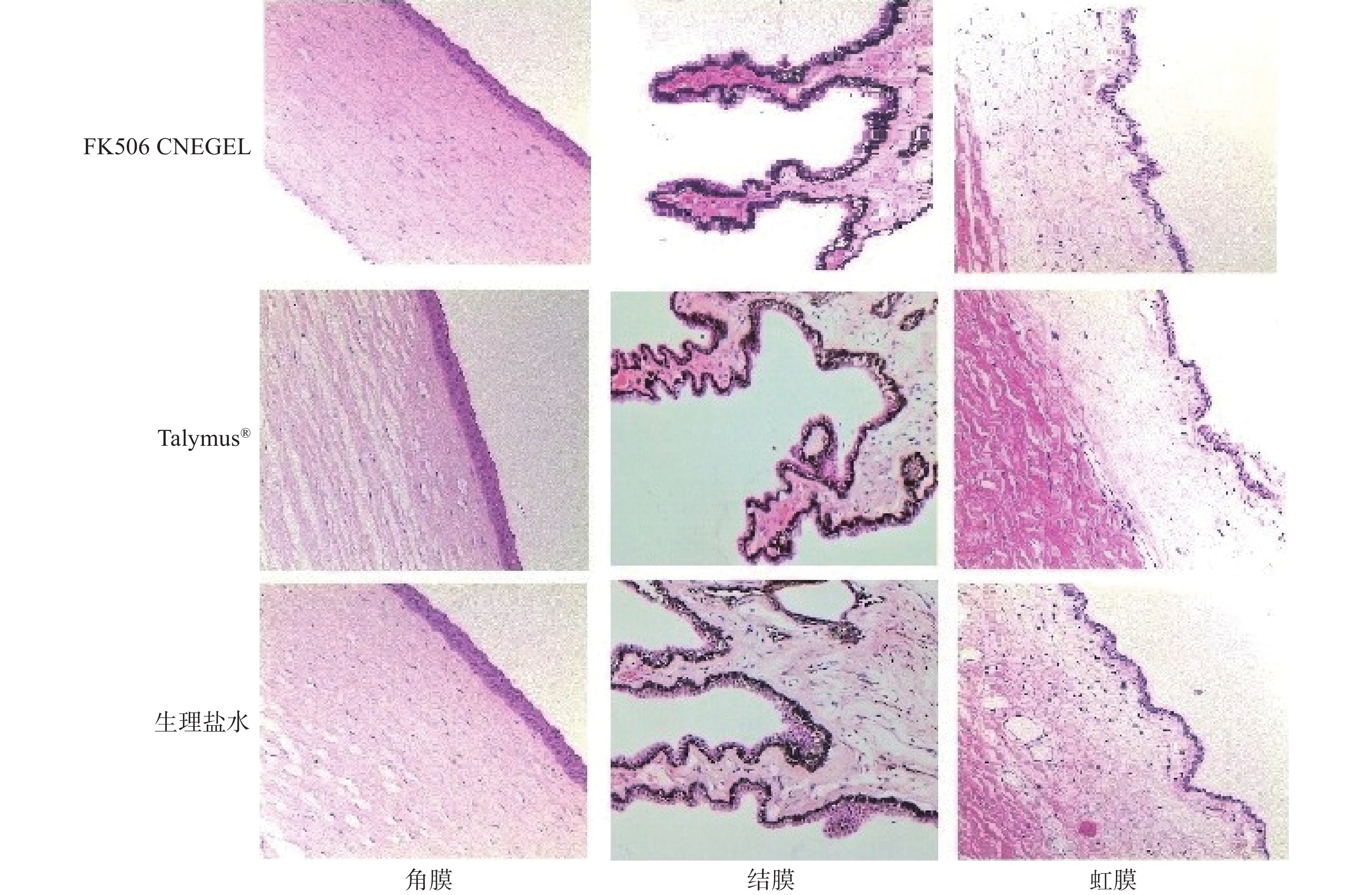
通过耳缘静脉注入空气处死实验兔后取出眼球,进行病理组织切片,详细步骤如下:① 10 %中性福尔马林固定;② 流水冲洗;③ 组织修切平面;④ 组织脱水、石蜡包埋;⑤ 石蜡组织切片;⑥ 二甲苯-无水乙醇脱蜡;⑦ 苏木素-伊红染色;⑧ 小浓度氨水返蓝;⑨ 脱水、复染、洗涤;⑩ 继续脱水后封片。光学显微镜下观察兔眼角膜,虹膜,结膜并拍照,试验结果见图1。
一般情况下,兔眼较人眼对刺激反应更为敏感。图1为显微镜下滴入FK506 CNE GEL、Talymus®及生理盐水后的兔眼角膜、虹膜及结膜结构。对比可见,滴入FK506 CNE GEL后兔眼角膜组织排列规则有序、纹理清晰;虹膜各层组织结构清晰,无明显异常;结膜组织清晰可见,未见坏死及炎性细胞浸润,与生理盐水组及Talymus®组对比无明显差异。结果表明,FK506 CNE GEL对兔眼角膜、虹膜及结膜均无明显刺激性。
2.3 FK506 CNE GEL房水药动学研究[7-10]
2.3.1 色谱条件
采用Agilent 1100型高效液相色谱仪,色谱柱为Agilent Poroshell 120 EC-C18 (2.1 mm×50 mm, 2.7 μm),流动相为甲醇-水(2 mmol/L醋酸铵)(90∶10, v/v),柱温为40 ℃,流速为0.3 ml/min,进样量为1 μl。
2.3.2 质谱条件
采用SCIEX QTRAP® 5500 型高压快速液相色谱-三重串联四级杆质谱联用仪以ESI正离子电离方式检测,扫描方式为多反应监测(MRM),扫描时间为100 ms,离子源电离电压为5 500 V,离子源温度为550 ℃,雾化气流流速为7 L/min。以上述质谱条件对FK506及子囊霉素(ascomycin ,FK520)进行离子扫描,结果如表1所示。根据扫描结果,选择m/z 821.5→768.4 作为 FK506 定量分析离子对,m/z 821.5→576.3 作为其定性分析离子对;选择m/z 809.5→756.5作为FK520定量分析离子对,m/z 809.5→564.3 作为其定性分析离子对。
表 1 FK506和FK520的质谱行为分析参数 FK506 FK520 分子量 804.2 792.4 定性分析的离子反应(m/z) 821.5→576.3 809.5→564.3 碎裂能量(CE, V) 31.2 29.0 定量分析的离子反应(m/z) 821.5→768.4 809.5→756.5 碎裂能量(CE, V) 28.0 26.1 解簇电压(DP, V) 120 45 2.3.3 房水样品的制备
精密移取房水样品30 μl置于2 ml离心管中,加入50 μl FK520内标液(100 ng/ml)及120 μl甲醇,涡旋混合,12 000 r/min离心15 min,取上清液进样分析。
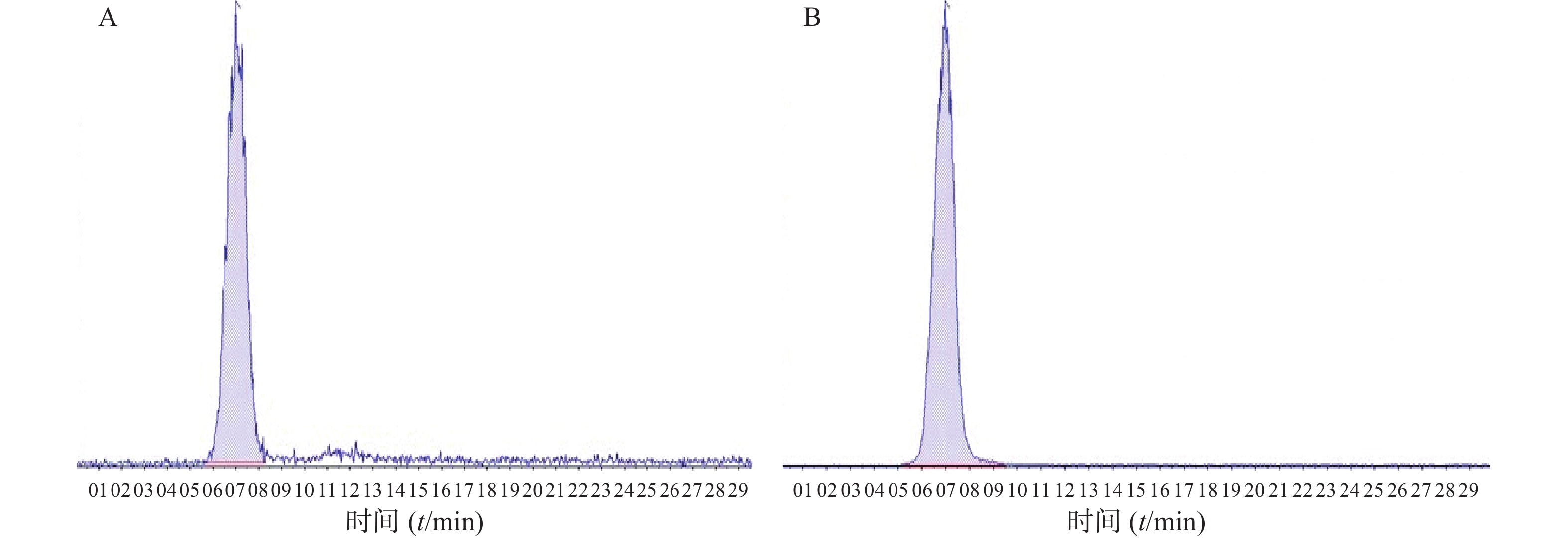
2.3.4 方法专属性考察
取空白房水30 μl,将一定浓度的FK506和FK520标准溶液分别加入空白房水中,按照“2.3.3”项下方法处理,记录谱图。结果如图2所示,表明房水中内源性物质对FK506的测定无干扰,方法专属性良好。
2.3.5 标准曲线和定量限
精密移取空白房水 30 μl置于2 ml离心管中,加入不同量的100 ng/ml FK506标准溶液及50 μl FK520内标液(100 ng/ml),加入甲醇使总量达200 μl制成系列浓度50、25、10、5、2.5、1、0.5 ng/ml的FK506溶液,12 000 r/min离心15 min,液质联用仪进样分析,记录对应图谱。以FK506峰面积Ai与FK520峰面积As的比值Ai/As作为纵坐标,以FK506浓度C(ng/ml)为横坐标进行线性回归,得线性回归方程:A=0.324 75C+0.05577,r=0.999 96。结果表明FK506在0.5~50 ng/ml浓度范围内线性关系良好,定量限为0.5 ng/ml。
2.3.6 方法精密度考察
配制浓度为1、10、30 ng/ml的FK506样品,按照“2.3.3”项下方法处理,于1 d内重复测定5次,连续测定5 d,考察方法的日内、日间精密度。根据测得浓度与理论浓度比值计算方法回收率,结果见表2。结果表明,日内、日间精密度RSD<2%,精密度良好。
表 2 方法精密度试验结果时间 浓度
(ng/ml)序号 平均值 RSD
(%)1 2 3 4 5 日内 1 1.00 0.97 0.98 0.98 0.96 0.98 1.52 10 9.91 9.98 9.92 9.97 9.94 9.94 0.31 30 29.96 29.95 29.96 29.87 29.98 29.94 0.09 日间 1 0.99 0.98 1.97 0.96 1.01 1.18 0.37 10 9.96 9.98 9.95 9.97 9.98 9.97 0.13 30 29.98 29.96 29.96 30.01 29.95 29.97 0.05 2.3.7 方法重复性考察
配制浓度为1、10、30 ng/ml的房水样品各3份,按照“2.3.3”项下方法处理,1 d内测定。结果见表3,表明3个样品浓度RSD<2%,重复性良好。
表 3 方法重复性试验结果浓度
(ng/ml)序号 平均值 RSD
(%)1 2 3 1 0.98 0.96 0.97 0.97 1.03 10 9.97 9.93 9.96 9.95 0.21 30 29.93 29.98 29.92 29.94 0.06 2.3.8 回收率试验
取FK506浓度为1、10、30 ng/ml样品各3份,按照“2.3.3”项下方法处理并测定,记录FK506峰面积为A1;取空白房水同法萃取,于分离的上清液中加入对应浓度等量的FK506和FK520,测定并记录FK506峰面积A2。按提取回收率公式(A1/A2)×100 %算得FK506的提取回收率。结果表明,FK506在各个浓度的提取回收率分别为(78.14±4.21)%、(78.32±4.55)%、(76.56±4.35)%,符合体内药动学研究的相关指标。
2.3.9 分组给药设计
将实验兔随机分成A、B两组,每组6只,共12只。A组实验兔(A1~A6)左眼给予Talymus®,右眼给予自制FK506 CNE;B组实验兔(B1~B6)左眼给予FK506 CNE GEL,右眼给予FK506 CNE。实验前24 h自由进食、饮水,并进行眼部检查,以确保无任何疾病。于给药点用开睑器撑开实验兔眼睑,使用移液枪往实验兔左、右眼分别滴入等量药液50 μl,按压实验兔眼睑使之被动闭合约10 s使药物分布均匀。
2.3.10 统计学分析
采用SPSS统计软件进行独立样本t检验分析,当P<0.05时,统计学有显著性差异。实验数据均以(
$ \bar x \pm s $ )表示。2.3.11 样品采集
提前给予实验兔1 %戊巴比妥钠(0.6 ml/kg)进行耳缘静脉麻醉,并于采样前使用盐酸丙美卡因滴眼液进行局麻。接着,用镊子固定眼球后采用角膜穿刺术抽取房水,分别于给药后0.5、1、1.5、2、2.5、3、4、6、8、10 h时间点采样。A1~A3实验兔于给药后0.5、1.5、2.5、4、8 h各抽取房水30 μl,A4~A6实验兔于给药后1、2、3、6、10 h各抽取房水30 μl。B1~B3实验兔于给药后0.5、1.5、2.5、4、8 h各抽取房水30 μl,B4~B6实验兔于给药后1、2、3、6、10 h各抽取房水30 μl。
2.3.12 数据处理分析
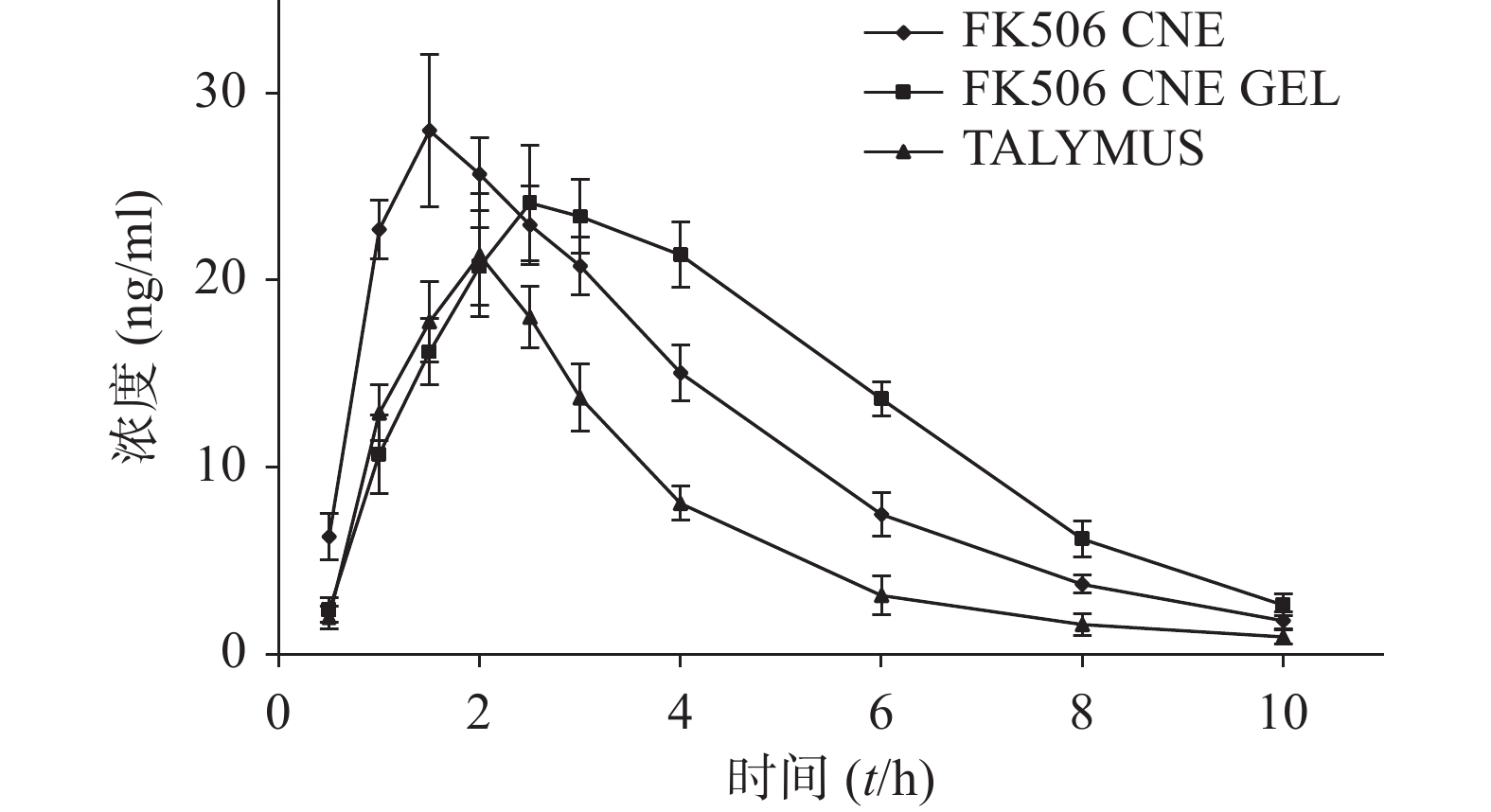
以房水样品中FK506浓度C(ng/ml)为纵坐标,以时间T(h)为横坐标作图,得药-时曲线图3及对应药动学参数表4。
表 4 给予FK506三种制剂后的房水药动学参数(n=3)药动学参数 FK506 CNE Talymus® FK506 CNE GEL AUC(ng·h /ml) 113.61±12.36* 68.25±10.82 128.34±13.09*# c max (ng/ml) 28.02±4.07 21.34±3.31 24.14±3.10 t max (t/h) 1.50±0.20* 2.00±0.17 2.50±0.25*# ka (h-1) 2.16±0.51* 1.14±0.90 0.94±0.08*# ke (h-1) 0.34±0.02* 0.41±0.05 0.32±0.02*# MRT (t/h) 3.46±0.28* 3.23±0.24 4.23±0.34*# *P<0.05,与Talymus®比较;#P<0.05,与FK 506 CNE比较 由表4可见,MRT(CNE GEL)>MRT(CNE)>MRT(Talymus®),即FK506 CNE GEL的平均滞留时间最长,表明FK506 CNE GEL在角膜的滞留时间最长。此外,AUC(Talymus®)为(68.25±10.82) ng·h /ml,AUC(CNE)为(113.61±12.36)ng·h /ml,AUC(CNE GEL)为(128.34±13.09)ng·h /ml。三者对比得AUC(CNE GEL)是AUC(CNE)的1.13倍,是AUC(Talymus®)的1.88倍,说明FK506 CNE GEL的生物利用度较高。
3. 讨论
3.1 FK506 CNE GEL的辅料
FK506 CNE GEL所采用的辅料都是安全、无刺激的,例如采用的阳离子材料为阳离子表面活性剂西他氯胺(CKC)。CKC作为眼药水中常用的防腐剂苯扎氯胺的一个组分,其安全性已得到保证,且CKC在市售产品空白阳离子纳米乳Cationorm®和口腔软膏Bonjela®中广泛使用,其临床安全性得到进一步证实。此外,采用的凝胶基质为P407/P188。由于非离子型表面活性剂泊洛沙姆无毒、无刺激,不仅可以通过空间位阻效应稳定纳米乳而且具有模拟黏膜的性质,是温敏型原位凝胶最常用的凝胶基质,同样安全性也能得到保证。其他辅料如蓖麻油、MCT、吐温-80和甘油均是常用的眼用制剂辅料之一。
3.2 FK506 CNE GEL的药动学参数
药动学参数t max (CNE GEL)>t max (Talymus®)>t max (CNE),说明FK506 CNE GEL的达峰时间最长。这是因为FK506 CNE GEL在角膜表面形成一层凝胶且其所带正电荷能与带负电荷的角膜发生静电吸引作用,从而延长其在眼部的滞留时间,缓慢而持续地释放药物,使药物作用时间延长,达峰时间延迟。而ka (CNE)>ka (Talymus®)>ka (CNE GEL)同样证实了这一点,由于FK506 CNE和Talymus®是水溶性滴眼液,相较于FK506 CNE GEL,释放药物透过角膜被吸收的速度相对较快,故FK506 CNE GEL被吸收的速度最慢。而Talymus®的粒径(1671.5±66.3)nm较FK506 CNE的粒径(178.8±2.7)nm大,故FK506 CNE相较而言吸收快、达峰时间短。
由于泪液冲刷及鼻泪管排泄,房水药物浓度随时间延长而降低。由药时曲线可见,在给药后2~4 h,Talymus®的消除曲线下降趋势最为陡峭,FK506 CNE次之,而FK506 CNE GEL的消除曲线最为平缓。ke (Talymus®)>ke (CNE)>ke (CNE GEL)同样说明FK506 CNE GEL在眼部被消除的速度最慢,相较另外两种制剂而言,明显延缓了药物从前房的消除。
综上所述,FK506 CNE GEL对兔眼无明显刺激性,给药后能黏附于黏膜表面,延长药物作用时间,提高药物生物利用度,减少给药频次。有望成为一种眼部安全性高、滞留时间长的FK506眼用制剂,其研发成功将为眼科临床提供更多选择,为IIAODs患者的临床治疗提供帮助。
-
[1] WINTER G D. Formation of the scab and the rate of epithelisation of superficial wounds in the skin of the young domestic pig. 1962[J]. J Wound Care,1995,4(8):366-371. doi: 10.12968/jowc.1995.4.8.366 [2] EAGLSTEIN W H, SULLIVAN T P, GIORDANO P A, et al. A liquid adhesive bandage for the treatment of minor cuts and abrasions[J]. Dermatol Surg,2002,28(3):263-267. [3] CASPER K A. OTC product: band-aid liquid bandage[J]. J Am Pharm Assoc,2006,46(6):768. doi: 10.1331/1544-3191.46.6.768.Casper [4] GREIG, LY NN. First aid for minor burns, cuts and grazes[J]. Australian Pharmacist,2012,31(6):464-465. [5] ZHANG D, ZHOU W, WEI B, et al. Carboxyl-modified poly(vinyl alcohol)-crosslinked chitosan hydrogel films for potential wound dressing[J]. Carbohydr Polym,2015,125:189-199. doi: 10.1016/j.carbpol.2015.02.034 [6] SIRITIENTONG T, RATANAVARAPORN J, SRICHANA T, et al. Preliminary characterization of genipin-cross-linked silk sericin/poly(vinyl alcohol) films as two-dimensional wound dressings for the healing of superficial wounds[J]. Biomed Res Int,2013,19(6):235-246. [7] ROBINS P, GOLDBERG L, MOY R, et al. The effectiveness of liquid bandage as an adhesive and antimicrobial agent[J]. J Drugs Dermatol,2008,7(8):764-766. [8] WOO K Y, CHAKRAVARTHY D. A laboratory comparison between two liquid skin barrier products[J]. Int Wound J,2014,11(5):561-566. doi: 10.1111/iwj.12325 [9] DU L N, TONG L, JIN Y G, et al. A multifunctional in situ-forming hydrogel for wound healing[J]. Wound Repair Regen,2012,20(6):904-910. doi: 10.1111/j.1524-475X.2012.00848.x [10] HUANG Y C, CHU H W, HUANG C C, et al. Alkali-treated konjac glucomannan film as a novel wound dressing[J]. Carbohydr Polym,2015,117:778-787. doi: 10.1016/j.carbpol.2014.10.047 -





 下载:
下载:

 下载:
下载: