-
心脑血管疾病是由于血液黏稠、动脉粥样硬化等导致的心脏、脑部乃至整个身体组织层面上的健康障碍[1]。目前对这类疾病的常规治疗方法主要集中在手术干预和药物调理,涉及到血管扩充、减少颅内高压、维持生理功能和针对性治疗等,然而这些方法往往伴随多种不良反应,并且患者的康复预期通常不是很乐观[2-4]。传统医学认为心脑血管疾病属“胸痹”、“心痛”、“中风”范畴[5]。中医药一方面可以改善微循环、保护神经功能,另一方面可以益气活血,改善心脑血管引起的不适症状。
血通胶囊为黄浦区香山中医医院特色院内制剂,处方由水蛭、大黄、何首乌三味药材组成,具有化瘀活血、通络降脂等功效,主治动脉粥样硬化、高脂血症、中风后遗症等疾病,疗效确切,安全性好[6-7]。但血通胶囊在临床应用仍有一定局限性:制剂工艺落后,采用药材原粉直接入药,服用量大,卫生学检查难以合格;制剂稳定性差等。依照2020年国家市场监督管理总局发布的《药品注册管理办法》及2023年国家药品监督管理局发布的《中药注册管理专门规定》的要求,本研究采用了正交试验设计方法来优化提取工艺。同时,针对何首乌与大黄含有的5种蒽醌类化合物,建立了高效液相色谱(HPLC)的定量分析方法,为血通胶囊的质量控制指标提供了一套新的量化检测指标。
-
LC-20AD岛津高效液相色谱仪、ShimNex C18-AQ色谱柱(4.6 mm×250 mm,5 μm)(日本岛津公司);XS105DU分析天平[梅特勒-托利多仪器(上海)有限公司];100SD极脉超声波清洗机(深圳市超洁科技实业有限公司)。
-
乙腈(HPLC梯度级,批号:0134240402D,上海星可高纯溶剂有限公司)、无水乙醇(分析纯,批号:20231213)、磷酸(HPLC梯度级,批号:20230807)、盐酸(分析纯,批号:20230331)、三氯甲烷(分析纯,批号:20220901)均购于国药集团化学试剂有限公司;何首乌(批号:2023041002,上海华济药业有限公司,经上海中医药大学附属龙华医院史秀峰主任药师鉴定为蓼科植物何首乌Polygonum multiflorum Thunb.的干燥块根)、大黄(批号:2023021901,上海华济药业有限公司,经上海中医药大学附属龙华医院史秀峰主任药师鉴定为蓼科植物掌叶大黄Rheum palmatum L.、唐古特大黄 Rheum tanguticum Maxim. ex Balf.或药用大黄 Rheum officinale Baill.的干燥根和根茎)、芦荟大黄素(含量97.5%,批号:110795-202211)、二苯乙烯苷(含量97.9%,批号:10844-202317)、大黄酸(含量95%,批号:110757-202308)、大黄素(含量96.0%,批号:110756-201913)、大黄酚(含量99.8%,批号:110796-202011)、大黄素甲醚(含量98.9%,批号:110758-202218)均购于中国食品药品检定研究院;血通胶囊(批号:240101、240102、240103,上海市黄浦区香山中医医院自制制剂)。
-
ShimNex C18-AQ色谱柱(4.6 mm×250 mm,5 μm);流动相为乙腈(A)-0.1%磷酸溶液(B),梯度洗脱(0~15 min,17%A;15~40 min,17%~80%A;40~50 min,80%A);检测波长:双波长254 nm(芦荟大黄素)、320 nm(二苯乙烯苷);流速:1.0 ml/min;进样量:10 μl。
-
取二苯乙烯苷、芦荟大黄素对照品适量,精密称定,置于棕色量瓶中,加稀乙醇溶解稀释,定容,摇匀即得429.98 μg/ml芦荟大黄素、323.07 μg/ml二苯乙烯苷混合对照品溶液。
-
称取0.4 g干膏粉,置具塞锥形瓶中,加入稀乙醇25 ml,称定重量,加热回流30 min,放冷,称定重量,用稀乙醇补足重量,摇匀,静置,上清液滤过,即得。
-
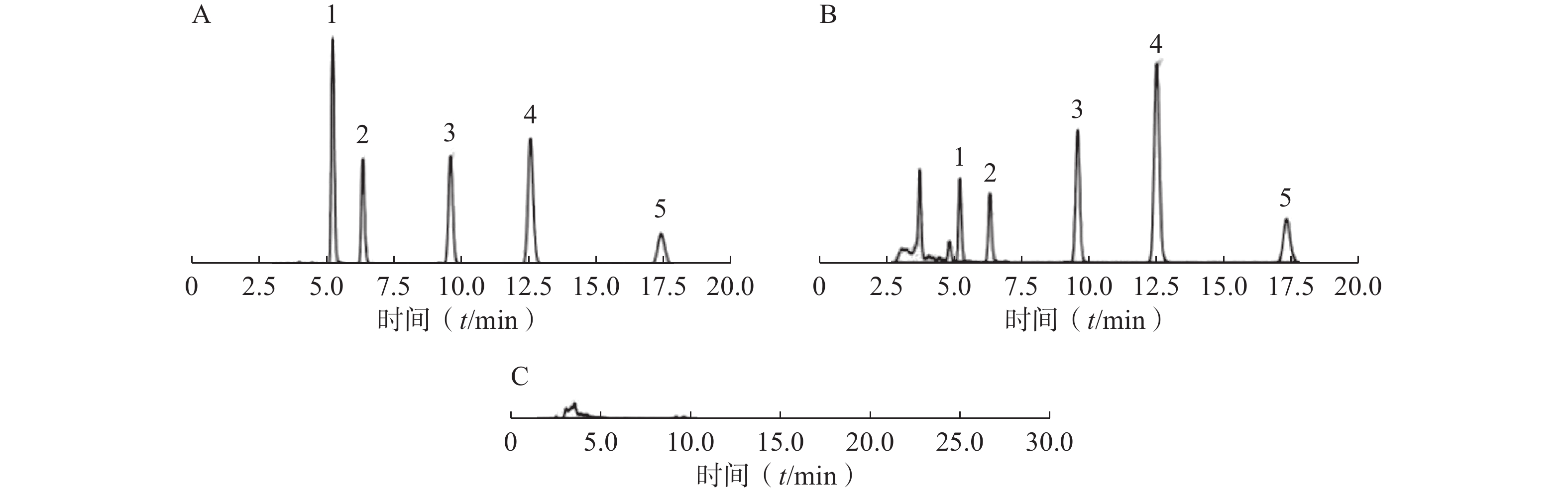
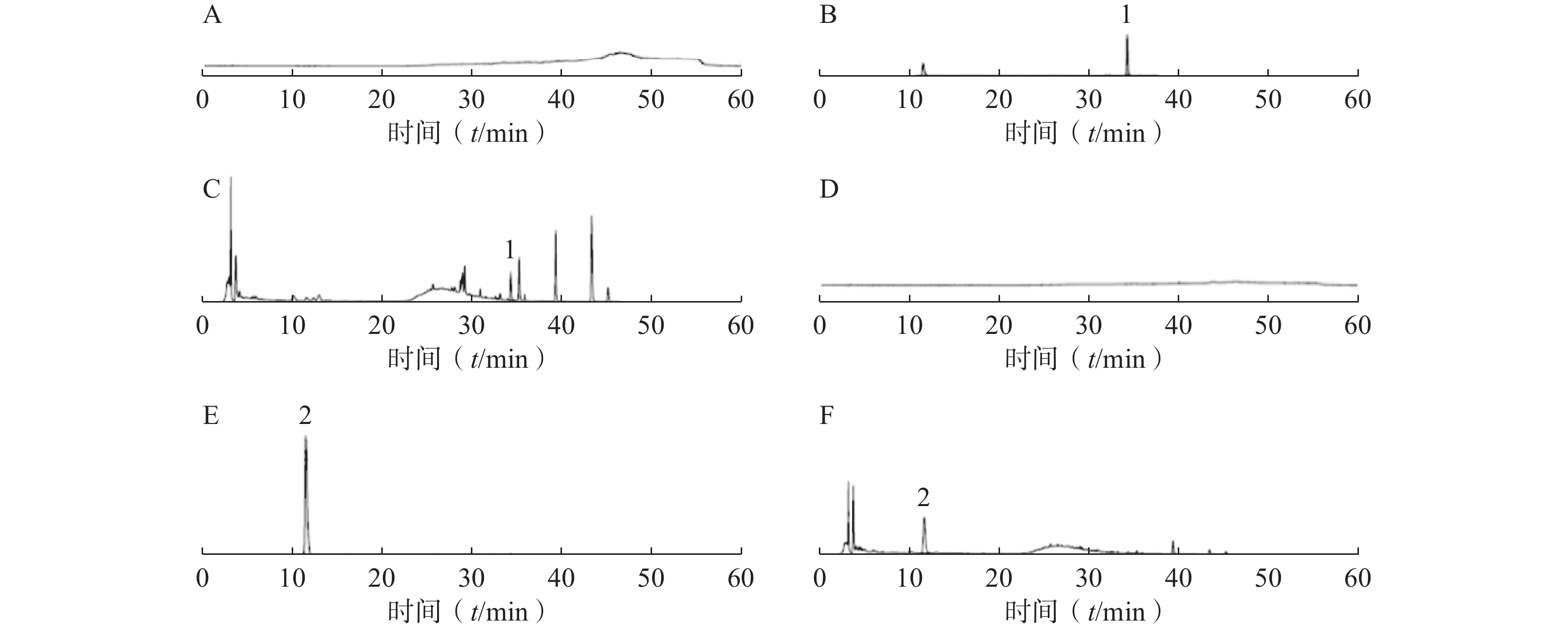
按照2.1.1项下色谱条件,分别精密吸取混合对照品溶液、供试品溶液和空白溶剂稀乙醇溶液各10 μl进样测定。结果显示,供试品溶液色谱图与对照品溶液色谱图相同的保留时间上有相同的色谱峰,而空白溶剂稀乙醇溶液在同一位置没有检查到色谱峰,表明专属性良好,见图1。
-
取2.1.2项下对照品溶液适量,加稀乙醇按比例稀释,定容至刻度,混匀,使二苯乙烯苷的含量为20.19、40.38、80.77、161.54、323.07 μg/ml,芦荟大黄素的含量为26.87、53.75、107.49、214.99、429.98 μg/ml。按2.1.1项下色谱条件进样10 μl,测定峰面积(Y),以样品浓度(X)进行线性回归,计算回归方程。二苯乙烯苷:Y=42 381 X−15 930,r=0.999 8;芦荟大黄素:Y=15 707 X+9 782.4,r=0.999 8。结果表明,二苯乙烯苷在20.19~323.07 μg/ml、芦荟大黄素在26.87~429.98 μg/ml范围内线性关系良好。
-
精密吸取混合对照品溶液10 μl,按2.1.1项下色谱条件重复进样5次,按峰面积计算二苯乙烯苷、芦荟大黄素的RSD分别为0.29%、0.17%(n = 5)。表明仪器精密度良好。
-
按2.1.3项下供试品溶液制备方法制备供试品溶液,精密吸取10 μl,按2.1.1项下色谱条件分别在0、2、4、6、8 h各进样1次,记录峰面积,计算得到二苯乙烯苷、芦荟大黄素的RSD分别为0.24%、0.75%(n=5),表明供试品溶液在8 h内稳定。
-
按2.1.3项下供试品溶液制备方法制备供试品溶液5份,精密吸取10 μl,按2.1.1项下色谱条件进样测定,记录峰面积,计算得到二苯乙烯苷、芦荟大黄素的含量分别为6.05、6.60 mg/g;RSD分别为0.14%、0.55%(n=5),表明方法的重复性良好。
-
取已知二苯乙烯苷、芦荟大黄素含量的浸膏粉9份,每份约0.4 g,精密称定,分别加入相当于二苯乙烯苷、芦荟大黄素含量80%、100%、120%的对照品溶液适量,按2.1.3项下制备供试品溶液,并测定含量,计算样品的加样回收率。结果二苯乙烯苷的平均加样回收率为98.57%,RSD为0.98%(n=9);芦荟大黄素的平均加样回收率为97.55%,RSD为1.10%(n=9)。
-
选择乙醇回流法对何首乌和大黄进行提取。利用正交试验设计手段,本研究以何首乌中的二苯乙烯苷和大黄中的芦荟大黄素含量及其浸膏得率作为评价指标,对乙醇用量(因素A)、乙醇浓度(因素B)、提取时间(因素C)、提取次数(因素D)进行考察,见表1。
表 1 正交试验因素水平表
水平 因素A
乙醇用量(倍)因素B
乙醇浓度(%)因素C
提取时间(t/h)因素D
提取次数(次)1 6 60 1 1 2 8 70 1.5 2 3 10 80 2 3 -
称取何首乌和大黄饮片各10 g,根据正交试验设计安排表进行实验(表2)。乙醇回流法提取,每组提取后合并提取液,过滤,减压浓缩回收乙醇至稠膏状,放置于真空干燥箱内(设定温度为60℃~75℃,压力控制在0.04~0.08 MPa,持续时间12~24 h)进行烘干处理。烘干完毕的物料经过粉碎成干燥的膏状粉末。然后,通过测量该粉末的质量来计算提取率,并据此得到浸膏的提取效率。
表 2 正交试验分析表
试验号 因素
A因素
B因素
C因素
D二苯乙烯
苷含量
(mg/g)芦荟大黄
素含量
(mg/g)浸膏
得率
(%)综合
评分1 1 1 1 1 3.335 5.096 19.4 0.63 2 1 2 2 2 4.996 6.162 25.8 0.85 3 1 3 3 3 5.725 6.549 25.6 0.89 4 2 1 2 3 5.155 5.228 29.5 0.87 5 2 2 3 1 5.128 6.714 20.2 0.80 6 2 3 1 2 2.458 7.114 23.5 0.73 7 3 1 3 2 5.172 5.086 29.4 0.86 8 3 2 1 3 6.064 6.694 28.6 0.96 9 3 3 2 1 3.145 7.427 19.9 0.73 K1 2.375 2.360 2.320 2.158 K2 2.393 2.603 2.438 2.434 K3 2.544 2.348 2.554 2.719 R 0.169 0.255 0.234 0.561 -
依据所得二苯乙烯苷、芦荟大黄素的含量以及浸膏得率,按公式[综合评分=0.3×二苯乙烯苷含量/实验中二苯乙烯苷含量最大值+0.3×芦荟大黄素含量/实验中芦荟大黄素含量最大值+0.4×浸膏得率/实验中浸膏得率最大值],计算综合评分,见表2、表3。
表 3 综合评分正交试验方差分析表
变异来源 离差平方和
(SS)自由度
(df)均方
(MS)F值 P 因素B 0.014 2 0.007 2.333 0.30 因素C 0.009 2 0.004 1.430 0.41 因素D 0.052 2 0.026 8.430 0.11 因素A(含误差) 0.006 2 0.003 由表2、表3可见,各因素对乙醇回流法无显著性影响(P>0.05),根据影响力大小排序为:D>B>C>A。正交试验结果得出最佳提取工艺条件为A3B2C1D3。考虑到节约资源、提高效率的原则,参考评分结果,确定最佳工艺为A3B2C1D3,即加入处方药材质量10倍的70%乙醇,提取3次,每次1 h。
-
称取正交试验处方量药材3份,按最佳工艺进行验证实验,浸膏得率平均值为28.80%,RSD为0.73%(n=3);二苯乙烯苷和芦荟大黄素平均含量分别为6.04、6.60 mg/g,RSD分别为0.25%、0.80% (n=3),说明优选的提取工艺稳定、可行。
-
色谱柱:ShimNex C18-AQ柱,4.6 mm×250 mm,5 μm;流动相:甲醇-0.1%磷酸溶液=85∶15,检测波长:254 nm,流速:1.0 ml/min,进样量:10 μl。
-
精密称取芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚适量,置于100 ml量瓶中,加适量甲醇超声、水浴加热使其充分溶解,放置室温后再用甲醇定容至刻度,制成含芦荟大黄素106.67 μg/ml、大黄酸104.41 μg/ml、大黄素207.74 μg/ml、大黄酚210.38 μg/ml和大黄素甲醚191.47 μg/ml的混合对照品溶液,备用。
-
精密称定优化提取工艺后制备的血通胶囊样品(批号:240101)0.45 g,置具塞锥形瓶中,加入甲醇25 ml,称定重量,加热回流1 h,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过。精密量取续滤液5 ml,至烧瓶中,挥去溶剂,加8%的盐酸溶液10 ml,加热回流1 h,放冷,至分液漏斗中,用少量三氯甲烷洗涤容器,并入分液漏斗中,分取三氯甲烷层,酸液再用三氯甲烷提取3次,每次10 ml,合并溶液,减压回收溶剂至干,残渣加甲醇溶解,转移至10 ml量瓶中,加甲醇至刻度,摇匀,滤过,取续滤液,即得。
-
按血通胶囊处方比例称取除大黄、何首乌外的药材适量,按照处方工艺及供试品溶液制备方法,制得阴性对照溶液。
-
按照3.1项下色谱条件,分别精密吸取混合对照品溶液、供试品溶液和阴性对照溶液各10 μl进样测定。结果显示,供试品溶液色谱图与对照品溶液色谱图相同的保留时间上有相同的色谱峰,而阴性对照溶液在同一位置没有检查到色谱峰,表明专属性良好,见图2。
-
取3.2项下对照品溶液适量,加甲醇稀释,定容至刻度,混匀,使芦荟大黄素的含量为2.73、6.83、17.07、42.67、106.67 μg/ml,大黄酸含量为2.67、6.68、16.70、41.76、104.41 μg/ml,大黄素含量为5.32、13.30、33.24、83.10、207.74 μg/ml,大黄酚含量为5.39、13.46、33.66、84.15、210.38 μg/ml,大黄素甲醚含量为4.90、12.25、30.64、75.59、191.47 μg/ml。按3.1项下色谱条件进样10 μl,测定峰面积(Y),以样品浓度(X)进行线性回归,计算回归方程。芦荟大黄素:Y=51 669 X+13 430,r=0.999 8;大黄酸:Y=42 556 X−62 801,r=0.999 7;大黄素:Y=39 484 X−51 629,r=0.999 8;大黄酚:Y=53 244 X−69 950,r=0.999 9;大黄素甲醚:Y=15 518 X+4 047,r=0.999 8。结果表明,芦荟大黄素在2.73~106.67 μg/ml、大黄酸在2.67~104.41 μg/ml、大黄素在5.32~207.74 μg/ml、大黄酚在5.39~210.38 μg/ml、大黄素甲醚在4.90~191.47 μg/ml范围内线性关系良好。
-
精密吸取对照品混合溶液10 μl,按3.1项下色谱条件重复进样5次,按峰面积计算芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的RSD,分别为0.52%、0.20%、0.57%、0.26%和0.84%(n = 5)。表明仪器精密度良好。
-
按3.3项下供试品溶液制备方法制备血通胶囊供试品溶液(批号:240101),精密吸取10 μl,按3.1项下色谱条件分别在0、2、4、6、8 h各进样1次,记录峰面积,计算得到芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的RSD分别为0.38%、0.57%、0.59%、0.60%和0.58%(n=5),表明供试品溶液在8 h内稳定。
-
按3.3项下供试品溶液制备方法制备血通胶囊供试品溶液(批号240101)6份,精密吸取10 μl,按3.1项下色谱条件进样测定,记录峰面积,计算得到芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的含量分别为0.635、0.677、1.965、2.518、1.070 mg/g;RSD分别为0.96%、0.87%、0.47%、0.89% 和0.72%(n=6),表明方法的重复性良好。
-
取同一批号已知芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚含量的血通胶囊9份(批号:240101),每份约0.45 g,精密称定,分别加入相对于5种蒽醌类成分含量80%、100%、120%的对照品溶液适量,按3.3项下制备供试品溶液并测定含量,计算样品的加样回收率。结果芦荟大黄素96.85%,RSD为1.62% (n=9);大黄酸95.76%,RSD为1.48%(n=9);大黄素95.64%,RSD为1.66%(n=9);大黄酚93.66%,RSD为1.56%(n=9);大黄素甲醚94.71%,RSD为1.64%(n = 9)。
-
取3批血通胶囊样品约0.45 g,分别按3.3项下供试品溶液制备方法平行制备9份供试品溶液,按3.1色谱条件测定峰面积,计算含量,结果见表4。
表 4 血通胶囊蒽醌类成分含量测定结果(n = 3)
批号 芦荟大黄素 大黄酸 大黄素 大黄酚 大黄素甲醚 含量(mg/g) RSD(%) 含量(mg/g) RSD(%) 含量(mg/g) RSD(%) 含量(mg/g) RSD(%) 含量(mg/g) RSD(%) 240101 0.632 0.133 0.681 0.851 1.968 0.102 2.570 0.354 1.101 0.196 240102 0.637 0.471 0.660 0.313 1.970 0.154 2.580 0.424 1.079 0.352 240103 0.641 0.545 0.681 0.73 1.991 0.253 2.547 0.127 1.076 0.382 -
血通胶囊原制剂工艺中,水蛭、大黄、何首乌三味药材均为药材原粉入药,制剂服用量偏大,卫生学检查难以合格,因此,本研究分别对大黄、何首乌二味药材的提取工艺进行了筛选优化。张绵松等[8]研究证实何首乌醇提物体外抗氧和抑菌作用明显强于水提物。李冰韶等[9]研究发现,大黄醇提物中蒽醌类成分含量高于水提物,且降脂效果更强。因此,本研究选择乙醇回流法对何首乌和大黄进行提取,采用正交试验设计法对乙醇用量、浓度、提取时间、次数等因素进行考察。
正交试验结果显示,血通胶囊提取物中二苯乙烯苷含量、芦荟大黄素含量、浸膏得率综合评分最高是实验8,根据直观分析可知,被考察因素对综合评分重要性排序为因素D>因素B>因素C>因素A,确定最优提取工艺为A3B2C1D3,即加10倍乙醇,乙醇浓度70%,提取3次,每次1 h。验证实验结果表明该方法重复性好,提取效率较高。
-
血通胶囊的原始质量控制标准仅有的薄层色谱法定性鉴别,并未设立定量的质量控制标准。本研究根据2020年版发布的《中国药典》所列出的规范[10],对血通胶囊中5个蒽醌类化合物进行含量测定。检测结果显示,3批血通胶囊蒽醌类成分含量稳定,表明该提取方法制备的血通胶囊稳定可靠。本研究结果为血通胶囊的质量控制及进一步研究奠定基础。
Extraction process optimization and quality control of Xuetong capsules
-
摘要:
目的 优化血通胶囊提取工艺,建立质量控制方法。 方法 采用乙醇回流法,通过正交试验考察不同因素对二苯乙烯苷、芦荟大黄素、浸膏得率的影响;采用HPLC法同时测定血通胶囊5种蒽醌类成分含量。 结果 最佳提取工艺为加10倍乙醇,乙醇浓度70%, 提取3次,每次1 h;5种成分在一定浓度范围内与峰面积具有良好的线性关系, 相关系数r均>0.999 7;平均加样回收率在93.66%~96.85%之间,RSD范围在1.48%~1.66%。3 批血通胶囊中5种成分的含量测定结果分别为(0.632~0.641)、(0.660~0.681)、(1.968~1.991)、(2.547~2.580)、(1.076~1.101) mg/g。 结论 该方法准确、重复性好、可行性高,对血通胶囊生产和质量控制标准提高具有参考意义。 Abstract:Objective To optimize the extraction process of Xuetong capsules and establish its quality control method. Methods The extraction process was optimized by orthogonal experiment using ethanol reflux method to investigate the effects of different factors on diphenylstilbene, aloin and extraction yield. The content of 5 anthraquinone compounds in Xuetong capsule was determined by HPLC. Results The optimal extraction process was to add 10 times ethanol, with an ethanol concentration of 70%, and extract 3 times, each time for 1 h; 5 components had a good linear relationship with peak area within a certain concentration range, r>0.999 7; The range of sample recovery rate was 93.66%-96.85%, RSD range of 1.48%-1.66%. The content determination results of the 5 components in three batches of Xuetong capsules were (0.632-0.641), (0.660-0.681), (1.968-1.991), (2.547-2.580), and (1.076-1.101) mg/g. Conclusion The method was accurate, reproducible, and highly feasible, which could be references for producing and improving the quality control standards of Xuetong capsules. -
三阴性乳腺癌(triple-negative breast cancer,TNBC)临床特点表现为转移能力强、复发率高和患者预后差,是目前威胁女性健康常见的恶性肿瘤之一[1-3]。由于其细胞表面不表达孕酮受体、雌激素受体以及表皮生长因子受体,使得常规靶向疗法对TNBC收效甚微,目前临床治疗手段仍以传统的化疗为主。然而TNBC除了不表达多种激素受体外,往往也伴随着乳腺癌基因(breast cancer gene,BRCA)等多种基因的突变[4-6],导致其成为一种高度异质性的肿瘤类型,易对化疗药物产生抗性,进一步增加了治疗难度。
代谢旺盛的肿瘤细胞能量供应高度依赖有氧糖酵解产生的ATP,越来越多的研究表明,线粒体氧化磷酸化(oxidative phosphorylation,OXPHOS)对肿瘤细胞糖类、脂类及蛋白质类三大营养物质的相互转化和氧化还原反应的平衡有着重要的作用[7-8]。在多种流行病学、临床和实验室研究中证实,糖代谢抑制剂、线粒体呼吸链阻滞剂等具有显著的抗肿瘤作用[9]。因此,在正常细胞可承受范围内,靶向破坏肿瘤细胞的糖代谢以及干扰呼吸链的电子传递,是目前肿瘤治疗的新策略。
二甲双胍以其良好的安全性和耐受性,在糖尿病临床治疗中被广泛应用[10]。越来越多的研究表明,以二甲双胍为代表的双胍类药物对多种肿瘤具有抑制作用[11-12]。苯乙双胍是比二甲双胍作用强50倍的线粒体复合物I抑制剂[13]。然而,苯乙双胍作为一种抗肿瘤药物却难以获得各国药品管理部门的批准,主要原因是其副作用会产生大量的乳酸,易引起严重的乳酸性酸血症[14-16]。因此,联用其他辅助药物以降低苯乙双胍的使用剂量,在可控的不良反应内达到有效的抗肿瘤作用,是目前肿瘤临床治疗研究的新策略。
笔者将以肿瘤细胞能量代谢为突破点,研究低剂量的苯乙双胍联合己糖激酶抑制剂2-DG对TNBC的治疗作用,为将来针对TNBC的耐药和复发而进行的临床治疗提供新的策略。
1. 材料
1.1 实验动物及细胞
40只SPF级雌性6周龄BALB/c小鼠,体质量(20±2)g,购自浙江省实验动物中心,许可证号:SCXK(浙)2016-0002。小鼠三阴性乳腺癌细胞系4T1和人三阴性乳腺癌细胞系MBA-MD-231(中国医学科学院基础医学研究所细胞资源中心)。
1.2 实验试剂
苯乙双胍(Selleck公司);2-脱氧葡萄糖(Sigma公司);RNA反转录试剂盒(ABI公司);FITC-annexin Ⅴ/PI凋亡染色试剂盒(BD公司);葡萄糖含量检测试剂盒、乳酸含量(LA)检测试剂盒(北京索莱宝科技有限公司);海马细胞线粒体压力检测试剂盒(Agilent公司)。
2. 方法
2.1 细胞分组及药物处理
分别将1×105个4T1或MDA-MB-231细胞接种到6孔板中,每组设3个复孔。实验分为空白对照组、苯乙双胍(100 μmol/L)组、2-DG(2 mmol/L)组和联用组(苯乙双胍:10 μmol/L;2-DG:200 μmol/L)。作用48 h后,用0.25%的胰蛋白酶消化细胞,获得单细胞悬液,用于后续的细胞增殖和凋亡检测。
2.2 流式细胞仪检测细胞凋亡
药物处理细胞48 h后,收集各组细胞悬液,4℃ 500×g离心5 min。弃上清液,每管加入1 ml冷PBS重悬细胞,离心后弃上清液,清洗细胞。加入100 μl 1×偶联缓冲液重悬细胞,然后每管分别加入2 μl annexin Ⅴ和PI,4℃避光孵育30 min。加入400 μl PBS重悬细胞,流式细胞仪检测各组细胞凋亡的情况。
2.3 葡萄糖和乳酸浓度的测定
各组细胞处理48 h后,收集细胞培养上清液,分别用葡萄糖含量检测试剂盒和乳酸含量检测试剂盒测定葡萄糖和乳酸浓度,同时收集细胞并计数。
2.4 线粒体耗氧量(OCR)的测定
用海马细胞线粒体压力检测试剂盒测定4T1或MDA-MB-231细胞的线粒体OCR。细胞用药物预处理24 h,在评估前8 h,以6×105个细胞/孔的最佳培养密度将细胞转移到XF微板上,使细胞贴壁。用调节好pH 7.4的培养基对细胞进行清洗,在无CO2培养箱中平衡1 h。ABC孔分别加入寡霉素、线粒体解偶联剂(FCCP)、鱼藤酮和抗霉素A后,上机检测。
2.5 动物实验的分组及处理
分为空白(PBS)组、苯乙双胍(1 mg/kg)组、2-DG(5 mg/kg)组和联用组(苯乙双胍:0.1 mg/kg;2-DG:0.5 mg/kg),每组10只小鼠。1×105个 4T1细胞原位接种到BALB/c小鼠乳腺脂肪垫内,待肿瘤生长至5 mm×5 mm左右时,荷瘤小鼠开始给药治疗,并每天测量肿瘤的大小。各给药组小鼠按50 μl体积瘤内注射给予,对照组给予等体积的PBS,每2 d给药1次。连续给药10次后,观察荷瘤小鼠的肿瘤大小并记录各组小鼠的死亡时间。
3. 统计学分析
采用SPSS 22.0软件进行统计学分析。实验数据用(
$\bar x $ ±s )表示,两组间比较用t检验,多组的组间比较采用单因素方差分析,动物生存时间比较采用Kaplan-Meier法。4. 结果
4.1 苯乙双胍下调4T1或MDA-MB-231细胞线粒体OCR
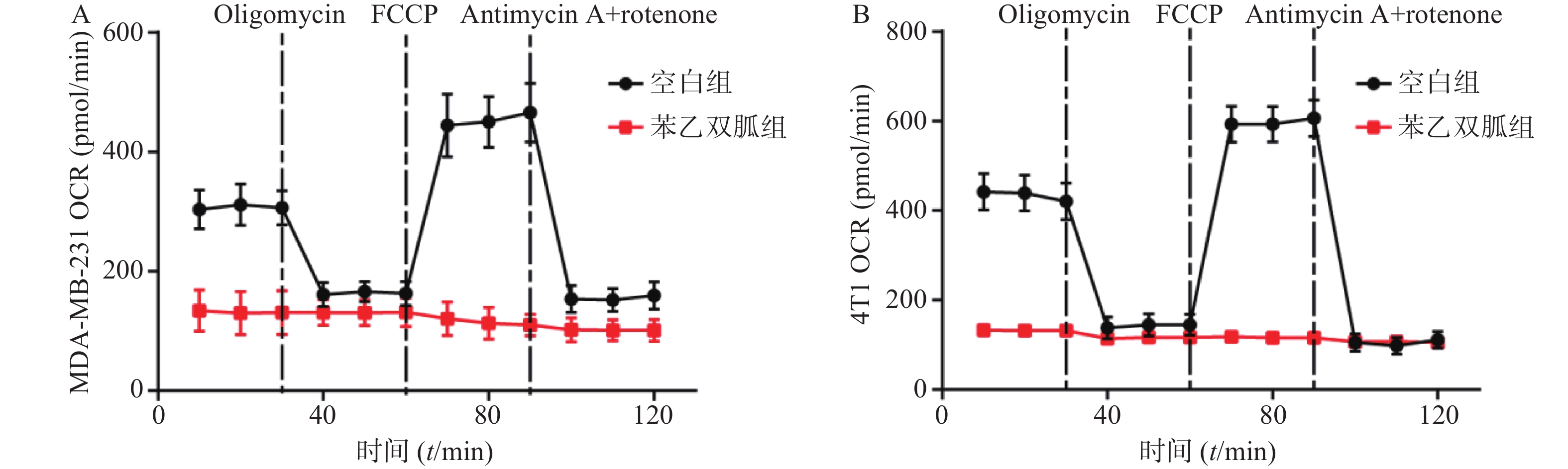
为检测苯乙双胍对线粒体呼吸的影响,将100 μmol/L苯乙双胍分别作用于4T1和MDA-MB-231细胞,24 h后收获细胞,海马生物能量分析仪检测细胞OCR水平。结果表明,苯乙双胍孵育24 h后,MDA-MB-231或4T1细胞线粒体OCR与空白组相比显著降低(图1)。
4.2 苯乙双胍对4T1或MDA-MB-231细胞有氧糖酵解的影响
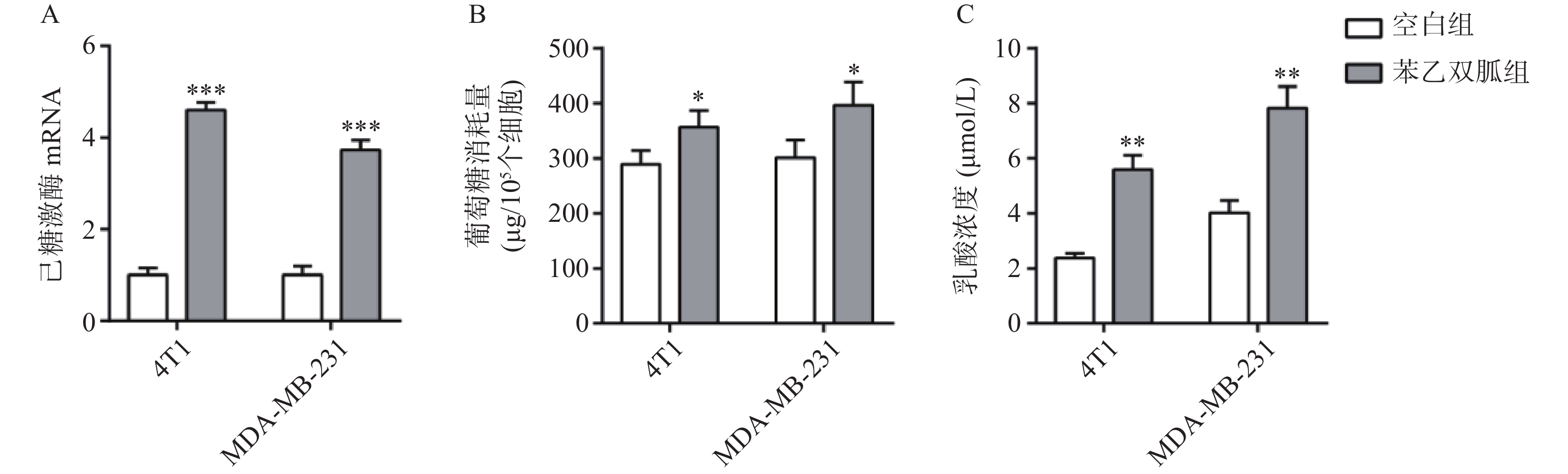
100 μmol/L苯乙双胍处理4T1和MDA-MB-231细胞48 h后,检测细胞上清液中己糖激酶表达量、葡萄糖以及乳酸浓度。结果显示,4T1和MDA-MB-231细胞上清液中己糖激酶表达量,苯乙双胍给药组(4.6±0.17,3.73±0.21,n=3)明显高于空白组(1±0.15,1±0.12, n=3),组间有显著性差异(P<0. 001),表明苯乙双胍可在基因水平显著上调己糖激酶的表达(图2A);4T1和MDA-MB-231细胞上清中葡萄糖消耗量,苯乙双胍给药组(356±31,397±42,n=3)μg/105个细胞明显高于空白组(289±25,301±32,n=3)μg/105细胞,组间有显著性差异(P < 0. 05),表明苯乙双胍能促进细胞摄取更多的葡萄糖,致使培养基中葡萄糖含量显著增加(图2B);4T1和MDA-MB-231细胞上清中乳酸浓度,苯乙双胍给药组(5.59±0.52, 7.83±0.78, n=3)μmol/L明显高于空白组(2.37±0.18,4.01±0.45,n=3)μmol/L,组间有显著性差异(P < 0.01),表明苯乙双胍能显著促进培养上清液中乳酸的产生(图2C)。
4.3 苯乙双胍联合2-DG诱导三阴性乳腺癌细胞凋亡
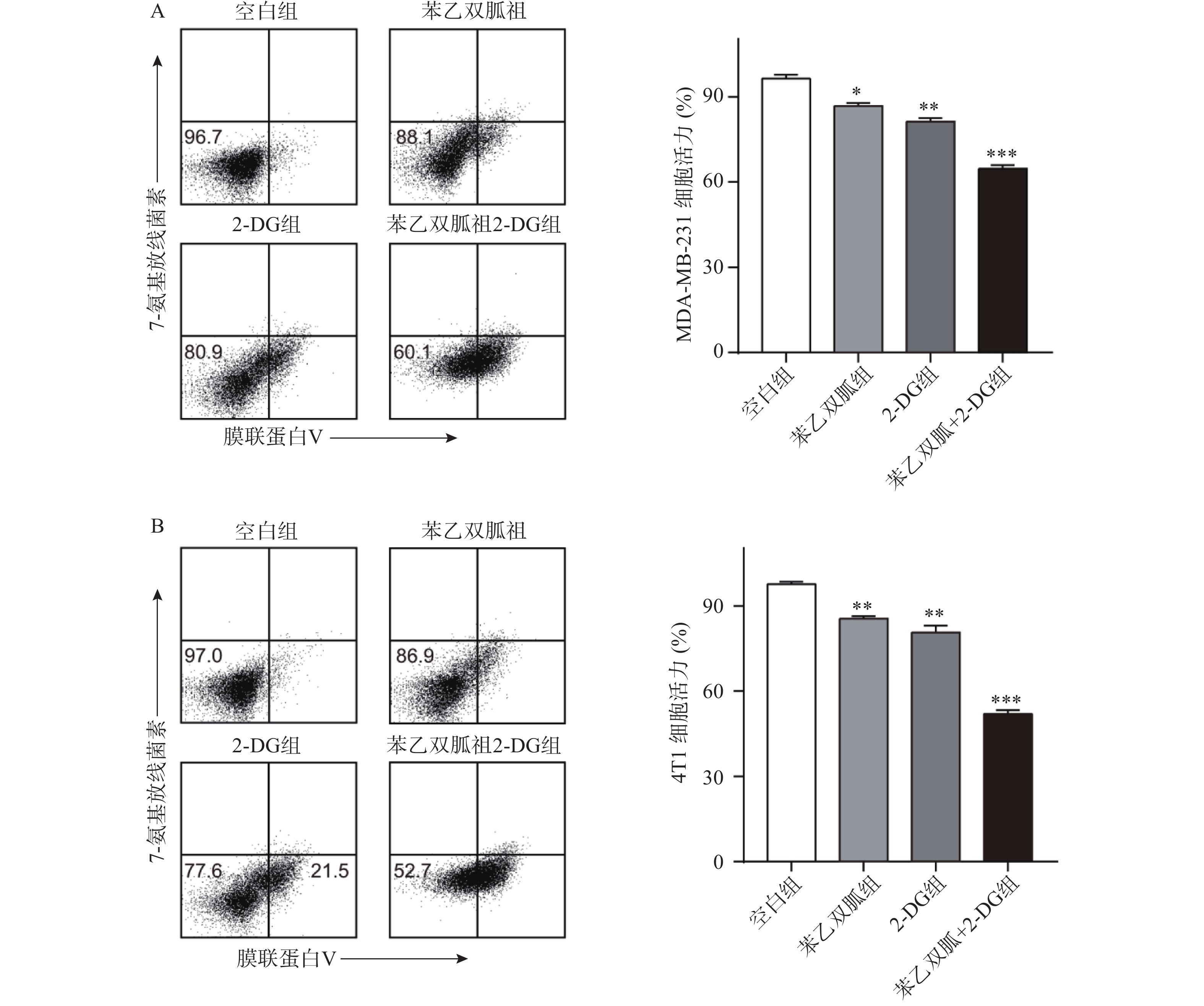
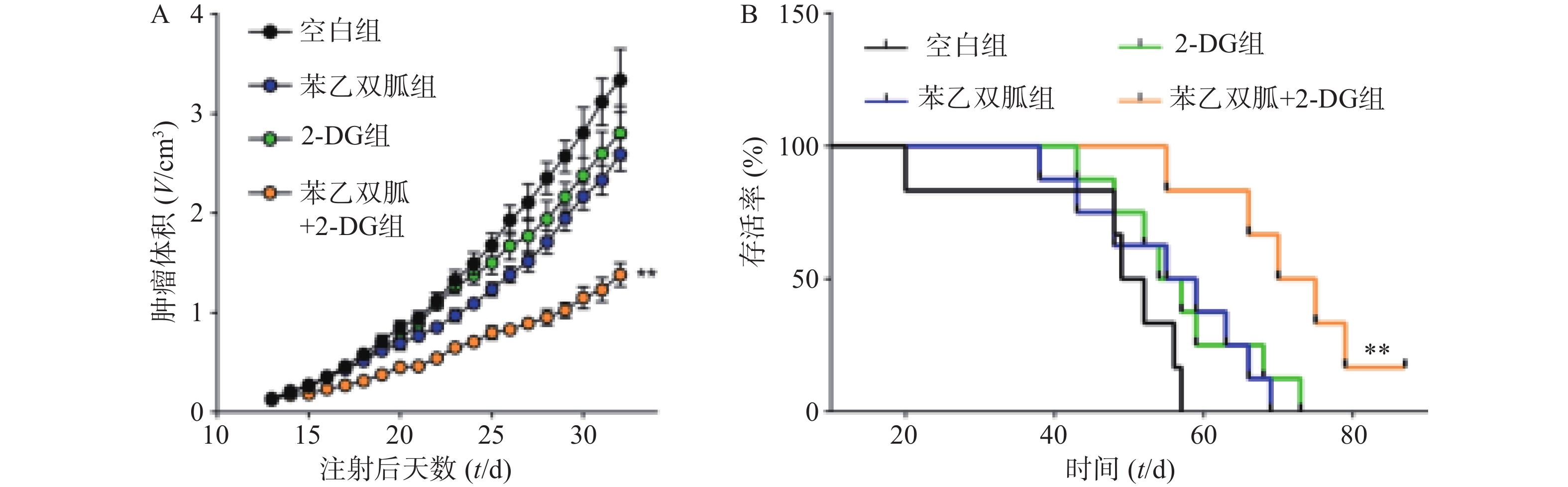
由于苯乙双胍可上调4T1和MDA-MB-231细胞的有氧糖酵解,因此当我们联用低剂量的己糖激酶抑制剂2-DG时,三阴性乳腺癌细胞会发生什么变化呢?结果显示,与空白组相比,单用苯乙双胍或2-DG均能显著降低4T1与MDA-MB-231细胞存活率(P<0.01)(表1,图3);与苯乙双胍或2-DG单药组相比,苯乙双胍联用2-DG,即使降低90%剂量,仍然可以显著降低4T1与MDA-MB-231细胞的存活率(P<0.001)(表1,图3),以上结果表明,苯乙双胍联用2-DG能显著促进三阴性乳腺癌细胞的凋亡。与此同时,检测细胞上清液中的乳酸含量,相比苯乙双胍组(5.59±0.52,7.83±0.78,n=3)μmol/L,苯乙双胍与2-DG联用组(3.46±0.37,5.18±0.62,n=3)μmol/L细胞的乳酸产量也大幅下降(P < 0.01)(图4)。
表 1 苯乙双胍联合2-DG对三阴性乳腺癌细胞凋亡的影响[`x±s , n = 3,存活率(%)]组别 4T1 MDA-MB-231 空白组(PBS) 96.37±2.31 97.63±1.46 苯乙双胍组(100 μmol/L) 86.70±1.83 * 85.53±1.46 ** 2-DG(2 mmol/L) 81.27±2.16** 80.67±4.07** 苯乙双胍+2-DG组(苯乙双胍:
10 μmol/L,2-DG: 200 μmol/L)64.63±2.28*** 51.97±2.29*** *P<0. 05,**P<0.01,***P<0.001,与空白组比较 4.4 苯乙双胍联用2-DG显著抑制4T1肿瘤的生长
为了进一步验证苯乙双胍联合2-DG在体内抗肿瘤的效果,我们将4T1细胞原位接种到小鼠乳腺脂肪垫中,并分别给予单药治疗或联合治疗,观察肿瘤的生长速度以及荷瘤小鼠的生存时间。结果显示,与苯乙双胍或2-DG单药组相比,苯乙双胍联合2-DG组可显著抑制荷瘤小鼠体内肿瘤的生长速度(P<0.01)(图5A)。此外,苯乙双胍联合2-DG组荷瘤小鼠中位生存时间为72.5 d,高于苯乙双胍组(57 d)、2-DG组(55.5 d)、空白组组(50.5 d),差异有统计学意义(P<0.01)(图5B),表明苯乙双胍联合2-DG可以延长荷瘤小鼠生存时间。
5. 讨论
二甲双胍等双胍类糖尿病治疗药物,能够通过抑制线粒体复合物I来降低细胞内ATP水平。线粒体复合物I的损伤会降低NADH氧化为NAD+,这是维持TCA循环功能的关键反应,并最终导致抑制氧化磷酸化。前期研究表明,二甲双胍表现出显著的抗肿瘤作用。苯乙双胍与二甲双胍具有非常相似的代谢特征,而苯乙双胍的效力更强[17-18]。由于乳酸性酸中毒病死率高,2型糖尿病临床治疗不再使用苯乙双胍作为一线药物[19]。 然而作为一种抗癌药物,因其较低的有效剂量和较短的疗程,与糖尿病临床治疗大有不同,苯乙双胍被认为最有希望替代二甲双胍的双胍类药物[20-22]。
本研究采用小鼠三阴性乳腺癌细胞系4T1和人三阴性乳腺癌细胞系MBA-MD-231作为研究对象,发现苯乙双胍可显著抑制其线粒体氧化磷酸化,并上调肿瘤细胞的糖酵解。当加入己糖激酶抑制剂2-DG时,糖酵解途径被阻断,肿瘤细胞被迫使用氧化磷酸化来获取ATP,在此情况下,细胞对苯乙双胍更加敏感。基于该项发现,采用苯乙双胍联用2-DG治疗三阴性乳腺癌细胞。动物体内外结果表明,苯乙双胍联用2-DG可显著增加4T1细胞和MBA-MD-231细胞的死亡率,并延长荷瘤小鼠的生存时间。除了对这两种糖代谢方式双重抑制作用外,联用2-DG带来的另一个优势是可大大降低苯乙双胍的使用剂量,从而减轻苯乙双胍代谢产生的乳酸对机体的不良作用。
综上所述,通过苯乙双胍联用2-DG,可显著增强苯乙双胍对三阴性乳腺癌的凋亡作用,并降低其使用剂量,减轻不良反应,这一发现为三阴性乳腺癌的临床治疗提供新的策略。
-
表 1 正交试验因素水平表
水平 因素A
乙醇用量(倍)因素B
乙醇浓度(%)因素C
提取时间(t/h)因素D
提取次数(次)1 6 60 1 1 2 8 70 1.5 2 3 10 80 2 3 表 2 正交试验分析表
试验号 因素
A因素
B因素
C因素
D二苯乙烯
苷含量
(mg/g)芦荟大黄
素含量
(mg/g)浸膏
得率
(%)综合
评分1 1 1 1 1 3.335 5.096 19.4 0.63 2 1 2 2 2 4.996 6.162 25.8 0.85 3 1 3 3 3 5.725 6.549 25.6 0.89 4 2 1 2 3 5.155 5.228 29.5 0.87 5 2 2 3 1 5.128 6.714 20.2 0.80 6 2 3 1 2 2.458 7.114 23.5 0.73 7 3 1 3 2 5.172 5.086 29.4 0.86 8 3 2 1 3 6.064 6.694 28.6 0.96 9 3 3 2 1 3.145 7.427 19.9 0.73 K1 2.375 2.360 2.320 2.158 K2 2.393 2.603 2.438 2.434 K3 2.544 2.348 2.554 2.719 R 0.169 0.255 0.234 0.561 表 3 综合评分正交试验方差分析表
变异来源 离差平方和
(SS)自由度
(df)均方
(MS)F值 P 因素B 0.014 2 0.007 2.333 0.30 因素C 0.009 2 0.004 1.430 0.41 因素D 0.052 2 0.026 8.430 0.11 因素A(含误差) 0.006 2 0.003 表 4 血通胶囊蒽醌类成分含量测定结果(n = 3)
批号 芦荟大黄素 大黄酸 大黄素 大黄酚 大黄素甲醚 含量(mg/g) RSD(%) 含量(mg/g) RSD(%) 含量(mg/g) RSD(%) 含量(mg/g) RSD(%) 含量(mg/g) RSD(%) 240101 0.632 0.133 0.681 0.851 1.968 0.102 2.570 0.354 1.101 0.196 240102 0.637 0.471 0.660 0.313 1.970 0.154 2.580 0.424 1.079 0.352 240103 0.641 0.545 0.681 0.73 1.991 0.253 2.547 0.127 1.076 0.382 -
[1] WADHERA R K, FIGUEROA J F, RODRIGUEZ F, et al. Racial and ethnic disparities in heart and cerebrovascular disease deaths during the COVID-19 pandemic in the United States[J]. Circulation, 2021, 143(24):2346-2354. doi: 10.1161/CIRCULATIONAHA.121.054378 [2] 赵冬. 新中国成立70年来我国人群血脂流行病学研究回顾与进展[J]. 中国医药, 2019, 14(10):1441-1444. [3] BLESSBERGER H, KAMMLER J, DOMANOVITS H, et al. Perioperative beta-blockers for preventing surgery-related mortality and morbidity[J]. Cochrane Database Syst Rev, 2018, 3(3):CD004476. [4] 胡皓. 从 “络脉空虚” 论治缺血性心脑血管病[J]. 中西医结合心血管病电子杂志, 2018, 6(23):17-19. [5] 孔祥琳, 吕琴, 李运伦, 等. 黄芪甲苷对心脑血管疾病的现代药理作用研究进展[J]. 中国实验方剂学杂志, 2021, 27(2):218-223. [6] 陈敏先, 姚克裘, 周曾绮, 等. “血通胶囊”治疗高脂血症、高粘滞血症的临床观察[J]. 江苏中医, 1997,(10):13-14. [7] 姚克裘, 周曾绮, 陈敏先. 血通胶囊对老年高脂血症影响的临床研究[J]. 上海中医药杂志, 1995,(1):37-38. [8] 张绵松, 刘新, 孟秀梅, 等. 生何首乌体外抗氧化活性及抗菌活性的研究[J]. 食品科技, 2012, 37(8):228-231. [9] 李冰韶, 陈柽, 刘鑫, 等. 大黄不同炮制品与阿托伐他汀联用对HepG2肝脂肪变性细胞的作用研究[J]. 中华中医药杂志, 2019, 34(11):5374-5379. [10] 国家药典委员会. 中华人民共和国药典(一部)2020年版[S]. 北京: 中国医药科技出版社, 2020: 24-25. 期刊类型引用(3)
1. 杨凌,韩杰,谢小中,金万清,彭清林. 基于巨噬细胞及其相关通路探讨骨坚散干预激素性股骨头坏死作用机制. 辽宁中医药大学学报. 2025(02): 113-118 .  百度学术
百度学术2. 刘奇,章越,盛燕,胡云莉,姜慧洁,慎凯峰,姜艳,陈承守,周丹英. 基于层次分析法-熵权法-独立性权法结合正交设计法优选胃病1号提取工艺. 中国现代应用药学. 2023(21): 2998-3004 .  百度学术
百度学术3. 陆玫霖,潘其明,王宝林,何宇铭,黄婉凤,陈明,钟国跃,杨世林,高红伟. 山鸡椒的化学成分、药理活性及临床应用研究进展. 中草药. 2022(17): 5565-5581 .  百度学术
百度学术其他类型引用(2)
-






 下载:
下载:

 下载:
下载: