-
表面增强拉曼光谱(surface-enhanced Raman spectroscopy, SERS)是在拉曼光谱技术上发展起来的,一种快速、灵敏、简便、无损的分析方法[1-2],可用于食品、药物、环境污染、生物分子、细菌等物质的结构鉴定、定性定量分析等[3-7]。其主要有两种增强机制:化学增强和电磁增强[8-9]。两种机制共同作用,可使SERS信号增强106~1014倍。SERS图谱包含待测物质详细的指纹图谱信息,即使是细微的结构差别,在SERS图谱上均有明显不同,是区分结构类似物很好的技术手段[10]。同时,因其简便、快速等特性使得SERS技术可以应用于原位现场检测。
黄嘌呤、茶碱、可可碱均属于嘌呤类衍生物,在结构上十分相似,其中,茶碱和可可碱与黄嘌呤是同系物,茶碱与可可碱是同分异构体。临床上常用黄嘌呤或茶碱进行支气管扩张、哮喘治疗等,可可碱常用来降低血液黏度[11-13]。较窄的治疗窗使得临床应用此类药物时通常需要对其进行血药浓度监测,以防止用药过量或不足等情况发生。但是,由于这3种物质的结构类似物很多,且常见于普通食品之中。如发生误服,易导致检测到的数据偏高,因此,急需一种实用、高效的分析手段,能够对这类结构类似物进行有效的区分和鉴别。常规分析方法如液相、质谱等[14]要经过复杂的分离手段,操作复杂、耗时长,给临床监测带来诸多不便。笔者利用SERS技术对3种结构类似物进行了有效的区分,并极大地降低了三者的检测限,同时,在实际血清样品的鉴别中也得到了很好的应用。
-
DF-101S恒温加热磁力搅拌器(上海梅颖浦仪器仪表制造有限公司);Vortex-Genie2多功能旋涡混合器(美国Scientific Industries公司);TG16-WS离心机(上海卢湘仪离心机有限公司);电子分析天平(北京赛多利斯仪器系统有限公司);BWS415-785H便携式拉曼光谱仪(美国必达泰克公司);TU-1902紫外可见分光计(北京普析通用仪器有限责任公司);Zeiss EVO MA-10扫描电子显微镜(德国Carl-Zeiss公司);
-
黄嘌呤、茶碱、可可碱(分析纯)购自上海泰坦科技股份有限公司;硝酸银、柠檬酸三钠、碘化钾、甲醇(分析纯)购自国药集团化学试剂有限公司;血清样品取自SD大鼠;去离子水为实验室自制。
-
10 μmol/L黄嘌呤溶液:用精度为十万分之一的电子天平准确称取15.21 mg黄嘌呤粉末,溶于1 L去离子水中,搅拌均匀,待完全溶解后得到浓度为100 μmol/L的黄嘌呤储备液。再利用去离子水按照浓度梯度稀释,依次得到浓度为10、5、1、0.5、0.2、0.15、0.1、0.075 μmol/L的黄嘌呤溶液。
10 μmol/L茶碱溶液:用精度为十万分之一的电子天平准确称取18.16 mg茶碱粉末,溶于1 L去离子水中,搅拌均匀,待完全溶解后得到浓度为100 μmol/L的茶碱储备溶液。再利用去离子水按照浓度梯度稀释,依次得到浓度为10、5、1、0.5、0.2、0.15、0.1、0.075 μmol/L的茶碱溶液。
10 μmol/L可可碱溶液:用精度为十万分之一的电子天平准确称取18.16 mg可可碱粉末,溶于1 L去离子水中,搅拌均匀,待完全溶解后得到浓度为100 μmol/L的可可碱储备溶液。再利用去离子水按照浓度梯度稀释,依次得到浓度为10、5、1、0.5、0.2、0.15、0.1、0.075 μmol/L的可可碱溶液。
1 μmol/L碘化钾溶液:用精度为十万分之一的电子天平准确称取碘化钾粉末16.6 mg,溶于100 ml去离子水中,搅拌均匀,待完全溶解后即得1 mmol/L的碘化钾溶液。
10 mmol/L硫酸镁MgSO4溶液:用精度为十万分之一的电子天平准确称取无水硫酸镁粉末120 mg,溶于100 ml去离子水中,搅拌均匀,待完全溶解后即得10 mmol/L的MgSO4溶液。
-
用电子分析天平准确称取硝酸银36 mg,用200 ml 的去离子水充分溶解,将该溶液缓慢倒入500 ml的三颈烧瓶中,不断加热的同时进行磁力搅拌,溶液微沸时,加入4 ml质量分数1%的柠檬酸三钠溶液,继续加热搅拌约1 h,溶液的颜色由无色变为灰绿色,停止加热,冷却至室温,倒入棕色瓶中,避光保存[15]。由于溶胶体系的不稳定性,每次使用银胶之前都要摇晃均匀。
-
紫外图谱表征:取2 ml纳米银胶溶液离心(7 000 r/min,5 min),尽可能多地去除上清液,然后加入等量的去离子水,吹打混匀,再加入8 ml去离子水稀释5倍,最后在300~700 nm波长范围内进行紫外光谱扫描,观察物质的紫外特征吸收峰。
扫描电镜表征:取1 ml银胶溶液离心(7 000 r/min,5 min),尽可能多地去除上清液,然后加入1 ml去离子水,吹打混匀后,用移液枪吸取2.5 µl银胶溶液滴于硅片上,烘干后电镜扫描,观察纳米银胶颗粒的形态。
-
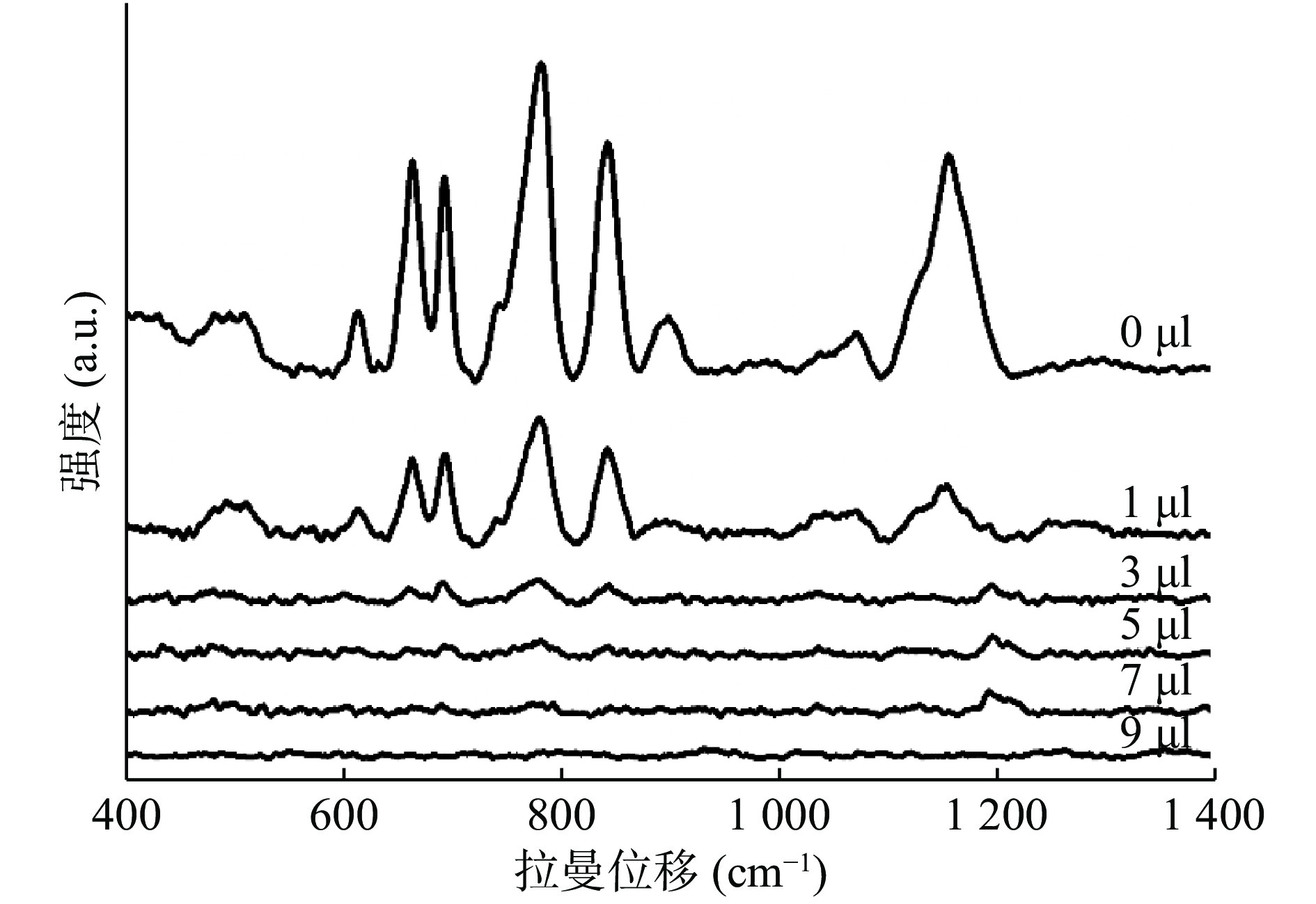
本实验为了增加单位面积内SERS检测的“热点”数目,对银胶溶液进行了浓缩处理。结果发现浓缩约60倍的银胶溶液信号增强效果最好,但是却产生了极强的背景信号,推测可能是由于制备银胶溶液时残留的柠檬酸根导致的。根据任斌课题组的方法[16],我们用碘化钾溶液对银胶表面进行清洗。首先用移液枪分别吸取10 μl浓缩后的银胶溶液,置于6个1.5 ml离心管中,然后向每个离心管中分别加入0、1、3、5、7、9 μl的碘化钾溶液,涡旋混匀后,室温下孵育20~30 min采集SERS光谱。观察当多少碘化钾用量可使银胶浓缩后的背景信号基本去除。
-
本实验所有SERS图谱均由BWS415拉曼光谱仪测得,将待测体系加到96孔板中,置于拉曼显微系统的检测台上,检测过程中,96孔板保持水平的状态,打开激光,将激光聚焦于待测溶液表面,点击开始,然后进行SERS检测。
光谱检测参数如下:激光波长785 nm,分辨率5 cm−1,积分时间10 s,扫描次数为1次,激光功率为100 mW。
-
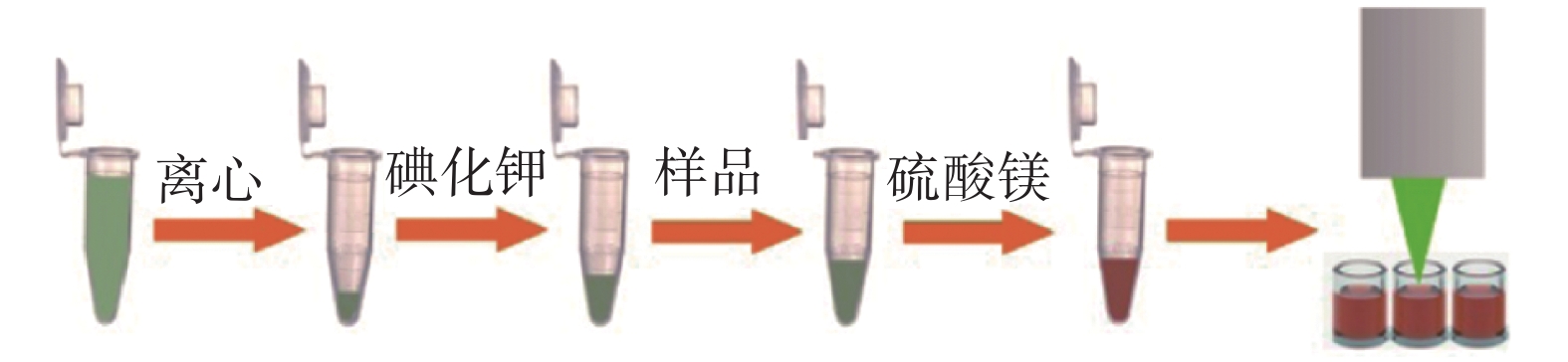
用移液枪吸取10 μl浓缩60倍后的银胶溶液置于1.5 ml离心管中,向其中加入5 μl 1 mmol碘化钾溶液,涡旋混匀后,室温下孵育20~30 min。然后加入10 μl 100 mmol的黄嘌呤(茶碱/可可碱)溶液和2 μl的MgSO4溶液(这里Mg2+的加入是为了对银胶颗粒起到团聚作用,以达到增强检测信号的目的),吹打混匀后,加入去离子水,使最终的溶液体积为100 μl。此时,黄嘌呤(茶碱/可可碱)的最终检测浓度均为10 mmol/L,然后将溶液转移到96孔板中,放到检测台上,打开激光,采集SERS图谱。SERS检测步骤如图1所示。
-
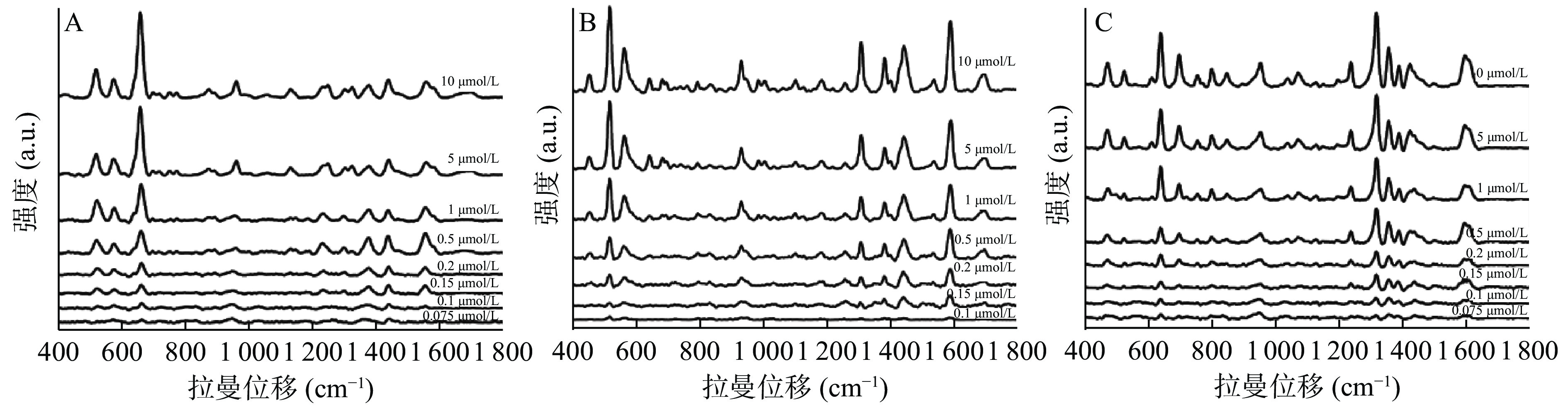
按照上述SERS检测的步骤,分别对已经配好的10、5、1、0.5、0.2、0.15、0.1、0.075 μmol/L的黄嘌呤、茶碱、可可碱溶液进行检测,测定3种结构类似物的最低检测限。
-
从SD大鼠眼眶中获取适量全血样品溶液,等比例加入黄嘌呤、茶碱、可可碱粉末,混合均匀后,按照1:3的比例加入纯甲醇溶液,用以沉淀蛋白,获得包含3种物质的血清样品溶液。按照上述拉曼检测步骤对3种物质的血清体系进行检测。
-
采用BWSpec4软件对采集到的光谱原始数据进行处理,主要为光谱平滑和基线校正。然后利用Matlab软件对数据进行光谱波段的截取,选取400~1 800 cm−1处的光谱数据进行分析,同时采用Origin 9软件对处理好的数据进行绘图。
-
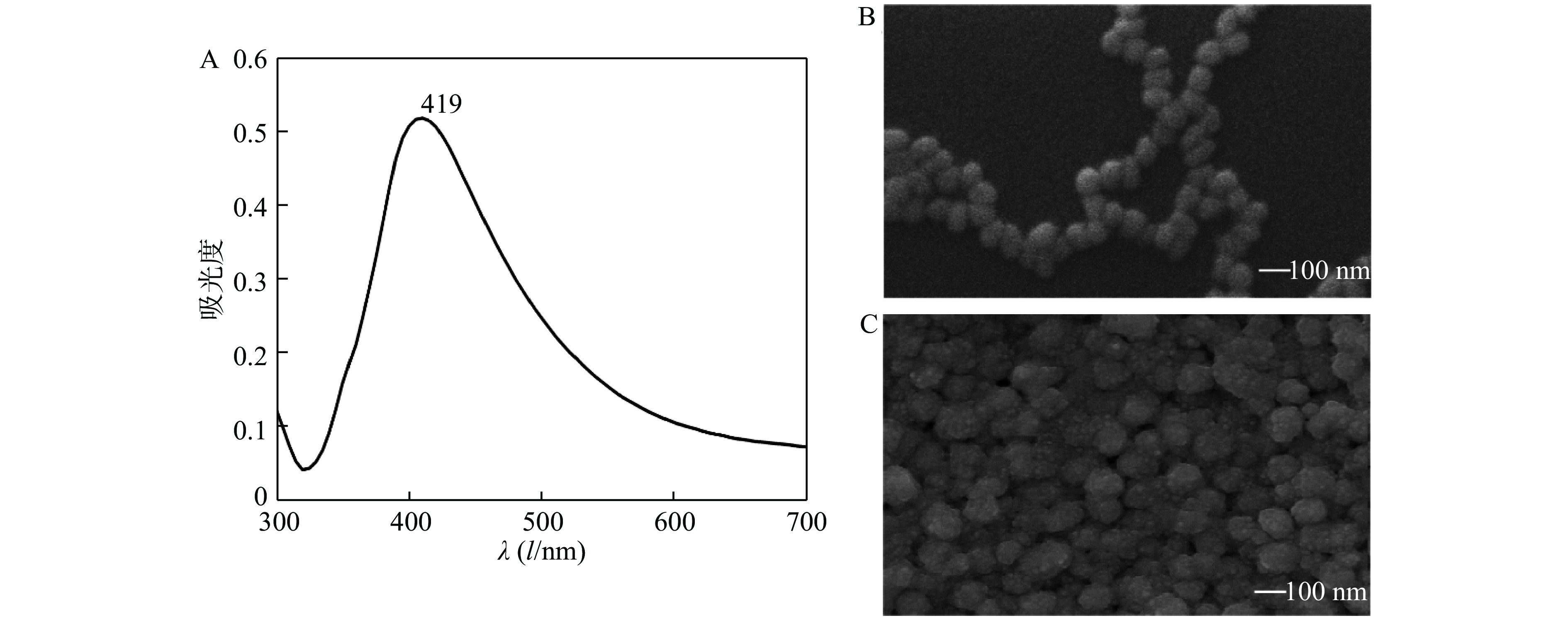
本实验采用的制胶方法来源于Lee法,是银胶最经典的制备方法。大多数实验的银胶制备方法都在Lee法的基础上加以进一步的改进和优化,所以,不同实验室制备的纳米银胶在粒径、形态大小上略有不同。本实验利用紫外光谱和扫描电镜对纳米银胶颗粒进行表征,结果如图2所示。由图2A可见,纳米银胶在300~700 nm扫描范围内,只在419 nm处出现了一个尖锐的单峰,半峰宽较窄。验证本实验制备的溶液确实为银胶溶液,且较小的半峰宽也可以反映出纳米银颗粒具有良好的分散性和均一性[17-18]。图2B可以看出本实验制备的纳米银胶颗粒为球形,大小均一,直径约为60 nm,分布较为松散。而图2C是将银胶溶液浓缩之后的纳米银胶颗粒形态,相比于未浓缩的银纳米颗粒,浓缩之后粒子之间距离极大缩短,单位面积之内的粒子数目增加,SERS检测“热点”也随之增加,极大地提高了待测物质的信号强度。
-
为了增强待测物质的信号强度,提高SERS检测的灵敏度,本实验将银胶溶液通过离心的方式进行了浓缩。经过一系列浓缩倍数的尝试,发现当浓缩倍数为60倍左右时,信号增强效果最好。但是,与此同时,制备银胶溶液时残留在溶液里的柠檬酸根离子也随之富集,显示了强大的背景信号,严重掩盖了待测物质的信号。所以,本实验采用碘化钾溶液对银纳米颗粒表面进行清洗。由图3可知,当1 mmol/L碘化钾溶液用量为5 μl时,背景信号基本去除干净。碘化钾用量不宜过多,因为过量的I−也会屏蔽待测物质的信号,所以,碘化钾用量为刚好去除背景信号即可。之后的所有实验都会对浓缩后的银胶溶液经历KI清洗步骤,以保证待测物质信号不受背景信号干扰,同时也不会被I−屏蔽。
-
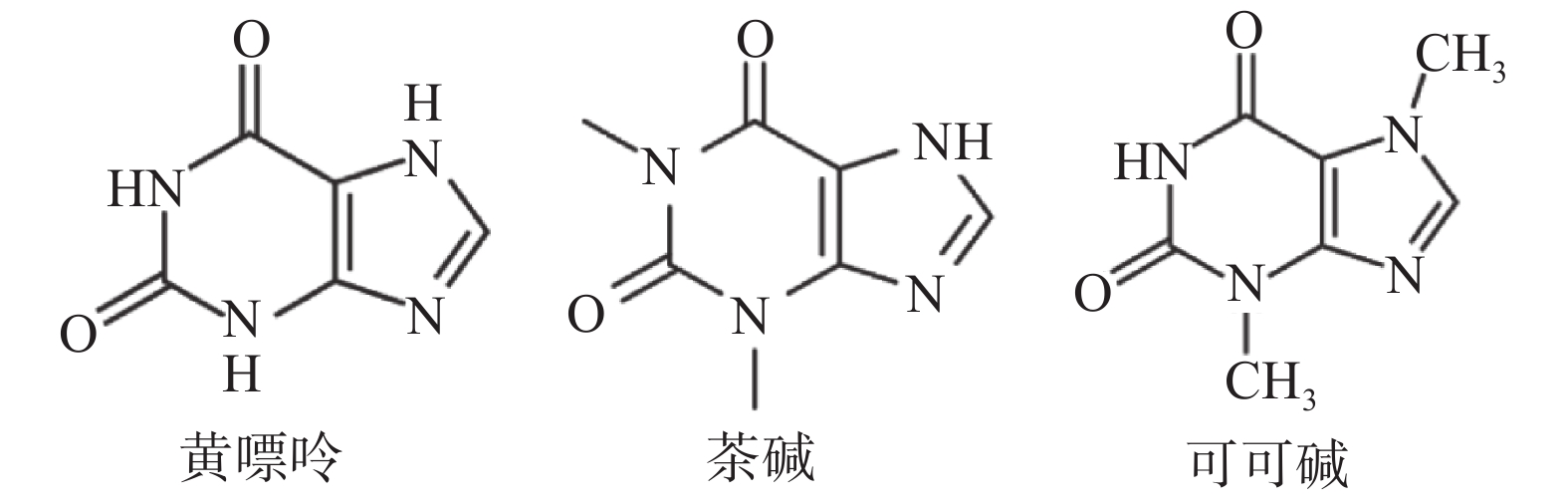
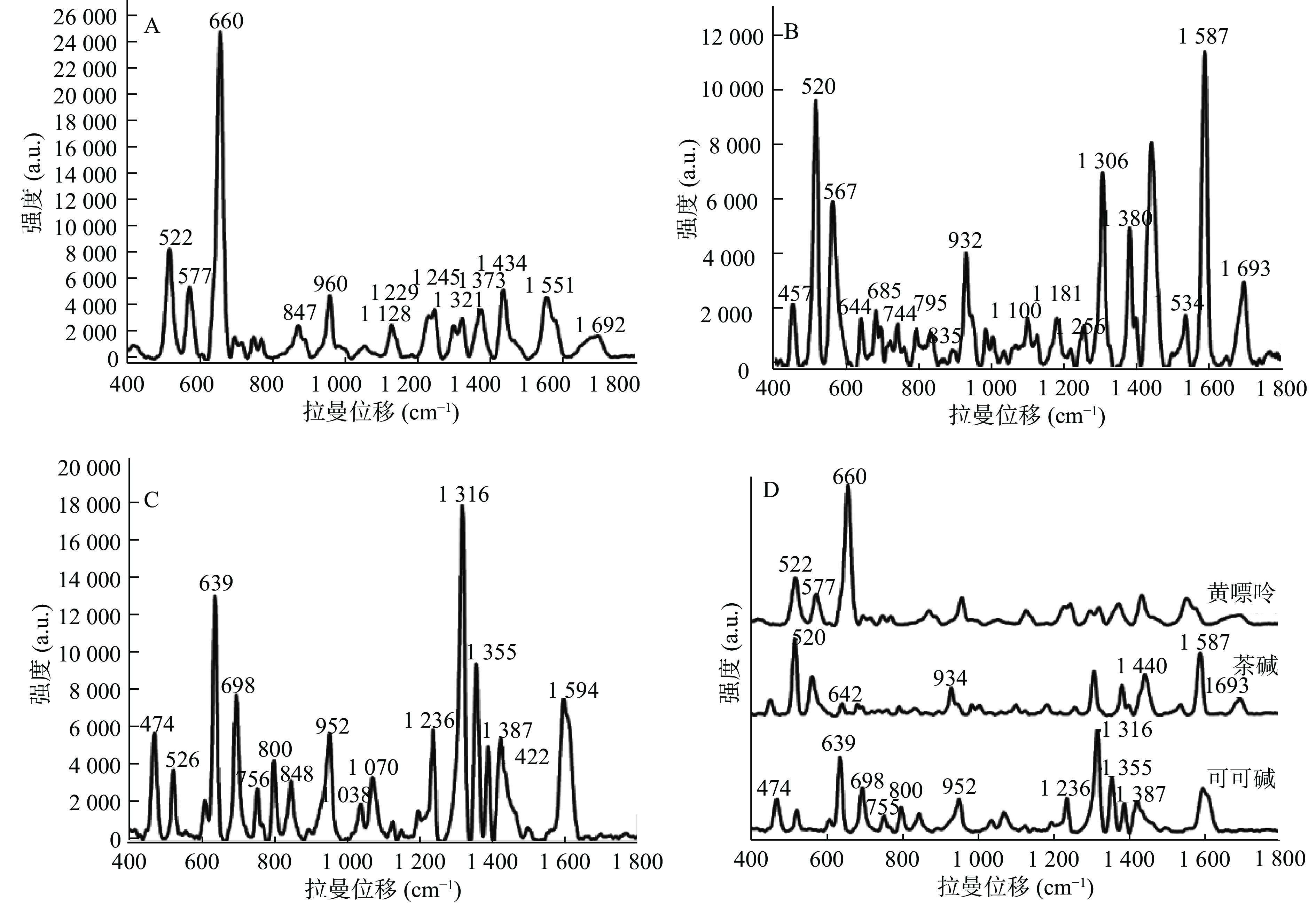
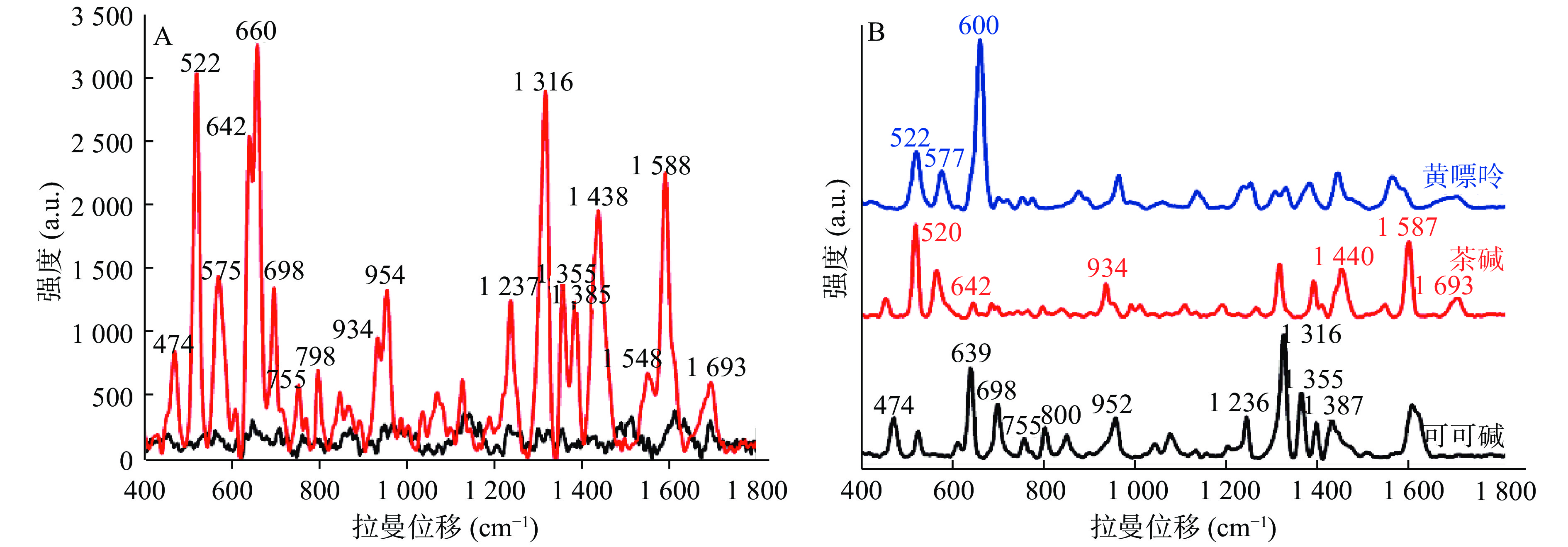
黄嘌呤、茶碱、可可碱是3个结构十分相似的化合物,其中,茶碱、可可碱与黄嘌呤是同系物,而茶碱与可可碱之间是同分异构体,如图4所示。所以在实际应用中,对于三者的鉴定检测十分困难。通过SERS特有的指纹图谱特性,可以对三者进行很好的区分。由图5可知,黄嘌呤的特征峰主要出现在400~800 cm−1处,其中,522、577、660 cm−1处峰强明显;茶碱的特征峰主要出现在400~600 cm−1以及1 300~1 700 cm−1处,其中,520、567、932、1 306、1 380、1 440、1 587 cm−1峰强明显;而可可碱出峰较多,在400~1 800 cm−1均有出峰,其中,474、639、698、1 316、1 355、1 594 cm−1峰强较高。由此可见,尽管3种物质的结构十分类似,但是在SERS图谱中的特征峰却完全不同。所以SERS技术对于这类结构类似物具有很好的区分效果。
-
上述对银胶溶液进行浓缩,不仅是为了增强待测物质的信号强度,同时也有降低检测限的目的。现利用浓缩银胶对3种物质检测限分别测定,由图6可知,黄嘌呤和可可碱的最低检测限为0.075 μmol/L,而茶碱的最低检测限为0.1 μmol/L,相比于液相等方法[19-21],该方法对三者的检测灵敏度更高,检测限更低,完全能满足实际应用中对3种物质含量的检测。
-
黄嘌呤、茶碱以及可可碱都是常见药物成分,临床上常对3种物质的血药浓度进行监测。但是三者之间互为结构类似物,常常对监测过程产生干扰,使得测定结果偏高,故而本实验利用SERS技术对3种物质同时存在的血清溶液进行测定,观察SERS图谱是否可以很好地将其区别开来。结果如图7所示。由图7A可知,单独对血清空白样品进行检测,是没有SERS信号产生的。表明血清体系不对测定结果产生干扰。而含有3种物质的血清样品溶液可以检测到三者的特征信号。尽管信号强度对比水溶液来说弱了许多,但是与图7B对比可知,3种物质的特征峰均可以在混合血清溶液中一一对应。以上表明,利用SERS技术可以有效检测血清样品中是否包含黄嘌呤、茶碱、可可碱中一个或多个物质的存在。
-
本实验利用SERS技术对结构类似物黄嘌呤、茶碱、可可碱进行测定。结果表明,尽管3种物质在结构上相差不大,但是其各自的SERS图谱却完全不同,特征峰各异,可以很好的区分。整个实验过程操作简单、耗时短、样品需求少,证明了SERS技术对结构类似物具有很好的区分鉴别作用。同时,我们通过将SERS技术应用到检测3种物质的血清样品溶液中,证明该方法可以有效地对 三者混合物进行鉴定。综上,SERS在对结构类似物进行定性鉴别等方面具有巨大优势。
Identification of structural analogues xanthine, theophylline and theobromine by surface-enhanced Raman spectroscopy
-
摘要:
目的 采用表面增强拉曼光谱技术对结构类似物黄嘌呤、茶碱、可可碱进行区分。 方法 通过制备浓缩的银胶增强试剂作为拉曼基底,增加单位面积内的“热点”数目,从而提高表面增强拉曼光谱的灵敏度,增强待测样品的信号强度,实现对结构类似物进行有效区分的目的。同时,通过测定包含3种混合物的血清样品,验证表面增强拉曼光谱在实际应用中的可行性。 结果 浓缩后的银胶极大地提高了3种结构类似物的信号强度,分别得到3种物质各自的特征光谱图,以及混合物在血清体系下的光谱图。3种物质水溶液的检测限依次为:0.005、0.01、0.005 μmol/L。 结论 表面增强拉曼光谱是一种很好的用于区分结构类似物的分析方法,具有简便快捷、灵敏度高、对样品无损等特点,可广泛应用于检测、分析、临床治疗和诊断等领域。 -
关键词:
- 表面增强拉曼散射光谱 /
- 黄嘌呤 /
- 茶碱 /
- 可可碱 /
- 鉴别
Abstract:Objective To distinguish the structural analogues xanthine, theophylline and theobromine by surface-enhanced Raman spectroscopy. Methods Concentrated silver colloid enhancement reagent was prepared as the Raman substrate to increase the number of "hot spots" per unit area, improve the sensitivity of surface-enhanced Raman spectroscopy, enhance the signal strength of the samples and achieve the effective discrimination of structural analogues. Meanwhile, the feasibility of surface-enhanced Raman spectroscopy in practical application was verified by determining serum samples of three mixtures. Results The concentrated silver colloid greatly increased the Raman intensity of the three structural analogues. The spectra of each individual compound and the mixture in the serum system was obtained. The detection limit of the three substances in aqueous solution were 0.005, 0.01 and 0.005 μmol/L respectively. Conclusion Surface-enhanced Raman spectroscopy is a potent technique for distinguishing structural analogues. It is rapid, sensitive and nondestructive to samples. Hence, it can be widely used in the fields of detection, analysis, clinical treatment and diagnosis. -
Key words:
- surface-enhanced Raman spectroscopy /
- xanthine /
- theophylline /
- theobromine /
- distinguish
-
[1] 兰燕娜, 周玲. 表面增强拉曼光谱[J]. 南通工学院学报(自然科学版), 2004, 3(2):21-23. [2] 王明栋, 王宗廷, 王凤英. 表面增强拉曼光谱技术研究进展[J]. 化学分析计量, 2016, 25(1):104-107. doi: 10.3969/j.issn.1008-6145.2016.01.030 [3] 白敏. 表面增强拉曼光谱技术在环境污染物检测中的应用[J]. 中国资源综合利用, 2019, 37(8):191-193. doi: 10.3969/j.issn.1008-9500.2019.08.057 [4] 应方, 梁苗苗, 李剑锋. 有机磷农药残留的表面增强拉曼光谱快速检测[J]. 光散射学报, 2019, 31(2):131-135. [5] 王海波. 表面增强拉曼光谱用于食品检测的研究进展[J]. 食品工业科技, 2019, 40(15):322-329. [6] 罗丹, 周光明, 陈蓉, 等. 表面增强拉曼光谱法分析软饮料中的阿斯巴甜[J]. 分析测试学报, 2019, 38(3):328-333. [7] 张晨曦, 孙波, 刘佳佳, 等. 表面增强拉曼光谱在肿瘤实验室诊断中的应用[J]. 国际检验医学杂志, 2019, 40(12):1502-1505, 1525. doi: 10.3969/j.issn.1673-4130.2019.12.022 [8] ZONG C, XU M X, XU L J, et al. Surface-enhanced Raman spectroscopy for bioanalysis: reliability and challenges[J]. Chem Rev,2018,118(10):4946-4980. doi: 10.1021/acs.chemrev.7b00668 [9] ZHANG Y, ZHAO S J, ZHENG J K, et al. Surface-enhanced Raman spectroscopy (SERS) combined techniques for high-performance detection and characterization[J]. Trac Trends Anal Chem,2017,90:1-13. doi: 10.1016/j.trac.2017.02.006 [10] WU M R, LI H, LV D, et al. Dynamic-SERS spectroscopy for the in situ discrimination of xanthine analogues in ternary mixture[J]. Anal Bioanal Chem,2017,409(23):5569-5579. doi: 10.1007/s00216-017-0495-3 [11] 翟剑凤. 氨茶碱在支气管炎治疗中的临床效果研究[J]. 临床医药文献电子杂志, 2019, 6(59):152-153. [12] 郭晓玲, 崔继文, 李锦莲, 等. 聚苏氨酸修饰铅芯电极同时测定尿酸、黄嘌呤和次黄嘌呤[J]. 佳木斯大学学报(自然科学版), 2019, 37(4):621-623. [13] 张先平. 己酮可可碱联合治疗急性脑梗死的临床疗效[J]. 中国现代医生, 2007, 45(6):44-45. doi: 10.3969/j.issn.1673-9701.2007.06.029 [14] 周绪云. 一测多评法测定水蛭中尿嘧啶、次黄嘌呤、黄嘌呤和尿苷的含量[J]. 中国药品标准, 2019, 20(4):339-345. [15] LEE P C, MEISEL D. Adsorption and surface-enhanced Raman of dyes on silver and gold sols[J]. J Phys Chem,1982,86(17):3391-3395. doi: 10.1021/j100214a025 [16] XU L J, LEI Z C, LI J X, et al. Label-free surface-enhanced Raman spectroscopy detection of DNA with single-base sensitivity[J]. J Am Chem Soc,2015,137(15):5149-5154. doi: 10.1021/jacs.5b01426 [17] BIAO L H, TAN S N, WANG Y L, et al. Synthesis, characterization and antibacterial study on the chitosan-functionalized Ag nanoparticles[J]. Mater Sci Eng: C,2017,76:73-80. doi: 10.1016/j.msec.2017.02.154 [18] LO T H, SHIH P Y, WU C H. The response of UV/blue light and ozone sensing using Ag-TiO2 planar nanocomposite thin film[J]. Sensors (Basel),2019,19(23):E5061. doi: 10.3390/s19235061 [19] 王存, 孟丽, 惠俊敏. 聚咪唑/氮化碳新型纳米复合材料修饰电极对尿酸、黄嘌呤和次黄嘌呤的同时检测[J]. 高等学校化学学报, 2019, 40(3):431-438. doi: 10.7503/cjcu20180717 [20] 聂吉语, 李荣, 王颖, 等. 可可碱、茶碱和咖啡碱的快速测定及其色谱保留行为[J]. 食品科学, 2019, 40(20):318-324. doi: 10.7506/spkx1002-6630-20181120-227 [21] 唐喆, 管静. RP-HPLC同时测定万古霉素和茶碱的血清药物浓度[J]. 中国执业药师, 2015, 12(10):7-10. -





 下载:
下载: