-
金沸草(Inulae Herba)为菊科(Asteraceae)植物条叶旋覆花(Inula linariifolia Turcz.)或旋覆花(Inula japonica Thunb.)的干燥地上部分,被列入2015年版《中国药典》,具有降气、消痰、行水的功效,临床上应用广泛 [1]。金沸草的不同基源中,已有多篇文献报道过旋覆花的含量测定,而条叶旋覆花的含量测定目前尚未见报道[2-6]。
前期研究发现线叶旋覆花内酯A(britanin)是从条叶旋覆花中分离得到的含量较高且抗炎活性显著的一个倍半萜内酯,其结构式如图1所示。据文献报道,线叶旋覆花内酯A可应用于慢性阻塞性肺疾病[7]及心肌炎[8]的预防和治疗,具有神经保护[9]功能,能够通过抑制NF-κB和MAPK信号通路降低脂多糖(LPS)诱导的一氧化氮(NO)、前列腺素和炎性细胞因子的分泌水平[10]。这些功能与金沸草治疗“外感风寒,痰饮蓄结,胸膈脾满”相对应,因此可将其作为条叶旋覆花的重要质量标志物[1]。本研究优化了线叶旋覆花内酯A的提取方法和色谱条件,并开展系统适应性试验,建立了HPLC-UV法测定条叶旋覆花的干燥地上部位和头状花序中线叶旋覆花内酯A的含量测定方法,确定了含量较高的部位,有助于药材的合理应用。该方法操作简单,方便快捷,可为金沸草的基源药材条叶旋覆花的质量标准制定提供数据支持和科学依据。
-
HP-1100系列高效液相色谱仪(惠普,美国);G1311A 四元泵、G1313A 自动进样器、G1316A 柱温箱、G1314A VWD可变波长检测器、G1315B DAD二极管阵列检测器(安捷伦,美国);Agilent Zorbax SB C18色谱柱(4.6 mm×250 mm,5 µm;安捷伦,美国);BP211D 型电子天平(Sartotius,德国)。
-
7批条叶旋覆花的干燥地上部分购自不同地区,获得的头状花序部位经由海军军医大学药学院生药学教研室张汉明教授鉴定;线叶旋覆花内酯A对照品(britanin)为实验室自制,化学分子式为C19H26O7,相对分子质量为366。经紫外光谱(UV)、红外光谱(IR)、核磁共振(NMR)和质谱(MS)分析,纯度≥98%,符合中药化学对照品的含量测定要求;乙腈为J.T Baker 色谱纯,水为Milli-Q超纯水,其他试剂均为分析纯。
-
超声法提取,超声时间为40 min。溶剂:100%甲醇。溶剂体积倍数:40倍。
-
色谱柱为Agilent Zorbax SB C18柱(250 mm×4.6 mm,5 µm;安捷伦,美国);初始流动相为乙腈-水(30:70),在20 min内升至乙腈-水(40:60)进行梯度洗脱,流速始终为1.2 ml/min;柱温为恒温30 ℃;检测波长212 nm。
-
精密称取1.21 mg线叶旋覆花内酯A对照品,置于10 ml容量瓶中,用100%甲醇溶解后定容,摇匀,获得1 ml中含有线叶旋覆花内酯A 0.121 mg的对照品溶液(浓度为0.121 mg/ml),冷藏备用。
-
精密称定条叶旋覆花(头状花序)粉末(过3号筛) 和条叶旋覆花(干燥地上部分)粉末(过3号筛) 各1.0 g,分别置于具塞锥形瓶中,精密加入40 ml 100%甲醇,密塞,称重,超声提取60 min后,静置放冷,再称重,加100%甲醇溶液补足失重,摇匀,过滤,取续滤液,在5 000 r/min条件下离心10 min,取上清液,即得条叶旋覆花头状花序和干燥地上部分的供试品溶液。
-
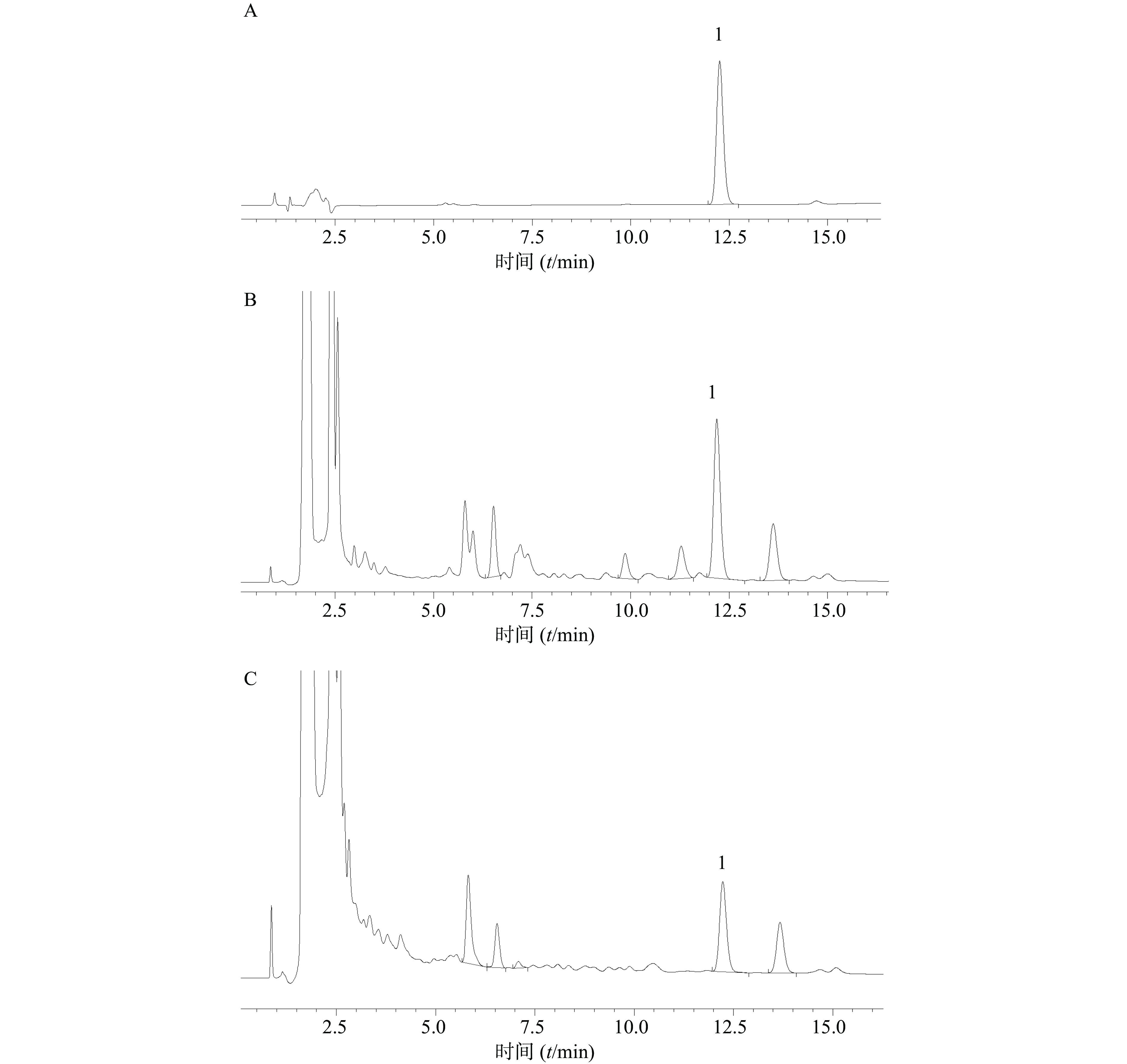
取“2.3”项下制备的对照品溶液(0.121 mg/ml)和“2.4”项下制备的两种供试品溶液,分别按“2.2”项下的色谱条件进样测定,采用二极管阵列检测器(DAD)进行全波长扫描,记录并查看保留时间为12.2 min处峰上5点的紫外吸收图。如图2所示,两种供试品溶液的最大吸收波长与对照品溶液的最大吸收波长一致,峰形均为单一峰,分离度达到规定的要求,该方法的专属性良好。
-
精密吸取“2.3”项下制备的浓度为0.121 mg/ml的线叶旋覆花内酯A对照品溶液各0.5、1、2、4、10、16、20、24 µl,根据“2.2”项下的条件进行色谱测定,记录峰面积积分值。以线叶旋覆花内酯A的进样量为横坐标(X,相当于µg数),峰面积积分值为纵坐标(Y),计算并绘制标准曲线。计算得线叶旋覆花内酯A含量测定的回归方程为Y = 1 040.5X+1.379(r = 1.000 0),理论板数平均为25 554。结果显示线叶旋覆花内酯A在0.060~2.904 µg范围内呈现良好的线性关系。
-
精密吸取等量 “2.3”项下制备的线叶旋覆花内酯A对照品溶液(0.121 mg/ml),根据“2.2”项下的条件进行色谱测定,记录线叶旋覆花内酯A的峰面积,连续测定6次。计算结果显示6份线叶旋覆花内酯A对照品溶液的峰面积RSD值为0.59%。表明仪器和方法具有较高的精密度,符合要求。
-
取 “2.4”项下制备的同一供试品,分别于提取后0、1、2、4、6、8、10、12 h按“2.2”项下的条件进行色谱测定,记录各谱图中线叶旋覆花内酯A的峰面积。结果显示,12 h内线叶旋覆花内酯A的峰面积的RSD为0.97%,具备良好的稳定性。
-
取样品批号为000 3的条叶旋覆花5份,分别精密称重,按照“2.2”项下的色谱条件,测定并计算线叶旋覆花内酯A的峰面积。根据结果计算得到其平均峰面积积分值为399.9,平均峰面积积分值的RSD值为1.04%,表明该方法测定线叶旋覆花内酯A的含量重现性良好。
-
在“2.2”项下的色谱条件下,以100%的甲醇为溶剂对线叶旋覆花内酯A对照品溶液(0.121 mg/ml)进行倍比稀释,按信噪比为3测定最低检测限。结果表明,当线叶旋覆花内酯A对照品的浓度为1.51 µg/ml、进样量为1 µl时,峰信号约为噪声的2 ~ 3倍,即最低检测限为1.51 ng。将线叶旋覆花内酯A对照品溶液稀释至浓度为0.453 µg/ml且信噪比约为10时,重复进样6次,计算得峰面积的RSD为1.96%,表明线叶旋覆花内酯A对照品的定量限为0.453 µg/ml,即4.53 ng。
-
取同一批号的样品6份(批号为000 3),分别精密加入与样品中线叶旋覆花内酯A含量相等的对照品,按“2.2”项下的色谱条件进行测定,计算线叶旋覆花内酯A的含量、回收率和RSD值。结果如表1所示,线叶旋覆花内酯A的平均回收率为95.77%,RSD为1.80%,表明该方法测定线叶旋覆花内酯A的加样回收率良好。
表 1 回收率试验结果
取样量(m/g) 样品中的含量(m/mg) 对照品加入量(m/mg) 测定量(m/mg) 回收率(%) 平均回收率(%) RSD(%) 0.505 0 0.803 0.770 1.555 97.8 95.77 1.80 0.524 2 0.834 0.770 1.557 94.3 0.502 8 0.799 0.770 1.519 93.7 0.509 1 0.809 0.770 1.562 97.8 0.504 9 0.803 0.770 1.534 95.2 0.509 6 0.810 0.770 1.546 95.8 -
分别精密称取对照品与7个批次样品的头状花序和干燥地上部分,按“2.3”项下与“2.4”项下分别制备对照品溶液和供试品溶液,按“2.2”项下的条件进行色谱测定分析,每批样品平行3次,记录峰面积。根据上述标准曲线计算7批样品中线叶旋覆花内酯A的平均含量。结果如表2所示,条叶旋覆花的头状花序中线叶旋覆花内酯A的平均含量为0.732%,干燥地上部分中线叶旋覆花内酯A的平均含量为0.125%,仅为头状花序的1/7。
表 2 条叶旋覆花的头状花序及地上干燥部分的含量测定结果
部位 编号 采集点 含量(%) 平均含量(%) 头状花序 0001 江苏省南京市玄武区 0.733 0.732 0002 江苏省南京市溧水区 0.693 0003 安徽省马鞍山市含山县 0.936 0004 江苏省淮安市盱眙县 0.509 0005 安徽省滁州市明光市 0.709 0006 安徽省滁州市凤阳县 0.564 0007 安徽省六安市霍邱县 0.983 干燥地上部分 0001 江苏省南京市玄武区 0.202 0.125 0002 江苏省南京市溧水区 0.141 0003 安徽省马鞍山市含山县 0.158 0004 江苏省淮安市盱眙县 0.123 0005 安徽省滁州市明光市 0.059 0006 安徽省滁州市凤阳县 0.068 0007 安徽省六安市霍邱县 0.122 -
提取方法和色谱条件是经过优化后选用的。本研究考察了超声、回流、浸渍3种提取方法,其中冷浸法提取出的线叶旋覆花内酯A含量最高,尽管提出率高,但提取的杂质最多,影响测定,热回流法提出的含量最低。考虑提取方法的提出率及操作的可行性和便捷性,选用超声法提取条叶旋覆花中的线叶旋覆花内酯A。随后本研究考察了选择不同溶剂(水、不同浓度的乙醇或甲醇等)、不同溶剂倍数的溶剂体积(10、20、40、60倍)及不同超声时间(10、20、40、60 min)等条件对线叶旋覆花内酯A的提取效果。结果显示,当溶剂为100%甲醇、体积倍数为样品质量的40倍、超声时间为40 min时,可以将条叶旋覆花中的线叶旋覆花内酯A充分提出。
通过比较 Inertsil ODS-3 C18(250 mm×4.6 mm,5 µm;岛津,日本)、Kromasil 100-5 C18(250 mm×4.6 mm,5 µm;瑞典)和 Agilent Zorbax SB C18(250 mm×4.6 mm,5 µm;安捷伦,美国)3种色谱柱,发现Agilent Zorbax SB C18 柱能更好地分离条叶旋覆花药材的化学成分,而且线叶旋覆花内酯A峰峰形较好,理论板数较高,故选用该色谱柱分析。另外,本研究考察了不同柱温(20、25、30 ℃)、不同流动相系统(甲醇-水、乙腈-水、乙腈-水-甲酸等系统)、不同流速(0.8、1.0、1.2 ml/min)等条件对分离效果的影响,结果表明柱温在30 ℃,以乙腈-水为流动相在1.2 ml/min的流速下梯度洗脱时,线叶旋覆花内酯A峰能较好地与其他峰达到基线分离。通过上述优化实验最终确定了方法部分所用的提取条件和色谱条件。
本文建立的以线叶旋覆花内酯A为标志物的金沸草的质量控制方法,能够帮助研究人员在对金沸草的研究开发过程中,对线叶旋覆花内酯A的含量进行质量控制,区分伪劣及混淆药材,选择质量合格的金沸草药材。另外,本研究发现相对于条叶旋覆花的干燥地上部分,线叶旋覆花内酯A在条叶旋覆花的头状花序中含量更高,是更有效的用药部位,为临床医师用药提供了参考。
Determination of britanin content in different parts of Inula linariifolia Turcz by HPLC
-
摘要:
目的 利用HPLC法对7批不同产地金沸草基源植物之一条叶旋覆花的干燥地上部分中线叶旋覆花内酯A的含量进行测定,并与其在头状花序中的含量比较,为金沸草药材质量标准的制定及合理应用提供依据。 方法 Agilent Zorbax SB C18色谱柱(250 mm×4.6 mm,5 μm),在柱温为30 ℃、流速为1.2 ml/min下以乙腈-水为流动相梯度洗脱,检测波长为212 nm。 结果 实验结果符合《中华人民共和国药典》(2015版)方法学验证的要求,金沸草基源条叶旋复花的头状花序中线叶旋覆花内酯A的平均含量为0.732%,在干燥地上部分的平均含量为0.125%,仅为头状花序的1/7,差异显著。 结论 建立的质量控制方法简单易行,可为条叶旋覆花的质量控制及合理用药提供数据支持和科学依据。 Abstract:Obejctive To determine and compare britanin content in dried aerial parts and capitulum of Inula linariifolia Turcz from 7 different origins by HPLC. Methods Analysis was performed on Agilent Zorbax SB C18 (250 mm×4.6 mm, 5 μm). Acetonitrile and water were used as mobile phase for gradient elution at 1.2 ml/min. Column temperature was 30 ℃ and the detection wavelength at 212 nm. Results The results meet the requirements of the method validation in 2015 edition of Chinese Pharmacopeia. The average britanin content in dried aerial parts of Inula linariifolia Turcz is 0.125% vs 0.732% in capitulum, which is significantly different. Conclusion The established method is simple and convenient. It can be used for quality control of Inula linariifolia Turcz. -
Key words:
- Inula linariifolia Turcz. /
- dried aerial parts /
- capitulum /
- britanin /
- content determination
-
氯吡格雷是一种前药,其代谢产物是血小板聚集抑制剂,可以选择性地抑制二磷酸腺苷(ADP)与其血小板P2Y12受体的结合及继发的ADP介导的糖蛋白GPⅡb/Ⅲa复合物的活化。它是经皮冠状动脉介入治疗(PCI)术后治疗方案中的主要药物,可以改善疾病的预后,预防支架内再狭窄[1]。但氯吡格雷作为前药,需要经肝药酶代谢为活性产物才能发挥药效。此外,还有其他因素会影响氯吡格雷的血药浓度和临床疗效,包括基因多态性,生理状况,肝肾功能、合用药物以及年龄等[2]。研究表明,主要是编码CYP2C19酶的等位基因突变会导致氯吡格雷代谢减慢,使其对血小板的抑制作用减弱。已有报道认为在亚裔人群中,能导致P450酶活性下降或者丢失的等位基因有两个位点,一个是CYP2C19*2,另一个是CYP2C19*3,这两个等位基因的突变都会导致氯吡格雷疗效减弱[3-5]。
由于氯吡格雷的疗效和不良反应存在个体差异,不同患者的剂量需求不一样[6-7]。本研究通过实验对PCI术后患者的代谢酶基因型和体内血药浓度进行测定,探索基因多态性对血药浓度、血小板抑制率和安全性的影响,来指导临床实施个体化治疗,为PCI术后患者的合理治疗提供依据。
1. 材料与方法
1.1 仪器与试剂
LC-20AB高效液相色谱系统(检测器为SPD-M20A,日本岛津);TG1650-WS高速离心机(上海卢湘仪);乙腈(色谱纯,德国Merck);甲酸(分析纯,中国国药集团)。荧光检测仪(西安天龙科技有限公司);PHARM-GENE 01 SNP分析保存液;PHARM-GENE 200 SNP分析样本处理试剂;NH4Cl预处理液。氯吡格雷片(波立维,75mg,赛诺菲制药,批准文号:J20180029),阿司匹林肠溶片(拜阿司匹林,100mg,批准文号:H20130339)。
1.2 研究对象
纳入2017年6月至2019年12月心内科87 例PCI 术后服用氯吡格雷联合阿司匹林抗血小板治疗的患者(氯吡格雷75mg,1次/d;阿司匹林100 mg,1次/d)。
纳入标准如下:①接受氯吡格雷联合阿司匹林双抗治疗的患者,年龄<80岁;②氯吡格雷用药时间应大于5 d,以保证体内药物处于稳态。
排除标准如下:①使用了对药物代谢酶活性有影响的药物,包括细胞色素P450 的诱导剂(如苯巴比妥、水合氯醛、苯妥英钠、利福平等)和活性抑制剂(如氯霉素、对氨基水杨酸、异烟肼、保泰松等);②治疗前或治疗中发生了肝或肾功能改变;③同一份样品,经多次测量,其血药浓度变异系数(CV)>25%。本研究经医院伦理委员会批准(批号:2017-KL002-03)。
1.3 血样采集与检测
1.3.1 血样采集
药物在体内经4~5个给药周期可以达到稳态,所以于氯吡格雷开始服药后第6天,在给药前静脉采血。
1.3.2 氯吡格雷血药浓度监测
使用RP-HPLC法检测人血浆中氯吡格雷的药物浓度,血清样品300 μl置于1.5 ml离心管中,加内标溶液900 μl,涡旋振荡30 s,以15000 r/min转速,离心3 min,取上清液10 μl,经0.45 μm滤膜过滤后进样分析[8]。
1.3.3 CYP2C19基因型的检测
使用非扩增免疫杂交技术检测CYP2C19的基因型,操作步骤:①使用耀金保预处理标本,收集DNA;②耀金分带有针对特定SNP位点的荧光染色原位杂交探针,使用耀金分对标本DNA进行原位杂交检测;③标本DNA中含有特定碱基时可以检测到荧光信号,判断目标碱基类型[9]。
1.4 血小板抑制率的评估
血栓弹力图是一种检测方式,便于快速、准确地对血小板的活性以及抗血小板聚集的效果进行评价和分析。记录的参数包括:凝血反应时间(R)、凝血形成时间(K)、凝固角(α)、最大血凝块强度(MA)和综合凝血指数。
1.5 安全性评估
氯吡格雷最主要的不良反应包括呼吸困难以及出血。根据国际多中心、随机对照试验(PLATO)[10],按照呼吸困难的程度划分:轻度,易于察觉到的轻微呼吸困难症状,但可以耐受,不影响正常体力活动;中度,呼吸困难影响了正常的体力活动,但可以耐受;重度,呼吸困难导致无法完成正常的体力活动。根据PLATO研究[10]将出血事件分为:主要出血和次要出血。
1.6 统计分析
样本的基因频率经Hardy-Weinberg遗传平衡检验,检验结果P>0.05,表明收集的样本符合H-W平衡,具有群体代表性。所有数据采用SPSS20.0进行统计分析。率的比较选择双侧χ2检验,各组之间的血药浓度比较采用方差分析或t检验,P<0.05为差异有统计学意义。
2. 结果
2.1 样本基本特征
本研究中共纳入87名患者,均检测了CYP2C19的基因型和氯吡格雷的血药浓度测定。其中男性46名,女性41名,患者平均年龄为(66.2±7.9)岁,平均体重(55.3±12.3)kg。患者基本情况及检测结果见表1。对样本CYP2C19的基因频率进行了Hardy-Weinberg遗传平衡检验,计算结果Chi-square为1.12,P>0.5,结果见表2。结果表明,收集的样本符合H-W平衡,具有群体代表性。
表 1 患者的基本特征(n=87)项目 信息 值 人口学特征 性别(男/女) 46/41 年龄(n±s) 66.2±7.9 体重(n±s) 55.3±12.3 基因型 快(例) 34 中(例) 38 慢(例) 15 血栓弹力图参数 R(min) 5.72±1.51 K(min) 1.52±0.33 α角(deg) 70.44±7.02 MA(mm) 65.58±5.93 综合凝血指数 1.01±1.33 血小板抑制率(%) 62.56±31.22 不良反应 呼吸抑制(%) 10.34%(9/87) 出血(%) 5.75%(5/87) 表 2 CYP2C19基因型分布频率(n=87)基因表型 基因型 基因频率/% Chi-square H-W平衡检验/P 快 CYP2C19*1/*1 43.59(34/87) 1.12 >0.5 中 CYP2C19*1/*2 48.71(38/87) CYP2C19*1/*3 慢 CYP2C19*2/*2 7.69(15/87) CYP2C19*3/*3 2.2 氯吡格雷治疗后的血小板抑制率和安全性
87例患者接受氯吡格雷治疗后,血药浓度分布于2~7 mg/L之间,血小板抑制率分布于20%~90%之间。常见的不良反应是呼吸抑制[10.34%(9/87)]和出血[5.75%(5/87)]。
2.3 基因多态性对血药浓度、血小板抑制率和安全性的影响
在本研究中,根据CYP2C19的基因型进行了分类(快、中、慢)。快、中和慢代谢型患者的平均血药浓度分别为2.64±1.03、2.88±1.79和5.23±3.23 mg/L,使用t检验分析两两之间的血药浓度,结果显示,血药浓度在快、中代谢型之间没有显著性差异(P=0.667),但慢代谢型中的血药浓度在与快、中代谢型比较时有统计学差异(P<0.05)。快、中、慢代谢型的血小板抑制率分别是(66.26±24.71)%、(67.77±22.32)%和(42.45±17.88)%,采用方差分析进行统计,显示基因多态性对血小板抑制率有显著性影响(P<0.05)。不良反应发生率分别是8.97%(7/87)、5.13%(4/87)和0%(0/87),采用Fishier确切概率法对不良反应进行统计分析,结果显示,基因多态性对用药安全亦有显著性影响(P<0.05),见表3。
表 3 CYP2C19基因型与氯吡格雷血药浓度、血小板抑制率和不良反应发生率的关系基因型 基因多态性 浓度(mg/L) 血小板抑制率(%) 不良反应(%) 快 CYP2C19*1/*1 2.64±1.03 66.26±24.71 8.97(7/87) 中 CYP2C19*1/*2 2.88±1.79 67.77±22.32 5.13(4/87) CYP2C19*1/*3 慢 CYP2C19*2/*2 5.23±3.23 42.45±17.88 0(0/87) CYP2C19*3/*3 3. 讨论
氯吡格雷属于前药,需要在体内经代谢后才能起效。因此,不同患者之间存在明显的个体差异。有性别、体重、年龄、合并用药等非遗传因素,但主要还是编码药物代谢酶及转运体的基因多态性。国内外对氯吡格雷在健康和患病人群中进行的一系列深入研究,结果一致表明该药物的体内过程同时受多种因素的影响[11]。对于不同个体、不一样的人群,它的治疗效果和安全性存在较大的差异。所以,我们应该关注基因多态性与血药浓度变化之间的关系。
氯吡格雷的血药浓度受CYP2C19基因型的影响,在治疗前行基因检测可以预测初始疗效,血药浓度监测结合基因检测技术的个体化给药可能有助于减少不良反应且提高疗效。近几年有许多关于CYP2C19基因多态性影响药物药动学参数的研究,比较了CYP2C19突变型与野生型对氯吡格雷代谢的影响,结果显示突变型的血清氯吡格雷浓度较高[11]。这表明CYP2C19基因缺失影响了氯吡格雷的代谢。关于氯吡格雷的群体药动学模型参数的研究显示[12],CYP2C19基因型改变了氯吡格雷的药动学参数,CYP2C19突变型的氯吡格雷原药体内浓度高于野生型,且清除率也高于野生型,不因性别,年龄和体重等因素而改变。这表明CYP2C19发生突变不但可能使活性产物减少,而且还会加快氯吡格雷的体内清除速度。
此外,还有一些现象无法完全用基因型和血药浓度的差异来解释,这可能需要考虑患者的个体差异。如CYP2C19为快代谢型,血药浓度亦处于正常范围,但患者出现了氯吡格雷相关的不良反应或有胸痛等症状。应考虑是个体差异导致的,建议停药,并观察生命体征变化,还需要进一步随访来确证是否为氯吡格雷个体差异所致。
本研究表明,氯吡格雷的血药浓度在CYP2C19快、中代谢型患者中并无差异,但慢代谢型患者的浓度与快、中代谢型患者比较差异较大;且不同CYP2C19基因型对氯吡格雷有效性及安全性的影响也有差异。但个别案例仅通过CYP2C19基因多态性无法解释氯吡格雷疗效的差异,这可能与影响氯吡格雷药效的因素众多有关,故仅根据CYP2C19基因型指导氯吡格雷临床用药并不一定达到较好的治疗效果,可联合CYP2C19基因型检测与血药浓度监测来指导氯吡格雷的临床个体化给药。
-
表 1 回收率试验结果
取样量(m/g) 样品中的含量(m/mg) 对照品加入量(m/mg) 测定量(m/mg) 回收率(%) 平均回收率(%) RSD(%) 0.505 0 0.803 0.770 1.555 97.8 95.77 1.80 0.524 2 0.834 0.770 1.557 94.3 0.502 8 0.799 0.770 1.519 93.7 0.509 1 0.809 0.770 1.562 97.8 0.504 9 0.803 0.770 1.534 95.2 0.509 6 0.810 0.770 1.546 95.8 表 2 条叶旋覆花的头状花序及地上干燥部分的含量测定结果
部位 编号 采集点 含量(%) 平均含量(%) 头状花序 0001 江苏省南京市玄武区 0.733 0.732 0002 江苏省南京市溧水区 0.693 0003 安徽省马鞍山市含山县 0.936 0004 江苏省淮安市盱眙县 0.509 0005 安徽省滁州市明光市 0.709 0006 安徽省滁州市凤阳县 0.564 0007 安徽省六安市霍邱县 0.983 干燥地上部分 0001 江苏省南京市玄武区 0.202 0.125 0002 江苏省南京市溧水区 0.141 0003 安徽省马鞍山市含山县 0.158 0004 江苏省淮安市盱眙县 0.123 0005 安徽省滁州市明光市 0.059 0006 安徽省滁州市凤阳县 0.068 0007 安徽省六安市霍邱县 0.122 -
[1] 国家药典委员会. 中华人民共和国药典2015年版(一部)[M]. 北京: 中国医药科技出版社, 2015: 112. [2] 郭伟琳, 冷红琼, 邓亮, 等. UPLC法同时测定旋覆花属植物中2种倍半萜内酯成分的含量[J]. 昆明医科大学学报, 2012, 33(12):4-6, 10. doi: 10.3969/j.issn.1003-4706.2012.12.002 [3] 马立满, 刘震, 尚明英, 等. HPLC法测定旋覆花药材中旋覆花素和去乙酰旋覆花素的含量[J]. 中国药房, 2016, 27(3):369-371. doi: 10.6039/j.issn.1001-0408.2016.03.28 [4] 耿红梅, 张嫡群, 王云志, 等. 欧亚旋覆花中总黄酮的测定[J]. 中草药, 2006, 37(3):450-451. doi: 10.3321/j.issn:0253-2670.2006.03.049 [5] 杨茜, 刘慧, 何雅君, 等. HPLC法同时测定旋覆花属植物中5种倍半萜内酯成分的含量[J]. 沈阳药科大学学报, 2012, 29(2):116-120. [6] 万祺, 龙凌云, 裴月湖, 等. 旋覆花中鞣质的含量测定[J]. 时珍国医国药, 2007, 18(11):2758-2759. doi: 10.3969/j.issn.1008-0805.2007.11.087 [7] 张卫东, 杨保华, 游蓉丽, 等. 线叶旋覆花内酯A在制备预防/治疗慢性阻塞性肺疾病药物中的应用: 107998122A[P]. 2018-05-08. [8] 张卫东, 单磊, 金慧子, 等. 线叶旋覆花内酯A在制备治疗心肌炎药物中的应用: 102727486A[P]. 2012-10-17. [9] YANG T, ZHANG J, LU J H, et al. Risk factors influencing postoperative outcomes of major hepatic resection of hepatocellular carcinoma for patients with underlying liver diseases[J]. World J Surg,2011,35(9):2073-2082. doi: 10.1007/s00268-011-1161-0 [10] PARK H H, KIM M J, LI Y, et al. Britanin suppresses LPS-induced nitric oxide, PGE2 and cytokine production via NF-κB and MAPK inactivation in RAW 264.7 cells[J]. Int Immunopharmacol,2013,15(2):296-302. doi: 10.1016/j.intimp.2012.12.005 -





 下载:
下载:

 下载:
下载: