-
微丸是指直径小于2.5 mm(或0.5~1.5 mm)的球形或类球形固体剂型[1]。相比传统的中药水煎剂和化学药片剂,微丸具有能够提高药物与胃肠道的接触面积,增加药物的生物利用度;载药范围宽,流动性好,体积小等特点;且单个微丸的缺陷不影响制剂的整体释放效果,尤其适用于复方制剂的配伍,同时能够提高药物的稳定性[2-4]。
溃疡性结肠炎(UC)是一种常见的自身免疫性疾病[5]。传统的UC治疗药物包括肾上腺皮质激素类(如泼尼松)、氨基水杨酸类(如美沙拉嗪)和免疫抑制剂类(如硫唑嘌呤)等,上述药物针对轻重度患者均有较好的治疗效果,但只能缓解症状,且长期应用副作用较大[6-7]。中医药在治疗溃疡性结肠炎方面独具优势,但剂型的落后、给药方式的局限在很大程度上影响了中药疗效的发挥[8-9]。本研究选择中药临床验方“白术黄连方[10]”为模型方剂,根据其组方特点和药物成分特性,以膜控型包衣微丸为给药载体,将其处方中的药物分别制备成“胃溶微丸”和“肠溶微丸”,进一步组合成结肠靶向给药胶囊,以期为临床溃疡性结肠炎的治疗提供一种新的有效制剂,同时为复方中药新药开发提供方法学借鉴。
-
101A-2型干燥箱(上海实验仪器总厂);AG285十万分之一电子分析天平(瑞士Mettler Toledo公司);SB100D超声波清洗器(宁波新芝生物科技股份有限公司);Agilent 1100高效液相色谱仪(美国安捷伦科技有限公司);5804R高速冷冻离心机(德国Eppendorf公司);FlexStream™ MP1流化床、NICA™ E140挤出机、NICA™ S450滚圆机(德国基伊埃技术设备有限公司);RCZ-6C3型药物溶出仪(上海黄海药检仪器厂)。
-
白术挥发油(批号:XC20170225)、黄连提取物(批号:XC20170113)、防风提取物(批号:XC20170216)购自西安小草植物科技有限公司;盐酸小檗碱对照品(按含C20H18ClNO4计为86.7%,批号:5UVU-ZFW7)购自中国食品药品检定研究院;β-环糊精(β-CD,曲阜市天利药用辅料有限公司,批号:161202);微晶纤维素(MCC,湖州市菱湖新望化学有限公司,批号:P101D0516N09);无水乳糖(DMV-Fonterra Excipients GmbH & Co.KG,Germany,批号:10147P9);交联聚维酮(PVPP XL-10,上海源叶生物科技有限公司,批号:B22A7S19749);丙烯酸树脂EUDRAGIT® L30D-55(以下简称L30,批号:B170314162)、丙烯酸树脂EUDRAGIT® FS30D(以下简称FS30,批号:C170265001)购自Evonic Rolm GmbH公司;羟丙甲基纤维素(HPMC,上海阿拉丁生化科技股份有限公司,批号:K1717099);柠檬酸三乙酯(TEC,上海昌为医药辅料技术有限公司,批号:170712);水为重蒸水,其他试剂均为分析纯。
-
色谱柱:依利特Hypersil BDS C18柱(4.6 mm×250 mm,5 μm),流动相:乙腈-0.05 mol/L磷酸二氢钾(0.5%三乙胺,磷酸调至pH=3)等度洗脱,比例:30∶70,流速1.0 ml/min,紫外检测波长345 nm,柱温25 ℃,进样量20 μl。
-
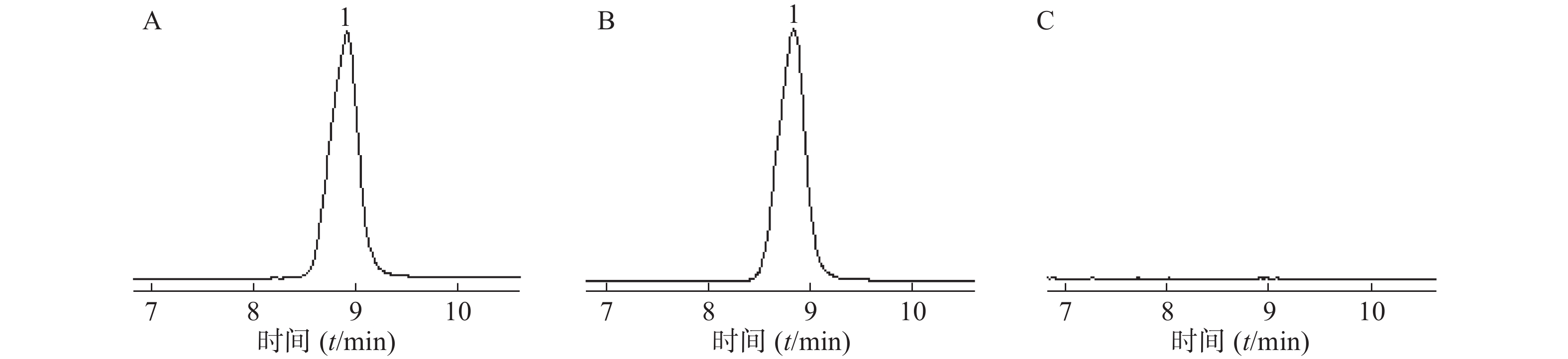
精密称取盐酸小檗碱对照品1.0 mg,用甲醇溶解定容于10 ml容量瓶中作为储备液,将此储备液用甲醇逐级稀释成系列对照品溶液,进样测定。取少量肠溶微丸研碎,称取一定量粉末,加入甲醇,超声提取30 min,3 000 r/min离心后取上清,定容后过0.45 μm滤膜得到供试品溶液。同法制备空白辅料溶液。方法学考察表明,盐酸小檗碱在(0.05~50.00)μg/ml浓度范围内线性关系良好,回归方程为:Y=100 513X−5 262.7(r=0.999 9)。甲醇、空白辅料对肠溶微丸中盐酸小檗碱的含量测定没有干扰,专属性良好(图1)。取浓度为10.0、20.0和50.0 μg/ml的盐酸小檗碱对照品溶液连续进样6次,连续测定3 d,记录色谱图峰面积,得到3个浓度的盐酸小檗碱的日内精密度结果分别为0.19%、0.42%、1.52%,日间精密度分别为0.58%、1.43%、1.28%。称取适量黄连提取物,分别加入浓度为10.0、20.0、50.0 μg/ml的盐酸小檗碱对照品溶液,超声提取30 min,3000 r/min离心后取上清液,定容后过0.45 μm滤膜,进样测定,记录色谱图峰面积,加样回收率RSD分别为0.85%、1.90%、0.60%,表明该方法可用于肠溶微丸中盐酸小檗碱的含量测定。
-
载药量、填充剂比例、润湿剂和黏合剂的用量对微丸的成型起到至关重要的作用。因此,我们采用单因素筛选的方法对上述4个因素进行了考察,评价的指标分别为微丸的圆整度、目标微丸的收率和物料黏性。
根据处方,黄连提取物与防风提取物的比例为15∶12。固定MCC:乳糖=5∶2,PVPP用量5%,水为润湿剂,6% HPMC为黏合剂。考察载药量对微丸圆整度、收率及物料黏性的影响,结果见表1。
表 1 载药量对微丸特性的影响
载药量(%) 圆整度(θ/°) 收率(%) 物料黏性 27 21.2 95.76 黏性适中,手握成团,轻压即散 40.5 23.7 89.64 黏性略大,易捏合成团 54 24.1 74.38 黏性极大,易黏附于器壁 同样采用单因素筛选的方法分别对填充剂比例、润湿剂用量和黏合剂用量进行了考察。固定载药量为27%,以水为润湿剂,PVPP用量为5%,6% HPMC为黏合剂,考察MCC与乳糖之比对微丸圆整度、收率及物料黏性的影响;固定载药量为27%,PVPP用量5%,6% HPMC为黏合剂,考察润湿剂的用量对微丸圆整度、收率及物料黏性的影响;固定载药量为27%,PVPP用量5%,水为润湿剂,考察黏合剂6% HPMC的用量对微丸圆整度、收率及物料黏性的影响。
根据单因素实验的结果,综合考虑微丸圆整度、收率和物料黏性等因素,最终确定优化后的丸芯处方为:载药量27%,PVPP 5%,MCC与乳糖之比5∶2,润湿剂占干物料比重30%,黏合剂占干物料比重20%,并以此条件制备3批丸芯进行验证试验,结果表明处方配比合理。
-
选取挤出速度、滚圆速度和滚圆时间进行三因素三水平正交实验,对工艺参数进行优化。按照表2分组进行微丸的制备,每组按投入干物料100 g进行实验。计算目标微丸收率Y(%,18~30目)和微丸圆整度(θ),并以微丸的成球性(Y-2θ)作为评价指标。
表 2 L9(34)正交试验设计与结果
实验编号 因素 收率(Y/%) 圆整度(θ/°) Y-2θ A挤出速度(Hz) B滚圆速度(r/min) C滚圆时间(t/min) 1 20 500 3 96.24 23.0 50.24 2 20 700 5 93.33 21.5 50.33 3 20 900 7 82.68 22.0 38.68 4 30 500 5 95.41 24.0 47.41 5 30 700 7 92.70 21.0 50.70 6 30 900 3 81.02 24.0 33.02 7 40 500 7 93.82 22.5 48.82 8 40 700 3 93.24 23.0 47.24 9 40 900 5 83.54 25.0 33.54 均值1 46.417 48.823 43.500 均值2 43.710 49.423 43.760 均值3 43.200 35.080 46.067 极差 3.217 14.343 2.567 结果表明,3个因素对综合评分的影响顺序为B>A>C,表3方差分析结果表明,3个因素对综合评分并无显著影响(P>0.05)。考虑到实际实验过程中较大的滚圆速度有利于减少微丸细粉的产生并提高生产效率,最终确定优化后的工艺参数为A1B2C3,即挤出速度20 Hz,滚圆速度700 r/min,滚圆时间7 min。
表 3 方差分析结果
因素 偏差平方和 自由度 F比 F临界值 显著性 A挤出速度(Hz) 17.933 2 0.127 5.140 P>0.05 B滚圆速度(r/min) 394.970 2 2.789 5.140 P>0.05 C滚圆时间(t/min) 11.976 2 0.085 5.140 P>0.05 误差 424.88 6 -
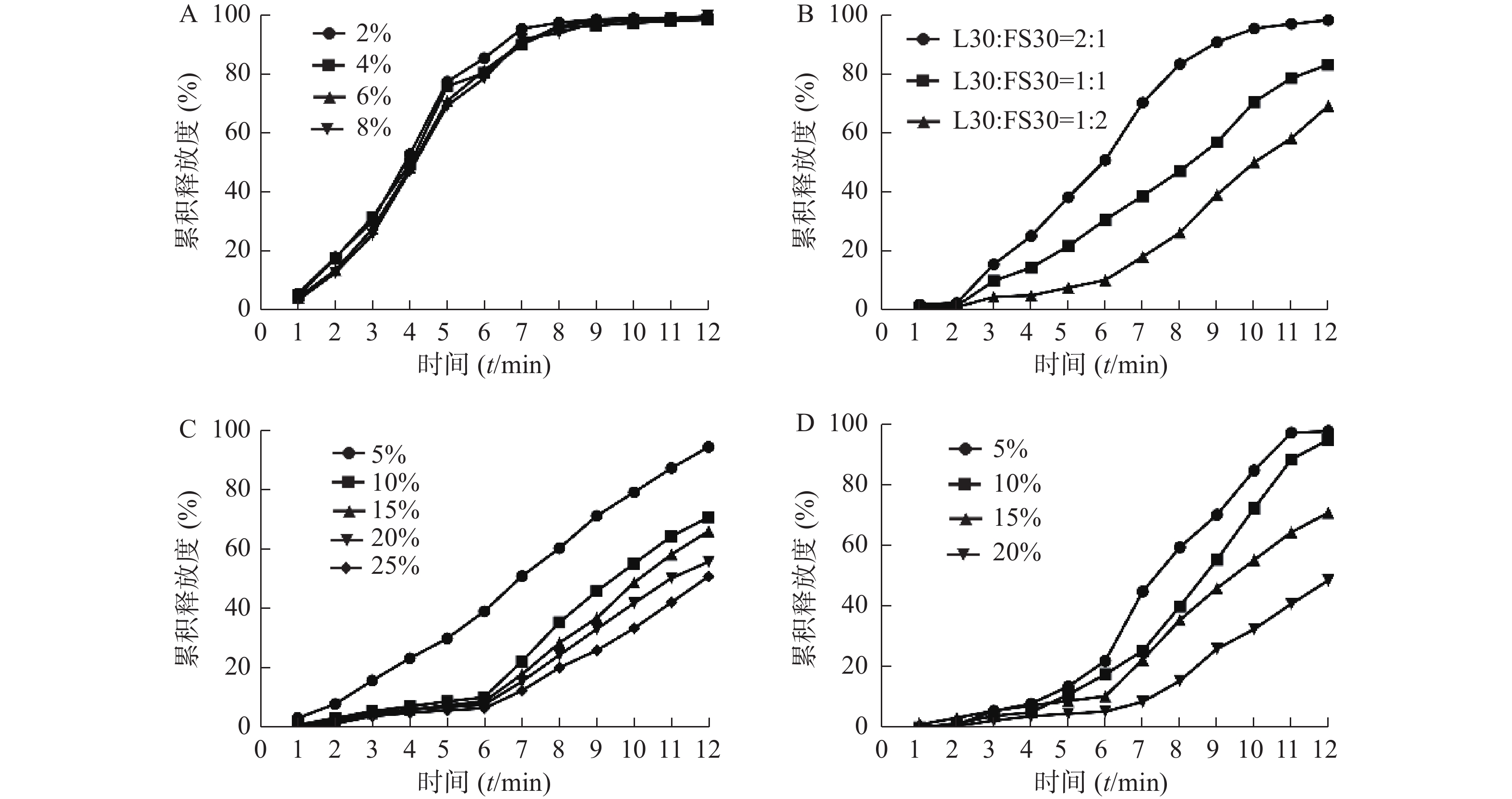
药物在溶出时,完整的包衣膜决定了微丸内部和介质之间存在一定的渗透压差。丸芯内外压差对药物的释放影响作用较大,因此,在处方筛选过程中,必须考察丸芯的隔离情况[11]。包制隔离衣后,也使后续包制的肠溶衣膜厚度更加均匀,保证了包衣过程的连续性。固定丸芯原辅料比例不变,分别考察了隔离衣增重为2%、4%、6%和8%时肠溶微丸中盐酸小檗碱的释放情况,累积释放曲线如图2A。结果表明隔离衣增重对累积释放度的影响不显著,最终采用4%的HPMC溶液进行隔离衣的包制,包衣增重为丸芯重量的2%。
-
聚合物比例、增塑剂用量和包衣增重是调节膜控型微丸释药速率的3个关键因素。因此,同样采用单因素筛选的方法对上述3个因素进行考察,并绘制不同参数下的累积释放曲线。
固定微丸的隔离衣增重为2%,肠溶衣增重为15%,考察聚合物不同比例对盐酸小檗碱累积释放度的影响,累积释放曲线如图2B所示,结果表明,当L30与FS30之比为1∶2,符合对累积释放度设定的标准。
固定L30与FS30之比为1∶2,包衣增重为15%,考察增塑剂用量占干聚物比例为5%、10%、15%、20%和25%时对微丸中盐酸小檗碱累积释放度的影响。图2C结果表明,当增塑剂用量为10%~25%时,药物释放基本满足给定的标准,但实际操作中发现增塑剂用量变大时,微丸包衣难度加大,易产生粘连现象。最终将增塑剂用量定为10%,既能满足释放要求,又能保证较高的生产效率。
最后对包衣增重进行筛选,固定L30与FS30之比为1∶2,考察包衣增重为5%、10%、15%和20%时对微丸中盐酸小檗碱累积释放度的影响,结果如图2D所示,当包衣增重为15%时,满足对累积释放度设定的标准。
根据单因素筛选的结果,最终确定包衣处方为:隔离衣增重2%,L30与FS30之比为1∶2,增塑剂用量10%,包衣增重为15%。按此处方制备3批微丸进行验证试验,工艺参数如下:喷嘴直径1 mm,输液管直径3 mm,雾化压力1.8 bar,蠕动泵转速2.5 r/min,进风温度32 ℃,进风量50 cm2,干燥温度28 ℃,干燥时间30 min。结果表明,据此条件制备的肠溶微丸满足对累积释放度设定的标准。
-
采用饱和水溶液法制备包合物。称取规定量的β-CD加入10倍蒸馏水,置于70 ℃的恒温水浴锅中,搅拌使成饱和溶液。在30 ℃下边搅拌边缓慢滴加一定量(挥发油与β-CD之比为1∶6)白术挥发油(用无水乙醇预先配置成1∶1的溶液),恒温搅拌1.5 h,冷却至室温,在4 ℃冰箱中冷藏24 h,抽滤后用无水乙醇冲洗3次(每次10 ml),40 ℃干燥4~5 h即得白术挥发油β-CD包合物[12]。
-
参照肠溶微丸的处方筛选过程,对胃溶微丸的处方同样进行单因素筛选。实验过程中发现,包合物由于粉末较为细腻,在与微晶纤维素和乳糖混合后,仅需加入少量水作为润湿剂就可以得到塑性良好的湿物料,且易于挤出-滚圆成丸,因此,胃溶微丸的处方中不再添加黏合剂。仅对载药量、填充剂比例和润湿剂用量进行考察。经单因素实验筛选后最终确定优化后胃溶微丸的丸芯处方为:载药量50%,PVPP5%,微晶纤维素与乳糖之比2∶1,润湿剂占干物料比重40%,并以此条件制备3批丸芯进行验证试验,结果表明处方可行。
-
同样选取挤出速度、滚圆速度和滚圆时间进行三因素三水平正交试验对工艺参数进行优化。按照表4分组进行微丸的制备,每组按投入干物料100 g进行实验。计算目标微丸收率Y(%,16~24目)和微丸圆整度(θ),并以微丸的成球性(Y-2θ)为评价指标。
表 4 L9(34)正交试验设计与结果
实验编号 因素 收率(Y/%) 圆整度(θ/°) Y-2θ A挤出速度(Hz) B滚圆速度(r/min) C滚圆时间(t/min) 1 20 500 3 87.31 24.5 38.31 2 20 700 5 90.12 24.0 42.12 3 20 900 7 82.88 24.5 33.88 4 30 500 5 93.90 27.0 39.90 5 30 700 7 90.68 25.5 39.68 6 30 900 3 81.01 23.0 35.01 7 40 500 7 96.08 25.5 45.08 8 40 700 3 90.20 27.0 36.20 9 40 900 5 80.36 26.5 27.36 均值1 38.103 41.097 36.507 均值2 38.197 39.333 36.460 均值3 36.213 32.083 39.547 极差 1.984 9.014 3.087 实验结果表明,3个因素对综合评分的影响顺序为B>C>A,方差分析结果(表5)表明,3个因素对综合评分并无显著性影响(P>0.05)。考虑到简化制备过程以降低成本,最终确定优化后的工艺参数为A1B1C2,即挤出速度20 Hz,滚圆速度500 r/min,滚圆时间5 min。
表 5 方差分析结果
因素 偏差平方和 自由度 F比 F临界值 显著性 A挤出速度(Hz) 7.514 2 0.138 5.140 P>0.05 B滚圆速度(r/min) 136.912 2 2.517 5.140 P>0.05 C滚圆时间(t/min) 18.771 2 0.345 5.140 P>0.05 误差 163.20 6 -
配制浓度为4%的HPMC溶液,流化床底喷包衣进行胃溶衣的包制,包衣增重为2%。包衣参数如下:喷嘴直径1 mm,输液管内径3 mm,雾化压力1.5 bar,蠕动泵转速2.5 r/min,进风口温度45 ℃,进风量50 m3/h,干燥温度40 ℃,干燥时间30 min。
将胃溶微丸与肠溶微丸按照质量比1∶1的比例装入0号硬质胶囊,得到白术黄连微丸口服结肠靶向胶囊。
-
按照《中国药典》2015版四部通则0931溶出度与释放度测定法第二法:桨法,评价肠溶微丸的释药特性。溶出介质体积为750 ml,转速100 r/min,温度(37±0.5)℃。分别在pH 1.2的人工胃液中释放2 h,pH 6.8的人工小肠液中释放4 h,pH7.6的人工结肠液中释放18 h,溶出介质体积均满足漏槽条件。分别于1~14 h之间每1 h一次,14~24 h之间每2 h一次,定时取样1 ml,随后立即补加同温同体积介质1 ml,将收集的样品过0.45 μm滤膜后按照“2.1.1”项下方法进样测定,计算体外累积释放度,释放曲线如图3所示。结果表明,按照最优处方制备出的肠溶微丸在人工胃液中2 h基本不释放,人工小肠液中4 h累积释放量小于10%,人工结肠液中缓慢释放,24 h基本释放完全,兼具缓释和结肠靶向的特性。
-
将肠溶微丸的释药曲线分别按零级、一级和Higuchi方程进行拟合[13],得到的结果如表6所示。结果表明,其释放行为符合Higuchi方程释药模型(r=0.9054)。
表 6 肠溶微丸不同释药行为的拟合方程
模型 拟合方程 r 零级 Q=3.298t+4.231 0.8303 一级 ln(1−Q)=144.633 t+0.037 0.8966 Higuchi Q=25.075 t1/2−36.962 0.9054 -
本研究首先将处方中黄连的有效成分黄连生物碱和防风的有效成分色原酮、多糖等采用L30与FS30混合包衣,制备肠溶微丸;再将白术的有效部位——挥发油类成分通过环糊精包合成挥发油β-CD包合物,制备成胃溶微丸;然后将两种微丸按比例混合装入胶囊,得到口服结肠靶向胶囊。药物口服后,能够发挥“两步释放”的效果,白术的有效成分首先在胃内释放;黄连生物碱和防风色原酮等成分在结肠部位缓慢释放,二者合一,体现了中医药整体与局部相结合的治法治则[14]。
肠溶微丸的制备采用挤出-滚圆工艺和流化床包衣技术,工艺稳定性和重现性好,适用于工业化大生产。肠溶微丸中药物的释放主要通过膜控来实现,而高分子材料丙烯酸树脂L30和FS30分别在pH>5.5和pH>7.0环境中溶解。因此,可通过混合并调节两者的用量,获得在小肠末端开始释放,到达结肠后大量释放的混合材料,起到缓释和结肠定位的双重作用。同时,本研究使用混合材料进行单层衣膜的包制,简化了包衣步骤,降低了多层包衣造成的成本损耗。依据本实验处方工艺连续制备3批肠溶微丸,释放度结果显示该3批微丸均具有良好的缓释效果,且批间差异小,表明本处方工艺合理,简单易行,重现性良好,适用于工业化生产。
经口服进入胃内的药物在2~4 h后基本会全部通过,随后进入小肠继续吸收,这一过程需要5~6 h,最后进入结肠被进一步重吸收,12~24 h后才会排出体外[15]。因此,将微丸中盐酸小檗碱的释放度标准定为,在pH1.2的人工胃液中2 h基本无释放(<5%),pH6.8的人工小肠液中4 h累积释放度<10%,pH7.8的人工结肠液中6 h累积释放度>60%。聚合物比例决定了肠溶衣膜溶解的速率,进而影响药物的释放度。适量增塑剂的加入可降低玻璃化温度和最低成膜温度,有助于提高包衣膜的完整性,柠檬酸三乙酯类的增塑剂还能够增加包衣膜的柔性。通过对包衣增重的调整,也可以使药物的释放度符合预期的设计。
将白术挥发油包合后,能够有效掩盖药物的不良气味,同时增加有效成分的稳定性,实现了液体药物向固体制剂的转化。胃溶微丸在口服后,表面衣膜与介质接触后不断溶胀,由于溶胀层较薄,丸芯中的MCC和乳糖吸水后大幅膨胀导致微丸迅速崩解成细颗粒,溶出介质将包合物溶解后形成浓度差,促进了药物的扩散释放,有利于药物迅速吸收入血,发挥全身作用。
Preparation and in-vitro drug release of Baizhu Huanglian pellets containing colon-targeting capsules
-
摘要:
目的 将中药“白术黄连方”制备成以胃溶微丸和肠溶微丸为基础的结肠靶向胶囊,优化其处方组成和制备工艺,考察其体外释放特性。 方法 采用单因素实验和正交实验法优化微丸的处方组成和工艺参数。用挤出-滚圆技术制备素丸,流化床底喷方式进行包衣,考察隔离衣增重、肠溶衣中聚合物比例、增塑剂用量和包衣增重对肠溶微丸释放行为的影响,并对其释药行为进行模型拟合。 结果 最终确定胃溶微丸的处方为:载药量50%,交联聚维酮(PVPP)5%,微晶纤维(MCC):乳糖=2∶1,润湿剂40%;工艺参数为:挤出速度20 Hz,滚圆速度500 r/min,滚圆时间5 min。肠溶微丸的处方为:载药量27%,PVPP 5%,MCC:乳糖=5∶2,润湿剂30%,粘合剂20%;工艺参数为:挤出速度20 Hz,滚圆速度700 r/min,滚圆时间7 min;肠溶衣处方为:EUDRAGIT® L30D-55:EUDRAGIT® FS30D=1∶2,增塑剂用量10%,包衣增重15%。肠溶微丸的体外释放时间达24 h,其释放行为符合Higuchi模型。 结论 成功制备了白术黄连微丸结肠靶向胶囊,肠溶微丸表现出缓释和结肠靶向的特性。 Abstract:Objective Colon-targeting capsules based on gastric pellets and enteric pellets were prepared from Baizhu Huanglian prescription. The formulation composition and preparation process were optimized and the in-vitro release characteristics were investigated. Methods Optimum formulation composition and process parameters of Baizhu Huanglian pellets were screened out by single factor experiment and orthogonal design. The pellets core were prepared by extrusion-spheronization technique and coated in the fluid bed using bottom spray coating technique. To investigate the effect of coating level of the isolation layer, the proportion of polymer, the amount of plasticizer and weight gain of enteric coating on the release behavior of the enteric pellets. The pellets release behavior was fitted by model as well. Results The prescription of gastric pellets was drug loading 50%, PVPP 5%, MCC to lactose 1∶2 and wetting agent 40%. The process parameters were extrusion frequency 20 Hz, rounding speed 500 r/min and rounding time 5 min. The prescription of enteric pellets was drug loading 27%, PVPP 5%, MCC to lactose 5∶2, wetting agent 30% and adhesive 20%. The process parameters were extrusion frequency 20 Hz, rounding speed 700 r/min and rounding time 7 min. For enteric coating layer, the coating mixture of EUDRAGIT®L30D-55 to EUDRAGIT® FS30D was 1∶2. The amount of plasticizer was 10%. The increased weight of coating layer was 15%. The release time of enteric pellets in-vitro was up to 24 hours. The release behavior of the pellets conforms to the Higuchi model. Conclusion The colon targeting capsule of Baizhu Huanglian pellets were successfully prepared and showed the characteristics of sustained release and colon targeting. -
侵袭性念珠菌病(invasive candidiasis)是院内血液感染的第四大原因[1]。由于各类疾病导致的免疫力低下病人增多,光滑念珠菌(Candida glabrata)的感染率逐年递增,引起败血症的数量也随之增加。除白念珠菌外,光滑念珠菌已成为部分国家和地区侵袭性感染中第二常见的念珠菌种类[2]。光滑念珠菌是一种条件致病菌,它广泛存在于自然界,也在人体皮肤黏膜、消化道寄生。当人体免疫功能降低或皮肤黏膜环境发生改变时,光滑念珠菌即可大量繁殖,引起深部脏器感染。与其他念珠菌相比,光滑念珠菌对于抗真菌药物显著耐受[3],它可以在抗真菌治疗过程中迅速产生耐药性,最终导致治疗失败[4-5]。我国侵袭性真菌耐药监测网(CHIF-NET)2020年统计结果显示,临床常用抗真菌药物氟康唑和伏立康唑对光滑念珠菌的最低抑菌浓度(MIC90)分别32 μg/ml和1 μg/ml。目前治疗光滑念珠菌的药物主要包括广谱三唑类、棘白菌素类以及多烯类抗真菌药。本文对光滑念珠菌的耐药机制进行综述。
1. 对唑类药物的耐药机制
1.1 麦角甾醇合成通路中基因改变
针对念珠菌属使用最广泛的药物当属唑类抗真菌药物。唑类药物通过作用14ɑ-去甲基化酶系统中的细胞色素P450,使环上氮原子与P450的血红素铁结合,阻碍麦角甾醇生物合成,同时致使其合成前体24-甲烯二氢羊毛甾醇累积,从而使念珠菌细胞膜损伤。麦角甾醇是保证念珠菌细胞膜稳定和流动性的重要成分,而ERG11编码的羊毛甾醇14ɑ-去甲基化酶作为关键酶,催化羊毛甾醇生成麦角甾醇。唑类药物通过结合14ɑ-去甲基化酶,阻碍催化过程,而麦角甾醇不足最终导致细胞膜结构改变,念珠菌增殖减少。
1.1.1 ERG11基因突变
ERG11基因突变导致唑类药物作用靶酶羊毛甾醇14ɑ-去甲基化酶的结构发生变化,其与唑类药物的结合位点消失,无法结合,从而产生耐药性。Hull等[6]在临床耐药分离株中发现ERG11基因G315D突变位点,这导致菌株对唑类药物敏感性降低。Zhang等[7]在念珠菌血流分离株中发现6株光滑念珠菌耐药株,并在其中2株中检测到ERG11基因I166S突变位点,其他4株耐药株并未出现ERG11基因的突变,但仍能产生耐药。由此推测,ERG11基因突变或许不能作为光滑念珠菌耐药的主要原因。
1.1.2 ERG11基因高表达
ERG11基因高表达导致唑类药物的靶酶生成增加,药物无法完全抑制靶酶活性。Upc2A和Rpn4是光滑念珠菌ERG11表达的关键调节因子,RPN4与UPC2A的基因突变是ERG11高表达的主要原因[8-9]。Wang等[10]研究2株耐药分离株,其中1株的CDR1和ERG11高表达,而另1株只有CDR1高表达,尽管验证ERG11高表达确实会导致光滑念珠菌产生耐药,但由于耐药株均存在CDR1高表达,因而ERG11高表达不能作为光滑念珠菌耐药的唯一原因。
1.1.3 AUS1基因高表达
当麦角甾醇生物合成在缺氧或由于甾醇合成缺陷而受到抑制时,甾醇流入转运蛋白基因(AUS1和TIR3)和麦角甾醇生物合成通路中相关基因(ERG2、ERG3、ERG6等)在真菌细胞中表达明显上调。在低氧条件或唑类作用下,细胞中的AUS1表达增加,通过输入外源性胆固醇和麦角甾醇,可使光滑念珠菌得以存活[11]。
1.2 药物外排增强
与其他念珠菌不同,光滑念珠菌细胞膜上与耐药性相关的外排泵主要是ABC转运蛋白家族(由念珠菌耐药性CDR1、CDR2、SNQ2基因编码),这类外排泵通过水解ATP获得能量,并通过细胞膜主动外排药物。
1.2.1 ABC转运蛋白家族表达增加
CDR1、CDR2及SNQ2基因高表达导致光滑念珠菌内药物被快速排出,从而对唑类药物产生耐药性。Zhang等[6]在念珠菌血流分离株中发现,光滑念珠菌耐药分离株的CDR1、CDR2基因表达显著增加。Wang等[10]研究两株耐药分离株,发现CDR1基因均高表达。有研究发现[12],CDR1、CDR2在16种耐药分离株中分别有12及8株高表达,且其中有4株耐药株CDR1、CDR2同时高表达;而有8株耐药株SNQ2表达仅相对升高,这可能说明SNQ2没有单独表达或并非主要外排泵,表明这些ABC转运蛋白之间可能存在相互作用。
1.2.2 PDR1基因突变
PDR1是ABC转运蛋白家族的上游调节基因。研究发现,Pdr1和Pdr3是酿酒酵母中两种密切相关的蛋白同系物,作用与光滑念珠菌中的Pdr1相似。Yao[13]等在耐药菌株中发现PDR1中的新错义突变位点A848V。Khakhina [14]等发现光滑念珠菌PDR1的作用是酿酒酵母PDR1和PDR3自调节转录作用的结合,PDR1自调节在光滑念珠菌耐药性产生中起重要作用。PDR1基因的功能获得性突变(GOF),会导致CDR1表达上调。Hou[15]等对PDR1多态性进行研究,发现唑类耐药分离株的PDR1多态性比率(14个中的13个,92.9%)明显高于唑类敏感分离株(144个中的28个,19.4%)。
1.3 DNA错配修复系统缺陷
真菌耐药性产生大多缘于基因突变。DNA错配修复(MMR)系统纠正DNA聚合酶在DNA复制过程中产生的错误,以及修复由环境因素或内源性因素引起的DNA损伤。MSH2为该修复系统的关键基因之一。
Healey[16]等发现有55%携带MSH2功能丧失的突变(LOF),导致体外和体内抗真菌药物耐药性的加速出现,这些突变在氟康唑处理后更为常见。但也有研究表明MSH2序列与氟康唑耐药性或基因型增加之间无明确关联,在这些研究中MSH2被认为是光滑念珠菌的管家基因,即该基因的多态性可能与遗传复合物的差异有关,而与抗真菌药物耐药性不直接相关[15,17]。尽管如此,不能否认MSH2功能丧失的突变引起错误的不匹配修复,进而参与真菌耐药性的发展,其相关性仍有待进一步研究。
2. 对棘白菌素类药物的耐药机制
β-葡聚糖是念珠菌细胞壁的基本成分,棘白菌素类药物通过抑制β-1,3-葡聚糖的合成,对念珠菌属发挥杀真菌活性。
多项研究表明,FKS基因突变导致其结合位点改变是棘白菌素耐药性产生的主要原因。Wang[10]等研究2株耐药分离株,对FKS测序显示,2种分离株在FKS2中都含有S663P突变且存在4个单核苷酸多态性(SNP),而FKS1则无突变。同时,FKS1和FKS2的表达均上调。Al-Baqsami[18]等在5种耐米卡芬净的分离株中,发现4株分离株FKS2含有非同义(S663P)突变,1株分离株含有FKS2热点-1(HS1)中的三核苷酸缺失(对应于F659;ΔF659)。Pham[19]等在1037株耐棘白菌素光滑念珠菌中进行FKS测序,检测出47株具有FKS突变。其中,检测出12种独特的突变:FKS1中的5种(15株)和FKS2中的7种(35株)。所有突变都发生在HS1中,没有检测到HS2突变。通过以上研究结果,可推测影响光滑念珠菌对棘白菌素易感性的大多数突变位于FKS1 HS1和FKS2 HS1区域,且FKS2的突变多于FKS1。
3. 对多烯类药物的耐药机制
多烯类药物是广泛运用于临床的抗真菌感染的广谱抗菌药。两性霉素B是多烯类的代表药物,通过结合念珠菌细胞膜上的麦角甾醇,形成孔道,以改变念珠菌细胞膜通透性从而使念珠菌死亡。
3.1 自身合成替代甾醇
真菌能够自身合成甾醇中间体完成代谢,但麦角甾醇缺乏,导致两性霉素B无作用靶点。Hull等[6]在多种临床耐药分离株中发现CG156分离株内仅可检测到14α-甲基化甾醇中间体这一种甾醇,即这种分离株内缺乏麦角甾醇,但该耐药株仍可以在没有外源性供应甾醇的情况下,用14α-甲基化甾醇中间体合成细胞所需的甾醇。
3.2 麦角甾醇生物合成基因突变
由ERG6中密码子Tyr192、Trp286或Leu341无义突变导致Erg6蛋白的过早终止;由ERG2中含有的G122S和G119S无义突变导致Erg2蛋白功能受损,最终均导致突变株细胞膜缺乏麦角甾醇,进而破坏细胞膜通透性和流动性[20-23]。
4. 小结
综上所述,光滑念珠菌作为临床上较为重要的致病菌之一,由于抗真菌药物种类有限,临床应用重复率高,导致的耐药问题日益严重。因此,一方面需要临床合理用药、联合用药,尽量避免耐药性的产生;另一方面,需要研发新型抗真菌药物。有研究表明[24-28],阿魏酸与卡泊芬净,薄荷醇、百里酚、替加环素、绒毛钩藤不溶性成分与唑类药物的协同作用,通过损伤念珠菌生物被膜等方式,可以有效降低唑类耐药菌的MIC。也有研究开辟新的思路,寻找新的药物靶点:合成的铋纳米颗粒可以潜在地用于改善氧化应激和各种微生物感染,对念珠菌病病例有强大抗真菌能力[29];4种双鸟胍衍生物(BG1-BG4)对光滑念珠菌和白念珠菌的MIC在2~15.6 μg/ml之间,其中BG3作用于DNA,扰乱复制转录过程,导致在细胞质膜外层的磷脂酰丝氨酸暴露,半胱氨酸蛋白酶活化,促进真菌细胞凋亡[30]。药物研发和探索是漫长的过程,需要一代代人的验证和实践,但可以预见,在不久的将来,这些药物最终会有一部分应用于临床实践中,为缓解临床耐药问题提供新的选择。
-
表 1 载药量对微丸特性的影响
载药量(%) 圆整度(θ/°) 收率(%) 物料黏性 27 21.2 95.76 黏性适中,手握成团,轻压即散 40.5 23.7 89.64 黏性略大,易捏合成团 54 24.1 74.38 黏性极大,易黏附于器壁 表 2 L9(34)正交试验设计与结果
实验编号 因素 收率(Y/%) 圆整度(θ/°) Y-2θ A挤出速度(Hz) B滚圆速度(r/min) C滚圆时间(t/min) 1 20 500 3 96.24 23.0 50.24 2 20 700 5 93.33 21.5 50.33 3 20 900 7 82.68 22.0 38.68 4 30 500 5 95.41 24.0 47.41 5 30 700 7 92.70 21.0 50.70 6 30 900 3 81.02 24.0 33.02 7 40 500 7 93.82 22.5 48.82 8 40 700 3 93.24 23.0 47.24 9 40 900 5 83.54 25.0 33.54 均值1 46.417 48.823 43.500 均值2 43.710 49.423 43.760 均值3 43.200 35.080 46.067 极差 3.217 14.343 2.567 表 3 方差分析结果
因素 偏差平方和 自由度 F比 F临界值 显著性 A挤出速度(Hz) 17.933 2 0.127 5.140 P>0.05 B滚圆速度(r/min) 394.970 2 2.789 5.140 P>0.05 C滚圆时间(t/min) 11.976 2 0.085 5.140 P>0.05 误差 424.88 6 表 4 L9(34)正交试验设计与结果
实验编号 因素 收率(Y/%) 圆整度(θ/°) Y-2θ A挤出速度(Hz) B滚圆速度(r/min) C滚圆时间(t/min) 1 20 500 3 87.31 24.5 38.31 2 20 700 5 90.12 24.0 42.12 3 20 900 7 82.88 24.5 33.88 4 30 500 5 93.90 27.0 39.90 5 30 700 7 90.68 25.5 39.68 6 30 900 3 81.01 23.0 35.01 7 40 500 7 96.08 25.5 45.08 8 40 700 3 90.20 27.0 36.20 9 40 900 5 80.36 26.5 27.36 均值1 38.103 41.097 36.507 均值2 38.197 39.333 36.460 均值3 36.213 32.083 39.547 极差 1.984 9.014 3.087 表 5 方差分析结果
因素 偏差平方和 自由度 F比 F临界值 显著性 A挤出速度(Hz) 7.514 2 0.138 5.140 P>0.05 B滚圆速度(r/min) 136.912 2 2.517 5.140 P>0.05 C滚圆时间(t/min) 18.771 2 0.345 5.140 P>0.05 误差 163.20 6 表 6 肠溶微丸不同释药行为的拟合方程
模型 拟合方程 r 零级 Q=3.298t+4.231 0.8303 一级 ln(1−Q)=144.633 t+0.037 0.8966 Higuchi Q=25.075 t1/2−36.962 0.9054 -
[1] 王彬辉, 章文红, 张晓芬, 等. 离心造粒法制备姜黄素微丸的影响因素研究[J]. 中华中医药学刊, 2014, 32(6):1430-1432. [2] 张丹参, 梅艳飞, 宋晓敏, 等. 大黄结肠靶向微丸的制备及处方优化[J]. 中草药, 2016, 47(8):1321-1326. doi: 10.7501/j.issn.0253-2670.2016.08.012 [3] 原丽慧, 卞俊. 盐酸尼卡地平缓释微丸的制备[J]. 药学实践杂志, 2013, 31(4):258-261. doi: 10.3969/j.issn.1006-0111.2013.04.005 [4] LIANG L P, CHEN H L, ZHAO S M, et al. Preparation of colon-specific and synchronous release pellet containing total alkaloids of Sophora alopecuroides[J]. Chin Herb Med,2016,8(1):44-52. doi: 10.1016/S1674-6384(16)60007-2 [5] 李明明, 王启之. 溃疡性结肠炎药物治疗的研究进展[J]. 胃肠病学和肝病学杂志, 2017, 26(4):458-461. [6] 卞莹莹, 王洁, 李安, 等. 炎症性肠病的药物治疗现状[J]. 药学实践杂志, 2017, 35(3):197-200, 228. doi: 10.3969/j.issn.1006-0111.2017.03.002 [7] 洪振宇. 西医治疗溃疡性结肠炎的现状和进展[J]. 中国医药指南, 2013, 11(3):43-44. doi: 10.3969/j.issn.1671-8194.2013.03.031 [8] 汪悦, 查安生. 中医药对溃疡性结肠炎作用机制的干预研究[J]. 中华中医药学刊, 2015, 33(2):394-396. [9] 申睿, 刘苗, 朱向东, 等. 中医药治疗溃疡性结肠炎实验研究进展[J]. 中草药, 2018, 49(7):1721-1725. doi: 10.7501/j.issn.0253-2670.2018.07.035 [10] 田代华. 实用中医对药方[M]. 北京: 人民卫生出版社, 2000: 223-224. [11] 戴红连, 江坤, 王思明, 等. 盐酸坦洛新缓释胶囊制备工艺及其体外释放度的考察研究[J]. 中国药学杂志, 2016, 51(18):1586-1591. [12] 相聪坤, 张静宜, 李佳佳, 等. 白术、桂枝挥发油β-环糊精包合工艺研究及其包合物评价[J]. 天然产物研究与开发, 2017, 29(1):46-51. [13] 刘天易, 王信, 杨田义, 等. pH依赖型重芪结肠靶向微丸的制备及体外释放性能的评价[J]. 中草药, 2016, 47(18):3199-3203. doi: 10.7501/j.issn.0253-2670.2016.18.010 [14] 徐洋洋, 蔡皓, 段煜, 等. 白术芍药散治疗溃疡性结肠炎研究进展[J]. 中国中药杂志, 2017, 42(5):856-862. [15] 陈艳君, 刘梅, 靳倩, 等. 食物影响口服药物吸收的研究进展[J]. 中国新药杂志, 2018, 27(10):1137-1143. -





 下载:
下载: