-
槟榔为棕榈科植物槟榔的干燥成熟种子,居“四大南药”之首,入药最早记录在《李当之药录》中[1],具有行气利水,消积杀虫,截疟等功效,用于治疗寄生虫病、关节炎、青光眼、水肿、脚气、疟疾等疾病[2]。槟榔主要含生物碱、多酚、多糖、脂肪酸、鞣质、氨基酸、三萜类、矿物质、槟榔红色素、粗纤维、油脂、维生素等多种物质[3-4]。药理研究表明其具有抗氧化、抗抑郁、抗炎、抗寄生虫、抗老化、清除自由基、修护神经系统、抗疲劳、改善胃肠功能、治疗糖尿病、抑菌等作用[5],文献报道槟榔的抗氧化作用与其含有的多酚类物质有关[6-12]。
课题组前期的研究发现,槟榔醇提取物能显著增强H9c2细胞的耐缺氧能力[13],进行高原实地研究发现,槟榔多酚能够显著改善高原实地缺氧大鼠的血气指标,能提高其肝、肺、心组织中谷胱甘肽、超氧化物歧化酶活性,降低其肝、肺、心组织中丙二醛的含量,槟榔多酚提取物的抗缺氧作用与消除过量的氧自由基,减轻脂质过氧化和氧化应激损伤有关[14-15]。同时,课题组进一步研究还发现,槟榔多酚提取物能预防高原肺水肿的发生,该作用与其减轻肺水肿、维持肺泡毛细血管通透性、改善氧化应激损伤及病理损伤有关[16]。由此可见,将槟榔多酚提取物开发为新的抗高原缺氧药物具有很大的潜力。槟榔多酚成分复杂,文献报道槟榔多酚中含有儿茶素、表儿茶素、原儿茶酸、没食子酸等,另外药理研究表明,儿茶素、表儿茶素、原儿茶酸具有抗氧化、抗炎等作用[17-21],基于此,本研究采用紫外分光光度法对槟榔多酚提取物中总多酚的含量进行测定;并建立槟榔多酚提取物中儿茶素类成分的HPLC测定方法,以期为槟榔多酚提取物的质量控制和标准制定提供实验依据。
-
槟榔由联勤保障部队第九四〇医院药剂科中药房提供,没食子酸(上海源叶生物科技有限公司,批号Y19M8C36143,质量分数≥98%)、儿茶素(中国食品药品检定研究院,批号110877-201604,质量分数99.2%)、表儿茶素(上海阿拉丁生化科技股份有限公司,批号K2009336,质量分数≥98%)、原儿茶酸(成都曼思特生物科技有限公司,批号MUST-20110310,质量分数99.78%),甲醇、乙腈均为色谱纯;酒石酸钠钾、七水合硫酸亚铁、磷酸二氢钠、磷酸氢二钠、无水乙醇、甲酸均为分析纯。
-
Ultimate 3000DGLC高效液相色谱仪(赛默飞世尔科技)、超微量分光光度计NP80(德国IMPLEN公司),电子分析天平(上海梅特勒-托利多有限公司),超声波清洗器(上海科导超声仪器有限公司),多功能动态热回流提取浓缩机(上海天巨源设备有限公司),电热恒温鼓风干燥箱(上海跃进医疗器械厂)。
-
取槟榔药材20 kg,粉碎后过3号筛,分别加入10倍、8倍、6倍量的80%乙醇,80 ℃加热回流提取3次,时间分别为2、1.5、1.5 h,合并提取液,过滤,滤液减压回收乙醇,得浸膏。浸膏加入等体积水悬浮,加入到已经处理好的AB-8大孔吸附树脂柱上,纯水洗脱除杂,20%乙醇洗脱,收集20%洗脱液,减压回收乙醇得浸膏,真空60 ℃干燥,制得干燥槟榔多酚提取物1,命名为:BLDF202001。大孔吸附树脂经80%乙醇洗脱,收集洗脱液,减压回收乙醇得浸膏,真空60 ℃干燥,制得干燥槟榔多酚提取物2,命名为:BLDF202002。提取物2加水悬浮,加入到已经处理好的聚酰胺层析柱上,纯水洗脱除杂,80%乙醇洗脱,收集80%洗脱液,减压回收乙醇得浸膏,真空60 ℃干燥,制得干燥槟榔多酚提取物3,命名为:BLDF202003。
-
精密称取没食子酸对照品5 mg,置于5 ml容量瓶中,加蒸馏水超声使其充分溶解,定容,配制成1 mg/ml的对照品溶液。
-
分别精密称取各对照品适量,加甲醇制成含儿茶素1.92 mg/ml、表儿茶素2.46 mg/ml和原儿茶酸1.12 mg/ml的单一对照品储备液。
-
精密称取槟榔多酚提取物10 mg,置于10 ml容量瓶中,加乙醇超声,使其充分溶解,定容,配制成1 mg/ml的供试品溶液。
-
精密称取槟榔提取物50 mg,置于10 ml棕色容量瓶中,用甲醇超声使其充分溶解,定容,配制成浓度为5 mg/ml的供试品储备液。精密吸取供试品储备液2 ml,置于5 ml容量瓶中,用50%的甲醇定容至刻度,摇匀,临用前过0.22 μm微孔滤膜,取续滤液,即得。
-
采用酒石酸亚铁法测定槟榔多酚的含量[14],精密吸取“2.2.1”项下的没食子酸对照品溶液各0.05、0.10、0.15、0.20、0.25、0.30 ml,置于5 ml容量瓶中,加蒸馏水至1 ml,再加入酒石酸亚铁溶液1 ml,用pH 7.5的磷酸缓冲溶液定容,混匀,静置15 min,以蒸馏水为空白参照,在540 nm处测定吸光度值。以吸光度值(A)为纵坐标,浓度(X,μg/ml)为横坐标,绘制标准曲线,得没食子酸对照品的线性回归方程:A=12.44X+0.0731,r=0.999 4,表明没食子酸对照品溶液在9.8~58.8 μg/ml范围内线性关系良好。
-
精密吸取没食子酸对照品溶液0.1 ml,按“2.3.1”项下方法测定吸光度,重复测定6次,没食子酸对照品溶液的吸光度RSD值为0.40%,表明该方法精密度良好。
-
取同一供试品溶液(BLDF202001)6份,按“2.3.1”项下方法测定吸光度,槟榔提取物中总多酚的吸光度RSD值为1.1%,表明该方法重复性良好。
-
取同一供试品(BLDF202001)10 mg,精密称定,按“2.2.3”项下方法制备供试品溶液,分别在0、5、10、15、30 min和1、2、4、8、12、24 h后,按“2.3.1”项下方法测定吸光度,槟榔提取物中总多酚吸光度的RSD值为2.8%,表明该供试品在24 h内稳定性良好。
取同一供试品溶液(BLDF202001)0.1 ml,按“2.3.1”项下方法分别于7、9、11、13、15、17、21 min测定吸光度,槟榔提取物中总多酚吸光度的RSD值为0.93%。表明该供试品溶液在21 min内显色稳定,提示总多酚含量测定应等待7 min之后,在21 min之前完成。
-
取同一批(BLDF202001)已知含量的槟榔多酚提取物,平行6份,按“2.2.3”项下方法制备供试品溶液,取供试品溶液0.1 ml,置于5 ml棕色容量瓶中,加入没食子酸对照品溶液0.1 ml,按“2.3.1”项下方法测定吸光度,没食子酸的加样回收率为98.44%,RSD值为1.4%。。
-
吸取0.3 ml的供试品溶液,按“2.3.1”项下方法测定吸光度,平行测定3次,计算总多酚的含量。3批槟榔提取物中总多酚的含量见表1。
表 1 3批槟榔多酚提取物中总多酚的含量(n=3)
批号 总多酚含量(%) BLDF202001 51.45 BLDF202002 51.82 BLDF202003 52.70 -
色谱柱:AcclaimRSLC120 C18柱(3 mm×150 mm,3 µm);流动相为:乙腈(A)-0.3%甲酸溶液(B),梯度洗脱程序见表2;检测波长:280 nm;流速:1.0 ml/min;柱温:35 ℃;进样量:5 μl。
表 2 梯度洗脱程序
时间(t/min) 流动相A(%) 流动相B(%) 0~5 5~10 95~90 5~7 10~15 90~85 7~9 15~20 85~80 9~12 20~5 80~95 -
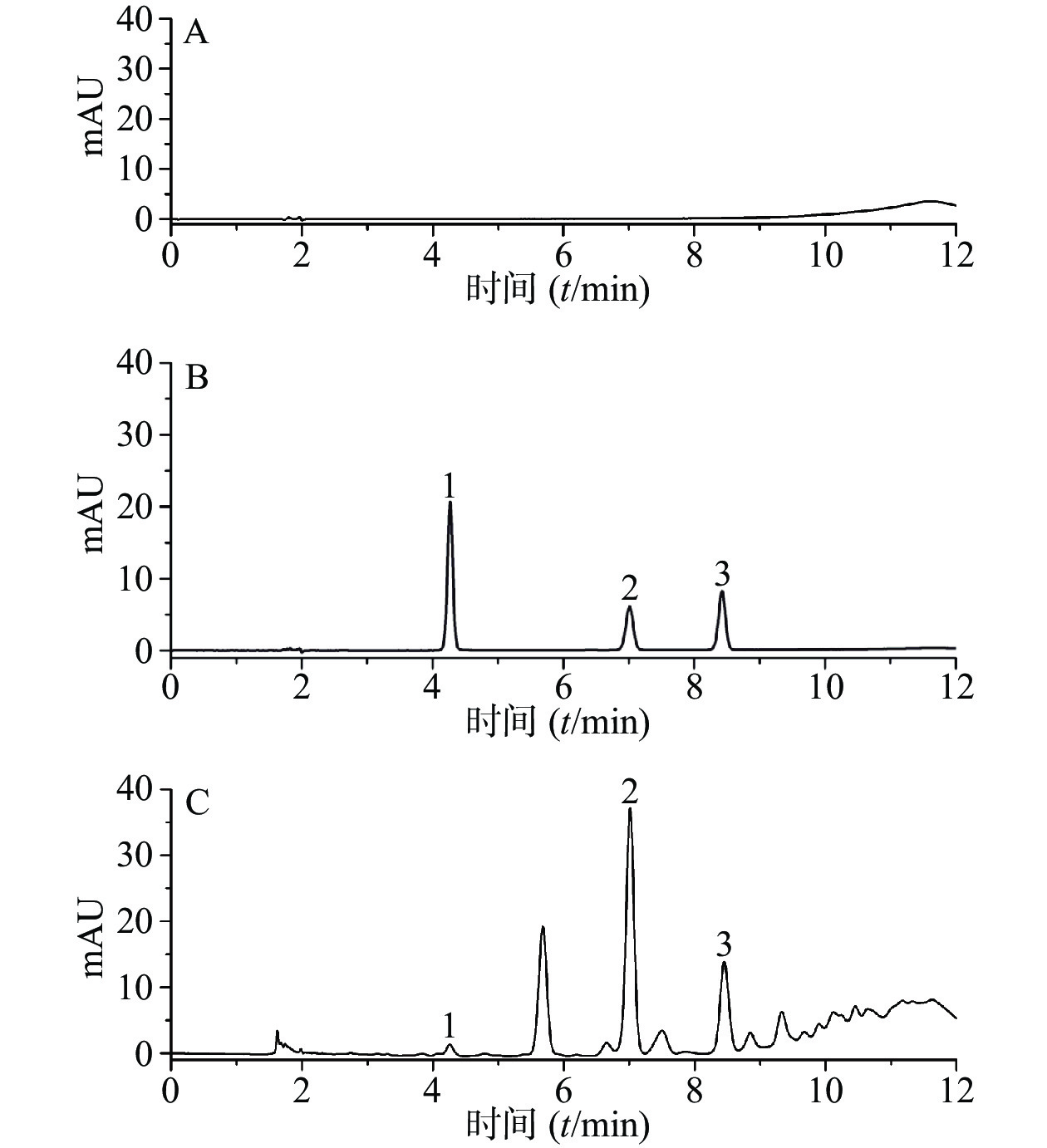
分别精密吸取50%的甲醇,混合对照品溶液,供试品溶液各5 μl,按“2.4.1”项下色谱条件进样分析,记录色谱图。结果表明,各峰分离度均较好,各组分的分离度大于1.5,符合定量分析要求,理论板数以儿茶素计,不低于6 000。其中原儿茶酸、儿茶素、表儿茶素的保留时间分别为4.273、7.017和8.433 min,色谱图见图1。
-
分别精密吸取“2.2.2”项下儿茶素对照品储备液0.010、0.025、0.05、0.1、0.2、0.4、0.8 ml;表儿茶素储备液0.010、0.025、0.05、0.1、0.2、0.4、0.6 ml;原儿茶酸储备液0.005、0.010、0.025、0.05、0.1、0.2、0.4 ml,用50%的甲醇定容于5 ml容量瓶中,配制成不同浓度的对照品溶液,按“2.4.1”项下的色谱条件进样,以对照品的浓度(X,μg/ml)为横坐标,峰面积(Y)为纵坐标进行线性回归,结果见表3,表明儿茶素、表儿茶素、原儿茶酸分别在相应的线性范围内线性关系良好。
表 3 槟榔多酚提取物中儿茶素、表儿茶素、原儿茶酸的线性方程
成分 回归方程 r 线性范围(μg/ml) 儿茶素 Y=0.0436X−0.0201 0.999 7 3.84~307.2 表儿茶素 Y=0.0415X+0.0395 0.999 8 4.92~295.2 原儿茶酸 Y=0.0833X+0.0113 0.997 7 1.12~89.6 -
取各成分浓度约为20 μg/ml的混合对照品溶液,按“2.4.1”项下的色谱条件连续进样6次,记录峰面积。儿茶素、表儿茶素和原儿茶酸峰面积的RSD值分别为0.65%、0.96%、2.3%,表明仪器精密度良好。
-
取同一供试品溶液(BLDF202001)按“2.4.1”项下的色谱条件分别于0、4、8、12、18 h进样分析,记录峰面积。儿茶素、表儿茶素、原儿茶酸峰面积的RSD值分别为1.1%、1.6%、1.1%,表明供试品溶液在18 h内稳定。
-
取槟榔多酚提取物(BLDF202001)约50 mg,精密称定,平行6份,分别按“2.2.4”项下方法制备供试品溶液,按“2.4.1”项下的色谱条件测定,计算供试品中儿茶素、表儿茶素、原儿茶酸的质量分数分别为5.9%、2.4%、0.10%,RSD值分别为1.0%、2.1%、2.1%,表明该方法的重复性良好。
-
精密称取已知含量的槟榔多酚提取物(BLDF202001)25 mg,置于5 ml容量瓶中,共6份,分别精密加入一定量的儿茶素、表儿茶、原儿茶酸对照品溶液,分别按“2.2.4”项下方法制备供试品溶液,按“2.4.1”项下的色谱条件测定,计算回收率和RSD值。儿茶素、表儿茶素、原儿茶酸的平均回收率为99.17%、101.67%、101.18%;RSD值分别为2.5%、1.2%、1.8%,表明该方法准确度良好。
-
取3批按“2.2.4”项下方法制备的供试品溶液,按“2.4.1”项下的色谱条件分别测定。3个批号的供试品中儿茶素、表儿茶素、原儿茶酸的含量见表4。
表 4 3批槟榔多酚提取物中儿茶素、表儿茶素、原儿茶酸的百分含量(%, n=3)
批号 儿茶素 表儿茶素 原儿茶酸含量 BLDF202001 5.90 2.40 0.10 BLDF202002 0.52 0.43 / BLDF202003 1.30 0.77 /
Determination of total polyphenols and catechins in betel nut polyphenol extract
-
摘要:
目的 建立槟榔多酚提取物中总多酚和儿茶素类含量的测定方法,为槟榔多酚提取物的质量控制提供参考。 方法 采用紫外分光光度法对槟榔提取物中总多酚的含量进行测定;高效液相色谱法对儿茶素类物质进行含量测定。 结果 紫外分光光度法测定槟榔提取物中总多酚含量在9.8~58.8 μg/ml范围内线性关系良好,平均加样回收率为98.44%,RSD为1.4%;在高效液相色谱测定中,儿茶素、表儿茶素和原儿茶酸3种主要成分完全分离,在各自范围内线性关系良好,平均加样回收率为99.17%~101.67%,RSD为1.2%~2.5%。 结论 建立的含量测定方法简单、稳定可靠,可用于槟榔多酚提取物的定量分析,为槟榔多酚提取物的质量控制提供实验依据。 Abstract:Objective To establish a method for the determination of total polyphenols and catechins in betel nut polyphenols extract, and provide reference for the quality control of betel nut polyphenols extract. Methods The content of total phenol in betel nut extract was determined by ultraviolet spectrophotometry. The content of catechins was determined by HPLC. Results The linear range of total polyphenols in betel nuts extract was 9.8~58.8 μg/ml. The three components of catechin, epicatechin and protocatechuic acid were completely separated by HPLC, and the linear relationship was good in their respective ranges, with the recoveries between 99.17% and 101.67%, the RSD between 1.2% and 2.5%. Conclusion The established method is simple, stable and reliable, which could be used for the quantitative analysis of betel polyphenol extract, and provide experimental basis for the quality control of betel polyphenol extract. -
Key words:
- betelnut total polyphenols /
- catechins /
- HPLC /
- UV spectrophotometry
-
胰腺癌是一种病死率极高的消化道恶性肿瘤 [1]。超过80%以上的患者一旦确诊即是晚期,手术难以根治,需在术后进行辅助化疗、放疗、对症支持治疗等 [2]。盐酸吉西他滨(hcGEM)是治疗胰腺癌的一线化疗药。由于存在半衰期短、产生耐药性及不可避免的毒副作用等问题,其疗效不尽如人意[3]。因此,hcGEM的临床应用需要联合化疗来提高疗效[4]。
铁死亡是一种铁依赖的非凋亡性细胞死亡形式,针对铁死亡的治疗策略可能为传统疗法难以攻克的癌症提供新的治疗思路 [5]。埃拉斯汀 (Era)作为一种高效持久的铁死亡诱导剂,它可以激活多种信号通路来触发癌细胞的铁死亡 [6]。柳氮磺胺吡啶(SASP)是一种能抑制铁死亡相关的胱氨酸-谷氨酸逆向转运蛋白的抗炎药,可通过降低癌细胞对胱氨酸的摄取以及胞内谷胱甘肽水平来抑制胰腺癌细胞的生长[7]。青蒿琥酯(Art)是一种青蒿素的衍生物,除用作抗疟治疗外,可通过促进铁蛋白吞噬来增加细胞内游离铁水平,进而引发癌细胞的铁死亡[8]。铁死亡诱导剂与盐酸吉西他滨联合应用可能是胰腺癌治疗的潜在策略[9]。
本研究分别考察Era、SASP和Art这三种铁死亡诱导剂单独或联合hcGEM使用,对人胰腺癌PANC-1细胞的增殖抑制作用,以期发现具有潜在协同抑制的联合方案,为今后开发胰腺癌新疗法奠定基础。
1. 实验材料
1.1 试剂
盐酸吉西他滨、柳氮磺胺吡啶、埃拉斯汀(美国MCE公司);青蒿琥酯(上海泰坦科技股份有限公司);胎牛血清、青链霉素、胰酶(以色列BI公司);DMEM高糖培养基、PBS缓冲液(上海泰坦科技股份有限公司),CCK- 8细胞毒性试剂盒(日本同仁化学研究所)。
1.2 细胞株
人胰腺癌PANC-1细胞,来源于海军军医大学第一附属医院消化内科,冻存复苏后培养于含10%胎牛血清的DMEM高糖培养基。
2. 实验方法
2.1 细胞培养
人胰腺癌PANC-1细胞用DMEM完全培养基(含10 %胎牛血清,1 %青-链霉素)于5 % CO2、37 ℃的恒温培养箱中培养。待细胞融合度达80 %~90 %时,移除旧培养基,PBS缓冲液清洗2遍后加入适当体积的胰蛋白酶消化3 min。待大部分细胞镜下变圆,小部分细胞脱落时,加入2倍胰酶体积的完全培养基终止消化,充分吹打使细胞脱离。将细胞悬液以1 000 r/min转速,离心5 min,弃上清液,加入2 ml完全培养基重悬,并按1∶2的比例均匀接种于两个培养皿,加入8 ml完全培养基水平摇匀后置于恒温细胞培养箱内培养,取对数生长期的细胞进行后续细胞毒性实验。
2.2 实验分组
将实验细胞单独用药组根据药物种类与浓度不同,分为hcGEM单药组(hcGEM: 0.015 625、0.031 25、0.062 5、0.125、0.25、0.5、1、2、4 μmol/L),Era单药组(Era:0.25、0.5、1、2、4、8、16、32、64 μmol/L),SASP单药组(SASP: 6.25、12.5、25、50、100、200、400、800、1600 μmol/L)以及Art单药组(Art:0.5、1、2、4、8、16、32、64、128 μmol/L),每种药物都按2倍比率设置浓度梯度,每组各9个浓度;联合用药组根据联合药物组成与比例不同分为hcGEM-Era联合用药组(包括4∶1、1∶1、1∶4和1∶16 联合组)、hcGEM-SASP联合用药组(包括4∶1、1∶1、1∶20和1∶400联合组)、hcGEM-Art联合用药组(包括 2∶1、1∶1、1∶4和1∶16联合组)。每个联合用药组中,hcGEM的浓度均为相同的浓度梯度(hcGEM: 0.015 625、0.031 25、0.062 5、0.125、0.25、0.5、1、2、4 μmol/L),并与恒定比例的联合药物共同作用于细胞。hcGEM-Era 1∶16联合组的药物浓度梯度为0.015 625 μmol/L hcGEM+0.25 μmol/L Era、0.031 25 μmol/L hcGEM+0.5 μmol/L Era、0.062 5 μmol/L hcGEM+1 μmol/L Era、0.125 μmol/L hcGEM+2 μmol/L Era、0.25 μmol/L hcGEM+4 μmol/L Era、0.5 μmol/L hcGEM+8 μmol/L Era、1 μmol/L hcGEM+16 μmol/L Era、2 μmol/L hcGEM+32 μmol/L Era、4 μmol/L hcGEM+64 μmol/L Era。
2.3 CCK-8法检测细胞抑制情况
取对数生长的PANC-1细胞接种于96孔板,密度为5 000个细胞/孔。待细胞贴壁24 h后,弃上清液,每3个复孔加入100 μl不同浓度的每种药物,另设空白对照组与药物未处理组各3个复孔。药物与细胞共培养48 h后,每孔加入含10% CCK-8的DMEM培养基。于恒温培养2 h后,用酶标仪测量450 nm波长下各孔的吸光度值(A值)。使用GraphPad Prism 8.0.2软件对数据进行非线性回归分析,得到各组药物作用于细胞的半数抑制浓度(IC50) 以及细胞增殖抑制率,具体公式为:抑制率=[1−(A用药组−A空白组)/(A未用药组−A空白组)]×100%。
2.4 联合指数计算
根据单独用药组与联合用药组的摩尔浓度与细胞增殖抑制率,使用CompuSyn软件计算联合指数(CI),并依据CI值判断药物的联合效果: CI>1表示拮抗作用;CI=1表示相加作用;CI<1表示协同作用,且协同抑制效果随CI值的减小而增强。
2.5 统计学分析
实验结果以(
$\bar x $ ±s)表示,采用GraphPad Prism 8.0.2软件进行数据的处理分析,多组间比较采用单因素方差分析,两组间比较采用t检验。P<0.05表示组间差异有统计学意义。3. 结果
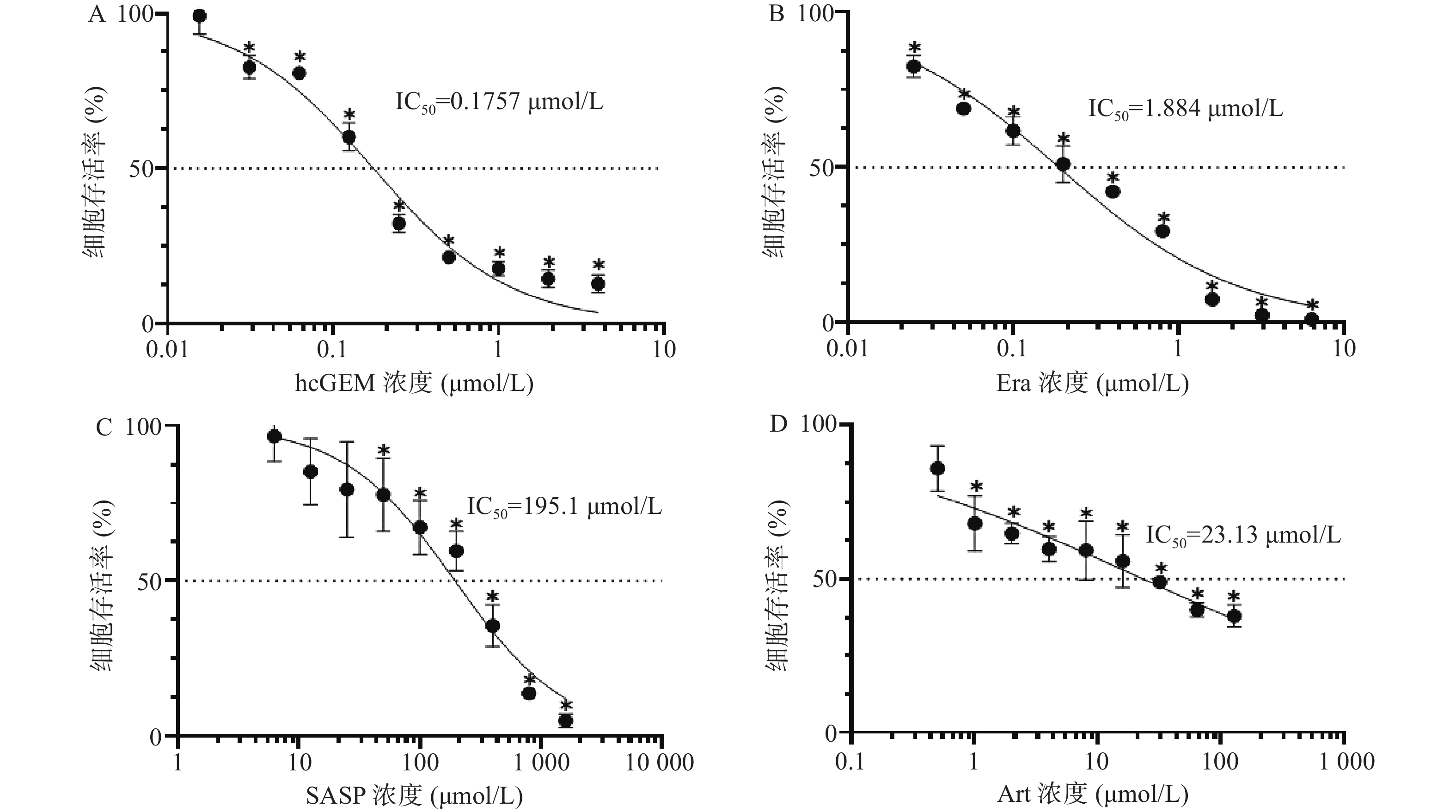
3.1 hcGEM、Era、SASP、Art单独用药对PANC-1细胞的影响
如图1所示,hcGEM、Era、SASP、Art单独作用于PANC-1细胞时可明显抑制细胞的增殖,并且这种抑制作用呈现剂量依赖性。hcGEM、Era、SASP、Art作用于PANC-1细胞的IC50值分别为0.175 7、1.884、195.1、23.13 μmol/L。hcGEM单独用药时,小于0.015 625 μmol/L的剂量对PANC-1细胞的生长几乎无抑制作用,存活率>95%(P>0.05);剂量大于2 μmol/L时,细胞的活性受到显著抑制,存活率<15%(P<0.05)。Era单独用药时,大于16 μmol/L 的剂量能显著抑制PANC-1细胞的生长,存活率<10%(P<0.05),而小于0.25 μmol/L的剂量会使80%以上的细胞存活。SASP单独用药时,大于800 μmol/L的剂量能抑制PANC-1细胞的生长,存活率<15%(P<0.05),而小于12.5 μmol/L的剂量仅轻微抑制PANC-1细胞存活,存活率>85%(P>0.05)。Art单独用药时,大于128 μmol/L的剂量能显著抑制PANC-1细胞的生长,存活率<40%(P<0.05),而小于0.5 μmol/L时,仅能轻微抑制细胞增殖,存活率>85%(P>0.05)。
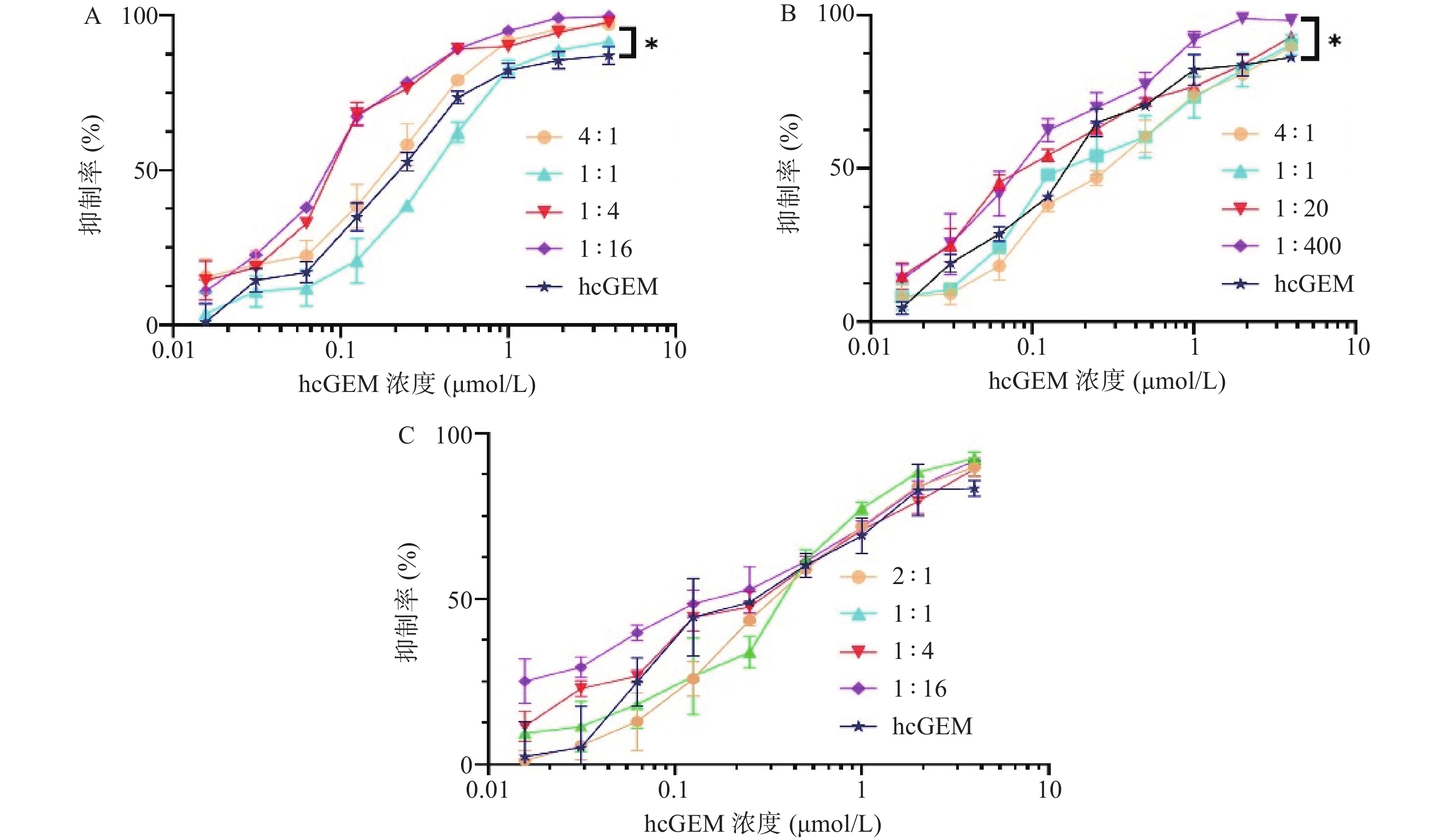
3.2 hcGEM分别与Era、SASP、Art联合用药对PANC-1细胞的影响
在研究单药对PANC-1细胞抑制效果的基础上,我们进一步探究了hcGEM-Era 4∶1、1∶1、1∶4和1∶16 联合用药,hcGEM-SASP 4∶1、1∶1、1∶20和1∶400联合用药,以及hcGEM-Art 2∶1、1∶1、1∶4和1∶16联合用药,对PANC-1细胞的抑制效果。如图2所示, hcGEM-Era、hcGEM-SASP以及hcGEM-Art联合用药组的抑制效果随着浓度的增加而提高。其中,hcGEM-Era 4∶1、1∶4、1∶16联合组,以及hcGEM-SASP 1∶400联合组对PANC-1细胞抑制效果在所有浓度梯度范围均优于hcGEM组(P<0.05)。此外,hcGEM-Era 4∶1、1∶4、1∶16联合用药组,hcGEM-SASP 1∶20、1∶400联合组,和hcGEM-Art 1∶16联合组的IC50值均小于0.1757 μmol/L(hcGEM单药组的IC50),说明上述联合用药能在一定程度上提高对PANC-1细胞的抑制效果。不同联合用药组hcGEM的IC50值见表1。
表 1 hcGEM联合三种铁死亡诱导剂对胰腺癌PANC-1细胞作用时的IC50值组别 摩尔浓度比 IC50(μmol/L,hcGEM) hcGEM-Era联合组 1∶0.25 0.140 3±0.009 1 1∶1 0.340 2±0.018 3 1∶4 0.091 3±0.005 1 1∶16 0.083 3±0.002 5 hcGEM-SASP联合组 1∶0.25 0.297 5±0.016 1 1∶1 0.240 2±0.021 2 1∶20 0.120 8±0.008 9 1∶400 0.092 6±0.006 7 hcGEM-Art联合组 1∶0.5 0.366 4±0.018 7 1∶1 0.344 4±0.026 3 1∶4 0.249 3±0.015 7 1∶16 0.154 6±0.013 5 3.3 药物联合指数
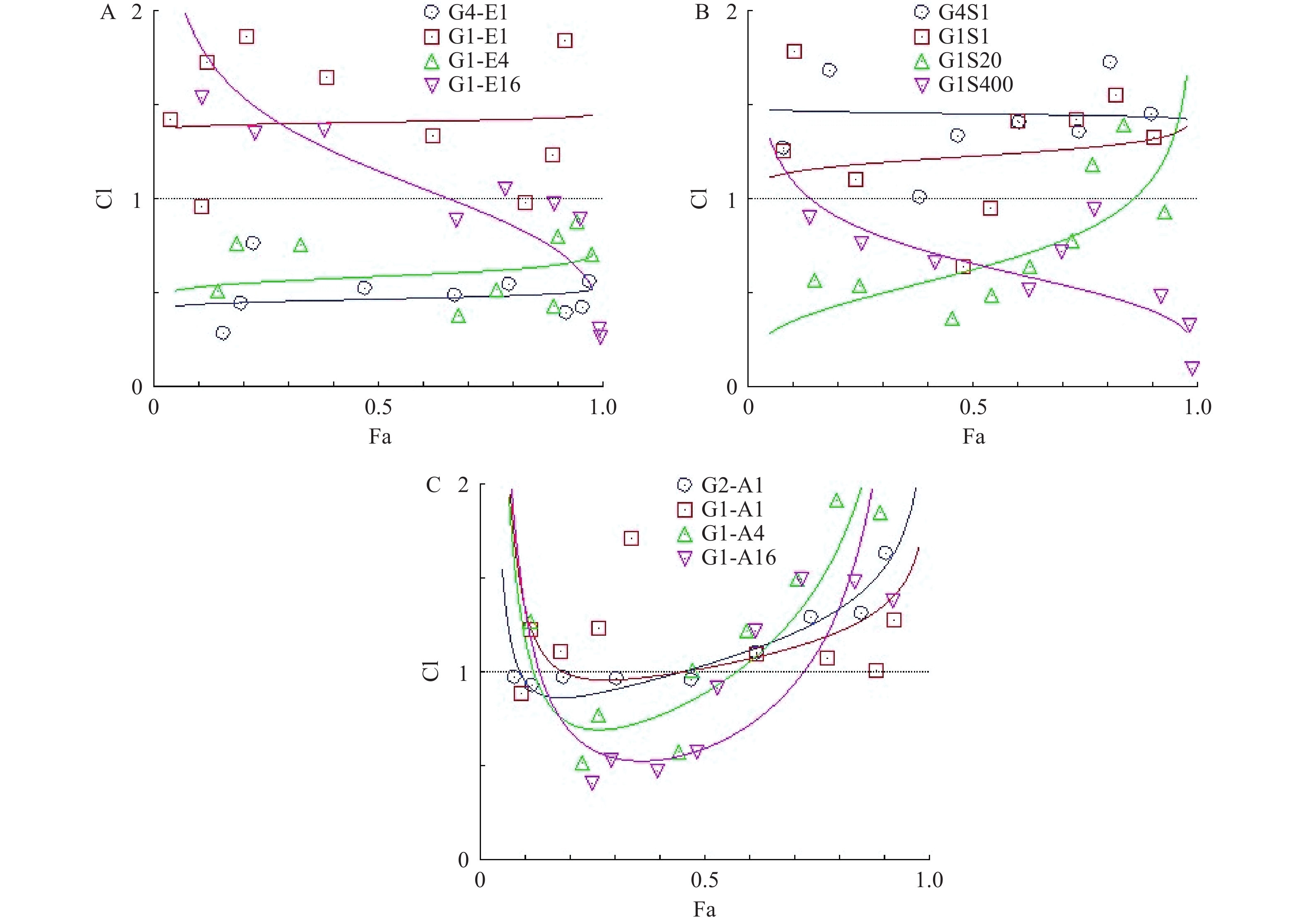
为了研究hcGEM分别与Era、SASP、Art联合用药,对PANC-1细胞是否具有协同抑制作用,我们分别设计了hcGEM与三种铁死亡诱导剂的4种不同比例的联用方案,来探讨不同联合用药组对PANC-1细胞的协同抑制效果。CompuSyn软件分析结果显示,hcGEM-Era 4∶1或1∶4联用组在所有药物浓度下均能对PANC-1细胞产生良好的协同抑制效果(CI<1),且4∶1联用组的协同抑制效果略优于1∶4联用组。对于hcGEM-Era 1∶16联用组,CI值随着联合药物浓度的增加而减小,说明该比例下两药协同抑制效果随着浓度增大有所增强,而hcGEM-Era 1∶1联用组的CI值,仅除1 μmol/LhcGEM+1 μmol/L Era、0.031 25 μmol/L hcGEM+0.031 25 μmol/L Era联用组的CI<1外,其余浓度组CI>1,说明hcGEM-Era 1∶1联用组对PANC-1细胞几乎无协同抑制效果(图3A)。
对于hcGEM与SASP联合用药组对PANC-1细胞的协同抑制效果,CompuSyn分析结果提示,hcGEM-SASP 4∶1联用对PANC-1细胞没有协同作用(CI>1),而hcGEM-SASP 1∶1联用组除了0.25 μmol/L hcGEM+0.25 μmol/L SASP、0.125 μmol/L hcGEM+0.125 μmol/LSASP联用组CI<1外,其余联用浓度组的CI>1,表明hcGEM-SASP 1∶1联合用药对PANC-1细胞几乎无协同抑制作用。hcGEM-SASP 1∶20联合用药对PANC-1细胞,除了1 μmol/LhcGEM+20 μmol/L SASP、2 μmol/L hcGEM+40 μmol/LSASP联用组CI>1外,其余浓度组CI<1,提示hcGEM-SASP 1∶20联合用药对PANC-1细胞主要是协同抑制效果,且协同效果随着浓度的增加而减弱。hcGEM-SASP 1∶400联合用药对PANC-1细胞有良好的协同抑制效果(CI<1),且协同效果随着浓度的增加而增强(图3B)。
对于hcGEM与Art联合用药组对PANC-1细胞的协同抑制效果,CompuSyn结果提示,hcGEM-Art 2∶1联用组在0.031 25 ~0.25 μmol/L hcGEM联合浓度范围内CI <1,且接近1,其余联合浓度组的CI>1,表明hcGEM-Art 2∶1联合用药对PANC-1细胞几乎无协同抑制作用。hcGEM-Art 1∶1联用组CI>1,表明hcGEM-Art 1∶1联合用药对PANC-1细胞无协同抑制作用。hcGEM-Art 1∶4联用组仅在0.031 25~0.125 μmol/L hcGEM联合浓度范围内CI<1,其余联合浓度范围内CI>1,表明hcGEM-Art 1∶4联合用药对PANC-1细胞仅在0.031 25~0.125 μmol/L hcGEM联合浓度范围内存在协同抑制作用。 hcGEM-Art 1∶16联用组在0.015 625~0.25 μmol/L hcGEM联合浓度范围内CI <1,其余联合浓度范围内CI>1,表明hcGEM-Art 1∶16联用组在0.015 625~0.25 μmol/L hcGEM联合浓度范围内对PANC-1细胞有协同抑制作用 (图3C)。
4. 讨论
目前,胰腺癌的一线治疗标准为吉西他滨联合白蛋白结合型紫杉醇或者FOLFIRONOX组合(5-氟尿嘧啶、亚叶酸钙、伊立替康和奥沙利铂)[10]。吉西他滨在一定程度上能提高患者的生存率,但耐药性的出现以及毒副作用限制了临床治疗效果,故临床上常将其与其他化疗药联合使用来提高其疗效[11]。近来大量研究证实,诱导癌细胞铁死亡可能对包括胰腺癌在内的多种类型癌症有效[12]。自2003年发现小分子铁死亡诱导剂埃拉斯汀至今,研究人员已发现多种铁死亡诱导剂,如RSL3、Sorafeni、SASP、Art等[13]。本研究选取了三种铁死亡诱导剂Era、SASP以及Art,首先研究了三种铁死亡诱导剂单独应用对PANC-1细胞的增殖抑制作用。通过CCK-8法检测了三种铁死亡诱导剂的细胞毒性作用,我们发现Era对PANC-1细胞的IC50最小,而SASP的IC50最大,表明在这三种铁死亡诱导剂中,Era对PANC-1细胞的抑制作用最强,而SASP最弱。三种铁死亡诱导剂单独使用对PANC-1细胞的增殖抑制作用呈现剂量依赖性,即浓度越大抑制效果越强。
为了进一步探究三种铁死亡诱导剂Era、SASP、Art与hcGEM联用是否对胰腺癌PANC-1细胞具有协同抑制作用,本研究设计了不同比例的联合用药组来探索最佳的联合协同方案。本次研究结果显示,当三种铁死亡诱导剂分别与hcGEM联合使用时, hcGEM-Era 4∶1或1∶4联用组,hcGEM-SASP 1∶400联用组对PANC-1细胞具有良好的协同抑制效果。hcGEM-Art 1∶4或1∶16联用组仅在一定浓度范围内对PANC-1细胞有协同抑制效果。胰腺导管腺癌患者中,90%存在KRAS突变, 而致癌KRAS将胰腺导管腺癌细胞重新编程为高度抗凋亡的状态。由于KRAS信号突变的副产物是生成大量的ROS,为了上调抗氧化能力,胰腺导管腺癌转而增强葡萄糖和谷氨酰胺代谢途径,使细胞对ROS诱导的、铁依赖性非凋亡的铁死亡模式敏感[13]。激活铁死亡可有效阻止肿瘤进展,增强化疗、放疗和免疫治疗的效果[14]。在治疗胰腺癌的过程中,吉西他滨通过NF-κB信号途径诱导内源性活性氧的产生,进而导致Nrf2信号通路的激活以及细胞内谷胱甘肽增加,最终使胰腺癌细胞对吉西他滨不敏感[15]。埃拉斯汀可通过抑制胱氨酸-谷氨酸逆向转运蛋白的活性来减少胱氨酸进入肿瘤细胞,从而降低胞内谷胱甘肽的合成,抑制线粒体的电压依赖性阴离子通道等多种途径促进线粒体代谢紊乱、活性氧类物质以及脂质过氧化物的大量积累,增强吉西他滨对胰腺癌细胞的杀伤效果[16]。柳氮磺胺吡啶可通过抑制胱氨酸-谷氨酸逆向转运蛋白的功能促进胰腺癌细胞的铁死亡,逆转癌细胞的耐药性 [17]。青蒿琥酯通过诱导铁依赖性氧化损伤促进胰腺癌细胞的死亡,并且这种脂质过氧化性细胞死亡可被铁死亡抑制剂阻断[18]。本研究中三种铁死亡诱导剂联合hcGEM对PANC-1细胞的协同抑制的效果可能与这三种铁死亡诱导剂引起的氧化应激反应的强弱有关,具体相关机制还有待进一步实验。
综上所述,本研究发现三种铁死亡诱导剂分别与hcGEM联合应用时存在对PANC-1细胞的协同抑制联合方案。hcGEM-Era 4∶1或1∶4联合用药以及hcGEM-SASP 1∶400联合用药对PANC-1细胞的协同抑制效果良好,而hcGEM-Art 1∶4或1∶16联合用药仅一定浓度范围能对PANC-1细胞产生协同抑制效果。
-
表 1 3批槟榔多酚提取物中总多酚的含量(n=3)
批号 总多酚含量(%) BLDF202001 51.45 BLDF202002 51.82 BLDF202003 52.70 表 2 梯度洗脱程序
时间(t/min) 流动相A(%) 流动相B(%) 0~5 5~10 95~90 5~7 10~15 90~85 7~9 15~20 85~80 9~12 20~5 80~95 表 3 槟榔多酚提取物中儿茶素、表儿茶素、原儿茶酸的线性方程
成分 回归方程 r 线性范围(μg/ml) 儿茶素 Y=0.0436X−0.0201 0.999 7 3.84~307.2 表儿茶素 Y=0.0415X+0.0395 0.999 8 4.92~295.2 原儿茶酸 Y=0.0833X+0.0113 0.997 7 1.12~89.6 表 4 3批槟榔多酚提取物中儿茶素、表儿茶素、原儿茶酸的百分含量(%, n=3)
批号 儿茶素 表儿茶素 原儿茶酸含量 BLDF202001 5.90 2.40 0.10 BLDF202002 0.52 0.43 / BLDF202003 1.30 0.77 / -
[1] 孔丹丹, 李歆悦, 赵祥升, 等. 药食两用槟榔的国内外研究进展[J]. 中国中药杂志, 2021, 46(05):1053-1059. [2] 栾剑, 郭迪, 周晓馥. 槟榔致癌性和毒性的药理学研究进展[J]. 食品与机械, 2019, 35(02):185-189+236. [3] 杨雅蛟, 孔维军, 孙兰, 等. 槟榔化学成分和药理作用及临床应用研究进展[J]. 世界科学技术-中医药现代化, 2019, 21(12):2583-2591. [4] PENG W, LIU Y J, WU N, et al. Areca catechu L. (Arecaceae): A review of its traditional uses, botany, phytochemistry, pharmacology and toxicology[J]. Journal of Ethnopharmacology,2015,164:340-356. doi: 10.1016/j.jep.2015.02.010 [5] 易攀, 汤嫣然, 周芳, 等. 槟榔的化学成分和药理活性研究进展[J]. 中草药, 2019, 50(10):2498-2504. doi: 10.7501/j.issn.0253-2670.2019.10.034 [6] FERREIRA I C F R, BAPTISTA P, VILAS-BOAS M, et al. Free-radical scavenging capacity and reducing power of wild edible mushrooms from northeast Portugal: Individual cap and stipe activity[J]. Food chemistry,2007,100(4):1511-1516. doi: 10.1016/j.foodchem.2005.11.043 [7] WANG N, SONG JY, ZHOU G, et al. Mechanism of salidroside relieving the acute hypoxia-induced myocardial injury through the PI3K/Akt pathway[J]. Saudi Journal of Biological Sciences,2020,27(6):1533-1537. doi: 10.1016/j.sjbs.2020.04.035 [8] Lin ES, Li CC. Evaluation of superoxide radical scavenging capacity and reducing power of Areca flower extracts[J]. Journal of Medicinal Plants Research,2010,4:975-981. [9] SARIEF, PRAYOGO GP, LOO YT, et al. Distinct phenolic, alkaloid and antioxidant profile in betel quids from four regions of Indonesia[J]. Scientific reports,2020,10(1):16254. doi: 10.1038/s41598-020-73337-0 [10] 蒋晨凤. 水解对槟榔多酚抗氧化活性的影响及多酚协同抗氧化特性研究[D]. 长沙: 湖南农业大学, 2016. [11] DSOUZA NG, FERNANDES J, D'SOUZA S, et al. In vitro antioxidant activity of leaves extracts of Areca catechu[J]. Research Journal of Pharmacy and Technology,2019,12(4):1536. doi: 10.5958/0974-360X.2019.00254.3 [12] CHAVAN YV, SINGHAL RS. Separation of polyphenols and arecoline from Areca nut (Areca catechu L. ) by solvent extraction, its antioxidant activity, and identification of polyphenols[J]. Journal of the Science of Food and Agriculture,2013,93(10):2580-2589. doi: 10.1002/jsfa.6081 [13] 赵安鹏, 靳婷, 王荣. 槟榔醇提物对H9c2心肌细胞的抗缺氧保护作用[J]. 药学实践杂志, 2019, 37(04):294-298. doi: 10.3969/j.issn.1006-0111.2019.04.002 [14] 宋晶燕. 槟榔多酚的提取分离及其抗高原缺氧药效学的研究[D]. 银川: 宁夏医科大学, 2020. [15] 靳婷. 槟榔提取物抗高原缺氧药效学及其机制研究[D]. 兰州: 兰州大学, 2018. [16] 霍妍, 赵安鹏, 宋晶燕, 等. 槟榔多酚对大鼠高原肺水肿的预防作用[J]. 解放军医学杂志, 2021, 46(10):961-967. doi: 10.11855/j.issn.0577-7402.2021.10.02 [17] GUO Y, PAN Y, ZHANG Z, et al. Study on the browning mechanism of betel nut (Betel catechu L. ) kernel[J]. Food Science & Nutrition,2020,8(4):1818-1827. [18] CHEN W, ZHANG C, HUANAG Y, et al. The inhibiting activity of areca inflorescence extracts on human low density lipoprotein oxidation induced by cupric ion[J]. International Journal of Food Sciences and Nutrition,2012,63(2):236-41. doi: 10.3109/09637486.2011.620946 [19] ADEYANJU A A, ASEJEJE F O, MOLEHIN O R, et al. Protective role of protocatechuic acid in carbon tetrachloride-induced oxidative stress via modulation of proinflammatory cytokines levels in brain and liver of Wistar rats.[J]. Journal of Basic and Clinical Physiology and Pharmacology,2021,3(18):1-12. [20] BERNATONIENE J, KOPUSTINSKIENE D M. The role of catechins in cellular responses to oxidative stress[J]. Molecules,2018,23(4):965. doi: 10.3390/molecules23040965 [21] QU Z, LIU A, LI P, et al. Advances in physiological functions and mechanisms of (−)-epicatechin[J]. Critical reviews in food science and nutrition,2021,61(2):211-233. doi: 10.1080/10408398.2020.1723057 [22] 王明月, 罗金辉, 李建国. HPLC法测定槟榔中的多酚类物质[J]. 天然产物研究与开发, 2011, 23(01):101-104. doi: 10.3969/j.issn.1001-6880.2011.01.024 -






 下载:
下载:
 下载:
下载:


