-
曲安奈德属于肾上腺糖皮质激素类药物,具有抗炎、抗毒素、抗休克等作用[1]。目前临床上主要有注射液和乳膏两种剂型,其中曲安奈德注射液用于治疗关节及结缔组织方面的炎症,曲安奈德乳膏用于治疗皮肤炎症,二者效果均显著,但副作用大,不可长期和大面积使用[2]。曲安奈德喷雾溶液作为一种新剂型,由于其活性成分浓度低,副作用小,如果再具有适度的透皮性能,则可进一步降低其在治疗皮肤病时的副作用,实现可长期和大面积使用的优势。因此,改善曲安奈德喷雾溶液的透皮功能对该药物的临床广泛应用具有重要价值。目前,药物中添加氮酮类化合物、多元醇类、表面活性剂等渗透促进剂是改善药物透皮功能的主要方法[3]。试验选取对皮肤温和的多元醇类中的乙醇和丙二醇两个渗透促进剂,考察单用与联用时对曲安奈德喷雾溶液透皮性能的影响,为曲安奈德喷雾溶液的透皮研究提供有用信息。
-
1260 Infinity II型高效液相色谱仪(安捷伦);智能透皮扩散仪(上海黄海药检仪器有限公司,规格:供给池容积4.8 ml、接收池容积8 ml、内径1.7 cm,外径2.7 cm);KQ-250DE型数控超声波清洗器(昆山市超声仪器有限公司);PB303-M型梅特勒-托利多电子天平。
-
曲安奈德0.015%喷雾溶液(自制);曲安奈德对照品(中国食品药品检定研究院,批号:100055-201804);8%硫化钠溶液;纯化水(屈臣氏);0.9%氯化钠溶液;色谱级甲醇;色谱级乙腈。雄性健康新西兰白兔[体质量2.0~2.5 kg,动物生产许可证号:SCXK (鲁) 2020004,购自于济南西岭角养殖繁育中心]。
-
称取不同量的乙醇溶解曲安奈德,添加不同含量的丙二醇,以水定容,即得曲安奈德喷雾溶液。
-
将健康的体质量为2 kg雄性新西兰白兔处死后立即取腹部皮肤,用配制好的8%硫化钠溶液进行浸泡,至兔毛透明时立即用棉签褪去兔毛,用配制好的0.9%氯化钠溶液清洗褪毛后的兔皮,待硫化钠气味消失后开始剥离兔皮的皮下黏膜组织和脂肪,随后用蒸馏水反复冲洗,待无白色浑浊时用0.9%氯化钠溶液再次清洗,最后将清洗好的兔皮浸泡至0.9%氯化钠溶液中,放置4 ℃冰箱冷藏保存,并在1周内使用。
-
采用的透皮试验条件分别为有效渗透面积:2.27 cm2;温度:(32 ± 1) ℃;供给液体积:4.6 ml;接收液体积:8 ml。体外透皮试验方法为将处理好的兔皮固定于Franz透皮扩散池的两池之间,角质层朝上,注入超声排尽气泡后的曲安奈德喷雾溶液,用封口膜将供给池顶部密封,分别于2、6、10、16、18、20、22和24 h时吸取接收液2 ml,每次取样后在接收池中补加相同温度和相同体积的含10%乙醇的生理盐水。在接收池中所取2 ml样品,用0.45 μm的聚醚砜微孔滤膜进行过滤,取续滤液即为供试品溶液。
-
精密称取曲安奈德对照品15.00 mg,置于100 ml的量瓶内,先用60 ml的甲醇将曲安奈德对照品溶解,再用纯化水定容至刻度线,得曲安奈德对照品储备液。精密量取2 ml曲安奈德对照品储备液,置于10 ml量瓶内,加60%甲醇至刻度线进行稀释,即得曲安奈德对照品溶液(30 μg/ml)。
-
色谱柱Zorbax SB-C18柱(250 mm×4.6 mm,5 μm);流动相:甲醇-水(60:40);流速:1.0 ml/min;检测波长:240 nm;进样量:20 μl。
-
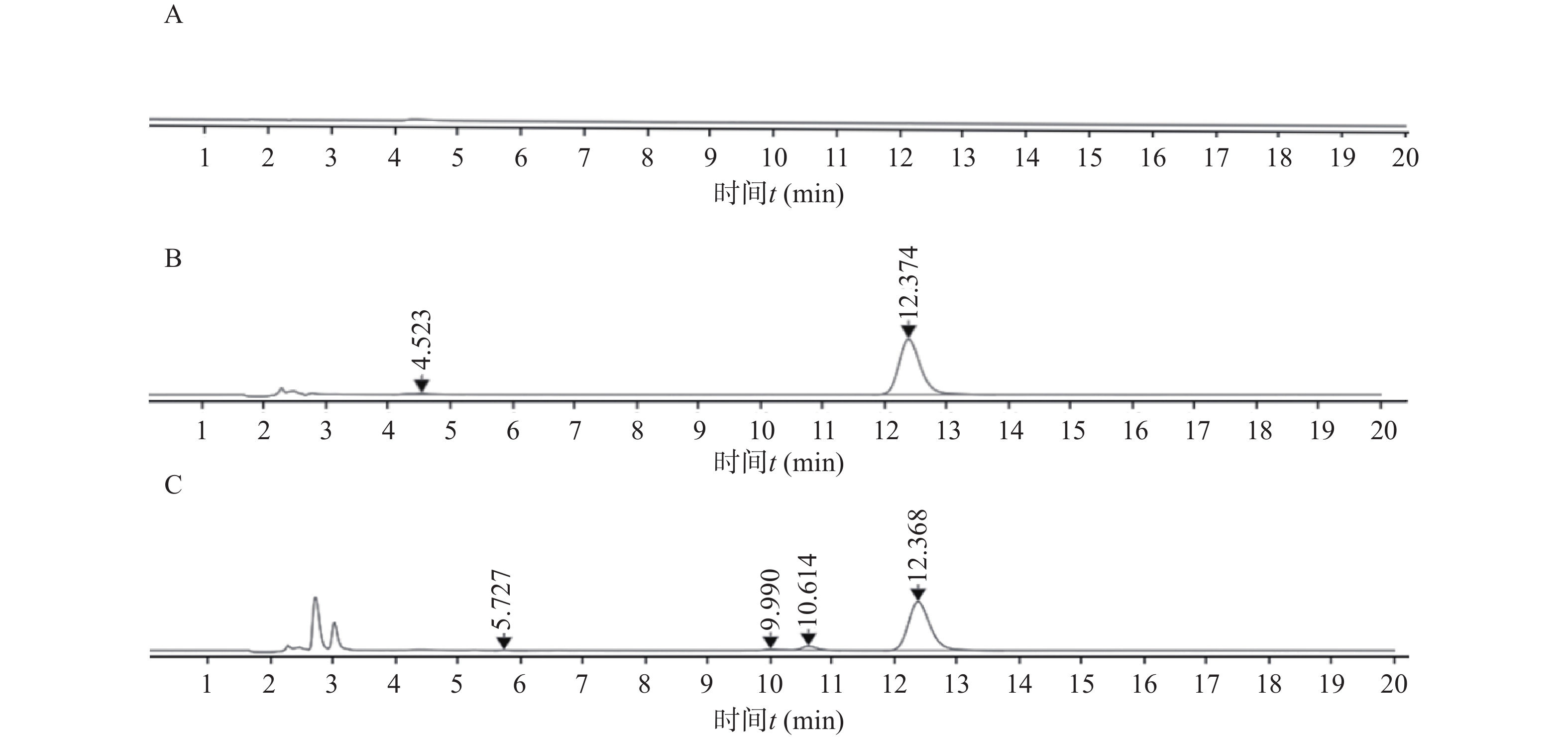
分别精密吸取20 μl空白接收液、曲安奈德对照品溶液和供试品溶液,注入液相色谱仪进行检测,所得的色谱图如图1所示,由图1可知曲安奈德供试品溶液主峰与对照品溶液的出峰时间相同,且空白接收液无干扰,说明所用的方法专属性良好。
-
精密量取45 μg/ml的曲安奈德对照品溶液适量,按照“2.5.1”项下方法连续检测6次,所得曲安奈德峰面积的RSD为0.9%,说明所用液相色谱仪的精密度良好,适用于曲安奈德的含量检测。
-
将曲安奈德对照品储备液用含10%乙醇的生理盐水逐级稀释,配制成45、35、18、9、6、0.9和0.06 μg/ml系列浓度的线性溶液,摇匀后经0.45 µm滤膜过滤,精密吸取20 μl续滤液,注入液相色谱仪进行检测,以上系列浓度溶液分别进行2次检测,检测结果以主峰浓度(C)为横坐标,以主峰峰面积(A)为纵坐标进行线性回归,结果显示在0.06~45 μg/ml的范围内线性关系良好,所得回归方程为A=44.003C+0.1663 (r=1.0000)。
-
按照“2.3”项方法分别制备同一浓度的供试液6份,按照“2.5.1”项下方法进行检测,所得曲安奈德含量的RSD为1.80%,说明所用含量测定方法的重复性良好。
-
在含10%乙醇的生理盐水中添加适量曲安奈德对照品储备液,配制成高、中、低浓度即18、9、0.9 μg/ml的曲安奈德供试品溶液,各浓度平行制备3份并进行测定,所得的平均回收率为102.02%,RSD为3.07%,说明该方法的准确度良好。
-
精密量取曲安奈德喷雾溶液剂自制样品适量,用含10%乙醇的生理盐水分别配制成高、中、低(18 μg/ml、9 μg/ml和0.9 μg/ml)浓度的供试品溶液,摇匀,在室温下放置,于0、3、6、9、12、15、18、21和24 h时精密量取20 μl,注入液相色谱仪进行检测,所得放置24 h后的高中低浓度供试品溶液的峰面积RSD分别为0.61%、0.61%和0.29%,符合规定(RSD≤2%),说明高中低浓度的供试品溶液常温放置24 h后,样品稳定。
-
各时间点所取的接收液按照“2.3”项下方法制备供试品溶液,供试品溶液按照“2.5.1”项下方法进行检测,并计算单位面积累计透皮吸收量(Q)。
$$ Q = m_{n} /S = v C^{i}_{n} /S =(VC_{n}+V \Sigma C_{n-1}) /S $$ 式中mn为接收池中曲安奈德的质量,S为扩散池的有效渗透面积,Cin为第n次样品的校正质量浓度,v为接收池中接收液的体积,Cn为第n次样品的实测质量浓度,V为各时间点的取样量。
以时间为横坐标,以累计透皮吸收量为纵坐标,进行线性回归,线性回归方程的斜率即为透皮吸收速率(Js)。
-
为改善曲安奈德喷雾溶液的透皮性能,又不会对皮肤造成刺激性,选取乙醇用量5%、10%和15%进行体外透皮吸收试验,计算透皮吸收速率(Js),结果见表1,表明当乙醇用量超过10%时,Js增加不显著,故当乙醇和丙二醇合用时,乙醇用量选择10%和15%。
表 1 乙醇、丙二醇单用和联用时对曲安奈德喷雾溶液体外透皮性能的影响 (
$\bar x $ ±s , n=12 )渗透促透剂 质量分数(%) 回归方程 r Js (μg/cm2·h) 乙醇 5 Y=1.7509 X−6.5211 0.9990 1.7509 10 Y=3.010 9 X−8.521 0 0.9993 3.0109 15 Y=3.021 3 X−7.562 0 0.9991 3.0213 丙二醇 15 Y=3.838 9 X−3.415 0 0.9992 1.8389 20 Y=3.753 9 X−5.412 0 0.9996 3.7539 25 Y=3.751 1 X−6.232 3 0.9992 3.7511 乙醇+丙二醇 10+20 Y=5.709 0 X−7.424 0 0.9990 5.7090* 10+25 Y=5.886 4 X−9.948 1 0.9974 5.8864* 15+20 Y=5.652 0 X−11.610 0 0.9970 5.6520* 15+25 Y=5.689 1 X−6.190 2 0.9992 5.6991* *P<0.05,乙醇和丙二醇联用时与单用时比较 -
基于丙二醇需要添加超过10%的浓度才能发挥促透作用的理论基础,同时结合曲安奈德喷雾溶液的特点,即需要保证药物渗透至皮肤但不过多的进入体循环,分别配制含丙二醇15%、20%和25%的曲安奈德喷雾溶液进行体外透皮试验,结果见表1,表明当丙二醇用量超过20%时,Js增加不显著,故当乙醇和丙二醇合用时,丙二醇用量选择20%和25%。
-
分别配制含乙醇10%和15%联合20%和25%丙二醇的曲安奈德喷雾溶液,进行体外透皮吸收试验,结果见表1。用SPSS 21中的单因素方差分析法对各组间的透皮吸收速率进行对比分析,结果显示,乙醇和丙二醇联用时的透皮吸收速率显著高于单用时的透皮吸收速率(P<0.05)。
-
体外透皮试验是经皮给药制剂处方筛选的重要手段,而接受介质的选择是体外透皮试验条件中的重点,其不仅需要结合药物的理化性质和处方因素,还需要在满足漏槽条件的同时不改变皮肤性质[4]。对于水溶性药物而言,生理盐水和磷酸盐缓冲液是常用的接受介质,而对于水溶性不好或脂溶性药物而言,生理盐水和磷酸盐缓冲液不能满足药物的漏槽条件,需要在其中加入乙醇、非离子表面活性剂等[5-6]。试验中曲安奈德极微溶于水,试验前期发现生理盐水作为接受介质无法满足漏槽条件,而在生理盐水中添加10%乙醇作为接收介质,既满足漏槽条件,同时不影响皮肤渗透功能,故选择含10%乙醇的生理盐水作为曲安奈德喷雾溶液体外透皮试验的接收介质。
曲安奈德喷雾溶液属于经皮给药制剂,可避免发生药物的肝肠首过效应及全身毒副作用,但由于皮肤角质层对经皮给药制剂渗透进入皮肤造成一定的阻碍,影响药物发挥治疗效果,因此,需要在经皮给药制剂中添加合适的渗透促进剂[7]。经皮给药制剂中常用的渗透促进剂种类多样,例如氮酮、萜烯类物质及多元醇,其中乙醇主要通过促进药物溶解和改变皮肤性能发挥促渗作用,丙二醇通过增加皮肤角质层中药物的溶解度发挥促渗作用[8-10]。Kiramat 等[11]发现丙二醇可显著改善口腔速溶膜剂的透皮功能。以上研究表明,药物制剂中加入乙醇或丙二醇,可增加药物的透皮功能。但众多研究发现,单用透皮吸收促进剂时的效果不如联用时,联用会产生促渗协同效果,使得药物的透皮功能达到最佳化[12-13]。基于此,本实验选择多元醇类中的乙醇和丙二醇作为渗透促进剂,并考察了乙醇和丙二醇单用和联用时对曲安奈德喷雾溶液透皮功能的影响,以获得乙醇和丙二醇单用或联用时的最佳配比,使得药物的透皮功能达到最佳化。结果显示,乙醇和丙二醇联用时的透皮吸收速率显著高于单用时的透皮吸收速率(P<0.05),且乙醇和丙二醇联用时对曲安奈德喷雾溶液的促透作用顺序为10%乙醇+25%丙二醇>10%乙醇+20%丙二醇>15%乙醇+25%丙二醇>15%乙醇+20%丙二醇,该结果可能是因为丙二醇使得乙醇更易于进入皮肤发挥作用,二者产生了协同促渗作用[14]。本研究为如何增加曲安奈德喷雾溶液及该类药物制剂的透皮功能提供了重要信息,后续还需要在此基础上继续深入研究其透皮效果和透皮机制。
Effects of ethanol and propylene glycol alone or in combination on the transdermal properties of triamcinolone acetonide spray solution
-
摘要:
目的 对曲安奈德喷雾溶液进行体外透皮试验,考察乙醇和丙二醇单用与联用时对曲安奈德喷雾溶液体外透皮功能的影响。 方法 选取新西兰白兔腹部皮肤,用Franz扩散池法对曲安奈德喷雾溶液进行体外透皮试验,用高效液相色谱法(HPLC)测定曲安奈德含量,用单因素方差分析法对各组间的透皮吸收速率进行对比分析。 结果 乙醇和丙二醇联用时的透皮吸收速率均显著高于单用时的透皮吸收速率(P<0.05),且乙醇和丙二醇联用时对曲安奈德喷雾溶液的促透作用顺序为10%乙醇+25%丙二醇>10%乙醇+20%丙二醇>15%乙醇+25%丙二醇>15%乙醇+20%丙二醇。 结论 10%乙醇和25%丙二醇联用时可使曲安奈德喷雾溶液的透皮功能达到最佳化。 Abstract:Objective To conduct in vitro transdermal test on triamcinolone acetonide spray solution, and investigate the effects of ethanol and propylene glycol alone or in combination on the in vitro transdermal function of triamcinolone acetonide spray solution. Methods Rabbit abdominal skin was selected, and the in vitro penetration test of triamcinolone acetonide spray solution was carried out by Franz diffusion cell method, and the content of triamcinolone acetonide was determined by HPLC. The rate of transdermal absorption was compared. Results The transdermal absorption rate of the combined use of ethanol and propylene glycol was significantly higher than that of the single use (P<0.05), and the order of promoting the penetration of triamcinolone acetonide spray solution when ethanol and propylene glycol were combined by 10% ethanol + 25% propylene glycol >10% ethanol + 20% propylene glycol >15% ethanol + 25% propylene glycol >15% ethanol + 20% propylene glycol. Conclusion The combination of 10% ethanol and 25% propylene glycol could optimize the transdermal function of triamcinolone acetonide spray solution. -
Key words:
- triamcinolone acetonide spray /
- in vitro transdermal test /
- franz diffusion cell /
- HPLC
-
阿尔茨海默症(Alzheimer's disease,AD)是常见的神经系统变性疾病之一,是一种持续性神经功能障碍,也是痴呆最常见的病因,其发生可导致进行性记忆减退、认知障碍、人格改变等症状。65岁以上患病率约5%,85岁以上患病率高于20%,是老年人死亡的主要原因之一[1-3]。AD的病理特征主要是老年斑(senile plaques,SP)、神经纤维缠结(neurofibrillary tangles,NFTs)和广泛神经元缺失。tau蛋白是一种微管相关蛋白,过度磷酸化tau蛋白是造成神经纤维缠结的主要原因,且AD患者病情严重程度与tau蛋白具有明显相关性。因此,tau蛋白显像剂的研究逐渐受到关注[4-5]。
近年来,研究者们研发了多种tau蛋白的PET显像剂,如“THK系列”(包括18F-THK5105、18F-THK523、18F-THK5117、18F-THK5351)[6-8],“RO系列”(包括18F-RO6958548、11C-RO6931643、11C-RO6924963)[9-11],“T系列”(包括18F-T807、18F-T808)[12]以及11C-PBB3[13]等。其中“T系列”18F-T807和18F-T808是由Simens公司开发的tau蛋白的分子探针。
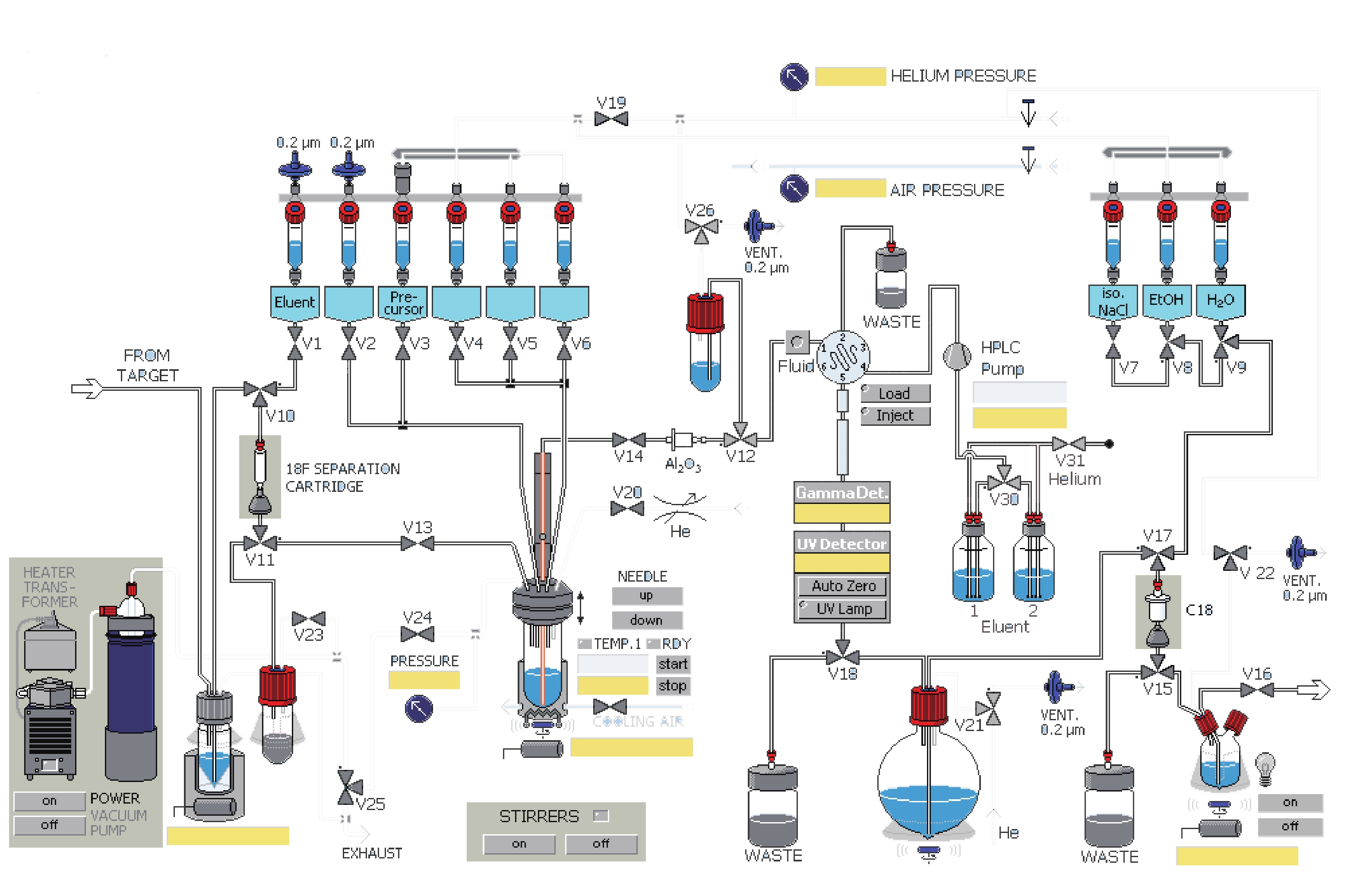
课题组在参考相关文献的基础上[14-15],使用GE公司的TRACERlab FXFN氟多功能合成模块(图1),以18F-T807前体(BOC保护)NPPI-95(1)为原料,使用改进一锅法自动合成了18F-T807(2),提高了产品产率,并开展初步的正常大鼠生物分布实验,探索其分布特征。
1. 材料与合成过程
1.1 原料、试剂与设备
18F-T807前体(BOC保护)NPPI-95(江苏华益公司);强阴离子交换固相萃取柱(QMA柱)、K222、碳酸钾水溶液、乙腈、(德国ABX公司);乙醇(国药化学试剂);盐酸(国药分析质检中心);DMSO(北京百灵威);Ultimate C18柱(美国Waters: 4.6 mm×250 mm,5 μm);富18O水(日本大阳日酸株式会社);0.22 μm MILLEX-GS液体滤膜、0.2 μm Millex-25空气滤膜(德国默克);0.7 mm×40 mm针头(西班牙BD Microlance);Wistar大鼠(北部战区总医院实验动物科)。溶剂乙醇为色谱纯,其余均为分析纯。
TRACERlab FXFN(美国GE)配备半制备VP 250×16高效液相色谱(德国MN)和紫外检测器及放射性检测器;正电子示踪剂质量控制薄层扫描仪(美国Bioscan),配塑料闪烁体晶体探测器;分析用HPLC(北京优联);GC-7900气相色谱(北京天美);CRC 25R活度计(美国Capintec),合成条件满足药品生产质量管理规范(GMP)的要求。
1.2 合成方法
表 1 TRACERlab FXFN合成器各溶剂瓶预装溶剂溶剂瓶 溶剂 1号瓶(V1) 1.5mg K2CO3溶于0.5 ml水 2号瓶(V2) 1.5 mg K222溶于1ml乙腈 3号瓶(V3) 1 mg前体溶于1.2 ml DMSO溶剂 5号瓶(V5) 1.5 ml HPLC流动相 6号瓶(V6) 1.5 ml HPLC流动相 圆底烧瓶 2 ml 84%NaHCO3水溶液和30 ml水 7号瓶(V7) 9 ml 0.9%生理盐水 8号瓶(V8) 1 ml 乙醇 9号瓶(V9) 10 ml 水 18F-T807自动化合成主要有以下几步:①18F-离子的柱分离纯化及蒸馏干燥。②T807前体的18F-离子亲核取代反应。③18F-T807的HPLC分离纯化。④18F-T807 C18柱溶剂转换与再纯化。
自动合成的具体步骤如下:
(1)共2.5 ml含18F-离子的18O水由MINItrace加速器经由18O(p, n)18F反应制备,轰击束流45μA,轰击时间40 min,18F-离子混合液由氦气作为载气经过TARGET管线传输到TRACERlab FXFN合成模块的锥形瓶内。
(2)V10、V11号阀门开启,18F-离子及18O水混合液中的18F-离子在真空泵抽取下被QMA柱(由1 ml乙醇,2 ml水活化)捕获滞留,18O水回收进入18O水回收瓶。
(3)V1、V13、V24号阀门开启,V1号瓶内的K2CO3溶液流经V1、V10、QMA柱、V11、V13,将18F-离子交换抽入反应瓶。
(4)关V1、V13号阀门,开启V2号阀门将V2号瓶内穴醚K222乙腈溶剂抽入反应管,18F-离子进入穴醚形成复合物。
(5)关V2号阀门,开启V20号阀门混合液在氦气吹拂下于85 ℃共沸蒸馏8 min,然后加热到110 ℃,在氦气吹拂下共沸蒸馏4 min除水。
(6)开启V3、V19号阀门,在氦气推动下V3号瓶内的前体流入反应管,V3、V19、V24号阀门关闭,反应管加热到140 ℃,反应10 min。
(7)反应瓶降温到50 ℃,开V24、V25号阀门恢复大气压。
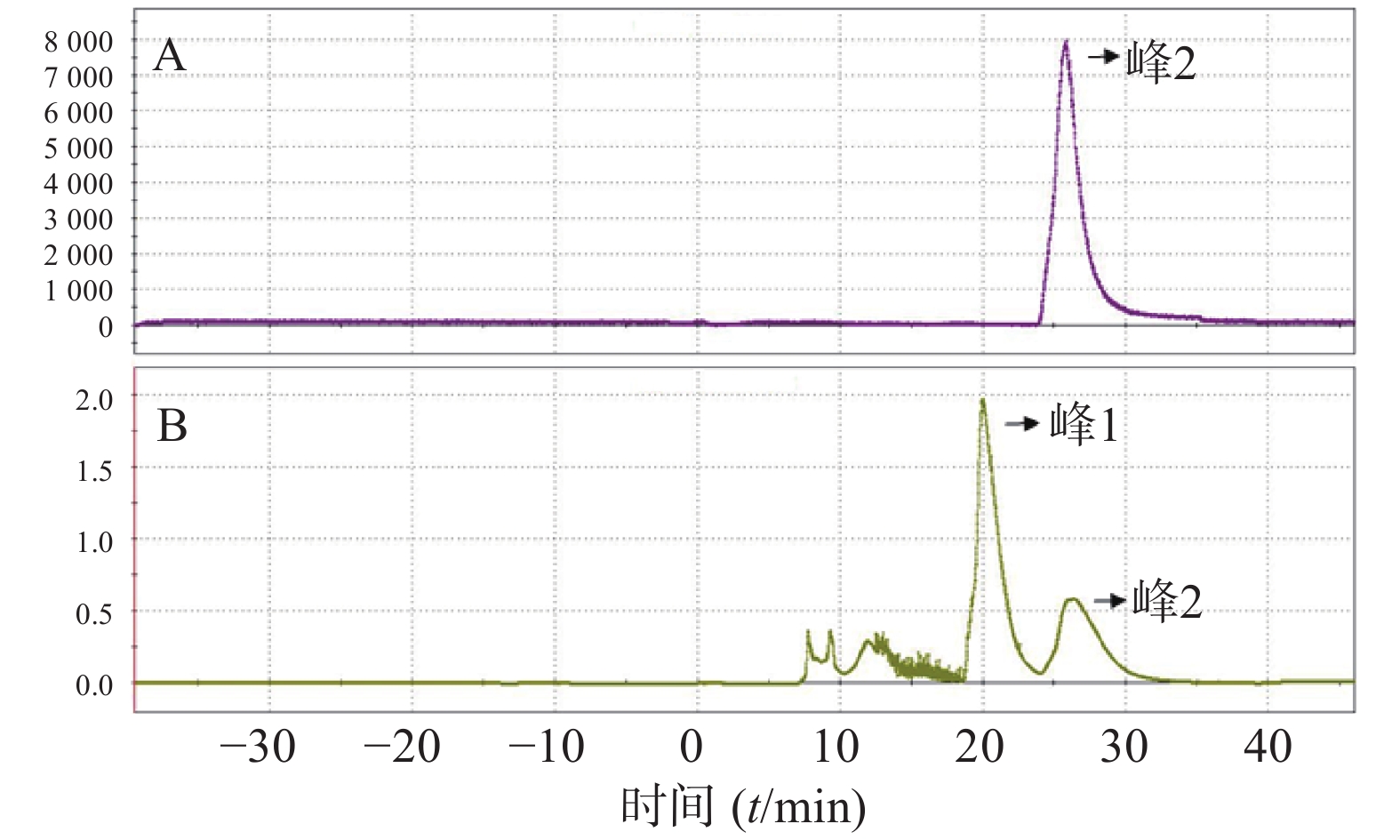
(8)反应后混合液经由V5、V6号瓶内的共3 ml HPLC流动相(25%乙醇水溶液,调整pH至2.0)冲洗到V26号阀门下的中转瓶内,然后打开V26、V12号阀门,在氦气压力下经由Fluid进入HPLC进样环,在Fluid控制下进样环旋转,产物进入HPLC半制备柱,Eluent1号瓶内流动相以5 ml/min的流速通过柱子分离。流动相以紫外(UV,λ=254 nm)和放射计数器监测。图3是18F-T807的HPLC及UV图。
(9)18F-T807溶液通过V18号阀门进入圆底瓶,圆底瓶内装有2 ml 84% NaHCO3水溶液和30 ml无菌注射用水。然后经V21、V15、V17号阀门,产物溶液通过V15、V17号阀门间的C18柱(以5 ml乙醇和10 ml水活化),产物会被捕获滞留在柱子上,然后打开V9阀门,用V9号瓶内10 ml水冲洗柱子到废液瓶(WASTE)内,然后C18柱经由V8号瓶内的1 ml乙醇冲洗进入V15阀门下的产品瓶,再经由V7号瓶内装有9 ml生理盐水再次冲洗。
(10)手动打开V22和V16号阀门,18F-T807在氦气压力下经过0.22μm液体滤膜过滤进入分装热室的收集瓶。
1.3 质量控制
对3批连续生产的产物进行了质量控制。质控项目包括澄明度、pH、核素半衰期、核素纯度、放化纯度、K222和残留溶剂、细菌内毒素、无菌测试,测试结果均符合标准要求。
1.4 正常大鼠生物分布实验
选择健康雄性Wistar大鼠30只,分为6组,每组5只,实验前6 h禁食禁水,每只通过尾静脉注入0.2 ml(约7.4 MBq)的18F-T807后,分别在5、15、30、60、90、120 min断头处死,取出脑、心、肝、肺、肾、肌肉、骨和血,去污、称重、计数,数据经衰减校正后计算放射性摄取率(每克组织的放射性摄取剂量占注射剂量的百分比)。
2. 结果与讨论
18F-T807有多种合成方法,本文在参考相关文献报道基础上,优化反应条件,改变前体用量为1 mg,同时使用HPLC分离条件为25%乙醇水溶液, pH调整至2.0,在线脱BOC保护。C18柱溶剂转换与再纯化,应用经改进的合成方法使合成产率由(20.5±6.1)%提高到(25.7±5.8)%,总反应时间为70 min。
连续3批产品,其质量控制结果如下:肉眼观察溶液无色透明,6 h后pH值为7,半衰期满足要求,不包含长半衰期核素(t1/2>5天),核素纯度大于99.5%,HPLC和TLC分析结果,即化学纯度和放化纯度合格,流动相是50%甲醇/水(HCl调节pH至2,),流速1.3 ml/min,紫外检测波长为254 nm,TLC条件为NH3H2O-甲醇-CH2Cl2 (1∶5∶94),气相色谱结果显示残留的丙酮、乙腈、DMSO等溶剂均在检测线下,细菌内毒素实验(鲎试剂法)合格,无菌检查合格。各项结果表明产品符合人体使用标准。
正常大鼠18F-T807在体内的生物分布如表2所示,可见大部分器官在给药5 min后摄取率最高,其中肾、肝、血的摄取率较高,超过5.56%ID/g(%ID/g为放射性摄取率,即各器官的每克放射性摄取值),在肌肉、骨骼摄取率相对较低,因此推断18F-T807主要是经过肝肾排出体外。18F-T807的脑、心、肺摄取率最低,120 min已降低至本底水平(1.08% ID/g),各器官的放射性摄取率随时间的推移逐渐降低,但清除较慢,在120 min 时大部分器官仍有较高的摄取率。
表 2 18F-T807在正常大鼠体内的分布($ \bar x \pm s $ ,n=5)器官 放射性摄取率(% ID/g) 5 min 15 min 30 min 60 min 90 min 120 min 脑 2.25±0.18 2.03±0.86 1.81±0.54 1.59±0.62 1.20±0.57 1.11±0.38 心 2.05±0.58 1.99±0.66 1.78±0.31 1.55±0.25 1.19±0.74 1.08±0.36 肝 5.79±2.58 5.95±1.17 5.48±0.66 5.29±0.71 4.83±0.84 4.27±0.86 肺 2.12±0.91 2.01±0.56 1.91±0.19 1.57±0.73 1.21±0.52 1.09±0.23 肾 7.36±4.01 5.11±1.21 3.89±1.99 3.63±1.82 3.17±1.68 2.99±0.98 肌肉 2.34±0.86 2.57±1.18 2.44±0.95 2.19±1.36 2.04±1.03 1.51±0.89 骨 2.58±0.91 2.67±0.75 2.02±0.68 1.99±0.82 1.52±0.46 1.27±0.55 血 5.56±0.35 5.41±0.56 4.73±0.74 4.57±1.31 4.22±0.37 4.01±0.45 3. 结论
在TRACERlab FXFN合成器上使用优化条件的一锅法自动合成了18F-T807,提高了产品产率。合成后进行的各种质量控制检测均显示产品符合质控标准。初步的正常大鼠生物分布实验,显示了其不同时间放射性摄取率的分布情况,为应用该产品开展人体显像提供了重要基础。
-
表 1 乙醇、丙二醇单用和联用时对曲安奈德喷雾溶液体外透皮性能的影响 (
$\bar x $ ±s , n=12 )渗透促透剂 质量分数(%) 回归方程 r Js (μg/cm2·h) 乙醇 5 Y=1.7509 X−6.5211 0.9990 1.7509 10 Y=3.010 9 X−8.521 0 0.9993 3.0109 15 Y=3.021 3 X−7.562 0 0.9991 3.0213 丙二醇 15 Y=3.838 9 X−3.415 0 0.9992 1.8389 20 Y=3.753 9 X−5.412 0 0.9996 3.7539 25 Y=3.751 1 X−6.232 3 0.9992 3.7511 乙醇+丙二醇 10+20 Y=5.709 0 X−7.424 0 0.9990 5.7090* 10+25 Y=5.886 4 X−9.948 1 0.9974 5.8864* 15+20 Y=5.652 0 X−11.610 0 0.9970 5.6520* 15+25 Y=5.689 1 X−6.190 2 0.9992 5.6991* *P<0.05,乙醇和丙二醇联用时与单用时比较 -
[1] NOOR F, WASEEM A, TARAR S A, et al. Frequency of destructive hip disease post intra-articular corticosteroid hip injection [J]. Pakistan J Med Health Sci, 2022, 16 (3): 344-344. doi: 10.53350/pjmhs22163344 [2] THOMAS ODK, CURRY ODJ. Longstanding crystalline retinopathy secondary to intravitreal triamcinolone injection [J]. Optometr Clin Pract, 2022, 4 (1): 5. doi: 10.37685/10.37685/uiwlibraries.2575-7717.4.1.1026 [3] JHA H, SAHU A, ARORA R. Anti-neoplastic transdermal patches: a novel approach for targeted drug delivery using nanocarriers in cancer therapy [J]. J Adv Res, 2022, 13(5): 1-16. [4] 邵鹏, 郑金琪, 潘芳芳, 等. 外用半固体制剂的体外释放试验和等效性评价 [J]. 中国现代应用药学, 2021, 38(20): 2481-2487. [5] TIFFNER K I, KANFER I, AUGUSTIN T, et al. A comprehensive approach to qualify and validate the essential parameters of an in vitro release test (IVRT) method for acyclovir cream, 5% [J]. Int J Pharm, 2018, 535 (1/2) : 217-227. [6] 李璐, 周建明, 杨一帆, 等. 复方南星止痛膏活性成分在不同接收介质中的透皮扩散行为比较 [J]. 中国实验方剂学杂志, 2018, 24 (3) : 1-7. [7] 董王明, 江昌照, 叶金翠, 等. 经皮给药制剂促透方法研究进展 [J]. 中国新药杂志, 2020, 29 (18) : 2089-2097. [8] KOVACIK A, KOPECNA M, VAVROVA K. Permeation enhancers in transdermal drug delivery: benefits and limitations [J]. Expert Opin Drug Deliv, 2020, 17 (2) : 145-155. doi: 10.1080/17425247.2020.1713087 [9] HAQUE T, TALUKDER M M U. Chemical enhancer: a simplistic way to modulate barrier function of the stratum corneum [J]. Adv Pharm Bull, 2018, 8 (2) : 169-179. doi: 10.15171/apb.2018.021 [10] LUO Z, LIU C, QUAN P, et al. Effect of chemical penetration enhancer-adhesive interaction on drug release from transdermal patch: mechanism study based on FT-IR spectroscopy, 13C NMR spectroscopy, and molecular simulation [J]. AAPS Pharm Sci Tech, 2021, 22 (5) : 198. doi: 10.1208/s12249-021-02055-1 [11] Kiramat Ali Shah, 高彬彬, 李洁琼, 等. 丙二醇对利扎曲普坦普鲁兰多糖/麦芽糖糊精口腔速溶膜剂制剂学性质的影响 [J]. 当代化工, 2020, 49 (11) : 2379-2382. [12] LI Z H, LI Y Y, HOU M, et al. Topically applied hypericin exhibits skin penetrability on nude mice [J]. Lasers Med Sci, 2018, 33 (6) : 1279-1286. doi: 10.1007/s10103-018-2479-8 [13] CHEN H L, CAI C C, MA J Y, et al. Effect of the dispersion states of azone in hydroalcoholic gels on its transdermal permeation enhancement efficacy [J]. J Pharm Sci, 2018, 107 (7): 1879-1885. doi: 10.1016/j.xphs.2018.02.020 [14] 贺梦媛, 丛竹凤, 张兵, 等. 近年醇质体制备工艺及制剂研究进展[J]. 中国医药工业杂志, 2021, 52 (11) : 1409-1417. -






 下载:
下载:

 下载:
下载:




