-
河豚毒素(TTX)是一种强效生物毒素,是目前已知毒性最强的生物毒素之一,主要存在于河豚鱼和部分海洋生物中。据报道,河豚毒素能与电压门控钠离子通道1∶1结合,阻断钠离子内流,从而发挥抑制兴奋的作用[1]。基于其对钠离子通道不同亚型的阻断,河豚毒素在一定剂量范围可以起到镇痛、局麻等多种药用效果[2-6]。其中镇痛效用为当前主要研究领域,相较于临床常用的阿片类药物,河豚毒素发挥镇痛作用无成瘾性,副作用小,肝肾功能损害小,但其治疗剂量极低,且治疗窗口狭窄,低剂量往往带来频繁的给药次数,要想良好的发挥镇痛作用,就需要选取合适的剂型来更好的发挥其作用。微球作为长缓释制剂的优良载体,经常包载治疗窗狭窄、半衰期较短的药物以发挥长周期药效的作用,为测定微球中TTX含量等数据,需要一套适用的检测方法。
目前针对河豚毒素定量检测的方法多为生物样本检测,应用于动物体内河豚毒素检测和人河豚毒素中毒血液检测,针对河豚毒素的体外测定方法较少,药用制剂的检测方法更是稀少。本方法的建立适用于河豚毒素药用制剂中的含量检测,为河豚毒素药用开发的含量测定提供了新选择。主流的河豚毒素含量测定方法包括小鼠生物法[7-8]、免疫测定法[9-11]、高效液相色谱法(HPLC)[12-13]、液相色谱-质谱联用法[14-16]、气相色谱-质谱联用法[17]等。高效液相色谱法因其适用性广、稳定性好及灵敏度良好而备受欢迎。但由于河豚毒素不溶于任何有机溶剂,仅溶于弱酸水溶液,常见的方法难以较好地保留河豚毒素。本研究使用庚烷磺酸钠作为离子对试剂,通过河豚毒素与离子对试剂结合形成复合分子,提高其在色谱柱上的保留能力,从而更好地分离河豚毒素与其他物质 [18-19]。
根据河豚毒素的作用功效和缓释长效镇痛目标,本研究制备了河豚毒素缓释微球。为考察微球中河豚毒素的含量,需要建立相应的含量测定方法。因此,本研究采用HPLC方法建立针对河豚毒素缓释微球的含量分析方法,以期为河豚毒素微球中的含量测定提供依据。
-
LC-20AD高效液相色谱仪(日本岛津制作所);电子天平(METTLER TOLEDO,瑞士);数显pH计(sartorius,德国),紫外可见分光光度计[安捷伦科技(中国)有限公司];循环水式真空泵(上海豫康科教仪器设备有限公司);SECURA125-1CN型十万分之一电子天平(赛多利斯,德国);Arium@ mini超纯水机(赛多利斯,德国)。
-
河豚毒素标准品(98%,中洋生物科技股份有限公司);PBS缓冲液(武汉普诺赛生物科技有限公司);聚乳酸羟基乙酸共聚物(PLGA, RG 503H,sigma-Aldrich Company);甲酸(色谱纯,国药集团);三氟乙酸(色谱纯,sigma-Aldrich Company);氢氧化钠(分析纯,国药集团化学试剂有限公司);泊洛沙姆-188(sigma-Aldrich Company);叠氮钠(Sigma-Aldrich Company);纯净水(杭州娃哈哈集团有限公司);乙腈(色谱纯,sigma-Aldrich Company);二氯甲烷(色谱纯,国药集团化学试剂有限公司);河豚毒素-PLGA微球、空白PLGA微球(海军军医大学药剂学教研室提供)。
-
色谱柱:Agilent ZORBAX SB C18柱(4.6 mm×150 mm,5 μm);流动相:8 mmol/L庚烷磺酸钠(0.005%TFA,1 mol/L NaOH调节pH4.0)水溶液∶乙腈=95∶5;检测波长:200 nm;流速:1.0 ml/min;柱温:30 ℃;分析时间:12 min;进样量:20 μl。
-
精密称取叠氮钠、泊洛沙姆-188适量,加入磷酸盐缓冲液配制成含0.02%NaN3、0.02%F-68的释放介质,取10 mg河豚毒素标准品,用6 ml 0.1%甲酸溶液溶解,以PBS介质(0.02%NaN3、0.02%F-68)定容得100 μg/ml的对照品溶液。
-
精密称取20.00 mg河豚毒素冻干微球,加入1 ml二氯甲烷(DCM)超声使完全溶解,加入经甲酸调节pH至4.0的释放介质,超声后充分振摇,取上层水相溶液过0.22 μm水系滤膜作为供试品溶液。
-
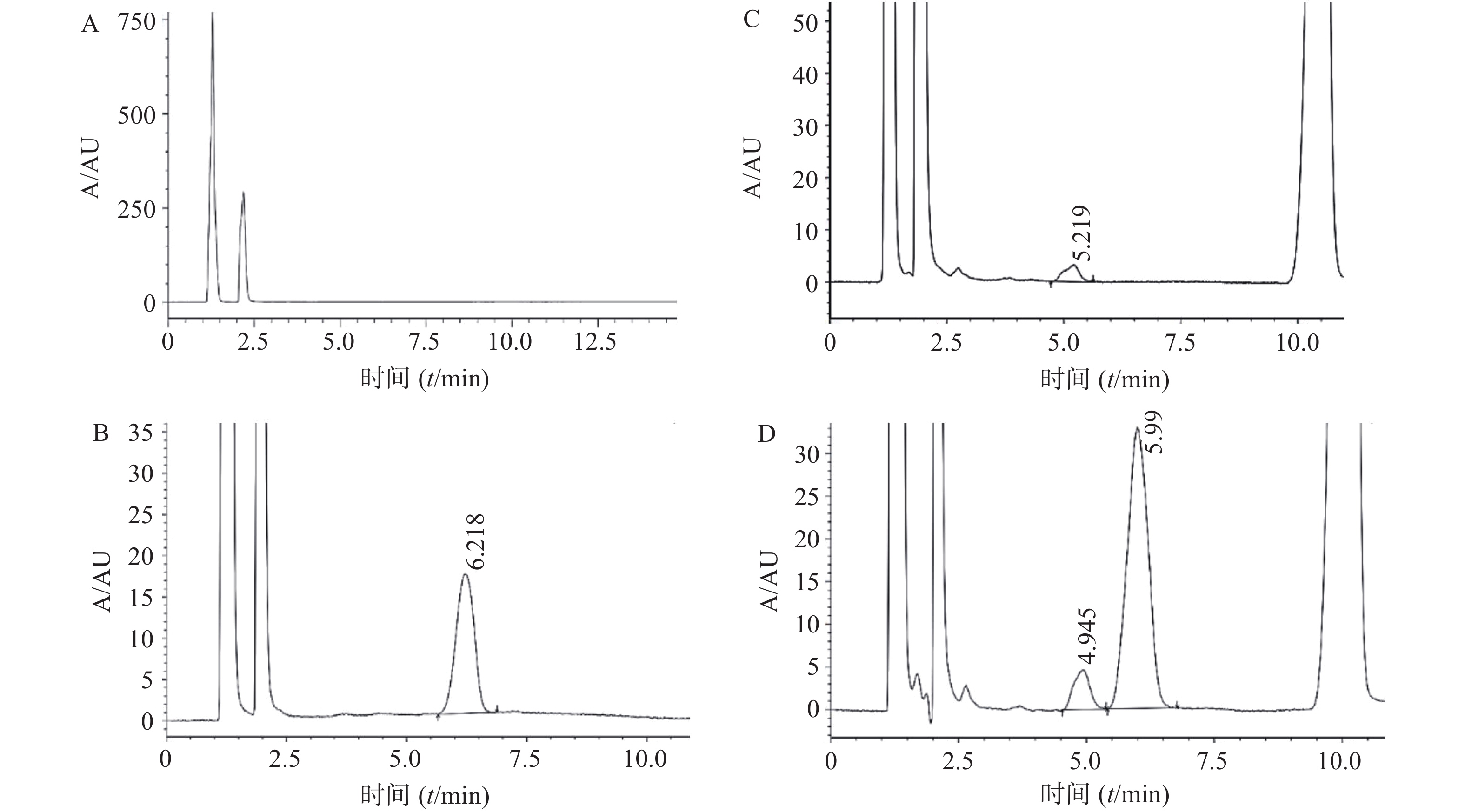
配制以下样品,考察方法专属性:① 1ml PBS释放介质加入50 μl 1%甲酸,为空白释放介质;② 甲酸调节pH的PBS介质稀释得的10 μg/ml TTX标准品溶液;③ 精密称取10 mg空白微球于5 ml EP管,加入1 ml二氯甲烷超声2 min使完全溶解,加入1 ml PBS介质及50 μl 1%甲酸,充分振摇后超声10 min,取上层水相过0.22 μm水系膜,为空白微球样品;④ 精密称取10 mg 空白微球于5 ml EP管,准确加入10 μg/ml TTX标准液1ml,加入1 ml二氯甲烷超声2 min使完全溶解,甲酸调节pH的PBS溶液提取,过膜处理后为河豚毒素微球样品。按照“2.1”项下方法进样检测,图谱如图1。实验结果表明,该方法专属性良好,河豚毒素得到了较好的分离。
-
精密量取对照品溶液于10 ml量瓶,加入PBS介质,分别稀释得20、15、12、10、5、2、1 μg/ml的系列浓度标准液。按照“2.1”项下方法进样检测,记录TTX峰面积。以峰面积(A)为纵坐标,河豚毒素的浓度(Xr μg/ml)为横坐标进行线性回归,得回归方程为Y=22 216X+591.8,r=0.999 9,证明本方法在1~20 μg/ml浓度范围内线性良好。
-
由对照品溶液配制低、中、高三个浓度的河豚毒素标准液,分别为2、10、20 μg/ml,进行日内精密度及日间精密度测定。日内精密度测定方法为样品测定5次,计算日内相对偏差;日间精密度测定法为3个浓度样品连续测定5 d,计算日间相对偏差。3个浓度由低到高的日内精密度RSD值分别为0.81%、0.43%、0.58%,日间精密度RSD值分别为1.32%、1.10%、0.68%,均小于2.0%,符合精密度要求。
-
按照“2.2.2”项下方法,平行制备5份河豚毒素供试品溶液,按照“2.1”项下色谱条件进行测定。结果显示,RSD值为1.49%,表明该方法重复性良好。
-
选取低、中、高3个浓度标准溶液,分别为2、10、20 μg/ml,称取10 mg空白微球于5 ml EP管,加入1 ml 二氯甲烷超声溶解和1 ml 标准溶液及50 μl 1%甲酸,充分振摇后超声10 min,超声后取上层水相过膜进样检测,计算回收率,结果见表1。
表 1 河豚毒素加样回收率试验结果(n=3)
加入量(μg/ml) 测得量(μg/ml) 回收率(%) RSD(%) 2 1.96 1.98 1.99 98.88±0.82 0.83 10 10.04 9.96 10.00 100.00±0.43 0.43 20 20.04 20.18 20.08 100.49±0.37 0.37 试验结果表明,低、中、高3个浓度的回收率均在98.0%~102.0%之间,3组不同浓度的RSD均小于2%,符合方法学要求。
-
为了考察该方法能否测定微球中还未释放的河豚毒素含量,本实验进行微球中药物含量测定。精密称取河豚毒素-PLGA微球20 mg,加入0.5 ml DCM超声溶解,再加入1%甲酸调节pH至4的PBS溶液2.5 ml,充分振摇后超声10 min,取上清液过膜后进样检测。测定河豚毒素浓度为2.52 μg/ml,换算后计算微球包封率(EE)及载药量(DL),计算方法如下:
$$ \begin{split} &\text{包封率}({\%})=\frac{\text{微球内药物量}}{\text{投入总药物量}}\times 100\\&{\text{载药量}}({\%})=\frac{\text{微球中包含药物量}}{\text{微球总重量}}\times 100 \end{split}$$ 换算可得微球包封率为60.77%,载药量为0.024%。因此,通过此方法可以计算微球的载药量和包封率,为下一步微球释放情况考察时通过测定微球中未释放含量从而间接测定微球的释放量提供依据。
-
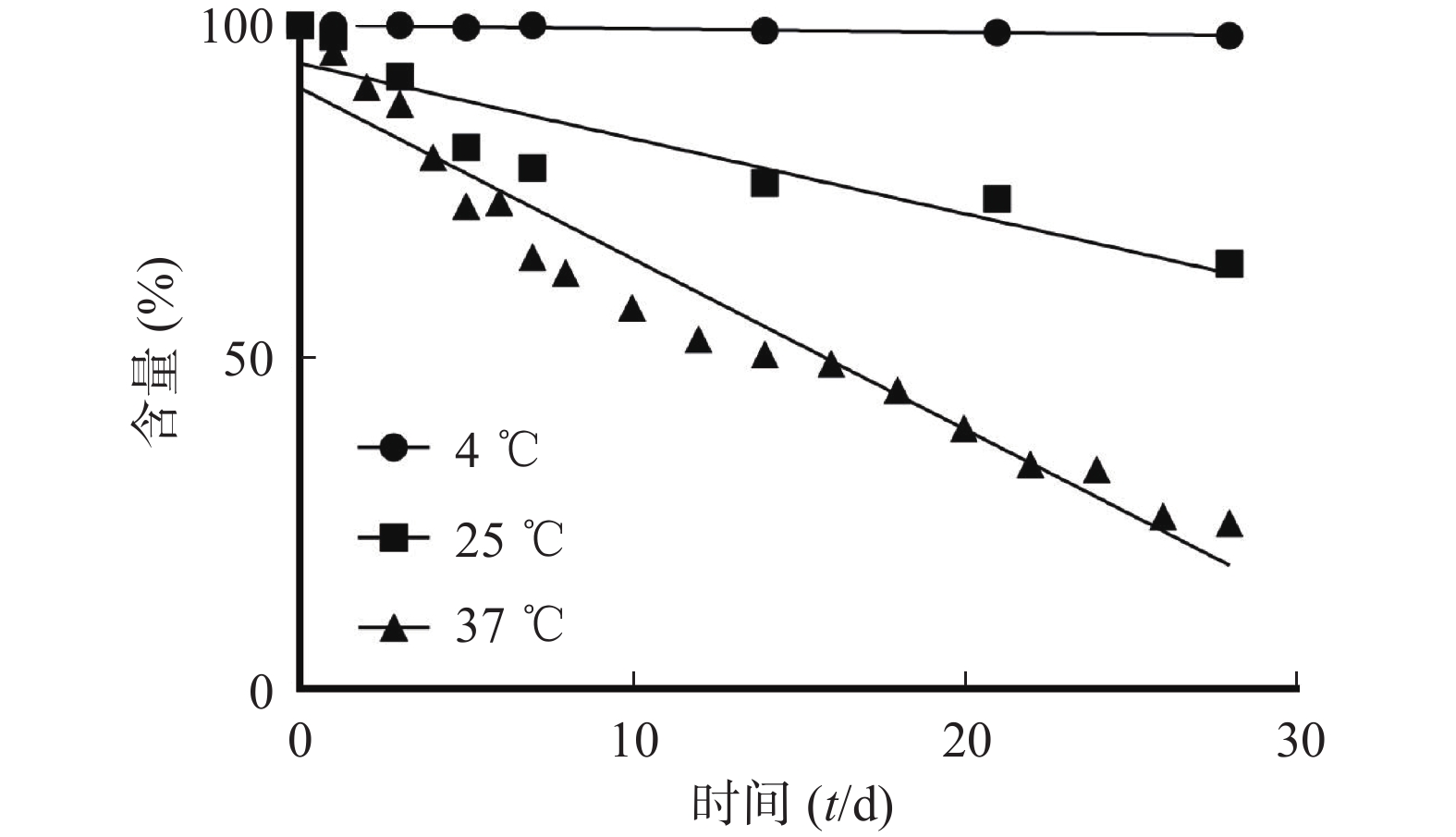
由于河豚毒素溶液受温度影响较大,温度越高,河豚毒素降解越快,在微球长期释放过程中,已释放的河豚毒素发生降解会影响体外释放的测定,故对河豚毒素标准品溶液进行4、25、37 ℃条件下释放介质中的稳定性考察,样品pH均为7.4。4 ℃和25 ℃样品分别在第1、3、5、7、 14、 21、28天取样检测;37 ℃样品在第1周每天取样,其后隔天取样。取12 μg/ml TTX标准品溶液分别置于4、25、37 ℃,100 r/min条件下考察,用于测定TTX在体外释放条件下稳定性,结果见图2。
结果表明,河豚毒素在水溶液中稳定性受温度影响比较大。28 d考察中,河豚毒素在4 ℃放置降解约1.53%,25 ℃放置降解约32.67%,37 ℃放置降解约74.96%。所以,在河豚毒素微球释放测定时不能直接测定释放介质中的河豚毒素含量,而应测定微球中还未释放的河豚毒素含量,从而间接测定微球的释放。
-
目前针对河豚毒素定量检测的方法多为生物样本检测,应用于动物体内河豚毒素检测和人河豚毒素中毒血液检测,针对河豚毒素的体外测定方法较少,药用制剂的检测方法更是稀少。本方法的建立适用于河豚毒素药用制剂中的含量检测,为河豚毒素药用开发的含量测定提供了借鉴。
针对河豚毒素微球的含量测定,我们尝试了许多方法,发现常规的反相色谱法对这类物质分离度不高,而反相离子对色谱法分离效果好。为了取得更佳的分离效果,分别考察了Agilent Zorbax SB-C8柱(4.6mm×150mm, 5μm)、shim-pack GIST C18-AQ(4.6mm×250mm, 5μm)、Agilent Zorbax SB C18柱(4.6mm×150mm, 5μm)等不同色谱柱对河豚毒素的分离效能及峰型的影响。结果显示,当色谱柱为Agilent Zorbax SB C18柱时,河豚毒素的分离效果及峰形最佳。
在离子对色谱法中,河豚毒素的分离及峰型等受到多种因素影响,在该方法建立过程中,我们考察了流动相pH、流动相比例等条件对河豚毒素分离效果的影响。流动相pH:我们考察了流动相中pH3.0、4.0、4.5和5.0,不同pH对其峰型有一定的影响,对比筛选后,我们确定了pH4.0时为最佳峰型。流动相比例:流动相比例对TTX出峰时间存在较大的影响,我们考察了90∶10、92∶8、94∶6、95∶5、98∶2等比例,保留时间在4~25 min不等,在保证出峰完整的情况下,调整进样时间至适宜,最终确定比例为95∶5。
微球中的河豚毒素提取我们尝试了不同的有机溶剂破乳,其中包括二氯甲烷、三氯甲烷、乙腈等有机溶剂,最终选用速度最快、溶解最完全的二氯甲烷溶剂破乳提取。
结果证明选用本方法测定缓释微球中的河豚毒素在一定浓度范围内线性良好,专属性强,精密度和回收率均符合方法学要求,可以作为TTX微球含量、释放量的测定方法。
Establishment of determination of tetrodotoxin sustained-release microspheres
-
摘要:
目的 建立测定河豚毒素(TTX)缓释微球中的含量检测方法。 方法 采用HPLC法,色谱柱为Agilent Zorbax SB C18柱(4.6 mm×150 mm,5 μm);流动相为5%乙腈-95% 8 mmol/L庚烷磺酸钠溶液(0.005%TFA,pH4.0);流速1.0 ml/min;紫外检测波长200 nm;柱温30 ℃。 结果 该方法专属性好,TTX在1~20 μg/ml浓度范围内线性良好,该方法日内精密度、日间精密度、稳定性、重复性均符合要求,加样回收率范围为98.0%~102.0%。 结论 本研究建立了适用于缓释微球中河豚毒素含量测定的HPLC方法,该方法准确可靠,专属性强,可以实现定量检测。 Abstract:Objective To establish a detection method for the determination of tetrodotoxin (TTX) in sustained-release microspheres. Methods The HPLC separation of tetrodotoxin was performed on an Agilent ZORBAX SB-C18 column (4.6mm×150mm,5 μm) with acetonitrile, 8mmol/L sodium heptane sulfonate containing 0.005% TFA (5:95) (pH 4.0) as the mobile phase. The flow rate was 1.0 ml/min. The UV detection wavelength was 200 nm and the column temperature was 30 °C. Results The method had good specificity and linearity of TTX in the concentration range of 1−20 μg/ml. The intra-day precision, inter-day precision, stability and repeatability of the method were good, and the average recoveries were found between 98.0% and 102.0%. Conclusion This study established an HPLC method which was suitable for the determination of tetrodotoxin sustained-release microspheres. The method is accurate and reliable within the applicable range, with strong specificity, which could lead to quantitative detection. -
Key words:
- Tetrodotoxin /
- HPLC /
- sustained-release microspheres /
- sodium heptane sulfonate
-
盐酸普萘洛尔(propranolol hydrochloride,PPL)是治疗婴幼儿血管瘤的一线和首选药物[1]。口服盐酸普萘洛尔疗效确切,但其存在首过效应强、生物利用度低、半衰期短等问题,且不良反应发生率高[2]。普通盐酸普萘洛尔外用制剂只对浅表型血管瘤有效,对深部型和复合型血管瘤的治疗仍需结合口服给药。诸多研究表明,立方液晶(cubosomes,Cubs)可显著提高经皮给药制剂的皮肤渗透性,且能提高其在皮肤尤其是皮肤真皮层的药物滞留量,有望能提高盐酸普萘洛尔外用制剂对深部型和复合型血管瘤的疗效[3~5]。因此,课题组拟基于立方液晶载药技术将盐酸普萘洛尔制备成一种纳米经皮给药制剂,以期能降低或避免口服给药带来的高不良反应发生率,提高盐酸普萘洛尔的治疗效果和患者依从性。前期实验中,课题组筛选了盐酸普萘洛尔立方液晶纳米粒(PPL-Cubs)的制备方法,并通过单因素考察结合星点设计效应面法优化了其最佳处方和制备工艺,结果制得的PPL-Cubs包封率低(约50%),远低于药典规定的80%。立方液晶为多层囊泡结构,类似于多囊脂质体,其可能与脂质体同样存在对水溶性化合物包封率较低的问题。鉴于前期研究表明,盐酸普萘洛尔在不同pH磷酸盐缓冲液下的溶解度存在极大差异,因此,本研究拟在立方液晶常规制备的基础上,引入“pH梯度法”的载药思路,制备PPL-Cubs,以期提高其包封率。
1. 仪器与试药
1.1 仪器
岛津LC-20AD型高效液相色谱仪(日本岛津公司);DV215CD型分析天平(美国奥豪斯公司);AL204型电子天平[梅特勒-托利多仪器(上海)有限公司];DF-101B集热式恒温加热磁力搅拌器(郑州长城科工贸有限公司);高压均质机(意大利NIRO-SAVI S.P.A.公司);NICOMP 380 ZLS激光粒度测定仪(美国PSS粒度仪公司);超滤离心管(100KD,Millipore)。
1.2 试药
盐酸普萘洛尔(含量99.9%,常州亚邦制药有限公司);单油酸甘油酯(法国GATTEFOSSé公司);泊洛沙姆407(德国BASF公司);甲醇、乙腈为色谱纯,水为超纯水,其余试剂为分析纯。
2. 方法与结果
2.1 包封率的测定
取PPL-Cubs适量,装入超滤离心管中,于4000 r/min离心10 min,收集离心液,采用课题组前期建立的盐酸普萘洛尔含量测定方法测定离心液中游离药物浓度C游离;取未透析的PPL-Cubs,测定药物浓度C总;根据公式EE(%)=[(C总−C游离)/ C总]×100%计算PPL-Cubs的包封率。
2.2 PPL-Cubs的制备
2.2.1 注入法
精密称取单油酸甘油酯9 g和泊洛沙姆407 1.5 g,加入10 ml无水乙醇,20 ℃水浴下搅拌溶解,为A相;精密称取盐酸普萘洛尔3.5 g,加入86 g纯化水,20 ℃水浴下搅拌溶解,为B相。于20 ℃水浴及600 r/min搅拌速度下,将A相缓慢地滴加至B相中,待磁力搅拌1 h后加入适量纯化水使总质量为100 g,再在800 bar压力下高压均质7次,得PPL-Cubs。
2.2.2 pH梯度法
精密称取单油酸甘油酯适量,40 ℃水浴加热使融化,为A相;精密称取泊洛沙姆407适量,加入适量纯化水,40 ℃水浴加热使溶解,并用1%磷酸溶液调节pH至酸性,为B相;于40 ℃水浴及600 r/min搅拌速度下,将A相缓慢滴加到B相中,待磁力搅拌30 min后,得空白立方液晶纳米粒粗品;取空白立方液晶纳米粒粗品,高压均质数次,得空白立方液晶纳米粒(B-Cubs)。取盐酸普萘洛尔溶解于适量纯化水中,得盐酸普萘洛尔水溶液;将盐酸普萘洛尔水溶液加入一定比例的B-Cubs中,搅拌均匀,并用氢氧化钠溶液调节pH至一定值,于一定温度下持续搅拌一定时间,再放置至室温,即得PPL-Cubs。
2.3 B-Cubs的制备工艺优化
前期试验结果表明,磁力搅拌速度、时间、温度、内水相pH值对B-Cubs的粒径基本无影响,高压均质压力及均质次数是影响其粒径的主要因素,故拟进一步优化高压均质压力和均质次数。
2.3.1 高压均质压力的考察
按照“2.2.2”项下方法,取空白立方液晶纳米粒粗品,分别在400、600、800、900、1000 bar下高压均质7次,测定制得B-Cubs的粒径及多分散指数(见表1)。结果表明,随高压均质压力的提高,制得B-Cubs的粒径和多分散指数均逐渐减小,当均质压力≥900 bar时,B-Cubs的粒径和多分散指数变化较小,故确定高压均质压力为900 bar。
表 1 高压均质压力的考察(n=3)压力(bar) 粒径(nm) 多分散指数 400 169.1±3.5 0.189±0.056 600 129.9±3.2 0.172±0.062 800 110.9±2.7 0.126±0.041 900 97.9±2.1 0.073±0.016 1000 96.4±1.9 0.057±0.009 2.3.2 高压均质次数的考察
按照“2.2.2”项下方法,取空白立方液晶纳米粒粗品,分别在900 bar下高压均质3、5、7、9次,测定制得B-Cubs的粒径及多分散指数(见表2)。结果表明,随高压均质次数的增加,制得B-Cubs的粒径和多分散指数均逐渐减小,当均质次数≥7次时,B-Cubs的粒径和多分散指数变化较小,故确定高压均质次数为7次。
表 2 高压均质次数的考察(n=3)次数(次) 粒径(nm) 多分散指数 3 160.4±4.6 0.173±0.052 5 129.2±3.8 0.140±0.037 7 97.9±2.1 0.073±0.016 9 93.3±1.7 0.067±0.011 2.4 B-Cubs的处方优化
2.4.1 单油酸甘油酯用量的考察
基于优化的B-Cubs最佳制备工艺,按照“2.2.2”项下方法,固定泊洛沙姆407用量为5%,内水相pH为3.0,考察单油酸甘油酯用量(15%、20%、25%、30%、35%)对制得B-Cubs粒径及多分散指数的影响(见表3)。结果表明,随单油酸甘油酯用量的增加,制得的B-Cubs粒径呈先减小后增大趋势,多分散指数则不断降低,当单油酸甘油酯用量为25%时,制得的B-Cubs具有最小的粒径和较适宜的多分散指数,故确定单油酸甘油酯用量为25%。
表 3 单油酸甘油酯用量的考察(n=3)用量(%) 粒径(nm) 多分散指数 15 137.8±3.4 0.160±0.033 20 119.2±2.9 0.147±0.032 25 97.9±2.1 0.073±0.016 30 118.3±3.5 0.024±0.015 35 150.8±5.4 0.026±0.011 2.4.2 泊洛沙姆407用量的考察
基于优化的B-Cubs最佳制备工艺,按照“2.2.2”项下方法,固定单油酸甘油酯用量为25%,内水相pH为3.0,考察泊洛沙姆407用量(3%、4%、5%、6%、7%)对制得B-Cubs粒径及多分散指数的影响(见表4)。结果表明,制得的B-Cubs粒径随泊洛沙姆407用量的增加逐渐降低,多分散指数变化无明显规律,但均较小(<0.1);当泊洛沙姆407用量≥5%时,粒径变化幅度降低,故确定泊洛沙姆407用量为5%。
表 4 泊洛沙姆407用量的考察(n=3)用量(%) 粒径(nm) 多分散指数 3 143.6±3.5 0.064±0.019 4 116.7±3.2 0.055±0.015 5 97.9±2.1 0.073±0.016 6 91.3±1.9 0.052±0.015 7 83.2±1.8 0.062±0.021 2.5 PPL-Cubs的包封率影响因素考察
2.5.1 外水相pH值的考察
根据前期盐酸普萘洛尔在不同pH的PBS中溶解度测定结果可知(见表5),盐酸普萘洛尔在pH≥8.5时溶解度显著下降。按照“2.2.2”项下方法,制备内水相pH为3.0的B-Cubs,并按载体/药物比(以单油酸甘油酯/盐酸普萘洛尔计)为6∶1的比例与B-Cubs和盐酸普萘洛尔水溶液进行混合,以10%氢氧化钠溶液分别调节外水相pH至7.5、8.0、8.5、9.0,于20 ℃水浴(载药温度)下600 r/min磁力搅拌15 min(载药时间),制得PPL-Cubs中药物浓度为1%,测定对包封率等参数影响(见表6)。结果表明,PPL-Cubs的包封率随外水相pH值的提高逐渐增加,当外水相pH值≥8.5时,包封率增加趋势渐小;外水相pH值对PPL-Cubs的粒径和多分散指数无明显影响。
表 5 盐酸普萘洛尔在不同pH PBS中的溶解度(n=3)pH 溶解度(mg/ml) 4.5 53.50±4.22 5.5 51.70±2.34 6.5 52.60±1.53 7.5 49.80±2.14 8.5 8.50±1.15 9.5 1.41±0.33 10.5 0.87±0.08 表 6 外水相pH值的考察(n=3)pH EE(%) 粒径(nm) 多分散指数 7.5 71.29±2.58 96.8±2.6 0.063±0.012 8.0 86.24±1.05 97.5±2.3 0.054±0.006 8.5 92.55±1.27 96.3±1.9 0.045±0.005 9.0 94.58±1.57 97.6±1.7 0.051±0.006 2.5.2 内水相pH值的考察
按照“2.5.1”项下方法,固定外水相pH为8.5时,分别考察内水相pH(3.0、4.0、5.0、6.0)对制得PPL-Cubs包封率等参数的影响(见表7)。结果表明,不同内水相pH的B-Cubs对制得的PPL-Cubs包封率无明显差异,对PPL-Cubs的粒径和多分散指数亦无明显影响。
表 7 内水相pH值的考察(n=3)pH EE(%) 粒径(nm) 多分散指数 3.0 92.55±1.27 96.3±1.9 0.045±0.005 4.0 91.85±1.05 97.5±2.3 0.054±0.006 5.0 91.62±1.27 96.3±1.9 0.045±0.005 6.0 89.33±1.57 97.6±1.7 0.051±0.006 2.5.3 载体/药物的考察
按照“2.5.1”项下方法,固定外水相pH为8.5时,分别考察载体/药物(5∶1、6∶1、7∶1、8∶1)对制得PPL-Cubs包封率等参数的影响(见表8)。结果表明,当载体/药物≥6时,PPL-Cubs的包封率不再增加;载体/药物比值对PPL-Cubs的粒径和多分散指数无明显影响。
表 8 载体/药物的考察(n=3)载体/药物 EE(%) 粒径(nm) 多分散指数 5∶1 90.93±1.52 98.5±2.7 0.076±0.015 6∶1 92.55±1.27 96.3±1.9 0.045±0.005 7∶1 92.06±2.37 97.5±2.1 0.077±0.015 8∶1 92.41±2.58 98.1±2.4 0.102±0.025 2.5.4 载药温度的考察
按照“2.5.1”项下方法,固定外水相pH为8.5时,分别考察载药温度(20、30、40、50 ℃)对制得PPL-Cubs包封率等参数的影响(见表9)。结果表明,载药温度对PPL-Cubs的包封率、粒径和多分散指数无明显影响。
表 9 载药温度的考察(n=3)载药温度(℃) EE(%) 粒径(nm) 多分散指数 20 92.55±1.27 96.3±1.9 0.045±0.005 30 91.05±1.95 96.9±2.3 0.068±0.021 40 91.38±2.08 97.1±2.6 0.066±0.012 50 90.55±1.75 97.2±2.1 0.053±0.018 2.5.5 载药时间的考察
按照“2.5.1”项下方法,固定外水相pH为8.5时,分别考察载药时间(15、30、45、60 min)对制得PPL-Cubs包封率等参数的影响(见表10)。结果表明,载药时间对PPL-Cubs的粒径和多分散指数无明显影响。
表 10 载药时间的考察(n=3)载药时间(min) EE(%) 粒径(nm) 多分散指数 15 92.55±1.27 96.3±1.9 0.045±0.005 30 92.09±1.54 97.2±2.4 0.071±0.013 45 92.01±2.01 97.5±1.6 0.065±0.024 60 91.86±1.86 98.1±1.9 0.075±0.026 2.5.6 B-Cubs粒径和多分散指数的考察
通过调整高压均质压力,制备不同粒径B-Cubs。按照“2.5.1”项下方法,固定外水相pH为8.5,分别考察B-Cubs粒径和多分散指数对制得PPL-Cubs包封率等参数的影响(见表11)。结果表明,B-Cubs的粒径和多分散指数不影响所制得PPL-Cubs的包封率,但B-Cubs的粒径和多分散指数基本决定了制得PPL-Cubs的粒径和多分散指数。
表 11 B-Cubs粒径和多分散指数的考察(n=3)载体 EE(%) PPL-Cubs 粒径(nm) 多分散指数 粒径(nm) 多分散指数 97.9±2.1 0.073±0.016 92.55±1.27 96.3±1.9 0.045±0.005 129.2±3.8 0.140±0.037 91.87±1.96 128.5±2.1 0.123±0.021 160.4±4.6 0.173±0.052 91.85±2.13 158.2±2.8 0.152±0.037 210.5±5.9 0.182±0.057 91.25±2.53 209.2±2.9 0.174±0.045 2.5.7 PPL-Cubs药物浓度的考察
按照“2.5.1”项下方法,固定外水相pH为8.5,分别考察药物浓度(0.1%、0.5%、1.0%、2.0%、3.0%)对制得PPL-Cubs包封率等参数的影响(见表12)。结果表明,随着PPL-Cubs中药物浓度的提高,包封率呈逐渐增加趋势,当药物浓度≥1%时,包封率增加趋势变慢。
表 12 PPL-Cubs中药物浓度的考察(n=3)浓度 EE(%) 粒径(nm) 多分散指数 0.1 51.83±3.17 97.2±2.4 0.057±0.013 0.5 81.87±2.12 96.3±2.1 0.062±0.012 1.0 92.55±1.27 96.3±1.9 0.045±0.005 2.0 94.42±1.37 96.3±1.9 0.045±0.005 3.0 95.87±1.28 97.8±2.5 0.042±0.007 2.6 pH梯度法制备PPL-Cubs的最优处方及制备工艺
精密称取单油酸甘油酯25.0 g,40 ℃水浴加热使融化,为A相;精密称取泊洛沙姆407 5.0 g,加入70 g纯化水,40 ℃水浴加热使溶解,并用1%磷酸溶液调节pH至3.0,为B相;于40 ℃水浴及600 r/min搅拌速度下,将A相缓慢滴加到B相中,待磁力搅拌30 min后,再在900 bar下高压均质7次,得B-Cubs。取盐酸普萘洛尔1 g,溶解于适量纯化水中,得盐酸普萘洛尔水溶液;将盐酸普萘洛尔水溶液加入24 g B-Cubs中,搅拌均匀,用10%氢氧化钠溶液调节pH至8.5,于20 ℃水浴持续搅拌15 min,再放置至室温,即得PPL-Cubs
3. 讨论
立方液晶纳米粒常用的制备方法包括注入法、熔融-分散法、热处理法、喷雾干燥法等[6]。试验前期以粒径、包封率等为评价指标筛选了最佳制备方法为注入法,并优化了其最佳处方制备工艺,结果制得的载药立方液晶纳米粒包封率较低(约50%)[7]。立方液晶是两亲性脂质分子分散在过量水中形成的含双连续水区和闭合脂质双分子层的蜂窝状液晶结构;水溶性分子被包封于立方液晶水道中,脂溶性分子被包封于脂质双层膜中,两亲性分子则贯穿其中。盐酸普萘洛尔在酸性环境下具有较高的溶解性,常规方法制得的盐酸普萘洛尔立方液晶纳米粒pH约为3.5,如何让其具有进入立方液晶载体内相的“动力”是提高载药立方液晶纳米粒包封率的关键。因此,本研究引入“pH梯度法”,通过创造高溶解度内环境(低pH值内水相)和低溶解度外环境(高pH值外水相),给盐酸普萘洛尔提供进入立方液晶载体内相的“动力”。离子化的盐酸普萘洛尔在调节pH的过程中逐渐变为分子形态的普萘洛尔而进入脂质区,脂质区的普萘洛尔分子接触内水相酸性环境而被离子化,内水相中离子化的盐酸普萘洛尔无法再通过脂质区而被捕获于内水相。结果表明,pH梯度法显著提高了PPL-Cubs的包封率,包封率达到90%。
-
表 1 河豚毒素加样回收率试验结果(n=3)
加入量(μg/ml) 测得量(μg/ml) 回收率(%) RSD(%) 2 1.96 1.98 1.99 98.88±0.82 0.83 10 10.04 9.96 10.00 100.00±0.43 0.43 20 20.04 20.18 20.08 100.49±0.37 0.37 -
[1] LEE C H, RUBEN P C. Interaction between voltage-gated sodium channels and the neurotoxin, tetrodotoxin[J]. Channels,2008,2(6):407-412. doi: 10.4161/chan.2.6.7429 [2] GONZÁLEZ-CANO R, RUIZ-CANTERO M C, SANTOS-CABALLERO M, et al. Tetrodotoxin, a potential drug for neuropathic and cancer pain relief? Toxins,2021,13(7):483. doi: 10.3390/toxins13070483 [3] HAGEN N A, CANTIN L, CONSTANT J, et al. Tetrodotoxin for moderate to severe cancer-related pain: a multicentre, randomized, double-blind, placebo-controlled, parallel-design trial[J]. Pain Res Manag,2017,2017:7212713. [4] 陈学军, 王陈, 石童, 等. TTX和吗啡对醋酸扭体小鼠联合镇痛效应的研究[C]//中国毒理学会第九次全国毒理学大会论文集. 太原, 2019: 13. [5] 邓兴朝, 陈欢, 陈静, 等. 河豚毒素对敏感性钠离子通道的作用及其与疼痛的关系[J]. 生物化工, 2019, 5(1):127-131. doi: 10.3969/j.issn.2096-0387.2019.01.037 [6] MARGAUX M, Salas. Tetrodotoxin suppresses thermal hyperalgesia and mechanical allodynia in a rat full thickness thermal injury pain model[J]. Neurosci Lett,2015,607:108-113. doi: 10.1016/j.neulet.2015.09.031 [7] 纪元, 刘岩, 宫庆礼. 小鼠生物法和酶联免疫法(ELISA)定量监测沿海5省养殖河豚鱼中的河豚毒素(TTX)[J]. 水产学报, 2010, 34(4):589-597. [8] HONG H J, LY S Y. Voltammetric detection of tetrodotoxin real-time in vivo of mouse organs using DNA-immobilized carbon nanotube sensors[J]. Curr Anal Chem,2019,15(5):567-574. doi: 10.2174/1573411014666180510145320 [9] A E, Vlasenko. Development of a polyclonal antibody-based indirect competitive ELISA for the determination of tetrodotoxins in marine ribbon worms (NEMERTEA) and its comparison with high performance liquid chromatography-tandem mass spectrometry[J]. Toxicon,2020,176:30-33. doi: 10.1016/j.toxicon.2020.01.009 [10] THUY L V, YAMAMOTO S, KAWAURA R, et al. Tissue distribution of tetrodotoxin and its analogs in Lagocephalus pufferfish collected in Vietnam[J]. Fish Sci,2020,86(6):1101-1110. doi: 10.1007/s12562-020-01460-y [11] REVERTÉ L, DE LA IGLESIA P, DEL RÍO V, et al. Detection of tetrodotoxins in puffer fish by a self-assembled monolayer-based immunoassay and comparison with surface plasmon resonance, LC-MS/MS, and mouse bioassay[J]. Anal Chem,2015,87(21):10839-10847. doi: 10.1021/acs.analchem.5b02158 [12] YU C H, YU C F, TAM S, et al. Rapid screening of tetrodotoxin in urine and plasma of patients with puffer fish poisoning by HPLC with creatinine correction[J]. Food Addit Contam A,2010,27(1):89-96. doi: 10.1080/02652030903207250 [13] LIN S J, LIAO C J, CHEN S K, et al. Survey on toxicity and label of dried dressed fish fillet in 1998[J]. J Food Drug Anal,2020,10(1):48-51. [14] 杨邦忠, 廖建萌, 章超桦, 等. 液相色谱-串联质谱法测定河豚毒素方法建立[J]. 科技展望, 2015, 25(15):102-104. [15] BANE V, HUTCHINSON S, SHEEHAN A, et al. LC-MS/MS method for the determination of tetrodotoxin (TTX) on a triple quadruple mass spectrometer[J]. Food Addit Contam Part A Chem Anal Control Expo Risk Assess,2016,33(11):1728-1740. doi: 10.1080/19440049.2016.1235801 [16] PATRIA F P, PEKAR H, ZUBEROVIC-MURATOVIC A. Multi-toxin quantitative analysis of paralytic shellfish toxins and tetrodotoxins in bivalve mollusks with ultra-performance hydrophilic interaction LC-MS/MS-an In-house validation study[J]. Toxins,2020,12(7):452. doi: 10.3390/toxins12070452 [17] INDUMATHI S M, KHORA S S. Toxicity assessment and screening of tetrodotoxin in the oblong blowfish (Takifugu oblongus) from the Tamil Nadu Coast of Bay of Bengal, India[J]. Asian Pac J Trop Med,2017,10(3):278-284. doi: 10.1016/j.apjtm.2017.03.007 [18] 龚玺. 养殖河豚鱼肉营养品质研究[D]. 上海: 上海海洋大学, 2011. [19] 陈唯真, 朱维华, 俞如英. HPLC法测定河豚毒素的含量及稳定性[J]. 药物分析杂志, 2004, 24(1):41-43. doi: 10.16155/j.0254-1793.2004.01.020 期刊类型引用(3)
1. 张远达, 陈志强, 尚静雪, 蔡小利, 战文, 张鹏举, 付丽云, 李海华. 中兽药乌梅颗粒质量标准的研究. 中国兽药杂志. 2019(10): 27-32 .  百度学术
百度学术2. 潘杰, 甘杰华, 郑晓英, 张辉, 严萍, 詹若挺. 蜜远志配方颗粒质量标准的研究. 中成药. 2017(04): 751-755 .  百度学术
百度学术3. 陈红林, 杨捡美, 汪兰, 夏新华, 黄本东, 肖利辉, 胡波, 谭桂林. 高效液相色谱技术在中药配方颗粒质量控制中应用现状. 中国中医药信息杂志. 2016(12): 133-136 .  百度学术
百度学术其他类型引用(2)
-





 下载:
下载:
 下载:
下载: