-
癫痫是一种慢性脑部疾病,其特征是具有持久性产生癫痫发作倾向,可在各年龄段发病。其中儿童(18岁以下)占全部患者的60%以上,婴儿期的发病率为109/10万[1,2]。癫痫病不仅对儿童的认知、行为产生影响,更对家庭产生了极大的影响[3,4]。癫痫的治疗方法有抗癫痫药、神经调控、手术和生酮饮食,其中最主要的治疗方法是抗癫痫药物(antiepileptic drugs, AEDs)[5]。丙戊酸钠和左乙拉西坦是临床上两种常用药物。丙戊酸钠是传统抗癫痫药物,对很多种类型的癫痫病有良好的治疗效果,临床应用较为广泛。但同时也有一定的副作用。左乙拉西坦是一种新型的抗癫痫药物,该药耐受性较好、安全性高,可以迅速稳定血药浓度[6]。目前很多学者对丙戊酸钠和左乙拉西坦进行了效果研究,比较二者的有效性和安全性,但是评价不一。本文基于已有的临床研究数据[7],通过决策树模型对丙戊酸钠和左乙拉西坦治疗儿童癫痫进行药物经济学评价。
-
原发性癫痫患儿,年龄5~14岁,发育正常,出诊治疗,符合《新诊断儿童癫痫的初始单药治疗专家共识》[8]中,用丙戊酸钠和左乙拉西坦一线单药治疗的原发性癫痫病患儿。将100名受试者随机分为对照组和试验组,每组各50人。
-
对照组:丙戊酸钠缓释片[赛诺菲(杭州)制药有限公司,规格0.5 g/片],儿童常规剂量为每日30 mg/kg。疗程为6个月。试验组:左乙拉西坦片(浙江京新药业股份有限公司,规格0.25 g/片),起始治疗量为500 mg/次,每日2次。根据临床疗效及耐受性,每日剂量可增至每次1 500 mg,每日2次。剂量的变化应每2~4周增加或减少500 mg/次,每日2次。疗程为6个月。
-
本研究采用医疗保障系统角度开展。采用决策树模型对两种干预措施治疗儿童癫痫病进行成本-效果分析[9]。模型一次模拟时间为6个月(180 d),主要评价两种干预措施的模拟时间内的药物经济学。
-
监测6个月(180 d)后的血药浓度,并根据疾病发作频率进行治疗效果评估。评估标准:
完全控制:治疗期间癫痫未发作;
显效:治疗期间癫痫发作频率相比治疗前减少≥75%;
好转:治疗期间癫痫发作频率相比治疗前减少50%~75%;
无效:治疗期间癫痫发作频率相比治疗前减少<50%。
总有效率=(完全控制+显效+好转)病例数/总病例数×100%。
-
有效率的数据来源于2022年一篇两种药物的效果比较文章[7],见表1。
表 1 丙戊酸钠和左乙拉西坦治疗儿童癫痫病的有效率
干预措施 有效率 标准误 丙戊酸钠 0.82 0.054 左乙拉西坦 0.96 0.028 -
根据文献,本研究两组药物安全性较好,不良反应发生率差异无统计学意义[7],因此,本研究未纳入不良反应衍生成本。由于本研究的研究角度为医疗保健系统角度,为简化研究,本研究仅计算药品成本。药品价格以药智网2023年和2024年中标价为基础,以各地中标价的中位数进行基础分析,最高中标价和最低中标价进行敏感性分析。模拟时间为6个月(180 d),成本和效果周期小于1年,根据指南规定,不考虑贴现[10]。由于药品使用量涉及患者体重,故根据《中国居民营养与慢性病状况报告(2015年)》[11]中5~14岁儿童平均体重,拟合估算本研究儿童平均体重,用以模拟6个月(180 d)用药总成本,见表2。
表 2 丙戊酸钠和左乙拉西坦药品成本信息
指标 基础值 最低价 最高价 丙戊酸钠缓释片单价(元/片) 2.01 1.61 2.01 丙戊酸钠缓释片6个月总费用(元) 723.6 554.4 723.6 左乙拉西坦片单价(元/片) 1.47 1.30 2.39 左乙拉西坦片6个月总费用(元) 1 931.58 6 992.19 17 291.44 -
本研究的分析方法为成本-效果研究,以增量成本-效果比(ICER)为决策指标。参数变动对结果的影响程度采用单因素敏感性分析,对基础分析结果的稳健性进行验证。概率敏感性分析采用蒙脱卡洛模型(MCS),模拟1 000次绘制成本效果可接受曲线(CEAC),判断试验组药物经济学的优劣概率。分析软件采用Microsoft Excel for Mac(V16.30)。
-
左乙拉西坦和丙戊酸钠比较的ICER值为8 628.43元,即使用左乙拉西坦治疗儿童癫痫病时1个疗程每增加1例有效患者需多花费8 628.43元。因缺乏阈值,所以当支付意愿>8 268.43元时,试验组(左乙拉西坦片)干预方案在治疗儿童癫痫时的经济性优于对照组(丙戊酸钠缓释片),见表3。
表 3 丙戊酸钠和左乙拉西坦的成本-效果比较
治疗药品 成本(元) 效果 增量成本(元) 增量效果 ICER(元) 丙戊酸钠 723.60 0.82 — — — 左乙拉西坦 1 931.58 0.96 1 207.98 0.14 8 628.43 注:“—”表示此项无内容。 -
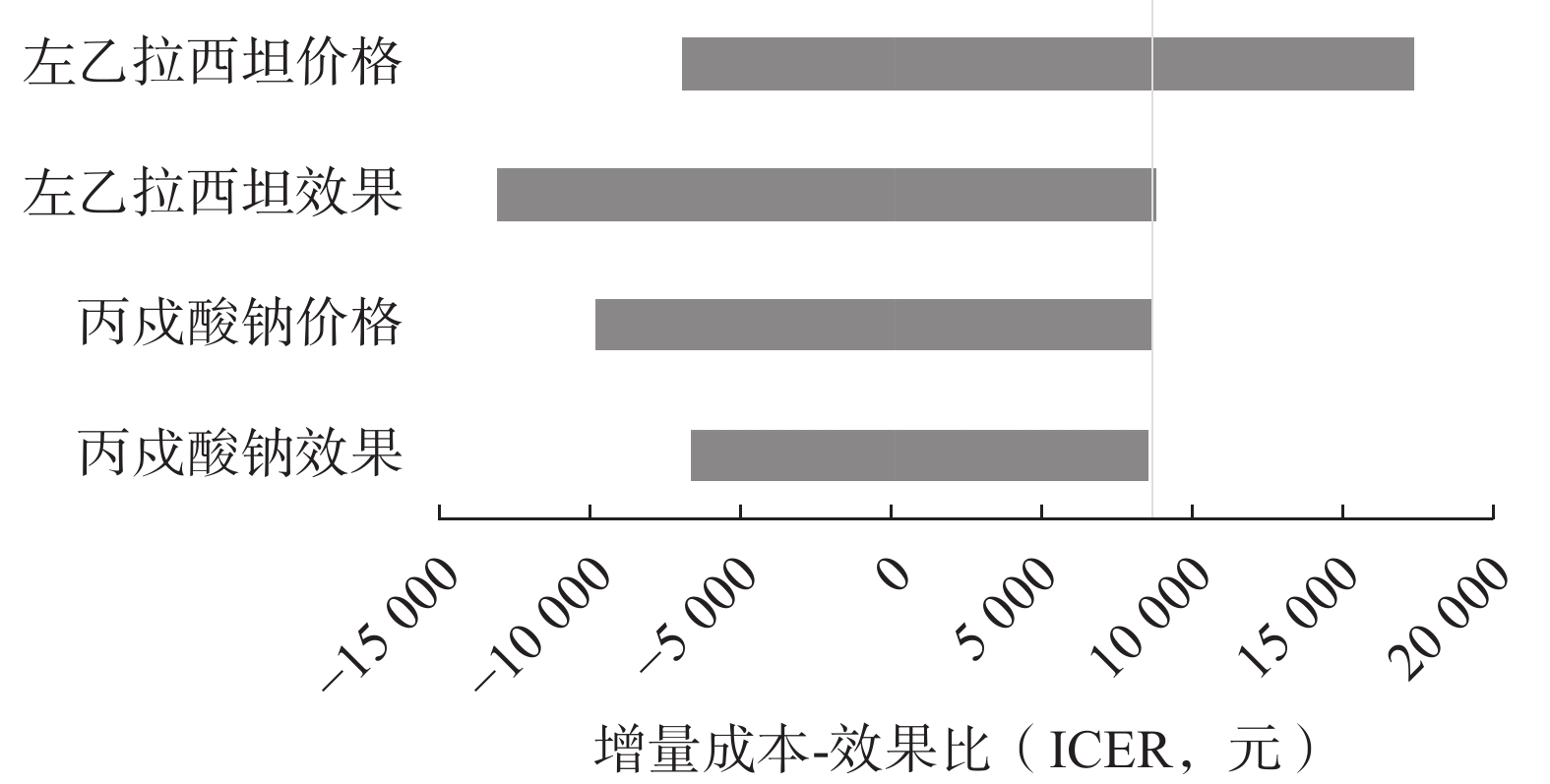
单因素敏感性分析药品价格基础值为各地中标价的中位数,最高价和最低价为最大值和最小值。经过药物经济学专家的指导和查阅相关文献成果[12-13],效果的上下限分别设为有效率的±3%,单因素敏感性分析结果见表4。图1展示了单因素敏感性分析的结果,基准增量成本效果比(ICER)为8 628.43元,旋风图清楚地展示了不同因素对ICER的影响范围。从图中可以看出,左乙拉西坦的价格对ICER的影响最大,价格上涨会导致ICER显著增加,表明药品定价是影响治疗经济性的重要因素。相比之下,丙戊酸钠效果的变化对ICER的影响较小,表明效果因素对经济学评估结果的敏感性较弱。该结果提示,未来在制定药物定价政策时,应优先考虑药品价格的合理调整,以确保治疗的经济性不受过大影响。
表 4 单因素敏感性分析参数范围
参数 基础值 下限 上限 戊丙酸钠价格(元) 2.01 1.61 2.01 左乙拉西坦价格(元) 1.47 1.30 2.39 戊丙酸钠效果 0.82 0.80 0.84 左乙拉西坦效果 0.96 0.93 0.99 -
假设两种干预措施药品价格服从Gamma分布,有效率服从Beta分布,根据表1和表2数据计算相关参数,见表5和表6。
表 5 成本分布
治疗药品 分布 参数 价格(元) 标准误 α β 戊丙酸钠 Gamma 2.01 0.043 3 2 153.213 3 0.000 9 左乙拉西坦 Gamma 1.47 0.070 1 437.267 8 0.003 3 表 6 有效率分布
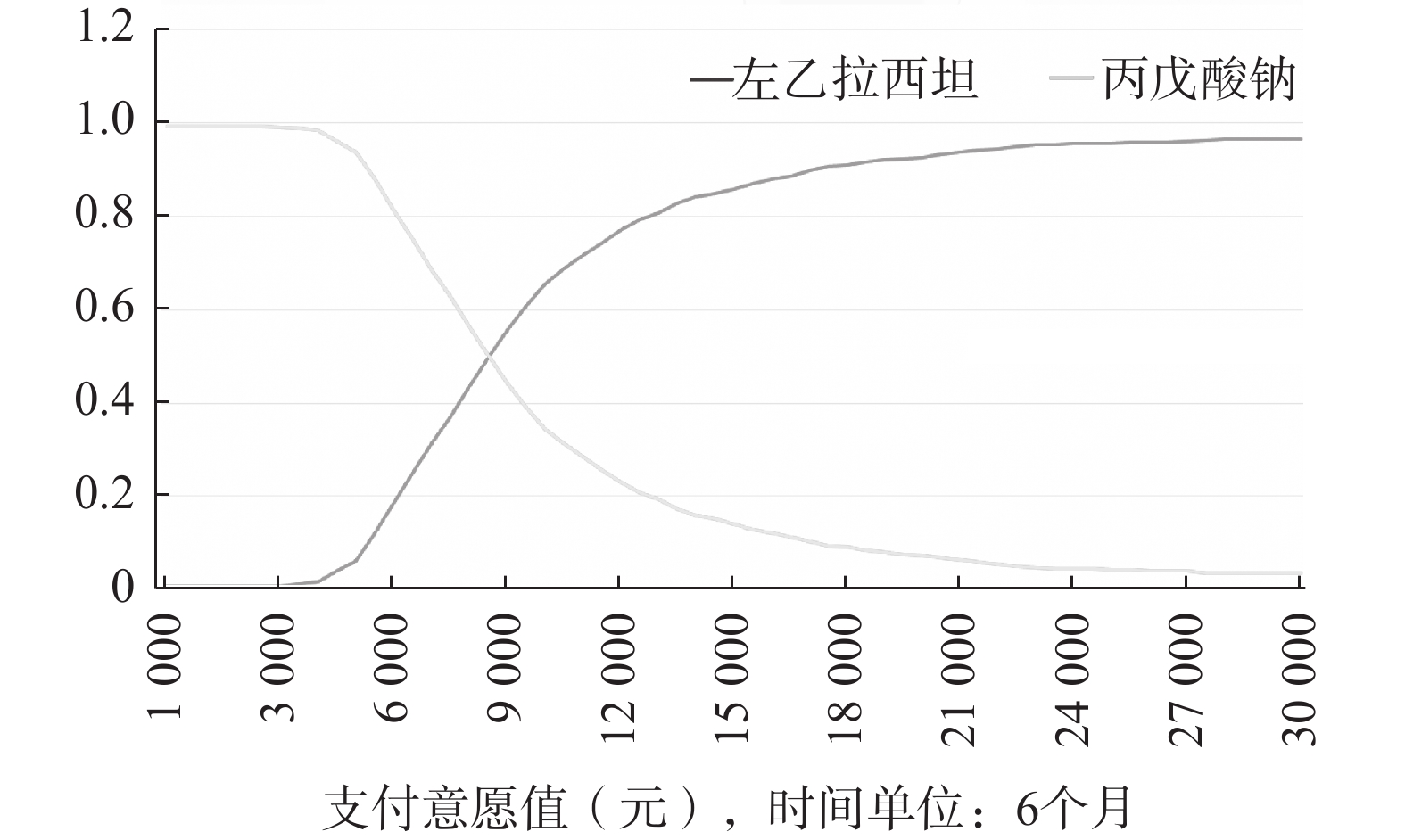
治疗药品 分布 参数 有效率 标准误 α β 戊丙酸钠 Beta 0.82 0.054 3 40.18 8.82 左乙拉西坦 Beta 0.96 0.027 7 47.04 1.96 通过运行蒙脱卡洛模型1 000次,绘制成本效果可接受曲线(CEAC),横轴代表支付意愿值,纵轴代表方案占优概率,见图2。
在治疗周期为6个月的情况下,每治疗一例儿童癫痫患者的支付意愿值不断增大,左乙拉西坦成为更经济的方案的概率不断增加,当支付意愿值为9 000时,左乙拉西坦的概率为46%左右。所以,在治疗周期为6个月的情况下,当支付意愿值<9 000时,丙戊酸钠治疗方案更具经济学优势,当支付意愿值>9 000时,左乙拉西坦更具经济学优势。
-
癫痫是神经系统中常见的疾病之一,在我国约900万癫痫患者中,70%~80%为儿童癫痫[14]。丙戊酸钠和左乙拉西坦是常用的治疗药物,临床证据表明,两者在短期疗效(1~3个月)上相当,但左乙拉西坦在长期疗效(6个月)以及消化系统安全性方面具有优势[7]。然而,关于这两种药物的经济学评价较为有限,通常只涉及基础性分析。本研究的成本-效果基础分析显示,左乙拉西坦相较于丙戊酸钠的ICER为8 628.43元。目前,国内尚无儿童癫痫治疗中的统一支付意愿标准,因此在临床治疗过程中,医生可根据患者的支付能力来进行判断。在治疗周期为6个月的情况下,当每个疗程的支付意愿值低于9 000元时,可优先选择丙戊酸钠;当支付意愿值超过9 000元时,则左乙拉西坦更为优先。
-
尽管本研究表明,左乙拉西坦在长期疗效和安全性方面相较于丙戊酸钠具有一定的优势,但实际的治疗效果也受到多个因素的影响。丙戊酸钠常被用于控制儿童癫痫的急性发作,但长期使用可能引起体重增加、肝功能异常等副作用[7]。相比之下,左乙拉西坦在消化系统的安全性上表现更佳,尤其适用于对丙戊酸钠耐受性差的患者。然而,丙戊酸钠作为广泛应用的传统药物,临床经验丰富,药物的疗效和副作用管理机制相对成熟,因此在一些情况下,依然是治疗儿童癫痫的首选药物。未来的临床研究可以进一步探讨丙戊酸钠与左乙拉西坦在不同类型癫痫(如局灶性癫痫、全身性癫痫等)中的疗效差异,尤其是在不同年龄段和临床背景下,药物的疗效与安全性如何变化。这不仅能帮助临床医生更好地选择药物,也有助于提升治疗的个体化水平。
-
由于左乙拉西坦已经纳入医保目录,患者的经济负担得到一定程度的减轻,尤其是在长期治疗过程中,这为患者提供了更大的治疗选择空间。医保目录的纳入,使得左乙拉西坦在治疗儿童癫痫中的可及性和普及度大大提高,尤其是在经济水平较低的地区,药物的可负担性得到了改善。相较于丙戊酸钠,虽然两者的价格差异依然存在,但医保报销政策的支持可以有效降低患者的实际支付负担。随着医保政策的进一步完善,左乙拉西坦的使用在临床治疗中的普及可能会进一步提高,从而影响医生和患者在选择药物时的决策。尤其是在治疗需要长期管理的儿童癫痫时,左乙拉西坦的疗效与安全性优势使其成为优选方案之一。而丙戊酸钠作为一种较为传统且经济的药物,依然在一些经济条件较差的地区或患者群体中占据一定市场份额。值得注意的是,医保目录的覆盖不仅有助于患者支付能力的改善,还能促使医疗资源的合理配置。在不同地区和不同经济水平的患者中,医保政策的差异可能仍然对药物的使用产生影响。因此,未来的政策调整和药品价格谈判将对药物的使用及成本效益比产生深远影响。
-
本研究存在一定的局限性,首先,在成本分析中,我们简化了治疗方案的成本,仅考虑了药品直接费用,而未考虑患者长期的疾病转归状态、就医频次、辅助治疗等相关费用。未来的研究应在成本评估中更加全面地考虑所有相关费用,特别是患者长期治疗过程中可能产生的附加成本。只有综合考虑药物成本、医疗资源消耗和患者长期健康状况,才能获得更为精确的经济性评价。其次,关于两种药物的长期经济性评价,当前的证据仍需通过更高质量的临床研究与长期数据支持进一步验证。例如,药物治疗的长期效果,如发作控制率、患者的生活质量以及药物副作用的长期影响等,均应纳入成本效益分析的考量范围。此外,在特定患者群体中的疗效差异(如儿童不同年龄段、合并症患者等)也应在未来研究中得到进一步探索。
-
尽管本研究提供了从经济学角度的治疗选择参考,但在实际临床应用中,药物的选择应综合考虑患者的个体情况、治疗的可达性、以及患者和家庭的支付能力。癫痫作为一种长期管理的疾病,治疗决策不仅涉及药物的短期和长期疗效,还应充分考虑患者的生活质量、药物的副作用和患者的社会经济背景。特别是在儿童患者中,个体化治疗尤为重要。医生应与患者家庭充分沟通,帮助他们了解不同治疗方案的利弊,并根据患者的具体需求和经济状况做出最适合的治疗选择。
本研究从经济学角度为决策者提供了儿童癫痫治疗中丙戊酸钠与左乙拉西坦的成本-效果比较,结果表明,左乙拉西坦在某些支付意愿区间内为更优选择。然而,药物选择的决策不仅仅依赖于经济学评价,实际临床中应结合患者的具体情况、药物的长期疗效及副作用、以及政策环境等多方面因素,做出最合适的治疗决策。未来研究应进一步补充长期经济性评价,以完善现有的决策支持框架,帮助优化资源配置,提升儿童癫痫治疗的效果和可及性。
Cost-effectiveness analysis between valproate and levetiracetam in the treatment of childhood epilepsy
-
摘要:
目的 探讨丙戊酸钠和左乙拉西坦在治疗儿童癫痫病中的成本-效果,为临床用药提供经济学依据。 方法 采用成本-效果分析方法,基于决策树模型,比较丙戊酸钠和左乙拉西坦在治疗儿童癫痫病中的有效率与药品成本。通过单因素敏感性分析和概率敏感性分析,评估各参数变动对研究结果的影响。 结果 左乙拉西坦的治疗成本显著高于丙戊酸钠,左乙拉西坦和丙戊酸钠比较的增量成本-效果比(ICER)值为8 628.43元。敏感性分析与基础分析结果相一致,概率敏感性分析结果显示,基于6个月的治疗周期,当支付意愿为9 000元或以上时,左乙拉西坦是更为经济的方案。单因素敏感性分析显示,在影响ICER的各因素中,左乙拉西坦的价格为最敏感因素。 结论 每治疗1例有效的儿童癫痫患者的支付意愿值在9 000元或以上时,左乙拉西坦更具有经济学优势。 Abstract:Objective To compare the cost-effectiveness between Valproate and Levetiracetam in the treatment of childhood epilepsy and provide an economic basis for clinical medication choices. Methods A cost-effectiveness analysis was conducted using a decision tree model to compare the effectiveness and drug costs of Valproate and Levetiracetam in treating childhood epilepsy. Single-factor sensitivity analysis and probabilistic sensitivity analysis were used to assess the impact of parameter variations on the study results. Results The treatment cost of levetiracetam was significantly higher than that of sodium valproate. The incremental cost-effectiveness ratio (ICER) of levetiracetam compared to sodium valproate was ¥8,628.43. Sensitivity analysis results were consistent with the base-case analysis. The probabilistic sensitivity analysis showed that, over a 6-month treatment period, levetiracetam became a more cost-effective option when the willingness-to-pay (WTP) threshold was ¥9,000 or higher. One-way sensitivity analysis revealed that the price of levetiracetam was the most influential factor affecting the ICER. Conclusion When the WTP per effective pediatric epilepsy case is ¥9,000 or higher, levetiracetam demonstrates a cost-effectiveness advantage. -
Key words:
- valproate /
- levetiracetam /
- childhood epilepsy /
- cost-effectiveness analysis
-
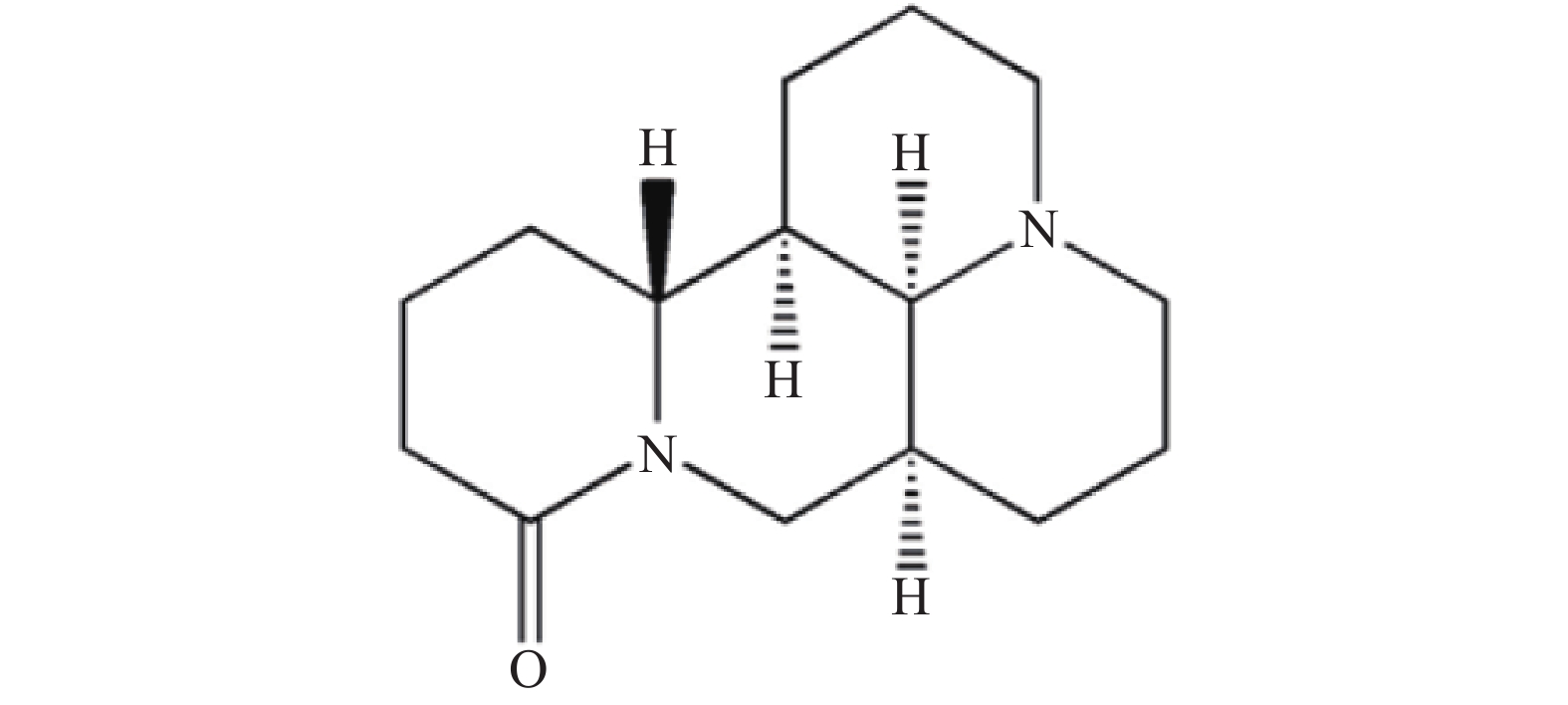
苦参碱(Matrine)是传统中药苦参的主要活性成分[1],是从苦参根中提取的生物碱类化合物,属于喹诺里西啶类生物碱,其化学结构见图1。苦参碱具有广泛的药理活性,包括抗肿瘤、抗病毒、抗纤维化、抗糖尿病、抗心衰、抗血小板和抗动脉粥样硬化等[2-4]。苦参碱存在着生物利用度低、化学稳定性差、生物毒性较高等一系列问题[5-6]。人们通过对苦参碱D环C-13、C-14和C-15位点的修饰,以及使D环的放开或融合等方法[7-9],获得了一系列活性更高、毒性更低的苦参碱衍生物,如硫代苦参碱[10]、13-羟基乙胺苦参碱[11]、13-酰胺基取代苦参碱[12]等。目前,对于苦参碱衍生物的研究多聚焦于抗肿瘤的活性,充分了解并探索其抗炎活性及机制,有助于人们开发苦参碱衍生物在炎症性疾病中的应用。本文将就苦参碱及衍生物的抗炎作用及其机制进行综述,为药物研发及临床应用提供理论支持。
1. 苦参碱及衍生物在各系统疾病中抗炎作用的研究
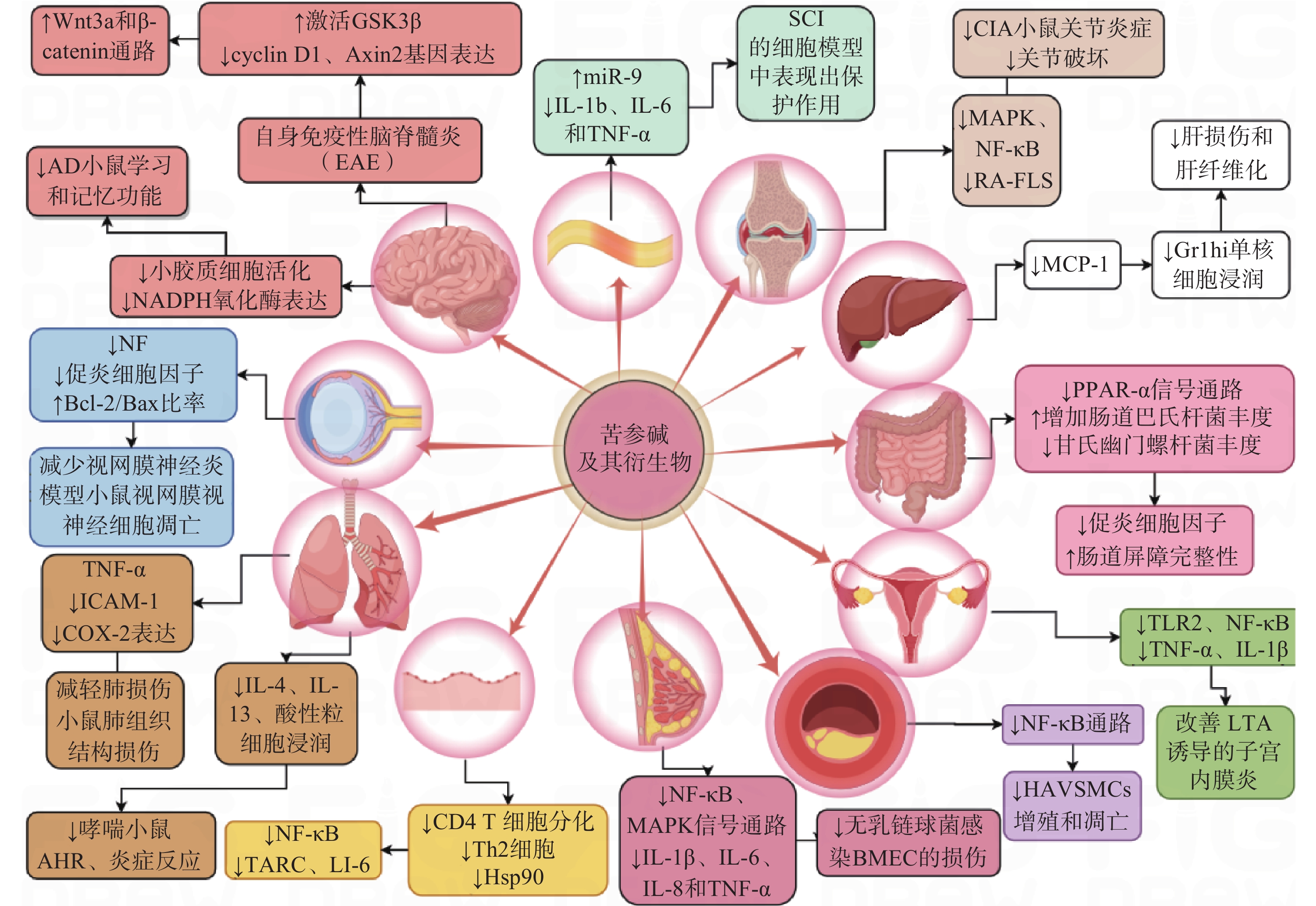
炎症是一种高度受控的过程,它被多种信号通路调控以维持机体的稳态[13]。苦参碱及其衍生物可能通过调节多种细胞信号通路或分子靶标在多系统炎症性疾病中发挥治疗作用(图2)。
1.1 神经系统
苦参碱可以通过抑制髓鞘少突胶质细胞糖蛋白MOG35-55诱导的自身免疫性脑脊髓灰质炎(EAE)小鼠中枢神经中Wnt 家族成员 3A(Wnt3a)和β-连环蛋白(β-catenin)活化,激活糖原合成酶激酶-3β(GSK-3β),降低Wnt3a/β-catenin通路中的两个靶基因G1/S-特异性周期蛋白-D1(cyclin-D1)和Axis抑制蛋白2(Axin2)的表达,促进少突胶质细胞(OL)的成熟和髓鞘修复功能,从而改善多发性硬化症(MS)动物模型的神经功能缺损[14]。苦参碱也可以通过抑制Ⅰ型星形胶质细胞的增殖与浸润,有效减轻中枢神经系统炎症促进神经再生,显著改善EAE 的临床评分[15]。
在阿尔茨海默病(AD)小鼠模型中,科研人员发现苦参碱可以降低海马组织中小胶质细胞的活性氧(ROS)、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)和IL-6水平,显著改善AD模型小鼠的学习和记忆功能[16]。
在脊髓损伤(SCI)的体外实验中,有研究发现苦参碱能够上调miR-9的表达来抑制c-Jun氨基末端激酶(JNK)和核因子κB(NF-κB)通路,并抑制IL-1β、IL-6和TNF-α的释放,保护大鼠肾上腺嗜铬细胞瘤细胞(PC 12)免受脂多糖(LPS)诱导的炎症损伤[17]。
此外,苦参碱还能够通过增加视神经中神经丝蛋白(NFs)的表达,降低Iba1细胞(巨噬细胞/小胶质细胞)数量,上调B淋巴细胞瘤-2(Bcl-2)/BCL2相关X蛋白(Bax)的比率,从而减少炎性浸润、脱髓鞘和视网膜神经节细胞凋亡[18]。
1.2 呼吸系统
有研究表明,苦参碱可以通过抑制急性肺损伤模型中单核细胞趋化蛋白-1(MCP-1)、IL-6和IL-8的表达,改善造模小鼠的肺组织损伤程度[19]。
在卵清蛋白(OVA)诱导的过敏性哮喘小鼠模型中,人们发现苦参碱可以通过抑制嗜酸性粒细胞趋化因子和Th2细胞因子的产生,显著降低哮喘小鼠的嗜酸性粒细胞浸润、减轻气道高反应性和气道炎症[20]。在过敏性哮喘小鼠模型和TNF-α诱导的人气管上皮细胞实验中,苦参碱可以减少IL-4、IL-6、IL-13和粘附分子的表达,抑制模型小鼠上皮细胞中的细胞因子信号传导抑制因子3 (SOCS3)表达,改善OVA诱导引发的气道高反应性、炎症细胞浸润、杯状细胞分化和黏液产生, 减少气管上皮细胞中促炎细胞因子的产生, 达到缓解哮喘症状的效果[21]。
1.3 消化系统
苦参碱可以抑制过氧化物酶增殖物激活受体-α(PPAR-α)信号通路,增加肠道巴氏杆菌的丰度,降低甘氏幽门螺杆菌的丰度[22]。在葡聚糖硫酸钠(DSS)诱导的溃疡性结肠炎小鼠模型中,苦参碱可以显著抑制炎性细胞因子水平,改善肠道屏障的完整性。
苦参碱衍生物能通过抑制MCP-1的产生和活性,减少炎症性Gr1hi单核细胞在肝脏中的浸润,从而明显减轻四氯化碳(CCl4)诱导的急性肝损伤和肝纤维化[23]。
1.4 风湿免疫系统
在胶原诱导的关节炎(CIA)小鼠模型中,人们观察到苦参碱衍生物MASM通过丝裂原活化蛋白激酶(MAPK)和NF-κB通路抑制炎症介质表达,诱导成纤维样滑膜细胞(RA-FLS)的凋亡来减轻CIA小鼠的关节炎严重程度,降低了CIA小鼠的炎症和关节破坏程度[24]。
1.5 循环系统
动脉粥样硬化是一种慢性炎症性疾病,与炎症反应以及血管平滑肌细胞不受控制的增殖和过度凋亡有关。研究发现,苦参碱通过抑制NF-κB通路,降低氧化低密度脂蛋白(oxLDL)诱导的动脉粥样硬化模型中人主动脉血管平滑肌细胞的增殖和凋亡,表现出抗炎作用[25]。
在缺氧性肺动脉高压(HPAH)模型中,炎性细胞因子可浸润肺动脉血管,使肺动脉平滑肌细胞异常增殖,导致肺血管重构。人们发现苦参碱可降低大鼠α平滑肌肌动蛋白和肺动脉介质中增殖细胞核抗原(PCNA)的表达,降低TNF-α和IL-1β水平,将细胞周期延缓在S期,并降低p50、p65、PCNA、Bcl-2的表达,逆转缺氧诱导的肺动脉平滑肌细胞(PASMCs)增殖和凋亡的失衡,降低大鼠右心室收缩压和平均肺动脉压,改善缺氧诱导的肺血管重塑(PVR)[26]。
1.6 其他
苦参碱可以提高小鼠调节性T细胞(Treg)细胞比例,降低CD4+/CD8+比例,减轻移植心脏的炎性细胞浸润,延长心脏移植小鼠的存活时间。更重要的是,苦参碱可以下调NF-κB通路,上调ERK 1/2信号通路,抑制小鼠树突状细胞(DCs)成熟,减少同种异体心脏的氧化损伤和凋亡[27]。
研究发现,在特应性皮炎(AD)小鼠模型和TNF-α/IFN-γ处理的人表皮角质形成细胞(HaCaT)模型中,苦参碱可以减少T淋巴细胞和肥大细胞浸润,抑制CD4+ T细胞分化,调节Th1/Th2炎症反应,抑制Hsp90/NF-κB信号轴来抑制TNF-α/IFN-γ处理的HaCaT细胞炎性因子分泌,从而减轻AD的症状[28]。
无乳链球菌是牛乳腺炎的主要致病菌,在其诱导的乳腺炎体外模型中,可导致牛乳腺上皮细胞 (BMEC)细胞凋亡,研究发现,苦参碱可以抑制NF-κB和MAPK信号通路,显著下调IL-1β、IL-6、IL-8和TNF-α等促炎细胞因子的产生并预防BMEC细胞损伤[29]。
在金黄色葡萄球菌脂磷壁酸(LTA)诱导的小鼠子宫内膜炎模型中,苦参碱可以抑制Toll样受体2(TLR2)的表达及其下游NF-κB的活化,降低TNF-α和IL-1β的表达,发挥对子宫内膜细胞的保护作用[30]。在临床试验中,应用苦参碱治疗慢性盆腔炎,苦参碱组患者的血清TNF-α、IL-1β和IL-6水平显著低于对照组,苦参碱组疗效明显优于对照组[31]。
2. 苦参碱及衍生物的抗炎作用机制
2.1 对炎症细胞的调节作用
在肽聚糖、脂蛋白等因子的刺激作用下,巨噬细胞发生极化并表现出两种主要表型M1和M2。其中,M1型巨噬细胞产生炎性细胞因子,M2型巨噬细胞则参与炎症的消退和修复[3]。研究表明,苦参碱可以抑制M1巨噬细胞侵袭与浸润,促进M1型巨噬细胞向M2型转化,降低M1/M2的比例,发挥抗炎作用[32]。
中性粒细胞是炎症反应的重要调节剂,它能够表达和产生多种细胞因子参与炎症过程,如IL-1β、IL-6和IL-17等。这些细胞因子在疾病的炎症反应中发挥重要作用。有研究表明,在香烟烟雾暴露诱导的肺炎小鼠模型中,苦参碱能够显著降低其支气管肺泡灌洗液 (BALF) 中嗜中性粒细胞数量,减轻肺部炎症和损伤。进一步研究发现, 苦参碱不是参与抑制中性粒细胞相关的细胞因子及趋化因子, 而是通过诱导中性粒细胞凋亡来起到调节炎症反应的作用[33]。 此外, 苦参碱也可以通过抑制细胞间黏附分子-1(ICAM-1)、 血管细胞粘附分子-1(VCAM-1)来减少中性粒细胞与病变组织的黏附改善炎症反应[34]。
2.2 炎症相关信号通路的影响
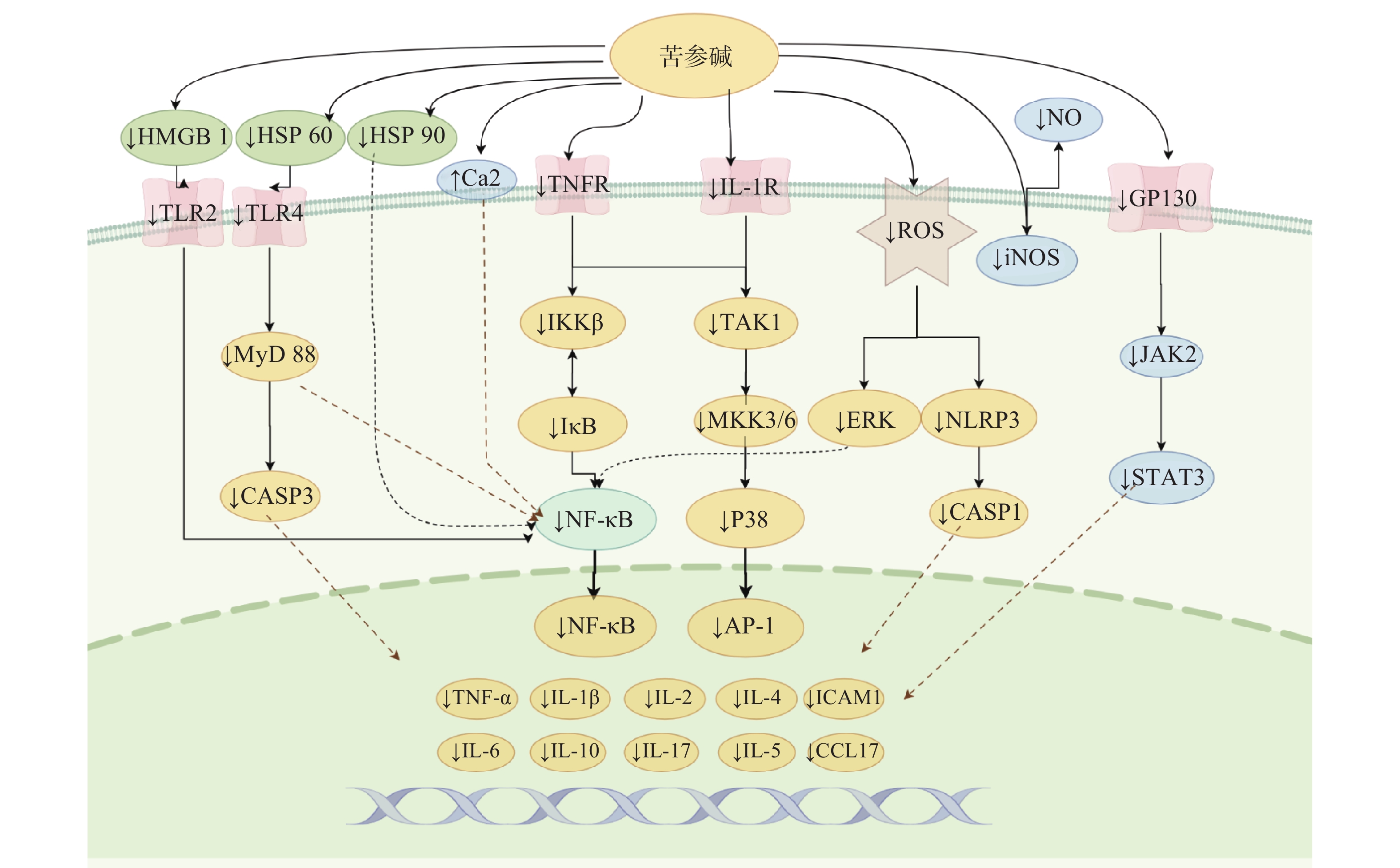
苦参碱及衍生物可以抑制包括NF-κB、JAK2/STAT3、MKK/p38 MAPK信号通路在内的多种炎症信号通路的激活,从而减少炎症因子的分泌,起到抗炎的效果,这也是苦参碱及衍生物发挥抗炎作用的最主要机制。其对各通路的影响汇总并阐述如下(图3)。
2.2.1 一氧化氮信号通路
一氧化氮(NO)是人体内重要的调节分子,诱导型一氧化氮合酶(iNOS)是产生NO的上游调节因子。多种炎症刺激可触发iNOS产生NO,并引发炎症反应。有研究表明,在LPS刺激的RAW 264.7细胞中,氧化苦参碱可以显著抑制iNOS的过表达,从而减少NO水平[35]。
2.2.2 NF-κB信号通路
NF-κB通路在许多生物过程的调节中起着至关重要的作用,是一种典型的促炎症信号通路,与炎症因子TNF和IL的分泌密切相关[27]。苦参碱可以通过刺激上调钙敏感受体的表达,来抑制NF-κB信号通路的激活,从而保护肠脏器并恢复肠屏障的完整性[36]。
氧化苦参碱能够抑制NF-κB和MAPKs信号通路,显著减轻LPS诱导的乳腺损伤[37];苦参碱可以上调miRNA-9的表达,通过抑制JNK和NF-κB通路,从而改善LPS诱导的PC 12细胞炎症损伤,减轻小鼠脊髓损伤的继发性损伤[17]。苦参碱通过NF-κB通路减弱HAVSMCs中的异常生物反应,减少oxLDL诱导的血管平滑肌细胞异常增殖和过度凋亡,表现出抗炎作用[25]。苦参碱衍生物MASM可显著减轻LPS诱导的小鼠腹腔巨噬细胞和RAW264.7细胞中NF-κB通路的激活,减少了TNF-α、IL-6和NO/iNOS的释放[38]。苦参碱也可以通过抑制NF-κB和MAPK途径的活化,抑制LPS刺激的人肺上皮A549细胞中环氧合酶-2(COX-2)和ICAM-1的转录和表达[19]。
2.2.3 JAK2/STAT3信号通路
JAK2/STAT3通路的异常激活与一些炎性疾病的进展密切相关,包括关节炎、肝炎、肾炎和溃疡性结肠炎等。苦参碱可阻断JAK2/STAT3信号通路,抑制DSS诱导的肠上皮细胞促炎因子水平、髓过氧化物酶(MPO)活性、NO产生和细胞凋亡[39]。苦参碱能够抑制脓毒症诱导的沉默信息调节因子1(SIRT-1)下调和NF-κB p65亚基和p53的去乙酰化,减少肺中M1型巨噬细胞的浸润数量,增加M2型巨噬细胞浸润,减轻脓毒症诱导的肺损伤 [32]。
2.2.4 MKK/p38 MAPK信号传导途径
P38 MAPK信号通路在许多细胞类型中诱导炎症反应。p38 MAPK的激活依赖于其上游激酶MKK3和MKK6的磷酸化。研究发现ox-LDL暴露后显著促进MKK3、MKK6和p38的磷酸化,激活p38 MAPK炎症信号通路。而苦参碱能够通过抑制MKKs/p38 MAPK信号通路来减轻ox-LDL诱导的炎症,减少ox-LDL诱导的THP-1细胞ROS产生,发挥抗炎作用[3]。苦参碱能够抑制无乳链球菌诱导的BMEC细胞NF-κB、IκBα、p38和ERK磷酸化水平升高,抑制IL-1β、IL-6、IL-8和TNF-α的mRNA,减少无乳链球菌感染引起的BMEC损伤[29]。
2.2.5 Toll样受体通路
TLR4位于多种促炎细胞表面,是炎症反应中的主要受体。LPS激活免疫细胞中的TLR4启动信号级联,触发NF-κB通路的激活,从而导致后续一系列细胞因子和炎症介质的产生。研究发现,氧化苦参碱可以通过抑制TLR4的表达而减少NF-κB的活化,下调TLR4/NF-κB通路,抑制LPS刺激诱导的炎症反应[35]。炎症介质高迁移率族蛋白1(HMGB 1)是一种非组蛋白DNA结合蛋白,具有多种生物学效应,在炎症过程中,HMGB1可以通过结合TLR4,从而激活NF-κB信号通路,促进促炎细胞因子的转录。自身免疫性脑脊髓炎的发生发展便与这一通路的激活密切相关,有研究发现,苦参碱可抑制HMGB1/TLR4/NF-κB信号传导,减少炎症因子的产生,抑制炎性细胞浸润,从而减轻脑脊髓炎模型小鼠的炎性损伤[40]。
2.2.6 热休克蛋白通路
热休克蛋白60(HSP 60)于细胞外释放结合TLR4,可以刺激神经元细胞加重炎症反应。苦参碱可以通过抑制HSP60/TLR4/MyD88信号传导通路,抑制LPS诱导的小胶质细胞活化,发挥神经保护和抗炎作用[41]。苦参碱可以抑制炎性细胞因子-胸腺活化调节趋化因子TARC/CCL17和IL-6分泌,改善AD小鼠的炎症反应;苦参碱还可以通过抑制 Hsp90/NF-κB 信号轴来调节 Th1/Th2 炎症反应,从而缓解特应性皮炎[28]。
3. 总结与展望
苦参碱是从传统中药中提取出来的一种天然成分,具有相当大的药用价值。目前在炎症相关疾病中研究较为深入的苦参碱类生物碱主要包括苦参碱、氧化苦参碱、槐果碱3种。三者之中,苦参碱在多系统多器官的炎症性疾病中都有广泛研究;氧化苦参碱在支气管哮喘[42]、溃疡性结肠炎[43]的动物模型中表现出了一定的治疗效果;槐果碱则主要在类风湿性关节炎[44]、脓毒症[45]的动物模型中表现出了疗效。考虑到成药性,苦参碱的药理活性低、体内药效维持时间短,其临床应用局限很大,仅能偶尔作为辅助药物使用。因此,研究人员对苦参碱进行了结构修饰,提高了其药理活性,改善了其药代动力学特点,苦参碱衍生物在动物实验中表现出了明确的有效性和安全性。例如,苦参碱衍生物MASM已被证实在小鼠关节炎[24]和脓毒症等模型[38]中表现出较好的治疗效果。在实际临床工作中,对于严重感染引发的急危重症脓毒症,患者的致残致死率极高,给临床工作带来极大困难,如果联合应用安全有效的苦参碱衍生物可能会取得很好的疗效,苦参碱衍生物的临床应用前景值得期待。
与此同时,目前对于苦参碱及其衍生物在抗炎机制研究还不够深入,目前大部分研究还是集中在其抑制炎症相关通路(如NO、NF-κB、MAPK等)以及减少炎症因子分泌(IL-1β、IL-6、TNF-α等)的探讨上,缺乏对其特异性靶点的探索。此外,目前合成苦参碱衍生物通常需要经过多步合成反应,制备工艺还相对复杂,且有些合成产物的稳定性差,易被氧化或降解,距离产业化和临床应用还有较长的一段路要走。综上所述,苦参碱及其衍生物在炎症相关疾病中的应用是一个富有前景的研究方向,仍有许多极富价值的课题有待科研人员去探索和解决。
-
表 1 丙戊酸钠和左乙拉西坦治疗儿童癫痫病的有效率
干预措施 有效率 标准误 丙戊酸钠 0.82 0.054 左乙拉西坦 0.96 0.028 表 2 丙戊酸钠和左乙拉西坦药品成本信息
指标 基础值 最低价 最高价 丙戊酸钠缓释片单价(元/片) 2.01 1.61 2.01 丙戊酸钠缓释片6个月总费用(元) 723.6 554.4 723.6 左乙拉西坦片单价(元/片) 1.47 1.30 2.39 左乙拉西坦片6个月总费用(元) 1 931.58 6 992.19 17 291.44 表 3 丙戊酸钠和左乙拉西坦的成本-效果比较
治疗药品 成本(元) 效果 增量成本(元) 增量效果 ICER(元) 丙戊酸钠 723.60 0.82 — — — 左乙拉西坦 1 931.58 0.96 1 207.98 0.14 8 628.43 注:“—”表示此项无内容。 表 4 单因素敏感性分析参数范围
参数 基础值 下限 上限 戊丙酸钠价格(元) 2.01 1.61 2.01 左乙拉西坦价格(元) 1.47 1.30 2.39 戊丙酸钠效果 0.82 0.80 0.84 左乙拉西坦效果 0.96 0.93 0.99 表 5 成本分布
治疗药品 分布 参数 价格(元) 标准误 α β 戊丙酸钠 Gamma 2.01 0.043 3 2 153.213 3 0.000 9 左乙拉西坦 Gamma 1.47 0.070 1 437.267 8 0.003 3 表 6 有效率分布
治疗药品 分布 参数 有效率 标准误 α β 戊丙酸钠 Beta 0.82 0.054 3 40.18 8.82 左乙拉西坦 Beta 0.96 0.027 7 47.04 1.96 -
[1] 中华医学会儿科学分会神经学组. 儿童癫痫长程管理专家共识[J]. 中华儿科杂志, 2013, 51(9):699-703. doi: 10.3760/cma.j.issn.0578-1310.2013.09.016 [2] CASETTA I, PUGLIATTI M, FAGGIOLI R, et al. Incidence of childhood and adolescence epilepsy: a community-based prospective study in the province of Ferrara and in Copparo, Italy, 1996-2005[J]. Eur J Neurol, 2012, 19(2):312-316. doi: 10.1111/j.1468-1331.2011.03506.x [3] FLEEMAN N, BRADLEY P M. Care delivery and self-management strategies for children with epilepsy[J]. Cochrane Database Syst Rev, 2018, 3(3):CD006245. [4] FERRO M A, AVERY L, FAYED N, et al. Child- and parent-reported quality of life trajectories in children with epilepsy: a prospective cohort study[J]. Epilepsia, 2017, 58(7):1277-1286. doi: 10.1111/epi.13774 [5] 石秀玉, 胡琳燕, 韩芳, 等. 儿童癫痫的精准治疗[J]. 临床儿科杂志, 2022, 40(3):170-176. doi: 10.12372/jcp.2022.21e1721 [6] 李蕊, 刘畅, 徐鲁杰, 等. 左乙拉西坦对比丙戊酸钠治疗儿童癫痫有效性和安全性的Meta分析[J]. 中国药房, 2023, 34(2):205-211. doi: 10.6039/j.issn.1001-0408.2023.02.15 [7] 陆琳, 马素青, 毕金珠. 丙戊酸钠与左乙拉西坦治疗儿童原发性癫痫的效果比较[J]. 中国医疗导报, 2022, 19(14):84-87. [8] 中华医学会儿科学会神经学组. 新诊断儿童癫痫的初始单药治疗专家共识[J]. 中华儿科杂志, 2015, 53(10):734-737. [9] 高静云, 王颖慧, 杨莉, 等. 中国新诊断儿童首选丙戊酸钠和左乙拉西坦治疗方案的成本效果分析[J]. 中华实用儿科临床杂志, 2013, 28(1):42-47. doi: 10.3760/cma.j.issn.2095-428X.2013.01.013 [10] 王李婷, 彭六保, 彭烨, 等. 2020年版和2011年版中国药物经济学评价指南比较分析[J]. 中国药物经济学, 2021, 16(3):5-8,15. doi: 10.12010/j.issn.1673-5846.2021.03.001 [11] 国家卫生计生委疾病预防控制局. 中国居民营养与慢性病状况报告(2015年)[R]. 北京: 人民卫生出版社, 2015: 71. [12] 石丰豪. 奥美拉唑和艾司奥美拉唑治疗急性非静脉曲张性消化道出血的成本-效果分析[J]. 中国药物经济学, 2020, 15(6):31-34. doi: 10.12010/j.issn.1673-5846.2020.06.005 [13] 崔鑫, 李薇, 王春萍, 等. 天麻钩藤颗粒治疗原发性高血压的成本效果分析[J]. 药物评价研究, 2023, 46(9):1970-1976. [14] 洪震. 癫癎流行病学研究[J]. 中国现代神经疾病杂志, 2014, 14(11):919-923. doi: 10.3969/j.issn.1672-6731.2014.11.001 期刊类型引用(6)
1. 王玉群,孟名柱. 准确识别门急诊药品包装盒的YOLO-V5深度学习预测模型的建立及初步应用. 医药导报. 2024(04): 661-667 .  百度学术
百度学术2. 马海东,王条敏,秦小英,张皓均,何翠. 医院西药房处方调剂差错原因分析与防范措施. 中国药业. 2024(13): 28-30 .  百度学术
百度学术3. 王丰,马文兵,董海燕. 信息药师基于相似度算法的门诊药房药品差错防范体系建设及其应用. 中国医院药学杂志. 2024(13): 1585-1591 .  百度学术
百度学术4. 汤小林,陈梦莹,柴晓燕,龚丽霞,黄燕. 品管圈活动降低门诊西药房调剂内部差错率的实践研究. 药品评价. 2023(07): 785-788 .  百度学术
百度学术5. 林婉茹. 加强西药房药品管理对降低药患纠纷及药品差错发生率的影响分析. 中国医药指南. 2023(30): 70-72 .  百度学术
百度学术6. 赵思宇. 调剂管理创新在药剂科中的应用. 中医药管理杂志. 2022(24): 199-201 .  百度学术
百度学术其他类型引用(0)
-





 下载:
下载:
 下载:
下载: