-
药用植物自古以来便是人们预防和治疗疾病的主要武器,对人类健康的发展起着举足轻重的作用。根据世界卫生组织(WHO)的数据,全球至少有25%的药物直接或间接来源于药用植物,中药有95%以上来源于药用植物,并且超过60%的抗癌药物是直接或间接从药用植物中发现的[1],所以药用植物是药物的主要来源。次生代谢成分(secondary metabolites,SMs)是指不直接参与植物生长发育,但对植物的长期生存有着至关重要作用的小分子有机化合物[2]。根据其结构和生物合成途径,植物SMs主要分为多酚类、萜类和含氮有机物,这些化合物具有抗氧化、抗炎、清除自由基、抗菌和抗病毒等活性[3]。SMs实际上是植物在长期进化中为对抗生物和非生物胁迫而促进环境适应的结果[4]。SMs的合成和积累是非常复杂的,受多种因素的影响,包括内部发育遗传回路(受调控的基因、酶)和外部环境因素(光、温度、水、盐度等)[5]。在这些因素中,光几乎影响所有类型SMs的积累(见图1),光质、光强和光周期均影响药用植物SMs的含量[6]。药用植物的SMs是临床疗效的物质基础,是评价药材质量的重要指标。光如何影响SMs生物合成对于提高药用植物SMs的产量和质量至关重要。本文就近年来国内外关于光对药用植物SMs的研究现状进行综述,以期为相关研究及药用植物高产优质栽培提供指导。
-
根据光的波长,太阳光谱可分为:紫外光(UV,100~400 nm,其中:A波段,315~400 nm;B波段,280~315 nm;C波段,100~280 nm)、可见光或光合有效辐射(PAR;蓝光:400~500 nm;绿光:500~600 nm;红光:600~700 nm)和近红外光(700~800 nm)[7]。光感受器是植物光感觉和光信号转导不可或缺的部分,植物对光的反应能力是由能够感知不同光照强度、光质、光照方向和光周期的光感受器所决定的[3]。目前在模式植物拟南芥中至少鉴定出了五类光感受器:①光敏色素(phyA–phyE),主要感知红光和红外光;②隐色素(CRY1/CRY2),主要感知蓝光和紫外A波段(UV-A);③向光素(phots),主要感知蓝光;④蓝光受体ZTLs(zeitlupes),主要感知蓝光和绿光(450~520 nm);⑤紫外线感光器也称UV抗性位点8(UVR8),主要感知紫外B波段(UV-B)[8]。光感受器通过调节特定基因的表达来刺激SMs的生化途径,SMs的生物合成与光感受器吸收的波长密切相关。
-
紫外线的波长仅占到达地球表面的太阳辐射的一小部分,但它对包括植物在内的现存物种有重大的生物影响。因此,UV可作为一种重要的非生物激发剂用于促进各种植物培养中SMs的生产[9]。
-
SMs的产生是对UV暴露增强的一种适应机制。花青素为生物类黄酮物质,而黄酮类物质最主要的功能是自由基清除能力和抗氧化能力。有研究证明:花青素是当今人类发现最有效的抗氧化剂,也是最强效的自由基清除剂,花青素的抗氧化性能比维生素C高20倍,比维生素E高50倍,并且可以吸收多余的可见光和帮助植物抵抗紫外线,清除氧自由基保护植物,是植物天然的光保护剂[10]。研究发现UV-A可促进红花檵木愈伤组织花色素和黄酮类物质的合成[11],也可以明显促进津田芜菁膨大肉质根表皮花青素的积累[12]。
-
植物通过发展保护结构和机制来应对UV-B的过度损伤。前者包括毛发、蜡和其他提供光学保护的细胞修饰,而后者涉及抗氧化酶的诱导和保护分子浓度的提高[13]。SMs的形成和产生可增强植物对UV-B的适应性,保护植物免受UV-B的损伤。
在UV-B胁迫下研究最广泛的一类生物碱是长春花体外细胞培养中的具有抗癌活性的萜类吲哚生物碱(TIAs):长春花碱和长春碱。研究表明UV-B对长春花细胞悬浮液照射5 min可将长春花碱和长春碱的产量分别提高到3倍和12倍[14]。
UV-B对萜类SMs的影响较大。紫杉醇是红豆杉属植物具有抗癌作用的二萜类化合物,研究表明,UV-B辐射(3 W/m2)12 h和24 h,可显著诱导东北红豆杉组培苗中紫杉醇的积累[15]。青蒿素是一种含有过氧化物桥结构的倍半萜内酯,在UV-B照射2 h后ADS、CPR和DBR2基因的表达被诱导,4 h和6 h后达到高峰[16]。甘草酸是甘草的主要活性成分之一,UV-B低强度(0.43 W/m2)和高强度(1.43 W/m2)照射均能提高3月龄盆栽甘草根组织中甘草酸的浓度,为对照的1.5倍,且3~6个月生盆栽植物的甘草酸浓度与3~4年生田间植物的甘草酸浓度相似甚至更高,并证实在受控环境下,可以在短期内实现高浓度的甘草酸生产[17]。
UV-B可诱导产生更多的多酚类化合物,而黄酮类化合物是其中最大的类别。睡茄在UV-B辐射下叶片和根部4-香豆酸Co-A连接酶(4CL)、肉桂醇脱氢酶(CAD)、查尔酮异构酶(CHI)、苯丙氨酸解氨酶(PAL)和二氢黄酮醇还原酶(DFR)的活性增加[18]。与此相似,UV-B辐射显著提高了辣椒叶片中绿原酸和芹菜素8-C-己糖的含量,且苯丙氨酸解氨酶(PAL)和查尔酮合成酶(CHS)基因的表达量在UV-B处理下也有所增加[19]。
-
UV-C照射几乎可以诱导和提高所有酚类化合物中类黄酮的生物合成[9]。最近的一份研究表明,金荞麦在光周期为16L/8D h的UV-C(5.4 kJ/m2)处理后,积累了最优的生物量(438.3 g/L 鲜重,16.4 g/L 干重)、总黄酮含量(TFC: 4.05 mg/g)和酚类物质含量(TPC: 11.8 mg/g)[20]。虎杖在UV-C(10 W/m2)照射6 h和12 h后,白藜芦醇含量分别比未处理的显著提高了2.6倍和1.6倍。UV-C处理后,苯丙氨酸解氨酶、肉桂酸4-羟化酶、4-香豆酸辅酶a连接酶和二苯乙烯合酶(STS)等直接参与白藜芦醇合成的基因被强烈诱导,并确定了MYB、bHLH和ERF家族中的几个成员作为白藜芦醇生物合成基因的潜在调控因子[21]。
-
红光和蓝光较易被叶绿素吸收,所以是调节药用植物SMs含量的重要光质。Kapoor等[22]研究发现,蓝光处理的愈伤组织培养至第21天,积累的红景天苷(3.12 mg/g 干重)量最大,TFC(5.53 mg/g 干重)和总酚(TPC,11.84 mg/g 干重)的积累量均高于其他光照条件,但红光下培养的愈伤组织在第21天生物量(7.43 g/L)最大,红光培养下愈伤组织的比生长率最高(0.126/d),倍增时间最高(132.66 h),即红光刺激最大生物量积累,蓝光促进红景天苷、酚类物质和黄酮类物质积累。Manivannan等[23]研究发现,不同光照处理丹东玄参时,TPC和TFC的含量在蓝光处理下显著高于红光处理。值得注意的是,蓝光显著提高了TFC(比冷白色荧光灯组高65.68%)和TPC(比冷白色荧光灯组高55.14%)的含量。在对墨旱莲的研究中,红光处理可促进酚类物质(57.8 mg/g)和黄酮类物质(11.1 mg/g)的产生。蓝光处理下,4种主要化合物香豆素(1.26 mg/g)、小泡蛋白(5.00 mg/g)、威地洛内酯(32.54 mg/g)和去甲基威地洛内酯(23.67 mg/g)以及2种次要化合物β-香树素 (0.38 mg/g)和木犀草素(0.39 mg/g)的产量均有所增加[24]。Nadeem等[25]研究了发光二极管对罗勒愈伤组织中生物活性成分积累的影响,发现各处理中,蓝光处理下愈伤组织TPC含量最高,红光处理下愈伤组织TFC含量最高。高效液相色谱法(HPLC)分析表明,蓝光条件下迷迭香酸(96.0 mg/g 干重)和丁香酚(0.273 mg/g干重)浓度最高,分别为对照组的2.46和2.25倍。红光下愈伤组织中花青素(0.122 mg/g 干重)和芍药苷(0.127 mg/g 干重)含量最高。连续白光下培养的愈伤组织中,氨基酸积累量为81.40 mg/g(干重),是对照的4.52倍。水飞蓟是一种被广泛研究的著名保肝药材。研究发现红光能显著提高该植物的酚类物质、黄酮类物质和超氧化物歧化酶活性。在红光下,HPLC分析显示水飞蓟素总浓度(18.67 mg/g 干重)是对照的2倍。当暴露在红光下时,水飞蓟素、异水飞蓟素、水飞蓟宾A、水飞蓟宾B和水飞蓟宁的含量都很高[26]。此外,蓝光对远志根中TFC和TPC积累有促进作用[27],可有效促进半夏块茎中总生物碱的累积[28],也可以促进淫羊藿苷类黄酮的形成[29]。但也有相反的情况,如在对绞股蓝的研究中,红光比蓝光更有利于绞股蓝总皂苷的积累,但是红光却抑制绞股蓝TFC的积累[30];红光处理下黄花蒿的青蒿素和青蒿酸含量较低[31]。
也有研究表明,红蓝光组合能更好的促进药用植物中SMs的积累。李琪等[32]研究表明,与单色红光和蓝光相比,红蓝复合光更有利于金线兰组培苗的生长发育以及SMs的积累。其中,红蓝(1∶1)组相较于其他组合光更能显著促进金线兰黄酮类、酚类、氨基酸类等多种次级代谢产物的积累。因此,红蓝(1∶1)可以作为金线兰组织培养的最佳光质。刘建福等[33]发现,R7B3时最有利于姜黄根茎SMs的生成,此条件下,姜黄素类化合物含量达到最大值, 去甲氧基姜黄素、姜黄素和双去甲氧基姜黄素含量分别比白光(对照)显著提高44.32%、77.39%和43.80%。
-
有研究表明黄光可以促进SMs的产生。黄光处理下拟巫山淫羊藿的黄酮类化合物含量高于红光、蓝光和白光处理。RNAseq和qPCR分析表明,黄光可显著上调黄酮类生物合成基因CHS1、F3H1、PT_5和raGT_5的表达水平,可能是黄酮类生物活性物质积累增强的原因之一。耐阴植物通常生活在阳光较少的地方(如林下作物),光合作用驱动的波段,如红光和蓝光优先被上层冠层过滤掉,可利用的有效辐射主要为绿光、黄光和红外光。因此,拟巫山淫羊藿可能是为了适应遮荫条件下有限的黄色辐射光谱而进化的[34]。
-
研究表明绿色植物之所以呈现绿色是由于绿光大部分被植物叶片反射而很少被叶绿体吸收,因此绿光也被认为是生理无效光[7]。确实有很多研究表明绿光不利于SMs的积累。如绿光对绞股蓝总皂苷、TFC的积累有明显的抑制作用[30]。但也有研究表明绿光由于其高的透过率和反射率,可以深入叶片内部参与并影响光合作用,特别是在强烈的白光下,较低的叶绿体吸收任何额外的绿光都会比额外的红光或蓝光更大程度地促进叶片的光合作用[35]。青钱柳是一种兼具经济价值和药用价值的树种。研究发现与白光、蓝光和红光相比,绿光处理下青钱柳叶片TFC含量最高[36]。此外,绿光虽然抑制半夏块茎中总生物碱的积累,但却促进了黄酮类物质的产生[28]。
-
近红外光是可以通过对光敏色素作用来直接调控植物的生长发育。低R/ FR条件会使拟南芥的叶片大而厚、生物质数量大,冷适应能力强[37]。在川贝母中异甾体类生物碱的合成中,也发现了近红外光具有类似的作用[38]。光敏色素控制植物的开花主要取决于红外光吸收型(Pfr)/红光吸收型(Pr)的比值,因此可以通过红外光照射来控制Pfr/Pr值,从而较精确地控制开花的周期,这对于以花入药的药用植物具有重要意义[39]。
综上所述,不同的光质对不同植物甚至是同一植物的不同类型的SMs影响都是不一样的(见表1)。不同分类条件下光质对药用植物产生的影响见图2、图3所示,不同波长的光皆有可能成为诱导药用植物SMs积累的潜在因子。目前应用红蓝光调控黄酮类SMs研究较多,一方面是因为红蓝光较其它光质更易获取与利用,另一方面因为黄酮类次生代谢成分在药用植物中相对普遍存在,生物合成途径较为明确。不同光质对不同药用植物、不同的SMs存在不一样的调控作用,明确这些作用需要大量的实验去探索。UV在过去很长的一段时间里被视为不利于植物生长的有害因素,尤其是UV-C更被视为“灭生性辐射”,但现在许多研究表明低剂量的(适宜的)紫外辐射会触发植物体内抗逆境基因的表达,从而促进SMs的积累。
表 1 不同光质对药用植物SMs的影响
科名 拉丁名 中文名 光质 光强 作用时间 SMs影响 类型 参考文献 百合科 Fritillaria cirrhosa 川贝母 R
FR56 μmol/ (m2·s) 16 h
90 d异甾体类生物碱↑ 生物碱类 [38] 唇形科 Ocimum basilicum 罗勒 B 40~50 μmol/ (m2·s) 24 h
28 d迷迭香酸↑
丁香酸↑
总酚↑酚类 [25] 唇形科 Salvia miltiorrhiza 丹参 B
R300 μmol/ (m2·s) 16 h
20 d丹酚酸B↑ 酚类 [40] 豆科 Scutellaria baicalensis 黄芩 W 90 μmol/ (m2·s) 16 h
14 d黄芩苷↑
汉黄芩苷↑
黄酮类↑黄酮类 [41] 豆科 Astragalus membranaceus 黄芪 B
Y透光率85% 120 d 总皂苷↑
总黄酮↑萜类
黄酮类[42] 豆科 Glycyrrhiza uralensis 甘草 UVB 1.43 W/m2
0.43 W/m23 d
15 d甘草甜素↑ 萜类 [17] 红豆杉科 Taxus cuspidata 东北红豆杉 R
B
G40~50 μmol/ (m2·s) 15 d 总紫杉烷↑ 萜类 [43] 红豆杉科 Taxus cuspidata 东北红豆杉 UVB 3 W/m2 12 h 紫杉醇↑
类黄酮↑萜类
黄酮类[15] 胡桃科 Cyclocarya paliurus 青钱柳 B
G(800 ± 50) μmol/ (m2·s) 12 h
60 d山柰酚↑
异槲皮苷↑
槲皮素↑
总黄酮↑黄酮类 [36] 葫芦科 Gynostemma pentaphyllum 绞股蓝 B
R
G1500~2 000 Lx 12 h
60 d总黄酮↓ 黄酮类 [30] 夹竹桃科 Catharanthus roseus 长春花 UVB 1.26 W/m2 5 min 长春碱↑
长春新碱↑生物碱类 [14] 姜科 Curcuma longa 姜黄 G
FR280 μmol/ (m2·s) 13 h
60 d姜黄素类化合物↓ 黄酮类 [33] 金缕梅科 Loropetalum chinense 红花檵木 B+UVA
B60 μmol/ (m2·s) 12 h
15 d、30 d花色素苷↑
总黄酮↑黄酮类 [11] 景天科 Rhodiola rosea 红景天 B 25~27 μmol/ (m2·s) 16 h
30 d红景天苷↑
总黄酮↑
总多酚↑酚类
黄酮类[22] 菊科 Artemisia annua 黄花蒿 W
B(200 ± 10) μmol/ (m2·s) 16 h
7 d青蒿素↑
青蒿酸↑萜类 [31] 菊科 Eclipta prostrata 墨旱莲 R 40~50 μmol/ (m2·s) 24 h
28 d酚类↑
黄酮类↑酚类
黄酮类[24] 菊科 Silybum marianum 水飞蓟 R 40~50 μmol/ (m2·s) 24 h
28 d总水飞蓟素↑
总酚↑
总黄酮↑酚类
黄酮类[26] 菊科 Atractylodes lancea 茅苍术 9R1B 100 μmol/ (m2·s) 180 d 挥发油↑ 萜类 [44] 菊科 Artemisia annua 黄花蒿 UVB 1.5 μmol/ (m2·s) 4 h
9 d青蒿素↑
类黄酮↑萜类
黄酮类[16] 兰科 Anoectochilus roxburghii 金线莲 R1B1 (16± 1) μmol/ (m2·s) 12 h
120 d酚类↑
黄酮类↑酚类
黄酮类[32] 兰科 Arundina graminifolia 竹叶兰 1R3B
B45 μmol/ (m2·s) 12 h
40 d总酚↑
类黄酮↑酚类
黄酮类[45] 藜芦科 Paris polyphylla 陕产重楼 B 80 μmol/ (m2·s) 12 h
30 d总皂昔↑ 萜类 [46] 蓼科 Reynoutria japonica 虎杖 B 3000 Lx 30 d 白藜芦醇↑ 酚类 [47] 蓼科 Fagopyrum dibotrys 金荞麦 UVC 5.4 KJ/m2 30 min 总黄酮↑
多酚类↑酚类
黄酮类[20] 蓼科 Reynoutria japonica Houtt. 虎杖 UVC 6 W/m2 10 min 白藜芦醇↑ 酚类 [21] 葡萄科 Tetrastigma hemsleyanum 三叶青 B 1630~1660 Lx 12 h
30~45 d总黄酮↑ 黄酮类 [48] 茄科 Withania somnifera 睡茄 UVB 3.6 KJ/ (m2·d) 4 h 生物碱↑
黄酮类↑生物碱类
黄酮类[18] 茄科 Capsicum annuum 辣椒 UVB 80 W/m2 4 h 黄酮类↑ 黄酮类 [19] 秋海棠科 Gynura bicolo 紫背天葵 7R2B1Y (350±5) μmol/ (m2·s) 16 h
60 d总酚↑
类黄酮↑
花青素↑酚类
黄酮类[49] 十字花科 Brassica rapa 津田芜菁 UVA 3 W/m2 24 h 花青素↑ 黄酮类 [12] 石蒜科 Lycoris radiata 石蒜 B 50 μmol/ (m2·s) 12 h
30 d生物碱↑ 生物碱类 [50] 天南星科 Pinellia ternata 半夏 B 40 μmol/ (m2·s) 12 h
45 d总生物碱↑ 生物碱类 [28] 五加科 Eleutherococcus senticosus 刺五加 B
R透光率100% 20 d 总黄酮↓ 黄酮类 [51] 小檗科 Epimedium
pseudowushanense拟巫山淫羊藿 Y (18.2 ± 2.5) μmol/ (m2·s) 16 h
30 d黄酮类↑ 黄酮类 [34] 小檗科 Epimedium
pseudowushanense拟巫山淫羊藿 B
Y
R(18.2 ± 2.5) μmol/ (m2·s) 16 h
30 d淫羊藿苷类黄酮↑ 黄酮类 [29] 玄参科 Scrophularia kakudensis 丹东玄参 R 50 μmol/ (m2·s) 16 h
28 d总黄酮↑
总多酚↑酚类
黄酮类[23] 远志科 Polygala tenuifolia 远志 B 100 μmol/ (m2·s) 12 h
30 d总酚↑
总黄酮↑酚类
黄酮类[27] 注:B.蓝光;R.红光;Y.黄光;G.绿光;FR.红外光;UV.紫外线;↑表示SMs含量增加;↓表示SMs含量减少 -
与其它生理过程相似,药用植物的次生代谢过程也受光照强度的影响。每种植物都有其适宜的光照强度,在其合适的光强下,药用植物才能更好的生长,产生更多的具有药理活性的SMs(见表2)。如典型的阳生植物金银花在阳光充足的地方品质更佳,Fang等[52]研究发现,完全光照促进了金银花中木犀草苷的生物合成和积累,与50%、25%光强相比,100%光照强度下参与黄酮类代谢的光响应转录因子(NAC、WD40、MYB、ERF、WRKY)在金银花中大量上调。野菊为喜光植物,有效成分含量如绿原酸、木犀草苷、蒙花苷、TFC等随光强升高而增加。钩藤虽也为喜阳植物,但在幼苗期也需要适度的遮荫处理。钩藤在70%~75%光强下适宜幼苗生长和生物量积累,在30%~35%光强下适宜钩藤幼苗有效成分(钩藤碱、异钩藤碱)的积累[53]。而对于阴性植物而言,需要在弱光条件下才能更好的生长。典型的阴生植物如滇重楼、三七、细辛等在栽培过程中都需要进行适度的遮荫处理或者种植在林下等潮湿背阴处。陈黎明等[54]研究表明,在透光率为16%的光强下,三七的光合作用效率最高,并且地下部分三七总皂苷含量达到最大值为4.75%。张勤涛等[55]发现,滇重楼在黄光处理下的最适光强是(75~100) μmol/(m2·s),而在蓝光处理下(100~150) μmol/(m2 ·s)[56],表明不同光质下植物的最适光强范围会有所差异。总之,不同植物对光照强度的需求不一,甚至在不同的生长阶段对光照强度的需求也会有所差别,需要充分考虑不同植物的生态习性从而做出有益的处理。
表 2 不同光强对药用植物SMs的影响
科 拉丁名 物种 生态习性 光质 不同光强 最适光强 SMs 参考文献 菊科 Aster indicus 马兰 喜阳 自然光 100%、62.29%、35.17% 叶中呈下降趋势
根中呈上升趋势
茎中62.29%最高黄酮类 [57] 菊科 Viola philippica 紫花地丁 中性 自然光 100%、80%、50%、35%、5% 35%~100%增加
但无显著性差异黄酮类
香豆素[58] 菊科 Chrysanthemum indicum 野菊 喜阳 自然光 100%、80%、60%、40%、20% 呈下降趋势60%较好 总黄酮
蒙花苷
木犀草苷
绿原酸[59] 蓝果树科 Camptotheca acuminata 喜树 喜阳 白光 800、500、300 μmol/ (m2·s) 300 μmol/ (m2·s) 喜树碱 [60] 藜芦科 Paris polyphylla 滇重楼 喜阴 黄光 100、75、50、25 μmol/(m2·s) 75~100 μmol/ (m2·s) 皂苷类 [55] 藜芦科 Paris polyphylla 滇重楼 喜阴 蓝光 200、150、100、50 μmol/ (m2·s) 100~150 μmol/ (m2·s) 皂苷类 [56] 马兜铃科 Asarum heterotropoides 北细辛 喜阴 自然光 100%、50%、28%、12% 50% 挥发油
细辛脂素[61] 木樨科 Syringa oblata 紫丁香 喜阳 自然光 100%、50%~60%、25%~35% 50%~60% 芦丁 [62] 茜草科 Uncaria rhynchophylla 钩藤 喜阳 自然光 100%、70%~75%、
30%~35%、5%~10%前期70%~75%
后期30%~35%生物碱 [53] 忍冬科 Lonicera japonica 金银花 喜阳 自然光 100%、50%、25% 100% 木犀草苷 [52] 伞形科 Changium smyrnioides 明党参 中性 自然光 100%、60.54%、44.84%、31.39%、10.56% 31.39%~60.54% 甘露醇
胆碱[63] 五加科 Panax notoginseng 三七 喜阴 自然光 32%、16%、8%、4%、2% 16% 总皂苷 [54] 远志科 Polygala tenuifolia 远志 喜阳 白光 500、300、100 μmol/ (m2·s) 无显著性差异 总黄酮
总酚[27] -
光周期即昼夜的相对长度,根据植物开花对日照长度的反应可分为:长日照植物、短日照植物和中日照植物。合适的光周期可以促进SMs的积累(见表3)。朱宁等[64]研究了不同光周期对龙眼胚性愈伤组织的影响,发现在短光照处理下(6 h/18 h L/D)类黄酮的含量和产量最高;全光照处理下(24 h)类胡萝卜素含量和产量最高。Tusevski等[65]发现贯叶连翘毛状根在光周期16 h/8 h下可以从头合成五种氧杂蒽酮、三种黄酮苷和两种酚酸,但在暗培养下更有利于黄烷-3-醇的合成。刘静等[66]的研究表明,在光周期12 h/d处理下,明显促进醉马草内生真菌共生体幼苗麦角酰胺和麦角新碱的积累。而朱娇等[67]的研究表明,不同光周期对西红花的品质没有影响,但在光周期8 h/16 h下,有利于西红花生长、促进初期提前开花。由此可见,光周期可以调控药用植物中SMs的产生和积累。
表 3 不同光周期对药用植物SMs的影响
科 拉丁名 物种 光强 不同光照时长 最适光照时长 SMs 参考文献 禾本科 Achnatherum inebrians 醉马草 2500 Lx 16、14、12、8 h/d 12 h/d 麦角酰胺
麦角新碱[66] 金丝桃科 Hypericum perforatum 贯叶连翘 50 μmol/(m2·s) 16、0 h/d 16、0 h/d 酚酸、黄酮醇、氧杂蒽酮(16)
黄烷-3-醇(暗培养)[65] 落葵科 Basella alba 落葵 45 μmol/(m2·s) 24、16、0 h/d 16 h/d 总酚
黄酮类[68] 无患子科 Dimocarpus longan 龙眼 36 μmol/(m2·s) 24、18、12、6、0 h/d 24 h/d
6 h/d类胡萝卜素(24)
类黄酮(6)[64] 鸢尾科 Crocus sativus 西红花 (83±8) μmol/(m2·s) 14、12、10、8 h/d 8 h/d 西红花苷(无影响) [67] -
植物对光的响应具有特异性,光对不同植物SMs生物合成的影响不同。在植物光调控领域,光质、光强、光周期实际上是相互影响的,改变其中任何一个因素得到的实验结果可能会有所不同。在光强为(18.2 ± 2.5) μmol/(m2·s)时,黄光、蓝光和红光下淫羊藿苷类黄酮含量均高于白光;而在(90.9 ± 2.5) μmol/(m2·s) 光强下,白光促进淫羊藿苷类成分合成的效果却强于黄光、蓝光和红光[29]。再如,滇重楼在蓝光下得出的最适光强为(75~100) μmol/(m2·s);而在黄光下得出的最适光强却是(100~150) μmol/(m2·s)。光敏色素、隐色素、向光素、蓝光受体、紫外线感光器是目前已鉴定出的五类光感受器,光照通过与光感受器作用,调控SMs生物合成中涉及的转录因子或关键酶的基因表达。例如,当植物暴露于UV-B辐射时,UVR8同二聚体经历单体化并与COP1相互作用,从而增加COP1的稳定性并诱导HY5的表达,HY5结合一些转录因子基因的启动子,如AaWRKY9、GLANDULAR trichomspecific WRKY 1 (AaGSW1)和AaORA,从而上调它们的表达,这些转录因子刺激相关生物合成基因的表达,提高青蒿素的含量[69-70]。植物不同的生长时期对光的需求是不一样的,即植物对光的需求具有动态性,但大多数研究给予的光照条件却是静态性的。因此,目前许多对于光调控药用植物SMs的研究是有局限的,即如对光的某一方面(光质或光强或光周期)进行考察,得出的实验结果可能具有片面性,如能对光相互影响的三个方面(光质、光强、光周期)同时进行综合考察有可能得出较优的光配方。
体外培养(如组织培养)生产具有药理活性的SMs可以对光照条件进行更为精准的调控。对于次生代谢工程而言,通过光调控提高SMs的产量和质量是一种比较高效的、经济的手段。目前药用植物绝大多数是在室外种植,人们对光的调控是受限的。因此,在进行实验时,应更多的考虑室外大规模种植时可利用的光调控手段进行研究,这样得出的科研成果才有可能投入实际的生产中。
药用植物中SMs是其主要的药效物质基础和品质内涵,药材内在品质主要取决于这类产物的合成与积累。在自然界中,光往往与其它环境因子(如温度、水分、微生物等)协同或拮抗地调控药用植物SMs的生物合成。某种植物中SMs的种类及合成量的阈值由自身的遗传特性决定,光与其他环境因素则对这些产物的表达量起调控作用。随着人们对天然活性产物需求的增加,许多可人为控制的光调控系统已被用于药用植物的栽培。光对植物的调控作用是复杂的,目前人们对完整的光信号通路仍然不清楚,可以结合转录组学、基因组学、蛋白质组学、代谢组学等多种组学方法,更加全面的了解光对药用植物中SMs的影响机制,为提高SMs的产量和质量提供新的思路和方法。
Effects of light regulation on the synthesis of secondary metabolites in medicinal plants
-
摘要: 药用植物次生代谢成分,因具有特殊的药理活性或功效对人类的健康极为重要,是药品、保健品、化妆品的主要来源。随着人类对于健康和长寿的不断追求,医药市场的需求规模持续增长,提高药用植物次生代谢成分的产量和质量变得特别重要。植物次生代谢成分是植物对环境的一种适应,是在长期进化过程中植物与生物和非生物因素相互作用的结果。药用植物次生代谢成分的产生和积累主要受植物遗传因素和环境因素的影响,其中光环境对其合成影响尤为重要,因而,长期以来光调控一直是国内外众多学者研究的热点。本文综述近年来有关光调控对药用植物次生代谢成分影响的研究进展,主要从光质、光强、光周期的影响分别阐述,以期为高效生产具有重要药理活性的次生代谢成分提供理论依据和实践指导。Abstract: Secondary metabolites of medicinal plants are extremely important to human health because of their special pharmacological activities or efficacy. They are the main source of drugs, health care products, and cosmetics. As human beings continue to pursue health and longevity, the demand in the pharmaceutical market continues to grow. It becomes especially important to improve the production and quality of secondary metabolites of medicinal plants. Plant secondary metabolites are a kind of adaptation of plants to their environment and are the result of the interaction between plants and biotic and abiotic factors during the long-term evolution process. The production and accumulation of secondary metabolites in medicinal plants are mainly affected by plant genetic factors and environmental factors. Among them, light environment is extremely important for their synthesis. Therefore, light regulation has long been a research focus for many scholars in China and abroad. In this article, we the recent research progress on the effects of light regulation on the secondary metabolites of medicinal plants were reviewed, mainly focusing on the effects of light quality, light intensity and photoperiod, in order to provide theoretical basis and practical guidance for the efficient production of secondary metabolites with important pharmacological activities.
-
Key words:
- light quality /
- light intensity /
- photoperiod /
- medicinal plants /
- secondary metabolites
-
口服给药是最简单的给药方式,药物是否适合口服给药取决于其在胃肠道中的有效吸收,因此,开发能准确预测口服药物吸收的方法对药物研发相关研究具有非常重要的意义。近几十年来,为了评估临床前开发过程中的口服药物吸收,研究人员们已经建立了多种药物肠吸收的研究方法,主要有体外试验法(in vitro)、在体试验法(in situ)和体内试验法(in vivo)等。动物模型可以模拟整个有机体的生理,但动物模型在肠道生理学以及肠道转运蛋白的表达模式和底物特异性方面与人类有很大不同[1]。2004年,美国FDA估计,92%通过动物试验的药物未能进入市场,原因是动物试验没有预测到的有效性和安全性问题。此外,动物模型往往具有伦理学争议。与动物模型相比,体外培养细胞模型具有操作简便、成本低、无伦理问题等优点[2],研究人员开发了Boyden Chamber和Transwell等模型来模拟肠道的复杂结构和功能。然而,传统的体外培养细胞模型通常缺乏体内特性,例如,流体流动、周期性蠕动、宿主与微生物之间的串扰以及组织之间的串扰[3]。随着微制造和3D打印技术的发展,肠芯片(gut-on-a-chip, GOC)为体外研究肠道疾病提供了新方法[4]。基于肠道功能,肠芯片引入了具有不同部件的模块,例如,用于流体流动的注射泵和用于机械变形的压力系统[5],用于模拟一些肠道功能,使其更具生理相关性。肠芯片突破了传统细胞培养和动物实验的局限性,具有体积小、高度集成化和高通量等特点。本文综述了目前国内外肠芯片模型以及与肠道相关的多器官耦合芯片模型的研究进展,介绍了基于微流控芯片的肠道模型在疾病建模、药物吸收和转运方面的应用。
1. 肠道基本结构与功能
1.1 小肠的结构
肠道是人体重要的消化器官,是从胃幽门至肛门中最长的一段,主要器官功能是进行消化、吸收、分泌和免疫[6]。肠上皮是人体最大的黏膜表面,覆盖约400 m2的表面积,单层细胞组织形成隐窝和绒毛结构[7]。隐窝和绒毛是肠道基本的、具有自我更新功能的结构单位。人体小肠和大肠体内肠隐窝的实际深度分别为135 μm和400 μm,小肠绒毛的高度为600 μm[8]。隐窝和绒毛分别包括干细胞增殖和分化细胞区域。在肠上皮的分化绒毛区域中,发现了3种主要类型的分化肠上皮细胞(IEC):肠上皮细胞、杯状细胞和肠内分泌细胞[9]。肠上皮细胞是肠上皮中最常见的细胞,负责消化和吸收肠腔中的营养物质[10]。杯状细胞分泌的黏液在肠上皮上维持一层连续的黏液,提供保护屏障并有助于润滑肠道内壁[11]。肠内分泌细胞产生多种激素并调节许多不同的功能[12]。
1.2 肠道屏障
肠道屏障是机体内部和外部之间的屏障,允许营养素和液体的吸收,同时阻止有毒、有害物质的侵入,对人体的健康起着重要作用。肠道屏障分为四类:机械屏障、化学屏障、生物屏障和免疫屏障[7]。机械屏障又称为物理屏障,它能有效阻止有害物质,如细菌、毒素等透过肠黏膜进入机体的其他部位造成肠道损伤引发各类疾病,是人体肠道的第一道防线[13]。物理屏障主要通过细胞间的紧密连接复合构成,维持肠上皮细胞的完整性和渗透性[14]。化学屏障由胃肠道各种分泌物包括黏液、胃酸以及各种消化酶、溶菌酶等组成[15-16]。生物屏障是肠黏膜屏障的重要组成部分,由肠道微生物群附着在肠黏膜层上形成的一个动态稳定的微生物屏障[15]。免疫屏障由肠道相关淋巴组织及肠上皮固有层中的免疫细胞组成,如潘氏细胞、巨噬细胞、树突状细胞、淋巴细胞等,可分泌各种抗菌肽、IgG和细胞因子,维持肠道内稳态[17]。
1.3 肠道吸收和转运与体内外肠道模型
药物在胃肠道黏膜上皮细胞的吸收过程是药物在生物膜两侧的跨膜转运过程,药物的跨膜转运方式主要分为被动转运、转运体介导的主动转运和膜动转运等。口服药物在肠道的吸收不仅是简单的被动转运,还通过肠道上皮细胞的药物转运体来实现,其中,转运体参与的主动转运在药物吸收过程中起关键作用[18]。根据底物的转运方向,可以将转运体分为摄入型转运体和外排型转运体两大类,它们控制着肠黏膜屏障的通透性,影响了药物的生物利用度[19]。
为了研究肠道屏障功能及药物吸收特征,研究人员开发了各种体外和离体肠道吸收模型。将细胞外基质(ECM)包被肠上皮细胞置于Transwell培养装置中,常用于研究肠道屏障功能或药物吸收。但这种2D培养模式没有介质流动或施加机械应变,不能再现肠细胞和组织形态或重建其他关键的肠分化功能,肠绒毛无法分化,肠道分泌功能受到抑制[20]。为实现3D肠道细胞模型的建立,研究人员使用不同支架包埋细胞。Li等[21]使用胶原凝胶作为支架,将共培养的Caco-2/HT29-MTX单层细胞和两种基质细胞(成纤维细胞和免疫细胞)合并到胶原凝胶中,与Caco-2细胞的单层培养相比,构建的3D模型显示出更多的生理相关特征。研究表明,使用胶原凝胶作为支架的3D肠道模型可能成为研究肠道内药物转运的有前景的工具。但其也有一定的局限性,在长时间培养过程中,由于胶原蛋白降解,细胞穿透基质形成多层细胞,导致Caco-2细胞在胶原支架上的培养,绒毛高度缩短[22]。另外一些离体模型,如外翻囊模型[23]、Ussing腔模型[24]和InTESTineTM[25]在生理学上高度相关,但这些模型的吞吐量和寿命往往有限(最长可达6~8 h)。
2. 基于微流控芯片的肠道吸收模型
常规的肠道体外模型缺乏对组织结构的真实模拟、缺乏微生物群,以及肠道功能的复杂性,例如蠕动和流动。随着微流控技术的飞速发展,基于微流控的肠芯片成为了模拟人体胃肠道的有效途径。如图1所示,肠道微环境的关键因素包括肠道的3D绒毛结构、蠕动运动和肠屏障功能等[26]。为了真实地模拟人体肠道,肠芯片模型应能实现以下功能:①通过体外拉伸细胞培养膜来模拟蠕动样运动;②通过控制流体来再现肠道复杂的3D绒毛结构;③通过控制微流体的设计结构和材料的渗透性来产生生理氧梯度:④通过多细胞共培养的方式,研究肠道与其他组织或肠道-微生物之间的互作关系。
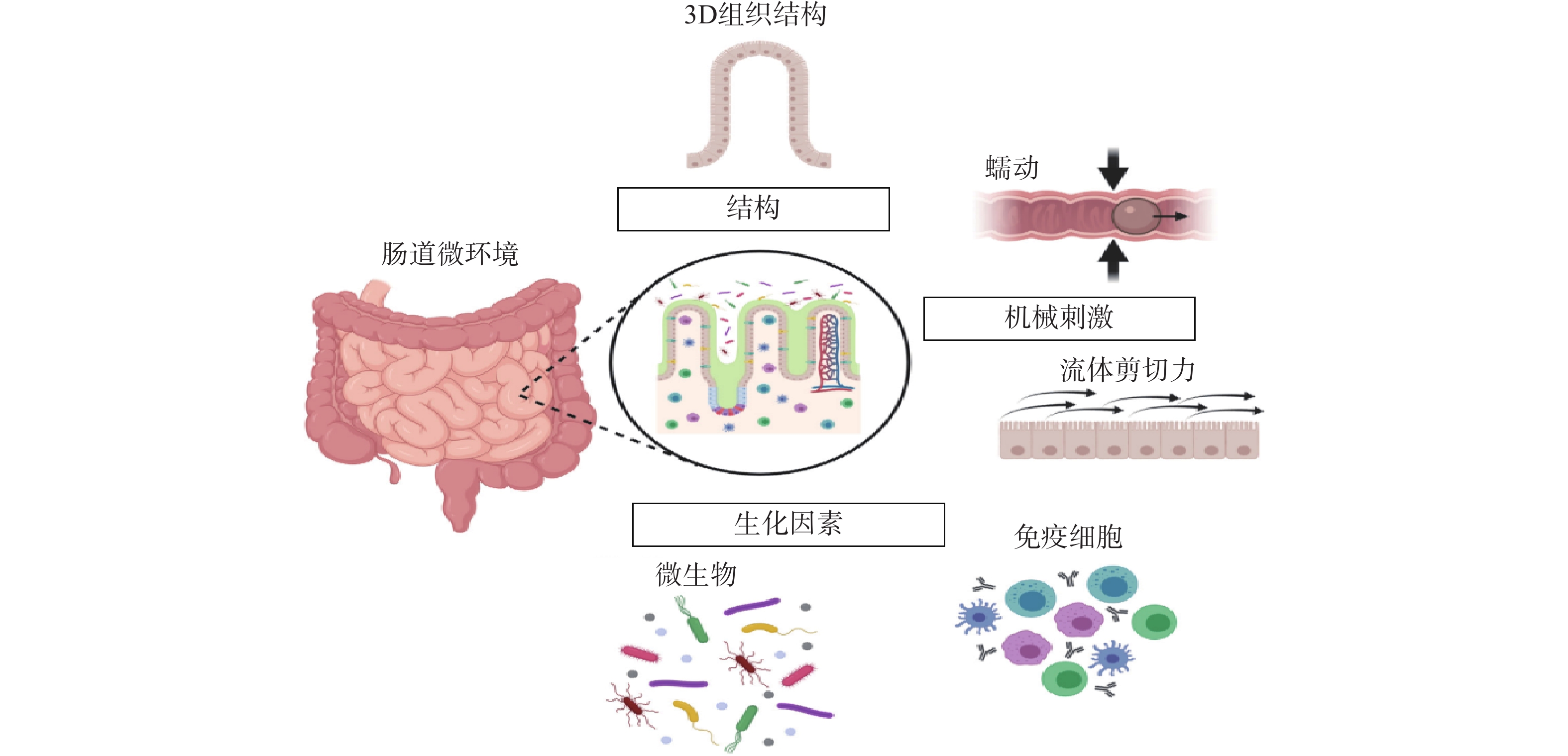 图 1 肠道微环境关键特征[26]
图 1 肠道微环境关键特征[26]2.1 肠道芯片设计
在过去的10年中,肠道芯片平台已经从简单的2D结构发展到包括更全面的功能,例如绒毛结构、肠道蠕动、氧梯度,甚至免疫系统。在肠道器官芯片发展的过程中,肠芯片的类型主要分为两种:二维夹膜肠芯片和三维绒毛肠芯片。
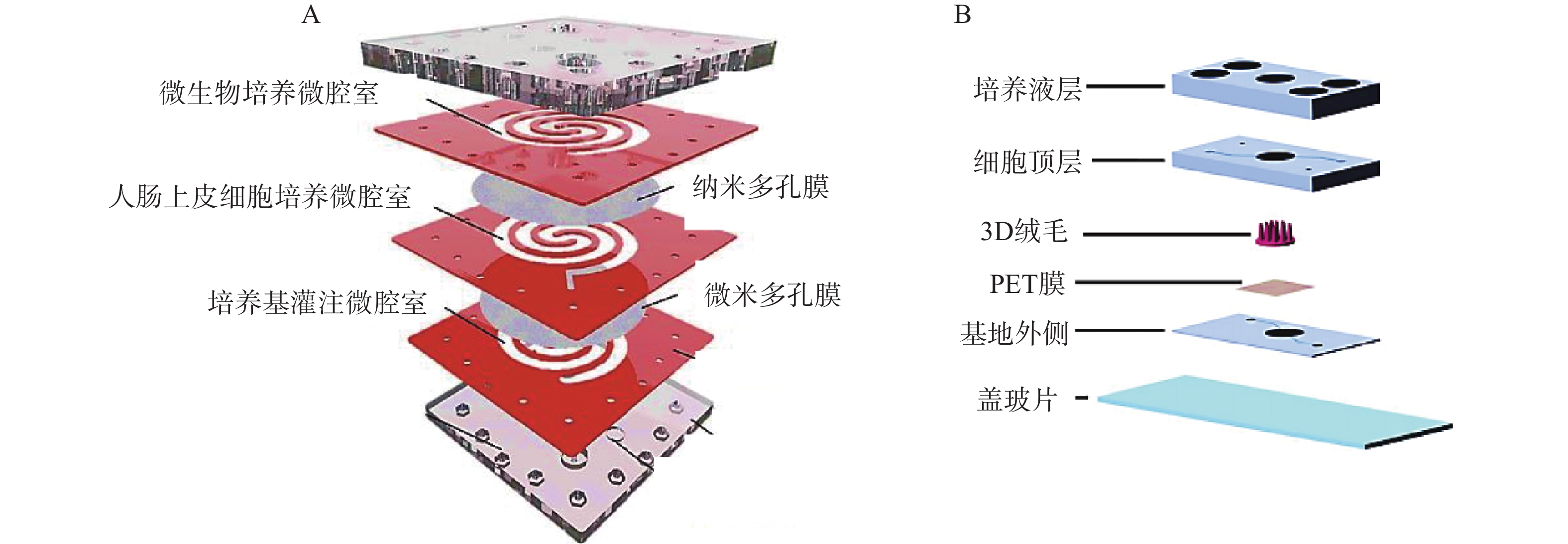
二维夹膜肠芯片最常见的设备结构包含两个通道(上部和下部),由半透膜(例如聚碳酸酯或聚酯材料)隔开,在膜上生长的肠上皮细胞形成单层上皮的顶端和基底外侧,这种简单的2D模型通常用于评估药物和营养吸收的体外药动学特性。Kimura等[27]开发了一种集成泵式循环装置和光学检测功能的微流控模型,该模型由被胶原蛋白涂层的半透膜分隔的两层通道组成,以抗癌药物环磷酰胺的渗透评价其吸收功能。Shah等[28]设计了一种基于微流控芯片的人类-微生物共培养模型“人与微生物交互系统”(HuMiX),见图2。培养基灌注微腔室与人肠上皮细胞培养微腔室之间用微米多孔膜(孔径1 μm)隔开,人肠上皮细胞培养微腔室与微生物培养微腔室之间用纳米多孔膜(孔径50 nm)隔开,每个微腔室有独立的进出口,该模型还集成了光电二极管用于监测溶解氧的浓度。2D肠道芯片模型可以模拟肠道细胞上的流体剪切应力,以减少对细胞和培养基的需求,但该模型仍缺乏模拟肠道组织关键特征的功能。
三维绒毛结构的实现对于构建体外肠道模型至关重要,肠道内的绒毛微结构不仅是肠上皮层的生理屏障,更重要的是增加了肠表面的吸收面积。虽然有报道称在平面基质上自发形成绒毛,但缺乏对绒毛尺寸和分布的控制,而且重复性差。微型3D支架的集成已经成为更好地再现人类肠道结构的解决方案。Shim等[29]植入了胶原蛋白支架,以重现肠道组织三维绒毛结构,绒毛高度为300 μm,绒毛间距为150 μm。3D条件下Caco-2细胞增殖良好,均能形成肠屏障。此外,将细胞置于灌注培养的3D培养条件下,可显著提高细胞的代谢活性。Costello等[30]利用激光雕刻翻模的技术制作了一种肠道芯片,在这种芯片中细胞依附于所制作的绒毛生长;但是激光雕刻在模具的制作中有一定局限性。激光雕刻利用激光垂直切割平面基底,制作出的模型多为柱状结构,较难制作出更为复杂的3D模型。张忆恒等[31]通过3D打印技术与表面微结构转移方法,成功地模拟了更为复杂的肠道绒毛。
2.2 流体控制
在肠道中,剪切力在细胞分化中起着重要作用,包括增强黏液产生、增加线粒体活性和提高药物吸收[32]。2D培养时细胞保持在静态条件下,动态参数不容易模拟。在微流控装置中,流体流动可以通过蠕动泵、注射器泵、重力或静水压力以及压力发生器产生,模拟体内液体流动的范围及其在细胞表面的相关剪切应力。与静态条件相比,在连续流动和循环应变下,Caco-2细胞经历细胞分化、极化、绒毛形成、屏障完整性维持、黏液产生等。GOC器件的剪切应力一般取值在0.01 ~ 0.06 dyn/cm2之间,大多数模型中的剪切应力是使用蠕动泵引入的,但这些装置体积庞大且吞吐量低。Tan等[33]用2个微型蠕动泵克服了低吞吐量的限制,每个泵有8个泵管路,允许流体通过16个微通道输送,通过测量微流控芯片中培养的Caco-2细胞氨肽酶活性评估其生长和分化速度,与第21天的静态培养的Transwell系统相比,微流控装置中的Caco-2细胞在第5天显示出更高的氨肽酶活性。尽管该系统具有简单、高通量的特点,但这些模型在重现定义的流速方面是有限的。Kim等[34]开发了一个具有流体流动和施加循环机械应变的肠芯片模型。该装置由两个微通道组成,两侧有两个空心腔室,在空心腔室中施加真空,使分离通道的多孔膜单向延伸。该研究发现,流体流动和周期性机械应变的结合导致了褶皱的形成,这些褶皱再现了肠绒毛的结构,并且该系统中使用的Caco-2细胞显示出极化柱状形态,大小与体内上皮细胞相似。
2.3 机械力刺激
在消化过程中,蠕动是由平滑肌与肠神经系统协同作用,在整个胃肠道内产生的食物的不自主的、周期性的推进。蠕动有助于食物消化、营养吸收和肠排空,但也对上皮产生剪切力和径向压力。研究表明,机械拉伸对于准确模拟人体肠道生理、允许细胞分化和防止细菌过度生长至关重要[35]。Jing等[36]提出并构建了一种基于循环变化流体压差原理的新型蠕动肠模型,通过使用多通道、计算机控制的气动泵同时实现了肠道微系统的流体流动和蠕动,考察了蠕动和流体流动对该装置肠上皮细胞生长和分化的影响。结果表明,微流体装置中的周期性蠕动加上流体流动显著促进了肠上皮细胞的增殖以及糖萼和微绒毛的分泌。此外,肠上皮细胞的屏障、吸收和代谢功能以及细胞分化也受到芯片上周期性蠕动和流体流动的影响。Fang等[37]开发另一款包含200个依次连接的横向微孔阵列芯片,通过调节微孔周围的气道内部气压,从而实现孔内类器官的周期性收缩与舒张,模拟肠道的蠕动。研究结果发现,在蠕动环境中长成的人结肠肿瘤类器官具有更均匀的尺寸分布,对该纳米胶束的摄入量显著降低。Grassart等[38]通过循环拉伸模拟肠道蠕动,研究蠕动状态是否会影响人类志贺菌在3D结肠上皮内的传染性。研究表明,与非机械刺激条件相比,拉伸力(蠕动)的应用显著提高了约50%的感染率,蠕动运动促进了细菌入侵。
2.4 氧气梯度产生
肠上皮富含含氧血液,对于增强绒毛的营养吸收和加速针对病原体的免疫反应至关重要。人体肠道是多种微生物群落的宿主,肠道微生物群在肠道的消化和吸收功能中发挥着重要作用[39]。HuMiX实现了肠道模型中氧气浓度梯度的变化,允许Caco-2细胞和厌氧菌之间的共培养,在体内重现转录、代谢和免疫特征[28]。Shin等[40]开发了一种缺氧-氧气接口(AOI芯片),将缺氧培养基从细菌生长的上通道灌注到肠细胞生长的下通道。实验结果表明,上皮细胞层的存在和管腔微通道中的流量依赖性调节对于在AOI芯片中产生稳态垂直氧梯度是必要且充分的。另一个包含高分辨率溶解氧监测的GOC模型是肠芯片,它有6个传感器盘,在模型的顶部和底部固定有氧淬灭荧光颗粒,允许实时监测氧水平。这种GOC模型有一个中央厌氧室,经常用饱和的5% CO2冲洗,维持上腔内低氧水平。使用这款厌氧肠道芯片,Jalili-Firoozinezhad等[41]也证明厌氧条件比好氧条件在生理上能保持更高的微生物多样性。表1概括了常见的肠道吸收芯片模型及其应用。
表 1 肠芯片模型的主要组成和应用细胞类型 共培养 膜材料 细胞外基质 剪切力 蠕动
(循环机械应变)氧气梯度 应用 Caco-2 否 聚对苯二甲酸(PET)膜 无 1 μl/h 否 否 肠道吸收的功能[42] Caco-2 鼠李糖乳杆菌GG (LGG) 聚碳酸酯(PC)膜 胶原蛋白 25 μl/h 否 是 宿主-微生物分子相互作用[28] Caco-2 人肠微血管内皮细胞 (HIMEC) 聚二甲基硅氧烷(PDMS)多孔膜 Ⅰ型胶原蛋白和Matrigel混合物 60 μl/h 否 是 概述疾病模型和对策药物筛选[41] Caco-2 LGG PDMS多孔膜 Ⅰ型胶原蛋白和Matrigel混合物 30 μl/h 10%;0.15 Hz 否 肠道的运输,吸收和毒性研究[34] Caco-2 大肠杆菌 PDMS膜 Ⅰ型胶原蛋白和Matrigel混合物 30 μl/h 10%;0.15 Hz 否 肠道-微生物相互作用和疾病模拟[35] Caco-2 人脐静脉内皮细胞 (HUVEC)、大肠杆菌细胞和巨噬细胞 PDMS膜 Ⅰ型胶原蛋白 60 μl/h 15%;0.17 Hz 否 模拟肠道炎症模型和药物筛选[43] 肠道活检类器官 HIMEC PDMS膜 Ⅰ型胶原蛋白和Matrigel混合物 60 μl/h 10%;0.2 Hz 否 模拟正常肠道生理学[44] 人十二指肠类器官(成人供体) HIMEC PDMS膜 Ⅳ型胶原蛋白和Matrigel混合物(上皮侧)、Ⅳ型胶原蛋白和纤连蛋白混合物(血管侧) 30 μl/h 10%;0.2 Hz 否 研究肠道代谢和药物转运[45] Caco-2 否 无 聚乙烯-醋酸乙
烯酯0.1 ml/min 否 否 高通量药物吸收分析和细菌-宿主相互作用的研究[30] 3. 肠道芯片模型的应用
3.1 肠炎模型的构建
肠炎是一种在发达国家和发展中国家都具有高发病率的疾病,炎症性肠病(IBD)已成为全球性问题,主要包括溃疡性结肠炎和克罗恩病两大类。研究人员发现通过添加细胞因子混合物,例如,白介素-1β、肿瘤坏死因子-α和干扰素γ[46-47],或通过与外周血单核细胞共培养可以在体外模拟肠道炎症[35]。
Kim等[35]在肠芯片中引入致病性大肠杆菌和人单核巨噬细胞构建了相应的肠炎病理模型,并且观察到黏液层损伤、屏障损伤及炎性因子大量表达等炎症反应。之后Shin等[48]又通过在肠腔引入葡聚糖硫酸钠(DSS),首次在体外构建了DSS肠炎损伤及恢复模型,利用该模型作者证明了氧化应激反应是炎症损伤的前提。研究发现蠕动的微流体模型可以重现在小鼠模型中相应的结肠炎,并能观察到的屏障完整性和绒毛结构的破坏。使用来自致病性大肠杆菌的脂多糖激活单核细胞,Caco-2细胞被诱导分泌促炎细胞因子,进而损害屏障完整性,从而模仿IBD病理学特征。此外,促炎信号可以促进中性粒细胞的募集,从而进一步加剧肠道损伤。重要的是,研究人员发现DSS暴露前给予益生菌可以维持肠道屏障,而在DSS后添加细菌时,肠道屏障功能会丧失[49]。这些结果表明,利用体外肠芯片建立肠炎病理模型,可以为肠炎病理机制研究及其治疗药物筛选提供更接近体内肠道环境的研究平台。
3.2 药物吸收和转运
与传统体外肠道模型相比,肠芯片具有高度还原人体肠道微环境、连续的液体流动和高通量筛选的优势[50]。Imura等[42]开发了一种基于微流控芯片的模拟肠道的系统,该芯片由载玻片、半透膜和PDMS组成。以荧光测定结果评价药物渗透性试验,结果显示环磷酰胺能渗透肠屏障,其渗透系数较高,而路西法黄不能在肠壁吸收,其渗透系数较低。这些结果与传统方法的结果一致,证明了该款芯片评估药物吸收的可行性。
Kulthong等[51]分别使用传统的Transwell(静态)和肠芯片(动态)模型,比较高渗透性化合物(安替比林、酮洛芬和地高辛)和低渗透性化合物(阿莫西林)的转运,并使用HPLC或LC-MS测定这些化合物在静态和动态条件下的转运结果。结果显示,相对于静态条件,肠芯片的药物摄取较低,其渗透性值与生物制药分类系(BCS)一致。同样,在接种Caco-2细胞的微流体装置中,几种化合物(姜黄素、甘露醇、葡聚糖、咖啡因和阿替洛尔)的吸收率与体内吸收的研究数据相当。
抗癌药物7-乙基-10-羟基喜树碱(SN-38)是伊立替康经羧酸酶转换后的活性代谢物,其抑制拓扑酶Ⅰ的活性远大于伊立替康,但其具有低水溶性和低跨黏膜通透性的缺点。研究人员发现将其合成为亲脂性前体药物能解决低口服生物利用度问题。Pocock等[52]开发了一款基于微流体的肠道芯片(IOAC)模型,该模型可用于研究亲脂性前药的结构-渗透性的关系(见图3)。IOAC模型利用外部机械力作用,诱导上皮细胞单层产生特异性分化,使细胞表面呈现微绒毛表达起伏形态的屏障功能,这比传统的Transwell模型更具生物相似性。用不同链长和不同分子位置的脂肪酸酯修饰SN-38,观察到SN-38前药溶解度与渗透性系数之间有良好的相关性。论证了模仿肠道上皮关键特征的IOAC 模型在筛选亲脂性前药方面具有显著潜力[52]。
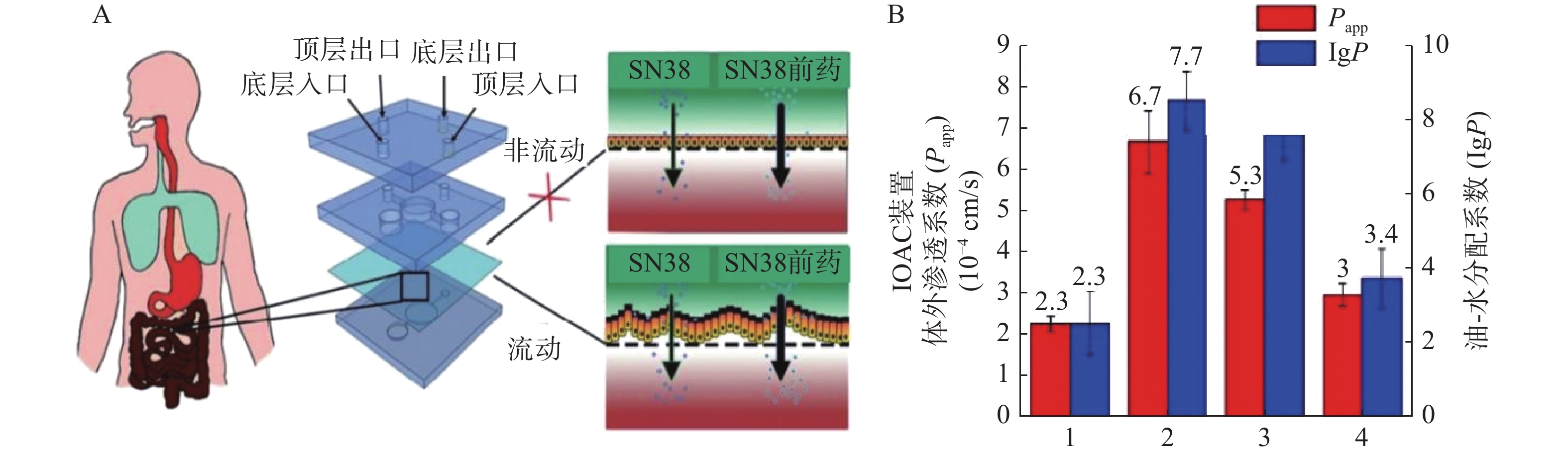 图 3 IOAC装置及对难溶SN38和前药的体外渗透系数与计算的油-水分配系数比较[52]A.IOAC装置示意图;B.SN38和前药的体外渗透性系数与计算的油-水分配系数比较;1. 7-乙基-10-羟基喜树碱;2. 7-乙基-10-羟基喜树碱-20-十一酸酯;3. 7-乙基-10-羟基喜树碱-10-十一酸酯;4. 7-乙基-10-羟基喜树碱-20-丙酸酯
图 3 IOAC装置及对难溶SN38和前药的体外渗透系数与计算的油-水分配系数比较[52]A.IOAC装置示意图;B.SN38和前药的体外渗透性系数与计算的油-水分配系数比较;1. 7-乙基-10-羟基喜树碱;2. 7-乙基-10-羟基喜树碱-20-十一酸酯;3. 7-乙基-10-羟基喜树碱-10-十一酸酯;4. 7-乙基-10-羟基喜树碱-20-丙酸酯4. 结论和展望
近年来,肠道芯片模型在芯片设计、微环境、微流体操控和细胞培养技术方面已经取得了重大进展,为胃肠道疾病机制研究和个体化治疗的发展提供了新的模型。但该技术本身仍然面临许多挑战。
肠上皮细胞的来源对于肠芯片的研究至关重要,Caco-2是目前应用最广泛的模拟肠上皮屏障的细胞系,但Caco-2细胞缺乏黏液生成层,很难控制其分化[53]。此外,Caco-2细胞表现出与人类肠道组织不同的转运蛋白表达[54]。因此,肠芯片还需要进一步研究,以确保上皮细胞系的代谢和转运蛋白活性与在体内观察到的相似。尽管微流控肠芯片模型模拟了人类肠道的许多不同表型和反应,但缺乏在某些疾病中发挥重要作用的特征。例如,平滑肌细胞表达Toll样受体,并且可以通过调节神经胶质源性神经营养因子的产生来调节神经元的完整性。因此,未来的肠道芯片模型构建中应考虑更多因素,例如肌肉和神经系统细胞[20],使得模型具有更多的肠道特征和功能,更接近真实的生理环境。
肠芯片研究的另一个挑战是材料的选用。尽管PDMS在微流控器官装置制备方面具有明显的优势,但PDMS可能吸附介质中存在的小分子、药物或其他荧光标记物,从而降低溶质分子浓度的重现性[55]。为了克服这一点,PDMS及其替代聚合物(例如聚氨酯、苯乙烯嵌段共聚物)的表面改性或基于ECM的材料更适用于预测药物生物利用度或吸收的研究[20]。目前,水凝胶广泛应用于肠道微流控模型,可以提供类似于体内细胞-细胞外基质相互作用的机械和生化环境,促进类组织结构的形成[55]。但其同时存在一些问题,如不稳定、易降解等。因此在未来的肠芯片研究中,寻找开发更优的PDMS替代材料也是非常有必要的。
-
表 1 不同光质对药用植物SMs的影响
科名 拉丁名 中文名 光质 光强 作用时间 SMs影响 类型 参考文献 百合科 Fritillaria cirrhosa 川贝母 R
FR56 μmol/ (m2·s) 16 h
90 d异甾体类生物碱↑ 生物碱类 [38] 唇形科 Ocimum basilicum 罗勒 B 40~50 μmol/ (m2·s) 24 h
28 d迷迭香酸↑
丁香酸↑
总酚↑酚类 [25] 唇形科 Salvia miltiorrhiza 丹参 B
R300 μmol/ (m2·s) 16 h
20 d丹酚酸B↑ 酚类 [40] 豆科 Scutellaria baicalensis 黄芩 W 90 μmol/ (m2·s) 16 h
14 d黄芩苷↑
汉黄芩苷↑
黄酮类↑黄酮类 [41] 豆科 Astragalus membranaceus 黄芪 B
Y透光率85% 120 d 总皂苷↑
总黄酮↑萜类
黄酮类[42] 豆科 Glycyrrhiza uralensis 甘草 UVB 1.43 W/m2
0.43 W/m23 d
15 d甘草甜素↑ 萜类 [17] 红豆杉科 Taxus cuspidata 东北红豆杉 R
B
G40~50 μmol/ (m2·s) 15 d 总紫杉烷↑ 萜类 [43] 红豆杉科 Taxus cuspidata 东北红豆杉 UVB 3 W/m2 12 h 紫杉醇↑
类黄酮↑萜类
黄酮类[15] 胡桃科 Cyclocarya paliurus 青钱柳 B
G(800 ± 50) μmol/ (m2·s) 12 h
60 d山柰酚↑
异槲皮苷↑
槲皮素↑
总黄酮↑黄酮类 [36] 葫芦科 Gynostemma pentaphyllum 绞股蓝 B
R
G1500~2 000 Lx 12 h
60 d总黄酮↓ 黄酮类 [30] 夹竹桃科 Catharanthus roseus 长春花 UVB 1.26 W/m2 5 min 长春碱↑
长春新碱↑生物碱类 [14] 姜科 Curcuma longa 姜黄 G
FR280 μmol/ (m2·s) 13 h
60 d姜黄素类化合物↓ 黄酮类 [33] 金缕梅科 Loropetalum chinense 红花檵木 B+UVA
B60 μmol/ (m2·s) 12 h
15 d、30 d花色素苷↑
总黄酮↑黄酮类 [11] 景天科 Rhodiola rosea 红景天 B 25~27 μmol/ (m2·s) 16 h
30 d红景天苷↑
总黄酮↑
总多酚↑酚类
黄酮类[22] 菊科 Artemisia annua 黄花蒿 W
B(200 ± 10) μmol/ (m2·s) 16 h
7 d青蒿素↑
青蒿酸↑萜类 [31] 菊科 Eclipta prostrata 墨旱莲 R 40~50 μmol/ (m2·s) 24 h
28 d酚类↑
黄酮类↑酚类
黄酮类[24] 菊科 Silybum marianum 水飞蓟 R 40~50 μmol/ (m2·s) 24 h
28 d总水飞蓟素↑
总酚↑
总黄酮↑酚类
黄酮类[26] 菊科 Atractylodes lancea 茅苍术 9R1B 100 μmol/ (m2·s) 180 d 挥发油↑ 萜类 [44] 菊科 Artemisia annua 黄花蒿 UVB 1.5 μmol/ (m2·s) 4 h
9 d青蒿素↑
类黄酮↑萜类
黄酮类[16] 兰科 Anoectochilus roxburghii 金线莲 R1B1 (16± 1) μmol/ (m2·s) 12 h
120 d酚类↑
黄酮类↑酚类
黄酮类[32] 兰科 Arundina graminifolia 竹叶兰 1R3B
B45 μmol/ (m2·s) 12 h
40 d总酚↑
类黄酮↑酚类
黄酮类[45] 藜芦科 Paris polyphylla 陕产重楼 B 80 μmol/ (m2·s) 12 h
30 d总皂昔↑ 萜类 [46] 蓼科 Reynoutria japonica 虎杖 B 3000 Lx 30 d 白藜芦醇↑ 酚类 [47] 蓼科 Fagopyrum dibotrys 金荞麦 UVC 5.4 KJ/m2 30 min 总黄酮↑
多酚类↑酚类
黄酮类[20] 蓼科 Reynoutria japonica Houtt. 虎杖 UVC 6 W/m2 10 min 白藜芦醇↑ 酚类 [21] 葡萄科 Tetrastigma hemsleyanum 三叶青 B 1630~1660 Lx 12 h
30~45 d总黄酮↑ 黄酮类 [48] 茄科 Withania somnifera 睡茄 UVB 3.6 KJ/ (m2·d) 4 h 生物碱↑
黄酮类↑生物碱类
黄酮类[18] 茄科 Capsicum annuum 辣椒 UVB 80 W/m2 4 h 黄酮类↑ 黄酮类 [19] 秋海棠科 Gynura bicolo 紫背天葵 7R2B1Y (350±5) μmol/ (m2·s) 16 h
60 d总酚↑
类黄酮↑
花青素↑酚类
黄酮类[49] 十字花科 Brassica rapa 津田芜菁 UVA 3 W/m2 24 h 花青素↑ 黄酮类 [12] 石蒜科 Lycoris radiata 石蒜 B 50 μmol/ (m2·s) 12 h
30 d生物碱↑ 生物碱类 [50] 天南星科 Pinellia ternata 半夏 B 40 μmol/ (m2·s) 12 h
45 d总生物碱↑ 生物碱类 [28] 五加科 Eleutherococcus senticosus 刺五加 B
R透光率100% 20 d 总黄酮↓ 黄酮类 [51] 小檗科 Epimedium
pseudowushanense拟巫山淫羊藿 Y (18.2 ± 2.5) μmol/ (m2·s) 16 h
30 d黄酮类↑ 黄酮类 [34] 小檗科 Epimedium
pseudowushanense拟巫山淫羊藿 B
Y
R(18.2 ± 2.5) μmol/ (m2·s) 16 h
30 d淫羊藿苷类黄酮↑ 黄酮类 [29] 玄参科 Scrophularia kakudensis 丹东玄参 R 50 μmol/ (m2·s) 16 h
28 d总黄酮↑
总多酚↑酚类
黄酮类[23] 远志科 Polygala tenuifolia 远志 B 100 μmol/ (m2·s) 12 h
30 d总酚↑
总黄酮↑酚类
黄酮类[27] 注:B.蓝光;R.红光;Y.黄光;G.绿光;FR.红外光;UV.紫外线;↑表示SMs含量增加;↓表示SMs含量减少 表 2 不同光强对药用植物SMs的影响
科 拉丁名 物种 生态习性 光质 不同光强 最适光强 SMs 参考文献 菊科 Aster indicus 马兰 喜阳 自然光 100%、62.29%、35.17% 叶中呈下降趋势
根中呈上升趋势
茎中62.29%最高黄酮类 [57] 菊科 Viola philippica 紫花地丁 中性 自然光 100%、80%、50%、35%、5% 35%~100%增加
但无显著性差异黄酮类
香豆素[58] 菊科 Chrysanthemum indicum 野菊 喜阳 自然光 100%、80%、60%、40%、20% 呈下降趋势60%较好 总黄酮
蒙花苷
木犀草苷
绿原酸[59] 蓝果树科 Camptotheca acuminata 喜树 喜阳 白光 800、500、300 μmol/ (m2·s) 300 μmol/ (m2·s) 喜树碱 [60] 藜芦科 Paris polyphylla 滇重楼 喜阴 黄光 100、75、50、25 μmol/(m2·s) 75~100 μmol/ (m2·s) 皂苷类 [55] 藜芦科 Paris polyphylla 滇重楼 喜阴 蓝光 200、150、100、50 μmol/ (m2·s) 100~150 μmol/ (m2·s) 皂苷类 [56] 马兜铃科 Asarum heterotropoides 北细辛 喜阴 自然光 100%、50%、28%、12% 50% 挥发油
细辛脂素[61] 木樨科 Syringa oblata 紫丁香 喜阳 自然光 100%、50%~60%、25%~35% 50%~60% 芦丁 [62] 茜草科 Uncaria rhynchophylla 钩藤 喜阳 自然光 100%、70%~75%、
30%~35%、5%~10%前期70%~75%
后期30%~35%生物碱 [53] 忍冬科 Lonicera japonica 金银花 喜阳 自然光 100%、50%、25% 100% 木犀草苷 [52] 伞形科 Changium smyrnioides 明党参 中性 自然光 100%、60.54%、44.84%、31.39%、10.56% 31.39%~60.54% 甘露醇
胆碱[63] 五加科 Panax notoginseng 三七 喜阴 自然光 32%、16%、8%、4%、2% 16% 总皂苷 [54] 远志科 Polygala tenuifolia 远志 喜阳 白光 500、300、100 μmol/ (m2·s) 无显著性差异 总黄酮
总酚[27] 表 3 不同光周期对药用植物SMs的影响
科 拉丁名 物种 光强 不同光照时长 最适光照时长 SMs 参考文献 禾本科 Achnatherum inebrians 醉马草 2500 Lx 16、14、12、8 h/d 12 h/d 麦角酰胺
麦角新碱[66] 金丝桃科 Hypericum perforatum 贯叶连翘 50 μmol/(m2·s) 16、0 h/d 16、0 h/d 酚酸、黄酮醇、氧杂蒽酮(16)
黄烷-3-醇(暗培养)[65] 落葵科 Basella alba 落葵 45 μmol/(m2·s) 24、16、0 h/d 16 h/d 总酚
黄酮类[68] 无患子科 Dimocarpus longan 龙眼 36 μmol/(m2·s) 24、18、12、6、0 h/d 24 h/d
6 h/d类胡萝卜素(24)
类黄酮(6)[64] 鸢尾科 Crocus sativus 西红花 (83±8) μmol/(m2·s) 14、12、10、8 h/d 8 h/d 西红花苷(无影响) [67] -
[1] CRAGG G M, NEWMAN D J. Plants as a source of anti-cancer agents[J]. J Ethnopharmacol, 2005, 100(1-2):72-79. doi: 10.1016/j.jep.2005.05.011 [2] 张小冰. 植物次生代谢产物的功能及应用概述[J]. 生物学教学, 2013, 38(11):7-10. [3] APPOLLONI E, PENNISI G, ZAULI I, et al. Beyond vegetables: effects of indoor LED light on specialized metabolite biosynthesis in medicinal and aromatic plants, edible flowers, and microgreens[J]. J Sci Food Agric, 2022, 102(2):472-487. doi: 10.1002/jsfa.11513 [4] HASHIM M, AHMAD B, DROUET S, et al. Comparative effects of different light sources on the production of key secondary metabolites in plants in vitro cultures[J]. Plants, 2021, 10(8):1521. doi: 10.3390/plants10081521 [5] LI Y Q, KONG D X, FU Y, et al. The effect of developmental and environmental factors on secondary metabolites in medicinal plants[J]. Plant Physiol Biochem, 2020, 148:80-89. doi: 10.1016/j.plaphy.2020.01.006 [6] LOI M, VILLANI A, PACIOLLA F, et al. Challenges and opportunities of light-emitting diode (LED) as key to modulate antioxidant compounds in plants. A review[J]. Antioxidants, 2020, 10(1):42. doi: 10.3390/antiox10010042 [7] 龙家焕, 浦敏, 黄志午, 等. 光谱调控植物生长发育的研究进展[J]. 照明工程学报, 2018, 29(4):8-16. doi: 10.3969/j.issn.1004-440X.2018.04.002 [8] ZHANG S C, ZHANG L, ZOU H Y, et al. Effects of light on secondary metabolite biosynthesis in medicinal plants[J]. Front Plant Sci, 2021, 12:781236. doi: 10.3389/fpls.2021.781236 [9] URBAN L, CHARLES F, DE MIRANDA M R A, et al. Understanding the physiological effects of UV-C light and exploiting its agronomic potential before and after harvest[J]. Plant Physiol Biochem, 2016, 105:1-11. doi: 10.1016/j.plaphy.2016.04.004 [10] 刘恺媛, 王茂良, 辛海波, 等. 植物花青素合成与调控研究进展[J]. 中国农学通报, 2021, 37(14):41-51. doi: 10.11924/j.issn.1000-6850.casb2020-0390 [11] 郭佩瑶, 邓斯颖, 张艺帆, 等. 不同光质对红花檵木愈伤组织生长及黄酮类物质含量的影响[J]. 西北植物学报, 2022, 42(1):118-126. doi: 10.7606/j.issn.1000-4025.2022.01.0118 [12] 王宇. 短波长光质诱导津田芜菁花青素合成相关基因差异表达机制研究[D]. 哈尔滨: 东北林业大学, 2013. [13] TAKSHAK S, AGRAWAL S. Defense potential of secondary metabolites in medicinal plants under UV-B stress[J]. J Photochem Photobiol B, 2019, 193:51-88. doi: 10.1016/j.jphotobiol.2019.02.002 [14] RAMANI S,JAYABASKARAN C.Enhanced catharanthine and vindoline production in suspension cultures of Catharanthus roseus by ultraviolet-B light[J].J Mol Signal,2008,25:3:9. [15] JIAO J, XU X J, LU Y, et al. Identification of genes associated with biosynthesis of bioactive flavonoids and taxoids in Taxus cuspidata Sieb. et Zucc. plantlets exposed to UV-B radiation[J]. Gene, 2022, 823:146384. doi: 10.1016/j.gene.2022.146384 [16] LI Y P, QIN W, FU X Q, et al. Transcriptomic analysis reveals the parallel transcriptional regulation of UV-B-induced artemisinin and flavonoid accumulation in Artemisia annua L[J]. Plant Physiol Biochem, 2021, 163:189-200. doi: 10.1016/j.plaphy.2021.03.052 [17] AFREEN F, ZOBAYED S M A, KOZAI T. Spectral quality and UV-B stress stimulate glycyrrhizin concentration of Glycyrrhiza uralensis in hydroponic and pot system[J]. Plant Physiol Biochem, 2005, 43(12):1074-1081. doi: 10.1016/j.plaphy.2005.11.005 [18] TAKSHAK S, AGRAWAL S B. Secondary metabolites and phenylpropanoid pathway enzymes as influenced under supplemental ultraviolet-B radiation in Withania somnifera Dunal, an indigenous medicinal plant[J]. J Photochem Photobiol B, 2014, 140:332-343. doi: 10.1016/j.jphotobiol.2014.08.011 [19] RODRÍGUEZ-CALZADA T, QIAN M J, STRID Å, et al. Effect of UV-B radiation on morphology, phenolic compound production, gene expression, and subsequent drought stress responses in chili pepper ( Capsicum annuum L. )[J]. Plant Physiol Biochem, 2019, 134:94-102. doi: 10.1016/j.plaphy.2018.06.025 [20] ABBASI B H, KHAN T, KHURSHID R, et al. UV-C mediated accumulation of pharmacologically significant phytochemicals under light regimes in in vitro culture of Fagonia indica (L. )[J]. Sci Rep, 2021, 11:679. doi: 10.1038/s41598-020-79896-6 [21] LIU Z Y, XU J X, WU X, et al. Molecular analysis of UV-C induced resveratrol accumulation in Polygonum cuspidatum leaves[J]. Int J Mol Sci, 2019, 20(24):6185. doi: 10.3390/ijms20246185 [22] KAPOOR S, RAGHUVANSHI R, BHARDWAJ P, et al. Influence of light quality on growth, secondary metabolites production and antioxidant activity in callus culture of Rhodiola imbricata Edgew[J]. J Photochem Photobiol B, 2018, 183:258-265. doi: 10.1016/j.jphotobiol.2018.04.018 [23] MANIVANNAN A, SOUNDARARAJAN P, PARK Y G, et al. Physiological and proteomic insights into red and blue light-mediated enhancement of in vitro growth in Scrophularia kakudensis—a potential medicinal plant[J]. Front Plant Sci, 2021, 11:607007. doi: 10.3389/fpls.2020.607007 [24] KHURSHID R, ULLAH M A, TUNGMUNNITHUM D, et al. Lights triggered differential accumulation of antioxidant and antidiabetic secondary metabolites in callus culture of Eclipta alba L[J]. PLoS One, 2020, 15(6):e0233963. doi: 10.1371/journal.pone.0233963 [25] NADEEM M, ABBASI B H, YOUNAS M, et al. LED-enhanced biosynthesis of biologically active ingredients in callus cultures of Ocimum basilicum[J]. J Photochem Photobiol B, 2019, 190:172-178. doi: 10.1016/j.jphotobiol.2018.09.011 [26] YOUNAS M, DROUET S, NADEEM M, et al. Differential accumulation of silymarin induced by exposure of Silybum marianum L. callus cultures to several spectres of monochromatic lights[J]. J Photochem Photobiol B, 2018, 184:61-70. doi: 10.1016/j.jphotobiol.2018.05.018 [27] 彭亮, 赵停, 杨冰月, 等. 不同光质光强对远志生长和相关酶活性及成分的影响[J]. 中草药, 2018, 49(21):5004-5009. doi: 10.7501/j.issn.0253-2670.2018.21.008 [28] 胡龙娇. 诱导子及光质对半夏生长与次生代谢影响研究[D]. 南京: 南京农业大学, 2013. [29] 李小明, 潘俊倩, 落艳娇, 等. 不同光强下光质对拟巫山淫羊藿生长发育和淫羊藿苷类黄酮含量的影响[J]. 中国中药杂志, 2020, 45(11):2502-2508. doi: 10.19540/j.cnki.cjcmm.20200329.113 [30] 李馨芸. 光质对绞股蓝生长、光合作用及次生代谢产物积累的影响[D]. 吉首: 吉首大学, 2012. [31] SANKHUAN D, NIRAMOLYANUN G, KANGWANRANGSAN N, et al. Variation in terpenoids in leaves of Artemisia annua grown under different LED spectra resulting in diverse antimalarial activities against Plasmodium falciparum[J]. BMC Plant Biol, 2022, 22(1):128. doi: 10.1186/s12870-022-03528-6 [32] 李琪, 吴栋, 吴延妮, 等. LED光质对两种金线莲组培苗生理特征和代谢物质的影响[J]. 南昌大学学报(理科版), 2021, 45(1):56-62. [33] 刘建福, 王明元, 唐源江, 等. 光质对姜黄生理特性及根茎次生代谢的影响[J]. 植物生理学报, 2014, 50(12):1871-1879. [34] YANG Q R, PAN J Q, SHEN G A, et al. Yellow light promotes the growth and accumulation of bioactive flavonoids in Epimedium pseudowushanense[J]. J Photochem Photobiol B, 2019, 197:111550. doi: 10.1016/j.jphotobiol.2019.111550 [35] HORMAETXE K, BECERRIL J M, FLECK I, et al. Functional role of red (retro)-carotenoids as passive light filters in the leaves of Buxus sempervirens L. : increased protection of photosynthetic tissues?[J]. J Exp Bot, 2005, 56(420):2629-2636. doi: 10.1093/jxb/eri255 [36] LIU Y, FANG S Z, YANG W X, et al. Light quality affects flavonoid production and related gene expression in Cyclocarya paliurus[J]. J Photochem Photobiol B, 2018, 179:66-73. doi: 10.1016/j.jphotobiol.2018.01.002 [37] PATEL D, BASU M, HAYES S, et al. Temperature-dependent shade avoidance involves the receptor-like kinase ERECTA[J]. Plant J, 2013, 73(6):980-992. doi: 10.1111/tpj.12088 [38] CHEN C C, LEE M R, WU C R, et al. LED lights affecting morphogenesis and isosteroidal alkaloid contents in Fritillaria cirrhosa D. don-an important Chinese medicinal herb[J]. Plants, 2020, 9(10):1351. doi: 10.3390/plants9101351 [39] LIVADARIU O, MAXIMILIAN C, RAHMANIFAR B, et al. LED technology applied to plant development for promoting the accumulation of bioactive compounds: a review[J]. Plants, 2023, 12(5):1075. doi: 10.3390/plants12051075 [40] 梁宗锁, 李倩, 徐文晖. 不同光质对丹参生长及有效成分积累和相关酶活性的影响[J]. 中国中药杂志, 2012, 37(14):2055-2060. [41] YEO H J, PARK C H, PARK S Y, et al. Metabolic analysis of root, stem, and leaf of Scutellaria baicalensis plantlets treated with different LED lights[J]. Plants, 2021, 10(5):940. doi: 10.3390/plants10050940 [42] 胡瑜辉, 杨振宇, 宋诗娟, 等. 不同光质对黄芪抗氧化酶活性及产量和品质的影响[J]. 山西农业科学, 2021, 49(10):1173-1178. doi: 10.3969/j.issn.1002-2481.2021.10.07 [43] 王馨. 不同光质对东北红豆杉愈伤组织中紫杉烷类成分合成代谢影响与初步机制解析[D]. 哈尔滨: 东北林业大学, 2020. [44] 李强, 姚霞, 孙楷, 等. 不同光质对茅苍术生长、抗氧化酶活性及挥发油含量的影响[J]. 中国实验方剂学杂志, 2018, 24(10):27-32. [45] 郭阿瑾, 杨凤玺, 王亚琴, 等. 不同光质LED对竹叶兰酚类物质及抗氧化性的影响[J]. 热带作物学报, 2018, 39(7):1318-1323. doi: 10.3969/j.issn.1000-2561.2018.07.009 [46] 李铂, 唐志书, 王楠, 等. 不同LED光质对陕产重楼生理特性和成分积累的影响[J]. 中国现代中药, 2019, 21(10):1386-1391. [47] 肖林霞, 卢其能, 李润根. 光质、光强和外植体对虎杖愈伤组织增殖及白藜芦醇积累的影响[J]. 江苏农业科学, 2016, 44(11):60-63. [48] 韩敏琪, 徐琳煜, 白岩, 等. 光质对三叶崖爬藤光合特性和总黄酮含量调控的研究[J]. 植物生理学报, 2019, 55(6):883-890. [49] 巩彪, 靳志勇, 刘娜, 等. 光质对紫背天葵生长、次生代谢和抗氧化胁迫的影响[J]. 应用生态学报, 2016, 27(11):3577-3584. [50] 李青竹, 蔡友铭, 杨贞, 等. 不同LED光质对石蒜幼苗生长、生理和生物碱积累的影响[J]. 应用与环境生物学报, 2019, 25(6):1414-1419. [51] 宋莹. 不同光质对刺五加生理代谢影响[D]. 哈尔滨: 东北林业大学, 2021. [52] FANG H L, QI X W, LI Y M, et al. De novo transcriptomic analysis of light-induced flavonoid pathway, transcription factors in the flower buds of Lonicera japonica[J]. Trees, 2020, 34(1):267-283. doi: 10.1007/s00468-019-01916-4 [53] WANG J J, JI L L, DENG X H, et al. Effects of light intensity on growth and content of active components of Uncaria rhynchophyll[J]. China J Chin Mater Med, 2019, 44(23):5118-5123. [54] 陈黎明, 罗美佳, 夏鹏国, 等. 光强对三七生长、光合特性及有效成分积累的影响[J]. 时珍国医国药, 2016, 27(12):3004-3006. [55] 张勤涛, 梁社往, 曹嘉芮, 等. 不同光强LED黄光对滇重楼生长、光合特性和皂苷含量的影响[J]. 现代食品科技, 2018, 34(3):178-183. [56] 曹嘉芮, 梁社往, 张勤涛, 等. 不同光强LED蓝光对滇重楼生长、光合特性及皂苷累积的影响[J]. 中国农学通报, 2019, 35(14):77-81. doi: 10.11924/j.issn.1000-6850.casb18040090 [57] 李中林, 郭开秀, 周守标, 等. 光强对马兰形态、生理及黄酮类化合物含量的影响[J]. 草业学报, 2014, 23(4):162-170. [58] 严晓芦, 郭巧生, 史红专, 等. 光照强度对紫花地丁生长、生理及化学成分的影响[J]. 中国中药杂志, 2019, 44(6):1119-1125. [59] 禤汉美. 光强对野菊生长及药材品质的影响[D]. 南京: 南京农业大学, 2020. [60] 周昕, 汪贵斌, 刘琳, 等. 光强对喜树幼苗生长及喜树碱含量的影响[J]. 南京林业大学学报(自然科学版), 2016, 40(3):9-14. [61] 方阔, 马海琴, 王振兴, 等. 不同光强下北细辛的光合特性及有效成分差异研究[J]. 中国中药杂志, 2019, 44(13):2753-2761. [62] LIU Y Y, CHEN X R, WANG J P, et al. Transcriptomic analysis reveals flavonoid biosynthesis of Syringa oblata Lindl. in response to different light intensity[J]. BMC Plant Biol, 2019, 19(1):487. doi: 10.1186/s12870-019-2100-8 [63] WANG C L, GUO Q S, ZHU Z B, et al. Physiological characteristics, dry matter, and active component accumulation patterns of Changium smyrnioides in response to a light intensity gradient[J]. Pharm Biol, 2017, 55(1):581-589. doi: 10.1080/13880209.2016.1263345 [64] 朱宁, 焦楠, 张舒婷, 等. 光周期对龙眼胚性愈伤组织类黄酮类胡萝卜素含量及合成相关基因的表达影响[J]. 园艺与种苗, 2019, 39(11):1-5. [65] TUSEVSKI O, PETRESKA STANOEVA J, STEFOVA M, et al. Phenolic profile of dark-grown and photoperiod-exposed Hypericum perforatum L. Hairy root cultures[J]. Sci World J, 2013, 2013:602752. [66] 刘静, 万志文, 陈振江, 等. 光照强度和光周期对醉马草内生真菌共生体幼苗生长和生物碱积累的影响[J]. 西北植物学报, 2017, 37(11):2238-2246. doi: 10.7606/j.issn.1000-4025.2017.11.2238 [67] 朱娇, 张永春, 周琳, 等. 不同光周期对西红花开花和花丝品质的效应比较[J]. 西北植物学报, 2021, 41(3):431-438. doi: 10.7606/j.issn.1000-4025.2021.03.0431 [68] KUMAR S S, ARYA M, MAHADEVAPPA P, et al. Influence of photoperiod on growth, bioactive compounds and antioxidant activity in callus cultures of Basella rubra L[J]. J Photochem Photobiol B, 2020, 209:111937. doi: 10.1016/j.jphotobiol.2020.111937 [69] HAO X, ZHONG Y, NïTZMANN HW, et al. Light-induced artemisinin biosynthesis is regulated by the bZIP transcription factor AaHY5 in Artemisia annua[J]. Plant Cell Physiol, 2019, 60(8):1747-1760. doi: 10.1093/pcp/pcz084 [70] FU X Q, PENG B W, HASSANI D, et al. AaWRKY9 contributes to light- and jasmonate-mediated to regulate the biosynthesis of artemisinin in Artemisia annua[J]. New Phytol, 2021, 231(5):1858-1874. doi: 10.1111/nph.17453 -





 下载:
下载:

 下载:
下载:




