-
METRNL(Metrn-like)蛋白是近年来发现和证实的新的分泌蛋白[1-2],其与METRN构成了一个两蛋白的新蛋白家族。虽然最初的研究表明,该家族蛋白均可促进神经细胞轴突的生长[2-4],但两者表达差异很大,METRN在中枢神经系统中高特异性表达,而METRNL则在全身较为广泛地表达,提示其可能具有更广泛的生理功能[1-2, 5-6]。
最近的研究发现,METRNL对代谢具有重要的调节作用。其在脂肪组织中表达较高,特别是皮下脂肪,被认为是一种新的脂肪因子[1]。研究发现,该蛋白可以调节脂肪细胞的分化,脂肪细胞中METRNL过表达可提高全身胰岛素敏感性,减少脂肪炎症扩大脂肪细胞的体积等[7]。也有研究发现,METRNL可以在运动后由肌肉组织增加分泌,促进脂肪组织棕色化,从而提高代谢率,减轻体重和改善胰岛素敏感性[8]。这些研究提示,METRNL可能与提高胰岛素敏感性相关。
噻唑烷二酮类药物,如罗格列酮,可以通过激动PPARγ受体,提高胰岛素增敏性,被称为胰岛素增敏剂。但是这类药物与METRNL蛋白之间的关系,至今尚不清楚。我们前期的研究发现,白色脂肪组织中METRNL过表达可以提高PPARγ的表达,促进脂肪重构,降低白色脂肪炎症,但是激动PPARγ对METRNL表达的影响尚未有报道。
本研究拟通过高脂饮食(HFD)诱导的胰岛素抵抗小鼠模型,检测血液METRNL的浓度变化;通过给予胰岛素增敏剂罗格列酮治疗,构建胰岛素增敏动物模型,检测血液中METRNL的水平变化,从而明确激动PPARγ对血液METRNL水平影响,通过实时定量PCR检测不同组织中METRNL的表达,明确PPARγ通过何种组织调控METRNL的表达与血液浓度。
-
12周龄的雄性C57BL/6小鼠与小鼠饲料,均购自上海斯莱克实验动物有限公司。为检测胰岛素抵抗对METRNL表达的影响,分两组小鼠,每组8只,分别给予正常饮食(NCD)和HFD,均饲养4个月;为了检测胰岛素增敏对于METRNL表达的影响,分两组小鼠,每组8只,两组均先HFD饲养3个月,而后实验组的饲料中加入药物罗格列酮(胰岛素增敏组),剂量为10 mg/kg·d,治疗1个月,对照组继续HFD饲养1个月。
-
小鼠禁食18 h,腹腔注射30%葡萄糖溶液(2 g/kg),分别在0、30、60、90、120 min取尾静脉血,采用强生血糖仪(OneTouch Ultra)检测小鼠血糖水平。
-
戊巴比妥钠麻醉小鼠后(80 mg/kg),心脏取血收集血液,室温静置2 h,3000 r/min离心20 min,取上清液。采用小鼠METRNL ELISA试剂盒(购自美国R&D biosystem公司)检测血清中METRNL浓度。操作步骤参照试剂盒说明书。
-
取小鼠附睾周围白色脂肪、肩胛骨间棕色脂肪、肝脏、腓肠肌、脑组织、肾脏、脾脏组织,采用TRIzol试剂(购自美国Invitrogen公司),按照说明书抽提组织总RNA,用RT-PCR逆转录试剂盒(购自中国TARARA公司)逆转录为cDNA。1 μg的cDNA用于检测METRNL的表达,GAPDH作为内参。采用2−ΔΔCt法与SYBR® Green PCR Master Mix(Applied Biosystems)试剂,反应条件为,95 ℃,5 min, 1个循环;95 ℃, 15 s,60 ℃,30 s,72 ℃,30 s,40个循环。相关引物序列见表1。
表 1 相关引物序列
基因 上游序列(5'—3') 下游序列(5'—3') METRNL CTGGAGCAGGGAGGCTTATTT GGACAACAAAGTCACTGGTACA GAPDH GTATGACTCCACTCACGGCAAA GGTCTCGCTCCTGGAAGATG ERRα GCCG CGATGTCCTTTTGTG CTGTACTCGATGCTCCCTGC UCP-1 CACGGGGACCTACAATGCTT ACAGTAAATGGCAGGGGACG clec10a TGGTGTCTTGGTTTCCGTCC AGCTCCTAGCTCTCCTTGGC Mrc-1 CTCTGTTCAGCTATTGGACGC TGGCACTCCCAAACATAATTTGA Lipe GTTATGAGTGCGCTCCGAGA GAGCAAAGCTAGAGTCGGGG LPL GGTTGCGCGTAGAGAGGATG CTCACGCTCTGACATGCCTTC FABP4 AAGGTGAAGAGCATCATAACCCT TCACGCCTTTCATAACACATTCC CD36 ATGGGCTGTGATCGGAACTG TTTGCCACGTCATCTGGGTTT -
所有数据均用(
$ \bar x \pm s $ )表示,用SPSS 10.0处理。两样本均数比较采用t检验。 -
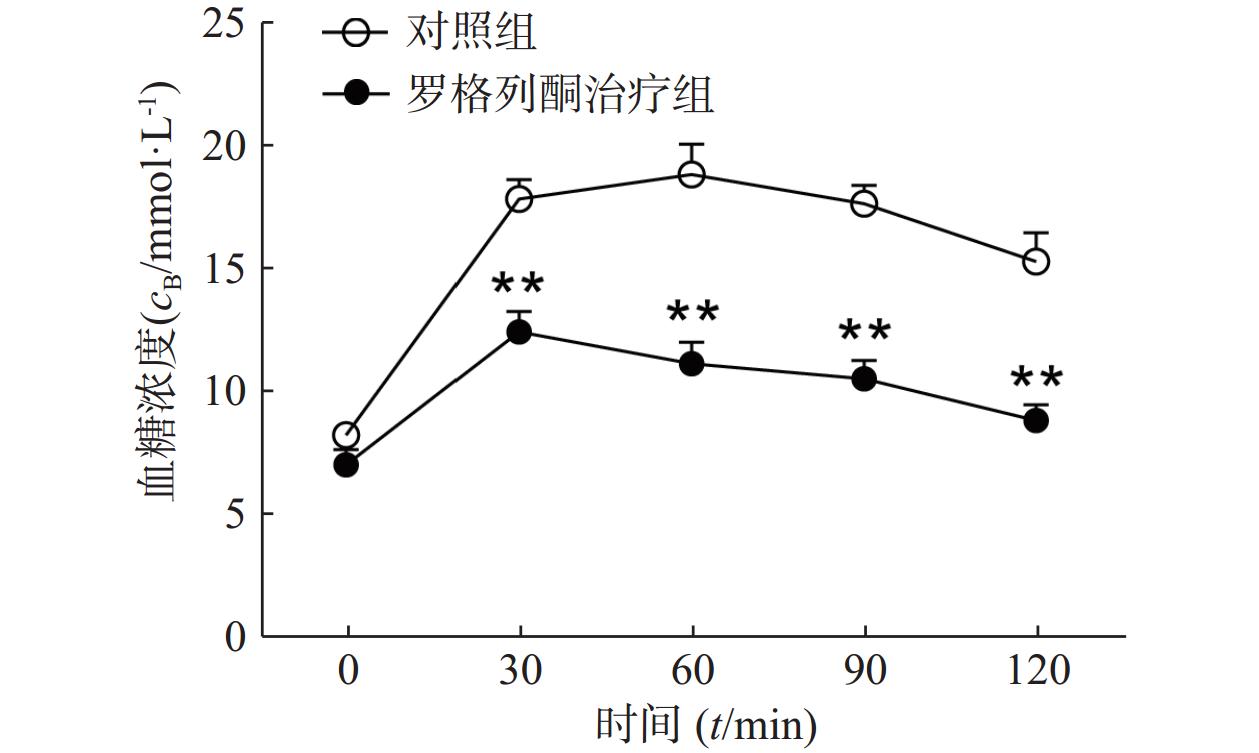
对HFD 3个月的小鼠采用罗格列酮治疗1个月后,葡萄糖耐量实验检测其糖耐量情况如图1所示,罗格列酮治疗组给予葡萄糖后30、60、90、120 min的血糖浓度均明显低于单纯HFD组(P<0.01),说明罗格列酮治疗明显改善了小鼠的糖耐量,提高了机体胰岛素敏感性。
-
取正常对照组、HFD组、HFD罗格列酮治疗组小鼠的血清,ELISA检测METRNL的水平,结果如图2所示,罗格列酮组血清中METRNL的浓度为(6 632±358) pg/ml,是单纯HFD组(4 271±310) pg/ml的1.6倍(P<0.05)。
-
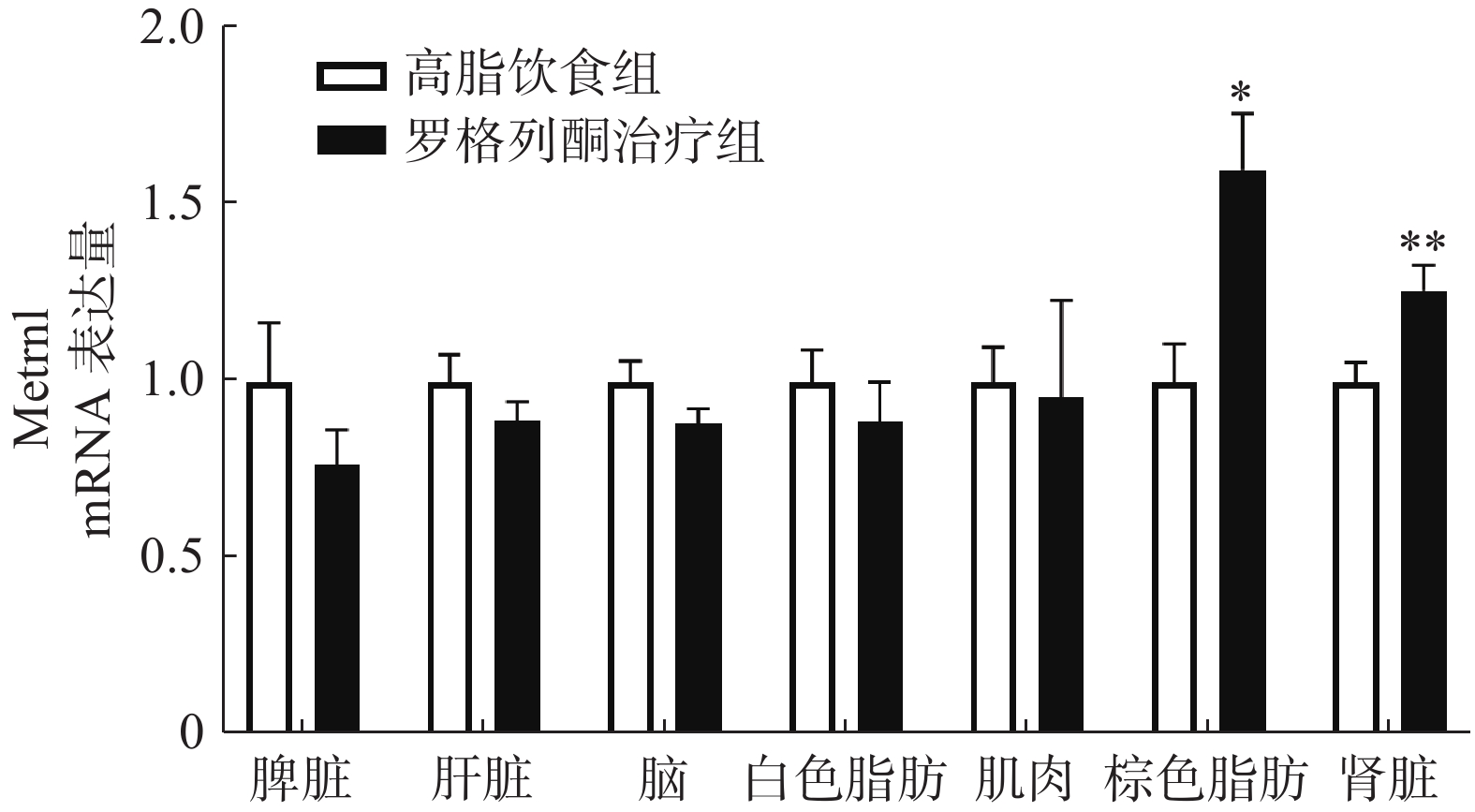
实时荧光定量PCR检测肌肉、肝脏、白色脂肪、棕色脂肪、脑、脾脏、肾脏等组织中METRNL的表达,结果如图3所示,与单纯HFD组相比,罗格列酮治疗组棕色脂肪组织METRNL表达升高1.6倍,肾脏组织METRNL表达升高1.3倍。
-
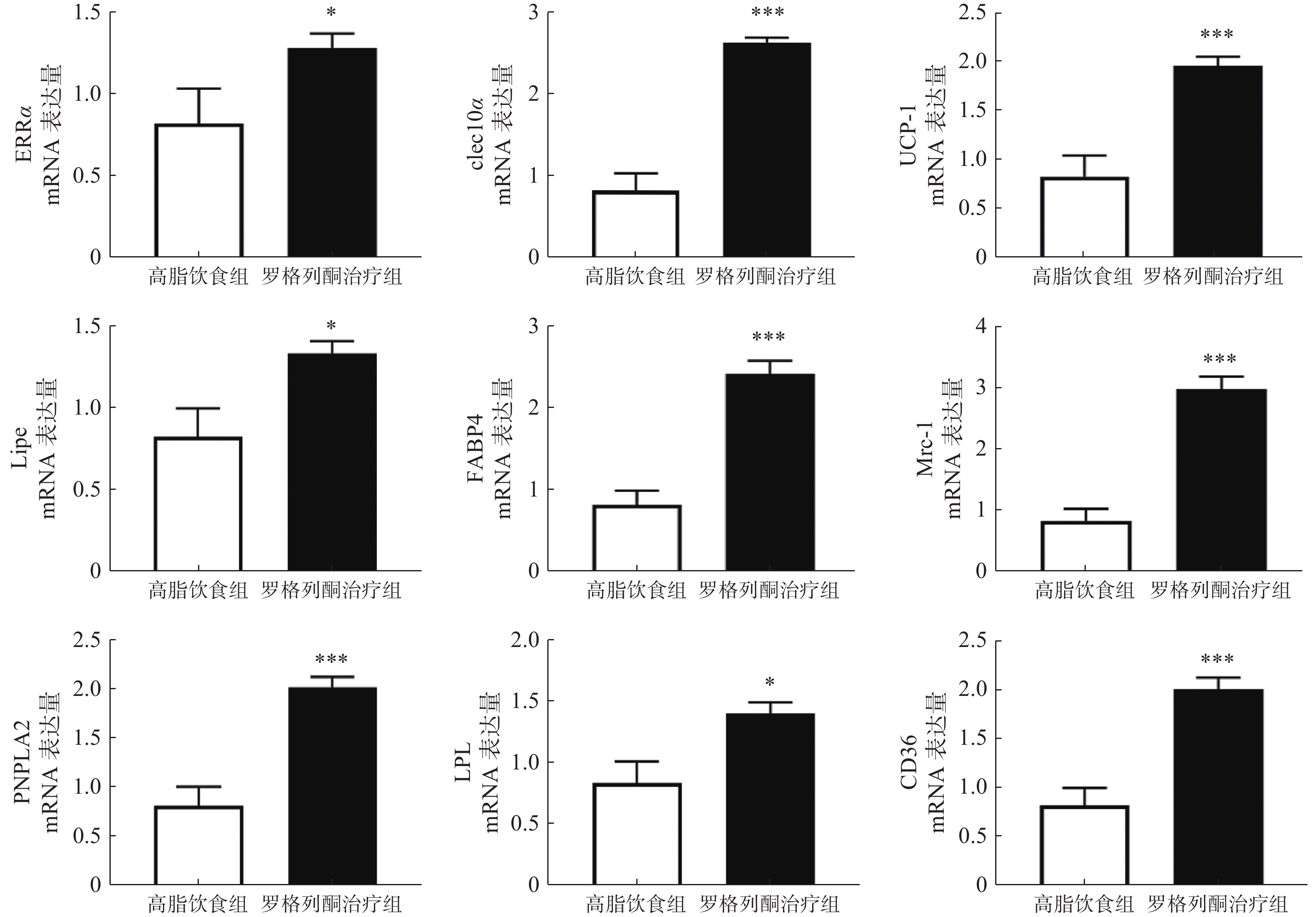
实时荧光定量PCR检测棕色脂肪组织代谢与棕色脂肪标记蛋白等mRNA表达情况,结果如图4所示,与单纯HFD组相比,罗格列酮治疗组ERRα、UCP-1、clec10a、Mrc-1、Lipe、LPL、FABP4、CD36、PNPLA2等因子表达显著升高。
-
本研究通过HFD诱导胰岛素抵抗的肥胖小鼠,发现HFD可以导致METRNL血液水平升高。对肥胖小鼠不同组织METRNL表达的检测显示,脂肪组织METRNL表达显著升高。HFD诱导的胰岛素抵抗小鼠,给予胰岛素增敏剂罗格列酮治疗后,小鼠糖耐量改善,同时,血清METRNL的浓度也升高。这些结果说明,METRNL并非胰岛素敏感性的特异性指标,脂肪可能是使血液METRNL水平改变的主要组织之一。
Li等研究发现,肥胖小鼠的脂肪组织METRNL表达增加[7]。本研究也表明,METRNL的血液浓度在高脂诱导肥胖后升高。Löffler等研究发现,METRNL与脂肪细胞的肥大相关,而脂肪细胞肥大被认为与PPARγ活性的降低相关,是胰岛素抵抗的重要标志之一,进而认为METRNL是机体胰岛素抵抗的标志[9]。然而,在本研究中,胰岛素增敏剂罗格列酮治疗后小鼠胰岛素敏感性提高,同时METRNL表达也显著升高,可见METRNL血液浓度的升高并不能代表胰岛素抵抗的增加。
罗格列酮可以显著提高胰岛素的敏感性,故也称为胰岛素增敏剂。本研究表明,其可以显著提高METRNL的表达,而METRNL又具有促进白色脂肪棕色化和提高胰岛素敏感性的作用,所以METRNL可能参与介导了罗格列酮的胰岛素增敏作用。
我们前期的研究表明,增加白色脂肪表达可以提高血液中METRNL的水平。本研究发现,罗格列酮未促进高脂条件下白色脂肪METRNL的表达,在检测的7种组织中,罗格列酮显著提高了棕色脂肪和肾脏METRNL的表达,但是对脾脏、肝脏、肌肉、白色脂肪、脑组织METRNL的表达没有影响,说明罗格列酮可能主要通过棕色脂肪和肾脏提高血液METRNL浓度。此外,进一步实验发现,罗格列酮促进了棕色脂肪中代谢和棕色脂肪标记蛋白的表达,这与以往的研究结果一致[10],既往研究表明,METRNL可促进白色脂肪棕色化,提示罗格列酮促进棕色脂肪代谢的作用可能有METRNL蛋白参与。
本研究发现了胰岛素增敏剂罗格利酮治疗可能通过提高棕色脂肪和肾组织的METRNL表达来升高血清METRNL水平,提示METRNL可能参与了罗格列酮对糖尿病的治疗过程。
The increasement of blood METRNL protein by insulin sensitizer rosiglitazone
-
摘要:
目的 探讨胰岛素增敏剂罗格列酮对血液中镍纹样蛋白(METRNL)水平的影响。 方法 高脂饮食3个月诱导胰岛素抵抗的肥胖小鼠,给予罗格列酮治疗1个月,葡萄糖耐量实验检测罗格列酮对小鼠糖耐量的作用,酶联免疫吸附实验检测血清中METRNL水平,实时定量PCR检测肌肉、肝脏、白色脂肪、棕色脂肪、脑、脾脏、肾脏等组织中METRNL的表达,以及棕色脂肪中线粒体蛋白的表达。 结果 罗格列酮治疗改善了高脂饮食动物的糖耐量,同时血液中METRNL浓度也显著增高;罗格列酮治疗增加了棕色脂肪和肾脏组织中METRNL的表达,对肌肉、肝脏、白色脂肪、脑、脾脏的METRNL表达没有影响;罗格列酮治疗增加了棕色脂肪线粒体相关蛋白的表达。 结论 胰岛素增敏剂罗格利酮可能通过提高棕色脂肪和肾组织的METRNL表达升高血清METRNL水平,提示METRNL可能参与了罗格列酮对糖尿病的治疗作用。 Abstract:Objective To investigate the effect of insulin sensitizer rosiglitazone on blood METRNL levels. Methods After fed with high fat diet (HFD) for 3 months, obese mice were treated with rosiglitazone for 1 month. Glucose tolerance was tested with glucose tolerance test (GTT), and METRNL levels in blood were measured by ELISA. Real time fluorescence quantitative PCR was used to detect the expression of METRNL in various tissues such as muscle, liver, white fat, brown fat, brain, spleen and kidney, as well as the expression of mitochondrial proteins in brown adipose tissue. Results Glucose tolerance of animals fed a high-fat diet was improved in rosiglitazone group, and blood METRNL levels were also increased significantly in this group. Rosiglitazone treatment increased the expression of METRNL in brown fat and kidney tissue. There was no effect on METRNL expression in muscle, liver, white fat, brain and spleen. Rosiglitazone increased the expression of mitochondrial-associated proteins in brown adipose tissue. Conclusion The insulin sensitizer rosiglitazone might increase the serum METRNL level by increasing the METRNL expression in brown fat and kidney tissue, suggesting that METRNL may be involved in the therapeutic effect of rosiglitazone on diabetes. -
Key words:
- insulin sensitizer /
- rosiglitazone /
- METRNL /
- insulin resistance
-
光动力治疗(PDT)基于光辐照聚集光敏剂的肿瘤组织,由光敏剂诱发光动力反应形成单线态氧(1O2)等活性氧(ROS),通过对肿瘤细胞和肿瘤血管的直接杀伤及激活机体系统免疫反应等多种机制发挥抗肿瘤作用[1-3]。二氢卟吩及菌绿素类光敏剂是PDT新药研究的热点[4-8]。其中,已获批上市的代表药物有他拉泊芬(talaporfin)和帕利泊芬(padeliporfin)等[9, 10]。
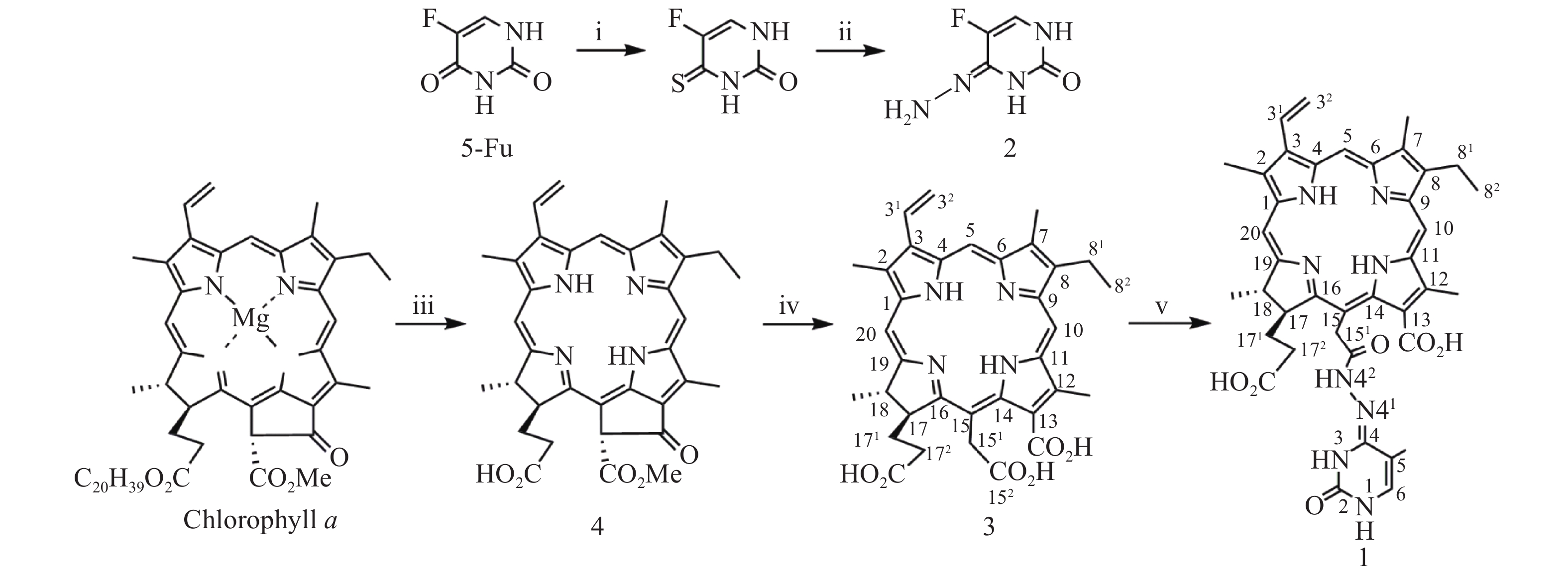
光敏剂作为结构非特异性药物,存在缺乏肿瘤靶向性摄入和明确的作用药靶等缺陷。此外,PDT受制于局部治疗,对浸润较深的肿瘤组织,及已发生转移的肿瘤疗效有限。目前,PDT和化疗联用是克服上述缺陷,提高PDT疗效最为普遍和有效的策略之一。研究表明,抗代谢化疗药物氟尿嘧啶(5-Fu)与PDT联用具有协同抗肿瘤作用[11-13]。据此,我们设想利用在肿瘤微环境下能响应性断裂的连接基团(linker)将光敏剂与化疗药物偶联,希望实现二者在肿瘤组织的靶向释放,从而发挥其PDT和化疗协同抗肿瘤作用。酰腙键是酸敏感化学键,常被用来连接载体,以药物制备智能药物载体。这种药物载体到达肿瘤细胞的内涵体或溶酶体中时,会发生酸性水解将药物有效释放出来。因此,本文针对肿瘤微环境呈弱酸性的特点,采用药物化学最经典的前药设计策略,以脱镁叶绿素a(Phephorbide a)粗提物经酸碱降解制得的二氢卟吩e6(3)[14]为先导光敏剂,通过其152-羧基与抗肿瘤药物5-Fu以酸敏感酰腙键连接,设计合成pH响应型光化疗协同抗肿瘤光敏剂二氢卟吩e6-偕氟尿嘧啶(1),并考察其体外PDT抗肿瘤活性和pH响应性5-Fu释放,及其对黑色素瘤B16-F10和肝癌HepG2细胞的光动力抗癌活性及其作用机制,以期获得高效、低毒的PDT治癌药物候选药物,合成路线见图1。
1. 化学合成
1.1 仪器与试剂
用Bruker MSL-600型核磁共振仪测定1H NMR,CD3OD为溶剂;用API-3000 LC-MS型电喷雾质谱仪测定质谱(ESI-MS);用岛津UV-160型紫外分光光度计测定UV吸收谱;用日立F-7000荧光分光光度计测定荧光发射谱;用Shimazu LC-20AD HPLC仪测定化合物1的相对纯度及其5-Fu的体外释放。色谱柱型号为Waters Xterra C18柱,流动相:乙腈-0.3%乙酸水溶液(80 : 20);流速:1.0 ml/min;检测波长:400 nm(化合物1的相对纯度)或254 nm(5-Fu释放);柱温:30 ℃;进样量:20 μl。柱色谱分离用TELEDYNE ISCO的快速制备色谱Combi Flash@Rf+仪,硅胶H作为固定相。PDT抗癌活性测试使用BWT半导体激光仪(北京凯普林,波长为660 nm);用流式细胞仪(BD Accuri C6,美国)(激发波长:488 nm,发射波长:525 nm)检测受试肿瘤细胞样品的ROS水平、细胞凋亡率和细胞周期阻滞。
二氢卟吩e6(3)按照文献[14]的方法制备;其它实验用材料和化学试剂均为市售商品。
1.2 42-N-(二氢卟吩 e6-152-酰基)-5-氟尿嘧啶-4-腙(1)的合成
取氟尿嘧啶(0.2 g,1.563 mmol)溶于无水吡啶(10 ml),加入五硫化二磷(0.298 g,1.563 mmol),加热回流12 h。反应完毕,减压回收溶剂,残物加乙酸乙酯溶解(100 ml),用0.1 mol/L HCl洗涤(50 ml×2),无水Na2SO4干燥,减压除去溶剂得4-硫代-5-氟尿嘧啶粗品。上述4-硫代-5-氟尿嘧啶粗品加甲醇(10 ml)溶解,于0 ℃下滴加N2H4·H2O(0.316 g,6.252 mmol),室温继续搅拌2 h。反应完毕,减压抽滤,P2O5真空干燥得固体化合物5-氟尿嘧啶-4-腙(2)中间体,直接用于下步反应。取二氢卟吩e6(0.1 g,0.168 mmol)溶于无水DMF(10 ml),加1-乙基-(3-二甲氨基丙基)碳二亚胺盐酸盐(EDC·HCl)(0.035 g,0.183 mmol),室温搅拌反应6 h后再加入中间体2(0.031 g,0.218 mmol),继续搅拌36 h。反应完毕,反应液加入10倍体积量乙酸乙酯,饱和NaCl水溶液洗涤(50 ml×3),无水Na2SO4干燥,减压回收溶剂所得固体经快速制备色谱梯度洗脱分离纯化(流动相为二氯甲烷/甲醇/甲酸=15∶1∶0.1~8∶1∶0.1)得黑色固体1纯品0.048 g,产率39.6%。UV-vis λmax (MeOH, nm) (ε, M−1cm−1):660 (3.15×104), 510 (0.82×104), 402 (8.13×104)。1H-NMR (600 MHz, CD3OD, δ, ppm): 9.79 (s, 1H, 10-CH), 9.73 (s, 1H, 5-CH), 9.07 (s, 1H, 20-CH), 8.19 (dd, J = 18.0, 12.0 Hz, 1H, 31-CH), 7.29 (s, 1H, 5-Fu的6-CH), 6.38 (d, J = 18.0 Hz, 1H, 32-CHB), 6.15 (d, J = 12.0 Hz, 1H, 32-CHA), 5.35 (s, 2H, 151-CH2), 4.65 (m, 2H, 17-CH和18-CH), 3.84 (q, J = 7.5 Hz, 2H, 81-CH2), 3.63 (s, 3H, 12-CH3), 3.53 (s, 3H, 2-CH3), 3.30 (s, 3H, 7-CH3), 2.3~2.0 (m,4H , 171-CH2 和172-CH2), 1.76 (m, 6H¸ 18-CH3和82-CH3)。MS (ESI+) m/z: 723.63 (M+H)+ (100%)。元素分析(C38H39N8O6F,%)计算值:C 63.16, H 5.40, N 15.48;实测值:C 63.34, H 5.38, N 15.43。HPLC测定纯度:95.2%。
2. 体外光理化性质和光生物活性
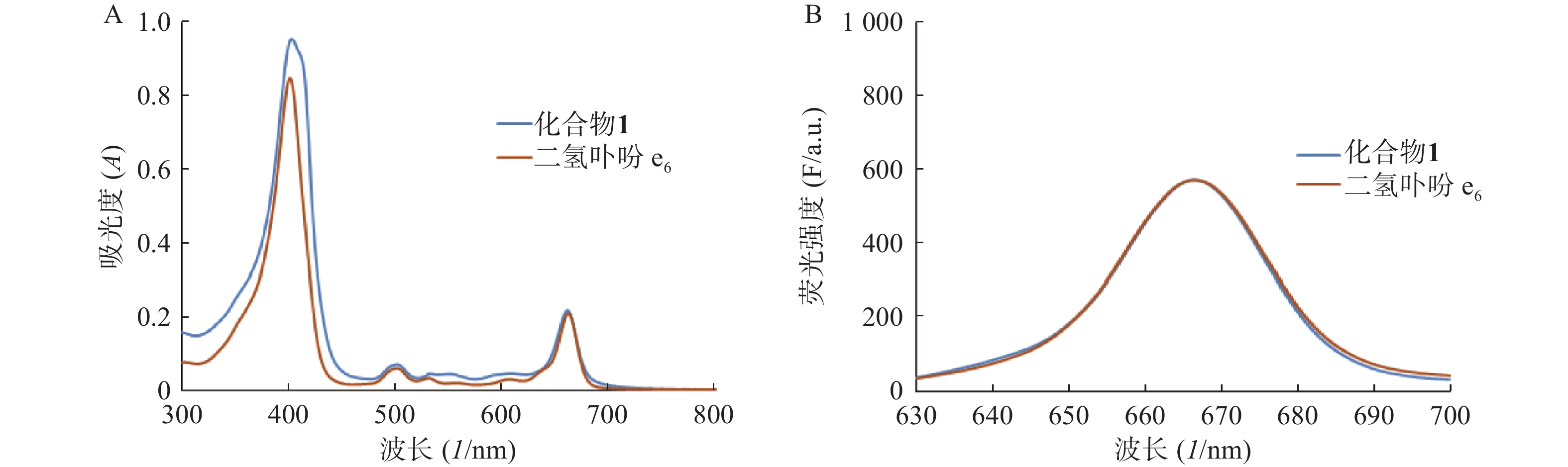
2.1 化合物1的紫外吸收谱和荧光发射谱
分别测定目标化合物1及其先导化合物二氢卟吩e6(3)的甲醇溶液(10 μmol/L)在300~800 nm处的紫外吸收谱和激发波长为400 nm的荧光发射光谱,结果见图2。
2.2 化合物1的体外pH响应性5-Fu释放
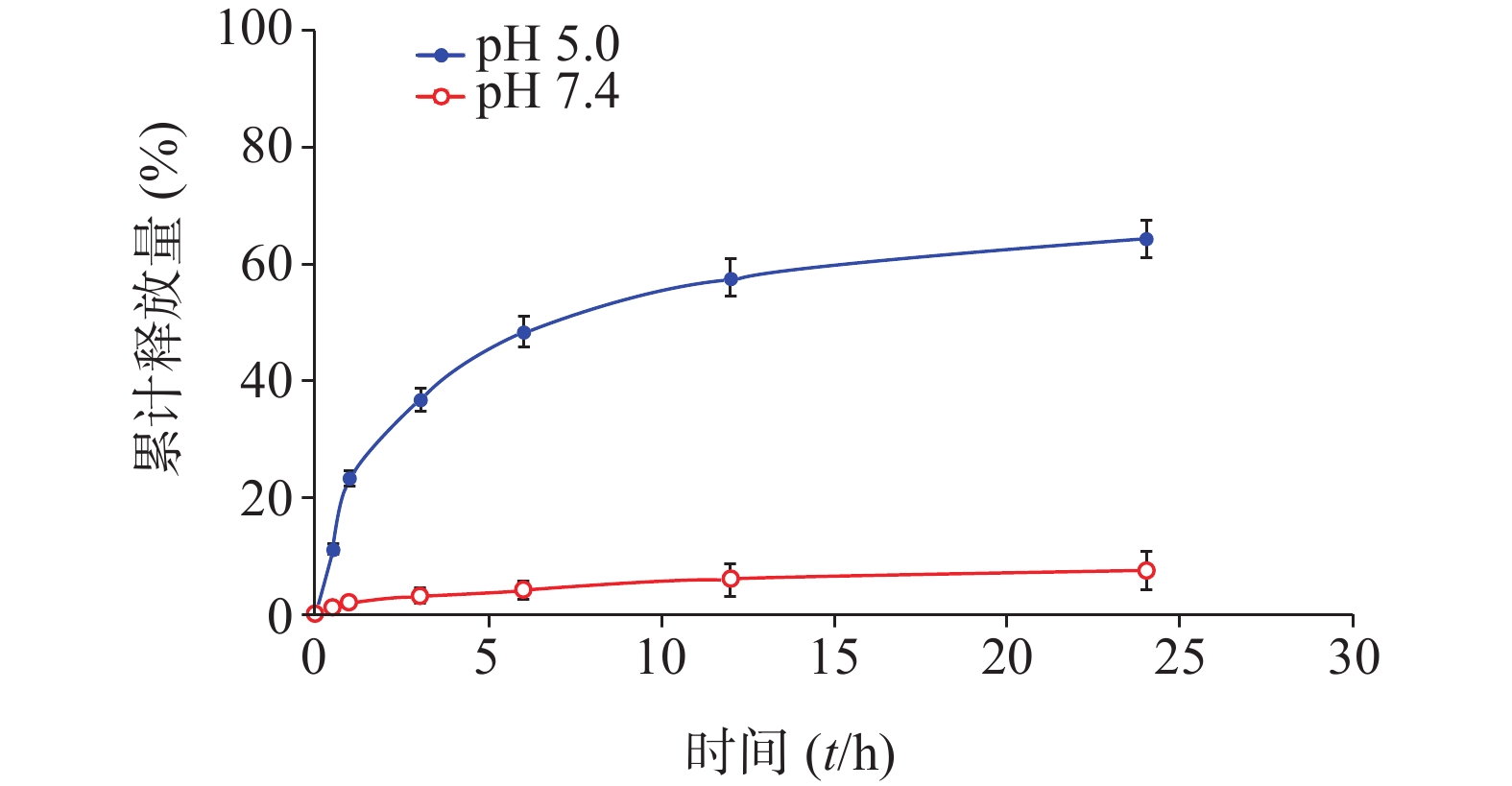
分别配制浓度为50 μmol/L的化合物1的HOAc-NaOAc缓冲液(pH 5.0)和PBS溶液(10 ml),并于0.5、1.0、3.0、6.0、12、24 h时分别取样(500 μl)。其中,HOAc-NaOAc缓冲液(pH 5.0)组取样液用0.1 mol/L氢氧化钠水溶液迅速调节pH值至7.4。每份取样液加PBS稀释至原溶液1/3浓度,微孔滤膜(孔径0.22 μm)过滤,HPLC进样检测;实验重复3次。根据5-Fu的HPLC峰面积-浓度标准曲线分析计算,绘制目标化合物1于弱酸(pH 5.0)中的5-Fu体外释放量-时间曲线,结果见图3。
2.3 化合物1的体外光动力抗癌活性
2.3.1 细胞孵育
2.3.2 细胞暗毒性测试
参照文献[6-8]的方法,每孔5×103个B16-F10细胞或HepG2细胞悬液(100 μl)接种于96孔板上,加入等体积上述细胞培养液孵育24 h;更换含不同浓度待测物的培养液(DMSO浓度小于1%,100 μl),继续避光孵育48 h;再更换含10%(V/V)CCK-8(Beyotime,中国)的RPMI 1640基础培养基(100 μl),继续培养1.5 h,然后用Varioskan Flash全波长酶标仪(Thermo)于波长450 nm处测定每孔的吸光度值,计算各浓度对应的细胞存活率,并拟合得到待测物的肿瘤细胞半数抑制浓度即IC50值。
2.3.3 细胞光毒性测试
每孔5×103个B16-F10细胞或HepG2细胞悬液(100 μl)接种于96孔板上,加入等体积细胞培养液孵育24 h;更换含不同浓度待测物的细胞培养液(DMSO浓度小于1%,100 μl),继续避光孵育24 h;再更换新鲜培养液(100 μl),以波长为660 nm的激光辐照受试细胞样品(光照剂量为10 J/cm2),继续孵育24 h。最后按“2.3.2”项下CCK-8法测定各待测物的肿瘤细胞IC50值。
2.3.4 实验结果
以临床光敏药物他拉泊芬为阳性对照,化合物1及其先导化合物3对肿瘤细胞株的体外PDT抗癌活性结果见表1。
表 1 目标化合物1的体外光动力抗癌活性(IC50,μmol/L)化合物 B16-F10细胞 暗毒/光毒比 HepG2细胞 暗毒/光毒比 暗毒性 光毒性 暗毒性 光毒性 化合物 1 46.84±8.46*, ΔΔΔ 0.73±0.16**, ΔΔΔ 64.2 50.80±6.45**, #, ΔΔΔ 0.90±0.22**, ΔΔΔ 56.4 二氢卟吩e6 69.72±4.69 3.36±0.59 20.8 70.38±10.9 2.75±0.41 25.6 他拉泊芬 254.8±18.8 11.31±3.88 22.5 176.4±28.4 15.47±5.07 11.4 5-Fu 35.80±6.68 NTa − 39.16±2.7 NTa − NTa:未测定;*P < 0.05,**P < 0.01,与二氢卟吩 e6组比较;#P < 0.05,与5-Fu组比较;ΔΔΔP < 0.001,与他拉泊芬组比较。 2.4 化合物1介导的PDT对肿瘤细胞内ROS水平的影响
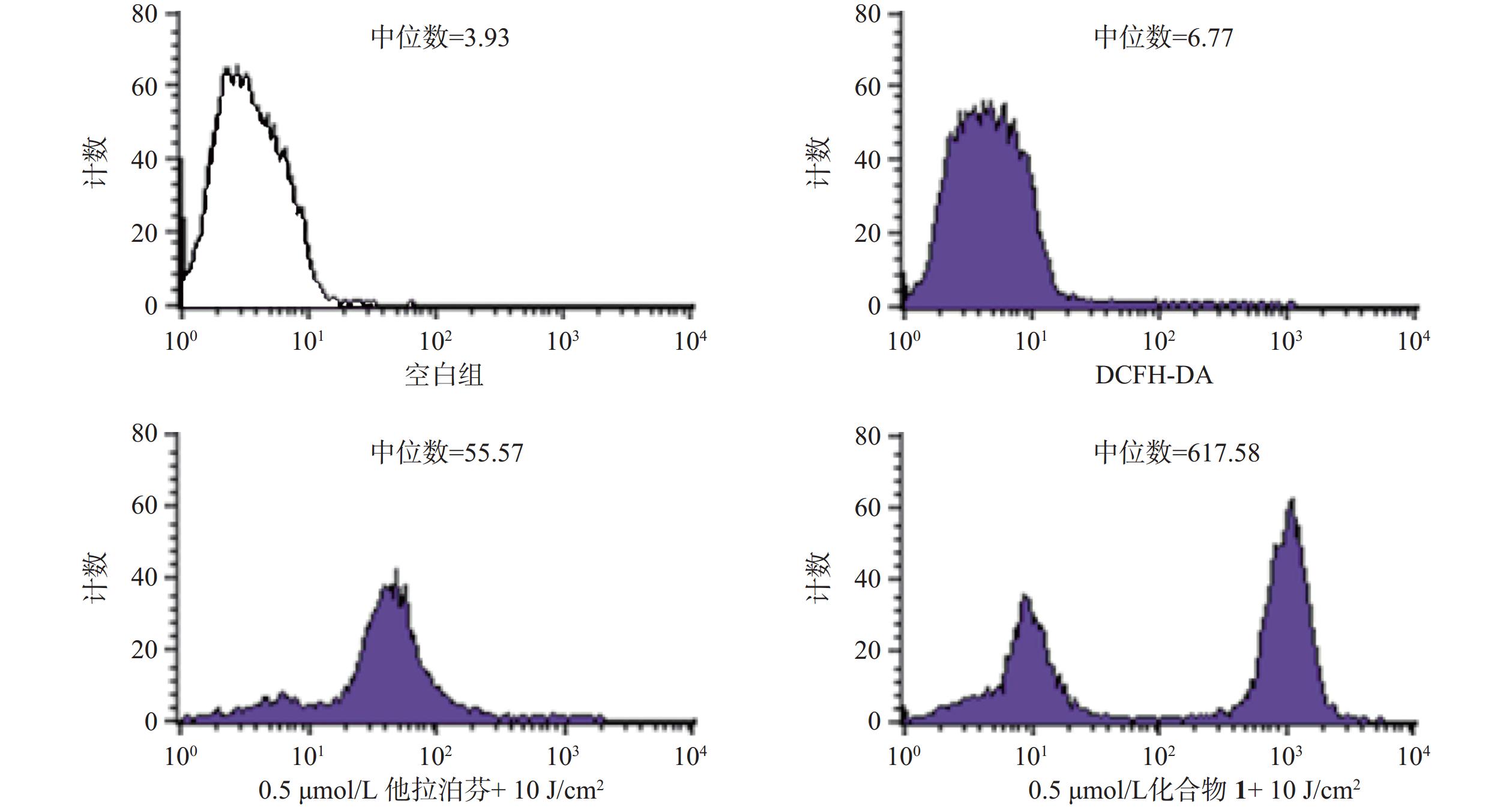
操作步骤如下:a. 每孔3 × 105个B16-F10细胞悬液(2 ml)接种6孔板上,按“2.3.1”项条件避光孵育24 h;b. 分别更换含一定浓度化合物1或他拉泊芬的新鲜培养液(DMSO浓度小于1%,2 ml),继续避光孵育24 h;c. 加入10 mmol/L DCFH-DAROS荧光检测探针(Beyotime,1.5 μl),吹打混匀,继续避光孵育20 min;d. PBS洗涤3次,再加新鲜培养液(2 ml),以660 nm波长的激光辐照(光剂量10 J/cm2)细胞样品,继续避光孵育20 min;e. 收集每孔细胞样品,用流式细胞仪检测各孔细胞ROS水平,结果见图4。
2.5 化合物1介导的PDT对肿瘤细胞凋亡的影响
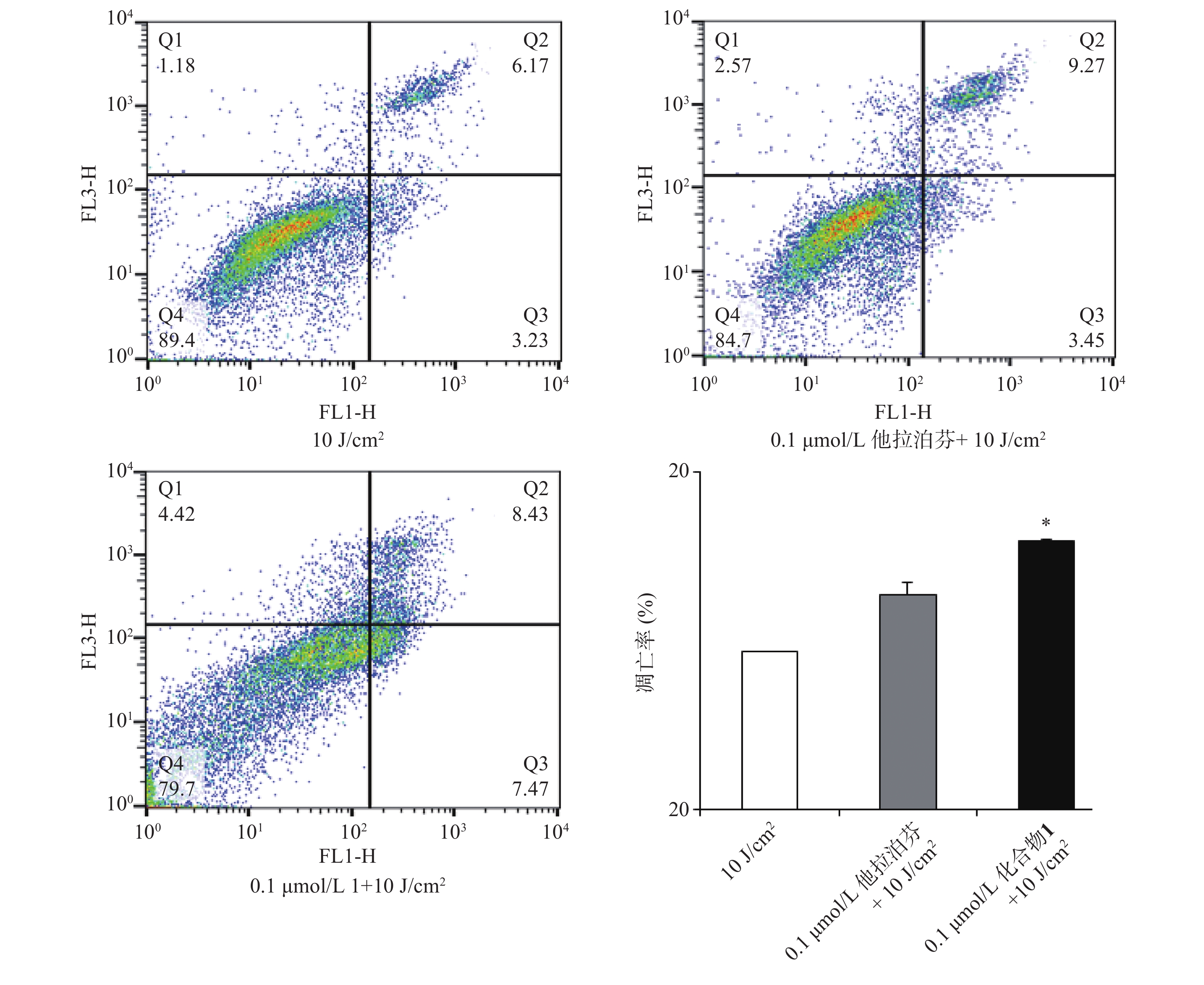
按“2.4”项下操作方法,仅从步骤c开始,更换新鲜培养液(2 ml),用660 nm波长的激光辐照(光剂量10 J/cm2)细胞样品,继续避光孵育20 min;d. 以1 500 r/min离心(5 min)细胞样品,PBS洗涤,再以1 000 r/min离心(5 min)后获取细胞样品;e. 按Annexin V-FITC细胞凋亡检测试剂盒(Beyotime)操作流程操作,结果见图5。
2.6 化合物1介导的PDT对肿瘤细胞周期的阻滞作用
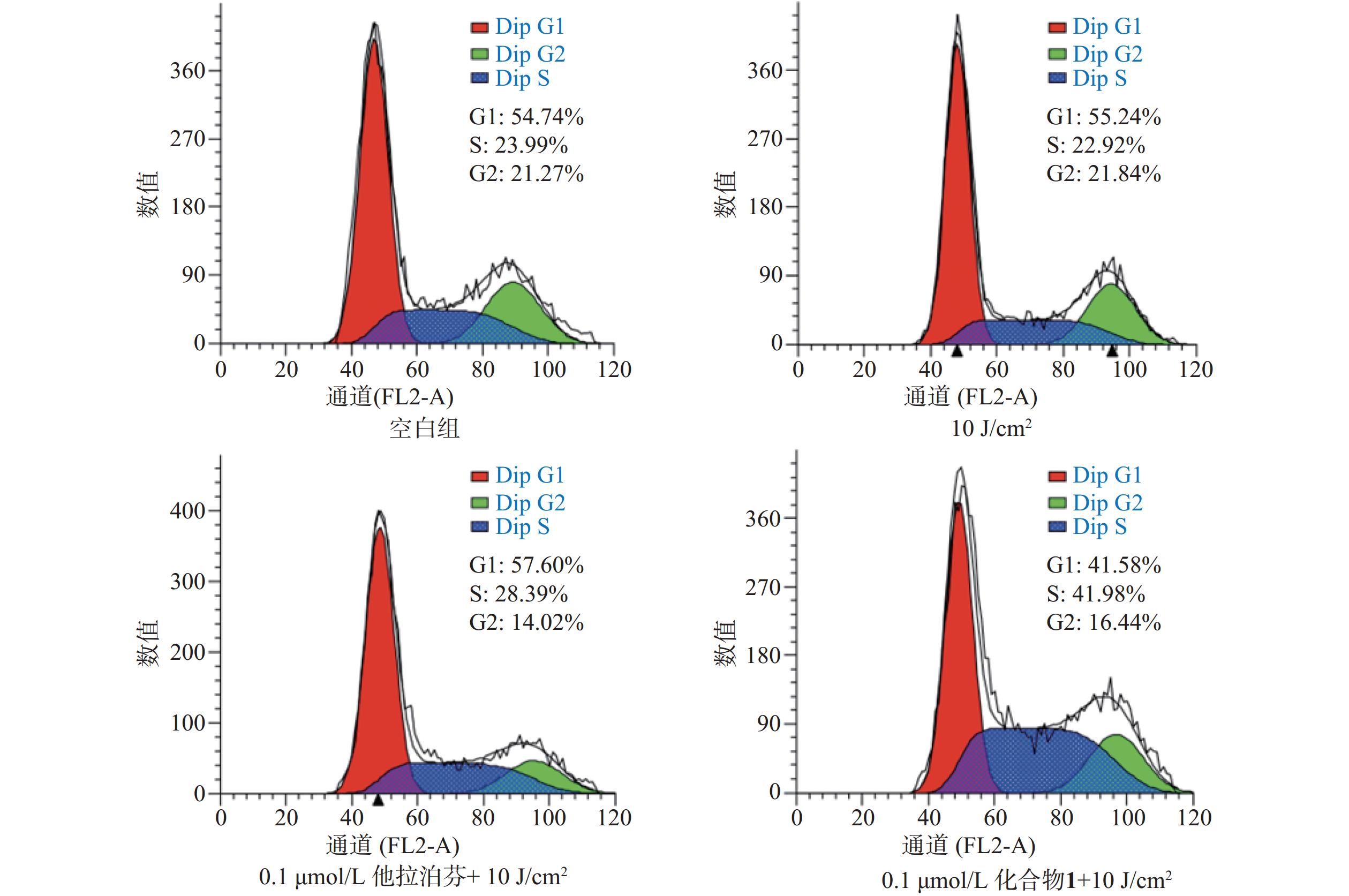
按“2.5”项下操作方法,仅在e步骤中,换以细胞周期阻滞检测试剂盒(Beyotime)的操作流程,每份细胞样品中分别加入染色缓冲液(300 µl)、RNase A(6 µl)和碘化丙啶染色液(15 µl),轻轻混匀,避光孵育20 min后,用流式细胞仪进行细胞周期阻滞检测,结果见图6。
3. 结果与讨论
按文献[14]方法制得的二氢卟吩e6(3)为先导化合物,经1-乙基-(3-二甲氨基丙基)碳二亚胺盐酸盐(EDC·HCl)于无水DMF中催化分子内脱水缩合制得二氢卟吩e6-131,152-酸酐活泼中间体[15],然后直接与中间体2发生酰化反应成功合成得到了光化疗双模抗肿瘤光敏剂二氢卟吩e6-偕氟尿嘧啶(1),反应收率达39.6%,其结构经UV、ESI-MS、1H NMR及元素分析确证。
化合物1在甲醇中最大紫外吸收波长和荧光发射波长(激发波长:400 nm)分别为660 nm和670 nm,与先导物3相一致,表明先导物3以酰腙键偶联5-Fu后,并没有改变其作为光敏剂特有的紫外吸收和荧光发射光谱等光物理特性。此外,化合物1在弱酸(pH 5.0)条件下,能有效释放5-Fu,24 h内累积释放率可达60.3%;但在pH 7.4的条件下较为稳定,24 h内5-Fu累积释放率仅为5%。
体外PDT抗癌活性测试结果显示,化合物1对B16-F10和HepG2细胞株的光毒活性和暗毒/光毒比(治疗指数)均显著优于先导物二氢卟吩e6(3)(P<0.005)和他拉卟吩(P<0.001),其IC50值分别达0.73 μmol/L和0.90 μmol/L。
体外PDT抗癌机制研究提示,化合物1介导的PDT能显著提升B16-F10细胞内ROS水平和诱导B16-F10细胞凋亡,并阻滞肿瘤细胞周期于S期。
总之,二氢卟吩e6-偕氟尿嘧啶(1)具有PDT抗癌活性强、治疗指数(暗毒/光毒比)高且可在肿瘤弱酸环境中有效释放5-Fu等优点,从而实现“单分子”光化疗协同抗肿瘤作用,值得进一步开发研究。
-
表 1 相关引物序列
基因 上游序列(5'—3') 下游序列(5'—3') METRNL CTGGAGCAGGGAGGCTTATTT GGACAACAAAGTCACTGGTACA GAPDH GTATGACTCCACTCACGGCAAA GGTCTCGCTCCTGGAAGATG ERRα GCCG CGATGTCCTTTTGTG CTGTACTCGATGCTCCCTGC UCP-1 CACGGGGACCTACAATGCTT ACAGTAAATGGCAGGGGACG clec10a TGGTGTCTTGGTTTCCGTCC AGCTCCTAGCTCTCCTTGGC Mrc-1 CTCTGTTCAGCTATTGGACGC TGGCACTCCCAAACATAATTTGA Lipe GTTATGAGTGCGCTCCGAGA GAGCAAAGCTAGAGTCGGGG LPL GGTTGCGCGTAGAGAGGATG CTCACGCTCTGACATGCCTTC FABP4 AAGGTGAAGAGCATCATAACCCT TCACGCCTTTCATAACACATTCC CD36 ATGGGCTGTGATCGGAACTG TTTGCCACGTCATCTGGGTTT -
[1] LI Z Y, ZHENG S L, WANG P, et al. Subfatin is a novel adipokine and unlike Meteorin in adipose and brain expression[J]. CNS Neurosci Ther, 2014, 20(4):344-354. doi: 10.1111/cns.12219 [2] JØRGENSEN J R, FRANSSON A, FJORD-LARSEN L, et al. Cometin is a novel neurotrophic factor that promotes neurite outgrowth and neuroblast migration in vitro and supports survival of spiral ganglion neurons in vivo[J]. Exp Neurol, 2012, 233(1):172-181. doi: 10.1016/j.expneurol.2011.09.027 [3] NISHINO J, YAMASHITA K, HASHIGUCHI H, et al. Meteorin: a secreted protein that regulates glial cell differentiation and promotes axonal extension[J]. EMBO J, 2004, 23(9):1998-2008. doi: 10.1038/sj.emboj.7600202 [4] JØRGENSEN J R, THOMPSON L, FJORD-LARSEN L, et al. Characterization of Meteorin: an evolutionary conserved neurotrophic factor[J]. J Mol Neurosci, 2009, 39(1-2):104-116. doi: 10.1007/s12031-009-9189-4 [5] LI Z Y, FAN M B, ZHANG S L, et al. Intestinal Metrnl released into the gut lumen acts as a local regulator for gut antimicrobial peptides[J]. Acta Pharmacol Sin, 2016, 37(11):1458-1466. doi: 10.1038/aps.2016.70 [6] USHACH I, BURKHARDT A M, MARTINEZ C, et al. METEORIN-LIKE is a cytokine associated with barrier tissues and alternatively activated macrophages[J]. Clin Immunol, 2015, 156(2):119-127. doi: 10.1016/j.clim.2014.11.006 [7] LI Z Y, SONG J, ZHENG S L, et al. Adipocyte metrnl antagonizes insulin resistance through PPARγ signaling[J]. Diabetes, 2015, 64(12):4011-4022. doi: 10.2337/db15-0274 [8] RAO R R, LONG J Z, WHITE J P, et al. Meteorin-like is a hormone that regulates immune-adipose interactions to increase beige fat thermogenesis[J]. Cell, 2014, 157(6):1279-1291. doi: 10.1016/j.cell.2014.03.065 [9] LÖFFLER D, LANDGRAF K, ROCKSTROH D, et al. METRNL decreases during adipogenesis and inhibits adipocyte differentiation leading to adipocyte hypertrophy in humans[J]. Int J Obes, 2017, 41(1):112-119. doi: 10.1038/ijo.2016.180 [10] MIAO Z W, HU W J, LI Z Y, et al. Involvement of the secreted protein Metrnl in human diseases[J]. Acta Pharmacol Sin, 2020, 41(12):1525-1530. doi: 10.1038/s41401-020-00529-9 -





 下载:
下载:
 下载:
下载: