-
铁死亡(ferroptosis)是一种铁依赖性,区别于细胞凋亡、细胞坏死和细胞自噬新型细胞程序性死亡方式[1]。细胞中铁过量时,可通过芬顿反应产生羟自由基,这些自由基直接会与细胞膜中多不饱和脂肪酸反应,产生大量脂质活性氧,从而诱导细胞死亡。铁死亡在细胞内受到多种代谢途径调控。其中就包括一个重要的抗氧化系统——谷胱甘肽系统。谷胱甘肽可以在还原态(G-SH)和氧化态(G-S-S-G)之间循环,使其能够参与细胞内的氧化还原生物化学反应。正常情况下,细胞内谷胱甘肽以还原态为主[2]。谷胱甘肽过氧化物酶4(GPX4),分子量约为19 000,由170个氨基酸组成,是含硒GPx家族第4位成员。目前已在哺乳动物中发现GPX1-GPX8等多个GPx家族成员,然而仅有GPX4表现出对于膜脂过氧化氢产物的清除能力,这与GPX4独特的氨基酸序列以及空间结构相关。GPX4能够以谷胱甘肽或其他硫氧化还原蛋白作为电子供体,将氢过氧化物(R-OOH)还原为对应的醇(R-OH),从而限制铁离子依赖的毒性自由基生成,抑制脂质过氧化,使得细胞膜免受氧化损伤,是铁死亡的重要调节蛋白[3]。
近年来,大量研究表明通过抑制GPX4蛋白来诱导细胞发生铁死亡,在克服肿瘤细胞耐药、治疗脂质过氧化相关神经退行性疾病等方面极具前景[4]。本文介绍了GPX4蛋白结构及其功能,并重点综述了目前GPX4小分子抑制剂最新研究进展,为开发基于GXP4蛋白功能抑制的铁死亡诱导剂提供研究基础。
-
GPX4是一种由170个氨基酸组成的单体蛋白质,显示出典型的硫氧还蛋白基序,由四个定位在蛋白质表面α螺旋和七条β链组成。GPX4含有在其他GPX硒酶中存在的保守催化活性四分体,由硒代半胱氨酸(Sec46)、谷氨酰胺(Gln81)、色氨酸(Trp136)和天冬酰胺(Asn137)组成,见图1A。Sec46,Gln81和Trp136三个氨基酸残基之间可以发生氢键相互作用和静电相互作用,这种相对牢固的空间排列对GPX4催化活性至关重要[5]。其中,Sec46是催化活性必需的,Sec46突变为半胱氨酸会使GPX4催化活性大幅降低。Sec46催化氧化还原反应是由3个连续反应组成的循环反应,见图1B:第一步,过氧化物与离子化的GPX4反应,产生GPX4硒酸衍生物;第二步,GPX4硒酸衍生物与还原型谷胱甘肽反应,还原型谷胱甘肽通过硫与GPX4的硒共价结合形成GPX4-谷胱甘肽复合物;催化循环最后一步,GPX4-谷胱甘肽复合物通过与另一个还原型谷胱甘肽反应分离为GPX4和一分子氧化型谷胱甘肽[2]。与其他GPx同工酶相比,GPX4表现出3种特性:一是该酶具有广泛的底物,即使是在高度结构化脂质蛋白组装体中,如生物膜和脂蛋白中,GPX4也能够减少复杂的脂质过氧化物;二是GPX4不仅可以将还原型谷胱甘肽作为氢供体,也可以接受蛋白质硫醇和其他还原等价蛋白;三是GPX4除了以单体形式存在以外,在精子细胞中还能以蛋白质聚集体的形式存在,这一特性影响了精子发育过程中线粒体膜的形成[6]。
GPX4主要功能是利用谷胱甘肽作为辅助因子来降低脂质过氧化,从而保护细胞膜的完整性。GPX4作为一种关键的抗过氧化物酶,可还原膜和脂蛋白中的磷脂氢过氧化物(PLOOH)。GPX4不仅可以利用谷胱甘肽消除毒性PLOOH,还可以通过减少胸腺嘧啶氢过氧化物、胆固醇氢过氧化物和脂肪酸氢过氧化物,保护细胞免受氧化损伤。除了还原氢过氧化物以外,GPX4还具有抑制花生四烯酸脂氧合酶(ALOX)活性的功能[6]。此外,与其他GPx家族成员相比,GPX4另一个独特功能是调节哺乳动物的胚胎发育[2]:在GPX4基因敲除小鼠模型中,小鼠胚胎在妊娠中期就在子宫内死亡,与此相反,GPX1、GPX2或GPX3敲除小鼠不会产生胚胎致死性。
-
迄今为止,已报道的GPX4小分子抑制剂大部分都包含与催化晒代半胱氨酸发生共价结合的反应弹头,其中最早发现的抑制剂就是以氯乙酰胺为共价结合弹头的化合物。RSL3(图2,化合物1)是最具有代表性的GPX4小分子抑制剂,最初被Yang[7]等人从47725种化合物中筛选出来,发现其具有抑制RAS突变肿瘤细胞增殖的效果。该团队发现RSL3诱导的细胞死亡与凋亡、坏死和自噬均不同。该研究团队进一步开展研究[8],通过化学蛋白质组学来筛选鉴定RSL3靶标蛋白,确定了GPX4是其作用的靶蛋白,并发现RSL3氯乙酰胺部分对其活性至关重要,即1.0 μmol/L浓度下,GPX4抑制率为(17.08 ± 0.40)%,更换为其他亲电弹头取代时,会导致活性丧失。Hengrui团队从晶体结构角度进一步阐述了GPX4和RSL3的结合方式,发现RSL3结合位点是半胱氨酸66(Cys66)而不是GPX4的催化活性位点Sec46[9]。
Michel团队[10]对
303282 种化合物进行了高通量筛选,得到了对RAS突变细胞具有优秀抑制活性的化合物ML162(图2,化合物2)。该化合物同样含有氯乙酰胺基团,与RSL3相比显示出更好抑制率,其在1.0 μmol/L浓度下,GPX4抑制率为(27.0±0.9)%。Chen的团队[11]在ML162和RSL3的基础上,设计得到了一系列新型GPX4共价抑制剂,其中,化合物C18(图2,化合物3)表现出优于RSL3和ML162的GPX4抑制率[1.0 μmol/L浓度下,GPX抑制率为(98.8±1.5)%],能抑制三阴性乳腺癌细胞生长(IC50=0.012 μmol/L)。Xu的团队[12]以RSL3多环的刚性骨架为切入点,以RSL3为先导化合物,将分子骨架中的哌啶环打开,并基于此继续进行结构优化,设计合成了一系列衍生物(图3)。其中化合物26a(图2,化合物4)表现出优秀的GPX4蛋白抑制活性[1.0 μmol/L浓度下,GPX抑制率为(71.7±1.7)%],能诱导三阴性乳腺癌细胞死亡(IC50=0.78 μmol/L)。 -
目前报道GPX4抑制剂主要是通过氯乙酰胺基团与GPX4进行共价结合来抑制其活性。然而,这些化合物中的氯乙酰胺基团不仅与GPX4的半胱氨酸残基共价结合,还可能与其他氨基酸残基发生结合,从而降低了它们对GPX4的特异性。鉴于此,研究人员正致力于寻找能够更特异性地与GPX4结合的化学结构。Michel[10]团队发现,不含亲电弹头的化合物ML210(图4,化合物5)在1.0 μmol/L浓度下对GPX4的抑制率高达(34.8±0.5)%。Eaton[13]等研究者揭示了ML210的作用机制(图4):ML210中的硝基异噁唑基团在细胞内转化为氧化腈基团,进而与GPX4中的半胱氨酸残基形成共价结合。同样的机制也在化合物二酰基呋咱(图4,化合物6)中观察到[14],其结构中的噁二唑基团能在细胞内转化为氧化腈基团,从而抑制GPX4,1.0 μmol/L浓度下抑制率为(34.8±0.5)%。不同于RSL3和ML162这类作用于多种蛋白质的抑制剂,ML210和二酰基呋咱可专一性地作用于GPX4,说明掩蔽腈氧化物是一种高特异性的GPX4靶向结构。
-
除了直接与GPX4发生共价结合外,某些化合物可通过非直接途径抑制GPX4蛋白。例如Shimada[15]团队从
3169 种化合物中筛选出FIN56(图5,化合物7),该化合物并不具有亲电弹头,但能导致GPX4失活。FIN56会增加细胞内活性氧的含量,但其作用速度明显慢于直接作用于GPX4的抑制剂RSL3。研究表明,经FIN56处理的细胞中GPX4丰度显著下降,但是其转录水平却显著增加,这种现象在RSL3处理的细胞中并未观察到。因此,研究者推测FIN56可能通过促进GPX4的降解来发挥作用,但具体机制尚不明确。另一种由Micheal[16]报道的非共价GPX4抑制剂是FINO2(图5,化合物8),其结构中的过氧键能直接氧化亚铁离子,导致GPX4失活。这些分子的发现为GPX4小分子抑制剂的开发提供了新的视角。 -
近年来,随着对铁死亡相关研究的进一步深入,人们发现铁死亡与多种癌症以及神经性疾病等病理过程相关,为治疗这些疾病提供了新的解决策略。在铁死亡的发生过程中,GPX4是关键的调控因子,它能够分解脂质过氧化物,维持脂质双分子层的稳定,反之,抑制GPX4可以诱导细胞发生铁死亡。目前,大多数已报道的GPX4小分子抑制剂为含有氯乙酰胺基团的共价抑制剂,这些化合物由于其强大的亲电性,可以与多种蛋白质结合,从而导致它们与GPX4结合的特异性不高。为解决这一问题,研究者们设计了含掩蔽氧化腈弹头的化合物,这种设计旨在通过减少细胞与高亲电性弹头的接触时间,提高靶向GPX4的特异性。这两类GPX4小分子抑制剂虽然具有较好的蛋白及细胞水平活性,但尚无候选分子进入临床试验。此外,还发现了一些非共价的GPX4小分子抑制剂,这些分子显示出抑制GPX4活性并能诱导细胞发生铁死亡,但其与GPX4具体的作用机制尚不清楚。因此,无论是基于关键调控蛋白GPX4探索高特异性的共价抑制剂,还是揭示GPX4非共价抑制剂的作用机制,都是铁死亡相关研究领域的热点问题,克服这些挑战是未来铁死亡诱导剂进入临床应用的关键一步。
Research progress on small-molecule inhibitors of ferroptosis regulatory protein GPX4
-
摘要: 铁死亡(ferroptosis)是2012年新发现的一种非凋亡坏死的细胞死亡方式,其主要特征为脂质活性氧增多以及细胞内亚铁离子累积。谷胱甘肽过氧化物酶4(GPX4)是含硒GPx家族第4位成员,是细胞清除脂质过氧化物的重要蛋白,也是铁死亡的重要调节因子。靶向GPX4小分子抑制剂能诱导铁死亡发生,为治疗耐药性癌症和神经退行性疾病提供了新的策略。主要介绍GPX4蛋白的结构和功能,并综述GPX4小分子抑制剂最新前沿进展,为开发基于GXP4抑制的铁死亡诱导剂提供研究基础。Abstract: Ferroptosis, discovered in 2012, is a newly form of non-apoptotic and non-necrotic cell death, which is characterized by an increasement in lipid peroxidation and accumulation of intracellular iron ions. Glutathione peroxidase 4(GPX4)is the fourth member of the selenoprotein GPx family and plays a crucial role in clearing lipid peroxides in cells, making it an important regulator of ferroptosis. Small molecule inhibitors targeting GPX4 can induce ferroptosis, offering a new strategy for treating drug-resistant cancers and neurodegenerative diseases. The protein structure and function of GPX4 were primarily discusseed, and the latest advances in small molecule inhibitors of GPX4 were summarized, which provided a research foundation for developing ferroptosis inducers based on GPX4 inhibition.
-
Key words:
- ferroptosis /
- GPX4 /
- small molecule inhibitors /
- glutathione /
- lipid peroxidation
-
流感是一种严重的上呼吸道病毒感染,由于其高毒力和突变率,该病毒仍然是对公众健康的主要威胁。据美国疾病控制与预防中心和世界卫生组织估计,每年有多达65 万人死于季节性流感引起的呼吸道疾病[1]。传统中医药预防和治疗流感病毒导致的感染(如呼吸道肺炎和支气管炎)已成为中国临床上常规治疗策略,发挥了独特的医疗优势[2,3]。
感冒安颗粒是由金银花、连翘、板蓝根、拳参、桑叶、紫苏和荆芥等七味中药制成的复方制剂,临床应用30 多年,具有疏散风邪,解表退热功能,其预防和治疗呼吸道感染的作用已得到很好的临床验证,特别是在病毒感染初期的治疗效果尤其显著,但药效物质基础并不清楚。目前,建立了TLC法对方中的板蓝根和连翘两味药材进行特征鉴别;同时对方中各药味的共有成分绿原酸和齐墩果酸也建立了TLC鉴别方法。在含量限度方面,则建立了制剂中连翘酯苷A的HPLC法。尽管这些获批的标准已用于制剂常规质量控制,但尚需进一步进行质量评价,以期更客观、准确地反映感冒安颗粒的临床疗效。
由于中药复方复杂的化学成分,它的药理作用是通过多靶点、多途径而实现的。流感病毒感染的病理生理过程主要是病毒的直接作用和宿主免疫反应损伤(如细胞因子风暴所致的炎性损伤和ROS导致的氧化应激损伤)的结果[2,4]。为了研究感冒安颗粒临床效果的药效物质基础,我们对组方各药味的化学成分进行了文献追踪,发现方中药味含有多种黄酮类成分,如异槲皮苷、芦丁、木樨草素及木樨草苷等[5-9]。而黄酮类成分对流感病毒的作用越来越受到关注[10,11]。异槲皮苷抑制流感病毒A和B的复制,与抗病毒药amantadine或者oseltamivir合用可抑制它们导致的耐药病毒出现[12]。槲皮素与流感病毒A H1N1(A/PR/8/34)的神经酰胺酶的结合与zanamivir相当,体内研究也证实了其抗流感病毒能力,可作为抗甲型H1N1流感的有效先导化合物[13]。Zima研究认为木犀草素及其同源物是强效流感核酸内切酶抑制剂,揭示黄酮类化合物的抗流感作用[14]。鉴于此,本研究在总黄酮含量测定的基础上[15],采用HPLC-MS/MS方法建立5 种黄酮类成分的定量方法,不仅为制剂质量评价提供方法学,也为进一步研究感冒安颗粒防治流感病毒引起的呼吸道感染机制奠定物质基础。
1. 仪器与试药
1.1 仪器
Agilent Technologies
6410 Triple Quad LC/MS仪,配以Triple Quad B.02.01(B2043.12)数据处理软件(美国安捷伦公司);XS205DU电子天平(瑞士梅特勒-托利多仪器有限公司);DL-720A超声波清洗器(上海之信仪器有限公司)。1.2 试药
感冒安颗粒(本院院内制剂,批号110418、110704、111025、111121、111130、111221、120131、120201、120207、120214);芦丁对照品(中国食品药品检定研究院,供UV法测定,含量以92.5 %计,批号:100080-200707);金丝桃苷对照品(中国食品药品检定研究院,供含量测定用,含量以93.9 %计,批号:111521-201004);木犀草素对照品(中国食品药品检定研究院,供含量测定用,批号:111520-200504);槲皮素对照品(中国食品药品检定研究院,供含量测定用,批号:100081-200406);异槲皮苷对照品(成都曼斯特生物制品有限公司,纯度>99.0 %,批号:MUST-10021901);甲醇为色谱纯;甲酸为分析纯;水为蒸馏水。
2. 方法与结果
2.1 溶液制备
2.1.1 对照品溶液制备
分别取芦丁、金丝桃苷、异槲皮苷、槲皮素和木犀草素对照品各适量,用甲醇溶解,摇匀,各配制成500 μg/ml的对照品贮备液。分别精密量取5种对照品贮备液适量,稀释成浓度如下:分别含芦丁0.25、0.50、1.00、2.00、4.00、6.00、8.00 μg/ml,金丝桃苷0.002、0.008、0.020、0.032、0.044、0.056、0.080 μg/ml,异槲皮苷0.03、0.10、0.25、0.45、0.65、0.95、2.00 μg/ml,槲皮素0.02、0.10、0.20、0.30、0.40、0.60、0.70 μg/ml,木犀草素0.012、0.026、0.040、0.054、0.082、0.096、0.200 μg/ml的混合对照品溶液。
2.1.2 供试品溶液制备
按已优化的黄酮提取方法进行[15]。取样品约0.5 g,精密称定,置量瓶中,加70 %甲醇35 ml,超声提取30 min,放冷,过滤,滤液加70 %甲醇溶液定容至50 ml,摇匀,用微孔滤膜(0.45 μm)滤过,即得。
2.2 色谱-质谱条件
色谱条件:采用Kromasil C 18(4.6 mm×150 mm,5 μm,100 Å)色谱柱;甲醇(A)- 0.1 %甲酸(B)作为流动相,按0~20 min,35 % A;20~40 min,45 % A梯度洗脱。
质谱条件:电喷雾负离子化(ESI−)源:毛细管电压 3.0 kV;气体温度 350 ℃,气体流速 10 L/min,雾化气压 35 psi。多反应模式(MRM)监测。5种黄酮检测的离子对:芦丁m/z 609.1→300.1、金丝桃苷和异槲皮苷m/z 463.0→300.1、槲皮素m/z 301.0→151.0、木犀草素m/z 285.0→132.9。
2.3 方法学考察
2.3.1 检测限和定量限
采用上述色谱条件,每个待测化合物对照品用70%甲醇溶液进行系列稀释,分别以信噪比(S/N)等于3和10确定各自的检测限和定量限。结果见表1。
表 1 5种黄酮成分的线性方程、相关系数、线性范围、检测限和定量限黄酮化合物 线性方程 相关系数
r线性范围
(ng/ml)检测限
(ng/ml)定量限
(ng/ml)芦丁 Y=24 527X–162.17 0.999 7 250~8 000 0.025 0.50 金丝桃苷 Y=34 123X– 1.7381 0.999 1 2~80 0.005 0.01 异槲皮苷 Y=29 935X+1 597.80 0.999 1 30 ~2 000 0.02 0.50 槲皮素 Y=19 667X+370.71 0.999 2 20~700 0.02 0.10 木犀草素 Y=33 076X–177.98 0.999 7 12~200 0.005 0.01 2.3.2 线性范围考察
精密量取“2.1.1”项下配制的5 种黄酮成分的对照品混合溶液,照“2.2”项下进样测定,记录各待测组分的峰面积积分值。横坐标为黄酮成分质量浓度(X,ng/ml),纵坐标为峰面积(Y),进行线性回归,计算回归方程和相关系数。结果见表1,表明5 种黄酮成分在各自浓度范围内呈良好的线性关系。
2.3.3 精密度试验
精密吸取供试品溶液(批号
120131 ),照“2.2”项下操作,进样,连续测定5 次和连续测定5 d,记录各待测组分的峰面积积分值,计算日内、日间RSD。结果显示,芦丁、金丝桃苷、异槲皮苷、槲皮素和木犀草素的日内精密度RSD分别为1.09 %、1.42 %、1.69 %、0.86 %、1.27 %(n=5),日间精密度RSD分别为1.85 %、1.76 %、1.43 %、2.01 %、1.90 %(n=5),表明仪器精密度良好。2.3.4 重复性试验
取同一批号样品(批号
120131 )5 份,各0.5 g,精密称定,照“2.1.2”项下方法制备供试品溶液,照“2.2”项下操作,进样,测定峰面积积分值,并进行含量测定。结果显示,芦丁、金丝桃苷、异槲皮苷、槲皮素和木犀草素的含量分别为260.16、1.84、19.76、13.39、3.73 μg/g(n=5),RSD分别为1.51 %、1.73 %、0.90 %、1.44 %、1.68 %(n=5),表明方法的重复性良好。2.3.5 加样回收率试验
取已知含量的样品(批号120131)9 份,每份约0.5 g,精密称定,各精密加入对照品贮备液适量,使已知样品中加入的相当对照品量分别含芦丁140.00 μg、金丝桃苷0.90 μg、异槲皮苷10.00 μg、槲皮素7.00 μg、木犀草素1.90 μg的各对照品贮备液,按“2.1.2”项下的方法制备供试品溶液,照“2.2”项下操作,进样,测定峰面积积分值,计算加样回收率。结果显示,芦丁、金丝桃苷、异槲皮苷、槲皮素和木犀草素的平均加样回收率分别为:102.06%、101.60%、100.63%、102.81%、101.80%(n=9),RSD分别为1.56%、1.93%、0.67%、2.07%、1.84%(n=9)。
2.3.6 样品含量测定
取10 个批号的感冒安颗粒,分别按“2.1.2”项下的方法制备供试品溶液,照“2.2”项下操作,进样,测定峰面积积分值,计算含量,结果见表2。
表 2 不同批号感冒安颗粒含量测定结果($\bar x $ ±s, n=3)批号 芦丁 金丝桃苷 异槲皮苷 槲皮素 木犀草素 含量(μg/g) RSD(%) 含量(μg/g) RSD(%) 含量(μg/g) RSD(%) 含量(μg/g) RSD(%) 含量(μg/g) RSD(%) 110418 479.83±1.99 0.41 0.855±0.004 0.49 20.54±0.25 1.23 14.83±0.05 0.31 3.46±0.06 1.70 110704 198.98±3.01 1.52 0.596±0.006 1.05 11.79±0.20 1.68 15.31±0.13 0.86 4.51±0.01 0.19 111025 32.23±0.26 0.83 0.993±0.012 1.26 13.31±0.00 0.02 6.53±0.04 0.55 5.15±0.08 1.58 111121 69.18±1.03 1.51 0.499±0.006 1.26 13.36±0.21 1.56 8.04±0.14 1.69 5.65±0.07 1.19 111130 67.53±0.27 0.40 0.533±0.008 1.57 13.36±0.21 1.54 7.48±0.12 1.62 5.42±0.06 1.15 111221 275.38±3.61 1.31 0.291±0.002 0.73 11.44±0.02 0.21 15.74±0.02 0.14 6.51±0.02 0.24 120131 264.55±0.51 0.19 1.825±0.012 0.68 20.29±0.04 0.17 13.66±0.02 1.52 3.78±0.01 0.26 120201 239.19±1.55 0.65 0.593±0.010 1.76 18.95±0.06 0.33 18.41±0.21 1.16 3.86±0.03 0.81 120207 109.20±2.14 1.97 0.503±0.004 0.83 18.00±0.21 1.16 6.72±0.08 1.22 4.21±0.02 0.37 120214 108.93±0.59 0.54 0.461±0.002 0.45 17.67±0.10 0.01 6.32±0.08 1.19 4.73±0.01 0.11 3. 讨论
3.1 MS/MS条件的优化
为了获得良好的MS结果,优化了检测的离子模式、碎裂电压、碰撞能量等参数,以获得高灵敏度的分子离子和碎片离子。结果显示,ESI采用负离子模式可使待测的黄酮成分有更高的灵敏度。对照品混合液经产物离子扫描显示,芦丁的主要碎片为m/z:300.1、271.0;金丝桃苷和异槲皮苷的主要碎片为m/z:300.1、270.8;槲皮素的主要碎片为m/z:178.6、151.0、120.9、106.9;木犀草素的主要碎片为m/z:150.9、132.9、106.8。依据定量碎片离子选择原则,从远离母离子、裂解方式稳定、碎片离子有足够的丰度等方面进行考察,最终选择的碎裂电压、碰撞能量和定量离子如表3所示。由于金丝桃苷和异槲皮苷是结构异构体,它们有相同分子离子峰[M-H]− m/z 463,MS/MS图谱中有相同的产物离子峰m/z 300,这两个化合物通过比较两者在HPLC中的保留时间进行定位。
表 3 5种黄酮化合物的质谱检测参数黄酮化合物 母离子 产物离子 碰撞电压
(U/ V)碰撞能量
(U/ eV)芦丁 609.1 300.1 190 38 金丝桃苷 463.0 300.1 170 25 异槲皮苷 463.0 300.1 170 25 槲皮素 301.0 151.0 130 19 木犀草素 285.0 132.9 150 37 3.2 定量方法学验证
采用已优化的测定条件,感冒安颗粒中5 种黄酮类成分通过与各自标准对照品的保留时间和MS谱图的比较得以鉴别和确认,结果见图1。由于金丝桃苷、异槲皮苷和芦丁均是以槲皮素为苷元,结合不同的糖而形成,金丝桃苷与异槲皮苷还具有相同的分子量,它们的保留时间非常相近。采用HPLC-UV或二极管阵列检测的方法专属性不强,待测成分间相互干扰,很难保证测定结果的准确性。而本研究采用MS/MS-MRM模式测定,实现了准确定量的目的。
3.3 结果分析
本研究采用经优化的超声提取法提取感冒安颗粒中黄酮成分,用所建立的LC-MS/MS方法测定了10 个批号样品,结果显示,每批样品中均为芦丁含量最高,金丝桃苷含量最低;批间样品同种黄酮成分含量存在差异。为了保证感冒安颗粒质量的稳定性,临床疗效的一致性,对其中的主要黄酮成分可以考虑设定最低限度要求。感冒安颗粒是经传统水提醇沉工艺制得的稠膏制粒而成,我们以往的研究表明,制剂中含有大量的酸性成分[16],工艺提取过程中的高温、偏低的pH值可能导致金丝桃苷、异槲皮苷、芦丁等苷类黄酮化合物发生水解反应。本研究将3种黄酮苷对照品及生产工艺获得的稠膏经2 % HCl溶液在80 ℃水浴加热处理30 min,进行HPLC-MS/MS分析,处理后的稠膏样品中金丝桃苷和芦丁含量降低,异槲皮苷和槲皮素含量增加;在3种黄酮苷对照品水解液中,均有槲皮素产生;除此之外,芦丁对照品溶液水解还出现了异槲皮苷。由此可以推测,感冒安颗粒的制备工艺可能导致黄酮类成分的水解和转化。
本研究采用HPLC-MS/MS同时测定了感冒安颗粒中5 种黄酮类成分的含量,所建立方法的专属性、灵敏度、精密度和准确性均已得到确证,达到了同时测定多种结构相似的黄酮类成分的目的,为其质量标准的建立提供了方法学依据。我们的研究已经证明感冒安颗粒中含有多种酚酸类成分[17],本研究又测定了其中的黄酮类成分。这些成分可能共同作用于流感病毒在宿主内复制的多环节,或者改善流感病毒对机体的炎性损伤,降低炎性细胞因子表达,改善氧化应激损伤,提高机体的免疫力等,充分发挥其多途径和多靶点作用优势,为其预防和治疗流感病毒所致呼吸道感染性疾病奠定物质基础。
-
[1] FORCINA G C, DIXON S J. GPX4 at the crossroads of lipid homeostasis and ferroptosis[J]. Proteomics, 2019, 19(18):e1800311. doi: 10.1002/pmic.201800311 [2] XIE Y C, KANG R, KLIONSKY D J, et al. GPX4 in cell death, autophagy, and disease[J]. Autophagy, 2023, 19(10):2621-2638. doi: 10.1080/15548627.2023.2218764 [3] GALLUZZI L, VITALE I, AARONSON S A, et al. Molecular mechanisms of cell death: recommendations of the Nomenclature Committee on Cell Death 2018[J]. Cell Death Differ, 2018, 25(3):486-541. doi: 10.1038/s41418-017-0012-4 [4] ZHAO Y C, LI Y Q, ZHANG R F, et al. The role of erastin in ferroptosis and its prospects in cancer therapy[J]. Onco Targets Ther, 2020, 13:5429-5441. doi: 10.2147/OTT.S254995 [5] SCHEERER P, BORCHERT A, KRAUSS N, et al. Structural basis for catalytic activity and enzyme polymerization of phospholipid hydroperoxide glutathione peroxidase-4(GPx4)[J]. Biochemistry, 2007, 46(31):9041-9049. doi: 10.1021/bi700840d [6] SAVASKAN N E, UFER C, KÜHN H, et al. Molecular biology of glutathione peroxidase 4: from genomic structure to developmental expression and neural function[J]. Biol Chem, 2007, 388(10):1007-1017. doi: 10.1515/BC.2007.126 [7] YANG W S, STOCKWELL B R. Synthetic lethal screening identifies compounds activating iron-dependent, nonapoptotic cell death in oncogenic-RAS-harboring cancer cells[J]. Chem Biol, 2008, 15(3):234-245. doi: 10.1016/j.chembiol.2008.02.010 [8] YANG W S, SRIRAMARATNAM R, WELSCH M E, et al. Regulation of ferroptotic cancer cell death by GPX4[J]. Cell, 2014, 156(1-2):317-331. doi: 10.1016/j.cell.2013.12.010 [9] LIU H, FOROUHAR F, LIN A J, et al. Small-molecule allosteric inhibitors of GPX4[J]. Cell Chemical Biology, 2022, 29(12):1680-93. doi: 10.1016/j.chembiol.2022.11.003 [10] WEÏWER M, BITTKER J A, LEWIS T A, et al. Development of small-molecule probes that selectively kill cells induced to express mutant RAS[J]. Bioorg Med Chem Lett, 2012, 22(4):1822-1826. doi: 10.1016/j.bmcl.2011.09.047 [11] CHEN T T, LENG J F, TAN J, et al. Discovery of novel potent covalent glutathione peroxidase 4 inhibitors as highly selective ferroptosis inducers for the treatment of triple-negative breast cancer[J]. J Med Chem, 2023, 66(14):10036-10059. doi: 10.1021/acs.jmedchem.3c00967 [12] XU C J, XIAO Z H, WANG J, et al. Discovery of a potent glutathione peroxidase 4 inhibitor as a selective ferroptosis inducer[J]. J Med Chem, 2021, 64(18):13312-13326. doi: 10.1021/acs.jmedchem.1c00569 [13] EATON J K, RUBERTO R A, KRAMM A, et al. Diacylfuroxans are masked nitrile oxides that inhibit GPX4 covalently[J]. J Am Chem Soc, 2019, 141(51):20407-20415. doi: 10.1021/jacs.9b10769 [14] EATON J K, FURST L, RUBERTO R A, et al. Selective covalent targeting of GPX4 using masked nitrile-oxide electrophiles[J]. Nat Chem Biol, 2020, 16(5):497-506. doi: 10.1038/s41589-020-0501-5 [15] SHIMADA K, SKOUTA R, KAPLAN A, et al. Global survey of cell death mechanisms reveals metabolic regulation of ferroptosis[J]. Nat Chem Biol, 2016, 12(7):497-503. doi: 10.1038/nchembio.2079 [16] GASCHLER M M, ANDIA A A, LIU H R, et al. FINO2 initiates ferroptosis through GPX4 inactivation and iron oxidation[J]. Nat Chem Biol, 2018, 14(5):507-515. doi: 10.1038/s41589-018-0031-6 -





 下载:
下载:
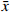

 下载:
下载:






