-
仑伐替尼是一种新型的分子靶向药物,其打破了近10年来索拉非尼作为晚期肝细胞癌(HCC)一线治疗药物的垄断局势,为HCC治疗提供了新的策略[1]。仑伐替尼是一种多靶点酪氨酸激酶抑制剂(TKI),能够阻断血管内皮生长因子受体家族、成纤维细胞生长因子受体家族、血小板源性生长因子受体、酪氨酸激酶受体等的活性[2-6]。已有研究表明,仑伐替尼在抗肿瘤疗效上优于索拉非尼[7-8]。然而,仑伐替尼的水溶性差和生物利用度低,导致其在临床上需要增大剂量以发挥抗肿瘤作用,从而可能引起腹泻、厌食、呕吐、消化道出血,乃至胃肠道穿孔和形成胃肠瘘[9-11]。这些副作用限制了仑伐替尼在HCC治疗中的广泛应用。因此,通过制剂技术改善仑伐替尼的溶解性,降低其不良反应,增强其治疗效果,成为仑伐替尼的研究重点。既往研究显示纳米载体(如胶束、混合胶束、聚合物、脂质体和纳米颗粒等)已被用于改善药物的溶解度和递送效果[12-15]。
近年来,胶束在药物递送、基因传递和诊断成像等多个生物医学领域展现了重要作用。胶束主要由表面活性剂分子通过自发组装形成,具有疏水核心和亲水外壳的结构,能够包裹疏水药物,提高其在体内的溶解度和生物利用度[16-17]。此外,通过调节胶束的组成和结构,可以优化药物的释放特性[18]。而混合胶束利用不同嵌段共聚物的互补特性,具有克服单一聚合物胶束在载药量低和稳定性不足等方面局限的优势[19-21]。
本研究选用具有良好生物相容性、低毒性和增溶性的两亲性嵌段共聚物 P123和 F127作为载体材料,对肝癌一线治疗药物仑伐替尼进行包载。通过星点设计-效应面法优化仑伐替尼混合胶束(LFT-MMs)的工艺处方,为药物递送系统的进一步研究提供科学依据。
-
RV 10 D S96旋转蒸发仪(德国IKA);SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司);Scientz-10N冷冻干燥机(宁波新芝生物科技股份有限公司);KMS-101B磁力搅拌器(上海精凿科技有限公司);Waters
2487 高效液相色谱仪(美国waters公司);N-2000色谱工作站数据处理系统(浙江大学);AE240电子天平、S210 pH计(梅德勒-托利多仪器有限公司);Mastersizer3000 马尔文粒度测定仪(英国Malvern Panalytical Ltd公司);K-82J真空干燥箱(上海博迅医疗生物仪器股份有限公司);JP-100超声波清洗机[深圳市结盟清洗设备(上海)有限公司]。 -
仑伐替尼(aladdin,纯度≥99%,批号:D2219078,购自阿拉丁试剂有限公司);P123(批号:10111562547)、F127(批号:101141111)均为德国 Sigma-Aldrich 公司;甘露醇(批号:20180528)、乙酸铵(分析纯,批号:20160118)均为天津市盛奥化学试剂有限公司;磷酸(批号:20101005,天津永晟精细化工有限公司);甲醇(色谱纯,批号:34860-4 L-R)、乙腈(色谱纯,批号:34851-4 L)均为Sigma-Aldrich;其余试剂均为分析纯;水为灭菌注射用水。
-
采用薄膜水化法制备仑伐替尼混合胶束(LFT-MMs)。精密称取处方量的仑伐替尼原料药及载体材料 P123 和 F127,将其置于 50 ml 圆底烧瓶中,加入甲醇10 ml并超声处理以促进其溶解。在一定温度下旋转蒸发除去有机溶剂,使其形成一层均匀药物薄膜后,置于真空干燥箱中干燥过夜以彻底去除残余溶剂。向干燥膜中加入适量的同温灭菌注射用水在一定温度下进行水化,制得载药胶束溶液,并将溶液冷却至室温。此溶液通过0.22 μm有机微孔滤膜过滤,将其移入透析袋(分子量截留限为8 000),使用去离子水透析以去除杂质及未被包封的药物,最终获得无色透明的LFT-MMs溶液。向LFT-MMs溶液中加入10%的甘露醇作为冻干保护剂,冷冻干燥过夜,最终得到白色固体形态的LFT-MMs粉末,冷冻保存备用。
-
以DiKMA-C18(型号4.6 mm×150 mm,5 μm)为色谱柱,0.1%磷酸水溶液(乙酸铵调节pH至4.5)-90%乙腈(体积比 60∶40)为流动相,检测波长为300 nm,柱温为30℃,流速为1.0 ml/min,进样量为20 μl。
-
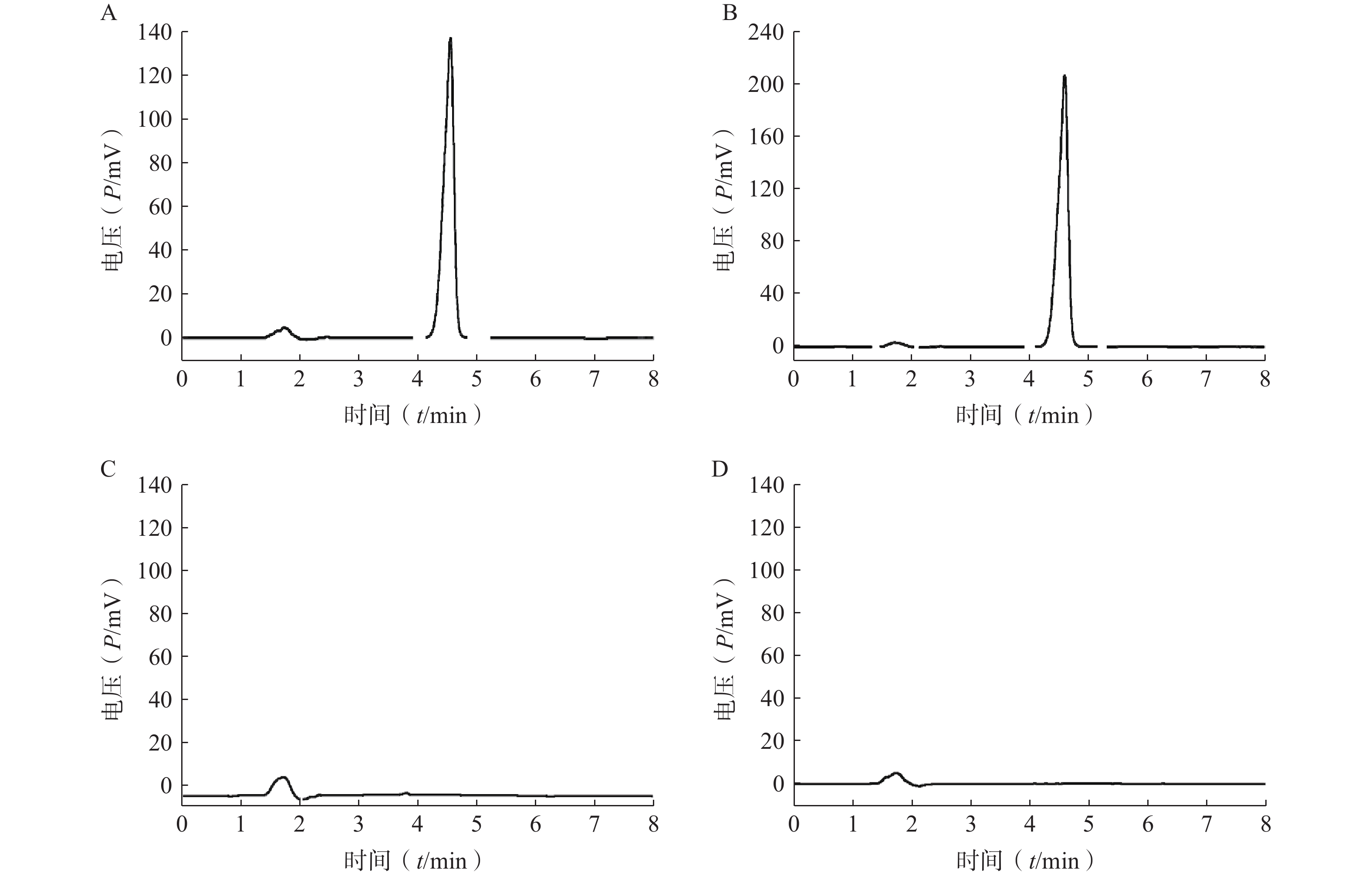
分取LFT-MMs溶液、空白胶束溶液、仑伐替尼对照品溶液,按“2.2.1”项条件进样分析,记录色谱图。如图1所示,仑伐替尼对照品的保留时间大约为 4.6 min, LFT-MMs溶液在相应的保留时间下有色谱峰出现,而空白胶束溶液在相应的时间下无色谱峰出现。该结果表明胶束的辅料P123和F127对仑伐替尼含量的测定无干扰,此方法专属性良好。
-
准确称取10 mg仑伐替尼置于10 ml量瓶中,使用DMSO溶解,并通过0.22 μm微孔滤膜过滤后稀释至刻度,混匀,制备得到1 mg/ml的仑伐替尼对照品储备液。将储备液用甲醇逐步稀释,得到一系列质量浓度分别为100.0、80.0、60.0、40.0、20.0、10.0、5.0 μg/ml的对照品溶液。以仑伐替尼的质量浓度(C)作为横坐标,色谱峰面积(A)作为纵坐标,绘制标准曲线,并得到线性回归方程:A=23 514C+102 029,相关系数r= 0.999 9。结果显示,仑伐替尼的质量浓度在5.0~100.0 μg/ml范围内具有良好的线性关系。
-
在精密度实验中,低浓度(5 μg/ml)、中浓度(40 μg/ml)、高浓度(100 μg/ml)对照品溶液的日内精密度相对标准偏差(RSD)分别为0.73%、0.89%、0.40%,日间精密度RSD分别为1.02%、1.18%、0.87%(n=5)。在回收率测试中,低、中、高质量浓度的加标回收率分别为103.13%、99.93%、101.00%,RSD分别为0.35%、0.70%、0.25%(n=3)。经验证,所建立的检测方法准确且可靠。
-
取同LFT-MMs溶液,在 0、2、4、8、12、24 h,按“2.2.1”条件下测定仑伐替尼的峰面积值,计算 RSD 值为 1.83%,表明供试品溶液在 24 h内稳定性较好。
-
取适量制备的冻干胶束粉末用甲醇溶解,并稀释至一定浓度,超声破乳,经孔径 0.22 μm 微孔滤膜滤过,按“2.2.1”项下色谱条件进行定量。包封率(EE)和载药量(DL)的计算公式如下:
EE(%)=载药胶束中仑伐替尼含量 /仑伐替尼的投药量×100%;
DL(%)= 载药胶束中仑伐替尼含量/(仑伐替尼的投药量+载体材料的总质量)×100%。
-
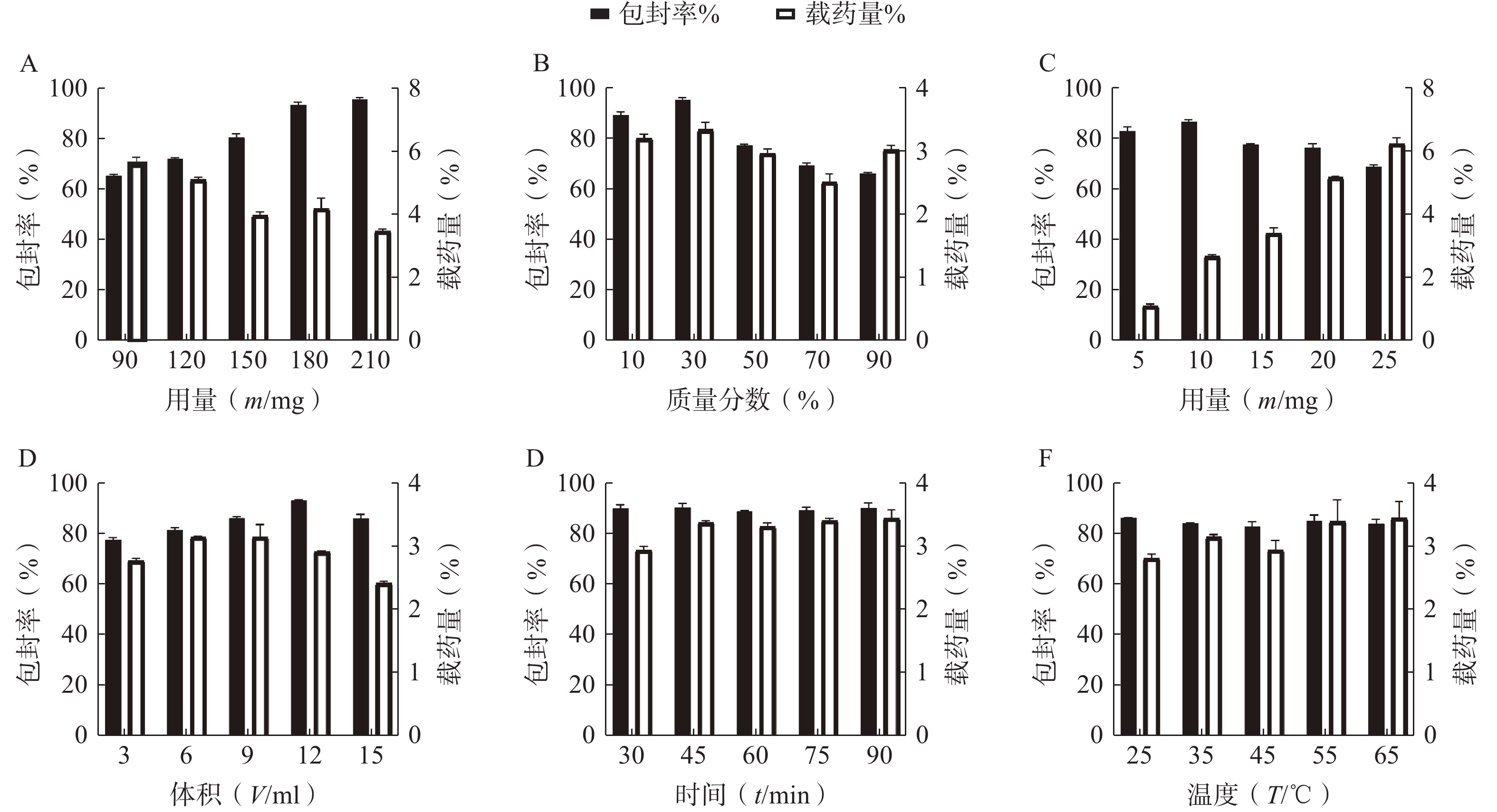
按“2.1”项下的制备方法,以 EE和DL为考察指标,通过单因素试验考察 P123 占载体材料的质量比(10%、30%、50%、70%和90%)、载体材料用量(90、120、150、180和210 mg)、水相体积(3、6、9、12和15 ml)、水化时间(30、45、60、75和90 min)、旋蒸温度(25℃、35℃、45℃、55℃和60℃)、有机溶剂用量(1、2、3、4和5 ml)的影响,结果见图2。根据单因素的初步考察,最终确定投药量为10 mg,旋蒸温度为 55℃,水化时间为45 min,而载体 P123 质量百分比、载体材料用量和水相体积对 EE和DL有显著影响,因此将它们作为待优化项进行星点设计-效应面法实验。
-
在单因素试验的基础上,进一步采用星点设计-效应面法优化LFT-MMs制剂工艺。选择载体 P123 质量百分比(a)、P123-F127 混合载体用量(b)、水相体积(c)3 个显著因素作为考察因素,每因素设 5 个水平,因素水平见表1。应用 Design Expert 12软件以 EE(Y1) 和DL(Y2)为考察指标,设计共 20个试验点的效应面分析试验,见表2。
表 1 星点设计因素水平表
因素 P123质量百分比
(%)F127-P123用量
(m/mg)水化体积
(V/ml)−1.68 6.25 49.09 2.93 −1.00 25.00 90.00 6.00 0 52.50 150.00 10.50 1.00 80.00 210.00 15.00 1.68 98.75 250.91 18.07 表 2 星点设计表及效应值
序号 a:P123质量
百分比(%)b:载体材料
用量(m/mg)c:水化体积
(V/ml)包封率
(%)载药量
(%)1 80.00 90.00 6.00 90.79 9.53 2 52.50 150.00 10.50 80.95 5.95 3 52.50 150.00 10.50 77.21 6.19 4 25.00 90.00 6.00 59.43 4.91 5 52.50 150.00 10.50 79.97 6.16 6 98.75 150.00 10.50 90.04 5.62 7 80.00 210.00 6.00 77.86 6.96 8 25.00 90.00 15.00 43.77 4.98 9 80.00 210.00 15.00 94.30 4.10 10 52.50 150.00 10.50 84.36 6.82 11 6.25 150.00 10.50 79.19 6.46 12 25.00 210.00 6.00 85.31 3.62 13 52.50 150.00 18.07 76.50 4.33 14 52.50 150.00 10.50 83.22 6.96 15 52.50 250.90 10.50 80.85 3.33 16 52.50 150.00 10.50 82.82 6.99 17 80.00 90.00 15.00 68.94 7.95 18 25.00 210.00 15.00 83.54 5.29 19 52.50 49.09 10.50 52.12 8.99 20 52.50 150.00 2.93 70.97 8.09 -
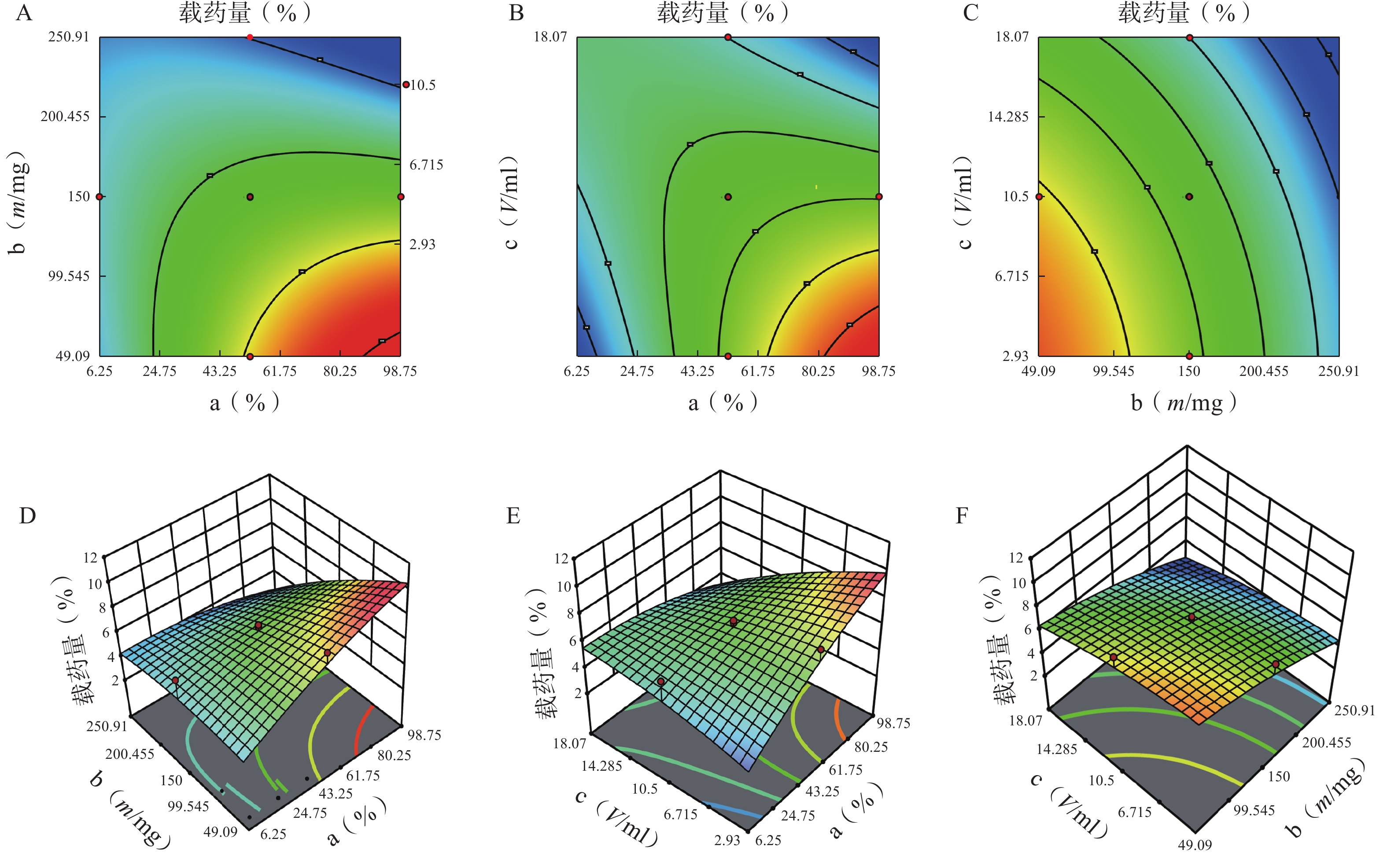
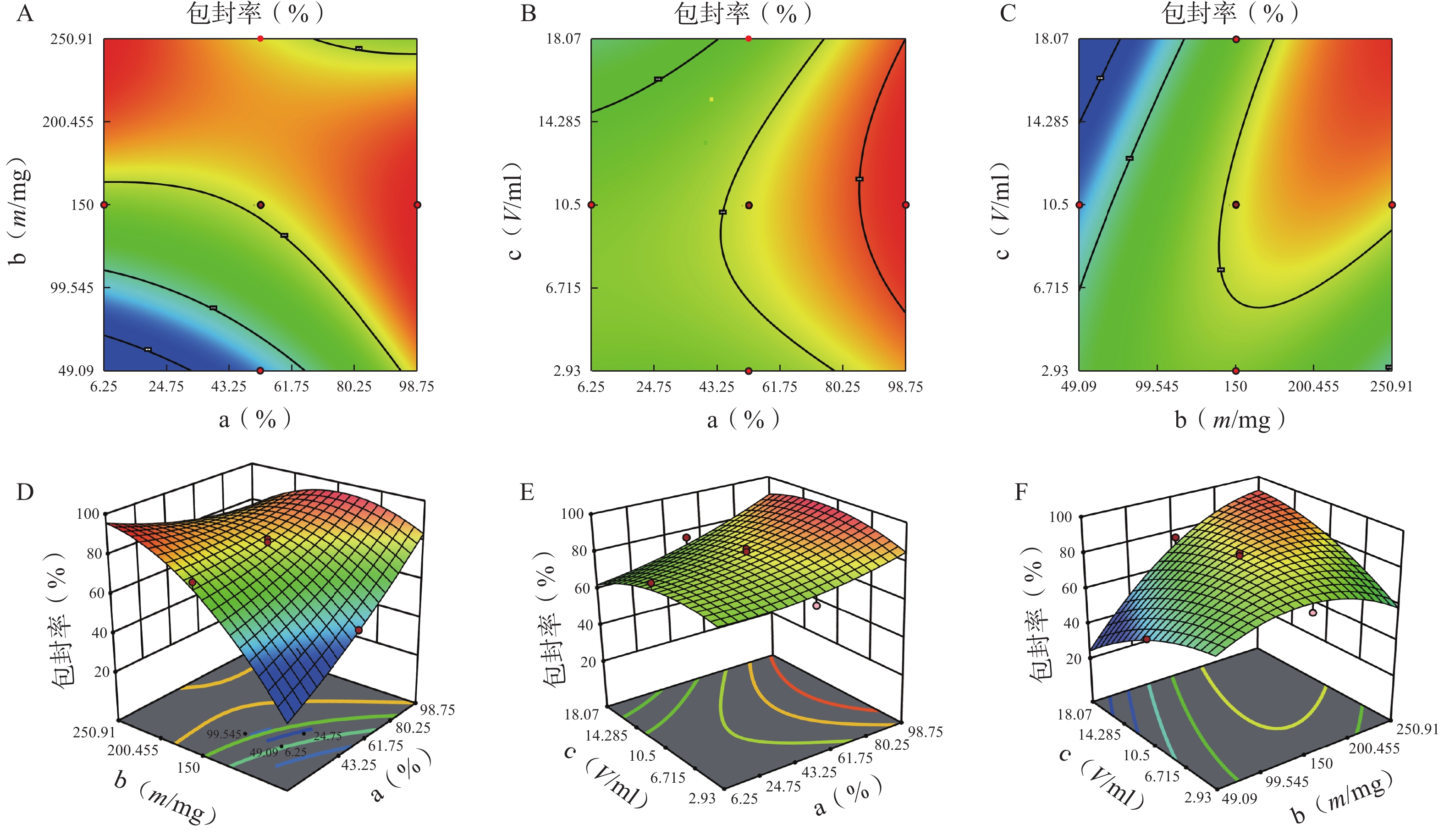
分别对各因素各水平用Design Expert 12软件进行多元线性回归及模型拟合后,以模型回归项的差异显著(P<0.01)且R2是否接近1来评价模拟方程。发现以三次多项式拟合效果最好(R2接近1且P值较小),具体方程及评价指标如下:
Y1=81.42+5.43 a+6.71 b+2.77 c−18.82 ab+4.25 ac+18.45 bc+3.19 a2−12.28 b2−7.69 c2+14.51 abc−0.012 2 a2b−21.41 a2c+20.24 ab2 (r2=0.989 0,P=0.006 1);
Y2=6.51−0.42 a−1.402 b−1.88 c−1.92 ab−2.19 ac+0.113 2 bc+0.471 7 a2−0.907 3 b2−0.301 8 c2−1.71 abc−0.025 6 a2b+3.71 a2c+6.98 ab2 (r2=0.980 6,P=0.002 4)。
各方程的方差分析结果见表3。两个模型均具有显著性差异(P<0.05),能较好反映因素对效应值的影响。进一步分析各方程中的各项“a、b、ab、bc、b2 ”对包封率有显著性影响,发现a、b、a2、b2对载药量有显著性影响。
表 3 效应面拟合模型对包封率和载药量的方差分析
方差来源 自由度 包封率 载药量 平方和 均方 F值 P值 平方和 均方 F值 P值 模型 9 2833.07 314.79 12.95 <0.01 41.61 4.62 3.48 0.03 a 1 446.49 446.49 18.37 <0.01 5.08 5.08 3.82 0.08 b 1 1169.85 1169.85 48.12 <0.01 20.96 20.96 15.78 0.00 c 1 13.42 13.42 0.55 0.47 5.96 5.96 4.49 0.06 ab 1 354.05 354.05 14.56 <0.01 3.70 3.70 2.79 0.13 ac 1 18.06 18.06 0.74 0.41 4.77 4.77 3.59 0.09 bc 1 340.34 340.34 14.00 <0.01 0.01 0.01 0.01 0.92 a² 1 25.39 25.39 1.04 0.33 0.62 0.62 0.47 0.01 b² 1 372.27 372.27 15.31 <0.01 0.40 0.40 0.30 0.01 c² 1 91.46 91.46 3.76 0.08 0.32 0.32 0.24 0.64 残差 10 243.11 24.31 13.28 1.33 失拟项 5 209.21 41.84 6.17 0.03 12.21 2.44 11.44 0.01 净误差 5 33.89 6.78 1.07 0.21 总离差 19 3076.18 54.89 由以上方程可知,三项式拟合相关系数 R2 值高于多元线性回归及二次项拟合,失拟值无显著性,表明建立的模型可靠,拟合情况良好,故选择三项式拟合模型为最终模型。据上述回归模型绘制三维效应面图和二维等高线图,结果见图3、图4。软件分析优化得到LFT-MMs 的最优制备工艺为:P123 质量百分比为 80%,载体材料用量为 90 mg,水化体积为 6 ml。
-
根据星点设计-效应面法得出的最佳处方工艺,制备 3批 LFT-MMs,并测量对每批胶束的EE和DL,取平均值与预测值进行比较。预测EE为84.24%,DL为8.67%,测得平均EE为(83.33±0.30)%,平均DL为(8.67±0.07)%。EE和DL预测值和实际测量值偏差较小且工艺重复性好,说明建立的三次回归模型,在试验范围内具有很好的预测性,可为载药胶束制备提供理论依据。
-
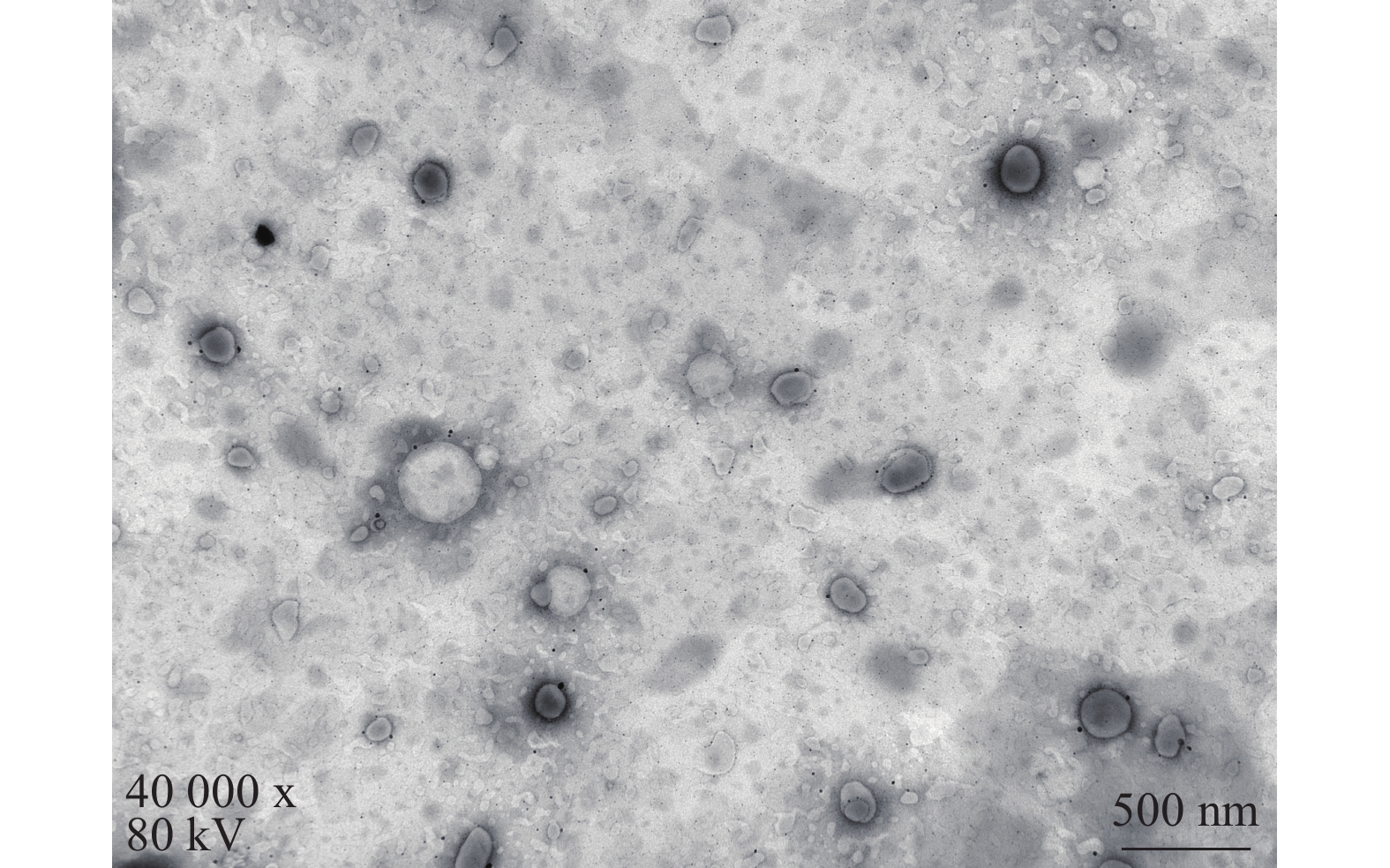
将最优工艺制备的 LFT-MMs冻干制剂用灭菌注射用水稀释到一定倍数后,取1滴于铜网上吸附后,用 2.0%磷钨酸负染,自然挥干,置透射电镜下观察微观形态并拍照,结果可见LFT-MMs的形态规整,呈圆球形,分散性好,无聚集(图5)。
-
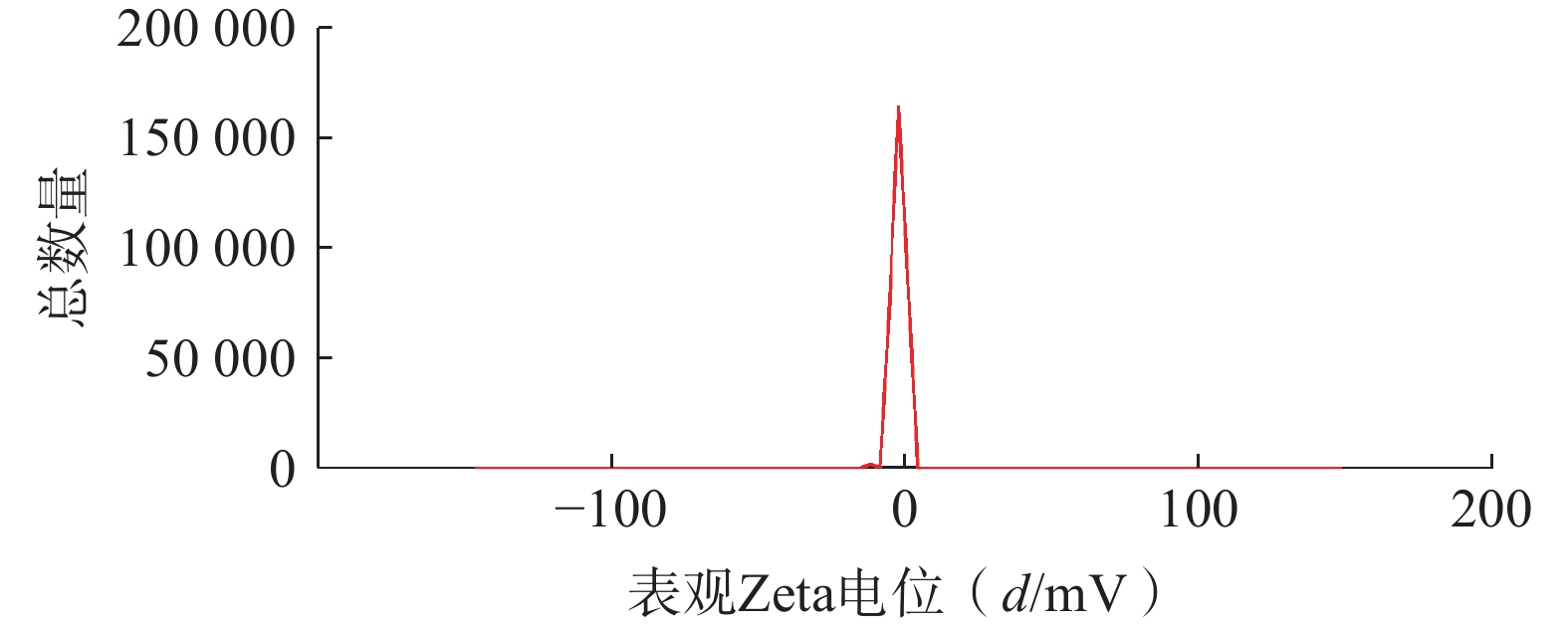
将最优工艺制备的 LFT-MMs冻干制剂用灭菌注射用水稀释到一定倍数后,使用马尔文纳米粒度电位仪测定胶束的粒径、 PDI及Zeta 电位,结果见图6、图7。LFT-MMs 的平均粒径、PDI 和 Zeta 电位分别为(104.0±0.32) nm、(0.22±1.19)和(−2.56±0.81) mV。
-
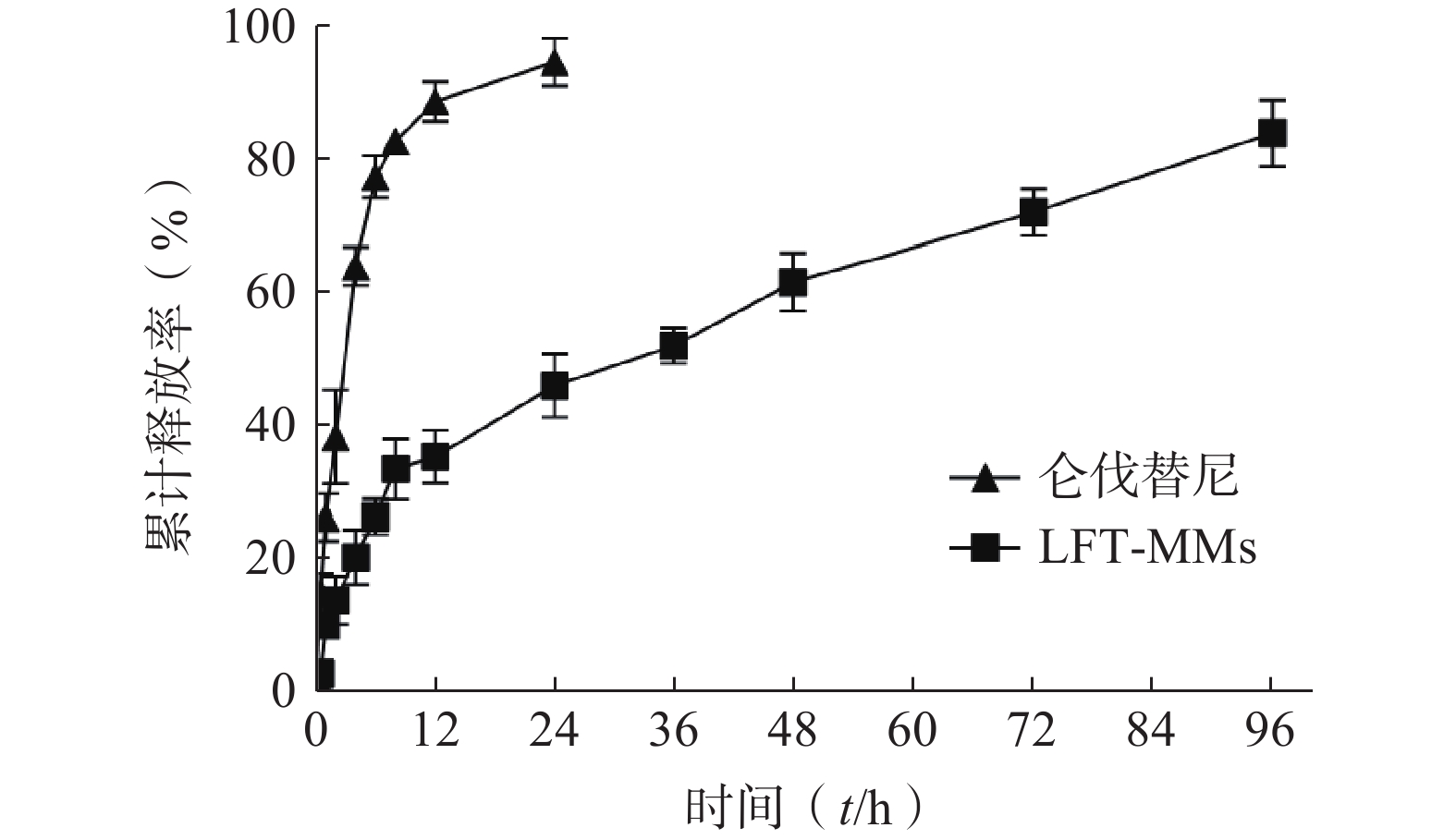
选择含0.5%(w/v)Tween 80的PBS(pH=7.4)作为体外释放介质,采用恒温振荡摇床法进行 LFT-MMs纳米胶束的体外释放实验。将游离仑伐替尼、LFT-MMs纳米胶束冻干粉末用灭菌注射用水稀释至1 mg/ml,精密吸取 3 ml装入预先处理过的透析袋(截留分子量为 8 000),两端扎紧后置于已装40 ml 释放介质的50 ml离心管中,将其放入预设好的恒温振荡器中,温度为 37℃,震荡频率为100 r/min。分别于 0.5、1、2、4、6、8、12、24、36、48、72及96 h 取样3 ml,并补入相同温度,相同体积的释放介质,平行3批样品。取出的样品用0.22 μm微孔滤膜过滤,采用HPLC测定释放介质中仑伐替尼含量,计算累积释放百分率,绘制体外累积释放曲线(图8)。结果显示,在96 h 内LFT-MMs 体外释放缓慢平稳,具有一定的缓释能力。
-
尽管用于治疗肝脏疾病的化疗药物在不断研发与应用,但由于其水溶性低,对其他正常组织产生毒副作用等问题限制了其临床应用。因此,提升难溶性药物的溶解度和生物利用度在药物制剂设计中至关重要。胶束不仅可以提升药物的溶解度和生物利用度,还可以通过调节其组成和结构来优化药物释放特性,因而在药物递送、基因传递和诊断成像等众多生物医学领域中发挥了重要作用。本研究采用薄膜水化法制备的载仑伐替尼的纳米胶束制剂,具有均一的粒径、良好的分散性和高稳定性。在本研究中,通过单因素结合星点设计-效应面法筛选包括P123质量百分比、载体材料用量、投药量、水化体积、水化时间、旋蒸温度等变量,以EE和DL为考察指标,最终确定了最优处方。在此条件下的验证试验显示,实际EE和DL与预测值接近,证明了利用星点设计-效应面法优化后的胶束制备工艺的稳定性和良好的工艺重现性。
综上所述,本研究通过采用星点设计-效应面法优化了仑伐替尼混合胶束的处方和制备工艺。该方法预测性强,成功制备的胶束具有较高的DL和EE,外观规整,粒径分布均一,且药物释放稳定,为仑伐替尼新剂型的进一步研发提供了重要参考。随着各种新型两亲性嵌段共聚物的不断发展,基于胶束的药物递送系统在从理论到临床应用的转化上将展现出更大的潜力。
Optimization of the preparation process for lenvatinib mixed micelles by central composite design-response surface methodology
-
摘要:
目的 优化仑伐替尼混合胶束的处方及其制备工艺。 方法 以Pluronic P123和F127作为载体材料,通过薄膜水化法制备仑伐替尼混合胶束。利用单因素实验和星点设计-效应面法筛选出最优处方并对其物理性质进行初步表征。 结果 优化后的最佳处方和工艺条件为:P123质量百分比80%、载体材料用量90 mg、投药量10 mg、水化体积6 ml、水化时间45 min、旋蒸温度55℃。制备得到的仑伐替尼混合胶束的平均粒径为(104.0±0.32) nm,PDI为0.22±1.19,Zeta电位为(−2.56±0.81) mV,平均包封率为83.33%±0.30%,平均载药量为8.67%±0.07%。胶束形态为分布均一的规整球形,并显示出一定的缓释性能。 结论 该研究开发的制备工艺简单可行,所得载药胶束具有较高的载药量和包封率且释放稳定,为仑伐替尼混合胶束的进一步研究和开发提供了有价值的参考。 Abstract:Objective To optimize the formulation and preparation process of lenvatinib mixed micelles. Methods Hybrid micelles of lenvatinib were prepared by film hydration method, with Pluronic P123 and F127 as carrier materials. Optimal formulation was selected through single-factor experiments and central composite design-response surface methodology, and preliminary characterization of its physical properties was conducted. Results The optimized formulation and process conditions were identified as follows: P123 mass percentage of 80%, carrier material amount of 90 mg, drug loading of 10 mg, hydration volume of 6 ml, hydration time of 45 min, and rotary evaporation temperature of 55℃. The resulting lenvatinib mixed micelles had an average particle size of (104.0±0.32) nm, a polydispersity index (PDI) of 0.22±1.19, and a Zeta potential of (−2.56±0.81) mV. The average encapsulation efficiency was 83.33%±0.30% and the average drug loading was 8.67%±0.07%. The micelles displayed a uniform spherical morphology with a certain sustained-release capability. Conclusion The preparation process developed in this study was simple and feasible and produced drug-loaded micelles with high drug loading and encapsulation rates, and stable release, which could provide valuable insights for further research and development of lenvatinib mixed micelles. -
药物利用研究(DUR)是促进用药安全、有效和经济的重要手段[1]。随机对照临床试验(RCT)作为评价药物安全性、有效性的金标准,在外推至日常诊疗环境时往往面临挑战。作为RCT的重要补充,真实世界研究(RWS)考察日常诊疗环境中产生的真实世界数据(RWD),注重评价药物使用的“安全性”和“有效性”,已经成为药物利用研究的热点[2]。RWS着眼于应用到医疗实践环境中,大大缩短了试验周期、降低了成本,真实世界实效性临床研究更加易于获取全面的病例数据,使其结果更具有可靠性及可行性[3]。应当正确认识两者关系,将两者作为互补且相辅相成的研究方法和手段来为药物利用评价和监管评价等方面提供循证支持[4-7]。
随着医院管理信息系统(HIS)的高速发展以及高新传感器技术在生物医疗领域探索运用,使得逐步精准化、数字化患者的各项检查及健康诊疗数据成为现实,并进一步完善患者诊疗、实验室检查以及用药信息等全生命周期的医疗记录,且便于追溯及交互关联[2]。尽管数据库技术及大数据挖掘服务于药物安全性、有效性等方面研究成为现实,但应用于DUR尚缺乏具体的技术指导方案、自然流程等。本研究借鉴国内外RWS在药品器械上市后适应证开发及安全性评价方面的做法,梳理DUR中RWS有效技术手段和方法路径,为RWS更好的服务于DUR提供借鉴和参考。
1. 相关概念
DUR是按照预定的标准,评价、分析和解释一个给定的医疗卫生制度下药物利用的模式、质量、影响因素和结果,着重于药物的市场销售、分配、处方和使用情况,强调由此产生的医疗、社会和经济方面的结果。广泛应用于药物流行病学、抗菌药物管理、药物监测、药物警戒等方面的研究。2020年4月,国家药监局发布《真实世界证据支持药物研发与审评的指导原则(试行)》[8],对RWD、真实世界证据(RWE)以及RWS等概念做了相关阐述[8-9]。RWS作为实现从RWD到RWE的有效手段,是连接两者的桥梁[10]。然而,大规模的数据并不一定就能产生有价值的证据,只有通过适用性评估的RWD、分析得出医疗产品的使用和潜在收益或风险的临床证据时才有可能使数据转变为证据[11-12]。数据适用性即从数据使用者角度出发,评价数据满足使用者需求的程度[13],强调数据质量在开展相应RWS方面的可应用程度[14]。
2. 真实世界药物利用研究现状
2.1 真实世界研究与药物利用研究结合现状
国家药品监督管理局自2014年起就陆续出台多项措施,支持RWS用于医疗器械评价、药物审评、研发及监管决策,完善医疗器械不良事件监测和再评价制度,并联合高校、医联体推进多项试点工作的开展,出台了《真实世界研究支持儿童药物研发与审评的技术指导原则(试行)》[15]等法规文件以推进RWS。目前RWS主要集中在以下3个方面:①药物治疗效果[16-17],RWS在药物疗效、不良事件、安全可靠方面的结果研究,以满足药物对人类临床应答的解释以及推广方面应用;②指南或临床实践[18-20],国内外权威的指南是临床实践的重要参考依据,RWS也可用于协助制定和修订患者治疗方案,而RWE有利于指南更加科学性和具有实践性。此外,RWS还可以用于协助政府部门管理的指导性文件的制定;③经济效益[21-23],RWS应用于卫生经济学中筛选研究和治疗选择等方面,帮助医师制定最优的药物治疗方案,并提供合理的经济成本。此外,RWS在帮助制定个性化医疗政策方面也具有很大的潜力。
2.2 真实世界研究体系现状
国际上,随着药品审评和监管标准的不断提高,越来越多的研究者重视RWS,目前已经形成了良好的研究体系,比如美国的以患者为中心的结局研究所(PCORI)和欧盟临床试验公共注册和结果数据库(EUPAS)。RWS主要集中于:①在研究用药的随机对照试验、观察性研究及实践指南中的应用;②在疾病的发病风险评估、医疗健康保险的应用。目前国内的RWS主要涉及:①在中医方面的应用研究[24-26],包括中药的药物疗效及不良反应的研究;②基于医院信息数据库疾病及其合并疾病的用药特征的分析;③在医疗大数据及循证医学方面的应用[27-29]。
RWS的研究设计和方法学也不断完善,近年来不少国家或国际组织都陆续出台关于RWS的指南以及指导原则,提高了RWS的质量和可靠性,比如美国 FDA[30-31]、欧洲EMA[32],英国NICE[33]。
3. 真实世界研究在药物利用研究中的应用
3.1 真实世界药物利用研究的方法
3.1.1 数据来源及研究问题
RWS收集真实诊疗数据或者基于已经存在的研究型数据库或数据研究平台,建立登记数据库,针对具体研究问题,运用循证医学方法,开展数据分析,从而回答验证假设[34-36]。RWD通常来自于以上一个或多个数据库,包含需要主动收集的数据以及常规诊疗行为产生的临床数据。随着医学大数据的快速发展,一些研究型数据库或数据研究平台也逐步拓展,目前,国内外利用公共数据库如SEER、MIMIC等进行相关研究已成为RWS的重要发展方向。
RWS通常基于研究目的建立研究数据库或数据集,研究要素一般包含目标患者人口学特征、用药信息、门诊、住院信息、实验室检查、治疗转归与结局,以及其他研究目的所涉及到的临床治疗、护理、手术处置等信息。如果数据来自多个不同数据库,还必须通过如患者身份证号码、住院号/检查号、姓名等患者唯一标识码进行辨识和数据关联。如果研究的资料内容涉及到患者的个人信息等情况,还要注意取得伦理学审核以及保护患者隐私[37-41]。真实世界DUR的药品数据通常通过ATC编码来规范,采用用药依从性,限定日剂量(DDD)、平均治疗天数(ATD)、总DDD数、处方年费用等DUR指标[42]。基于药物效果和安全性研究、经济学和药物政策、多个疾病和多个治疗方案的复杂病情分析是当前真实世界药物利用研究的一个热点。
RWS作为一项非随机、开放性、不使用安慰剂的研究。为了挖掘真实的临床医疗环境产生的诊疗数据,应把质量控制作为全局指标来进行把握,并从研究伊始就建立起全面的数据质量控制方案并严格遵守。同时,在研究中详细记录异常情况[43],还要注意数据清洗以及混杂因素的控制,如此才能保证研究证据的质量及等级[44]。
3.1.2 研究人群及纳排标准
RWS人群纳入条件较为宽松,但仍在研究中需要明确与研究目的相关或可能影响研究的因素,以及纳入及排除标准的研究时间段和制定日期。研究通常通过WHO国际疾病分类(ICD-9/10)筛选研究人群。研究人群通常为患有特定疾病的患者、药物使用者(罕见病、孕妇、儿童等)以及患有多种疾病的复杂病例或有多种伴随症状的人群。有时候为解决研究对象以往接受过某种治疗措施可能导致的选择偏倚,还需要考虑遵照首次用药人群的设计[45]。最后,研究者需谨慎纳入和排除标准,以免直接影响研究结果的外推。
研究者应当严格参照PICOTS原则明确的6个关键点(总体、干预、比较对象、结果、时间和场所),同利益相关者一同提出针对研究问题可利用的科学方法[46]。
3.1.3 真实世界药物利用研究设计
观察性研究设计是RWS中广泛使用的设计类型之一[44],常见的有前瞻性观察研究[47]、回顾性队列研究[18,48]、Meta分析[49]等。根据不同的研究目的和研究对象,可以选择适合的研究方法和样本来源,通常需要开展大规模、跨学科的合作,以确保研究结果的可靠性和科学性。RWS设计时要结合研究目的来具体确定研究要素,综合考虑年龄、混杂偏倚和特殊人群、药品ATC编码,以及病历等非结构化数据。设计通常包括以下几个阶段:①定义问题:在研究开始之前明确研究的目的和问题,确定研究的对象、变量和数据采集方式。需要考虑研究的可行性、科学性和意义。②研究设计:根据定义的问题,制定设计方案。明确设计类型、样本容量、数据采集方式、结局指标以及数据分析方法等。③招募研究对象:确定研究对象的选择标准,并依照这些标准进行样本招募。④数据收集和管理:采集所需的研究数据,将收集到的数据进行规范化、清洗、质量控制和审查等处理。⑤数据分析:使用统计学方法进行数据分析,包括描述性统计、回归分析、生存分析和成本效益分析等。⑥结果解释和推广:将研究结果进行整合、解释和推广,发表研究报告和文章,向目标受众,如医师、政策制定者、患者和公众等,传达研究结论和建议。
3.1.4 特征变量及评价指标
RWS设计阶段应该充分了解现有数据的优缺点,并恰当合理的定义并描述暴露因素,尽可能的收集与暴露相关的特征指标。RWS结局指标是评估一种治疗或干预措施在真实医疗实践中的效果和安全性以及相关临床和经济结果的指标。
通常有以下几种结局指标:①主要疗效结局:主要的成果、结果或效果指标。例如,治疗效果、复发率、临床终点事件;②次要疗效结局:主要疗效结局之外的其他疗效结果或事件。如总体存活率(OS)、无进展生存期(PFS)、无病生存期(DFS)、疾病进展时间(TTP)、治疗失败时间(TTF)、死亡率,住院时间等[50];③安全性结局[12,51]:一般采用药物不良反应(ADR)、不良反应发生率(IRs,通常以1000人/年表示)[12]、危险性信号、药物相互作用等;④经济学结局[52-53]:包括成本效益和成本效用评估、日均费用、医疗保险、社会资源利用及患者的自付费用等。
选取结局指标时需要根据研究目的和研究对象,进行目标导向和可行性评估。常规首选应该是临床意义明确和易于全面评估的主要疗效结局,同时可以考虑次要疗效结局和安全性结局作为辅助评估。为综合评估治疗效果和成本并获得系统的经济评估结果,相关经济学方面的评价指标也应该考虑进来。
3.2 统计及敏感性分析
通常对目标患者群体和治疗模式进行描述性统计分析,分析各分类变量的频率、百分比,以及在连续区间尺度上测量的变量平均值、标准差、中位数及范围,有学者应用Kaplan-Meier(KM)生存函数进行相关生存分析[54]。针对研究目标确定分析要素,选用合适的统计分析方法,如卡方检验、logistic回归和多元线性回归等,对治疗结局、暴露因素、协变量数据类型及分布情况进行校正分析。由于所有研究结果基于假设提出,而这些假设往往是推论真实性的依据。研究者需对数据的局限性和问题本质有清晰认识,研究过程中对假设进行调整,评价观察结果对特定假设的敏感度或方向大小上的一致性。
3.3 混杂因素及偏倚控制
3.3.1 混杂因素
RWD来源包含电子病历、医保数据库、生命体征记录、医学图像等,存在许多复杂的混杂因素。混杂因素可能的类型包括个体基线特征、随时间变化的特征、医疗诊断和治疗、环境因素。常见的混杂控制策略包括随机对照、匹配分析、协变量校正、倾向值和剂量反应模型等。除此之外,在实施RWS时,还要注意有代表性的样本选择,对数据质量和分析偏倚进行评估和控制,以获得准确和可靠的研究结论。
3.3.2 偏倚控制
RWS是在真实临床环境下进行的研究,目标人群的治疗措施因非随机分配影响内部真实性,虚弱个体治疗措施与结局之间的关联性等,使得其研究结果可能存在一定的偏倚,这些偏倚可能影响研究的可靠性和有效性。常见的偏倚类型包括选择性偏倚、信息偏倚[55]、报告偏倚、记忆偏倚等,常见的偏倚控制方法有模拟试验、设计分层、倾向值匹配、重复量表、级联分析等。
4. 展望
真实世界DUR作为一种新兴的药物评价方法,可将从真实世界环境下收集和分析的大量数据利用起来,通过实效性、回顾性研究使得过往产生的既有诊疗数据进一步提炼成RWE而二次利用。通过研究分析获得的循证医学证据,可以为DUR提供有价值的依据,帮助优化药物使用、个体化医疗、提高患者结局、降低医疗费用、促进医学的健康发展;也可采用前瞻性研究大样本或特殊人群,为其更好、更安全有效用药提供证据。
同时,RWS也是评价药物滥用的有效手段。随着大数据和医疗技术的不断发展,RWS将会成为药物治疗效果、患者治疗策略和临床实践方面重要的研究领域,并将不断地推动医药的创新、优化和进步。
值得注意的是,RWS是一项复杂的研究工作,需要具备较强的统计、数据挖掘和医学知识背景,同时也面临着数据质量、缺失值、样本匹配和结果影响因素多等问题。因此,在实施RWS时,需要有效的科学设计、广泛报告,同时进行敏感度分析和可能存在的偏差分析,为制定更加科学和有效的药物治疗方案提供科学支持。
-
表 1 星点设计因素水平表
因素 P123质量百分比
(%)F127-P123用量
(m/mg)水化体积
(V/ml)−1.68 6.25 49.09 2.93 −1.00 25.00 90.00 6.00 0 52.50 150.00 10.50 1.00 80.00 210.00 15.00 1.68 98.75 250.91 18.07 表 2 星点设计表及效应值
序号 a:P123质量
百分比(%)b:载体材料
用量(m/mg)c:水化体积
(V/ml)包封率
(%)载药量
(%)1 80.00 90.00 6.00 90.79 9.53 2 52.50 150.00 10.50 80.95 5.95 3 52.50 150.00 10.50 77.21 6.19 4 25.00 90.00 6.00 59.43 4.91 5 52.50 150.00 10.50 79.97 6.16 6 98.75 150.00 10.50 90.04 5.62 7 80.00 210.00 6.00 77.86 6.96 8 25.00 90.00 15.00 43.77 4.98 9 80.00 210.00 15.00 94.30 4.10 10 52.50 150.00 10.50 84.36 6.82 11 6.25 150.00 10.50 79.19 6.46 12 25.00 210.00 6.00 85.31 3.62 13 52.50 150.00 18.07 76.50 4.33 14 52.50 150.00 10.50 83.22 6.96 15 52.50 250.90 10.50 80.85 3.33 16 52.50 150.00 10.50 82.82 6.99 17 80.00 90.00 15.00 68.94 7.95 18 25.00 210.00 15.00 83.54 5.29 19 52.50 49.09 10.50 52.12 8.99 20 52.50 150.00 2.93 70.97 8.09 表 3 效应面拟合模型对包封率和载药量的方差分析
方差来源 自由度 包封率 载药量 平方和 均方 F值 P值 平方和 均方 F值 P值 模型 9 2833.07 314.79 12.95 <0.01 41.61 4.62 3.48 0.03 a 1 446.49 446.49 18.37 <0.01 5.08 5.08 3.82 0.08 b 1 1169.85 1169.85 48.12 <0.01 20.96 20.96 15.78 0.00 c 1 13.42 13.42 0.55 0.47 5.96 5.96 4.49 0.06 ab 1 354.05 354.05 14.56 <0.01 3.70 3.70 2.79 0.13 ac 1 18.06 18.06 0.74 0.41 4.77 4.77 3.59 0.09 bc 1 340.34 340.34 14.00 <0.01 0.01 0.01 0.01 0.92 a² 1 25.39 25.39 1.04 0.33 0.62 0.62 0.47 0.01 b² 1 372.27 372.27 15.31 <0.01 0.40 0.40 0.30 0.01 c² 1 91.46 91.46 3.76 0.08 0.32 0.32 0.24 0.64 残差 10 243.11 24.31 13.28 1.33 失拟项 5 209.21 41.84 6.17 0.03 12.21 2.44 11.44 0.01 净误差 5 33.89 6.78 1.07 0.21 总离差 19 3076.18 54.89 -
[1] ZHAO Y, ZHANG Y N, WANG K T, et al. Lenvatinib for hepatocellular carcinoma: From preclinical mechanisms to anti-cancer therapy[J]. Biochim Biophys Acta Rev Cancer, 2020, 1874(1):188391. doi: 10.1016/j.bbcan.2020.188391 [2] CHEN C Y, WU S M, LIN Y H, et al. Induction of nuclear protein-1 by thyroid hormone enhances platelet-derived growth factor A mediated angiogenesis in liver cancer[J]. Theranostics, 2019, 9(8):2361-2379. doi: 10.7150/thno.29628 [3] WANG Y J, LIU D F, ZHANG T Y, et al. FGF/FGFR signaling in hepatocellular carcinoma: from carcinogenesis to recent therapeutic intervention[J]. Cancers, 2021, 13(6):1360. doi: 10.3390/cancers13061360 [4] AL-SALAMA Z T, SYED Y Y, SCOTT L J. Lenvatinib: a review in hepatocellular carcinoma[J]. Drugs, 2019, 79(6):665-674. doi: 10.1007/s40265-019-01116-x [5] HATANAKA T, NAGANUMA A, KAKIZAKI S. Lenvatinib for hepatocellular carcinoma: a literature review[J]. Pharmaceuticals, 2021, 14(1):36. [6] FACCIORUSSO A, TARTAGLIA N, VILLANI R, et al. Lenvatinib versus sorafenib as first-line therapy of advanced hepatocellular carcinoma: a systematic review and meta-analysis[J]. Am J Transl Res, 2021, 13(4):2379-2387. [7] VENTURA C, JUNCO M, SANTIAGO VALTIERRA F X, et al. Synergism of small molecules targeting VDAC with sorafenib, regorafenib or lenvatinib on hepatocarcinoma cell proliferation and survival[J]. Eur J Pharmacol, 2023, 957:176034. doi: 10.1016/j.ejphar.2023.176034 [8] CHEN Y Y, WANG C C, LIU Y W, et al. Clinical impact of lenvatinib in patients with unresectable hepatocellular carcinoma who received sorafenib[J]. PeerJ, 2020, 8:e10382. doi: 10.7717/peerj.10382 [9] SUESHIGE Y, SHIRAIWA K, HONDA K, et al. A broad range high-throughput assay for lenvatinib using ultra-high performance liquid chromatography coupled to tandem mass spectrometry with clinical application in patients with hepatocellular carcinoma[J]. Ther Drug Monit, 2021, 43(5):664-671. doi: 10.1097/FTD.0000000000000872 [10] SPAHN S, KLEINHENZ F, SHEVCHENKO E, et al. The molecular interaction pattern of lenvatinib enables inhibition of wild-type or kinase-mutated FGFR2-driven cholangiocarcinoma[J]. Nat Commun, 2024, 15(1):1287. doi: 10.1038/s41467-024-45247-6 [11] TAO M, HAN J, SHI J Y, et al. Application and resistance mechanisms of lenvatinib in patients with advanced hepatocellular carcinoma[J]. J Hepatocell Carcinoma, 2023, 10:1069-1083. doi: 10.2147/JHC.S411806 [12] CHEN S Z, HAO X H, LIANG X J, et al. Inorganic nanomaterials as carriers for drug delivery[J]. J Biomed Nanotechnol, 2016, 12(1):1-27. doi: 10.1166/jbn.2016.2122 [13] JACOB S, NAIR A B, BODDU S H S, et al. The emerging role of lipid nanosystems and nanomicelles in liver diseases[J]. Eur Rev Med Pharmacol Sci, 2023, 27(18):8651-8680. [14] KIM S, OH S M, KIM S Y, et al. Role of adsorbed polymers on nanoparticle dispersion in drying polymer nanocomposite films[J]. Polymers, 2021, 13(17):2960. doi: 10.3390/polym13172960 [15] SAKAI-KATO K, YOSHIDA K, TAKECHI-HARAYA Y, et al. Physicochemical characterization of liposomes that mimic the lipid composition of exosomes for effective intracellular trafficking[J]. Langmuir, 2020, 36(42):12735-12744. doi: 10.1021/acs.langmuir.0c02491 [16] SINANI G, DURGUN M E, CEVHER E, et al. Polymeric-micelle-based delivery systems for nucleic acids[J]. Pharmaceutics, 2023, 15(8):2021. doi: 10.3390/pharmaceutics15082021 [17] MOHAN A, NAIR S V, LAKSHMANAN V K. Polymeric nanomicelles for cancer theragnostics[J]. Int J Polym Mater Polym Biomater, 2018, 67(2):119-130. doi: 10.1080/00914037.2017.1309540 [18] JIN G W, REJINOLD N S, CHOY J H. Multifunctional polymeric micelles for cancer therapy[J]. Polymers, 2022, 14(22):4839. doi: 10.3390/polym14224839 [19] MANJAPPA A S, KUMBHAR P S, PATIL A B, et al. Polymeric mixed micelles: improving the anticancer efficacy of single-copolymer micelles[J]. Crit Rev Ther Drug Carrier Syst, 2019, 36(1):1-58. doi: 10.1615/CritRevTherDrugCarrierSyst.2018020481 [20] PATHAN T, GIRASE M, RAY D, et al. Scrutinizing micellar transitions and interfacial properties in mixed micelles comprising sodium dodecyl sulfate and sodium oleate: a tensiometric and scattering insight[J]. J Mol Liq, 2024, 397:124138. doi: 10.1016/j.molliq.2024.124138 [21] LI C L, GUAN H, LI Z H, et al. Study on different particle sizes of DOX-loaded mixed micelles for cancer therapy[J]. Colloids Surf B Biointerfaces, 2020, 196:111303. doi: 10.1016/j.colsurfb.2020.111303 -





 下载:
下载: