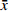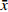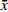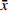-
替考拉宁(teicoplanin)是一种糖肽类抗生素,常用于治疗包括耐甲氧西林金黄色葡萄球菌(MRSA)在内的G+菌引起的感染[1]。它包括5个主要成分(TA 2-1、TA 2-2、TA 2-3、TA 2-4和TA 2-5)、1个水解成分(TA 3-1)和4个次要成分(RS-1~RS-4)[2]。其中,TA 2-2组分是活性最强的化合物,占各组分相对含量的40%以上[3-4],临床上常常通过测定TA 2-2的含量来监测替考拉宁的浓度[5-6]。目前,替考拉宁治疗药物监测主要以测定总浓度为主,但监测结果存在较大的个体差异。主要因为替考拉宁蛋白结合率较高(90 %~95%),在血液循环中主要与白蛋白(Alb)结合并处于动态平衡,未结合的游离部分在体内发挥药效[7]。健康状态下,人体白蛋白为正常水平(35~52 g/L),不同患者药物的血浆蛋白结合率变化不大;但在低蛋白血症(Alb<25 g/L)[8-10]、危重症、酸血症、肾衰竭、肝硬化、吸烟、多种药物合用等特殊情况下,患者常伴有白蛋白水平下降,当Alb<30 g/L时,白蛋白就会对替考拉宁游离浓度产生显著影响从而影响疗效[7, 10]。同时,游离药物水平升高导致肾脏排泄增加,肾毒性风险增加[11-12]。所以,针对上述白蛋白水平较低的患者,单纯用总浓度去评价替考拉宁的疗效和安全性是片面的,若同时测定替考拉宁游离浓度,将更加利于临床精准调整给药方案,以获得满意的治疗效果,减少或避免不良反应的发生。本研究旨在建立一种简便、快速、灵敏、准确的离心超滤结合超高效液相色谱串联质谱法(UPLC-MS/MS)用来测定替考拉宁游离浓度,为临床实现替考拉宁游离血药浓度监测提供依据。
-
QTRAP 5500型三重四极杆/复合线性离子阱质谱仪(美国AB-SCIEX有限公司);30AD型超高效液相色谱仪(日本岛津有限公司);AL204型分析天平(梅特勒-托利多仪器上海有限公司);H1850R台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司);Vortex-5型涡旋混合机(江苏海门其林贝尔仪器制造有限公司);超纯水仪系统(默克密理博上海有限公司);Centrifree® 超过滤装置(截留分子量>30 000的物质)(默克密理博上海有限公司);DK-S24型电热恒温水浴器(上海精密试验设备有限公司)。
-
替考拉宁对照品(中国食品药品检定研究院);甲酸、醋酸铵(色谱纯,Dikma科技有限公司);乙腈(色谱纯,Sigma-Aldrich公司)。
-
色谱柱:EndeavorsilTM C18柱 (50 mm×2.1 mm,1.8 µm);流动相A:0.02 mol/L醋酸铵溶液(含0.1%甲酸),流动相B:乙腈,梯度洗脱信息见表1;柱温:35 ℃;进样量:5 µl。
表 1 梯度洗脱信息
时间(t/min) 流速(ml/min) A(%) B(%) 0.0 0.2 85 15 11.0 0.2 74 26 13.0 0.2 74 26 15.0 0.2 85 15 20.0 0.2 停止 停止 -
喷雾针电压(ISV):5 500 V;碰撞气(CAD):medium;气帘气(CUR):20 psi;入口电压(EP):10 V;去簇电压(DP):78 V;碰撞能量(CE):20.74 V;碰撞池出口电压(CXP):13 V;离子源气体1(GS1):55 psi;离子源气体2(GS2):60 psi;离子源温度(TEM):550 ℃。检测模式:电喷雾离子化(ESI),选择性离子检测(SIM),正离子。多离子反应监测模式(MRM)离子对:替考拉宁TA2-2 m/z 940.7→316.2。扫描时间:200 ms。
-
精密称取替考拉宁对照品2.0 mg置于100 ml容量瓶中,用超纯水溶解并稀释至刻度,得到浓度为20.0 μg/ml的储备液。分别取不同体积的替考拉宁储备液,用超纯水稀释成浓度为0.20、0.50、1.00、2.00、4.00、8.00、12.0、16.0 μg/ml的标准曲线工作液,以及0.50、3.00、12.0 μg/ml的质控工作液。
-
取1 ml血浆样品置于Centrifree®超滤装置(截留分子量>30 000的物质)中,在37 ℃水浴中平衡30 min,然后在37 ℃,1 500×g下离心30 min,取样品超滤液直接进样。
-
分别取“1.4”项下各浓度标准曲线工作液以及质控工作液100 μl,加入100 μl空白血浆超滤液,稀释成浓度为0.10、0.25、0.50、1.00、2.00、4.00、6.00、8.00 μg/ml的标准曲线血浆超滤液样品,以及浓度为0.25、1.50、6.00 μg/ml的质控点血浆超滤液样品。
-
取空白血浆超滤液,直接进样,得到色谱图A;空白血浆超滤液加替考拉宁对照品溶液配制成一定浓度(1.00 μg/ml),混合均匀后进样,得色谱图B;取使用替考拉宁的患者血浆,按“1.5”项下处理,进样后得色谱图C,考察方法的专属性。根据色谱图1中A、B、C,可以看出血浆中内源性物质没有干扰替考拉宁的检测,同时TA 2-2与TA 2-3完全分开,TA 2-2保留时间为11.57 min,可以准确定量TA 2-2。
-
分别取“1.6”项下各浓度标准曲线血浆超滤液样品5 μl直接进样分析,以替考拉宁游离浓度为横坐标(X),峰面积为纵坐标(Y),得线性回归方程为Y=51 708.90X+1 397.10(r=0.999,n=8),结果表明,替考拉宁游离浓度在0.10~8.00 μg/ml范围内,与峰面积呈良好的线性关系,定量下限为0.10 μg/ml。
-
按照“1.6”项下质控点血浆超滤液样品配制方法,配制低、中、高浓度(0.25、1.50、6.00 μg/ml)的质控点血浆超滤液样品各6份,直接进样分析,计算批内精密度。按照相同的方法重复测定3次,计算批间精密度。结果见表2。如表2所示,在低、中、高浓度水平,样品的批内和批间RSD (%)均不超过7.00%,实测值与理论值相对误差在−5.00%~7.00%之间,精密度与准确度均符合生物样品测定要求。
表 2 批内和批间精密度与准确度(n=6,
$ \bar x$ ±s)理论浓度
(μg/ml)实测浓度
(μg/ml)准确度
(%)精密度(%) 批内 批间 0.25 0.25±0.02 1.56 6.91 6.77 1.50 1.43±0.05 −4.52 2.53 3.83 6.00 5.95±0.20 −0.88 2.99 3.44 -
按照“1.6”项下质控点血浆超滤液样品配制方法,配制低、中、高浓度(0.25、1.50、6.00 μg/ml)的质控点血浆超滤液样品各6份,直接进样分析,按线性回归方程计算实测浓度,以实测浓度与理论浓度的比值计算方法回收率。表3结果显示,低、中、高浓度水平的回收率在93.8%~101%范围内,总回收率为97.9%,同时RSD (%)也符合生物样品分析要求。
表 3 替考拉宁的方法回收率(n=6,
$ \bar x$ ±s)浓度水平
(μg/ml)回收率
(%)RSD
(%)总回收率
(%)总RSD
(%)0.25 101±7.00 6.91 97.9 5.50 1.50 93.8±2.37 2.53 6.00 98.5±2.96 3.01 -
取来源不同的6个空白血浆样品,按照“1.6”项下质控点血浆超滤液样品配制方法,每个来源都分别配制成低、中、高浓度(0.25、1.50、6.00 μg/ml)的质控点血浆超滤液样品(每个浓度3份),直接进样分析,得峰面积A1。此外,用超纯水配制低、中、高浓度(0.25、1.50、6.00 μg/ml)的替考拉宁对照品溶液(每个浓度3份),直接进样分析,得峰面积A2。计算相应样品中替考拉宁的A1/A2值,即为基质因子(MF),考察基质效应。表4结果显示,低、中、高浓度水平所有样品的平均基质因子为0.97,接近1.00,且RSD (%)为2.12%,符合生物样品分析要求,说明基质效应不会影响分析方法的准确性。
表 4 替考拉宁在血浆超滤液中的基质效应(n=3,
$ \bar x$ ±s)浓度水平(μg/ml) 基质因子 0.25 1.50 6.00 基质A 0.96±0.02 0.96±0.01 0.98±0.02 基质B 0.95±0.03 0.96±0.03 0.97±0.01 基质C 1.00±0.01 0.97±0.01 0.99±0.01 基质D 0.97±0.02 1.00±0.01 0.98±0.01 基质E 0.99±0.03 0.98±0.02 0.99±0.03 基质F 0.97±0.02 0.95±0.01 0.98±0.01 各浓度水平均值 0.97 0.97 0.98 各浓度水平RSD (%) 2.58 2.21 1.30 总均值 0.97 总RSD (%) 2.12 -
配制低、中、高浓度(0.25、1.50、6.00 μg/ml)的质控点血浆超滤液样品,每个浓度有6个重复样品,放置在室温10 h后与当日配制的标准曲线同批测定,考察替考拉宁血浆超滤液样品在室温下的稳定性。结果见表5,室温放置10 h后,样品实测浓度与理论浓度偏差在−4.00%~2.17%,RSD(%)不超过6.00%,在生物样品分析要求范围内,表明样品在室温下放置10 h后稳定性较好。
表 5 不同储存条件下替考拉宁样品的稳定性(n=6,
$ \bar x$ ±s)储存条件 理论浓度(μg/ml) 实测浓度(μg/ml) RSD (%) 准确度(%) 室温10 h 0.25 0.24±0.01 5.52 −4.00 1.50 1.48±0.03 2.16 −1.33 6.00 6.13±0.12 2.09 2.17 −20 ℃ 15 d 0.25 0.22±0.01 4.76 −12.00 1.50 1.46±0.02 1.98 −2.67 6.00 5.79±0.13 2.23 −3.50 冻融3次 0.25 0.22±0.01 6.43 −12.00 1.50 1.44±0.05 3.67 −4.00 6.00 5.68±0.18 3.15 −5.33 -
配制低、中、高浓度(0.25、1.50、6.00 μg/ml)的质控点血浆超滤液样品,每个浓度有6个重复的样品,在−20 ℃放置15 d后与测定当日配制的标准曲线同批进样分析,考察替考拉宁血浆样品−20 ℃下的稳定性。结果见表5,−20 ℃下储存15 d后,样品实测浓度与理论浓度偏差在−12.0%~−2.67%,RSD在5.00%以内,符合生物样品分析要求,表明样品在−20 ℃保存15 d后稳定性达标。
-
配制低、中、高浓度(0.25、1.50、6.00 μg/ml)的质控点血浆超滤液样品,每个浓度有6个重复的样品,放置在−20 ℃的冰箱内超过24 h,取出放置在室温条件下完全溶解后,再放置在−20 ℃的冰箱内,反复冻融3次,在第3次融化后与测定当日配制的标准曲线同批进样分析,以考察血浆样品3次冻融循环稳定性。结果见表5,反复冻融3次后,样品实测浓度与理论浓度偏差在−12.0%~−4.00%,RSD在6.50%以内,符合生物样品分析要求,表明样品冻融后稳定性仍较好。
-
近年来,血浆药物游离浓度的监测逐渐受到广泛关注。对于临床上提倡进行治疗药物监测,而蛋白结合率又高于80%的药物,建议监测药物游离浓度用以指导用药的剂量调整。对于高蛋白结合率的药物来说,白蛋白水平的改变可能会导致其药动学参数变异性增加[12]。因此,对于低蛋白血症(Alb<25 g/L)[8-10]、危重症、酸血症、肾衰竭、肝硬化、吸烟、多种药物合用等这类常伴有白蛋白水平降低的患者来说,替考拉宁的蛋白结合率具有一定的变异性[7, 13],即使获得相同的替考拉宁总浓度,体内真正发挥药效的游离替考拉宁浓度也可能不同。此时,应准确测定替考拉宁游离浓度来调整用药剂量,以防浓度低达不到治疗目标,或用药过量导致不良反应的发生。为实现对替考拉宁游离浓度的监测,本研究首次建立了超滤离心结合UPLC-MS/MS的方法。该方法与传统的高效液相色谱法相比,优点在于检测速度快,检测限较低,灵敏度较高,质谱检测可以排除患者所用的其他药物对替考拉宁的干扰,准确度较高。替考拉宁在水中易溶,在乙腈、甲醇中几乎不溶。因此,用超纯水作为储备液溶剂可使对照品完全溶解。替考拉宁成分复杂,为实现对各组分的有效分离,本研究选用Dikma公司的EndeavorsilTM C18柱,是通用型UPLC反相柱,具有独特的选择性和超高的分离性能,适合于高效、超快速分离分析,且峰形对称性好。在流动相选择的前期探索中,发现乙腈较甲醇可以更好地提高质谱响应,所以,选用乙腈作为有机相。水相则选择在0.02 mol/L醋酸铵溶液中加入0.1%甲酸,增加离子化效率,进一步改善峰形,使各组分完全分离。此外,采用电喷雾电离源(ESI)电离方式,发现替考拉宁在正离子模式下具有较高的离子化效率,且重现性良好。药物游离浓度的测定具有一定的难度,难点在于如何快速且有效地分离游离型药物,对血浆样品的处理有较高的要求。目前,测定药物游离浓度常见的样品处理方法主要有平衡透析法、超滤离心法[14]。其中最常用的是超滤离心法,该法不需稀释,不会改变生理pH值、离子组成,主要是利用离心力使游离药物通过半透膜,迅速而有效地从血液及其他生物样本中分离游离药物[15]。现国内外常用的超滤离心装置主要有Centrifree®和Amicon Ultra两种型号。本研究选用Centrifree®超滤装置进行分离。Roberts等在替考拉宁游离浓度测定的研究中,使用Amicon Ultra超滤装置分离蛋白[10]。但是,在实验前期探索中,我们发现Amicon Ultra装置所得血浆超滤液中加入乙腈后仍有沉淀析出,蛋白截留不完全;而Centrifree®装置产品说明书提示Centrifree®装置可以截留99.9%的蛋白,且使用该装置所得血浆超滤液中加入等量乙腈后未见明显沉淀析出。虽然两者所用滤膜均是再生纤维素膜,但是相比Amicon Ultra的凹槽设计、Centrifree®系列的平面设计,优点在于滤面更大,死体积更小,更有利于微溶质的滤过,是专用于从血液等生物样本中分离蛋白结合微溶质的,用于游离型药物的分离更为合理[15]。其次,为保证游离药物可以和蛋白有效分离,应选择合适的滤膜孔径。由于替考拉宁主要与白蛋白结合,而白蛋白的分子量约为66 000,本研究选用截留分子量为30 000的滤膜用以截留与白蛋白结合的药物,获得游离型替考拉宁。此外,确定合适的样品处理条件也是至关重要的。首先,收集的血浆样品为保持稳定性,需要低温保存,但温度较低可能会影响药物与蛋白的结合,导致药物游离浓度偏低,为保证测定结果的准确性,样品需在37 ℃平衡30 min后再进行超滤离心[10]。其次,离心力与离心时间也是影响超滤效果的重要因素[16]。离心力(1 000~2 000)×g可以达到最佳滤过率,离心时间在15~30 min时超滤液量与离心时间成正比[16],再结合文献[10]报道,本研究最终选用离心力1 500×g,离心时间30 min。同时,为保证样品测定尽可能不受基质的影响,本研究所有样品均采用空白血浆超滤液作为基质进行配制。有文献[17]也指出,游离药物分析最适宜的基质为空白血浆超滤液。方法建立后按照《中国药典》(2015年版)附录《生物样品定量分析方法验证指导原则》进行验证,验证结果均符合该指导原则的要求。综上,本研究建立了离心超滤结合UPLC-MS/MS检测替考拉宁游离浓度的方法,该方法简便、快速、灵敏、准确,可以为临床开展替考拉宁游离浓度监测提供依据。
Assay of unbound teicoplanin in human plasma by centrifugal ultrafiltration combined with ultra performance liquid chromatography-tandem mass spectrometry
-
摘要:
目的 建立离心超滤结合超高效液相色谱串联质谱法用以测定替考拉宁血浆游离浓度。 方法 利用Centrifree®超过滤装置去除血浆中的白蛋白,超滤液直接进样测定替考拉宁游离浓度。色谱柱为EndeadvorsilTM C18柱(50 mm×2.1 mm,1.8 μm),流动相为0.02 mol/L醋酸铵溶液(含0.1%甲酸)与乙腈,梯度洗脱,在电喷雾离子化(ESI)正离子模式下进行检测。 结果 替考拉宁血浆游离浓度为0.10~8.00 μg/ml,线性范围良好(r=0.999)。批内、批间精密度不超过7.00%,方法回收率为97.9%,基质效应因子为0.97。 结论 该研究建立的方法简便、快速、灵敏、准确,可为临床开展替考拉宁血浆游离浓度监测提供依据。 -
关键词:
- 替考拉宁 /
- 游离浓度 /
- 离心超滤 /
- 超高效液相色谱串联质谱法
Abstract:Objective To establish an assay method for unbound teicoplanin in plasma by centrifugal ultrafiltration combined with ultra-performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS). Methods Protein was removed from plasma by a Centrifree® ultrafiltration device. The ultrafiltrate was injected to determine the unbound concentration of teicoplanin. EndeadvorsilTM C18 column (1.8 μm, 50 mm×2.1 mm) was used with gradient elution of acetonitrile and 0.02 mol/L ammonium acetate solution (containing 0.1% formic acid). The detection was performed on a triple-quadrupole tandem mass spectrometer by multiple reaction monitoring (MRM)mode via electro spray ionization (ESI). Results The calibration curve of unbound teicoplanin in plasma was linear over the range of 0.10 to 8.00 μg/ml (r=0.999). The intra-assay precision and the inter-assay precision of samples didn't exceed 7.00%. The average relative recovery ratio was 97.9%, and the matrix effect factor was 0.97. The samples had good stability after being stored at room temperature for 10 h or at −20 ℃ for 15 days, and freeze-thawed 3 times (RSDs were all within 6.50%). Conclusion This method is convenient, fast, sensitive and accurate. It provided a basis for clinical development of teicoplanin unbound concentration monitoring. -
表 1 梯度洗脱信息
时间(t/min) 流速(ml/min) A(%) B(%) 0.0 0.2 85 15 11.0 0.2 74 26 13.0 0.2 74 26 15.0 0.2 85 15 20.0 0.2 停止 停止 表 2 批内和批间精密度与准确度(n=6,
$ \bar x$ ±s)理论浓度
(μg/ml)实测浓度
(μg/ml)准确度
(%)精密度(%) 批内 批间 0.25 0.25±0.02 1.56 6.91 6.77 1.50 1.43±0.05 −4.52 2.53 3.83 6.00 5.95±0.20 −0.88 2.99 3.44 表 3 替考拉宁的方法回收率(n=6,
$ \bar x$ ±s)浓度水平
(μg/ml)回收率
(%)RSD
(%)总回收率
(%)总RSD
(%)0.25 101±7.00 6.91 97.9 5.50 1.50 93.8±2.37 2.53 6.00 98.5±2.96 3.01 表 4 替考拉宁在血浆超滤液中的基质效应(n=3,
$ \bar x$ ±s)浓度水平(μg/ml) 基质因子 0.25 1.50 6.00 基质A 0.96±0.02 0.96±0.01 0.98±0.02 基质B 0.95±0.03 0.96±0.03 0.97±0.01 基质C 1.00±0.01 0.97±0.01 0.99±0.01 基质D 0.97±0.02 1.00±0.01 0.98±0.01 基质E 0.99±0.03 0.98±0.02 0.99±0.03 基质F 0.97±0.02 0.95±0.01 0.98±0.01 各浓度水平均值 0.97 0.97 0.98 各浓度水平RSD (%) 2.58 2.21 1.30 总均值 0.97 总RSD (%) 2.12 表 5 不同储存条件下替考拉宁样品的稳定性(n=6,
$ \bar x$ ±s)储存条件 理论浓度(μg/ml) 实测浓度(μg/ml) RSD (%) 准确度(%) 室温10 h 0.25 0.24±0.01 5.52 −4.00 1.50 1.48±0.03 2.16 −1.33 6.00 6.13±0.12 2.09 2.17 −20 ℃ 15 d 0.25 0.22±0.01 4.76 −12.00 1.50 1.46±0.02 1.98 −2.67 6.00 5.79±0.13 2.23 −3.50 冻融3次 0.25 0.22±0.01 6.43 −12.00 1.50 1.44±0.05 3.67 −4.00 6.00 5.68±0.18 3.15 −5.33 -
[1] 郑波, 李家泰. 糖肽类抗生素替考拉宁的研究进展[J]. 中国临床药理学杂志, 1999:64-68. [2] 王雅连, 魏理, 黄珊珊, 等. HPLC-UV法测定人血浆中替考拉宁的浓度[J]. 今日药学, 2018, 28(7):450-452. doi: 10.12048/j.issn.1674-229X.2018.07.005 [3] BERNAREGGI A, BORGHI A, BORGONOVI M, et al. Teicoplanin metabolism in humans[J]. Antimicrob Agents Chemother,1992,36(8):1744-1749. doi: 10.1128/AAC.36.8.1744 [4] MALABARBA A, STRAZZOLINI P, DEPAOLI A, et al. Teicoplanin, antibiotics from Actinoplanes teichomyceticus nov. sp. VI. Chemical degradation: physico-chemical and biological properties of acid hydrolysis products[J]. J Antibiot,1984,37(9):988-999. doi: 10.7164/antibiotics.37.988 [5] 于晓佳, 刘丽宏, 张征, 等. 高效液相色谱法测定替考拉宁的血药浓度[C]. 上海: 中国药理学会第三届全国治疗药物监测学术年会, 2013. [6] MCCANN S J. Assay of teicoplanin in serum: comparison of high-performance liquid chromatography and fluorescence polarization immunoassay[J]. J Antimicrob Chemother,2002,50(1):107-110. doi: 10.1093/jac/dkf067 [7] YANO R, NAKAMURA T, TSUKAMOTO H, et al. Variability in teicoplanin protein binding and its prediction using serum albumin concentrations[J]. Ther Drug Monit,2007,29(4):399-403. doi: 10.1097/FTD.0b013e3180690755 [8] BRINK A J, RICHARDS G A, LAUTENBACH E E G, et al. Albumin concentration significantly impacts on free teicoplanin plasma concentrations in non-critically ill patients with chronic bone Sepsis[J]. Int J Antimicrob Agents,2015,45(6):647-651. doi: 10.1016/j.ijantimicag.2015.01.015 [9] ULLDEMOLINS M, ROBERTS J A, RELLO J, et al. The effects of hypoalbuminaemia on optimizing antibacterial dosing in critically ill patients[J]. Clin Pharmacokinet,2011,50(2):99-110. doi: 10.2165/11539220-000000000-00000 [10] ROBERTS J A, STOVE V, DE WAELE J J, et al. Variability in protein binding of teicoplanin and achievement of therapeutic drug monitoring targets in critically ill patients: Lessons from the DALI Study[J]. Int J Antimicrob Agents,2014,43(5):423-430. doi: 10.1016/j.ijantimicag.2014.01.023 [11] BYRNE C J, PARTON T, MCWHINNEY B, et al. Population pharmacokinetics of total and unbound teicoplanin concentrations and dosing simulations in patients with haematological malignancy[J]. J Antimicrob Chemother,2018,73(4):995-1003. doi: 10.1093/jac/dkx473 [12] INVESTIGATORS T S S. Impact of albumin compared to saline on organ function and mortality of patients with severe Sepsis[J]. Intensive Care Med,2011,37(1):86-96. doi: 10.1007/s00134-010-2039-6 [13] ROBERTS J A, PEA F, LIPMAN J. The clinical relevance of plasma protein binding changes[J]. Clin Pharmacokinet,2013,52(1):1-8. doi: 10.1007/s40262-012-0018-5 [14] 徐丙发, 李秀. 特殊患者替考拉宁药物浓度监测的临床应用进展[J]. 中国医院药学杂志, 2017, 37(15):1536-1539. [15] 陈茂林, 周世文. 超滤法结合高效液相色谱法测定人血浆中伏立康唑蛋白结合率[J]. 中国医院药学杂志, 2017, 37(8):727-731. [16] 陈冰, 蔡卫民. 游离药物浓度监测及其应用研究进展[J]. 中国临床药理学杂志, 2008, 24(3):255-259. doi: 10.3969/j.issn.1001-6821.2008.03.016 [17] DE MORAES N V, LAURETTI G R, NAPOLITANO M N, et al. Enantioselective analysis of unbound tramadol, O-desmethyltramadol and N-desmethyltramadol in plasma by ultrafiltration and LC–MS/MS: Application to clinical pharmacokinetics[J]. J Chromatogr B,2012,880:140-147. doi: 10.1016/j.jchromb.2011.11.033 -






 下载:
下载: