-
儿童侵袭性真菌感染的诊断越来越多,其中以念珠菌和曲霉菌感染最为常见[1,2]。伏立康唑因其抗菌谱广、耐药率低的特点,被国内外推荐作为应对侵袭性曲霉菌、念珠菌血症等严重威胁生命的真菌感染的一线治疗药物[3,4],适用于2岁以上的儿童。伏立康唑血液稳态谷浓度与临床疗效及不良反应有着密不可分的关系。肝脏细胞色素P450同工酶[5](如CYP2C19、CYP2C9、CYP3A5)影响伏立康唑的代谢,等位基因的突变使代谢酶的活性增强或降低。儿童因器官发育不成熟,生理状态等不同于成人,为达到有效的临床治疗,降低不良反应,急需探索基因多态性在伏立康唑儿童个体化用药中的相关性影响,对指导临床安全有效用药,实现儿童个体化的给药方案有重大的意义。
本研究通过收集2020年1月至2020年12月期间在我院与上海市儿童医院接受伏立康唑静脉治疗的50例侵袭性真菌感染住院儿童的血液标本,检测其血药浓度与基因型,分析相关基因分型对伏立康唑血药浓度、疗效以及不良反应的影响。
-
2020年1月至2020年12月住院治疗的侵袭性真菌感染患儿。本研究共收集病例50例,男29例(56%),女21例(44%),年龄2岁至12岁,平均年龄(5.7±3.5)岁。纳入标准:①诊断为侵袭性真菌感染的儿童;②接受伏立康唑治疗持续用药至少3 d;③接受伏立康唑血药浓度监测及CYP2C19、CYP3A4、CYP3A5基因检测;④患儿家属在入院时签署预留血样本知情同意书。排除标准:①接受伏立康唑治疗后持续用药不足3 d;②未进行伏立康唑血药浓度监测与基因检测;③肝肾功能不全;④缺乏完整的试验室评价指标,不能进行疗效和安全性评价。
50例患儿均给予静脉注射用伏立康唑,由美国辉瑞公司生产,规格:200 mg/瓶,生产批号:Z572301。单次剂量 8 mg/kg,在1~2 h内滴注完成,q12h。安全性评价:参照《中国伏立康唑个体化用指南》[6],使用伏立康唑期间患者是否有视觉障碍、畏光、失眠兴奋、肝损害、及与伏立康唑有关的不良反应。肝损伤定义为患者使用伏立康唑后ALT(alanine transaminase)、ALP(alkaline phosphatase)检测值升高并≥3倍正常上限值,或TBil(total bilirubin)≥ 3倍正常上限值[7]。本研究经医院伦理委员会审批,伦理批准号:2019-LDYY-036,所有患儿家属均签署知情同意书。
-
研究对象接受伏立康唑治疗至少 3 d后检测血清谷浓度。使用全自动二维液相色谱耦合仪LC-100HP(湖南德米特仪器有限公司)进行HPLC法测定药物浓度:血样本采集后静置至自然凝固,4 500 r/min 离心 5 min,获取血清样本;取 300 μl血清加入900 μl去蛋白溶液,涡旋震荡1 min,15 000 r/min离心8 min,待分层完全后,取 1 000 μl上清液加入100 μl APC溶液进样,在色谱条件下检测,记录峰面积并计算伏立康唑谷浓度和血清伏立康唑浓度 。
-
本实验使用DP-TOF飞行时间质谱检测系统(浙江迪谱诊断技术有限公司)进行质谱检测,准备多重PCR引物和延伸引物,以人基因组DNA为模板,在一个反应体系内对多重PCR引物所在区域同时进行扩增,延伸,形成分子量差异。使用飞行时间质谱系统对不同延伸产物的分子量差异进行检测,通过数据分析,就可得到各突变位点的具体基因型。
-
采用SPSS22.0统计学软件对数据进行统计学分析,对样本数据呈正态分布的计量资料以均数±标准差表示;计数资料采用χ2检验,两样本比较采用独立样本 t 检验,多组间比较采用单因素方差分析,P<0.05有统计学意义。
-
50例患儿均为静脉给药伏立康唑,q12h,使用疗程为10~56 d,中位时间13.50(10.50 ~ 20.30)d,所测药物浓度值在0.56~7.62 μg/ml之间,平均(3.56±1.87) μg/ml。本研究总体有效率为84%(42/50),总体不良反应发生率20%(10/50),给药后50例患儿中共有10例出现不良反应,其中1例总胆红素(TBIL>正常值上限10倍)伴谷草转氨酶(AST)升高,3例谷丙转氨酶(ALT>正常值上限3倍以上)升高,5例ALT与AST均升高,以及1例发生皮疹。此10例患儿均未终止治疗,其中6例继续观察,3例予以保肝药物治疗,1例予以抗过敏治疗。
参考中国与美国指南[8,9]推荐的血浆稳态谷浓度值范围(1.0~5.5/ml),将本研究病例按照实测结果分为3组。组A<1.0 μg/ml(13例)、组B 1.0~5.5 μg/ml(30例)、组C > 5.5 g/ml(7例)。结果A、B和C 3组有效率分别为61.5%、93.3%和85.7%,统计对比显示3组有效率存在显著差异(χ2=6.840,P=0.033)。3组的不良反应发生率分别为3例(3/13例, 23.1%),3例(3/30例, 10.0%)和4例(4/7例, 57.1%),统计对比结果显示,3组不良反应发生率存在显著差异(χ2=7.988, P=0.018),具体数据见表1。
表 1 临床疗效及不良反应
组别(μg/ml) 临床疗效 不良反应 例数(n) 有效(%) 无效(%) 例数(n/%) <1.0 13 8(61.5) 5(38.5) 3(23.1) 1.0~5.5 30 28(93.3) 2(6.7) 3(10.0) >5.5 7 6(85.7) 1(14.3) 4(57.1) χ2 6.84 7.988 P 0.033 0.018 -
根据CYP2C19*2与CYP2C19*3基因位点突变形成的不同酶代谢活性[10]类型,分别为快代谢型(EM)16例,占32%;中间代谢型(IM)27例,占54%;慢代谢型(PM)7例,占14%。三组患儿的伏立康唑谷浓度出现显著的统计学差异(F=15.359, P<0.001),EM患儿的药物浓度明显低于IM与PM(EM vs IM, P=0.019, EM vs PM, P<0.001, IM vs PM, P<0.001),IM药物浓度低于PM,差异均具有统计学意义,见表2。
表 2 CYP2C19基因型与药物浓度
代谢速度 CYP2C19
基因型酶活性 例数
(n)药物浓度
(ρB/μg·ml−1)快 *1/*1 高 16 1.30±0.24 中 *1/*2 中 25
3.45±0.20中 *1/*3 中 2 慢 *2/*2 低 1 5.92±0.41 慢 *2/*3 低 5 慢 *3/*3 低 1 F 15.359 P <0.001 -
检测可能影响CYP2C9代谢活性的SNPs:CYP2C9*3(rs1057910),在纳入研究的患儿中,CYP2C9*3(rs1057910)野生纯合子AA型占92%(46/50),突变杂合子CA型占8%(4/50),未发现突变纯合子CC型。研究结果显示,CYP2C9*3的突变对伏立康唑血浆谷浓度未产生显著的影响,差异无统计学意义(F=2.213, P=0.086),结果见表3。
表 3 CYP2C9基因型与药物浓度
(CYP2C9*3)基因型 例数(n) 药物浓度(ρB/μg·ml−1) 野生纯合子(AA) 46 2.78±0.34 突变杂合子(CA) 4 4.02±0.13 突变纯合子(CC) 0 − F 2.213 P 0.086 注:“−” 表示未检测。 -
检测可能影响CYP3A5代谢活性的SNPs:CYP3A5*3(rs776746)。在纳入研究的患儿中,CYP3A5*3野生纯合子CC型占54%(27/50),突变杂合子TC型占44%(22/50),突变纯合子TT型占2%(1/50)。CYP3A5*3位点的突变对伏立康唑血浆谷浓度未产生显著的影响,差异无统计学意义(F=0.757, P=0.475),结果见表4。
表 4 CYP3A5基因型与药物浓度
(CYP3A5*3)基因型 例数(n) 药物浓度(ρB/μg·ml−1) 野生纯合子(CC) 27 3.43±0.36 突变杂合子(TC) 22 3.86±0.29 突变纯合子(TT) 1 2.85±0 F 0.757 P 0.475 -
伏立康唑药动学个体差异大,治疗窗较窄,其血药浓度与临床疗效和不良反应有显著相关性。从婴幼儿到青少年,随着身体功能的不断发生发展,肝、肾器官代谢功能的不断成熟,导致了伏立康唑药动学的个体差异性。为避免血药浓度过高产生药物毒性或血药浓度过低导致治疗失败,中国药理学会治疗药物监测研究专业委员会在制定《中国伏立康唑个体化用药指南推荐意见》[6]时,建议进行伏立康唑药物浓度监测和基因型检测。
参考国内外成人的伏立康唑有效目标浓度范围(1.0~5.5 μg/ml)[5,6],本研究发现,当药物浓度为1.0~5.5 mg/L时,临床有效率达93.3%,不良反应发生率为10%;浓度<1.0 mg/L时,临床有效率61.5%,不良反应发生率为23.1%;而浓度>5.5 mg/L时临床有效率为85.7%,发生的不良反应达50%以上(χ2=7.988, P=0.018)。可见低血药浓度并未降低不良反应的发生,而高药物浓度并未提高临床有效率,反而增加不良反应的发生。同样在监测了治疗药物浓度的情况下,TACHER等[11]报道伏立康唑临床有效率在80%,PASCUAL等[12]报道的有效率达85%。本文临床总有效率达84%(42/50),与PASCUAL等的研究结果较接近。
已有不少研究关注血浆伏立康唑浓度与肝毒性的关系,在一篇Meta分析[13]中发现,儿童组(2~12岁)发生肝毒性的比例较青少年和成人组更高。本文研究结果显示,参与研究的患者总体不良反应发生率为20%(10/50),以肝损害为主,其中9例为肝毒性,1例为过敏性皮疹(红色斑丘疹)。需要警惕的是,在本研究低浓度组(<1.0 mg/L)中,不良反应发生率为23.1%,这是由于儿童的肝脏组织结构发育不成熟,代谢功能弱,即使较低药物浓度亦可能导致肝损害,值得引起重视。本组资料中肝毒性均为可逆性,在临床可控范围内,给予保肝药物后恢复正常,无须停药,不影响临床治疗。结合本研究结果,推荐1.0~5.5 mg/L为儿童目标谷浓度,可在确保显著疗效的基础上,提高临床安全性。
CYP2C19[14]是CYP450酶第二亚家族中的重要成员,在肝脏中有表达较多,是人体重要的代谢酶。目前研究[15]较多的等位基因有*17(酶活性增强),*1(正常酶活性),*2、*3~*8(酶无功能活性)。在东亚人群中,CYP2C19*2与CYP2C19*3两个突变位点是导致相关弱代谢遗传缺陷的主要突变点,其突变率达到95%左右。有研究显示[10],亚洲人属于弱代谢者;强代谢者中纯合子代谢最快,弱代谢者中杂合子的代谢最慢。本研究中儿童慢代谢与中间代谢占本研究对象所有代谢型的68%(34/50),接近我国汉族群体中的变异比例[8,16],3种代谢型患者体内伏立康唑药物浓度有显著性差异。快代谢儿童药物浓度明显低于中间代谢和慢代谢儿童。这是因为药物在进入体内后,快代谢者体内药物很快被清除,只剩余较少的药物来抗真菌感染,这不仅很难清除体内的真菌,还可能引起耐药;而对慢代谢者,药物进入体内后很难被清除,大量的药物在组织蓄积,不仅提高了血药浓度,还会产生组织器官损害。可见,快代谢者适当增加给药剂量,可获得有效的治疗浓度。慢代谢者根据药物暴露量,建议相应的降低给药剂量,以防药物在体内蓄积,对各脏器功能产生不良影响。
CYP2C9基因[17]上是P450-IIC酶家族的主要组成部分,占肝微粒体中CYP总量的20%,参与16%的临床药物的代谢。CYP2C9*3基因的突变使酶与底物的亲和力降低,影响药物的代谢,可提高药物浓度。本研究中测得的突变基因仅有4例,其血药浓度虽高于未突变者,但并未提示有统计学意义,可能与本研究中的样本量较少有关。
CYP3A5基因[18]主要在肠道和肝脏表达,其编码区表达剪接缺陷,突变后形成无功能的蛋白,酶活性缺失,可能降低药物的代谢,提高药物浓度。本研究中CYP3A5*3(rs776746)部分突变和全突变占40%,但对伏立康唑的药物浓度无明显影响。提示可能多数在肠道表达的CYP3A5基因对于主要通过肝脏代谢的伏立康唑,并不是其关键性的影响因素。
本研究显示,CYP2C19的基因多态性是导致儿童体内伏立康唑代谢个体间差异的主要影响因素,进行基因分型有助于为患儿选择适当的伏立康唑给药剂量,并且推荐1.0~5.5 mg/L为儿童目标谷浓度,临床可根据CYP2C19基因型与药物浓度监测结果相应调整药物剂量。
Correlation between plasma concentration of voriconazole and polymorphisms in CYP2C19, CYP2C9 and CYP3A5 genes in children
-
摘要:
目的 探索CYP2C19、CYP2C9、CYP3A5基因型对儿童伏立康唑血药浓度的影响。 方法 收集2020年1月至2020年12月,接受伏立康唑静脉治疗的50例侵袭性真菌感染住院儿童的血液标本。采用HPLC法检测伏立康唑血药谷浓度,采用飞行时间质谱检测系统进行CYP2C19、CYP2C9、CYP3A5基因型检测,分析儿童相关基因分型对伏立康唑血药浓度、疗效以及不良反应的影响。 结果 50例IFI儿童接受伏立康唑治疗后,总有效率达84%(42/50例),不良反应发生率20%(10/50例)。测定伏立康唑血药浓度范围0.56~7.62 μg/ml。结合CYP2C19基因位点的不同突变类型,产生快、中、慢3种代谢活性,检测结果显示:快代谢16例、中间代谢27例、慢代谢7例。3组间的血浆浓度有明显的差异,(F=15.359,P< 0.001),快代谢组的药物浓度明显低于中间代谢和慢代谢组。CYP2C9、CYP3A5的突变对血药浓度无明显影响,分别为(F=2.213,P=0.086)和(F=0.757,P=0.475)。 结论 伏立康唑治疗儿童侵袭性真菌感染疗效显著,不良反应轻微。CYP2C19基因型与药物代谢速率明显相关,是影响血药浓度的重要因素,开展伏立康唑的药物浓度与基因型的检测,有助于临床调整有效药物剂量,实现更为科学的个体化治疗。 Abstract:Objective To explore the effects of CYP2C19, CYP2C9 and CYP3A5 genotypes on the plasma concentration of voriconazole in children. Methods Collected blood samples from 50 hospitalized children with invasive fungal infections who received intravenous voriconazole from January 2020 to December 2020. High performance liquid chromatography was used to detect the blood trough concentration of voriconazole, and the time-of-flight mass spectrometry detection system was used to detect the genotypes of CYP2C19, CYP2C9 and CYP3A5, and the effects of children’s genotyping on the plasma concentration, efficacy and adverse reactions of voriconazole were analyzed. Results The total effective rate of 50 children with IFI was 84% (42/50) after voriconazole treatment. The incidence of adverse reactions was 20% (10/50 cases). The measured plasma concentration of voriconazole ranged from 0.56~7.62 μg/ml. Combined with the different mutation types of CYP2C19 gene loci, three metabolic activities were produced: fast, medium and slow, and the test results showed that there were 16 cases of fast metabolism, 27 cases of intermediate metabolism and 7 cases of slow metabolism. There was a significant difference in plasma concentrations between the three groups (F=15.359, P< 0.001), and the drug concentrations in the fast metabolic group were significantly lower than those in the intermediate metabolic and slow metabolic groups. The mutations of CYP2C9 and CYP3A5 had no significant effect on the plasma concentrations of the drugs, which were (F=2.213, P=0.086)and (F=0.757, P=0.475). Conclusion Voriconazole had significant efficacy in the treatment of invasive fungal infections in children, and the adverse reactions were mild. CYP2C19 genotype was significantly related to the rate of drug metabolism and was an important factor affecting blood drug concentration, the detection of drug concentration and genotype of voriconazole was helpful to adjust the effective drug dose clinically and achieve more scientific and individualized treatment. -
Key words:
- voriconazole /
- pharmacogenes /
- blood drug concentrations /
- pediatric
-
结直肠癌(CC)发生率占所有肿瘤发生率的第3位,病死率仅次于肺癌,属于下消化系统恶性肿瘤[1]。目前,结肠癌的治疗主要采用多学科的综合治疗模式[2]。包括5-氟尿嘧啶、奥沙利铂与贝伐珠单抗等的组合[3-5]。然而,这些常规的化疗方案可能造成患者不耐受以及骨髓等的抑制。因此,寻找新的有效的药物对于现今结肠癌治疗具有重要意义。
紫杉醇(PTX)是一种广谱抗肿瘤活性的化疗药物,来源于太平洋紫杉树皮(红豆杉)[6,7]。临床试验结果表明,PTX在几种癌症治疗中有较好的活性,包括:乳腺癌、皮肤恶性肿瘤、非小细胞肺癌以及卵巢癌等[8,9]。然而,由于结肠癌中过表达的P糖蛋白(P-gp)引起了多重耐药性(MDR),导致PTX对结肠癌临床治疗效果不甚理想[10]。此外,PTX生物半衰期短,其一代药物Taxol以聚氧乙烯蓖麻油为表面活性剂,具有引起患者过敏反应的风险,从而限制了PTX临床疗效的发挥[11]。因此,迫切需要对PTX进行结构改进与剂型设计,改善其药物递送效率,提高生物利用度[12]。
脂肪酸作为生物膜和生物信号分子的重要成分,参与了细胞能量产生、代谢的过程。由于肿瘤细胞增殖快速,需要大量的细胞合成物质和能量的供应,因此,患有恶性肿瘤的患者其脂肪酸合成也较快。其中,肿瘤细胞因为迅速繁殖对含有16个碳原子的棕榈酸(PA)为主的脂肪酸需求量大,因此利用PA进行修饰有利于药物被肿瘤细胞摄取[13,14]。再者,研究发现,由PA修饰的紫杉醇,能降低其对P-gp的亲和力,避免了PTX进入肿瘤细胞后的外排,提高紫杉醇对于结肠癌治疗的有效性[15]。
此外,作为一种成熟的药物载体,脂质体(Lip)在体内可被降解、无毒性和免疫原性,能够增强药物在体内的稳定性,从而可以减少给药剂量、降低毒副作用,并且其表面具有可修饰性[16],例如,采用聚乙二醇磷脂(PEG-DSPE)修饰的脂质体因其空间位阻效应可延长其在体内的循环时间[17]。同时结合肿瘤组织的增强通透性和滞留效应(EPR),使药物通过被动靶向递送到靶部位[18]。
结合以上背景,本研究首先通过棕榈酸酯与紫杉醇共价键结合构建紫杉醇棕榈酸酯(PTX-PA),并建立基于高效液相(HPLC)的定量分析方法,旨在降低其对P-gp的亲和力,避免PTX进入肿瘤细胞后被外排,从而改善紫杉醇毒性较大、生物半衰期短、成药性差等问题,提高紫杉醇对于结肠癌治疗的有效性。其次,我们将PTX-PA包载进PEG修饰的脂质体构建紫杉醇棕榈酸酯的脂质体(PTX-PA/Lip),以实现其长循环,增加PTX的疗效、降低其毒副作用。最后,采用工艺筛选与单因素处方优化的方法制备最佳PTX-PA/Lip,为PTX-PA的制剂学研究奠定基础[19]。
1. 仪器与材料
1.1 仪器
高效液相色谱仪(安捷伦科技有限公司,美国);十万分之一电子天平(MS105DU,梅特勒托利多公司,瑞士);超滤管(30 kD,密理博公司,美国);低温高速离心机(Eppendorf-200,艾本德公司,德国);高压均质机(NanoGenizer,美国);Zeta-sizer Nano粒度仪(Nano-ZS,马尔文公司,英国)。
1.2 试剂与材料
紫杉醇购自江苏红豆杉生物科技股份有限公司,纯度≥98%;棕榈酸购自中国医药集团上海化学试剂公司,纯度≥99%;蛋黄卵磷脂(PC98-T)、胆固醇、DSPE-PEG 2000均购自上海艾韦特医药科技有限公司;1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC)、4-二甲氨基吡啶(DMAP)、乙酸乙酯、二氯甲烷、无水乙醇、石油醚均购自中国医药集团上海化学试剂公司,分析纯;乙酸乙酯、PC-98T蛋黄卵磷脂(上海艾韦特医药科技有限公司);胆固醇(上海艾韦特医药科技有限公司);二氯甲烷、DSPE-PEG 2000(上海艾韦特医药科技有限公司);无水乙醇、石油醚购自中国医药集团上海化学试剂公司;甲醇购自美国默克公司,色谱纯。
2. 方法
2.1 PTX-PA的制备与纯化
PTX-PA前药由PTX与PA发生酯化反应合成,其合成过程如下[20,21]:精密称取PTX 0.85 g,加入无水二氯甲烷 30 ml。依次加入精密称取的EDC 0.19 g、DMAP 0.15 g和PA 0.31 g,在氮气保护下室温搅拌反应12 h。反应结束后,用5%柠檬酸水溶液、饱和食盐水洗涤3遍,旋蒸除去有机溶剂,即得PTX-PA粗品。采用石油醚和乙酸乙酯通过柱层析法对PTX-PA进行分离、纯化。洗脱完成后,将产物旋蒸去除有机溶剂,得到的白色固体即为PTX-PA,样品经核磁共振氢谱、碳谱确定为PTX-PA,样品纯度98.5%。
2.2 基于HPLC定量检测的方法学建立[22]
2.2.1 最大吸收波长测定与色谱条件设定
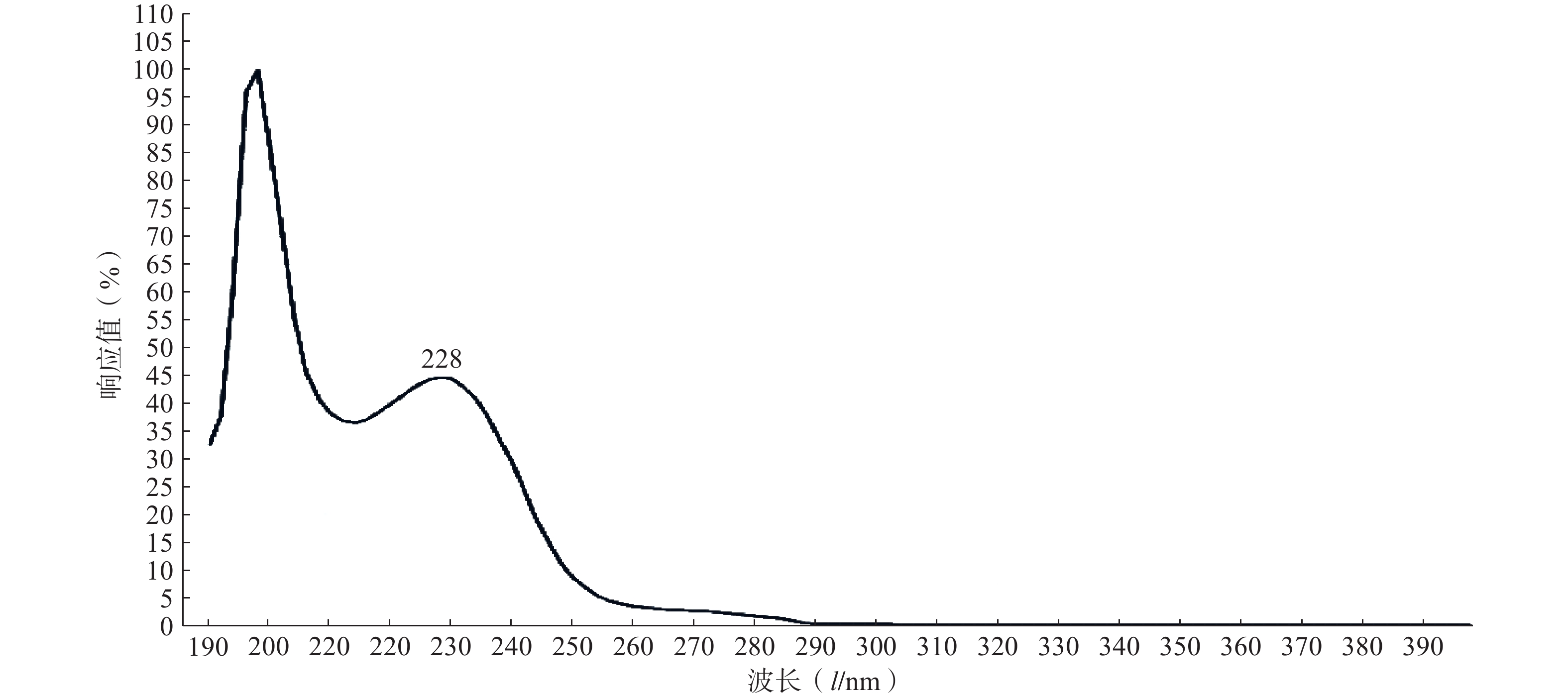
精密取适量的PTX-PA粉末,采用甲醇溶解,定容,通过全波长(190~400 nm)扫描测定其紫外最大吸收波长λmax。
本实验采用Agilent Eclipse plus C18色谱柱(4.6 mm×250 mm,5 μm),流动相采用甲醇/水(95∶5,V/V),进样量20 μl,流速1.0 ml/min。
2.2.2 样品溶液配制
空白溶液的配制:精密量取不含药的空白脂质体1 ml加入适量的甲醇溶液,超声,用甲醇定容至25 ml,0.45 μm的微孔滤膜过滤,滤液即为空白溶液。
对照品溶液的配制:精密称取PTX-PA 粉末50 mg,用甲醇溶解并定容至50 ml,过滤,即得PTX-PA对照品储备溶液。
供试品溶液的配制:精密量取1 ml PTX-PA/Lip,加入适量甲醇溶解、超声破乳、定容至25 ml,过滤,滤液即为供试品溶液。
2.2.3 专属性考察
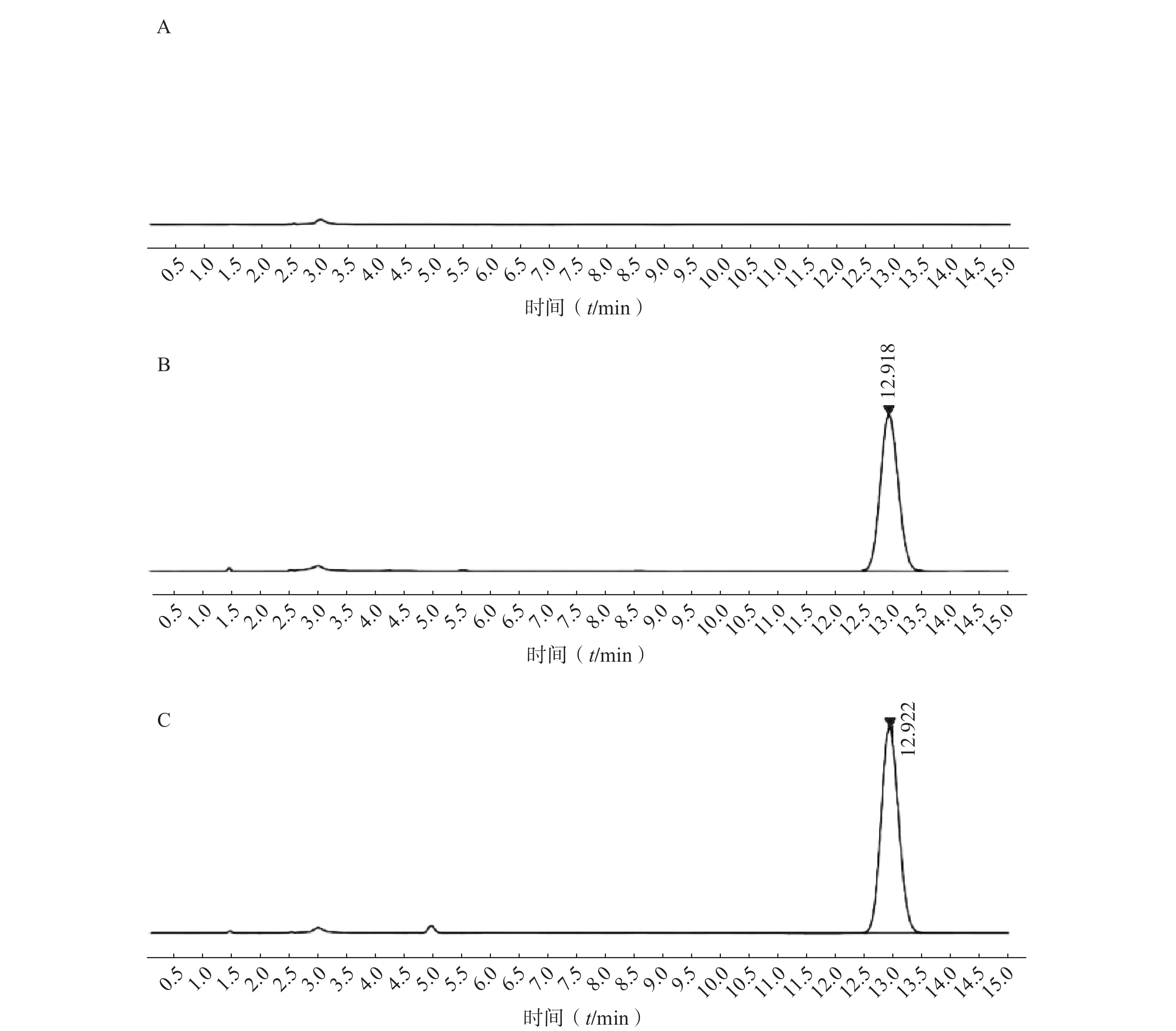
分别取适量空白溶液、对照品溶液和供试品溶液,用流动相稀释至适当的浓度后,按照“色谱条件”中建立的高相液相参数进行进样分析。
2.2.4 线性关系考察
精密量取适量PTX-PA对照品储备液依次稀释为浓度1、5、10、25、50、100 μg/ml的PTX-PA系列浓度。按照“色谱条件”中的高效液相参数进行进样分析(n=5),并记录不同浓度的PTX-PA的色谱峰面积。以浓度(C)为X轴、峰面积(A)为Y轴进行回归。
2.2.5 精密度考察
日内精密度考察:精密吸取3种不同浓度(5、25、100 μg/ml)的 PTX-PA对照品溶液,对同一浓度溶液连续进样5次,每次10 µl,按照“2.2.1”项下色谱条件进行分析,记录各个浓度吸收峰面积。
日间精密度考察:精密吸取3种不同浓度(5、25、100 μg/ml)的 PTX-PA对照品溶液,对同一浓度溶液连续进样5 d,每天1次,每次10 µl,按照“2.2.1”项下色谱条件进行分析,记录第0、1、2、3、4天的吸收峰面积,计算样品浓度,考察仪器的日间精密度。
2.2.6 重复性与稳定性
空白脂质体超声破乳,配制成3种不同浓度(1、10、100 μg/ml),连续进样5次,每次10 µl,记录各吸收峰面积,考察重复性。精密吸取浓度为50 μg/ml的 PTX-PA供试品溶液,于0、2、4、6、8、12、24 h进样测定,每次进样10 µl,记录各紫外吸收峰面积,考察样品的稳定性。
2.2.7 加样回收率考察
空白脂质体超声破乳,分别加入浓度为1 mg/ml的PTX-PA溶液0.5、2.5、5 ml,采用流动相稀释定容至100 ml,分别进样,并结合PTX-PA的理论浓度(5、25、50 μg/ml)进行加样回收率的计算与分析。
2.3 紫杉醇棕榈酸酯脂质体PTX-PA/Lip的制备
2.3.1 PTX-PA/Lip的制备方法的选择
(1) 薄膜分散法
精密称取PTX-PA 20 mg、蛋黄卵磷脂350 mg、胆固醇5 mg和DSPE-PEG2000 25 mg,加入适量的二氯甲烷使其充分溶解。然后旋蒸除去有机溶剂,使圆底烧瓶底部形成一层均匀透明的薄膜,再加入预热至同等温度的重蒸水10 ml,震荡、水化,得PTX-PA/Lip粗品。将得到的粗品经探头超声(1 min)、过滤处理后,即得PTX-PA/Lip纳米给药系统[19]。
(2) 高压均质法
将薄膜分散法制得的PTX-PA/Lip粗品置于高压均质机中,经3次均质处理后(均质压力12 000 psi),即得PTX-PA/Lip纳米给药系统[23,24]。
(3)挤出法
将薄膜分散法制得的PTX-PA/Lip粗品置于挤出器中,使分别经过孔径为0.2、0.1、0.05 μm的聚碳酸酯膜,即得PTX-PA/Lip纳米给药系统[25-27]。
2.3.2 处方工艺筛选
(1)磷脂种类的选择
采用薄膜分散法考察不同磷脂制备的PTX-PA/Lip,包括:氢化磷脂(HSPC)、蛋黄卵磷脂(PC98-T)、蛋黄磷脂(EPCS)、二棕榈酸磷脂酰胆碱(DPPC),以形态、粒径、包封率为指标进行评价。
(2)磷脂和药物/胆固醇比例的考察
分别以磷脂和药物的质量比(5∶1、10∶1、20∶1、30∶1、40∶1)/PC98-T和胆固醇的质量比(4∶0.05、4∶0.1、4∶0.2、4∶0.3、4∶0.4、4∶0.5)为自变量制备PTX-PA/Lip脂质体,考察不同处方的粒径、粒径分布、包封率,确定处方中磷脂与药物/胆固醇的质量比。
(3)药物和DSPE-PEG2000比例的考察
以PTX-PA和DSPE-PEG2000的质量比(1∶0.5、1∶1、1∶1.5、1∶2、1∶2.5)为自变量,考察其用量对制剂的外观澄明度、纳米粒子大小等是否产生影响。
(4)薄膜蒸发法的温度考察
将旋转蒸发仪温度分别设置为35、40、45、50、55 ℃,考察薄膜蒸发过程中温度对PTX-PA/Lip形态、粒径、包封率等的影响。
(5)探头超声时间的考察
以探头超声PTX-PA/Lip粗品的时间为自变量,考察不同超声时间(30、60、90、180、240 s)对PTX-PA/Lip纳米制剂形态、纳米粒子大小的影响。
2.4 统计学分析
数据采用IBM SPSS Statistics 27.0进行统计分析,采用单因素方差分析ANOVA进行显著性检验与评价。
3. 结果与讨论
3.1 基于PTX-PA的HPLC定量检测方法学建立
3.1.1 最大吸收波长的选择
实验结果如图1所示,选用PTX-PA的最大吸收波长为228 nm为测定波长。
3.1.2 专属性考察
如图2所示,本章所建立的色谱条件对PTX-PA检测具有专属性,溶剂以及样品中的辅料对PTX-PA的检测不产生干扰。
3.1.3 线性关系考察
按照2.2.4方法进行回归,得PTX-PA的吸收峰面积-浓度在1~100 μg/ml的浓度范围内为线性方程:A=15.14 C+10.81(r=0.999 8)。
3.1.4 精密度考察
按照2.2.5方法进行精密度考察,结果如表1所示,日内与日间精密度各时间点峰面积的RSD均小于3%,表明仪器的日内与日间精密度符合测定要求。
表 1 PTX-PA的精密度考察结果(n=5)理论浓度(μg/ml) 实测浓度(μg/ml) RSD(%) 日内 5.00 4.98±0.13 2.65 25.00 25.30±0.55 2.18 100.00 99.66±1.11 1.11 日间 5.00 4.99±0.11 2.31 25.00 25.50±0.57 2.23 100.00 100.65±1.38 1.37 3.1.5 重复性与稳定性
按照2.2.6方法进行研究,精密吸取3种不同浓度的 PTX-PA溶液,连续进样5次并记录各吸收峰面积。各浓度峰面积RSD均<3%,表明仪器符合检测检测要求。此外,稳定性结果表明,样品溶液峰面积的RSD为0.81%,表明制备的PTX-PA溶液在24 h内稳定。
3.1.6 加样回收率
按照2.2.7方法计算加样回收率,结果如表2所示:低、中、高3个浓度的加样回收率均在95%~105%之间,且RSD分别为2.39%、1.80%、2.34%,表明本实验建立的高效液相色谱定量方法可用于PTX-PA的含量测定。
表 2 PTX-PA的加样回收率测试结果(n=5)理论浓度(μg/ml) 检测浓度(μg/ml) 回收率(%) RSD(%) 5 5.02±0.12 100.4 2.39 25 24.98±0.45 99.92 1.80 50 50.01±1.17 100.02 2.34 3.2 紫杉醇棕榈酸酯脂质体的制备及处方优化
3.2.1 PTX-PA/Lip制备方法的选择
采用不同方法制备的PTX-PA/Lip表征结果如表3所示,按照2.4方法进行统计学分析,3种制备方法的包封率无显著性差异,但采用薄膜分散法制备的PTX-PA/Lip粒径与PDI更小。因此,本研究优选薄膜分散法来构建PTX-PA/Lip。
表 3 3种常规制备方法对PTX-PA/Lip粒径、粒径分布、包封率的影响制备方法 粒径(l/nm) PDI 包封率(%) 薄膜分散法 76.76±3.39 0.104±0.02 79.38±2.00 高压均值法 125.11±5.32 0.139±0.03 78.87±2.00 挤出法 128.87±4.92 0.239±0.05 81.38±1.11 3.2.2 处方工艺筛选
(1)磷脂种类的选择
按照2.3.2(1)制备的PTX-PA/Lip表征结果如表4所示,以PC98-T为膜材制备的纳米给药系统粒径小、外观澄明、粒径分布均匀、包封率较高,因此选择PC98-T作为本研究中的磷脂。
表 4 磷脂种类对脂质体的外观形态、颗粒大小、药物包封率的影响磷脂种类 外观 粒径(l/nm) PDI 包封率(%) PC98-T 半透明 76.76±3.39 0.104±0.02 79.38±2.00 HSPC 有沉淀 177.86±5.39 0.532±0.08 59.06±1.32 EPCS 半透明 135.12±5.65 0.108±0.03 73.23±1.15 DPPC 有沉淀 158.26±4.11 0.669±0.05 53.27±2.68 (2)磷脂和药物比例的考察
按照2.3.2(2)项下确定处方中药物和磷脂的用量,其结果如表5所示,磷脂PC98-T和药物的质量比大于10时,制备的PTX-PA/Lip外观澄明度、粒子大小、粒径分散系数等参数无显著性差别。随着磷脂浓度不断增加,药物的包封率不断增加,当PC98-T和PTX-PA的质量比为20∶1时,脂质体对药物的包封率最高,后期考虑到经济成本,将PC98-T和PTX-PA的质量比定为20∶1。
表 5 磷脂和药物质量比对脂质体的外观澄明度、颗粒大小、对药物包封率的影响磷脂∶药物 外观 粒径(l/nm) PDI 包封率(%) 5∶1 略透明 134.62±2.95 0.364±0.04 58.15±1.73 10∶1 有沉淀 90.29±4.66 0.151±0.04 71.56±1.60 20∶1 半透明 84.58±1.33 0.11±0.02 83.50±0.92 30∶1 半透明 86.06±2.71 0.09±0.05 73.44±4.44 40∶1 有沉淀 88.86±1.91 0.199±0.05 68.37±11.08 (3)磷脂和胆固醇比例的考察
按照2.3.2(2)方法研究,结果如表6所示,随着胆固醇用量增多,制剂变浑浊,粒径增大,载药量显著降低。因此,胆固醇不加入本制剂的处方中。
表 6 磷脂和胆固醇质量比对脂质体外观澄明度、颗粒大小、对药物包封率的影响磷脂∶胆固醇 外观 粒径(l/nm) PDI 包封率(%) 4∶0.05 半透明 115.37±4.48 0.200±0.07 71.57±1.28 4∶0.1 半透明 160.16±3.15 0.251±0.01 61.08±3.13 4∶0.2 半透明 182.75±2.43 0.217±0.04 54.97±0.95 4∶0.3 乳白色 241.90±12.09 0.697±0.12 54.11±1.64 4∶0.4 乳白色 255.33±8.27 0.700±0.138 48.84±0.78 (4)药物和DSPE-PEG2000比例的考察
按照2.3.2(3)方法研究,其结果如表7所示,DSPE-PEG2000对包封率没有显著性影响,但当DSPE-PEG2000含量不断增加时,纳米粒子的颗粒大小先降低,当药物与DSPE-PEG2000质量比小于1∶1.5时,粒径无显著性变化,因此,药物与DSPE-PEG2000的质量比选择1∶1.5。
表 7 PTX-PA和DSPE-PEG2000的质量比对脂质体外观、粒径、药物包封率的影响药物∶DSPE-
PEG2000外观 粒径(l/nm) PDI 包封率(%) 2∶1 半透明 82.86±2.15 0.107±0.01 90.48±0.49 1∶1 半透明 78.16±2.05 0.351±0.38 90.41±0.34 1∶1.5 半透明 72.23±2.60 0.110±0.02 89.66±1.25 1∶2 半透明 74.64±1.81 0.140±0.04 90.90±2.93 1∶2.5 半透明 75.38±2.10 0.097±0.04 89.48±0.67 (5)薄膜蒸发法的温度考察
按照2.3.2(4),采用不同温度制备纳米制剂表征结果如表8所示,在筛选的5个温度中,当温度为45 ℃时,脂质体粒径最小、粒径分散性好、包封率最高,因此,本研究选用45 ℃作为薄膜蒸发温度。
表 8 温度对PTX-PA/Lip外观、粒径、包封率的影响温度(T/ ℃) 外观 粒径(l/nm) PDI 包封率(%) 35 略透明 159.42±2.42 0.545±0.08 54.94±1.85 40 半透明 105.93±6.13 0.269±0.03 73.98±1.60 45 半透明 76.97±2.50 0.105±0.049 91.13±1.45 50 半透明 91.93±2.60 0.181±0.05 80.27±2.13 55 半透明 112.23±6.37 0.233±0.06 74.15±2.12 (6)探头超声时间的考察
按照2.3.2(5)方法进行研究,结果如表9所示:处理时间较短时,纳米粒径较大,颗粒大小分布不均匀;随着超声处理的延长,粒径减小,包封率也提高;超声时间过长,脂质体结构破坏,导致药物泄露、包封率降低。因此将探头超声处理时间定为90 s。
表 9 超声处理对脂质体的外观澄明度、颗粒大小、对药物包封率的影响超声时间(t/s) 外观 粒径(l/nm) PDI 包封率(%) 30 沉淀 278.09±4.73 0.857±0.10 42.83±2.76 60 半透明 113.21±11.16 0.485±0.04 54.96±2.41 90 半透明 78.13±2.78 0.055±0.02 92.74±0.77 180 半透明 123.17±8.39 0.430±0.08 76.29±1.76 240 沉淀 261.85±4.94 0.915±0.20 50.42±2.74 3.3 紫杉醇棕榈酸酯脂质体PTX-PA/Lip的理化性质表征
综上研究,采用的最优处方和制备工艺如下:精密称取PTX-PA 20 mg、PC98-T 400 mg、DSPE-PEG2000 30 mg,加入适量二氯甲烷溶解,接着45 ℃旋蒸去除有机溶剂,再向圆底烧瓶底部薄膜中加入10 ml重蒸水(预热至同等温度),震荡、水化,得PTX-PA/Lip粗品,最后粗品探头超声(90 s)、过滤(0.22 μm),得最终样品PTX-PA/Lip纳米给药系统。
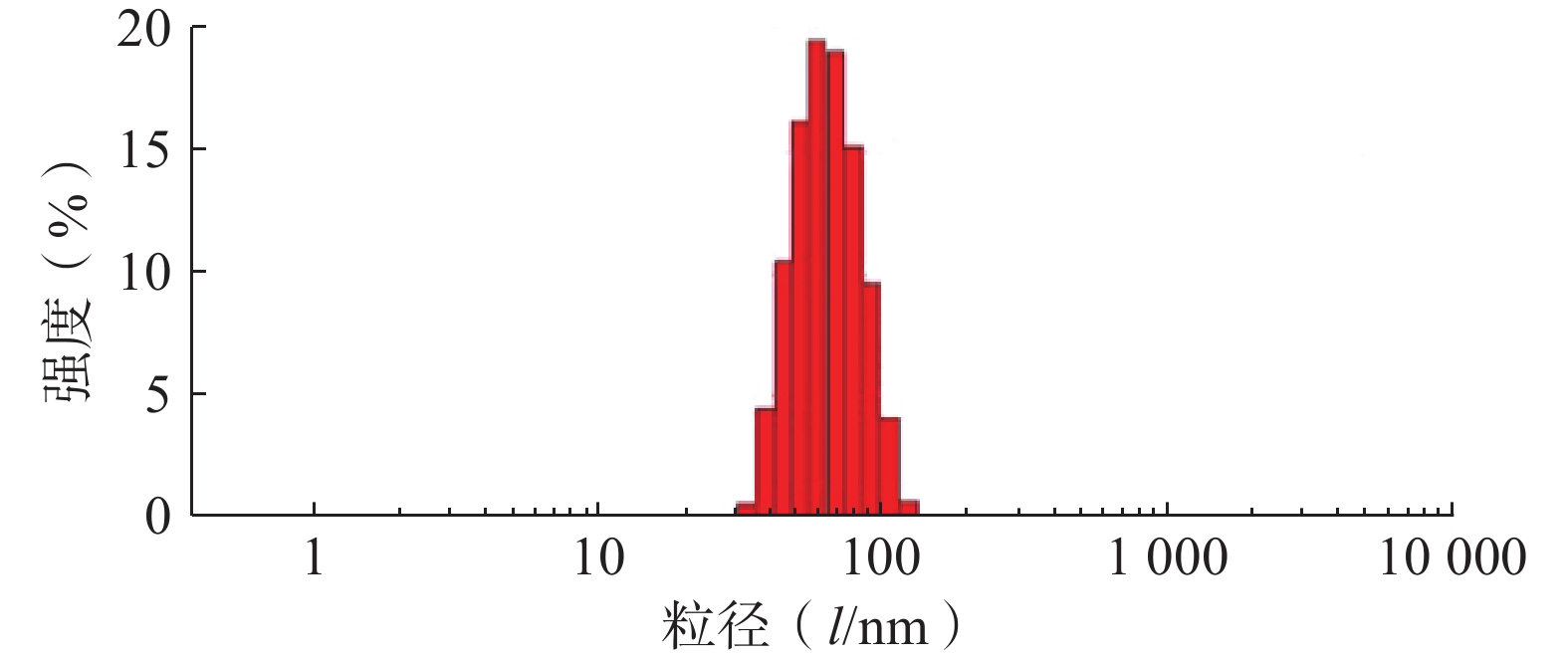
采用Zeta-sizer Nano粒度仪测定最优PTX-PA/Lip的粒径、PDI与zeta电位。结果如图3所示,制备的PTX-PA/Lip脂质体粒径大小为(62.75±1.81) nm,PDI为(0.076±0.020),Zeta电位为(−15.9±0.21) mV,表明制备的PTX-PA/Lip纳米给药系统粒径较小、分布均匀、具有良好的分散性。
4. 总结
本实验合成紫杉醇前药——紫杉醇棕榈酸酯PTX-PA,建立PTX-PA的HPLC定量测定方法,经一系列方法学验证,表明其符合PTX-PA定量分析要求,为后续试验奠定了基础。本实验采用薄膜分散法制备PTX-PA脂质体,工艺简便,技术成熟,并通过单因素筛选对PTX-PA脂质体进行处方优化。本文基于纳米技术成功制备出棕榈酸修饰的紫杉醇脂质体,增强了紫杉醇在靶细胞的递送,为PTX-PA后续的药效学研究奠定基础。
-
表 1 临床疗效及不良反应
组别(μg/ml) 临床疗效 不良反应 例数(n) 有效(%) 无效(%) 例数(n/%) <1.0 13 8(61.5) 5(38.5) 3(23.1) 1.0~5.5 30 28(93.3) 2(6.7) 3(10.0) >5.5 7 6(85.7) 1(14.3) 4(57.1) χ2 6.84 7.988 P 0.033 0.018 表 2 CYP2C19基因型与药物浓度
代谢速度 CYP2C19
基因型酶活性 例数
(n)药物浓度
(ρB/μg·ml−1)快 *1/*1 高 16 1.30±0.24 中 *1/*2 中 25
3.45±0.20中 *1/*3 中 2 慢 *2/*2 低 1 5.92±0.41 慢 *2/*3 低 5 慢 *3/*3 低 1 F 15.359 P <0.001 表 3 CYP2C9基因型与药物浓度
(CYP2C9*3)基因型 例数(n) 药物浓度(ρB/μg·ml−1) 野生纯合子(AA) 46 2.78±0.34 突变杂合子(CA) 4 4.02±0.13 突变纯合子(CC) 0 − F 2.213 P 0.086 注:“−” 表示未检测。 表 4 CYP3A5基因型与药物浓度
(CYP3A5*3)基因型 例数(n) 药物浓度(ρB/μg·ml−1) 野生纯合子(CC) 27 3.43±0.36 突变杂合子(TC) 22 3.86±0.29 突变纯合子(TT) 1 2.85±0 F 0.757 P 0.475 -
[1] FERRERAS-ANTOLÍN L, SHARLAND M, WARRIS A. Management of invasive fungal disease in neonates and children[J]. Pediatr Infect Dis J, 2019, 38(6S Suppl 1): S2-S6. [2] WARRIS A, LEHRNBECHER T, ROILIDES E, et al. ESCMID-ECMM guideline: diagnosis and management of invasive aspergillosis in neonates and children[J]. Clin Microbiol Infect, 2019, 25(9):1096-1113. [3] MCCREARY EK, DAVIS MR, NARAYANAN N, et al. Utility of triazole antifungal therapeutic drug monitoring: Insights from the Society of Infectious Diseases Pharmacists: Endorsed by the Mycoses Study Group Education and Research Consortium[J]. Pharmacotherapy. 2023, 43(10): 1043-1050. [4] 中华医学会儿科学分会, 中华儿科杂志编辑委员会. 儿童侵袭性肺部真菌感染临床实践专家共识(2022版)[J]. 中华儿科志, 2022, 60(4):274-282. [5] LEE J, NG P, HAMANDI B, et al. Effect of therapeutic drug monitoring and cytochrome P450 2C19 genotyping on clinical outcomes of voriconazole: a systematic review[J]. Ann Pharmacother, 2021, 55(4):509-529. doi: 10.1177/1060028020948174 [6] 陈恳, 张相林, 克晓燕, 等. 《伏立康唑个体化用药指南》解读[J]. 临床药物治疗杂志, 2019, 17(3):47-52,78. doi: 10.3969/j.issn.1672-3384.2019.03.012 [7] 中国医药生物技术协会药物性肝损伤防治技术专业委员会, 中华医学会肝病学分会药物性肝病学组. 中国药物性肝损伤诊治指南(2023年版)[J]. 中华肝脏病杂志, 2023, 31(4):355-384. doi: 10.3760/cma.j.cn501113-20230419-00176-1 [8] CHEN K, ZHANG X L, KE X Y, et al. Individualized medication of voriconazole: a practice guideline of the division of therapeutic drug monitoring, Chinese Pharmacological Society[J]. Ther Drug Monit, 2018, 40(6):663-674. doi: 10.1097/FTD.0000000000000561 [9] PATTERSON T F, THOMPSON G R, DENNING D W, et al. Practice guidelines for the diagnosis and management of aspergillosis: 2016 update by the Infectious Diseases Society of America[J]. Clin Infect Dis, 2016, 63(4):e1-e60. [10] MORIYAMA B, OBENG A O, BARBARINO J, et al. Clinical pharmacogenetics implementation consortium(CPIC)guidelines for CYP2C19 and voriconazole therapy[J]. Clin Pharmacol Ther, 2017, 102(1):45-51. [11] TAHER KW, ALMOFADA R, ALOMAIR S, et al. Therapeutic drug monitoring of voriconazole in critically Ill pediatric patients: a single-center retrospective study. Paediatr Drugs, 2024, 26(2): 197-203. [12] PASCUAL A, CSAJKA C, BUCLIN T, et al. Challenging recommended oral and intravenous voriconazole doses for improved efficacy and safety: population pharmacokinetics-based analysis of adult patients with invasive fungal infections[J]. Clin Infect Dis, 2012, 55(3):381-390. doi: 10.1093/cid/cis437 [13] 郭一萌, 安琳娜, 陈恳, 等. 伏立康唑在不同年龄段使用中安全性和有效性以及药代动力学差异的系统评价[J]. 中国临床药理学杂志, 2016, 32(3):261-263. [14] BAHAR MA, SETIAWAN D, HAK E, et al. Pharmacogenetics of drug-drug interaction and drug-drug-gene interaction: a systematic review on CYP2C9, CYP2C19 and CYP2D6[J]. Pharmacogenomics, 2017, 18(7):701-739. doi: 10.2217/pgs-2017-0194 [15] SHI C C, XIAO Y B, MAO Y, et al. Voriconazole: a review of population pharmacokinetic analyses[J]. Clin Pharmacokinet, 2019, 58(6):687-703. [16] 邵贝贝, 赵宁民, 段虹飞, 等. 基于基因多态性的伏立康唑药代动力学研究状况[J]. 中国临床药理学杂志, 2016, 32(7):663-666. [17] FAN X, ZHANG H, WEN Z, et al. Effects of CYP2C19, CYP2C9 and CYP3A4 gene polymorphisms on plasma voriconazole levels in Chinese pediatric patients. Pharmacogenet Genomics[J]. 2022, 32(4): 152-158. [18] AIUCHI N, NAKAGAWA J, SAKURABA H, et al. Impact of polymorphisms of pharmacokinetics-related genes and the inflammatory response on the metabolism of voriconazole[J]. Pharmacol Res Perspect, 2022, 10(2):e00935. doi: 10.1002/prp2.935 -





 下载:
下载:
 下载:
下载: 

