-
新型冠状病毒肺炎(简称新冠肺炎,COVID-19),具有较强的人际传播能力,传播速度快[1-3]。COVID-19患者会出现与流感类似的症状,包括发烧、咳嗽、乏力、腹泻等,重症患者出现呼吸困难或低氧血症,可发展为急性呼吸窘迫综合征、脓毒症休克、多器官功能衰竭等导致死亡[4]。中医药早期干预可有效预防病情向重、危重方向恶化[5]。目前,中医药控制COVID-19的疗效普遍受到重视[6],业界提倡结合不同疾病阶段使用不同的处方[2]。寒湿郁肺汤为武汉火神山医院依据国家卫健委印发的《新型冠状病毒感染的肺炎诊疗方案》所引进的四种肺炎诊疗中药汤剂处方之一,用于新型冠状病毒初期治疗,该汤剂由苍术、陈皮、厚朴、藿香、草果、生麻黄、羌活、生姜共八味中药组方而成。
UHPLC-MS/MS因具有分离能力强,检测限低,高灵敏度,高选择性等特点,易于开发为临床检测项目的参考方法[7]。本研究应用UHPLC-MS/MS法,依照2015版中国药典对寒湿郁肺汤中11种主成分进行含量测定,为后续的质量研究奠定基础。
-
Agilent1290超高效液相色谱仪(包括G4220A二元高压泵、G4226A自动进样器、G1330B控温箱、G1316C柱温箱)、Agilent G6460A型三重四极杆串联质谱仪、电喷雾离子源、Mass Hunter化学工作站B.06.00(美国Agilent公司);BSA124S-CW型天平、CPA225D型天平(德国Sartorius公司);Mini spin型离心机、移液枪(德国Eppendorf公司);Labnet VX-200型定时可调速涡旋混合器(美国Labnet公司);SK7200H型超声仪(上海科导超声仪器有限公司);UNIVERSAL32R型台式冷冻离心机(德国Hettich公司)。
-
香草酸(批号:H11J9Z65318)、厚朴酚(批号:Y27J10C91584)、和厚朴酚(批号:T28O6B5149)、汉黄芩素(批号:T11J11R108209)、刺槐素(批号:C12O8Q45551)、6-姜酚(批号:P29O10F101611)、桔皮素(批号:H24F11K108893)、羌活醇(批号:R28M9F57295)、川陈皮素(批号:N10J10R90249)、紫花前胡苷(批号:W07A10Z94862)、利血平(批号:Y02M11Y17235)、橙皮苷(批号:P06D9F77001)均为对照品,纯度均≥97%,购于上海源叶生物科技有限公司;甲醇(批号:10951907818,质谱级)、乙腈(批号:JA075930,质谱级)购自德国默克公司;甲酸(批号:17033D,分析纯)、乙酸铵(批号:H1709024,色谱纯)购自阿拉丁试剂(上海)有限公司;水为屈臣氏蒸馏水(广州屈臣氏食品饮料有限公司),其余试剂均为分析纯。
-
寒湿郁肺汤中苍术(批号:20092108)、陈皮(批号:20010181)、厚朴(批号:20061903)、藿香(批号:20031708)、草果(批号:19092902)、生麻黄(批号:20200301)、羌活(批号:20070709)等中药材均由上海长征医院药材科提供,生姜(批号:19062404)购于广西壮族自治区。
-
分别取各对照品适量,精密称定,用甲醇配制成含1.01 mg/ml香草酸、0.99 mg/ml厚朴酚、1.03 mg/ml和厚朴酚、1.00 mg/ml汉黄芩素、1.00 mg/ml刺槐素、1.01 mg/ml 6-姜酚、1.02 mg/ml桔皮素、1.01 mg/ml羌活醇、1.03 mg/ml川陈皮素、1.00 mg/ml紫花前胡苷、1.00 mg/ml利血平(IS)和1.00 mg/ml橙皮苷的对照品溶液,于−20 ℃冰箱保存,备用。
-
取寒湿郁肺汤中苍术15 g、陈皮10 g、厚朴10 g、藿香10 g、草果6 g、生麻黄6 g、羌活10 g、生姜10 g,精密称定,置锅中,加水500 ml,浸泡30 min,加热至煮沸后调至文火煎20 min,取药液;第二次加水300 ml,加热至煮沸后调至文火煎20 min,取药液,与第一次药液混匀,取出,放冷。精密量取药液1 ml,加入1 μg/ml的利血平10 μl,涡旋3 min,14 500 r/min离心10 min,取上清液,经0.22 μm微孔滤膜过滤,续滤液即为供试品溶液。
-
Agilent ZORBAX SB-C18色谱柱( 3.5 μm,2.1 mm×150 mm ),流动相为0.2%甲酸水−10 mmol/L醋酸铵溶液(A)-乙腈(B);梯度洗脱:0~0.6 min, 80%~40% A; 0.6~1 min, 40%~30% A; 1~4.3 min, 30%~5% A;流速:0.3 ml/min;柱温:40 ℃;进样量:10 μl,每个样品的分析周期为4.3 min。
-
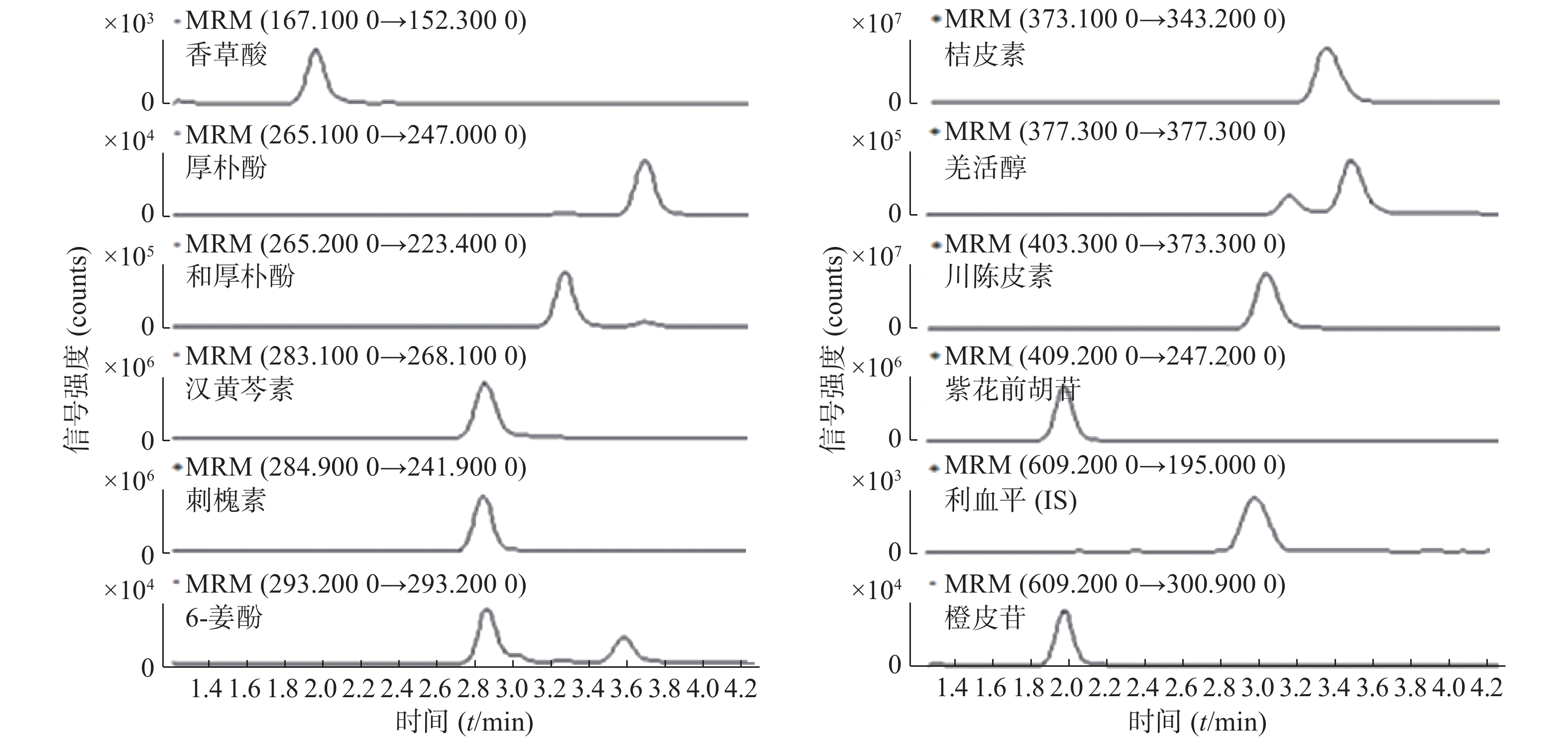
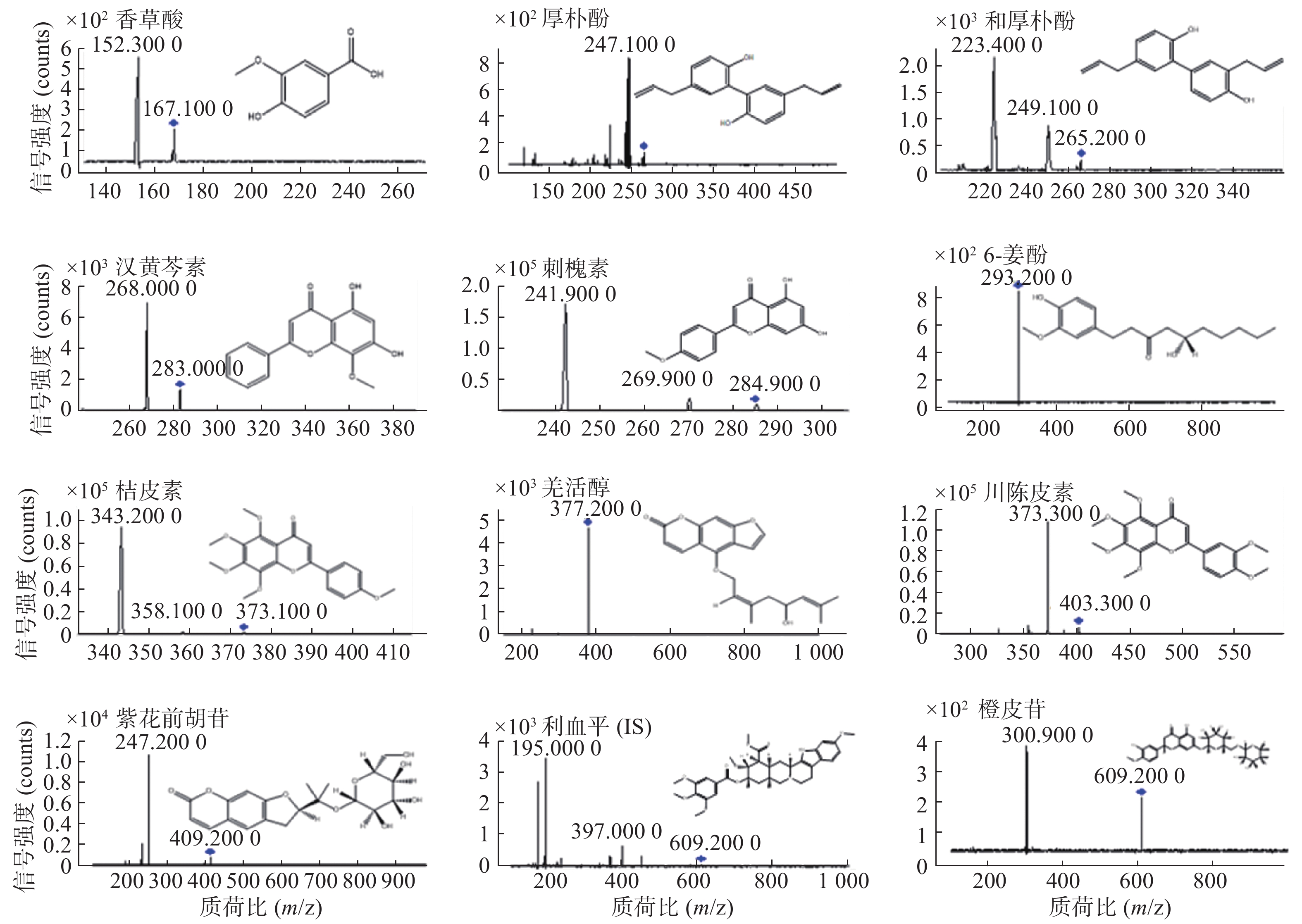
采用电喷雾离子源(ESI)和多反应监测模式(MRM)。正负离子同时扫描;氮气作为雾化气和干燥气;高纯氮气为碰撞气,毛细管电压为4 000 V;碰撞气压为40 psi;鞘流气温为350 ℃,干燥气温为325 ℃,干燥气流速为12 L/min;将一定浓度的标准溶液和内标溶液进样,在ESI电离方式下进行产物离子全扫描分析(见图1),定量分析质荷比详见表1。
表 1 寒湿郁肺汤中11个主成分及内标的质谱检测参数
测定成分 母离子
(m/z)子离子
(m/z)裂解电压
(V)碰撞能量
(V)ESI
模式香草酸 167.1 152.3 70 10 − 厚朴酚 265.1 247 148 29 − 和厚朴酚 265.2 223.4 135 29 − 汉黄芩素 283.1 268.1 105 13 − 刺槐素 284.9 241.9 140 34 − 6-姜酚 293.2 293.2 130 0 − 桔皮素 373.1 343.2 135 28 + 羌活醇 377.3 377.3 130 0 + 川陈皮素 403.3 373.3 130 26 + 紫花前胡苷 409.2 247.2 95 11 + 利血平(IS) 609.2 195 240 35 − 橙皮苷 609.2 300.9 135 15 − -
分别精密吸取空白溶剂、对照品溶液和供试品溶液各10 μl,按“2.1.2”项下方法制样,再按照“2.2”项下色谱与质谱条件进样测定,记录图谱。结果显示,专属性符合相关要求(图2)。
-
精密量取对照品溶液适量,浓度稀释为如下的混合对照品溶液:香草酸、厚朴酚、和厚朴酚、汉黄芩素、刺槐素、桔皮素、羌活醇、紫花前胡苷的线性浓度为20、50、100、200、500、1 000、1 500、2 000 ng/ml;6-姜酚、川陈皮素、橙皮苷的线性浓度为200、500、1 000、2 000、5 000、10 000、15 000、20 000 ng/ml。采用内标定量法按“2.2”项下色谱与质谱条件进行测定,并记录色谱峰面积。以峰面积为纵坐标(Y),对照品质量浓度为横坐标(C),绘制标准曲线,并进行线性回归,结果见表2。
表 2 寒湿郁肺汤中11种成分的线性考察
测定成分 回归方程 r 线性范围(μg/ml) 香草酸 Y=9.023C-1.345 0.99 0.02~2.00 厚朴酚 Y=0.023C+0.002 0.99 0.02~2.00 和厚朴酚 Y=0.028C-0.060 0.98 0.02~2.00 汉黄芩素 Y=0.701C+1.802 0.98 0.02~2.00 刺槐素 Y=0.488C+0.205 0.99 0.02~2.00 6-姜酚 Y=0.003C+1.510 0.99 0.20~20.00 桔皮素 Y=4.291C+70.573 0.99 0.02~2.00 羌活醇 Y=0.173C+3.849 0.98 0.02~2.00 川陈皮素 Y=0.576C+277.012 0.99 0.20~20.00 紫花前胡苷 Y=0.362C-0.081 0.99 0.02~2.00 橙皮苷 Y=0.011C+0.061 0.99 0.20~20.00 -
将母液稀释10倍,按“2.2”项下色谱与质谱条件进行测定,连续进样6次,记录峰面积,计算RSD。结果显示,香草酸、厚朴酚、和厚朴酚、汉黄芩素、刺槐素、6-姜酚、桔皮素、羌活醇、川陈皮素、紫花前胡苷、橙皮苷11种成分的峰面积RSD分别为1.83%、5.57%、4.39%、3.14%、4.25%、4.01%、1.26%、1.40%、1.75%、3.29%、2.55%,表明该方法精密度良好。
-
取同一份寒湿郁肺汤供试品溶液,按“2.1.2”项下方法平行制备6份,按“2.2”项下色谱与质谱条件进行测定,记录峰面积,计算RSD。结果显示,香草酸、厚朴酚、和厚朴酚、汉黄芩素、刺槐素、6-姜酚、桔皮素、羌活醇、川陈皮素、紫花前胡苷、橙皮苷11种化学成分的峰面积RSD分别为4.78%、8.40%、5.55%、3.27%、1.51%、3.30%、1.30%、3.37%、1.21%、1.98%、2.46%,表明该方法重复性良好。
-
取同一份供试品溶液,按“2.1.2”项下方法制备,室温放置,按“2.2”项下色谱与质谱条件,分别于0、2、4、6、12、16、24 h进样测定,记录峰面积,计算RSD。结果显示,香草酸、厚朴酚、和厚朴酚、汉黄芩素、刺槐素、6-姜酚、桔皮素、羌活醇、川陈皮素、紫花前胡苷、橙皮苷11种化学成分在4 h内的峰面积RSD分别为5.81%、4.68%、3.17%、13.09%、13.20%、8.99%、6.19%、5.19%、4.18%、5.55%、9.47%,表明供试品溶液在室温放置4 h内稳定性良好。
-
精密称取已知含量的寒湿郁肺汤样品,加入各对照品适量,平行制备6份,按“2.1.2”项下方法制备供试品溶液,按“2.2”项下色谱与质谱条件进样测定,进行UHPLC-MS/MS分析,计算各待测物的平均回收率及其RSD。11种待测物:香草酸、厚朴酚、和厚朴酚、汉黄芩素、刺槐素、6-姜酚、桔皮素、羌活醇、川陈皮素、紫花前胡苷、橙皮苷的平均加样回收率分别为111.73%、102.96%、108.94%、102.90%、99.36%、104.83%、100.55%、100.27%、105.49%、96.92%、93.11%,RSD分别为2.44%、2.37%、4.44%、1.92%、4.60%、2.57%、1.79%、2.36%、4.99%、3.08%、3.59%,表明该方法的准确度良好。
-
取9批寒湿郁肺汤药材,按“2.1.2”项下方法制备供试品溶液,按“2.2”项下色谱与质谱条件进行测定,计算寒湿郁肺汤9批样本中11种成分:香草酸、厚朴酚、和厚朴酚、汉黄芩素、刺槐素、6-姜酚、桔皮素、羌活醇、川陈皮素、紫花前胡苷、橙皮苷的含量,测定结果为香草酸0.07~0.09 μg/ml、厚朴酚0.06~0.07 μg/ml、和厚朴酚0.26~0.57 μg/ml、汉黄芩素0.07~0.09 μg/ml、刺槐素0.27~0.29 μg/ml、6-姜酚0.55~0.58 μg/ml、桔皮素0.31~0.33 μg/ml、羌活醇0.54~0.58 μg/ml、川陈皮素3.78~3.81 μg/ml、紫花前胡苷0.31~0.33 μg/ml、橙皮苷1.58~1.61 μg/ml。
-
在预实验中分别考察了Agilent ZORBAX SB C18(3.5 μm,2.1 mm ×100 mm)、Agilent ZORBAX SB-C18(3.5 μm,2.1 mm×150 mm)、Waters Xbridge®HILIC(3.5 μm,2.1 mm×100 mm)、Waters Atlantis®T3(3 μm,2.1 mm×100 mm)、Agilent Eclipse XDB-C18(3.5 μm,2.1 mm×150 mm)等色谱柱对11个待测成分含量测定的影响,结果显示,当色谱柱为Agilent ZORBAX SB-C18(3.5 μm,2.1mm×150 mm)时,11个待测成分及内标的峰形最佳。
-
实验中分别考察了水-乙腈、0.1%甲酸水-乙腈、0.15%甲酸水-乙腈、0.2%甲酸水-乙腈、5 mmol/L醋酸铵溶液-乙腈、10 mmol/L醋酸铵水-乙腈、0.2%甲酸-10 mmol/L醋酸铵水溶液-甲醇、0.2%甲酸-10 mmol/L醋酸铵水溶液-乙腈等流动相对11个成分含量测定的影响,结果显示,此11个待测成分在0.2%甲酸-10 mmol/L醋酸铵水溶液-乙腈中,采用梯度洗脱,响应与峰形均佳。
-
在预实验中分别考察了培美曲塞、利血平、卡马西平三个标准品作为内标时的响应和出峰时间,最终选用了出峰时间居中、响应好、稳定性高的利血平作为内标。本实验中所选取的化学成分以药典为基础,结合文献调研,舍弃挥发油类成分及违禁成分,最终选取了11个能代表药材的化学成分进行研究。
-
本研究基于UHPLC-MS/MS同时测定寒湿郁肺汤中11个成分含量的方法,经色谱柱、流动相的优化和全面的方法学考察,成功应用于样品中寒湿郁肺汤11种成分的测定。该法简便可靠,可为寒湿郁肺汤中的成分检测提供一定的方法参考,也为寒湿郁肺汤的质量控制及质量标准研究奠定了基础。
Determination of 11 main components in Hanshi Yufei decoction, a COVID-19 empirical prescription by UHPLC-MS/MS
-
摘要:
目的 建立测定寒湿郁肺汤中11个主成分含量的方法。 方法 采用超高效液相色谱串联质谱法(UHPLC-MS/MS),色谱柱为Agilent ZORBAX SB-C18(3.5 μm,2.1 mm×150 mm ),流动相为0.2%甲酸-10 mmol/L醋酸铵水溶液(A)-乙腈(B),梯度洗脱(0~0.6 min, 80%~40%A; 0.6~1 min, 40%~30%A; 1~4.3 min, 30%~5%A),流速0.3 ml/min,柱温40 ℃。以利血平为检测内标,采用多反应监测模式同时测定香草酸、厚朴酚、和厚朴酚、汉黄芩素、刺槐素、6-姜酚、桔皮素、羌活醇、川陈皮素、紫花前胡苷、橙皮苷11个化学主成分的含量。 结果 寒湿郁肺汤中11个主成分在各自浓度范围内线性关系良好(r>0.98),平均回收率在93.11%~111.73%。 结论 该实验所建立的方法操作简便、重复性好,为寒湿郁肺汤的质量控制提供了实验室依据。 -
关键词:
- 超高效液相色谱串联质谱法 /
- 含量测定 /
- 新型冠状病毒肺炎 /
- 寒湿郁肺汤
Abstract:Objective To establish a method to determine 11 main components in Hanshi yufei decoction. Methods The method adopted UHPLC-MS/MS with an Agilent ZORBAX SB-C18 (3.5 μm, 2.1 mm×150 mm) column. The mobile phase was consisted of 0.2% formic acid plus 10 mmol/L ammonium acetate aqueous solution(A) - acetonitrile(B) and gradient elution (0–0.6 min, 80%–40%A; 0.6–1 min, 40%–30%A; 1–4.3 min, 30%–5%A) at 0.3 ml/min. The column temperature was 40 ℃ and 11 main components including vanillic acid, magnolol, honokiol, wogonin, sophorin, 6-gingerol, citrinin, qianghuo alcohol, nobiletin, nodakenin, and hesperidin were quantified in a multiple reaction monitoring mode. The reserpine was the standard. Results The 11 main components in Hanshi Yufei decoction had a good linear relationship within their concentration range (r>0.98), and the average recovery was 93.11%~111.73%. Conclusion The UHPLC-MS/MS method established in this experiment is easy to operate and has good reproducibility, which provides a laboratory basis for the quality control of Hanshi Yufei decoction. -
Key words:
- UHPLC-MS/MS /
- content determination /
- COVID-19 /
- Hanshi Yufei decoction
-
中药红花(Carthami Flos)是菊科植物红花(Carthamus tinctorius L.)的干燥花,传统本草学著作《本草纲目》记载,红花具有活血散瘀,通经止痛的功效[1],其药材和制剂在临床上被广泛用于心脑血管疾病的预防和治疗。现代药理研究表明,其主要药效物质是以羟基红花黄色素A(hydroxysafflower yellow A,HSYA)为代表的查尔酮类化合物和以菸花苷为代表的黄酮醇类化合物,这些化合物均具有良好的心脑血管损伤保护活性[2-3]。红花药材的产量偏低,每平方千米产量仅为18.0~22.5 t[4],其中特有的HSYA[5]、红花红色素等查尔酮类成分在不同品种间差异较大[6]。由于红花中的查尔酮类成分仅特异性地存在于花冠中[7],加之体外组织培养再生率低[8]等原因,对其功能基因的研究工作一直进展缓慢。特别是对于HSYA等红花特有的有效成分,其生物合成相关的功能基因尚不完全清楚,合成通路也未被完全解析[9]。因此,用现代分子生物学技术手段以提高药效物质的含量,是提高红花品质,节约土地资源、降低制药成本的一条新途径。
短链脱氢酶/还原酶(short-chain dehydrogenases/reductases,SDR)在植物次生代谢物的生物合成中广泛参与各类碳-氧双键,碳-碳双键以及烯酮键的氧化还原催化反应。根据SDRs基因序列的特征结构,SDRs超家族可以被分为5个亚家族[10-14]。最早发现并且进行鉴定的两类主要短链还原酶命名为classical和extend,classical类的SDRs基因拥有长度约为250个氨基酸残基,被称为Extended类的SDRs基因在碳基末端因其含有多余的约100个氨基酸残基而得名。另外3种类型SDRs基因分别被命名为intermediate、complex和divergent。这些类型的SDRs基因基于其结合辅酶类型和结合催化位点的不同进行命名分类。此外,SDRs存在与传统类型不同的含有“rossmann-fold”保守结构域的氧化还原酶结构[15-18]。
黄酮类化合物起源于莽草酸途径和苯丙素生物合成途径,1个香豆酰辅酶A(coumaroyl CoA)和3个丙二酰辅酶A(malonyl CoA)在查尔酮合酶的作用下生成二氢查尔酮,然后经查尔酮异构酶催化为二氢黄酮,进一步在各类还原酶,聚合酶和糖基转移酶的作用下,生成终端次生代谢产物组合[19-21]。红花中所含的主要有效成分HSYA具有查尔酮式结构,本课题组前期研究认为:HSYA从前体物质到合成,中间存在必不可少的氧化还原过程。短链脱氢还原酶家族广泛参与植物体内次生代谢,这一类还原酶都带有相似的折叠结构以及催化位点,已有研究表明,其对苯丙烷代谢途径起重要作用[22-23],但有关红花中还原酶基因相关报道较少[24]。故笔者通过对红花转录组数据库、基因表达谱数据库以及代谢组数据库进行分析,筛选在HSYA生物合成途径的关键还原酶基因,并进行功能验证,以期揭示红花次生代谢成分生物合成途径,为定向调控红花的品质提供科学依据。
1. 材料与方法
1.1 植物材料
云南巍山红花品系(ZHH0119),采自海军军医大学药学系温室,经海军军医大学郭美丽教授鉴定为菊科植物红花(Carthamus tinctorius L.)。红花种植条件:温度恒定25 ℃,16 h光照,8 h黑暗。采集相关花与组织后迅速存放于液氮或者−80 ℃冰箱中冷冻。
1.2 RNA提取及cDNA第一链合成
按照Trans ZOL Plant植物总RNA提取试剂盒(北京全式金公司,中国)说明书方法提取红花花冠总RNA,按照Transtart One-Step gDNA Removal and cDNA Synthesis Super Mix逆转录试剂盒(北京全式金公司,中国)说明书方法进行cDNA第一链的合成。cDNA于−20 ℃保存。
1.3 基因筛选
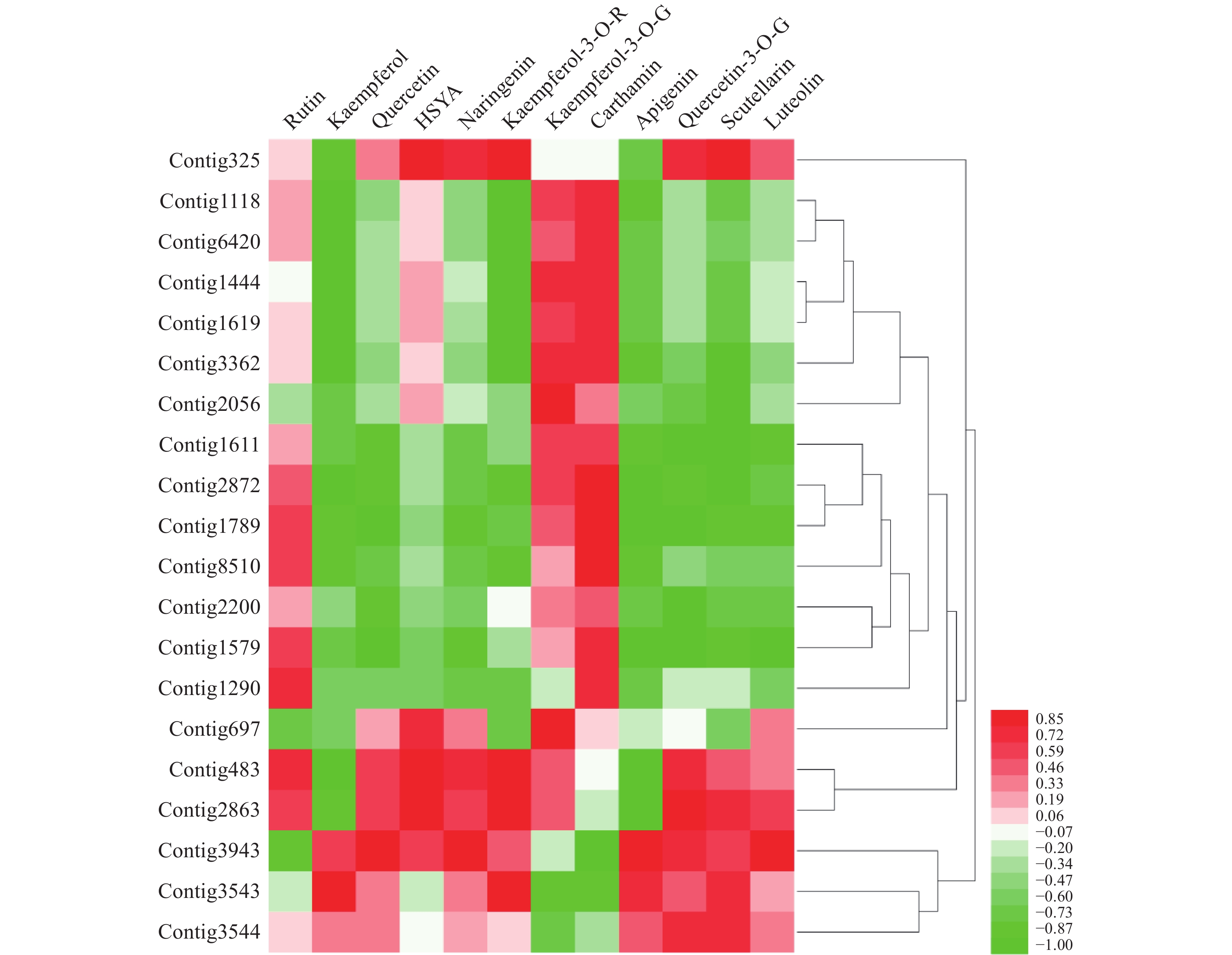
基于数据库中的基因注释以“黄酮还原酶”和“黄酮类化合物生物合成”作为关键词进行检索,筛选出其中可能与HSYA生物合成相关的还原酶基因,将筛选基因不同花期时间的表达量,将其与红花代谢组数据库中同花期的芦丁(rutin)、山柰酚(kaempferol)、槲皮素(quercetin)、HSYA、柚皮素(naringenin)、山柰酚-3-O-芸香糖苷(kaempferol-3-O-rutinoside)、山柰酚-3-O-葡萄糖苷(kaempferol-3-O-gluciside)、Carthamin、芹菜素(apigenin)、黄芩素(scutellarein)、木犀草素(luteolin)、苯丙氨酸(D-phenylalanine) 12个主要成分的含量[12,25]进行皮尔森相关性分析。
1.4 全长克隆及生物信息学分析
基于红花花冠EST转录组文库,结合第三代测序技术[26-29]红花花冠全长转录组数据库筛选得到目的基因序列。在其5'端、3'端分别设计特异性引物。按照2× Phanta Flash Master Mix(Dye Plus)高保真酶(南京诺唯赞公司,中国)说明书进行PCR扩增,扩增片段经EasyPure Quick Gel Extraction Kit胶回收试剂盒(北京全式金公司,中国)说明书操作回收后,连接于pEASY-Blunt Zero Cloning Kit(北京全式金公司,中国)载体上,转化至大肠杆菌T1感受态细胞(北京全式金公司,中国)后,涂布在LBA平板上,恒温培养37 ℃过夜,挑取阳性单克隆菌落[30-31],送至上海生工生物有限公司进行菌液测序。
用ExPASyProtParam工具(http://web.expasy.org/compute/)对目的基因的理论等电点(pI),蛋白分子量(MW)和蛋白分子式进行预测。通过Simple Molecule Architecture Research Tool工具(http://smart.embl-heidelberg.de/)对目的基因编码的蛋白质结构功能域进行分析。使用ProtScale(http://us.Expasy.org/cgi-bin/protscale.pl)以及TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)对蛋白质的亲/疏水性和跨膜区域做出预测。使用SignaIP 4.0(http://www.cbs.dtu.dk/services/SignalP/)预测目的蛋白是否含有信号肽。使用NCBI BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)对筛选出的SDRs基因进行BLAST序列比对。通过Neighbor-Joining相邻节点法构建系统发育进化树,自展分析法进行1000次重复[32-34]。使用PBILYON-GRLAND数据库预测构建蛋白质二级结构模型。蛋白三级结构由Protein Homology/analogy Recognition Engine预测。用WOLFPSORT软件(https://wolfpsort.hgc.jp/)进行亚细胞定位预测。
1.5 目的基因表达模式分析
取盛花期新鲜红花根、茎、叶、花冠4个部位的新鲜组织和花期Ⅰ(开花前3 d)、花期Ⅱ(开花当天)、花期Ⅲ(开花后1 d)、花期Ⅳ(开花后3 d)4个花期的新鲜花冠,提取总RNA,合成cDNA第一链后,在靠近5'端处对各个基因设计引物,依据Transtart Top Green qPCR super Mix(北京全式金公司,中国)试剂盒推荐体系,以Ct60s(KJ634810)作为内参标记基因,进行qRT-PCR实验,结果使用2−ΔΔCt的方法进行计算分析[35]。
1.6 植物表达载体构建及红花体内功能初步验证
根据CtSDR3的开放阅读框和植物真核表达载体pMT-39序列信息,设计无缝克隆引物。以红花cDNA做模板,使用高保真酶进行PCR反应。产物经胶回收后依无缝克隆试剂盒说明书与经NcoI酶切线性化的pMT-39载体进行重组连接。重组载体转化大肠杆菌T1感受态细胞,挑取阳性克隆菌株扩大培养后抽提质粒,提取的pMT39-CtSDR3质粒用冷冻法转至农杆菌GV3101中。LBK+Rif平板筛选阳性克隆后,取1ml OD600 = 0.8的菌液经6 000 r/min,离心3 min后用1 ml 5%蔗糖溶液重悬,加入Silwet-L 1μl,用注射器注射于红花花柱,套袋避光[35]。
在pMT-39的35 s启动子区域设计5'端特异性引物,在目的基因CtSDR3中设计3'端引物。取T2代新鲜叶cDNA第一链作为模板,2× Easy Taq PCR Mix(北京全式金,中国)推荐体系进行PCR反应,确定是否存在目的条带。采集CtSDR3阳性植株花冠以及pMT-39空载体对照植株的花冠,按照上述的qRT-PCR反应体系评价CtSDR3基因的过表达水平,使用UPLC-Q-TOF/MS 检测CtSDR3过表达组和空载体对照组的黄酮代谢物含量,选择以HSYA为代表性成分的8个黄酮类化合物作为检测对象。
1.7 原核表达载体构建及蛋白表达
根据CtSDR3的开放阅读框及蛋白表达载体pGEX-6p-1以及pET-28a序列信息,设计同源重组克隆引物[34]。以红花花冠cDNA为模板,使用高保真酶进行PCR反应。PCR产物经胶回收后依无缝克隆试剂盒说明书与经XhoI、BamHI酶切线性化的载体pGEX-6p-1以及pET-28a进行重组连接。重组载体转化大肠杆菌T1感受态细胞,挑取阳性菌株克隆扩大培养后抽提质粒,提取的重组质粒用热激法转至大肠杆菌Rosseta(DE3)(上海唯地生物,中国)中。
在20 ml LBA液体培养基中培养至OD600为0.6左右,分2份10 ml菌液各加入终浓度为0.3 mmol/L的IPTG和生理盐水。恒温培养箱中16 ℃,100 r/min继续培养16 h[35-36]。菌液离心弃上清液,用1×PBS缓冲液洗涤两次后重悬。超声破碎仪中40 kW,工作时间5 s,循环间隔时间25 s,共15个循环进行破碎[16],裂解完成后取上清与沉淀15 μl,上样检测。
2. 结果
2.1 基因筛选
通过分析,得到contig325、contig483、contig2863共3个与HSYA具有强相关性的基因(r>0.85),见图1。
2.2 全长克隆和生物信息学分析
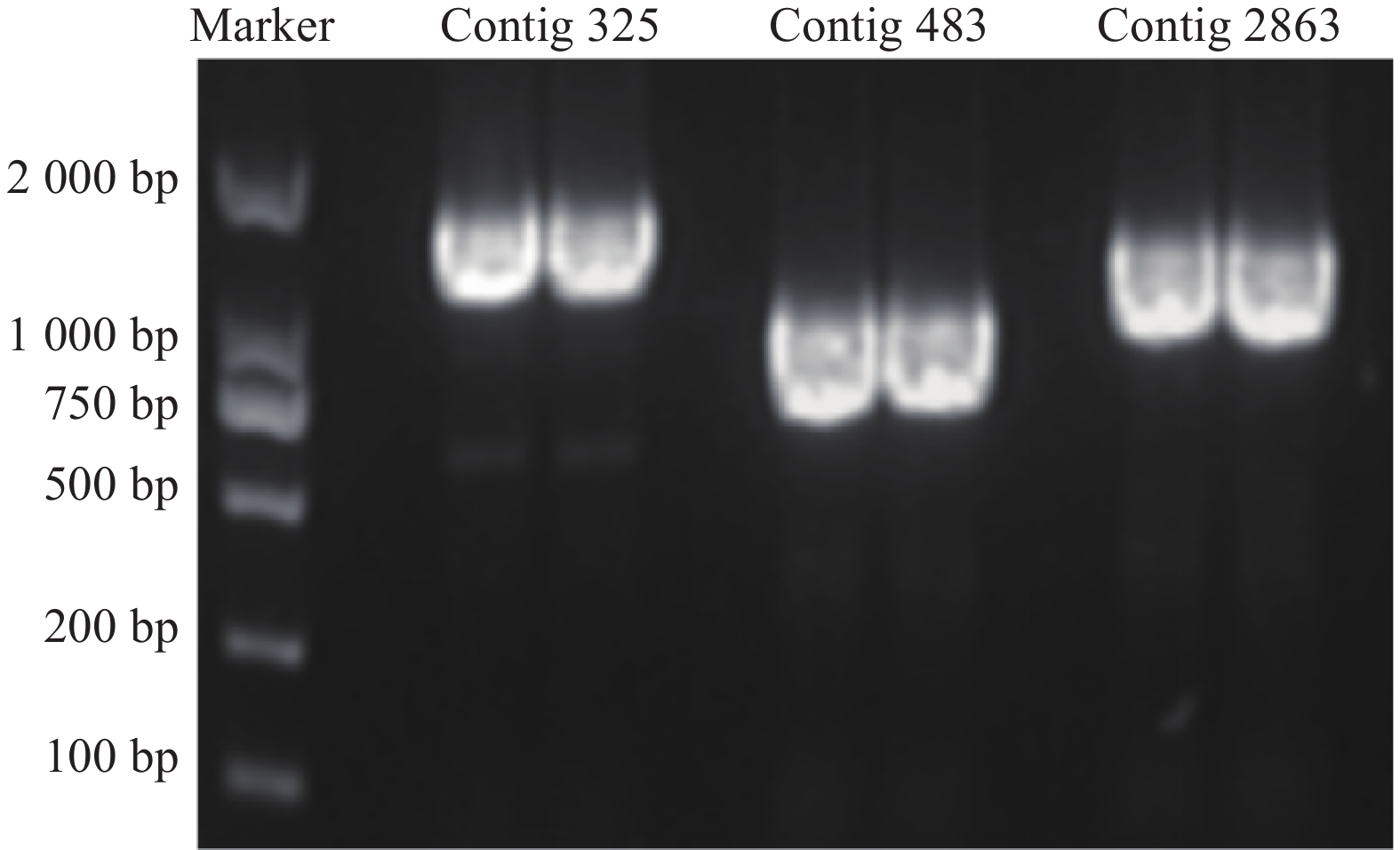
3个目的基因序列信息经测序验证结果如下:contig325全长共1523 bp,开放阅读框1341bp,编码446个氨基酸;contig483全长1393 bp,开放阅读框792 bp,编码263个氨基酸;contig2863全长序列1527 bp,开放阅读框1023 bp,编码340个氨基酸。PCR产物电泳结果如图2所示。
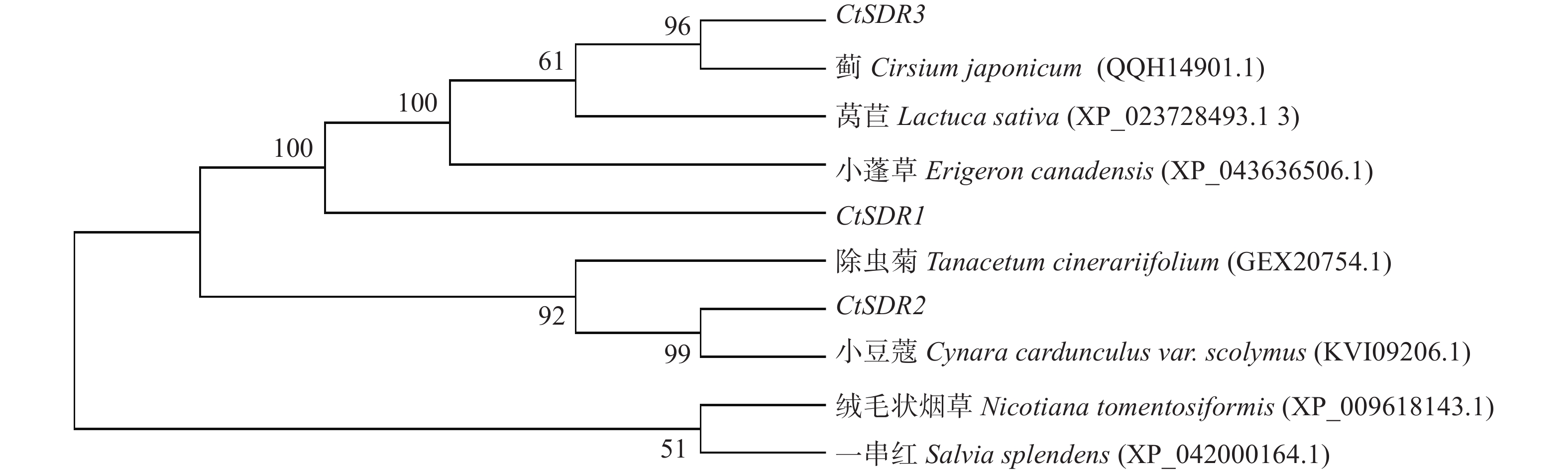
contig325基因编码446个氨基酸,命名为CtSDR1(GenBank登录号:MW792035);Contig483基因编码263个氨基酸,命名为CtSDR2(GenBank登录号:MW792036);Contig2863基因编码339个氨基酸,命名为CtSDR3(GenBank登录号:MW792037)。系统进化树表明CtSDR1与蓟Cirsium japonicum (QQH14901.1)同源性最高;CtSDR2与小蓬草Erigeron canadensis (XP_043636506.1)同源性最高;CtSDR3与小豆蔻Cynara cardunculus var. scolymus (KVI09206.1)同源性最高。Prot-param分析CtSDR1基因所编码的蛋白质分子式C2230H3346N606O639S7,相对分子量为49.2×103,理论等电点pI=9.61;CtSDR2基因所编码的蛋白质分子式C1289H2072N360O379S13,相对分子量为29×103,理论等电点pI=8.63;CtSDR1基因所编码的蛋白质分子式C1691H2614N442O481S9,相对分子量为37.1×103,理论等电点pI=6.80。Prot Scale分析预测CtSDR1、CtSDR2和CtSDR3蛋白为亲水性蛋白,无信号肽属非分泌蛋白。蛋白跨膜性分析显示CtSDR1、CtSDR2和CtSDR3不含有跨膜区域,为非跨膜蛋白。对CtSDR1、CtSDR2和CtSDR3蛋白二级结构的预测显示均属于不规则结构。对CtSDR1、CtSDR2、CtSDR3蛋白质三维结构预测如图3所示。系统进化树如图4所示。亚细胞定位预测显示,CtSDR1、CtSDR2、CtSDR3均可能定位于细胞质。
2.3 目的基因表达模式分析
取红花花期的Ⅳ期的红花各个部位进行分析,发现红花花冠内的CtSDR1、CtSDR2、CtSDR3基因表达量从高到低依次均为花冠>叶>茎>根。其中CtSDR1在花冠中的相对表达量约为根中的3倍、而CtSDR2、CtSDR3在花冠中的相对表达量约为根中的4倍。将4个花期的红花花冠进行qRT-PCR分析表明,CtSDR1、CtSDR2、CtSDR3花冠中表达量均随着花冠发育逐渐升高,特别是CtSDR1、CtSDR2、CtSDR3的Ⅳ期花冠对比Ⅲ期花冠的表达量分别提高了7.2倍、2.7倍、2.3倍(图5)。
2.4 CtSDR3植物表达载体构建及红花体内功能初步验证
构建真和表达载体并通过PCR鉴定后,我们从19株农杆菌浸染的子代植株中得到5株pMT39-CtSDR3阳性红花植株(图6)。通过qPCR对其CtSDR3基因转录水平进行测定,结果发现阳性红花植株中CtSDR3基因的转录水平得到显著增加,约为空白组株系的2~3倍,CtSDR3的在花冠部位的高表达也证明了研究成功获取CtSDR3过表达红花植株(图7)。通过UPLC-QTOF/MS技术测定阳性转基因红花株系组和空白对照组的目标化合物含量,包括7个红花花冠主要黄酮类化合物及苯丙烷类代谢途径上游关键物质苯丙氨酸(图8),分别为:野黄芩素(scutellarein)、Carthamin、HSYA、山柰酚(kaempferol)、山柰酚-3-O-β-D-葡萄糖苷(kaempferol-3-O-β-D-glucoside)、山柰酚-3-O-β-D-芸香糖苷(kaempferol-3-O-β-rutinoside)、芦丁(rutin)和苯丙氨酸(D-Phenylalanine)。由图8可知,与空白组相比,CtSDR3过表达株系相较于空白组野黄芩素提高了3.6%~9.8%,HSYA提高了7.1%~16.6%,以及苯丙氨酸含量提高了5.5%~15.7%,具有显著性升高。其他化合物含量则有无显著性变化趋势。通过对过表达株系与空白组的含量分析,我们认为CtSDR3基因过表达会引起红花中黄酮类物质的变化,尤其是HSYA含量升高显著。同时,苯丙氨酸代谢途径属于植物重要的次生代谢途径,过表达组引起苯丙氨酸含量的显著上升,上述指标性成分的变化也进一步说明CtSDR3对红花黄酮类化合物次生代谢途径具有一定的影响,但目前我们尚难以判断CtSDR3红花中影响次生代谢产物积累的明确途径。
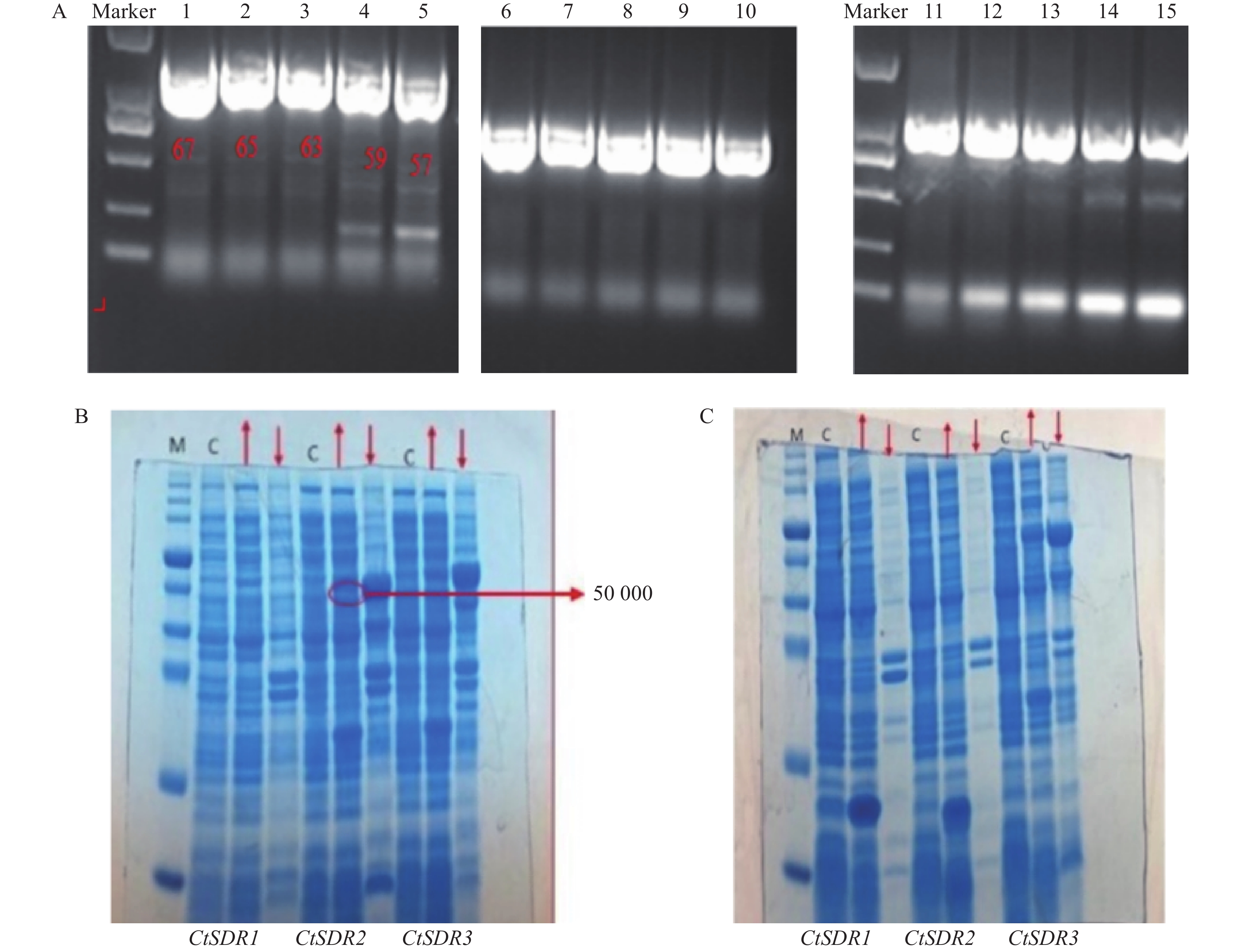
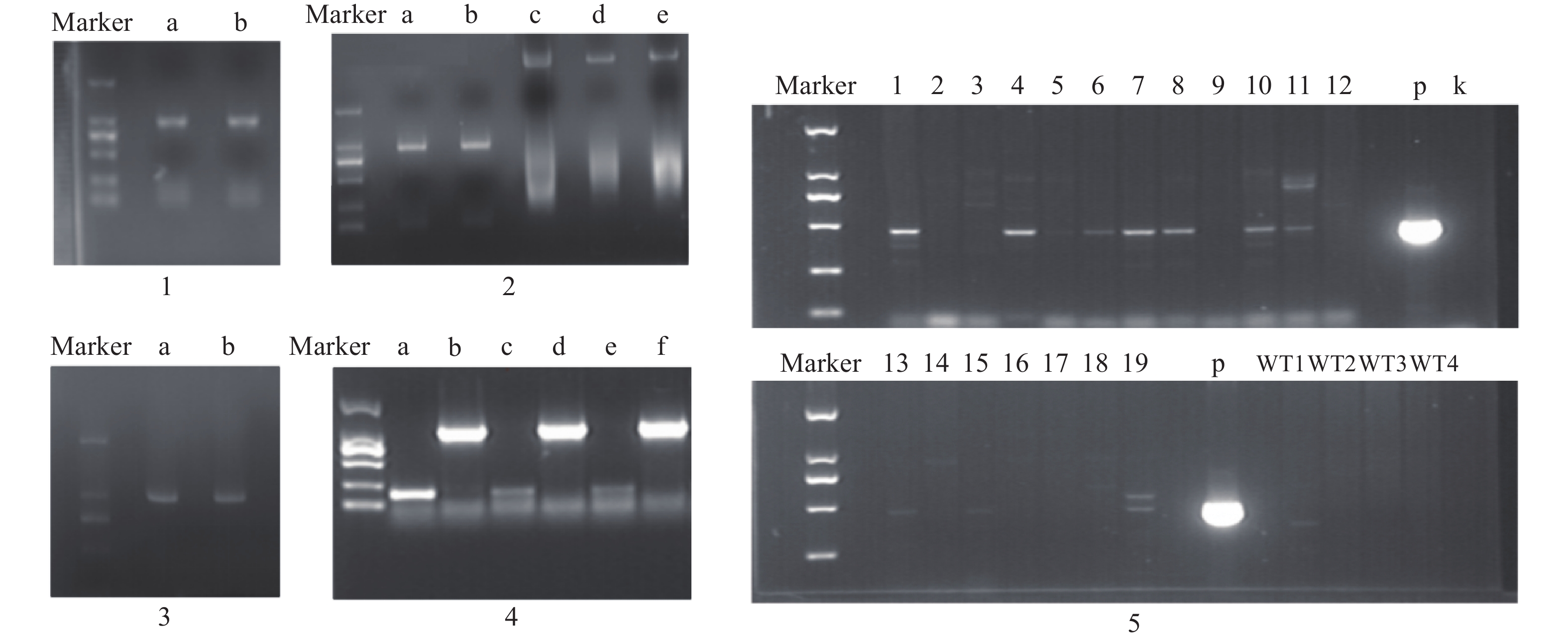 图 6 真核表达载体构建及阳性鉴定电泳图注:1. CtSDR3基因开放阅读框(ORF)区扩增产物电泳图,a、b泳道均为CtSDR3基因ORF区克隆PCR产物;2. 真核表达载体pMT-39载体酶切产物电泳图,a、b泳道为CtSDR3 PCR产物,c泳道为pMT-39载体,d、e泳道为pMT-39线性化载体;3. pMT39-CtSDR3重组载体阳性转化子鉴定电泳图,a、b泳道为阳性转化子菌液PCR产物;4. pMT39-CtSDR3质粒转化农杆菌GV3101,a、c和e泳道为空白对照组,b、d和f泳道为阳性克隆菌液PCR产物;5. 红花pMT39-CtSDR3阳性转化植株鉴定PCR产物电泳图,1~19为待鉴定植株,p为pMT39-CtSDR3质粒,k为空白组,WT为野生型红花植株
图 6 真核表达载体构建及阳性鉴定电泳图注:1. CtSDR3基因开放阅读框(ORF)区扩增产物电泳图,a、b泳道均为CtSDR3基因ORF区克隆PCR产物;2. 真核表达载体pMT-39载体酶切产物电泳图,a、b泳道为CtSDR3 PCR产物,c泳道为pMT-39载体,d、e泳道为pMT-39线性化载体;3. pMT39-CtSDR3重组载体阳性转化子鉴定电泳图,a、b泳道为阳性转化子菌液PCR产物;4. pMT39-CtSDR3质粒转化农杆菌GV3101,a、c和e泳道为空白对照组,b、d和f泳道为阳性克隆菌液PCR产物;5. 红花pMT39-CtSDR3阳性转化植株鉴定PCR产物电泳图,1~19为待鉴定植株,p为pMT39-CtSDR3质粒,k为空白组,WT为野生型红花植株2.5 原核表达载体构建及蛋白表达
目的片段成功扩增,将目的条带进行胶回收、纯化。CtSDR1、CtSDR1、CtSDR1构建的pGEX-6p-1、pET-28a原核表达载体均有在大肠杆菌内表达,但是CtSDR1-pGEX-6p-1、 CtSDR2-pGEX-6p-1、CtSDR3-pGEX-6p-1、CtSDR1-pET-28、CtSDR2-pET-28a、CtSDR3-pET-28a表达的目的蛋白均形成包涵体,存在于沉淀中。无法进行下一步大量纯化实验,唯有CtSDR2-pGEX-6p-1诱导表达了存在于上清液的目的蛋白,明显可以在上清液中观察到分子量约为50 000的蛋白条带(图9)。
3. 讨论
越来越多的红花药理学相关研究表明,红花的主要药效物质包括查尔酮类、黄酮醇类等多种黄酮类化合物,其中,查尔酮类HSYA对脑缺血具有保护作用,并且还能抗脑血栓形成以及抗氧化等。研究HSYA的生物合成分途径,对于HSYA的工业化生产具有重要意义。
本研究借助生物学分子技术、结合代谢组分析测定,筛选出3个参与HSYA生物合成途径的关键短链脱氢还原酶基因CtSDR1、CtSDR2和CtSDR3,这3个基因序列具有高度保守性,在不同器官的表达模式均呈现出花冠>叶>茎>根的特点,而且在花冠中的表达量随花冠发育逐渐升高,表明其很有可能参与红花中HSYA等主要药用成分的积累。进一步研究发现,转CtSDR3过表达T2代阳性植株花冠中CtSDR3基因的转录水平增加了2~3倍,次生代谢物HSYA的含量提高了7.1%~16.6%(P<0.05),验证了我们对CtSDR3在红花体内参与黄酮类化合物生物合成功能的推测。本研究中,体外表达CtSDR3蛋白,得到目的蛋白条带,但由于包涵体等原因,蛋白表达和纯化条件仍需要进一步摸索。下一步,我们将对可能起黄酮类生物合成途径的关键SDRs进行深入的生物学特性特别是酶结合位点的研究,为更好地阐释SDRs的生物学功能、利用分子生物育种技术培育高HSYA含量的红花新品种奠定基础。
-
表 1 寒湿郁肺汤中11个主成分及内标的质谱检测参数
测定成分 母离子
(m/z)子离子
(m/z)裂解电压
(V)碰撞能量
(V)ESI
模式香草酸 167.1 152.3 70 10 − 厚朴酚 265.1 247 148 29 − 和厚朴酚 265.2 223.4 135 29 − 汉黄芩素 283.1 268.1 105 13 − 刺槐素 284.9 241.9 140 34 − 6-姜酚 293.2 293.2 130 0 − 桔皮素 373.1 343.2 135 28 + 羌活醇 377.3 377.3 130 0 + 川陈皮素 403.3 373.3 130 26 + 紫花前胡苷 409.2 247.2 95 11 + 利血平(IS) 609.2 195 240 35 − 橙皮苷 609.2 300.9 135 15 − 表 2 寒湿郁肺汤中11种成分的线性考察
测定成分 回归方程 r 线性范围(μg/ml) 香草酸 Y=9.023C-1.345 0.99 0.02~2.00 厚朴酚 Y=0.023C+0.002 0.99 0.02~2.00 和厚朴酚 Y=0.028C-0.060 0.98 0.02~2.00 汉黄芩素 Y=0.701C+1.802 0.98 0.02~2.00 刺槐素 Y=0.488C+0.205 0.99 0.02~2.00 6-姜酚 Y=0.003C+1.510 0.99 0.20~20.00 桔皮素 Y=4.291C+70.573 0.99 0.02~2.00 羌活醇 Y=0.173C+3.849 0.98 0.02~2.00 川陈皮素 Y=0.576C+277.012 0.99 0.20~20.00 紫花前胡苷 Y=0.362C-0.081 0.99 0.02~2.00 橙皮苷 Y=0.011C+0.061 0.99 0.20~20.00 -
[1] LUO H, TANG Q L, SHANG Y X, et al. Can Chinese medicine be used for prevention of Corona virus disease 2019 (COVID-19)? A review of historical classics, research evidence and current prevention programs[J]. Chin J Integr Med,2020,26(4):243-250. doi: 10.1007/s11655-020-3192-6 [2] LI Y X, LIU X B, GUO L X, et al. Traditional Chinese herbal medicine for treating novel coronavirus (COVID-19) pneumonia: protocol for a systematic review and meta-analysis[J]. Syst Rev,2020,9(1):75. doi: 10.1186/s13643-020-01343-4 [3] ZHU F C, LI Y H, GUAN X H, et al. Safety, tolerability, and immunogenicity of a recombinant adenovirus type-5 vectored COVID-19 vaccine: a dose-escalation, open-label, non-randomised, first-in-human trial[J]. Lancet,2020,395(10240):1845-1854. doi: 10.1016/S0140-6736(20)31208-3 [4] 国家卫生健康委员会. 新型冠状病毒肺炎诊疗方案(试行第七版)[EB/OL]. [2020-12-01]. http://www.gov.cn/zhengce/zhengceku/2020-03/04/content_5486705.htm [5] REN J L, ZHANG A H, WANG X J. Traditional Chinese medicine for COVID-19 treatment[J]. Pharmacol Res,2020,155:104743. doi: 10.1016/j.phrs.2020.104743 [6] YANG Y, ISLAM M S, WANG J, et al. Traditional Chinese medicine in the treatment of patients infected with 2019-new coronavirus (SARS-CoV-2): a review and perspective[J]. Int J Biol Sci,2020,16(10):1708-1717. doi: 10.7150/ijbs.45538 [7] 中华医学会检验医学分会, 卫生计生委临床检验中心. 液相色谱-质谱临床应用建议[J]. 中华检验医学杂志, 2017, 40(10):770-779. 期刊类型引用(6)
1. 文艺,蒙露露,王宝艺,韦飞雪,邓鹏,柳荣英. 高效液相色谱法同时测定纯阳正气胶囊中3种成分的含量. 药学实践与服务. 2024(02): 78-81 .  本站查看
本站查看2. 赫云霞,夏亚穆. 高效液相色谱法测定兽用复方酮康唑乳膏中酮康唑的含量. 当代畜牧. 2024(01): 51-54 .  百度学术
百度学术3. 杨旭,张蕊. 反向高效液相色谱法同时测定复方氨酚烷胺片中三种主要组分的含量. 中国当代医药. 2023(03): 61-64 .  百度学术
百度学术4. 刘彬果,王晓丽,叶盛英. 氯新酮乳膏质量标准的研究. 药学实践与服务. 2023(08): 496-500 .  本站查看
本站查看5. 刘晓丹,郭伟娜,陆瑶,刘琦,孙宇,杨冬梅. 复方酮康唑软膏中甲硝唑和酮康唑含量测定方法研究进展. 兽医导刊. 2023(02): 43-45 .  百度学术
百度学术6. 尹伶灵,杨志昆,周晶,商菲,张含侠,章安源,门晓冬,李有志,田成国,陈玲. 高效液相色谱法同时测定兽药复方酮康唑软膏中的酮康唑和甲硝唑的含量. 中国兽药杂志. 2022(09): 47-51 .  百度学术
百度学术其他类型引用(0)
-





 下载:
下载:




 下载:
下载: