-
针对海训需求,本课题组研制出一款能同时满足防晒和防水母蛰伤需求的防水型多效防护乳,对于增强海军部队日常海训强度和提高海军战斗力具有重要作用和意义。经文献和相关专利调查,以及初步药效学评价[1-5],本课题确定以LaCl3·7H2O (500 mmol/L)、MgCl2·6H2O(25 mmol/L)、CaCl2(25 mmol/L)的水溶液作为防水母蛰伤成分加入到基质处方中。镧是一种重要的稀土元素,广泛应用与电子、医药、生物医学等领域,有文献报道[6-9],镧离子暴露可能会导致人的健康问题,对阈值效应而言,需要进行未观察到有害作用剂量(NOAEL)的测定。防护乳长期、大量涂抹,而且很可能接触破损的皮肤,镧离子(La3+)可能通过经皮吸收进入人体体循环,而其在体内的毒性或潜在毒性均未明确。此外,迄今为止,未见含镧乳膏的透皮安全性的报道,所以必须对防护霜中添加的镧离子进行安全性验证。
电感耦合等离子体发射光谱技术具有分析速度快、线性范围宽、可多元素同时测定、检出限低等特性,已被广泛地应用于各类物质中无机元素的分析检测[10]。本文以镧元素为检测对象,结合微波消解与电感耦合等离子体发射光谱(ICP-OES)技术,建立一种体内含量分析方法,可为多效防护乳的质量分析和透皮安全性评价提供基础数据。
-
Thermo Scientific iCAP6000系列电感耦合等离子体光谱仪,包括RF发生器、光谱仪系统和光电转换检测器、iTEVA工作站(美国赛默飞世尔公司);MDS-6G多通量微波消解/萃取系统(上海新仪微波化学科技有限公司);AL-104电子天平(瑞士梅特勒公司);VORTEX-6涡旋振荡器(海门市其林贝尔仪器有限公司);Barnstead D3750超级纯水仪(美国赛默飞世尔公司)。
-
硝酸(优级纯,批号:20190920)购自国药集团化学试剂有限公司;La元素标准溶液(浓度1000 μg/ml)购自国家有色金属及电子材料分析测试中心;水为超纯去离子水(≥18.2Ω);多效防护乳(批号:82004163)为中试放大样品。
-
SD大鼠,均为雄性,体重约250 g,昭衍(苏州)新药研究中心有限公司提供,许可证号(苏)2018-0006。
-
给药前,尽可能剃掉大鼠背部及两侧体毛,约5 cm×10 cm,休息观察24 h。实验前禁食12 h,自由饮水。实验前,将大鼠编号,用丙酮轻轻擦去皮脂。然后以0.4 g/cm2的剂量分别将防护乳均匀涂布在大鼠裸露皮肤表面。分别于给药前和给药后1 h在眼眶静脉丛取血1ml,置于肝素化的离心管中,于−20 ℃条件下保存。
-
iCAP6000系列电感耦合等离子体光谱仪最佳化后工作条件为:射频功率1150 W;采样深度5 mm;冷却气流量12 L/min;辅助气流量0.5 L/min;泵转速45 r/min。样品冲洗时间30 s;样品测定次数3次。微波消解仪参数和检测程序如表1所示。
表 1 全血样品微波消解程序
步骤 温度(T/℃) 保持时间(t/min) 功率(P/W) 1 120 6 800 2 150 5 800 3 180 15 800 -
准确吸取血样1 ml,置于聚四氟乙烯烧杯中,加入硝酸8 ml,混匀,在电热板上于120 ℃加热预消解20 min,血样可完全溶解为黄色的消解液;然后,按照表1程序将样品置于微波消解仪中完全消解。取出样品置于160 ℃的电热板上加热赶去硝酸,消解液呈无色透明或略带黄色,直到四氟乙烯杯剩余溶液小于1 ml时,将消解液转移至10 ml量瓶中,用2%硝酸溶液洗涤容器,洗液合并于量瓶中,用2%硝酸溶液稀释至刻度,摇匀,得到供试品溶液。未经给药处理的血样经过上述消解程序得到的溶液即为空白基质溶液。
-
精密量取La元素标准溶液1 ml,置10 ml量瓶中,用2%硝酸溶液稀释至刻度,得到浓度为100 μg/ml的储备液(A)。精密量取储备液0.05、0.1、0.25、0.5、1、2.5 ml,分别置50 ml量瓶中,用2%硝酸溶液稀释至刻度,摇匀,得到浓度分别为0.1、0.2、0.5、1、2、5 μg/ml的一系列对照品溶液。
-
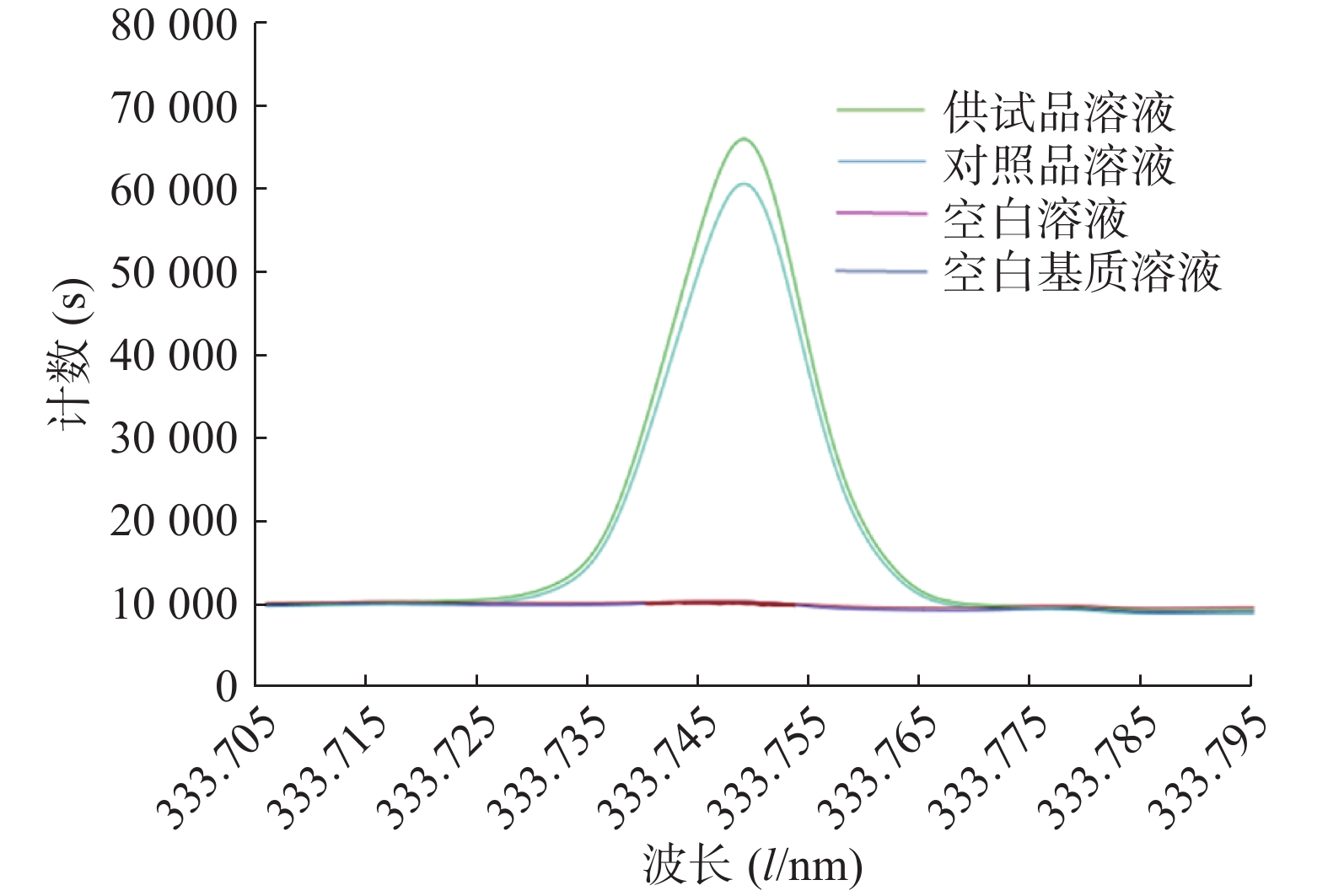
将空白溶液(2%硝酸溶液)、空白基质溶液、对照品溶液和供试品溶液依次注入等离子体光谱仪,检测并记录结果,其图谱如图1所示,结果表明La在333.749 nm处谱线干扰较少,对照品溶液和供试品溶液的峰形较好,空白溶液和空白基质溶液在此谱线无响应,方法的专属性较好。
-
将“2.4”项下制备的对照品溶液依次注入ICP-OES,检测并记录结果。结果表明,在0.1~5 μg/ml浓度范围内,仪器响应值与浓度呈良好线性关系,La的线性方程为Y=33730X-774.4,r=0.9998。
将2%硝酸溶液注入ICP-OES进行测试,连续进样11次,以空白溶液响应值标准偏差的3.3倍计算检出限,以空白溶液响应值标准偏差的10倍计算定量限。方法检出限为0.0025 μg/ml,定量限为0.0077 μg/ml。
-
精密量取空白血样9份于烧杯中,各1 ml, 分别精密加储备液0.16、0.2、0.24 ml,低、中、高每个浓度平行配制3份。随后按照“2.3”项下样品的处理方法进行制备,即得空白加标溶液。将空白基质溶液和空白加标溶液分别注入仪器,进样分析,结果见表2。La的低、中、高浓度的回收率均在94.9%~102.0%之间,表明本法的回收率良好。
表 2 空白血样加标回收率试验结果
加入对照品含量(μg/ml) 空白基质响应值(μg/ml) 测得值(μg/ml) 回收率(%) RSD
(%)1.6 0.0131 1.5354 95.1 0.86 1.6 0.0131 1.5610 96.7 1.6 0.0131 1.5543 96.3 2 0.0131 2.0521 102.0 1.20 2 0.0131 2.0246 100.6 2 0.0131 2.0059 99.6 2.4 0.0131 2.2914 94.9 0.85 2.4 0.0131 2.3231 96.0 2.4 0.0131 2.3272 96.4 -
取同一批血样(给药后1 h取血样本)共6份,按照“2.3”项下方法制备供试品溶液,进样分析。结果La含量的RSD为1.01%,表明本法的重复性良好。
-
4组样品在1 h的取血时点所测得的La的浓度(μg/ml)如表3所示。
表 3 全血样品在给药后1 h测得的镧浓度(μg/ml,n=4)
编号 含量(μg/ml) RSD(%) 1 1.770±0.016 0.94 2 2.092±0.012 0.57 3 1.968±0.008 0.44 4 1.885±0.012 0.67 -
La不是人体必需元素,已有研究表明[7, 9, 11]镧具有潜在的毒性,包括神经行为和认知行为功能障碍,可致肝功能下降,对骨、肾、脾脏、免疫系统均具有负面影响。镧可从农产品通过胃肠道进入人体,但是经皮吸收进入人体体循环的情况尚未可知,未见有La的经皮安全性评价的报道。本次试验建立了La元素的生物样本体内分析方法,为单次涂抹含镧防护乳后24 h的透皮安全性研究提供了新的方法和思路。
-
全血中无机元素的分析常通过两种途径:一是以TritonX-100水溶液或去离子水直接稀释进样测定;二是通过传统的干灰化法、湿法消解或微波消解法将血样完全消解后进样测定[12]。由于全血中含有大量蛋白质等物质,直接稀释干扰较多,与湿法、干法消解法相比,微波消解具有加热快、消解完全、消耗试剂少、节能环保等优点[13],故本研究选择微波消解法对全血样品进行处理。常用的消解溶剂有HNO3、HF、H2O2、HClO4等[14],本实验采用HNO3,即可将血液样品消解为近无色的澄清液体(消解完全),避免了H2O2、HClO4等易爆溶剂的使用。
-
本文通过微波消解-ICP-OES法,建立了生物样本中La的测定方法,该方法操作简单,分析速度快,灵敏度高,准确度好,为多效防护乳中La的含量测定和安全性评价提供依据。
Determination of lanthanum in whole blood by microwave digestion-inductively coupled plasma optical emission spectrometry
-
摘要:
目的 评估多效防护乳中镧(La)的透皮安全性,建立微波消解-电感耦合等离子体发射光谱(ICP-OES)法测定大鼠全血中镧的分析方法。 方法 全血样品经微波消解后,采用电感耦合等离子发射光谱仪分析,以333.749 nm为分析谱线,对大鼠全血中的La进行含量测定。 结果 该方法的标准曲线相关性良好(r>0.9994),方法检出限为0.0025 μg/ml,定量限为0.0077 μg/ml,精密度<3%,回收率在94.9%~102.0%之间。 结论 基于微波消解的ICP-OES方法稳定可靠,可为镧元素的含量测定和给药安全性研究提供重要依据。 -
关键词:
- 镧 /
- 微波消解 /
- 多效防护乳 /
- 电感等离子体原子发射光谱 /
- 透皮
Abstract:Objective To evaluate the transdermal safety of lanthanum (La) in sunscreen and jellyfish sting protective lotion, establish a microwave digestion-inductively coupled plasma opticalemission spectroscopy (ICP-OES) method for determination of lanthanum (La) in rat’s whole blood. Methods The whole blood samples were digested by microwave and analyzed by inductively coupled plasma emission spectrometer (ICP-OES). Using 333.749 nm as the analysis line, the content of La in rat whole blood was determined. Results The correlation linearity of the standard curve of this method was good (r>0.9994), the detection limit of the method was 0.0025 μg/ml, the limit of quantification was 0.0077 μg/ml, the precision was less than 3%, and the recovery rate was between 94.9% and 102.0%. Conclusion The ICP-OES method based on microwave digestion is stable and reliable, and can provide an important basis for the study of the transdermal safety of lanthanum. -
在正常条件下,大部分肝细胞处于静止状态(G0期),通常很少进入有丝分裂期。一旦肝细胞受到手术切除和药物等应激的刺激,它们会迅速对促分裂原产生反应,过渡到有丝分裂期,并开始增殖[1-4]。肝细胞增殖不仅是肝脏自我修复和再生的基础,也是应对慢性肝炎、肝硬化以及药物性肝损伤(DILI)等多种损害的重要机制。研究表明,肝脏出现病理性损伤后产生多种肝细胞因子,例如纤维蛋白原样蛋白(FGL1)、Hepassocin、肝细胞生长因子(HGF)等,在促进肝细胞增殖方面发挥重要作用[5-8]。例如,FGL1通过激活细胞增殖相关的信号通路促进肝细胞的再生,从而加速肝脏的修复[9]。此外,Hepassocin通过自分泌机制促进肝细胞生长[6]。这些研究提供了肝脏疾病治疗的新思路,尤其是调控这些肝细胞因子来加速肝功能的恢复。
Orosomucoid-1(ORM1),也称为α-1-酸性糖蛋白1(AGP1),作为一个已知的肝细胞因子[10],是一种主要由肝脏合成分泌的急性期蛋白,在应激条件下(如组织损伤和炎症)显著升高,具有调控细胞外基质(ECM)、调节糖代谢、维持血管通透性等重要的生物学功能[10-12]。此外,ORM1在结肠腺癌细胞、肝细胞、免疫细胞等多种细胞上,表现出促进增殖的作用[13-15]。但ORM1调控肝细胞增殖的具体作用机制尚不完全明确,有待进一步研究。
为进一步探究ORM1在肝细胞增殖中的具体作用及机制,本研究首先在两种肝细胞系上验证了ORM1促进肝细胞增殖,并通过对ORM1敲除小鼠的肝脏组织测序,挖掘ORM1调控肝细胞增殖的可能机制。本研究旨在揭示ORM1促进肝细胞增殖的潜在功能和机制,为肝脏损伤修复及相关疾病的治疗提供新的分子靶点和理论依据。
1. 材料与方法
1.1 试剂
α1-酸性糖蛋白(美国 Sigma-Aldrich 公司)、CCK8试剂盒(Adamas life)、Lipofectamine 3000试剂(Thermo Fisher Scientific)。
1.2 实验细胞
小鼠肝癌细胞系Hepa1-6,购自中国科学院细胞库。培养液配方:DMEM、10%FBS、1%双抗生素。培养条件:5%CO2、37 ℃恒温孵育箱。人肝癌细胞系HepG2,购自武汉普诺赛生命科技有限公司。培养液配方:MEM(含NEAA)、10%FBS、1%双抗生素。培养条件:5%CO2、37 ℃恒温孵育箱。
1.3 CCK8
细胞接种于96孔板,密度约104/孔,每组复孔为9;ORM1过表达、干扰或人源ORM给药(10、50、100 μg/ml)处理相应时间后,弃去培养基,在细胞贴壁后,使用无血清培养基处理细胞,培养相应时间后,加入CCK8试剂,吸光度测定(Epoch BioTeK酶标检测仪)450 nm处的A值,根据不同组之间的A值计算组间差异。
1.4 细胞瞬时转染
通过LipofectamineTM
3000 将ORM1过表达质粒(序列见NM_008768.2)或siRNA转染进细胞内,以实现过表达或干扰目标基因的目的。当细胞密度达到50%~70%时,进行过表达质粒的瞬时转染实验;当细胞密度达到30%~50%时,进行siRNA的瞬时转染实验。吸取舍弃原培养基后用1×PBS轻柔洗涤细胞1~2次,根据转染条件配制好转染试剂,随后将配置好含有过表达质粒(或siRNA)的DMEM培养基加入至细胞培养基中用于细胞继续培养,最后置于细胞培养箱中孵育24 h(若为转染siRNA,则孵育48 h)即可完成细胞瞬时转染试验。siRNA序列及转染试剂配制方法见表1、表2。表 1 ORM1 siRNA序列siRNA名称 siRNA序列(5'→3') si-ORM1 CCACCAACUUGAUAAACGATT 表 2 96孔培养板转染条件培养皿 Opti-MEM (μl) Lipo3000 (μl) DNA转染 RNA转染 DNA (ng) P3000 (μl) RNA (pmol) 96孔板 2×10 0.3 100 0.2 20 1.5 RNA-seq及差异基因富集分析
使用ORM1基因敲除(KO)小鼠和对应的野生型(WT)小鼠(均为C57BL/6背景,n=6)。在小鼠24周龄时采集肝脏组织,液氮速冻并存储于−80°C。RNA-seq委托上海欧易生物公司进行,差异基因分析通过DESeq完成,筛选标准为FoldChange>1.5或<0.66,且P<0.05。
差异基因富集分析通过DAVID进行,进行Kyoto Encyclopedia of Genes and Genomes (KEGG)富集分析。KEGG分析用于揭示差异基因在代谢通路中的富集情况。富集分析筛选标准为P<0.05。
1.6 数据统计与分析
实验数据采用GraphPad Prism 9.0软件进行统计与分析。单因素两组之间相互比较,采用双尾非配对t检验(Student’t)检验分析;单因素多组之间相互比较,采用单向方差分析(One-way ANOVA)检验,组间均值两两比较采用Dunnett's multiple comparisons test。实验结果均采用“均数±标准误(Mean±SE)”表示。以P<0.05认为差异具有统计学意义。
2. 结果
2.1 ORM1在小鼠肝切除术后表达增加
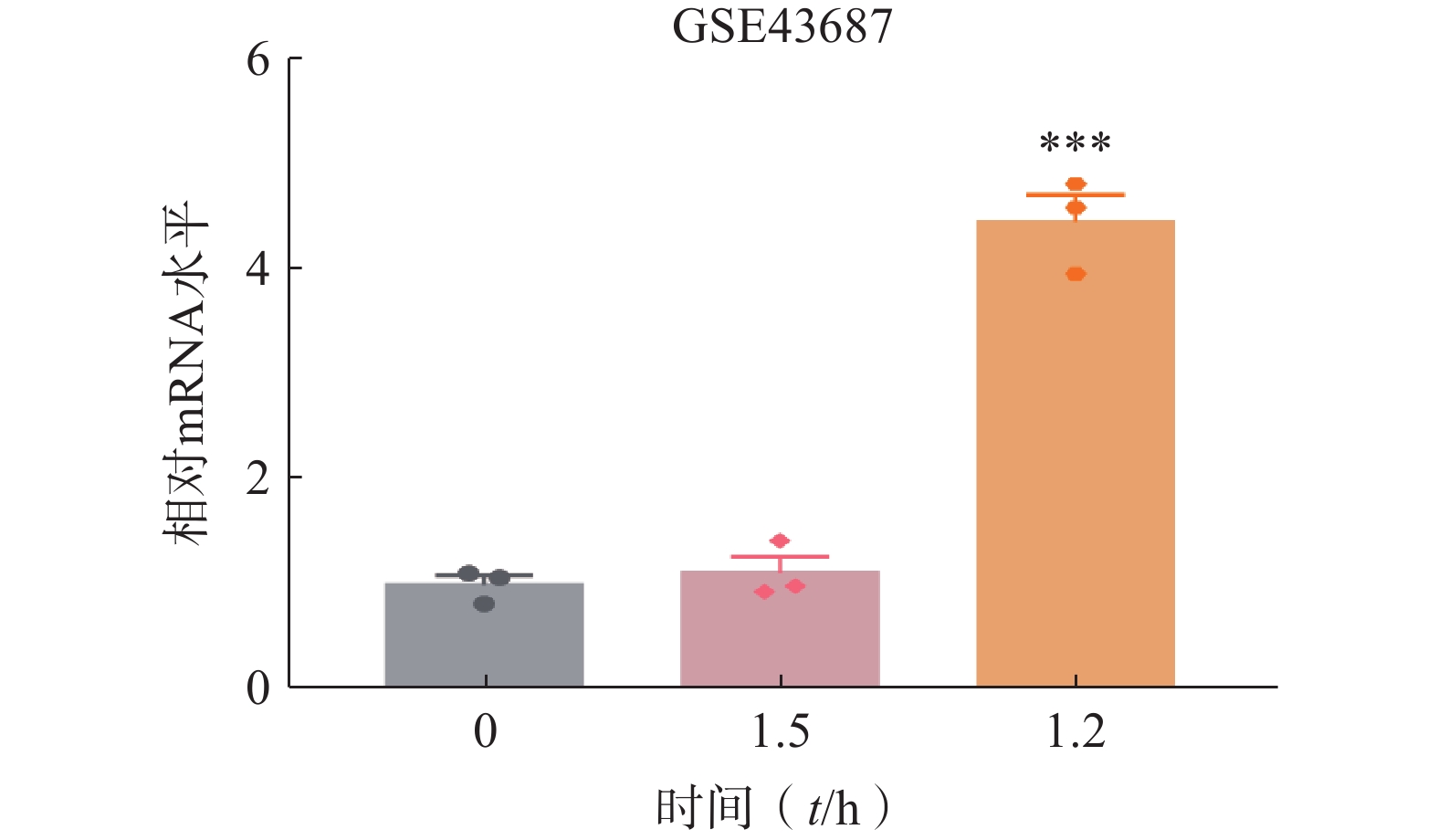
肝脏组织在肝切除术后会进入肝细胞快速增殖状态[16]。通过检索GEO数据库,选取C57BL/6小鼠在2/3肝脏部分切除术(PH)后数据(GSE43687)进行分析。结果显示,肝脏组织中ORM1的表达在PH后1.5 h时无显著变化,在PH后12 h显著上升(图1)。这一结果提示ORM1可能参与肝脏再生过程。
2.2 ORM1促进小鼠和人肝细胞增殖
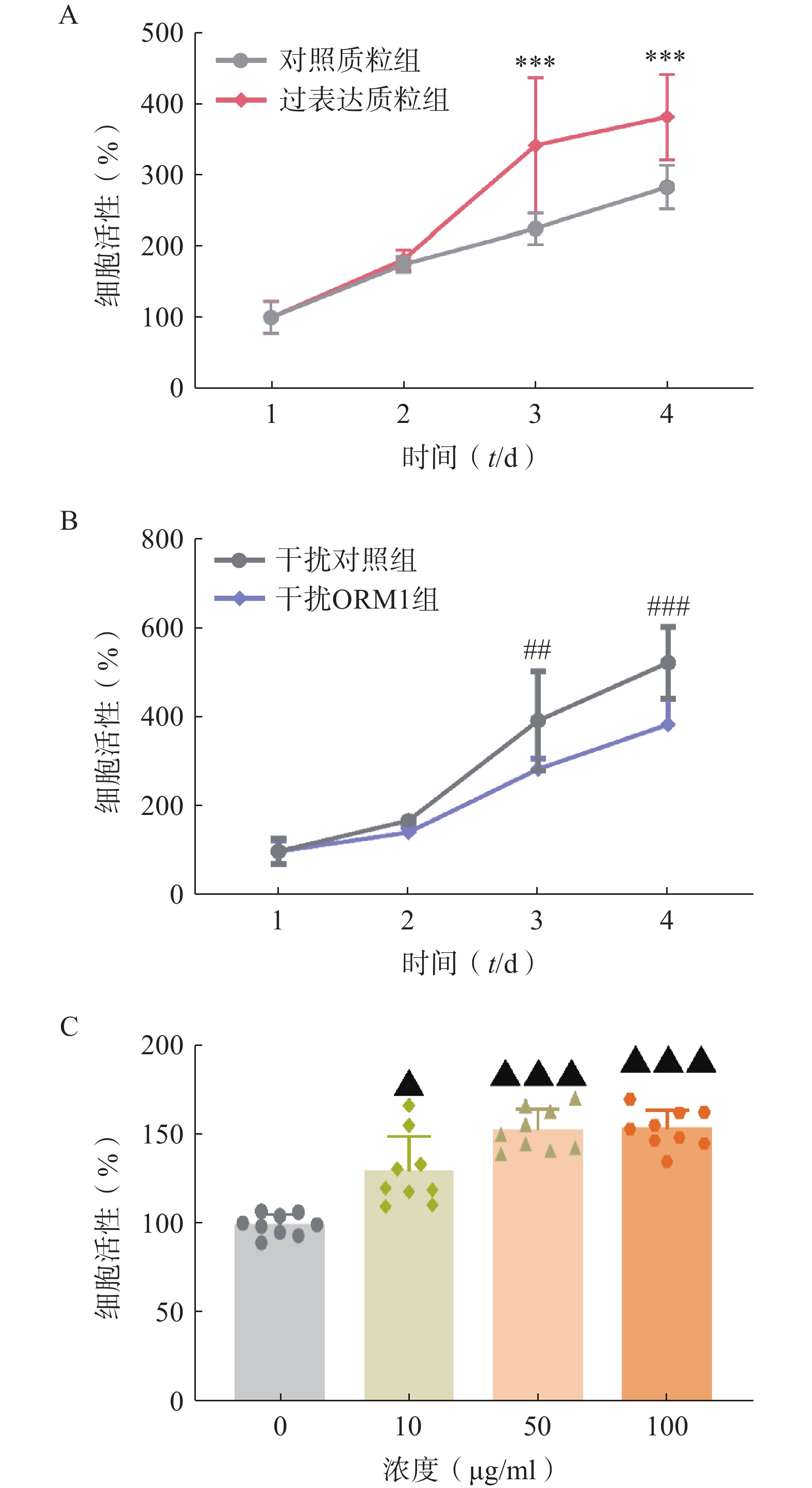
为验证ORM1对肝细胞增殖的影响,我们在小鼠和人的肝细胞系上进行了ORM1过表达、干扰或ORM外源性给药实验。在小鼠Hepa1-6肝癌细胞系过表达ORM1(pCMV-ORM1),与对照质粒组(pCMV)组相比,转染后第3、4天ORM1过表达质粒组的细胞增殖显著增加(图2A)。而干扰ORM1后细胞增殖能力呈现相反的结果(图2B)。人HepG2肝细胞上给予不同浓度外源性ORM,48 h后检测细胞增殖情况,可见随着ORM1浓度的增加,细胞增殖呈现显著上升(图2C)。上述结果表明ORM1对肝细胞增殖具有显著的促进作用。
2.3 ORM1基因敲除对肝脏细胞生物学功能及信号通路的影响
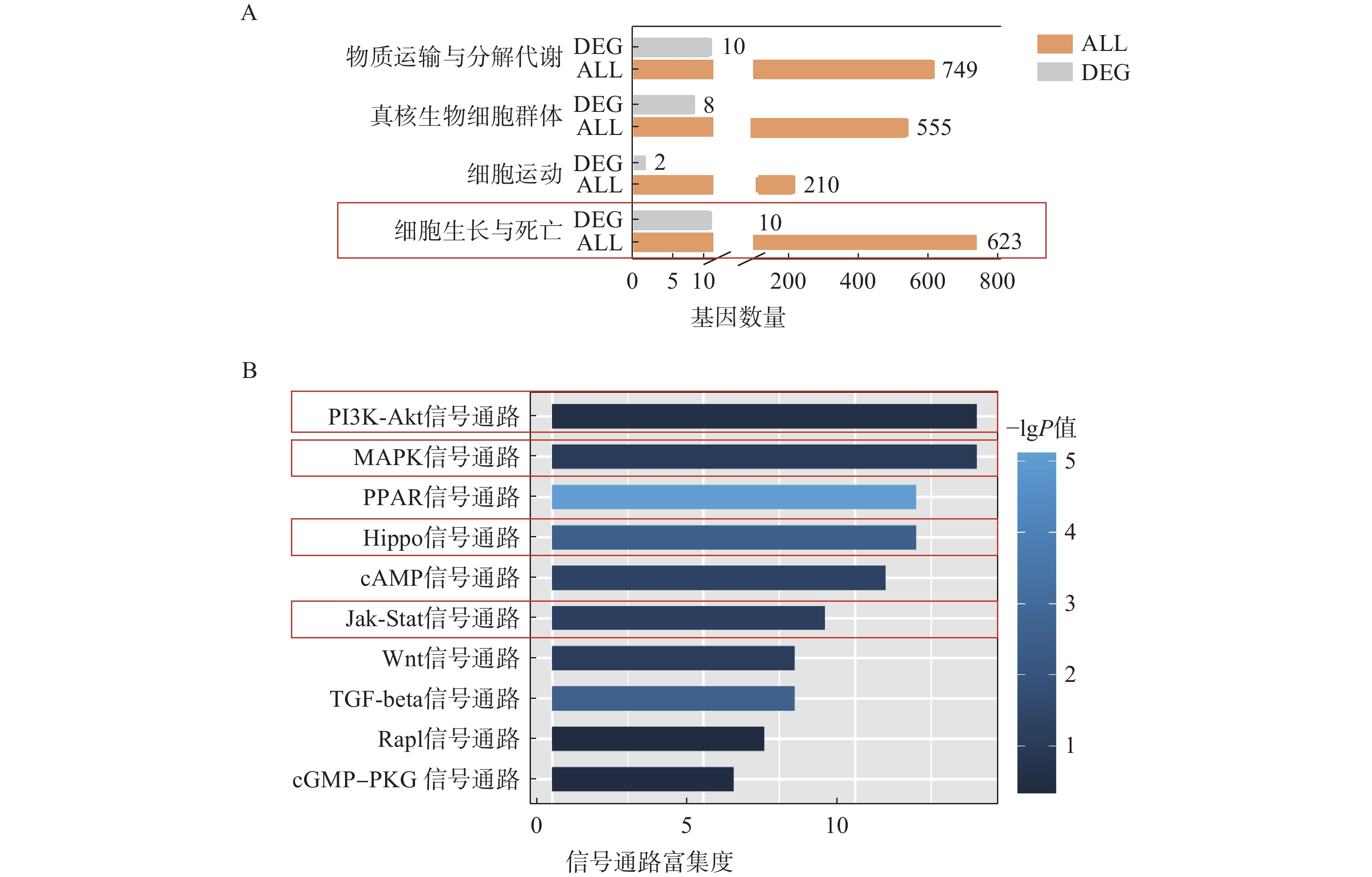
为了进一步探究ORM1基因敲除后对肝脏组织的影响,我们对ORM1基因敲除(KO)小鼠和野生型(WT)小鼠的肝脏组织进行了测序。KEGG富集分析表明,在ORM1基因敲除小鼠与野生型小鼠的比较中,差异表达基因被富集在“细胞生长与死亡”和“细胞运输与自噬”等通路中(图3A),提示ORM1缺失会引起细胞生长和死亡相关的通路相关改变。
进一步信号通路的富集分析显示,PI3K-Akt、MAPK、PPAR、Hippo、Jak-Stat等通路在差异基因表达分析中有显著富集(图3B),其中,PI3K-Akt、MAPK、Hippo、Jak-Stat通路据报道与细胞增殖高度相关[17-19]。这些结果提示,ORM1基因敲除可能影响细胞增殖关键通路,通过调控细胞生长、死亡相关的基因影响肝细胞增殖。
2.4 ORM1可能通过调控多条信号通路促进肝细胞增殖
为进一步明确ORM1在这些经典通路中的调控机制,我们重点分析了其中与细胞增殖相关的差异基因表达变化。在PI3K-Akt信号通路中,具有促增殖作用的Itgb8和Ntf3显著下调(图4A)。在MAPK信号通路中,同样具有促增殖作用的Map3k6在KO组中显著下调,而抑制细胞增殖作用的Gadd45a则显著上调,Hspa1b和Hspa2下调(图4B)。与之类似,Jak-Stat信号通路中的Il6ra和Lepr具有促增殖作用,其表达在KO组中也显著下调,而有抑制细胞增殖作用的Cish在KO组中的表达显著上调(图4C)。在Hippo信号通路中,具有促增殖作用的Tef7、Tead1、Ctgf在KO组中的表达显著下调(图4D)。这些结果表明,ORM1可能调控PI3K-Akt、MAPK、Jak-Stat和Hippo信号通路中的影响细胞增殖的多种关键信号分子影响肝细胞的增殖。
3. 讨论
本研究中,我们揭示了ORM1在肝细胞增殖中的潜在调控机制。首先,利用GEO数据库(GSE43687)分析,发现ORM1在小鼠2/3肝切除术后12h表达升高,提示ORM1可能参与肝脏再生。而在体外肝细胞系中,过表达ORM1或外源性给药ORM,可以促进肝细胞增殖;相反,干扰ORM1抑制的肝细胞的增殖,进一步验证了ORM1对肝细胞增殖的促进作用。此外,我们对ORM1基因敲除小鼠组学分析,发现PI3K-Akt、MAPK、Hippo、Jak-Stat等细胞增殖相关通路的多个信号分子在ORM1缺失时表现出显著变化,提示这些关键通路可能参与了ORM1对肝细胞增殖的调控。
在PI3K-AKT信号通路中,Ntf3(neurotrophin-3)主要通过与受体TrkC结合,促进细胞的存活、增殖和分化[20]。ORM1缺失后Ntf3的下调可能导致细胞存活和再生能力减弱。而Itgb8(整合素β8)和Lamc2(laminin subunit gamma-2)作用类似,均是通过与细胞外基质(ECM)蛋白(如纤连蛋白、胶原蛋白等)结合,介导细胞与其周围环境的相互作用,从而影响细胞的增殖和分化[21-22]。ORM1缺失后,Itgb8和Lamc2下调提示ECM重塑减弱,从而无法为新生肝细胞的重新附着与生长提供必要的微环境支持。
在MAPK信号通路中,Gadd45a(growth arrest and DNA damage-inducible alpha)是一种生长停滞和DNA损伤诱导因子,通过抑制细胞周期相关激酶(如CDK1和CDK2),阻止细胞从G1期或G2/M期进入下个阶段[23]。ORM1缺失后Gadd45a上调提示可能出现细胞周期停滞,从而抑制了肝细胞的增殖。Map3k6(mitogen-activated protein kinase 6)作为一种激酶,通过磷酸化MAPK激酶调控下游的信号分子和后续的细胞生物学反应,如细胞增殖、分化、存活、迁移和应激反应[24]。ORM1缺失后Map3k6下调可能导致MAPK通路激活减少。Hspa1b和Hspa2是热休克蛋白,在抑制凋亡通路主要通过抑制线粒体凋亡途径,caspase的活化以及调控JNK信号通路发挥作用;同时,Hspa1b和Hspa2通过清除活性氧(ROS)和稳定线粒体功能,发挥抗氧化应激损伤的作用,进而增加细胞存活。Hspa1b和Hspa2的下调提示ORM1缺失可能削弱细胞的抗氧化应激能力,从而影响肝细胞存活[26]。
此外,Jak-Stat3信号通路激活通过诱导与细胞增殖和抗凋亡相关的基因表达,如Cyclin D1和Bcl-2,从而促进细胞增殖、存活和组织修复[27]。而Cish(cytokine-inducible SH2-containing protein)是该通路一个重要的负反馈调节因子,通过抑制Jak-Stat信号的活化,调控细胞因子信号传导的强度和持续时间,发挥抑制细胞增殖和促进细胞凋亡的作用[28]。与之相反,Il6ra是IL-6受体的亚基,IL-6结合IL-6受体后激活Jak-Stat3信号通路,诱导与细胞存活、增殖和组织修复相关基因的表达[29]。此外,Lepr(leptin receptor)是瘦素(leptin)的主要受体,该受体激活后亦可激活下游Jak-Stat3信号通路[27]。特别是在肝脏中,Lepr信号能够促进肝细胞的再生和修复能力[30]。而ORM1敲除时,Cish上调,Il6ra、Lepr下调均表明JAK-STAT通路激活减少,从而导致细胞增殖减弱。
最后,在Hippo信号通路中,Tcf7在Hippo信号通路中扮演着重要的角色,其与细胞增殖的关系主要通过YAP/TAZ的激活来实现,并参与促进细胞增殖[31],Ctgf是一种与细胞外基质(ECM)相关的结合肝素的蛋白,能够直接与整合素结合。它由成纤维细胞合成,并能促进细胞的增殖和趋化[32],ORM1敲除导致Hippo通路中Tcf7和Ctgf表达下调,可能通过解除其对肝细胞增殖的抑制作用而促进细胞增殖。ORM1缺失还导致了该通路Tead1基因的下调,而Tead1作为YAP(yes-associated protein)和TAZ的下游效应器,与YAP/TAZ结合后在细胞核中调控靶基因Birc5、Cyr61、CTGF和Myc等的表达,进而促进细胞增殖、抑制细胞凋亡,并推动组织生长和再生[33]。
本研究阐释了ORM1可能通过调控PI3K-Akt、MAPK、Hippo、Jak-Stat等信号通路发挥促进肝细胞增殖的作用。提示ORM1可能通过影响肝细胞存活、ECM重塑等一系列复杂机制调节肝细胞增殖过程。未来研究应进一步探讨ORM1在这些信号通路中的具体调控机制,特别是在不同病理条件下如何影响肝细胞的增殖、凋亡以及组织修复,为肝脏疾病的治疗提供新的潜在靶点。
-
表 1 全血样品微波消解程序
步骤 温度(T/℃) 保持时间(t/min) 功率(P/W) 1 120 6 800 2 150 5 800 3 180 15 800 表 2 空白血样加标回收率试验结果
加入对照品含量(μg/ml) 空白基质响应值(μg/ml) 测得值(μg/ml) 回收率(%) RSD
(%)1.6 0.0131 1.5354 95.1 0.86 1.6 0.0131 1.5610 96.7 1.6 0.0131 1.5543 96.3 2 0.0131 2.0521 102.0 1.20 2 0.0131 2.0246 100.6 2 0.0131 2.0059 99.6 2.4 0.0131 2.2914 94.9 0.85 2.4 0.0131 2.3231 96.0 2.4 0.0131 2.3272 96.4 表 3 全血样品在给药后1 h测得的镧浓度(μg/ml,n=4)
编号 含量(μg/ml) RSD(%) 1 1.770±0.016 0.94 2 2.092±0.012 0.57 3 1.968±0.008 0.44 4 1.885±0.012 0.67 -
[1] GINESTAR G J, PANYELLA C D, RECASENS G M, et al. Anti-jellyfish compositions [P]. EP2363135, 2011, 09. [2] GINESTAR G J, PANYELLA C D, CATAL E R, et al. Anti-jellyfish combinations [P]. EP2380577, 2011, 10. [3] LOTAN A. Compositions and methods for inhibiting nematocyst discharge [P]. US6406709, 2002, 06. [4] 张智. 水母蜇伤皮肤防护剂研究[D]. 上海: 第二军医大学, 2010. [5] LOTAN A. A Composition and method for inhibiting polar capsule discharge and protecting a subject from nematocyst sting[P]. EP1511457, 2015, 09. [6] D'HAESE P C, DOUGLAS G, VERHULST A, et al. Human health risk associated with the management of phosphorus in freshwaters using lanthanum and aluminium[J]. Chemosphere,2019,220:286-299. doi: 10.1016/j.chemosphere.2018.12.093 [7] BADRI N, FLOREA A, MHAMDI M, et al. Toxicological effects and ultrastructural changes induced by lanthanum and cerium in ovary and uterus of Wistar rats[J]. J Trace Elem Med Biol,2017,44:349-355. doi: 10.1016/j.jtemb.2017.09.011 [8] JIN C, GAO L, LI Y, et al. Lanthanum damages learning and memory and suppresses astrocyte-neuron lactate shuttle in rat Hippocampus[J]. Exp Brain Res,2017,235(12):3817-3832. doi: 10.1007/s00221-017-5102-5 [9] FANG H Q, YU Z, ZHI Y, et al. Subchronic oral toxicity evaluation of lanthanum: a 90-day, repeated dose study in rats[J]. Biomed Environ Sci,2018,31(5):363-375. [10] 张治军, 雷超海, 李沛, 等. 基于微波消解的ICP-OES/ICP-MS法测定鸡内金中24种元素[J]. 药物分析杂志, 2018, 38(9):1500-1506. [11] HUTCHISON A J, WILSON R J, GARAFOLA S, et al. Lanthanum carbonate: safety data after 10 years[J]. Nephrology,2016,21(12):987-994. doi: 10.1111/nep.12864 [12] 马悦红, 常旭红, 刘买利. 微波消解法在全血样品分析中的应用[J]. 西北大学学报(自然科学版), 1999, 29(4):317-320. [13] 魏双, 王力强, 郑智慷, 等. 微波消解-电感耦合等离子体发射光谱仪测定土壤样品中的硼[J]. 地质调查与研究, 2019, 42(4):256-258, 262. [14] 吴雅清, 许瑞安. 微波消解-电感耦合等离子体质谱法测定可口革囊星虫中稀土元素[J]. 分析科学学报, 2019, 35(3):385-388. -





 下载:
下载:

 下载:
下载:


