-
肺癌是一种常见的恶性肿瘤,其中,非小细胞肺癌(NSCLC)占肺癌的80%~85%,在全球范围内的发病率和病死率显著较高[1-2]。2020年全球估计有220万新发肺癌病例(占全球癌症病例总数的11.4%)和近180万肺癌死亡病例(占全球癌症死亡总数的18.0%)。而中国肺癌病例数和病死率(分别为37.0%和39.8%)为全球肺癌发病之首[3-4]。
传统的NSCLC治疗方式主要包括化疗、手术切除、放疗和最佳的支持性治疗。然而,化疗只能提供适度的好处,而安全性有限,因此最近几年上市的免疫检查点抑制剂(ICIs)已成为NSCLC的主要的治疗方法[5],特别是程序性死亡受体-1 (PD-1)和抗程序性死亡配体-1 (PD-L1)的免疫检查点抑制剂,通过恢复被抑制的效应T细胞的功能来增强抗肿瘤作用,并在大量转移性和晚期NSCLC患者中产生持久的反应[6]。
纳武利尤单抗(nivolumab)是一种全人源性的IgG4 PD-1免疫检查点抑制剂抗体,于2015年获得了美国FDA的批准,用于治疗NSCLC患者,在美国国立综合癌症网络(NCCN)的指南中,纳武利尤单抗被推荐为治疗NSCLC的一线药物。此药于2019年在国内上市,获批用于含铂类方案化疗后疾病进展或不可耐受的局部晚期或转移性NSCLC成人患者。但由于其上市时间较短,临床上应用有效性和安全性数据匮乏,本研究纳入最新的8项Ⅲ期随机对照临床试验(RCTs),共有4 945例患者参与。旨在通过Meta分析的方法评估纳武利尤单抗治疗NSCLC的有效性和安全性。
-
计算机检索PubMed、Embase、Cochrane Library、中国知网(CNKI)、维普中文科技期刊数据库、万方医学数据库中有关纳武利尤单抗治疗NSCLC的相关研究,检索时间自建库至2023年3月。英文检索词为“Nivolumab” “Opdivo” “ONO-4538” “MDX-1106” “BMS-936558” “Non-Small-Cell Lung Carcinomas” “Non-Small Cell Lung Cancer” “NSCLC” “Carcinoma” “Non-Small-Cell Lung”等;中文检索词为:“非小细胞肺癌”“纳武利尤单抗”“欧狄沃”“纳武单抗”等,不限制试验类型。
-
纳入标准:①基于Ⅲ期RCTs的研究。②研究对象为经组织学或细胞学证实为处于Ⅲ-Ⅳ期的NSCLC患者。③干预措施:试验组患者接受纳武利尤单抗单药治疗或纳武利尤单抗单药联合传统化疗方案进行治疗,而传统化疗组患者采用传统化疗方案或安慰药联合传统化疗方案进行治疗。④研究结果包括总生存期(OS)、无进展生存期(PFS)及三级以上不良事件的发生(如恶心、腹泻、中性粒细胞减少、皮疹、贫血、食欲减退、疲劳)。
不符合纳入标准的研究和共享相同数据集的研究被排除在外。如果为同一临床试验发表了两篇以上的文章,则从每一篇文章中获取每个研究结果的最新数据。
-
两位作者使用标准化表格独立完成了数据提取,并由第三作者进行验证。所有研究数据均以标准化形式提取,一式两份,如发生争议,则由研究小组协助解决。提取的数据内容包括本研究的基本特征:第一作者和发表年份、实验阶段与类型、病理分型、样本量及样本基本信息、干预措施、结局指标、不良反应例数等。
-
采用Cochrane偏倚评估工具2.0版本(RoB2.0)对本研究所纳入的RCTs进行质量评价,评估主要分为5个模块包括:随机过程中产生的偏倚、偏离既定干预的偏倚、结局数据缺失的偏倚、结局测量的偏倚以及结果选择性报告的偏倚。这些模块从不同角度对RCTs产生偏倚的可能性进行评估,根据工具算法,总体偏倚风险判断是“低风险”、“有一定风险”和“高风险”。
-
使用STATA13.1对提取的数据进行统计分析。对OS和PFS采用风险比(HR),不良反应采用比值比(OR)及其95%CI合并分析分类变量。OS和PFS采用HR分析(HR>1有利于对照组,HR<1有利于纳武利尤单抗组);不良反应发生率采用OR分析;采用卡方检验评估研究的异质性,当P≥0.1且I2≤50%时,采用固定效应模型;当P<0.1或I2>50%时,采用随机效应模型。
-
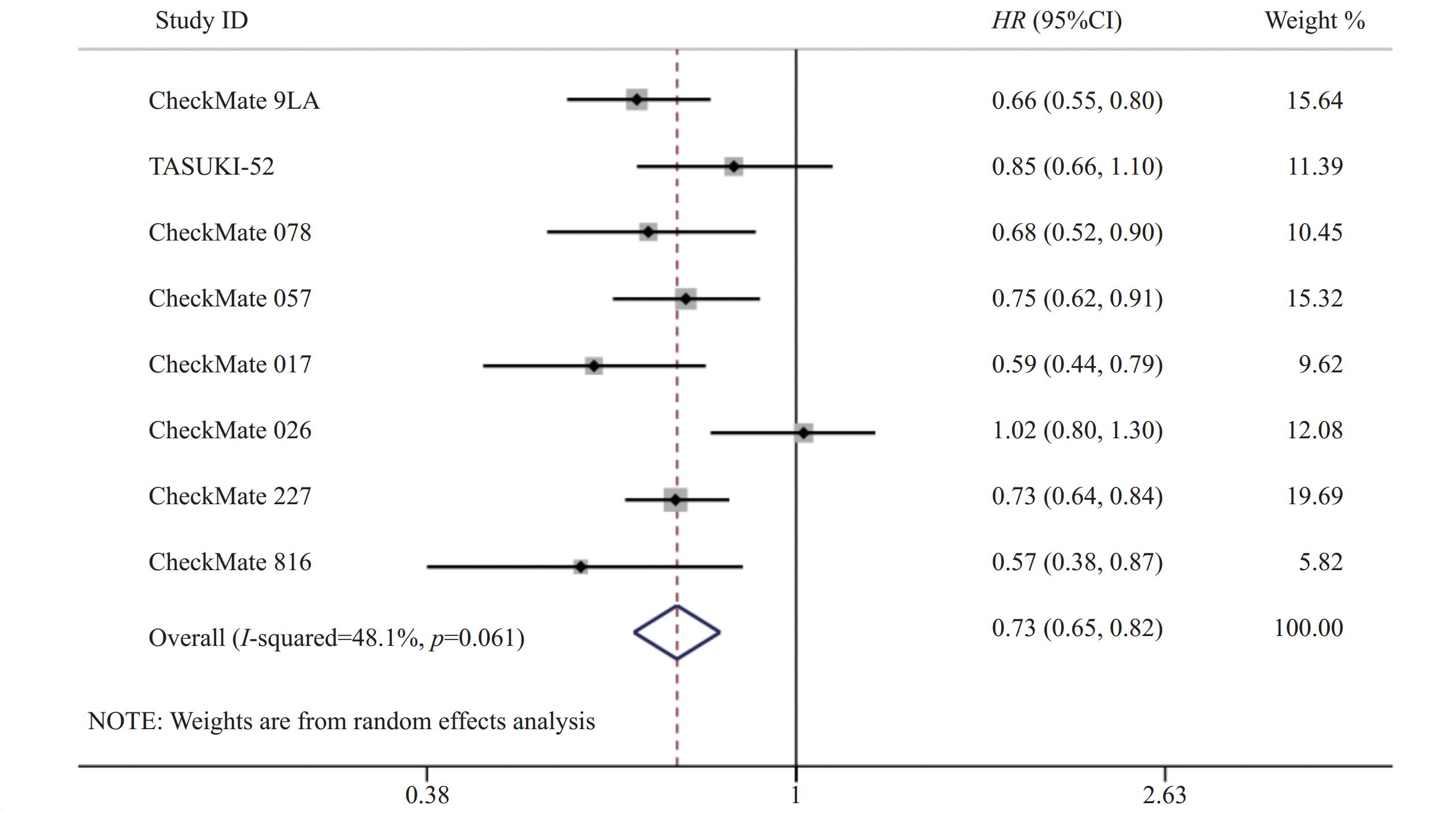
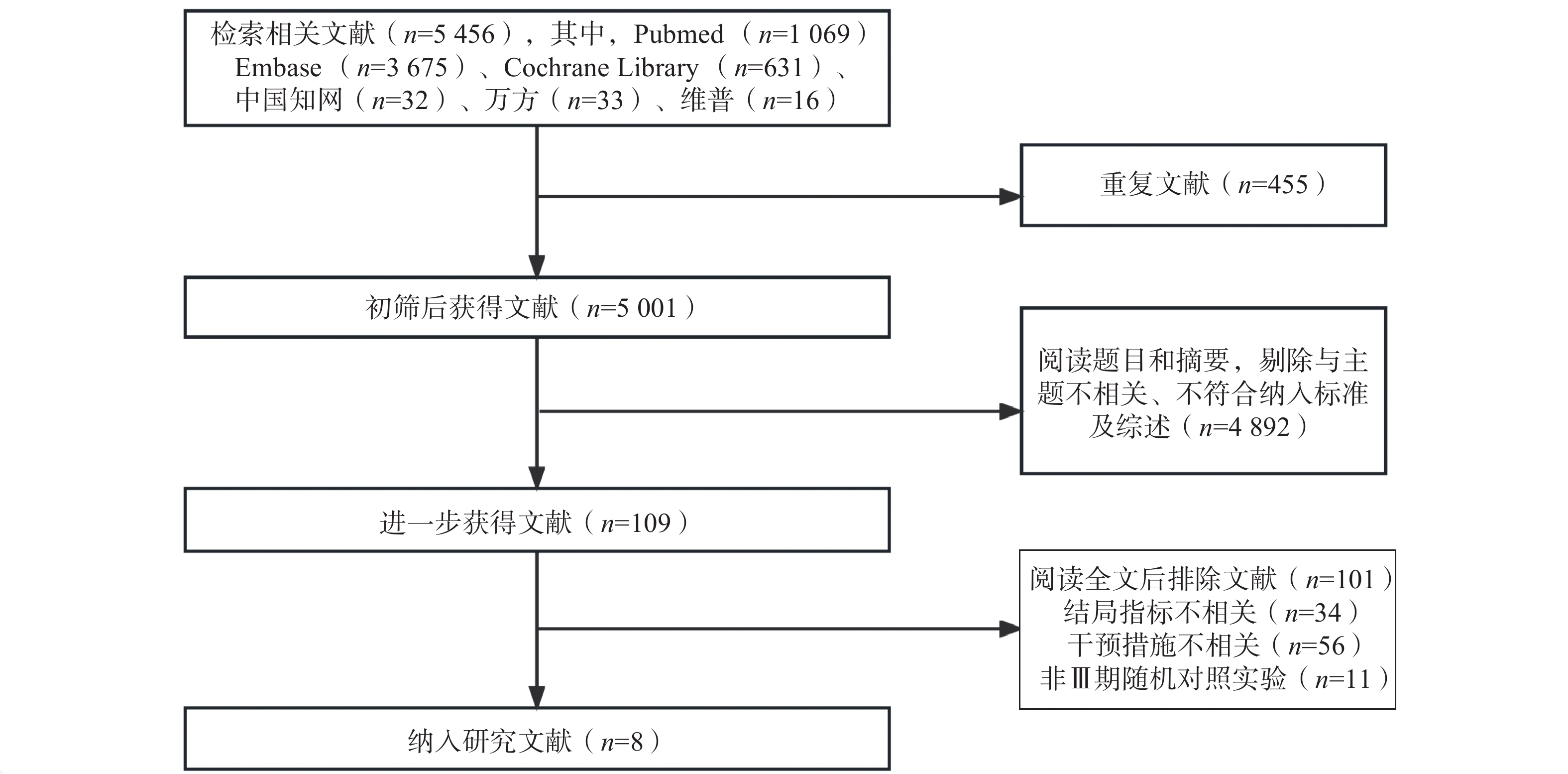
共检索相关文献5 456篇,根据纳排标准进行筛选后,最终纳入了来自8项[7-14]Ⅲ期RCTs的4 945例NSCLC患者进行统计分析。纳入研究基本信息见表1,文献筛选流程见图1。
表 1 纳入研究基本信息
研究 干预措施 患者例数 HR(95%CI) 相关不良反应* 试验组 对照组 试验组 对照组 总生存期 无进展生存期 CheckMate 9LA[7] 伊普利单抗+纳武利尤单抗+铂类化疗 以铂类为基础的
双重化疗361 358 0.66(0.55-0.80) 0.70(0.57-0.86) ①②③④⑤⑥⑦⑧ TASUKI-52[8] 卡铂+紫杉醇+贝伐珠单抗+纳武利尤单抗 卡铂+紫杉醇+
贝伐珠单抗+安慰剂275 275 0.85(0.66-1.10) 0.56(0.49-0.64) ①②③④⑤⑥⑦⑧ CheckMate 078[9] 纳武利尤单抗 多西他赛 338 166 0.68(0.52-0.90) 0.77(0.62-0.95) ①④⑤⑥⑦⑧ CheckMate 057[10] 纳武利尤单抗 多西他赛 292 290 0.75(0.62-0.91) 0.92(0.77-1.11) ①②④⑥⑦⑧ CheckMate 017[11] 纳武利尤单抗 多西他赛 135 137 0.59(0.44-0.79) 0.62(0.47-0.81) ①②③④⑤⑥⑦⑧ CheckMate 026[12] 纳武利尤单抗 以铂类为基础的化疗 211 212 1.02(0.80-1.30) 1.15(0.91-1.45) ①②③④⑤⑥⑦⑧ CheckMate 227[13] 伊普利单抗+
纳武利尤单抗以铂类为基础的化疗 576 570 0.73(0.64-0.84) 0.79(0.69-0.91) ①②③④⑤⑥⑦⑧ CheckMate 816[14] 纳武利尤单抗+
铂类双重化疗单独铂类双重化疗 179 179 0.57(0.38-0.87) 0.54(0.37-0.80) ①②③④⑤⑥⑦⑧ 注:* ①三级以上不良反应,②恶心,③腹泻,④中性粒细胞减少,⑤皮疹,⑥贫血,⑦食欲下降,⑧疲劳。所有研究均为经组织学或细胞学证实为处于Ⅲ-Ⅳ期的NSCLC患者。 -
对8篇RCTs采用RoB2.0工具进行评价,偏倚风险评价结果见图2。
-
8项研究[7-14]均对OS进行了统计分析。各研究间存在统计学异质性(P=0.06,I2=48.1%),使用随机效应模型,Meta分析结果显示,与对照组相比,试验组患者接受纳武利尤单抗治疗延长了NSCLC患者的OS,差异有统计学意义(HR=0.73,95%CI=0.65~0.82,P<0.05),提示使用纳武利尤单抗治疗NSCLC的疗效要优于传统的化疗方案,见图3。
-
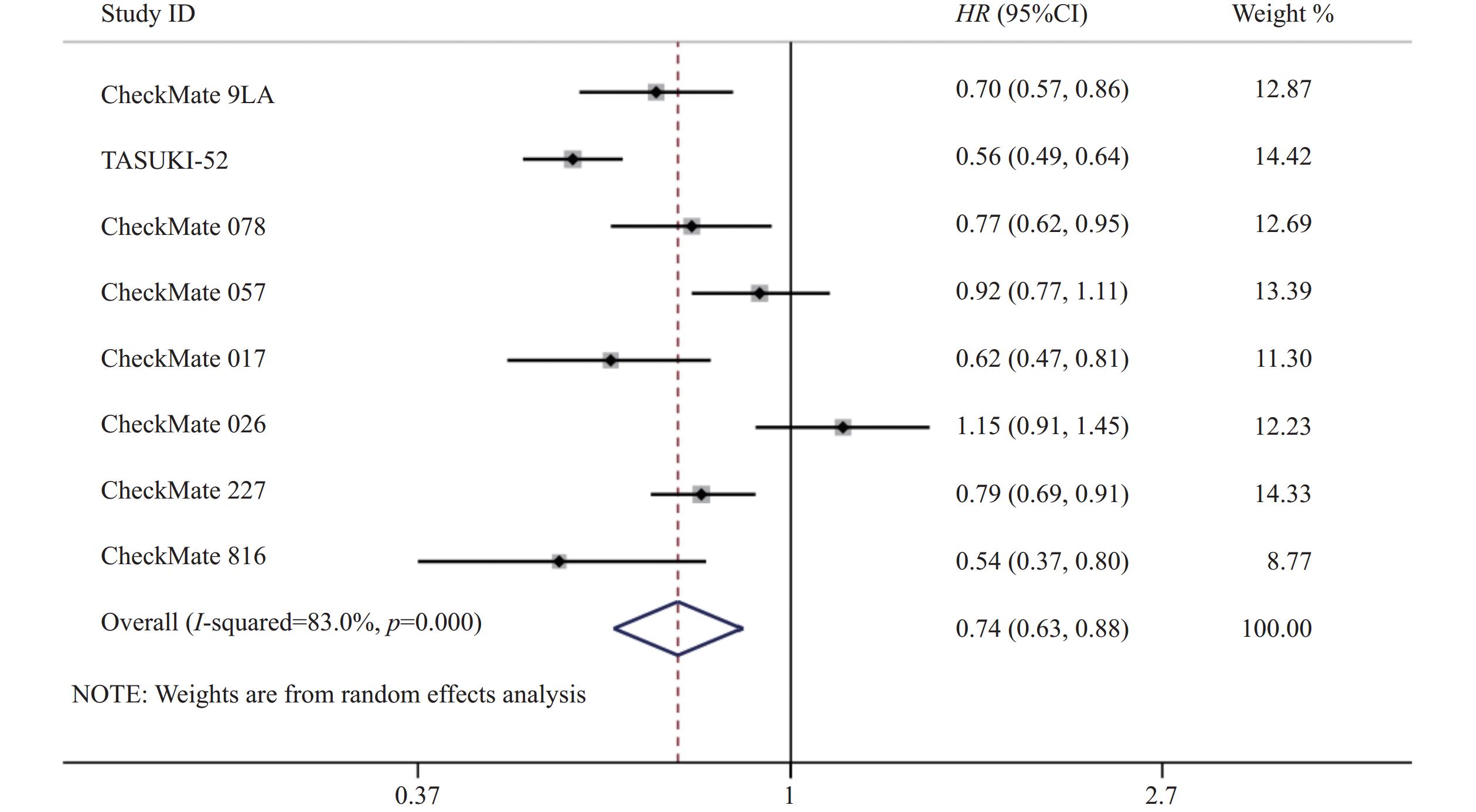
8项研究[7-14]均对PFS进行了统计分析。研究存在统计学异质性(P<0.05,I2=83%),使用随机效应模型,Meta分析结果显示,与对照组相比,试验组患者接受纳武利尤单抗治疗延长了NSCLC患者的PFS,差异有统计学意义(HR=0.74,95%CI=0.63~0.88,P<0.05),因此,使用纳武利尤单抗治疗NSCLC的疗效要优于传统的化疗方案,详见图4。
-
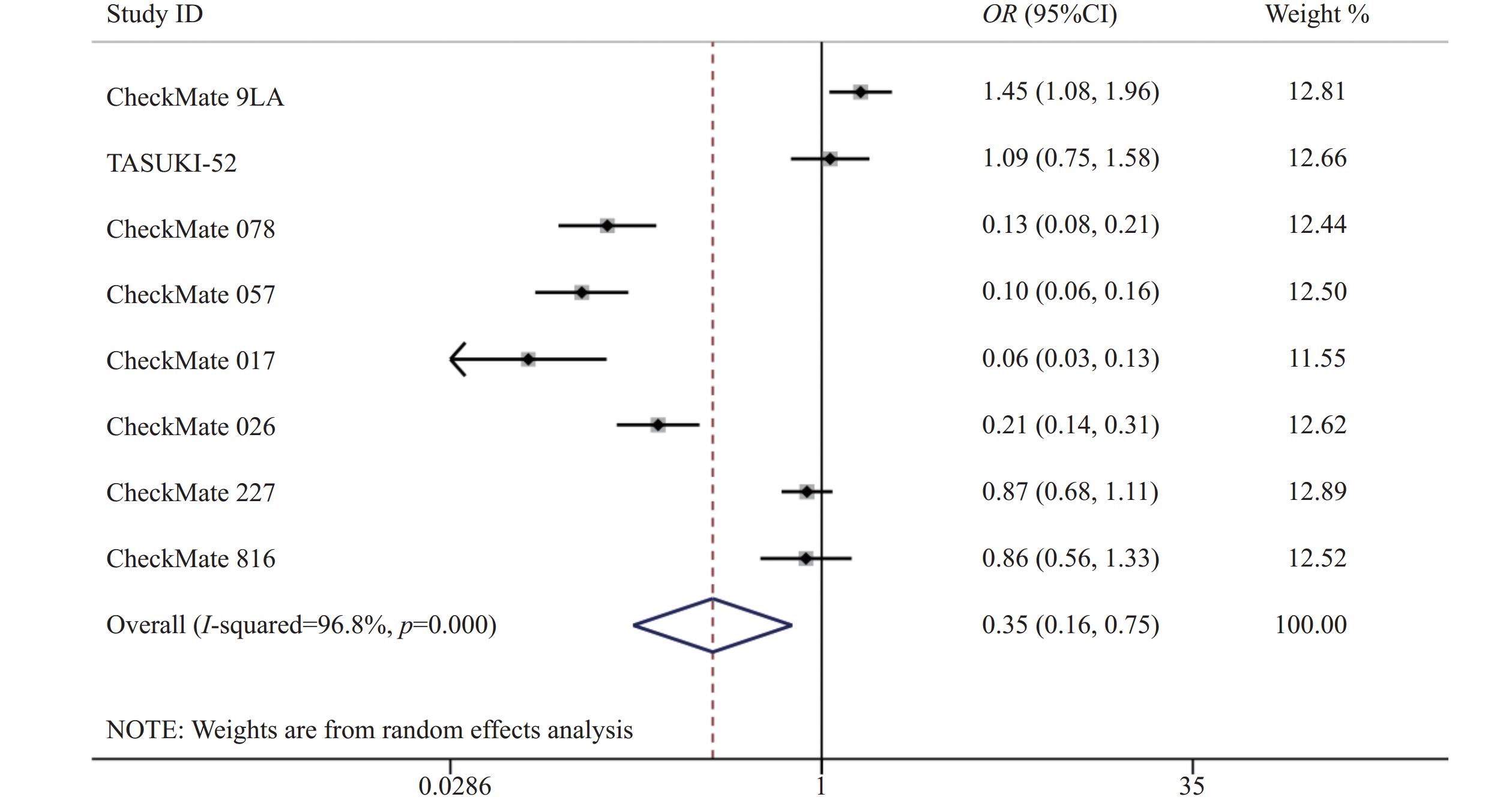
8项研究[7-14]均报道了两组三级以上的不良反应率。各研究间存在统计学异质性(P<0.05,I2=96.8%),使用随机效应模型,Meta分析结果显示,两组患者发生三级以上不良反应差异有统计学意义(OR=0.35,95%CI=0.17~0.75,P<0.05),因此,相对于传统的化疗,使用纳武利尤单抗可能会降低三级以上不良反应发生率,见图5。
-
①7项研究[7-8, 10-14]报道了恶心的发生率,研究间存在异质性(P<0.05,I2=91.7%),使用随机效应模型,两组患者恶心发生率差异有统计学意义(OR=0.38,95%CI=0.22~0.64,P<0.05)。②6项研究[7-8, 10-13]报道了腹泻的发生率,研究间存在异质性(P<0.05,I2=91.9%),使用随机效应模型,两组患者腹泻发生率差异无统计学意义(OR=0.93,95%CI=0.48~1.82,P>0.05)。③8项研究[7-14]报道了中性粒细胞减少的发生率,研究间存在统计学异质性(P<0.05,I2=97.1%),使用随机效应模型,两组患者中性粒细胞减少发生率差异有统计学意义(OR=0.05,95%CI=0.01~0.25,P<0.05)。④7项研究[7-9,11-14]报道了皮疹的发生率,研究间存在统计学异质性(P<0.05,I2=78%),使用随机效应模型,两组患者皮疹的发生率差异有统计学意义(OR=3.85,95%CI=2.05~6.25,P<0.05)。⑤8项研究[7-14]报道了贫血的发生率,研究间存在统计学异质性(P<0.05,I2=96.4%),使用随机效应模型,两组患者皮疹发生率差异有统计学意义(OR=0.16,95%CI=0.06~0.42,P<0.05)。⑥8项研究[7-14]报道了食欲下降的发生率,研究间存在统计学异质性(P<0.05,I2=70.5%),使用随机效应模型,两组患者食欲下降发生率差异有统计学意义(OR=0.57,95%CI=0.42~0.76,P<0.05)。⑦8项研究[7-14]报道了患者疲劳的发生率,研究间存在统计学异质性(P<0.05,I2=86.4%),使用随机效应模型,两组患者疲劳发生率差异有统计学意义(OR=0.54,95%CI=0.35~0.85,P<0.05)。
-
在这项研究中,我们对8项最新的Ⅲ期RCTs研究进行了Meta分析,结果支持纳武利尤单抗单用或联合传统化疗治疗NSCLC的有效性和安全性。更重要的是,Nivolumab相比传统疗法会降低NSCLC患者的三级以上不良反应发生率,降低恶心、中性粒细胞减少、贫血、食欲下降、疲劳的发生率。近年来,越来越多的临床试验报道了PD-1/PD-L1在NSCLC中的疗效和安全性。Zhang 等[15]的Meta分析结果发表于2021年,支持了PD-1/PD-L1在NSCLC中的有效性和安全性。然而,Nivolumab只有2项研究被纳入,其中只有一项研究[12](CheckMate 026试验)提供了完整的已发表数据,而另一项[13](CheckMate 227试验)在进行中。该Meta分析中包含的研究有限,因此,有必要对最新更新的研究数据进行Meta分析。
本研究分析了Nivolumab用于治疗NSCLC的有效性及每项研究发生率较高且共同记录的不良反应的发生率。与以往的研究相比,通过对最新的Ⅲ期RCTs 4 945例患者统计分析,得出的一些创新性结论,对指导临床治疗和后续研究具有新的意义。本研究中所有的文章均为Ⅲ期RCTs并选用平行设计随机对照试验,Cochrane偏倚评估工具2.0版本RoB2.0进行文献质量评价,RoB2.0内容丰富,覆盖全面,为RCTs的证据整合与评价提供了更多的偏倚风险信息。
本研究尚有一定局限性,具体包括:①纳入研究的患者使用纳武利尤单抗并非首次治疗方案,存在基础化疗方案,不同的治疗方案可能对有效性和安全性评价结果存在影响。②该文献检索限定为中文和英文,只检索了已公开发表的文献,且未找到符合要求的国内文献报道。纳入本研究的患者均为国外患者,因此研究结果可能与中国人群存在种族差异。③患者的基线信息如吸烟、组织学亚型、PD-L1表达水平、不同的化疗方案等因素都会影响治疗效果,使评价结果存在偏倚。④本研究中部分结局指标存在异质性,多种因素可能导致异质性,包括临床分期、组织学亚型、PD-L1表达水平、吸烟状况和患者种族,8项临床试验在美洲、亚洲和欧洲不同国家进行,并招募了来自不同种族的患者。为保证研究的同质性,建议后期更新更多临床试验后分析可统一纳入及排除标准。
-
综上所述,相较于传统化疗,纳武利尤单抗治疗NSCLC的疗效和安全性更优,常规单独使用或与化疗联合使用能显著改善患者的总生存期和无进展生存期,且不会增加传统化疗引起的不良反应(如恶心、中性粒细胞减少、贫血、食欲下降、疲劳等)。然而,纳武利尤单抗增加了免疫相关不良反应的风险如皮疹的发生,应引起关注,临床医生应仔细平衡纳武利单抗的疗效、毒性和成本,以优化临床结果。
Efficacy and safety of nivolumab in the treatment of non-small cell lung cancer:a meta-analysis
-
摘要:
目的 系统评价纳武利尤单抗治疗非小细胞肺癌(NSCLC)的有效性和安全性。 方法 系统检索PubMed、Embase、Cochrane Library、中国知网(CNKI)、维普中文科技期刊数据库、万方医学数据库,时间均为自建库至2023年3月;纳入公开发表的纳武利尤单抗治疗非小细胞肺癌患者的Ⅲ期随机对照临床试验,以总生存期、无进展生存期和不良反应发生率作为结局指标,采用STATA13.1版统计软件进行Meta分析。 结果 8项Ⅲ期随机对照试验共计4 945例患者的Meta分析结果显示,纳武利尤单抗治疗组在整体生存期方面相较于传统化疗组能显著降低患者死亡风险(HR=0.73,95%CI=0.65~0.82,P<0.05),纳武利尤单抗治疗组在无进展生存期方面相较于传统化疗组且能显著降低患者复发风险(HR=0.74,95%CI=0.63~0.88,P<0.05)。在安全性方面,对于腹泻,纳武利尤单抗组和传统化疗组没有显著差异。然而,对于恶心、中性粒细胞减少、贫血、食欲下降、疲劳等不良事件,纳武利尤单抗组的发生率均低于传统化疗组。值得注意的是,纳武利尤单抗组免疫相关性不良事件(如皮疹)的发生率显著高于传统化疗组,且具有统计学意义(OR=3.85,95%CI=2.05~6.25,P<0.05)。 结论 相较于传统化疗,纳武利尤单抗治疗非小细胞肺癌的疗效和安全性更优,但增加了免疫相关不良事件的风险。 Abstract:Objective To systematically evaluate the efficacy and safety of nivolumab in the treatment of non-small cell lung cancer. Methods PubMed, Embase, Cochrane Library, China National Knowledge Infrastructure(CNKI), Weipu Chinese Science and Technology Journal Database, Wanfang Medical Database were searched for articles published from the establishment of the database to March 2023. Published randomized controlled clirical trials of nivolumab in the treatment of patients with non-small cell lung cancer were selected, overall survival, progression-free survival, and adverse reaction rate as outcome indicators were used. A meta-analysis using STATA version 13.1 statistical software was conducted. Results A total of 8 phase Ⅲ randomized controlled trials involving 4945 subjects were included. Compared with the traditional chemotherapy group, patients in the nivolumab group had significantly reduced risk of death in terms of overall survival (HR=0.73, 95%CI=0.65-0.82, P<0.05), and in terms of progression-free survival, nivolumab significantly reduced the risk of recurrence compared with the traditional chemotherapy group (HR=0.74, 95% CI=0.63-0.88, P<0.05). In terms of safety, there was no significant difference between the nivolumab group and the traditional chemotherapy group for diarrhea, but the incidence of nausea, neutropenia, anemia, decreased appetite, and fatigue in the nivolumab group was lower than that in the traditional chemotherapy group. However, it should be worth noting that the incidence of immune-related adverse events such as rash was higher in the nivolumab group than in the traditional chemotherapy group, and the difference was statistically significant (OR=3.85, 95%CI=2.05-6.25, P<0.05).Conclusion Compared to traditional chemotherapy, the efficacy and safety of nivolumab in the treatment of non-small cell lung cancer were better, but the risk of immune-related adverse events increased. -
Key words:
- nivolumab /
- non-small cell lung cancer /
- Meta-analysis /
- efficacy /
- safety
-
结直肠癌(CC)发生率占所有肿瘤发生率的第3位,病死率仅次于肺癌,属于下消化系统恶性肿瘤[1]。目前,结肠癌的治疗主要采用多学科的综合治疗模式[2]。包括5-氟尿嘧啶、奥沙利铂与贝伐珠单抗等的组合[3-5]。然而,这些常规的化疗方案可能造成患者不耐受以及骨髓等的抑制。因此,寻找新的有效的药物对于现今结肠癌治疗具有重要意义。
紫杉醇(PTX)是一种广谱抗肿瘤活性的化疗药物,来源于太平洋紫杉树皮(红豆杉)[6,7]。临床试验结果表明,PTX在几种癌症治疗中有较好的活性,包括:乳腺癌、皮肤恶性肿瘤、非小细胞肺癌以及卵巢癌等[8,9]。然而,由于结肠癌中过表达的P糖蛋白(P-gp)引起了多重耐药性(MDR),导致PTX对结肠癌临床治疗效果不甚理想[10]。此外,PTX生物半衰期短,其一代药物Taxol以聚氧乙烯蓖麻油为表面活性剂,具有引起患者过敏反应的风险,从而限制了PTX临床疗效的发挥[11]。因此,迫切需要对PTX进行结构改进与剂型设计,改善其药物递送效率,提高生物利用度[12]。
脂肪酸作为生物膜和生物信号分子的重要成分,参与了细胞能量产生、代谢的过程。由于肿瘤细胞增殖快速,需要大量的细胞合成物质和能量的供应,因此,患有恶性肿瘤的患者其脂肪酸合成也较快。其中,肿瘤细胞因为迅速繁殖对含有16个碳原子的棕榈酸(PA)为主的脂肪酸需求量大,因此利用PA进行修饰有利于药物被肿瘤细胞摄取[13,14]。再者,研究发现,由PA修饰的紫杉醇,能降低其对P-gp的亲和力,避免了PTX进入肿瘤细胞后的外排,提高紫杉醇对于结肠癌治疗的有效性[15]。
此外,作为一种成熟的药物载体,脂质体(Lip)在体内可被降解、无毒性和免疫原性,能够增强药物在体内的稳定性,从而可以减少给药剂量、降低毒副作用,并且其表面具有可修饰性[16],例如,采用聚乙二醇磷脂(PEG-DSPE)修饰的脂质体因其空间位阻效应可延长其在体内的循环时间[17]。同时结合肿瘤组织的增强通透性和滞留效应(EPR),使药物通过被动靶向递送到靶部位[18]。
结合以上背景,本研究首先通过棕榈酸酯与紫杉醇共价键结合构建紫杉醇棕榈酸酯(PTX-PA),并建立基于高效液相(HPLC)的定量分析方法,旨在降低其对P-gp的亲和力,避免PTX进入肿瘤细胞后被外排,从而改善紫杉醇毒性较大、生物半衰期短、成药性差等问题,提高紫杉醇对于结肠癌治疗的有效性。其次,我们将PTX-PA包载进PEG修饰的脂质体构建紫杉醇棕榈酸酯的脂质体(PTX-PA/Lip),以实现其长循环,增加PTX的疗效、降低其毒副作用。最后,采用工艺筛选与单因素处方优化的方法制备最佳PTX-PA/Lip,为PTX-PA的制剂学研究奠定基础[19]。
1. 仪器与材料
1.1 仪器
高效液相色谱仪(安捷伦科技有限公司,美国);十万分之一电子天平(MS105DU,梅特勒托利多公司,瑞士);超滤管(30 kD,密理博公司,美国);低温高速离心机(Eppendorf-200,艾本德公司,德国);高压均质机(NanoGenizer,美国);Zeta-sizer Nano粒度仪(Nano-ZS,马尔文公司,英国)。
1.2 试剂与材料
紫杉醇购自江苏红豆杉生物科技股份有限公司,纯度≥98%;棕榈酸购自中国医药集团上海化学试剂公司,纯度≥99%;蛋黄卵磷脂(PC98-T)、胆固醇、DSPE-PEG 2000均购自上海艾韦特医药科技有限公司;1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC)、4-二甲氨基吡啶(DMAP)、乙酸乙酯、二氯甲烷、无水乙醇、石油醚均购自中国医药集团上海化学试剂公司,分析纯;乙酸乙酯、PC-98T蛋黄卵磷脂(上海艾韦特医药科技有限公司);胆固醇(上海艾韦特医药科技有限公司);二氯甲烷、DSPE-PEG 2000(上海艾韦特医药科技有限公司);无水乙醇、石油醚购自中国医药集团上海化学试剂公司;甲醇购自美国默克公司,色谱纯。
2. 方法
2.1 PTX-PA的制备与纯化
PTX-PA前药由PTX与PA发生酯化反应合成,其合成过程如下[20,21]:精密称取PTX 0.85 g,加入无水二氯甲烷 30 ml。依次加入精密称取的EDC 0.19 g、DMAP 0.15 g和PA 0.31 g,在氮气保护下室温搅拌反应12 h。反应结束后,用5%柠檬酸水溶液、饱和食盐水洗涤3遍,旋蒸除去有机溶剂,即得PTX-PA粗品。采用石油醚和乙酸乙酯通过柱层析法对PTX-PA进行分离、纯化。洗脱完成后,将产物旋蒸去除有机溶剂,得到的白色固体即为PTX-PA,样品经核磁共振氢谱、碳谱确定为PTX-PA,样品纯度98.5%。
2.2 基于HPLC定量检测的方法学建立[22]
2.2.1 最大吸收波长测定与色谱条件设定
精密取适量的PTX-PA粉末,采用甲醇溶解,定容,通过全波长(190~400 nm)扫描测定其紫外最大吸收波长λmax。
本实验采用Agilent Eclipse plus C18色谱柱(4.6 mm×250 mm,5 μm),流动相采用甲醇/水(95∶5,V/V),进样量20 μl,流速1.0 ml/min。
2.2.2 样品溶液配制
空白溶液的配制:精密量取不含药的空白脂质体1 ml加入适量的甲醇溶液,超声,用甲醇定容至25 ml,0.45 μm的微孔滤膜过滤,滤液即为空白溶液。
对照品溶液的配制:精密称取PTX-PA 粉末50 mg,用甲醇溶解并定容至50 ml,过滤,即得PTX-PA对照品储备溶液。
供试品溶液的配制:精密量取1 ml PTX-PA/Lip,加入适量甲醇溶解、超声破乳、定容至25 ml,过滤,滤液即为供试品溶液。
2.2.3 专属性考察
分别取适量空白溶液、对照品溶液和供试品溶液,用流动相稀释至适当的浓度后,按照“色谱条件”中建立的高相液相参数进行进样分析。
2.2.4 线性关系考察
精密量取适量PTX-PA对照品储备液依次稀释为浓度1、5、10、25、50、100 μg/ml的PTX-PA系列浓度。按照“色谱条件”中的高效液相参数进行进样分析(n=5),并记录不同浓度的PTX-PA的色谱峰面积。以浓度(C)为X轴、峰面积(A)为Y轴进行回归。
2.2.5 精密度考察
日内精密度考察:精密吸取3种不同浓度(5、25、100 μg/ml)的 PTX-PA对照品溶液,对同一浓度溶液连续进样5次,每次10 µl,按照“2.2.1”项下色谱条件进行分析,记录各个浓度吸收峰面积。
日间精密度考察:精密吸取3种不同浓度(5、25、100 μg/ml)的 PTX-PA对照品溶液,对同一浓度溶液连续进样5 d,每天1次,每次10 µl,按照“2.2.1”项下色谱条件进行分析,记录第0、1、2、3、4天的吸收峰面积,计算样品浓度,考察仪器的日间精密度。
2.2.6 重复性与稳定性
空白脂质体超声破乳,配制成3种不同浓度(1、10、100 μg/ml),连续进样5次,每次10 µl,记录各吸收峰面积,考察重复性。精密吸取浓度为50 μg/ml的 PTX-PA供试品溶液,于0、2、4、6、8、12、24 h进样测定,每次进样10 µl,记录各紫外吸收峰面积,考察样品的稳定性。
2.2.7 加样回收率考察
空白脂质体超声破乳,分别加入浓度为1 mg/ml的PTX-PA溶液0.5、2.5、5 ml,采用流动相稀释定容至100 ml,分别进样,并结合PTX-PA的理论浓度(5、25、50 μg/ml)进行加样回收率的计算与分析。
2.3 紫杉醇棕榈酸酯脂质体PTX-PA/Lip的制备
2.3.1 PTX-PA/Lip的制备方法的选择
(1) 薄膜分散法
精密称取PTX-PA 20 mg、蛋黄卵磷脂350 mg、胆固醇5 mg和DSPE-PEG2000 25 mg,加入适量的二氯甲烷使其充分溶解。然后旋蒸除去有机溶剂,使圆底烧瓶底部形成一层均匀透明的薄膜,再加入预热至同等温度的重蒸水10 ml,震荡、水化,得PTX-PA/Lip粗品。将得到的粗品经探头超声(1 min)、过滤处理后,即得PTX-PA/Lip纳米给药系统[19]。
(2) 高压均质法
将薄膜分散法制得的PTX-PA/Lip粗品置于高压均质机中,经3次均质处理后(均质压力12 000 psi),即得PTX-PA/Lip纳米给药系统[23,24]。
(3)挤出法
将薄膜分散法制得的PTX-PA/Lip粗品置于挤出器中,使分别经过孔径为0.2、0.1、0.05 μm的聚碳酸酯膜,即得PTX-PA/Lip纳米给药系统[25-27]。
2.3.2 处方工艺筛选
(1)磷脂种类的选择
采用薄膜分散法考察不同磷脂制备的PTX-PA/Lip,包括:氢化磷脂(HSPC)、蛋黄卵磷脂(PC98-T)、蛋黄磷脂(EPCS)、二棕榈酸磷脂酰胆碱(DPPC),以形态、粒径、包封率为指标进行评价。
(2)磷脂和药物/胆固醇比例的考察
分别以磷脂和药物的质量比(5∶1、10∶1、20∶1、30∶1、40∶1)/PC98-T和胆固醇的质量比(4∶0.05、4∶0.1、4∶0.2、4∶0.3、4∶0.4、4∶0.5)为自变量制备PTX-PA/Lip脂质体,考察不同处方的粒径、粒径分布、包封率,确定处方中磷脂与药物/胆固醇的质量比。
(3)药物和DSPE-PEG2000比例的考察
以PTX-PA和DSPE-PEG2000的质量比(1∶0.5、1∶1、1∶1.5、1∶2、1∶2.5)为自变量,考察其用量对制剂的外观澄明度、纳米粒子大小等是否产生影响。
(4)薄膜蒸发法的温度考察
将旋转蒸发仪温度分别设置为35、40、45、50、55 ℃,考察薄膜蒸发过程中温度对PTX-PA/Lip形态、粒径、包封率等的影响。
(5)探头超声时间的考察
以探头超声PTX-PA/Lip粗品的时间为自变量,考察不同超声时间(30、60、90、180、240 s)对PTX-PA/Lip纳米制剂形态、纳米粒子大小的影响。
2.4 统计学分析
数据采用IBM SPSS Statistics 27.0进行统计分析,采用单因素方差分析ANOVA进行显著性检验与评价。
3. 结果与讨论
3.1 基于PTX-PA的HPLC定量检测方法学建立
3.1.1 最大吸收波长的选择
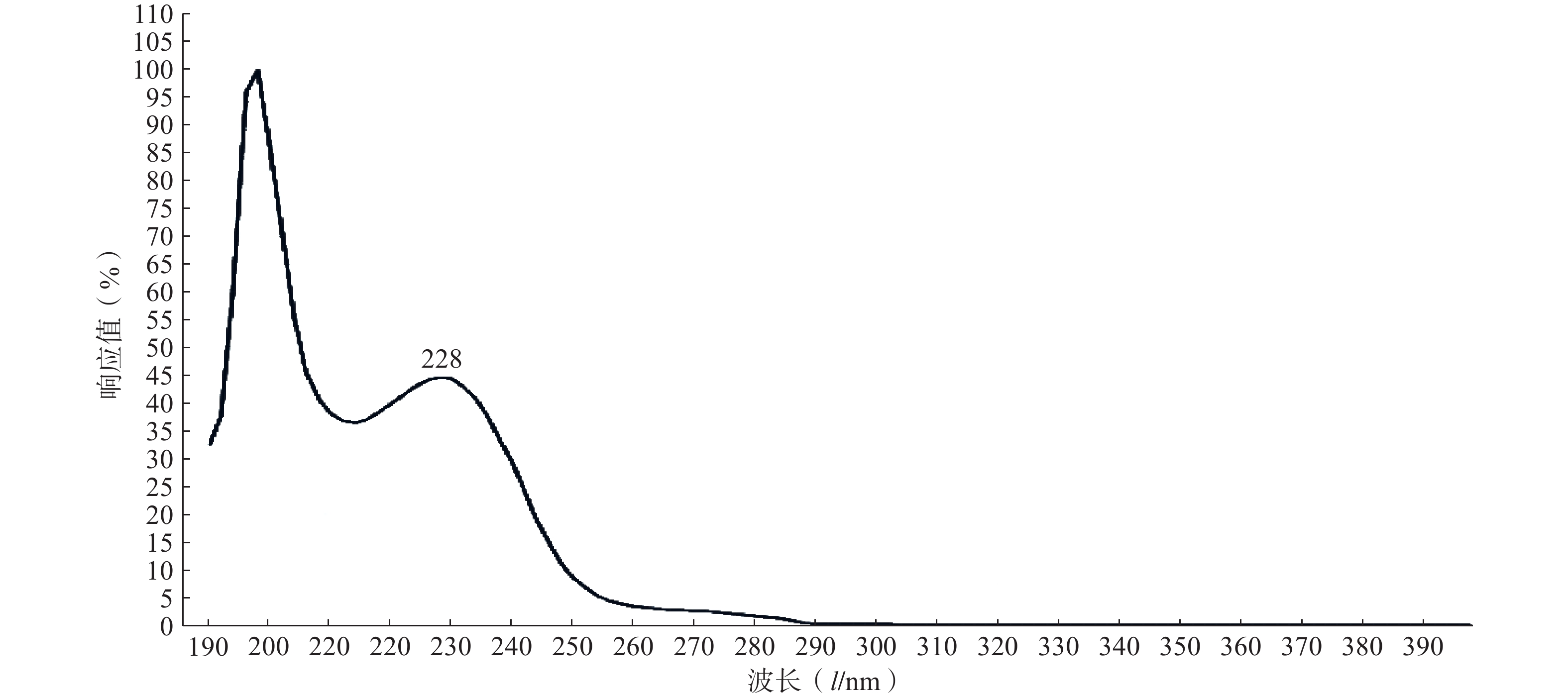
实验结果如图1所示,选用PTX-PA的最大吸收波长为228 nm为测定波长。
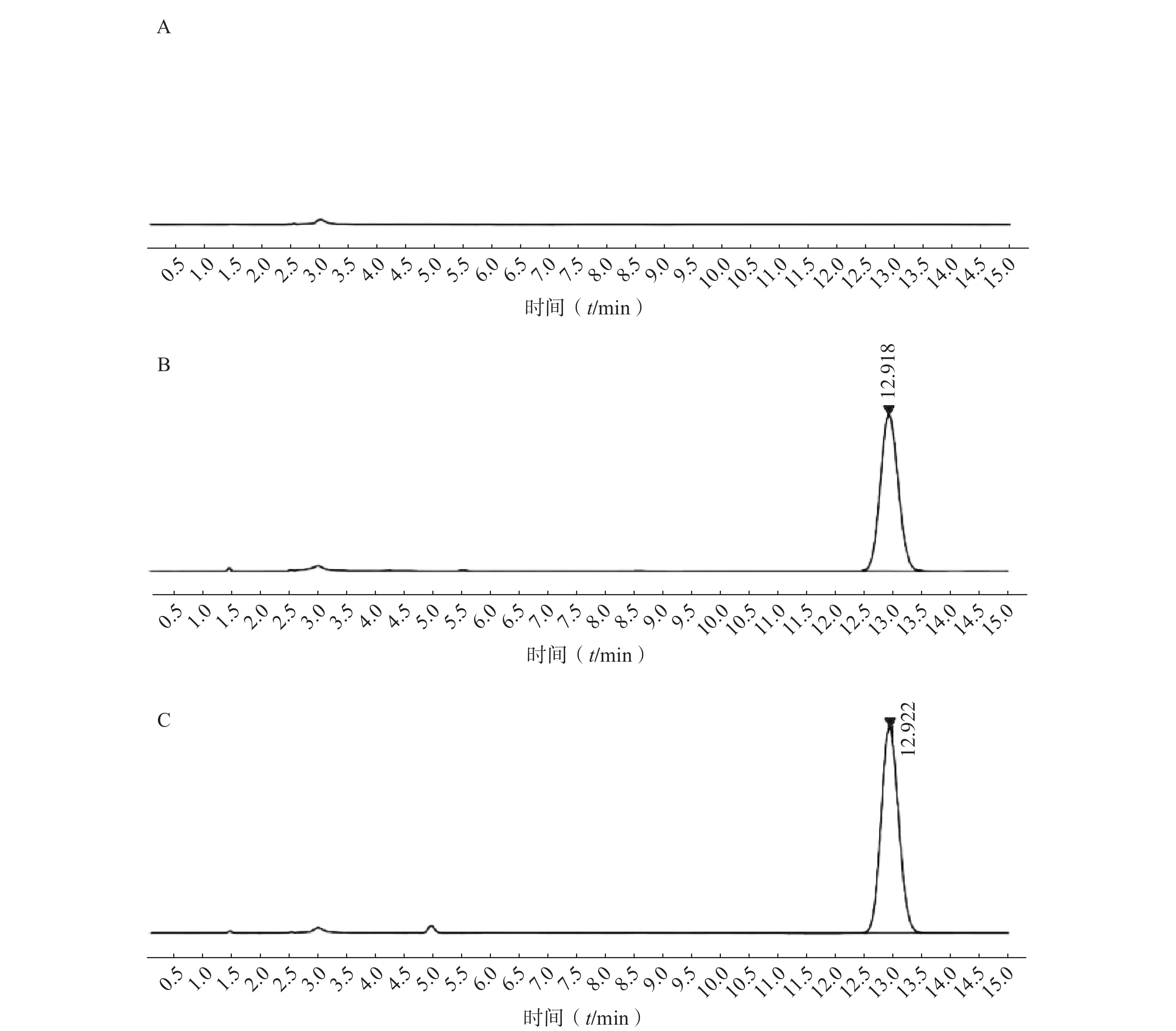
3.1.2 专属性考察
如图2所示,本章所建立的色谱条件对PTX-PA检测具有专属性,溶剂以及样品中的辅料对PTX-PA的检测不产生干扰。
3.1.3 线性关系考察
按照2.2.4方法进行回归,得PTX-PA的吸收峰面积-浓度在1~100 μg/ml的浓度范围内为线性方程:A=15.14 C+10.81(r=0.999 8)。
3.1.4 精密度考察
按照2.2.5方法进行精密度考察,结果如表1所示,日内与日间精密度各时间点峰面积的RSD均小于3%,表明仪器的日内与日间精密度符合测定要求。
表 1 PTX-PA的精密度考察结果(n=5)理论浓度(μg/ml) 实测浓度(μg/ml) RSD(%) 日内 5.00 4.98±0.13 2.65 25.00 25.30±0.55 2.18 100.00 99.66±1.11 1.11 日间 5.00 4.99±0.11 2.31 25.00 25.50±0.57 2.23 100.00 100.65±1.38 1.37 3.1.5 重复性与稳定性
按照2.2.6方法进行研究,精密吸取3种不同浓度的 PTX-PA溶液,连续进样5次并记录各吸收峰面积。各浓度峰面积RSD均<3%,表明仪器符合检测检测要求。此外,稳定性结果表明,样品溶液峰面积的RSD为0.81%,表明制备的PTX-PA溶液在24 h内稳定。
3.1.6 加样回收率
按照2.2.7方法计算加样回收率,结果如表2所示:低、中、高3个浓度的加样回收率均在95%~105%之间,且RSD分别为2.39%、1.80%、2.34%,表明本实验建立的高效液相色谱定量方法可用于PTX-PA的含量测定。
表 2 PTX-PA的加样回收率测试结果(n=5)理论浓度(μg/ml) 检测浓度(μg/ml) 回收率(%) RSD(%) 5 5.02±0.12 100.4 2.39 25 24.98±0.45 99.92 1.80 50 50.01±1.17 100.02 2.34 3.2 紫杉醇棕榈酸酯脂质体的制备及处方优化
3.2.1 PTX-PA/Lip制备方法的选择
采用不同方法制备的PTX-PA/Lip表征结果如表3所示,按照2.4方法进行统计学分析,3种制备方法的包封率无显著性差异,但采用薄膜分散法制备的PTX-PA/Lip粒径与PDI更小。因此,本研究优选薄膜分散法来构建PTX-PA/Lip。
表 3 3种常规制备方法对PTX-PA/Lip粒径、粒径分布、包封率的影响制备方法 粒径(l/nm) PDI 包封率(%) 薄膜分散法 76.76±3.39 0.104±0.02 79.38±2.00 高压均值法 125.11±5.32 0.139±0.03 78.87±2.00 挤出法 128.87±4.92 0.239±0.05 81.38±1.11 3.2.2 处方工艺筛选
(1)磷脂种类的选择
按照2.3.2(1)制备的PTX-PA/Lip表征结果如表4所示,以PC98-T为膜材制备的纳米给药系统粒径小、外观澄明、粒径分布均匀、包封率较高,因此选择PC98-T作为本研究中的磷脂。
表 4 磷脂种类对脂质体的外观形态、颗粒大小、药物包封率的影响磷脂种类 外观 粒径(l/nm) PDI 包封率(%) PC98-T 半透明 76.76±3.39 0.104±0.02 79.38±2.00 HSPC 有沉淀 177.86±5.39 0.532±0.08 59.06±1.32 EPCS 半透明 135.12±5.65 0.108±0.03 73.23±1.15 DPPC 有沉淀 158.26±4.11 0.669±0.05 53.27±2.68 (2)磷脂和药物比例的考察
按照2.3.2(2)项下确定处方中药物和磷脂的用量,其结果如表5所示,磷脂PC98-T和药物的质量比大于10时,制备的PTX-PA/Lip外观澄明度、粒子大小、粒径分散系数等参数无显著性差别。随着磷脂浓度不断增加,药物的包封率不断增加,当PC98-T和PTX-PA的质量比为20∶1时,脂质体对药物的包封率最高,后期考虑到经济成本,将PC98-T和PTX-PA的质量比定为20∶1。
表 5 磷脂和药物质量比对脂质体的外观澄明度、颗粒大小、对药物包封率的影响磷脂∶药物 外观 粒径(l/nm) PDI 包封率(%) 5∶1 略透明 134.62±2.95 0.364±0.04 58.15±1.73 10∶1 有沉淀 90.29±4.66 0.151±0.04 71.56±1.60 20∶1 半透明 84.58±1.33 0.11±0.02 83.50±0.92 30∶1 半透明 86.06±2.71 0.09±0.05 73.44±4.44 40∶1 有沉淀 88.86±1.91 0.199±0.05 68.37±11.08 (3)磷脂和胆固醇比例的考察
按照2.3.2(2)方法研究,结果如表6所示,随着胆固醇用量增多,制剂变浑浊,粒径增大,载药量显著降低。因此,胆固醇不加入本制剂的处方中。
表 6 磷脂和胆固醇质量比对脂质体外观澄明度、颗粒大小、对药物包封率的影响磷脂∶胆固醇 外观 粒径(l/nm) PDI 包封率(%) 4∶0.05 半透明 115.37±4.48 0.200±0.07 71.57±1.28 4∶0.1 半透明 160.16±3.15 0.251±0.01 61.08±3.13 4∶0.2 半透明 182.75±2.43 0.217±0.04 54.97±0.95 4∶0.3 乳白色 241.90±12.09 0.697±0.12 54.11±1.64 4∶0.4 乳白色 255.33±8.27 0.700±0.138 48.84±0.78 (4)药物和DSPE-PEG2000比例的考察
按照2.3.2(3)方法研究,其结果如表7所示,DSPE-PEG2000对包封率没有显著性影响,但当DSPE-PEG2000含量不断增加时,纳米粒子的颗粒大小先降低,当药物与DSPE-PEG2000质量比小于1∶1.5时,粒径无显著性变化,因此,药物与DSPE-PEG2000的质量比选择1∶1.5。
表 7 PTX-PA和DSPE-PEG2000的质量比对脂质体外观、粒径、药物包封率的影响药物∶DSPE-
PEG2000外观 粒径(l/nm) PDI 包封率(%) 2∶1 半透明 82.86±2.15 0.107±0.01 90.48±0.49 1∶1 半透明 78.16±2.05 0.351±0.38 90.41±0.34 1∶1.5 半透明 72.23±2.60 0.110±0.02 89.66±1.25 1∶2 半透明 74.64±1.81 0.140±0.04 90.90±2.93 1∶2.5 半透明 75.38±2.10 0.097±0.04 89.48±0.67 (5)薄膜蒸发法的温度考察
按照2.3.2(4),采用不同温度制备纳米制剂表征结果如表8所示,在筛选的5个温度中,当温度为45 ℃时,脂质体粒径最小、粒径分散性好、包封率最高,因此,本研究选用45 ℃作为薄膜蒸发温度。
表 8 温度对PTX-PA/Lip外观、粒径、包封率的影响温度(T/ ℃) 外观 粒径(l/nm) PDI 包封率(%) 35 略透明 159.42±2.42 0.545±0.08 54.94±1.85 40 半透明 105.93±6.13 0.269±0.03 73.98±1.60 45 半透明 76.97±2.50 0.105±0.049 91.13±1.45 50 半透明 91.93±2.60 0.181±0.05 80.27±2.13 55 半透明 112.23±6.37 0.233±0.06 74.15±2.12 (6)探头超声时间的考察
按照2.3.2(5)方法进行研究,结果如表9所示:处理时间较短时,纳米粒径较大,颗粒大小分布不均匀;随着超声处理的延长,粒径减小,包封率也提高;超声时间过长,脂质体结构破坏,导致药物泄露、包封率降低。因此将探头超声处理时间定为90 s。
表 9 超声处理对脂质体的外观澄明度、颗粒大小、对药物包封率的影响超声时间(t/s) 外观 粒径(l/nm) PDI 包封率(%) 30 沉淀 278.09±4.73 0.857±0.10 42.83±2.76 60 半透明 113.21±11.16 0.485±0.04 54.96±2.41 90 半透明 78.13±2.78 0.055±0.02 92.74±0.77 180 半透明 123.17±8.39 0.430±0.08 76.29±1.76 240 沉淀 261.85±4.94 0.915±0.20 50.42±2.74 3.3 紫杉醇棕榈酸酯脂质体PTX-PA/Lip的理化性质表征
综上研究,采用的最优处方和制备工艺如下:精密称取PTX-PA 20 mg、PC98-T 400 mg、DSPE-PEG2000 30 mg,加入适量二氯甲烷溶解,接着45 ℃旋蒸去除有机溶剂,再向圆底烧瓶底部薄膜中加入10 ml重蒸水(预热至同等温度),震荡、水化,得PTX-PA/Lip粗品,最后粗品探头超声(90 s)、过滤(0.22 μm),得最终样品PTX-PA/Lip纳米给药系统。
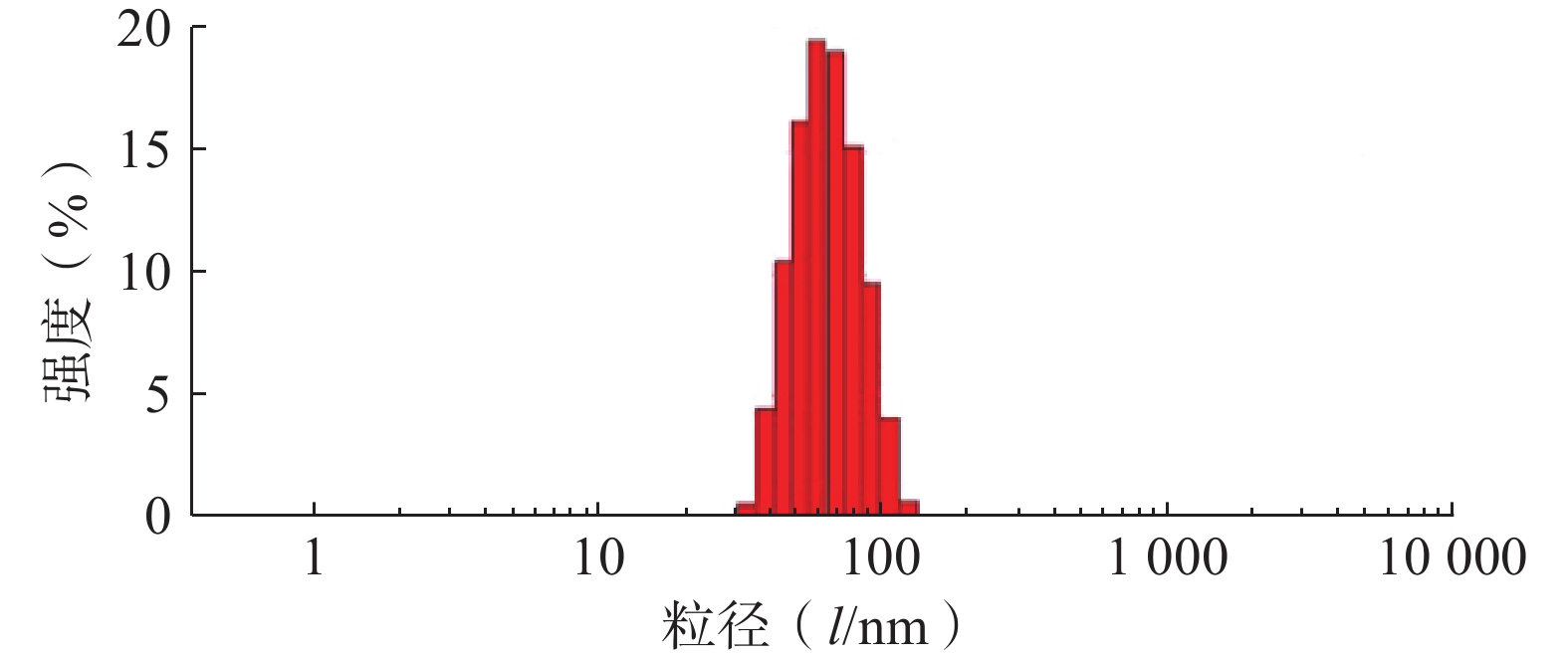
采用Zeta-sizer Nano粒度仪测定最优PTX-PA/Lip的粒径、PDI与zeta电位。结果如图3所示,制备的PTX-PA/Lip脂质体粒径大小为(62.75±1.81) nm,PDI为(0.076±0.020),Zeta电位为(−15.9±0.21) mV,表明制备的PTX-PA/Lip纳米给药系统粒径较小、分布均匀、具有良好的分散性。
4. 总结
本实验合成紫杉醇前药——紫杉醇棕榈酸酯PTX-PA,建立PTX-PA的HPLC定量测定方法,经一系列方法学验证,表明其符合PTX-PA定量分析要求,为后续试验奠定了基础。本实验采用薄膜分散法制备PTX-PA脂质体,工艺简便,技术成熟,并通过单因素筛选对PTX-PA脂质体进行处方优化。本文基于纳米技术成功制备出棕榈酸修饰的紫杉醇脂质体,增强了紫杉醇在靶细胞的递送,为PTX-PA后续的药效学研究奠定基础。
-
表 1 纳入研究基本信息
研究 干预措施 患者例数 HR(95%CI) 相关不良反应* 试验组 对照组 试验组 对照组 总生存期 无进展生存期 CheckMate 9LA[7] 伊普利单抗+纳武利尤单抗+铂类化疗 以铂类为基础的
双重化疗361 358 0.66(0.55-0.80) 0.70(0.57-0.86) ①②③④⑤⑥⑦⑧ TASUKI-52[8] 卡铂+紫杉醇+贝伐珠单抗+纳武利尤单抗 卡铂+紫杉醇+
贝伐珠单抗+安慰剂275 275 0.85(0.66-1.10) 0.56(0.49-0.64) ①②③④⑤⑥⑦⑧ CheckMate 078[9] 纳武利尤单抗 多西他赛 338 166 0.68(0.52-0.90) 0.77(0.62-0.95) ①④⑤⑥⑦⑧ CheckMate 057[10] 纳武利尤单抗 多西他赛 292 290 0.75(0.62-0.91) 0.92(0.77-1.11) ①②④⑥⑦⑧ CheckMate 017[11] 纳武利尤单抗 多西他赛 135 137 0.59(0.44-0.79) 0.62(0.47-0.81) ①②③④⑤⑥⑦⑧ CheckMate 026[12] 纳武利尤单抗 以铂类为基础的化疗 211 212 1.02(0.80-1.30) 1.15(0.91-1.45) ①②③④⑤⑥⑦⑧ CheckMate 227[13] 伊普利单抗+
纳武利尤单抗以铂类为基础的化疗 576 570 0.73(0.64-0.84) 0.79(0.69-0.91) ①②③④⑤⑥⑦⑧ CheckMate 816[14] 纳武利尤单抗+
铂类双重化疗单独铂类双重化疗 179 179 0.57(0.38-0.87) 0.54(0.37-0.80) ①②③④⑤⑥⑦⑧ 注:* ①三级以上不良反应,②恶心,③腹泻,④中性粒细胞减少,⑤皮疹,⑥贫血,⑦食欲下降,⑧疲劳。所有研究均为经组织学或细胞学证实为处于Ⅲ-Ⅳ期的NSCLC患者。 -
[1] SIEGEL R L, MILLER K D, WAGLE N S, et al. Cancer statistics, 2023[J]. CA A Cancer J Clinicians, 2023, 73(1):17-48. doi: 10.3322/caac.21763 [2] TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012[J]. CA A Cancer J Clinicians, 2015, 65(2):87-108. doi: 10.3322/caac.21262 [3] Li C, Lei S, Ding L, et al. Global burden and trends of lung cancer incidence and mortality[J]. Chin Med J(Engl). 2023, 136(13): 1583-1590. [4] Gao S, Li N, Wang S, et al. Lung Cancer in People's Republic of China[J]. J Thorac Oncol. 2020, 15(10): 1567-1576. [5] Sequist LV, Rolfe L, Allen AR. Rociletinib in EGFR-mutated non–small-cell lung cancer[J]. N Engl J Med, 2015, 373(6):578-579. doi: 10.1056/NEJMc1506831 [6] YIN J Q, WU Y J, YANG X, et al. Checkpoint inhibitor pneumonitis induced by anti-PD-1/PD-L1 therapy in non-small-cell lung cancer: occurrence and mechanism[J]. Front Immunol, 2022, 13:830631. doi: 10.3389/fimmu.2022.830631 [7] PAZ-ARES L, CIULEANU T E, COBO M, et al. First-line nivolumab plus ipilimumab combined with two cycles of chemotherapy in patients with non-small-cell lung cancer (CheckMate 9LA): an international, randomised, open-label, phase 3 trial[J]. Lancet Oncol, 2021, 22(2):198-211. doi: 10.1016/S1470-2045(20)30641-0 [8] SUGAWARA S, LEE J S, KANG J H, et al. Nivolumab with carboplatin, paclitaxel, and bevacizumab for first-line treatment of advanced nonsquamous non-small-cell lung cancer[J]. Ann Oncol, 2021, 32(9):1137-1147. doi: 10.1016/j.annonc.2021.06.004 [9] WU Y L, LU S, CHENG Y, et al. Nivolumab versus docetaxel in a predominantly Chinese patient population with previously treated advanced NSCLC: checkmate 078 randomized phase Ⅲ clinical trial[J]. J Thorac Oncol, 2019, 14(5):867-875. doi: 10.1016/j.jtho.2019.01.006 [10] BORGHAEI H, PAZ-ARES L, HORN L, et al. Nivolumab versus docetaxel in advanced nonsquamous non–small-cell lung cancer[J]. N Engl J Med, 2015, 373(17):1627-1639. doi: 10.1056/NEJMoa1507643 [11] BRAHMER J, RECKAMP K L, BAAS P, et al. Nivolumab versus docetaxel in advanced squamous-cell non–small-cell lung cancer[J]. N Engl J Med, 2015, 373(2):123-135. doi: 10.1056/NEJMoa1504627 [12] CARBONE D P, RECK M, PAZ-ARES L, et al. First-line nivolumab in stage Ⅳ or recurrent non–small-cell lung cancer[J]. N Engl J Med, 2017, 376(25):2415-2426. doi: 10.1056/NEJMoa1613493 [13] HELLMANN M D, PAZ-ARES L, CARO R B, et al. Nivolumab plus ipilimumab in advanced non-small-cell lung cancer[J]. N Engl J Med, 2019, 381(21):2020-2031. doi: 10.1056/NEJMoa1910231 [14] Forde PM, Spicer J, Lu S, Provencio M, et al. CheckMate 816 Investigators. Neoadjuvant Nivolumab plus Chemotherapy in Resectable Lung Cancer[J]. N Engl J Med. 2022;386(21): 1973-1985. [15] ZHANG W D, GU J J, BIAN C M, et al. Immune-related adverse events associated with immune checkpoint inhibitors for advanced non-small cell lung cancer: a network meta-analysis of randomized clinical trials[J]. Front Pharmacol, 2021, 12: 686876. -





 下载:
下载:
 下载:
下载: