-
昆仙胶囊是由昆明山海棠、淫羊藿、枸杞子、菟丝子四味中药组成的复方制剂,是国家“九五攻关”项目成果转化的中药六类新药,具有细胞因子拮抗、免疫抑制、抗炎镇痛等作用,临床上用于风湿性关节炎等免疫性疾病的治疗,疗效显著[1-5],这可能与各单味药材中富含生物碱、萜类及黄酮类等多种抗炎镇痛的化学成分密切相关[6-9]。雷公藤甲素为君药昆明山海棠中的二萜内酯类毒性效应成分,且有效剂量和中毒剂量极为相近[10-11],因此,为保证患者用药的安全性及有效性,有必要对昆仙胶囊中雷公藤甲素的含量进行限定。目前,昆仙胶囊现有的质量控制标准中仅对组方中的淫羊藿和枸杞子进行薄层鉴别,含量测定项下则监测雷公藤甲素和淫羊藿苷的含量,但通过实验发现雷公藤甲素的含量测定方法仍然存在前处理方法复杂,含量低,重现性及检测成分专属性差等亟待改进的问题,同时,原检验项目的设置也不够全面,难以对昆仙胶囊实现整体性质量控制。因此,本实验采用薄层色谱法补充建立方中所有药味的薄层鉴别方法,并改良了昆仙胶囊中微量毒效成分雷公藤甲素的含量测定方法,为提升该制剂的质量标准研究提供实验依据。
-
Linomat-Ⅵ薄层色谱自动点样器、Reprostar3薄层色谱摄像仪(瑞士CAMAG 公司);Agilent1260高效液相色谱仪,包括输液泵、自动进样器、柱温箱、二极管阵列检测器(美国Agilent公司);BP211D十万分之一电子天平(德国Sartorius公司);KQ-250DB数控超声波清洗器(昆山市超声仪器有限公司)。
-
雷公藤甲素(含量:99.8%,批号:111567-201404)、淫羊藿苷(含量:94.2%,批号:111737- 01516)、金丝桃苷(含量:94.9%,批号:111521-201809)对照品,以及对照药材:昆明山海棠(批号:121203-201503)、淫羊藿(批号:121632-201502)、菟丝子(批号:121232-201403)均购自中国食品药品检定研究院;21批昆仙胶囊以及各阴性样品均由广州白云山陈李济药厂有限公司提供,胶囊的批号分别为:K31002、K31005、K31006、K31007、K31008、K31009、K31010、K31011、K31012、K31013、K31014、L31001、L31002、L31003、L31004、L31005、L31006、L31007、L31008、L31009、J31002,分别编号为S1~S21。乙腈、甲醇、甲酸均为色谱纯,水为杭州娃哈哈纯净水,其余试剂均为分析纯。
-
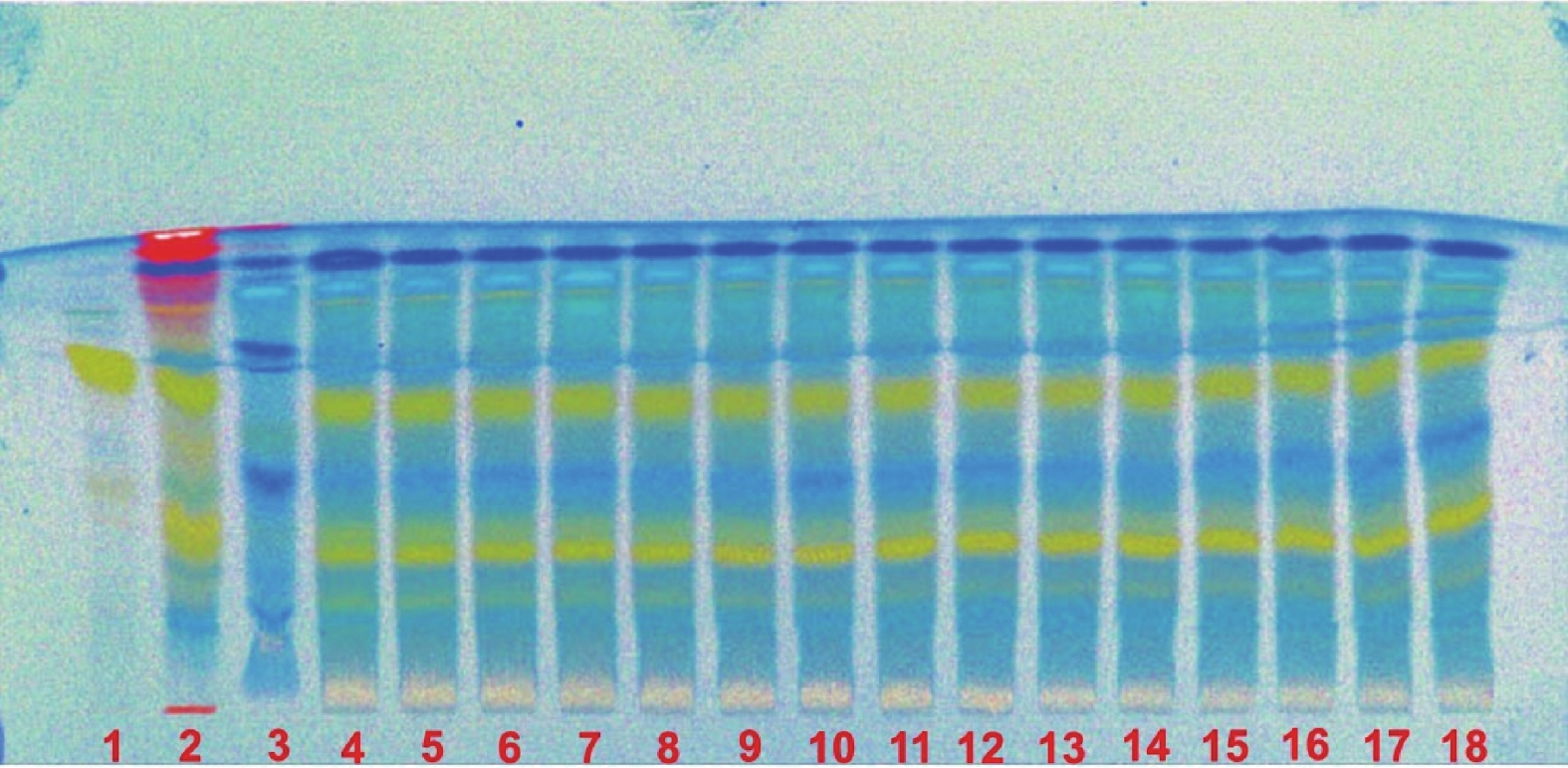
取昆仙胶囊内容物6 g,放入500 ml具塞锥形瓶中,加入300 ml甲醇,超声30 min,过滤,将滤液减压浓缩至干,残渣加40 ml水溶解,二氯甲烷萃取2次,每次40 ml,并于萃取过程中加5 ml饱和NaCl水溶液,合并二氯甲烷萃取液,减压浓缩至干,残渣加少量甲醇溶解,加1 g硅胶(200~300目)拌样,称4 g硅胶装入直径为2 cm的柱子,上柱。先用120 ml石油醚-乙酸乙酯(3∶1)洗脱,再以120 ml石油醚-乙酸乙酯(2∶1)洗脱,收集洗脱液,减压浓缩至干,残渣加入2 ml甲醇溶解,作为供试品溶液。另取昆明山海棠对照药材10 g,同法制备残渣后,加2 ml甲醇溶解,作为对照药材溶液。再取雷公藤甲素对照品加甲醇制成1 ml含0.5 mg的溶液,作为对照品溶液。按照薄层色谱法(通则0502)试验,分别吸取对照品溶液5 μl,对照药材溶液及供试品溶液各10 μl,分别点于同一高效硅胶G薄层板上,以二氯甲烷-丙酮(12∶1,V/V)为展开剂,展开,取出,晾干,喷以2%香草醛的10%硫酸乙醇溶液,105ºC加热至斑点显色清晰。日光下,供试品色谱中,在与对照药材和对照品色谱相应的位置上,显相同颜色的斑点,阴性无干扰(见图1)。
-
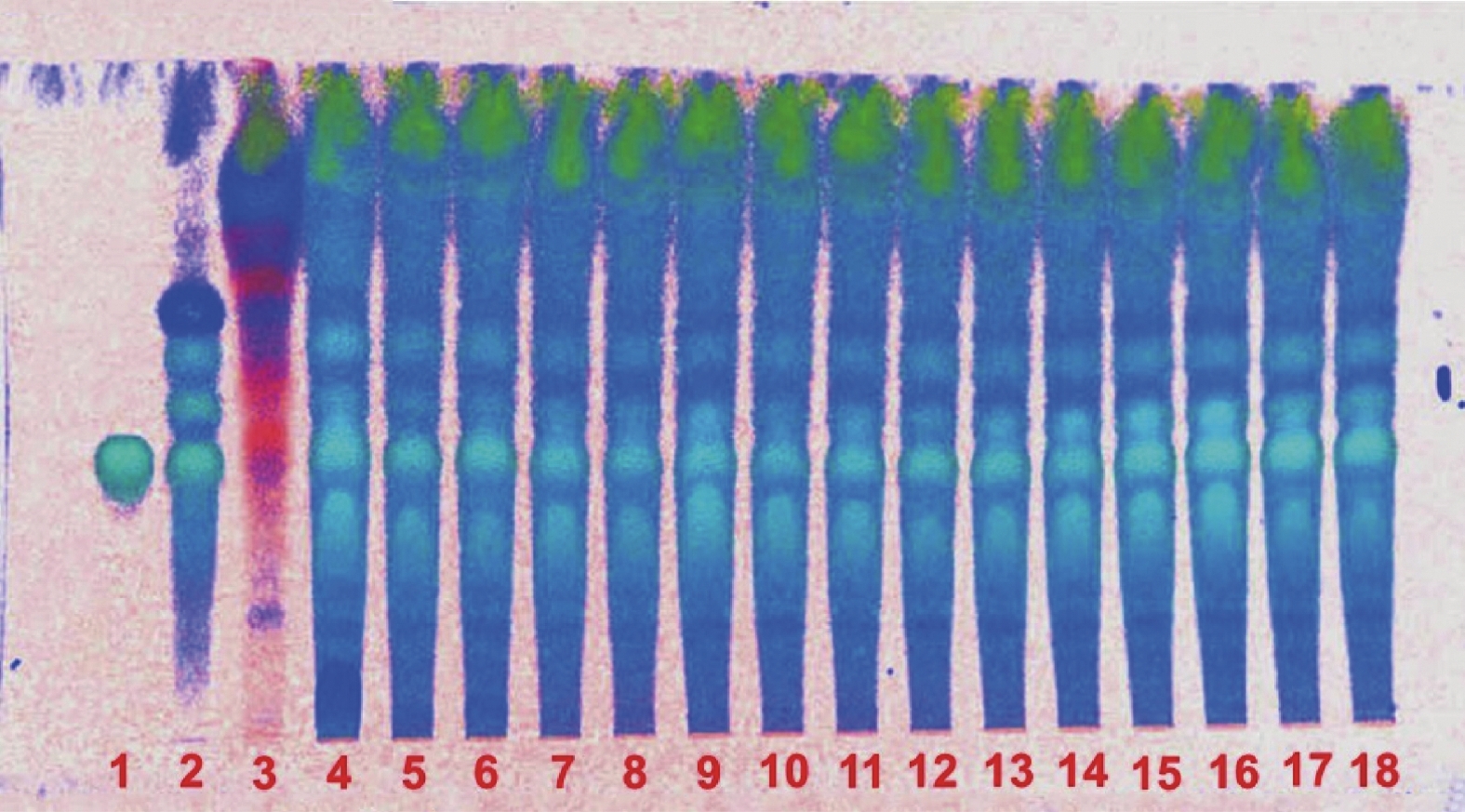
取本品内容物50 mg,加70%乙醇2 ml溶解,滤过,作为供试品溶液。另取淫羊藿对照药材0.5 g,加乙醇10 ml,40~60℃温浸30 min,滤过,滤液蒸干,残渣加乙醇l ml使溶解,作为对照药材溶液。再取淫羊藿苷对照品加乙醇制成1 ml含0.5 mg的溶液,作为对照品溶液。按照薄层色谱法(通则0502)试验,吸取上述3种溶液各5 μl,分别点于同一高效硅胶G薄层板上,以二氯甲烷:甲醇:水:甲酸(7∶3∶1∶0.2)的下层溶液为展开剂,展开,取出,晾干,喷以三氯化铝试液,烘干,置紫外光灯(365 nm)下检视,供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的荧光斑点,阴性无干扰(见图2)。
-
取本品内容物50 mg,加70%乙醇2 ml溶解,滤过,作为供试品溶液。另取菟丝子对照药材0.5 g,加乙醇40 ml,超声30 min,滤过,滤液浓缩至5 ml,作为对照药材溶液。再取金丝桃苷对照品加乙醇制成1 ml含0.3 mg的溶液,作为对照品溶液。照薄层色谱法(通则0502)试验,吸取上述对照药材及金丝桃苷对照品溶液各2 μl,供试品溶液5 μl,分别点于同一聚酰胺薄膜板上,以乙酸乙酯:甲醇:水:甲酸(12∶2∶1∶1)为展开剂,展开,取出,晾干,喷以三氯化铝试液,105 ºC加热至斑点显色清晰,置紫外光灯(365 nm)下检视,供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的荧光斑点,阴性无干扰(见图3)。
-
色谱柱:Agilent ZORBA SB-C18(4.6 mm×250 mm, 5 μm);流动相:乙腈(C)-0.1%甲酸水溶液(A);梯度洗脱:0~10 min,15%→23% C;10~35 min,23%→26% C;35~40 min,26%→26% C;40~41 min,26%→98% C;41~52 min,98%→98% C;检测波长:220 nm(紫外检测时间40 min);柱温:30 ℃;流速:0.8 ml/min;进样量:10 μl。
-
取雷公藤甲素对照品,加甲醇制成每毫升含502 μg雷公藤甲素溶液,作为对照品储备溶液。
-
取昆仙胶囊内容物约6 g,精密称定,其余步骤同“2.1.1”项下的方法,制得供试品溶液。
-
取缺昆明山海棠的阴性样品适量,按照“2.1.1”项下的方法操作,制得阴性对照溶液。
-
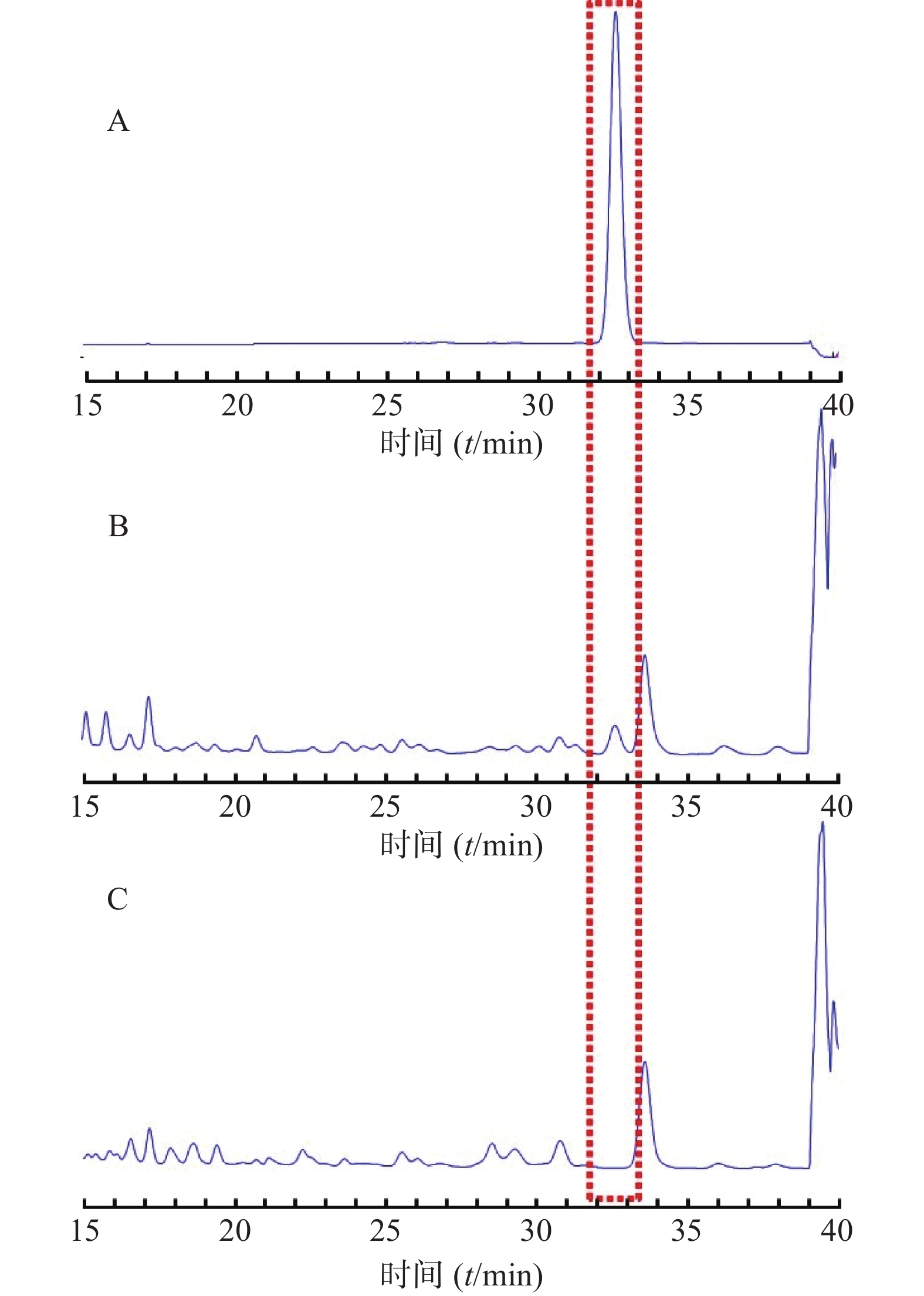
分别精密吸取对照品溶液、供试品溶液、阴性对照溶液各10 μl,按“2.2.1”项下色谱条件分析,结果显示,其与相邻色谱峰的分离度大于1.5,拖尾因子在0.95~1.10,理论塔板数在5000以上,且阴性样品在各色谱峰的位置上未见干扰,说明该方法专属性良好,其HPLC图谱见图4。
-
将雷公藤甲素对照品储备液用甲醇稀释制成每毫升含502.00、401.60、200.80、100.40、50.20、40.16 μg的系列溶液,分别吸取10 μl注入液相色谱仪,记录色谱图,以峰面积Y对质量浓度X(μg/ml)进行线性回归,得回归方程:Y=24.459X+347.82,r= 0.999 5,线性范围为40.16 ~502.00 μg/ml。
-
取雷公藤甲素对照品溶液(100.4 μg/ml),进样10 μl,连续进样6次,测定峰面积,结果显示雷公藤甲素的平均峰面积为2813.93,RSD为0.19%,表明仪器精密度良好。
-
按照供试品溶液制备方法,平行制备6份供试品溶液,分别进样10 μl,测定峰面积,结果表明,雷公藤甲素的平均含量为0.0097 mg/粒,RSD为3.57%,表明该方法重复性较好。
-
取某一批次(L31008)样品,制备成供试品溶液,分别于0、3、6、9、12、24、36、48 h分别进样测定雷公藤甲素的峰面积,结果显示雷公藤甲素平均峰面积为2647.16,RSD为1.53%,说明供试品溶液在48 h内稳定。
-
分别精密称取6份已知含量的样品约6 g,精密称定,置于具塞锥形瓶中,按照接近1∶1的量计算所需添加的雷公藤甲素对照品溶液,加入到样品中,按“2.2.3”项下方法平行制成6份供试品溶液,进样10 μl,记录峰面积,结果显示雷公藤甲素的平均回收率为98.12%,RSD为8.25%,说明该方法准确度较好,计算结果见表1。
表 1 雷公藤甲素的加样回收率试验结果(n=6)
样品量(m/mg) 加入量(m/mg) 测得量(m/mg) 回收率(%) 平均回收率(%) RSD
(%)0.097 6 0.097 9 0.188 7 92.98 98.12 8.25 0.097 6 0.097 9 0.181 8 85.92 0.097 6 0.097 9 2.050 5 109.71 0.097 6 0.097 9 1.937 0 98.11 0.097 6 0.097 9 1.972 9 101.78 0.097 6 0.097 9 1.957 8 100.23 -
分别取每批昆仙胶囊粉末约6 g,精密称定,按“2.2.3”项下的方法制成供试品溶液,每批样品平行制备2份,每份进样3针,进样量10 μl,记录峰面积,计算结果见表2。
表 2 21批次昆仙胶囊中雷公藤甲素的含量测定结果
批号 平均含量(mg/粒) 批号 平均含量(mg/粒) S1 0.010 3 S12 0.011 7 S2 0.009 2 S13 0.011 2 S3 0.009 1 S14 0.013 3 S4 0.005 9 S15 0.008 8 S5 0.011 7 S16 0.012 6 S6 0.009 0 S17 0.012 2 S7 0.006 5 S18 0.007 0 S8 0.007 6 S19 0.009 8 S9 0.011 6 S20 0.008 8 S10 0.010 2 S21 0.011 8 S11 0.008 4 -
本研究采用TLC法补充了昆仙胶囊全药味的鉴别方法,各项方法重复性好,专属性强,且阴性无干扰。与原标准相比,改良后的淫羊藿药材的薄层鉴别方法所获得的斑点分离度更佳,比移值适中;新增的昆明山海棠药材薄层法中点状点样优于条带状点样,喷以2%香草醛的10%硫酸乙醇溶液显色方式优于10%硫酸乙醇溶液显色;新增的菟丝子药材薄层鉴别中,按照2020版中国药典中菟丝子的鉴别方法以甲醇-冰醋酸-水(4∶1∶5)为展开剂时[12],所获得的目标斑点分离度及成点性均差,而以乙酸乙酯-甲醇-水-甲酸(12∶2∶1∶1)为展开剂时,所获目标斑点的成点性及分离度均得到有效改善。但由于所测成分化学性质相差较远,尚无法实现“一板多测”。
-
由于本品成分复杂,雷公藤甲素又属于微量成分,需对昆仙胶囊的前处理条件进行优化。首先,我们参考了厂家的前处理方法,即利用甲醇提取蒸发浓缩后,直接过氧化铝-硅胶柱纯化,结果得到的目标化合物含量较低,操作方法可重复性差,且液相色谱中雷公藤甲素分离度较差,易受其他化合物干扰。为此,我们又尝试通过甲醇提取,再多次萃取富集纯化的方法,均不能实现有效的测定。进而,我们结合厂家的方法,对我们的方法进行了优化,最终确定为甲醇超声提取后,用二氯甲烷萃取,然后通过硅胶柱再次富集和纯化目标成分,最终不仅提高了HPLC法检测雷公藤甲素含量的上限,且大大减少了其他化合物对目标色谱峰的干扰。整个前处理过程,还比较了不同的提取溶剂和萃取溶剂的效果,结果均不如本法。
-
由于样品中其他黄酮类成分的含量相对较高,按照现行部颁标准中的液相方法测定目标成分时,容易出现色谱柱对目标成分的分离效果差,含量测定结果的重复性、重现性不理想,RSD较大等问题。为此,本实验又对定量测定雷公藤甲素含量的色谱条件进行了优化,主要比较了不同色谱柱(Diamonsil C18、Agilent ZORBA SB-C18、Amethyst C18及Waters SunFireTm C18),不同流动相(乙腈-0.1%甲酸水溶液、乙腈-0.2%甲酸水溶液、乙腈-0.1%磷酸水溶液、乙腈-水、甲醇-0.1%甲酸水溶液),不同柱温(25、30、35、40 ℃)及不同体积流量(0.8、0.9、1.0 ml/min)对雷公藤甲素色谱峰的影响,最终以Agilent ZORBA SB-C18为色谱柱、乙腈-0.1%甲酸水溶液为流动相、柱温为30 ℃及流速为0.8 ml/min时,目标峰分离完全,效果最佳。
综上,本文建立的昆仙胶囊薄层鉴别及雷公藤甲素含量测定的方法,不仅弥补了昆仙胶囊全药味薄层鉴别的研究,同时也解决了现行标准中雷公藤甲素难测定,重复性差等难点,为完善昆仙胶囊的质量评价提供了依据。
Improvement of the quality standard for Kunxian capsules
-
摘要:
目的 提升昆仙胶囊质量标准,以有效地控制产品质量。 方法 以雷公藤甲素、淫羊藿苷、金丝桃苷为指标性成分,增加或改进昆明山海棠、淫羊藿及菟丝子的薄层鉴别方法;以Agilent ZORBA SB-C18(4.6 mm×250 mm, 5 μm)为色谱柱,以乙腈-0.1%甲酸水溶液为流动相,以220 nm为检测波长,改良雷公藤甲素的HPLC含量测定方法。 结果 昆明山海棠、淫羊藿及菟丝子的TCL法鉴别专属性强,特征斑点分离度良好、清晰,阴性无干扰;定量分析结果显示雷公藤甲素的质量浓度在40.16~502.00 μg/ml范围内与峰面积呈良好线性关系(r=0.999 5),平均加样回收率为98.12%,RSD为8.25%,准确度良好。 结论 本实验所建立的TLC鉴别方法和HPLC含量测定方法专属性强、重现性好,能有效地控制昆仙胶囊的质量。 Abstract:Objective To improve the quality standards of Kunxian capsules (KC) and effectively control the product quality. Methods Triptolide, icariin and hypericin were used as the indicator components, to increase or improve the thin layer chromatography (TLC) identification methods of Kunming begonia, epimedium and dodder. Agilent ZORBA SB-C18 (4.6 mm×250 mm, 5 μm) as a chromatographic column, the HPLC method for the determination of triptolide was improved with acetonitrile-0.1% formic acid solution as the mobile phase and 220 nm as the detection wavelength. Results The spots in the TLC method of Kunming begonia, epimedium and dodder has strong specificity, good and clear separation of characteristic spots, negative and no interference. The quantitative analysis of the content of triptolide in KC showed that there is a good linear relationship (r=0.9995) between the mass concentration of triptolide and the peak area in the range of 40.16-502.00 μg/ml, the average recovery was 98.12%, RSD was 8.25%, and the accuracy was good. Conclusion The TLC identification method and HPLC method established in this experiment have strong specificity and good reproducibility, and can effectively control the quality of KC. -
Key words:
- Kunxian capsules /
- TLC /
- triptolide /
- HPLC /
- quality standards
-
密闭环境中人体可能产生诸多心理、生理上改变,如电梯故障被困、地震后掩埋、空间站、载人飞船、潜艇作业等。这主要与密闭特殊环境有关,如通风较差使空气质量下降,缺少正常光照或仅有人工光照导致节律紊乱,活动量大大减少引起机体功能下降等。同时密闭环境作为特异性应激源会对心理造成极大影响,如感觉剥夺、睡眠障碍、情绪功能失调、认知功能受损、内分泌失调、代谢失调等[1],大大影响了工作效率和生活质量。本文综述了密闭环境影响脑功能的机制、模型建立、评价指标及治疗的潜在药物,以期为密闭环境中脑功能维持提供有效干预措施。
1. 密闭环境影响脑功能的可能机制
长期处于密闭环境作业易产生焦虑、烦躁等情绪,也更容易感到疲惫,影响正常认知和工作效率。早期发现并及时干预对防止关键任务中失误的发生至关重要[2]。认知从广义上讲包含人的所有意识活动,如感知、记忆、思维、想象、学习、理解等。从狭义上讲,认知等同于记忆或思维。认知是一种信息加工过程,具体可分为刺激的接收、编码、存储、提取和利用等不同阶段。密闭环境可通过不同机制诱发负面情绪而影响认知。
1.1 影响神经可塑性
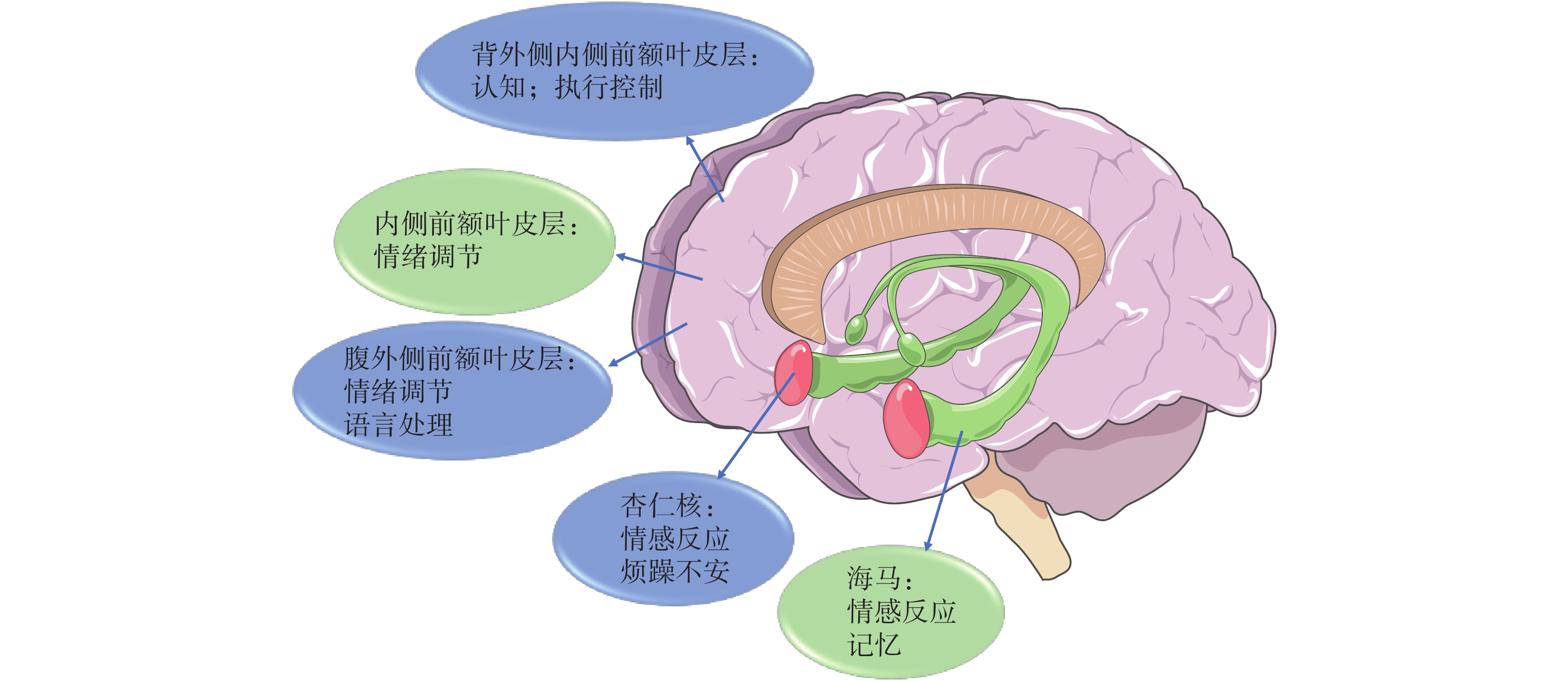
神经可塑性是大脑对环境变化灵活调整和重组的能力,是适应性功能的基础[3]。额叶皮层被认为是人类大脑进行认知和情绪处理的主要实体。长期处于密闭环境中会产生神经可塑性损伤,如内侧前额叶皮层和海马的神经元萎缩、突触丢失进而导致慢性应激和抑郁样行为出现[4](图1)。通过功能磁共振成像技术(fMRI)等神经成像方法研究发现,神经可塑性(如突触连接障碍)与大脑“输出”(即心理和认知过程)的下游变化密切相关。
隔离密闭环境会造成小鼠大脑海马区神经元和杏仁核体积减少[5],还会影响额叶皮层与控制人类情感与情绪的海马体、杏仁核之间的联系,进而影响额叶皮层与大脑其他区域间的整体性。对191名患者和282名健康对照者研究发现,与健康对照者相比,早期(首发)抑郁症患者的海马区左侧平均体积减少4%,右侧平均体积减少4.5%[6]。因此,神经可塑性受损也被认为是抑郁症的前提。且抑郁状态对海马体等的影响与发作时间呈正相关。
总之,密闭环境对认知结构和神经回路的可塑性改变可能首先导致认知障碍,继而降低了人在复杂环境中的灵活性和适应性,在策略规划和组织方面存在中度损伤,注意力和集中力也普遍受损。
1.2 影响神经递质
去甲肾上腺素、多巴胺和5-羟色胺是广泛分布于脑中的重要单胺类神经递质[7] 。长期密闭环境所造成的压力可能导致这些单胺类神经递质合成减少,继而引起中枢和外周疾病,如抑郁、焦虑、强迫症、饮食和睡眠障碍、高血糖、免疫反应降低等,而上述疾病则会直接影响情绪和认知。
2. 与密闭环境有关的脑部疾病
2.1 焦虑、抑郁等情绪问题
与久坐不动的人相比,坚持锻炼人群患焦虑症的风险大大降低,足够的体育锻炼可对焦虑等负面情绪起到积极改善作用[8]。习惯性体育活动的减少会增加年轻成年人的抑郁症状[9]。长期处于密闭太空舱中的宇航员必须借助相应器械设备进行足够的体育锻炼来对抗长期密闭环境下监禁导致的情绪和心理障碍[10]。
2.2 创伤后应激障碍
创伤后应激障碍(PTSD)是一种已知原因的主要精神障碍,即对自身或他人造成威胁并引起强烈恐惧、无助而造成的心理障碍[11]。长期处于密闭环境中的人会产生抑郁、焦虑等负面情绪,进而可能导致创伤后应激障碍。研究发现,创伤后应激障碍出现会伴随着海马体糖皮质激素受体水平升高、腹内侧前额叶谷氨酸水平和海马N-甲基-D-天冬氨酸受体(NMDA)水平异常、5-羟色胺受体基因的表达异常等[12]。而这些因子水平异常和相关基因表达的异常会导致不良情绪消退受损或恐惧等不稳定情绪的加强。
3. 常见密闭环境模型建立及评价指标
3.1 密闭环境导致脑功能损伤模型
3.1.1 草原田鼠
草原田鼠是研究社会应激反应神经生物学机制的常用动物模型[13]。将实验所用草原田鼠在21日龄时从繁殖对中移除,雌性与雄性分别饲养,直到实验开始。取一定数量的雄性草原田鼠(60~90天),随机平均分成两组。对照组田鼠在正常环境中饲养;实验组田鼠放置于自动进行12 h∶12 h明暗循环的密闭不透光笼子内,保持20~21°C室温和40%~50%相对湿度,允许动物自由接触食物和水,在此条件下隔离四周。注意保证对照组和实验组除密闭生存环境外其他实验条件(食物、水等)完全一致[14]。
3.1.2 大鼠
大鼠是常用动物模型,可用于建立应激模型。首先对大鼠进行适应性饲养两周,设置12 h光照/黑暗周期,8:00~20:00开灯;温度为(22±2)˚C;湿度为50%±10%,可自由获取食物和水,有充足空间进行活动,饲养环境为可视状态。在正式实验之前,挑选出80只在野外水平测试得分在30到120之间的大鼠。将合格的80只大鼠随机分成两组。对照组(n=40)继续被饲养在适应性饲养相同的条件下,且大鼠彼此之间不相互隔离;实验组(n=40)每只大鼠被单独关在独立的笼子里,笼子仅有有限的通道与外界进行空气流通,笼子为不透光的密闭环境,除此之外其他条件与对照组相同[15]。两组大鼠在实验条件下饲养两周后进行行为学测试。
3.2 常用评价指标
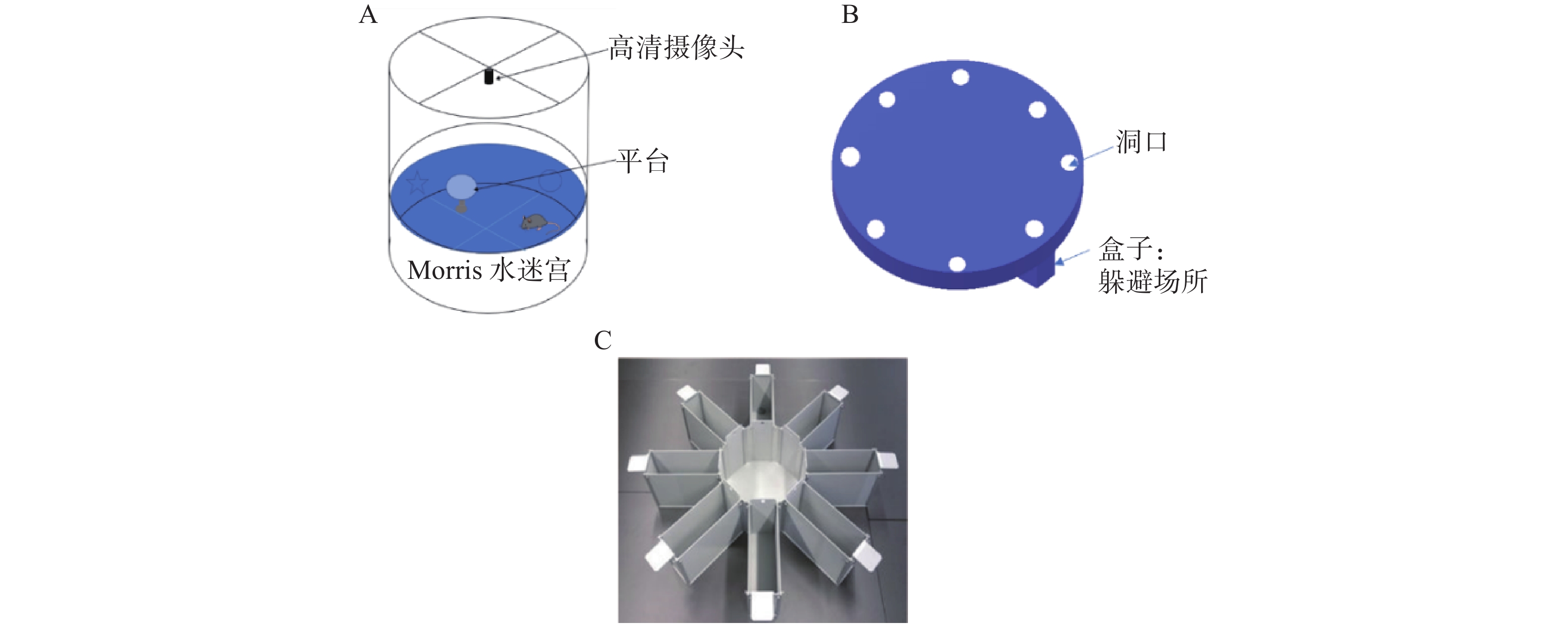
药物干预后是否能有效改善脑功能可采用相关行为学方法进行评价,如Morris水迷宫、Barnes迷宫、八臂电迷宫等。常用啮齿类动物研究学习和记忆功能,因为它们在新环境中可有效定位,并以与人类相似的方式学习复杂的空间关系。评价量表仅限于人类认知功能评估。
3.2.1 Morris水迷宫
Morris水迷宫有助于阐明啮齿类动物空间学习和记忆的基本过程,评价认知能力[16]。Morris水迷宫基本操作过程是将模型动物放在一个圆形游泳池中,大鼠用泳池直径为210厘米,小鼠用泳池直径为122厘米[17](图2A)。首先训练其记忆水中平台位置并顺利登上平台,在此过程中,动物通过记忆在脑中形成位置导航会很快发现平台。记录动物从入水到登上平台的时间即为逃避潜伏期。空间探索试验是在定位航行试验后去除平台,然后任选一个入水点将动物放入水池中,记录其在一定时间内的游泳轨迹,记录穿越原平台位置的次数,考察动物对原平台的记忆。
3.2.2 Barnes迷宫
Barnes迷宫基本操作是将模型动物安置在一个明亮的圆形平台中心,平台上有洞,只有一个洞口下面连有一个黑色逃生箱(图2B)。为了学习和记住黑暗目标洞的位置,啮齿动物必须根据视觉远端线索形成空间地图。评价指标如下[18]:(1)到达目标箱的逃逸潜伏期:首次找到目标洞之前的时间。(2)到达目标箱的错误次数:首次找到目标洞之前探究其他洞的次数。一次错误定义为动物把头伸向或探究任何一个非目标洞,包括专注于探究同一个非目标洞。(3)搜索策略:动物使用三种不同的策略来探索迷宫,即随机的、连续的、空间的。随机策略,动物随机无序搜索穿行迷宫;连续策略,动物以顺时针或逆时针方式连续搜索相邻的孔;空间策略,动物在搜索目标孔之前会直接移动到目标孔或目标孔相邻1~2个孔,这通常在非认知障碍动物中几次连续训练后即出现。
3.2.3 八臂电迷宫法
八臂电迷宫是一种研究动物空间记忆的迷宫模型,主要用于评估空间记忆和长期记忆。八臂电迷宫装置有辐射状均匀分布的八个通道,分为放置食物的食饵臂和给予电刺激的空食饵臂(图2C)。大鼠进入迷宫中央后需要通过寻找进入食饵臂获取食物,若进入空食饵臂则会被电击,通过多次训练形成空间记忆,避免电击,快速获取食物[19]。分别对实验组和对照组大鼠进行7天的八电臂迷宫训练实验后分别测试2组大鼠移动距离、移动速度、总体耗时、参考记忆错误以及工作记忆错误等实验指标,以评估大鼠空间学习记忆的探索能力[20]。
3.2.4 评价量表
评价量表只能用于评估人类认知功能。触摸面板型痴呆评估量表是阿尔茨海默氏病评估量表-认知亚量表的改进版本。在该量表中,受试者根据指令直接将答案输入触控面板式计算机。9项测试项目包括“单词识别” “服从命令” “视觉空间感知” “过程顺序的准确性” “命名手指” “方向” “金钱计算” “物体识别”和“时间识别”。分数从0分(全部正确)到101分(全部错误)不等[21] 。
简易智力状态检查量表(Mini-mental State Exa-mination, MMSE)是目前应用最广泛的认知功能定量评估工具之一,只需要5~10 min完成测试。它能全面、准确、迅速地反映被试者智力状态及认知功能缺损程度。量表由11个评估不同认知功能的问题组成,包括2个方向问题,1个注册问题,1个记忆问题,5个语言问题,1个注意和计算问题,1个视觉建构问题。其他量表也可酌情使用。
4. 提高脑功能的药物
对密闭环境引起的脑功能下降,以对症治疗为主,主要包括抗抑郁、抗焦虑药物和改善认知能力药物(表1)。除了常见的选择性5-羟色胺再摄取抑制剂(SSRIs)用作抗抑郁、抗焦虑外,天然药物在治疗抑郁症、改善认知方面也显示出广阔前景[22] ,如肉苁蓉、薰衣草、西番莲、藏红花、黑升麻、洋甘菊和荆芥等[23],赖氨酸和镁离子、维生素也具有镇静、保持清醒、治疗焦虑等疗效[24]。
表 1 已上市的改善认知障碍药物种类 名称 胆碱酯酶抑制剂 加兰他敏、多奈哌齐 兴奋性氨基酸受体拮抗剂 盐酸美金刚 麦角碱类药物 二氢麦角碱、尼麦角林 神经营养剂 叶酸、维生素B12、B1 抗氧化剂 银杏叶片、维生素E、C 中药制剂 苁蓉总苷胶囊 除用药物改善脑功能增强认知外,还可通过调节合理的饮食结构来增强认知能力,如控制好脂肪和糖的摄入,对增强认知能力有很好的辅助作用。
4.1 化学药物
4.1.1 选择性5-羟色胺再摄取抑制剂
脑中5-HT的水平是决定抑郁情绪的关键因素,当5-HT水平较低时会导致抑郁、焦虑等负面情绪出现。几十年来,SSRIs一直作为抑郁、焦虑治疗的一线用药,常见的有氟西汀、帕罗西汀、舍曲林、氟伏沙明、西酞普兰等,通过选择性抑制中枢神经系统突触前神经元对5-羟色胺的再摄取,提高突触间隙5-羟色胺浓度而发挥抗抑郁作用以及缓解焦虑情绪的作用[25]。服用SSRIs后,缺乏5-HT自身受体的小鼠腹侧海马体中5-HT水平增加,焦虑样行为减少。SSRIs的出现是精神类疾病治疗的一大突破,相比于其他药物它的副作用得到了极大的改善。
虽然SSRIs对抑郁症状有改善,但治愈率较低,复发风险较高。此外,大多数抗抑郁药物会产生一些不良反应,如抗胆碱能作用、直立性低血压、心律失常和性功能障碍等[26];同时还可能存在起效延迟、耐受性、滥用(如苯二氮䓬类、普瑞巴林)等问题。密闭空间所致的焦虑、抑郁等情绪问题多数程度较轻,治疗药物选择原则为有效、毒性小、不良反应少、尽量减少药物戒断反应。
4.1.2 哌醋甲酯及其类似物
哌醋甲酯是一种拟交感神经药物,在中枢神经系统中与儿茶酚胺竞争大脑前额叶皮层的结合位点,阻断多巴胺和去甲肾上腺素转运体,导致突触细胞外多巴胺和去甲肾上腺素水平升高而发挥改善注意力和认知能力的作用[27]。哌醋甲酯用于治疗注意缺陷障碍和发作性睡病已有数十年,近年也被用于增强认知和作为兴奋剂,但不规范使用会引起急性中毒和死亡[28]。所以应密切监控哌醋甲酯及其类似物用于治疗认知障碍。
4.1.3 吡拉西坦及其类似物
吡拉西坦及其类似物是大脑功能调节剂,可用于治疗认知障碍和中枢神经系统疾病[29],如认知/记忆下降、癫痫和癫痫发作、神经退行性疾病、中风、脑缺血、压力过大和焦虑[30]等。它与脑中目标受体结合后,可调节神经递质、神经激素和/或突触后信号的兴奋和/或抑制过程,影响信号传输,最终改善认知。吡拉西坦能增加大脑中氧气利用率,并增加细胞和线粒体膜对三羧酸循环中间物的通透性[31]。俄罗斯已批准苯吡拉西坦作为治疗脑血管病、抑郁症、冷漠、注意力和记忆力下降的处方药,建议宇航员在太空中可用于提升生理和认知能力。
4.1.4 镁
镁对人的情绪稳定具有重要作用,包括改善躁狂症、快速循环型双相情感障碍、慢性疲劳综合征等[32]。低镁血症会增加啮齿类动物抑郁行为,提升小鼠焦虑状态;而适量补充镁可降低焦虑相关行为[33]。镁与维生素B6联用可提高焦虑、抑郁等情绪问题的治疗效果[34]。镁对情绪调节作用可能基于镁能调节下丘脑-垂体-肾上腺轴,继而调节应激反应而改善焦虑状态。
4.2 中药
4.2.1 藏红花
藏红花中主要生物活性化合物包括番红花醛、番红花苷和苦红花苷[35],具有抗氧化、抗肿瘤、记忆增强、神经保护、心脏保护、抗焦虑和抑郁、调节情绪等药理作用[36]。其抗抑郁作用与氟西汀、丙咪嗪和西酞普兰等相当,主要来源于藏红花柱头中的抗氧化成分藏红花苷[37]。藏红花是治疗轻度焦虑和抑郁的有效药物。
4.2.2 薰衣草
薰衣草被广泛应用于植物疗法和芳香疗法,以治疗中枢神经系统紊乱,如焦虑,压力和睡眠障碍。薰衣草精油的抗躁动和抗抑郁作用可能部分归因于两种主要萜类成分——芳樟醇和乙酸芳樟醇。这两种萜类成分可通过抑制电压门控钙通道、降低5-羟色胺受体活性、增加副交感神经张力、对NMDA受体的调节作用以及对5-羟色胺转运蛋白的抑制而产生抗焦虑作用[38],薰衣草精油还能保护SH-SY5Y细胞免受过氧化氢引起的神经毒性[39]。吸入给药的薰衣草精油通过嗅球途径调节杏仁核和海马中与情绪和记忆相关的边缘输入。
4.2.3 西番莲
西番莲曾被用作抗焦虑剂、抗躁动药物等。西番莲提取物中含有神经保护次生代谢物,可减轻癫痫小鼠癫痫发作的严重程度、改善认知功能障碍和抗氧化应激,改善脑功能,提高学习和记忆能力[40]。一项双盲安慰剂对照研究比较了奥沙西泮和西番莲在符合一般焦虑症标准的患者中的疗效差异[41]。结果显示两种抗焦虑药在治疗一般焦虑症方面没有差异。西番莲组受试者认知损伤表现低于阳性药组,但阳性药受试者症状缓解更快。西番莲作为一种药食同源的药物可用于治疗轻度焦虑和抑郁。
4.2.4 贯叶连翘
贯叶连翘又名圣约翰草,主要成分为金丝桃素和贯叶金丝桃素,它能以非竞争性协同方式影响多种神经递质,具有促智作用,被认为是一种抗抑郁和抗焦虑剂。与其他抗抑郁药类似,贯叶连翘可抑制再摄取单胺类神经递质(5-羟色胺、去甲肾上腺素和多巴胺),增加海马、下丘脑、杏仁核和前额叶皮质等脑区细胞外空间中5-羟色胺和其他单胺类物质的浓度[31]。上述区域中5-羟色胺上调可减少影响记忆的负面因素。贯叶连翘对健康啮齿动物的认知能力有积极影响,对应激受损啮齿动物的影响更大。因此,贯叶连翘除用于治疗抑郁症外,也可用于改善认知障碍[27]。
4.2.5 丹参
丹参中主要含有姜黄素、咖啡酸、丹酚酸、香豆素、紫草酸、黄酮类化合物(木犀草素、芹菜素、槲皮素)熊果酸等大量活性成分,对记忆、注意力和学习在内的认知能力有明显提升,可用于预防神经退行性疾病(如阿尔茨海默病)[42]。丹参精油提取物和丹参叶提取物对空间记忆的改善有显著作用。两种提取物的组合使用可以提高长期记忆。丹参的慢性作用机制可能与蛋白激酶的调节有关,蛋白激酶参与记忆和学习过程,它涉及到许多神经元功能的形成,尤其是神经递质代谢、神经元信号转导(离子和通道活性)、突触可塑性等。为了确定丹参在神经元功能中的作用,具体的通路还有待阐明,丹参改善认知等的相关作用机制还需进一步研究调查。研究发现,使用丹参提取物后小鼠在Morris水迷宫中实现任务和执行任务的能力得到提升[43],事实表明丹参是一种潜在的避免记忆丧失或提高认知能力的药物。
此外,我们要重点关注饮食对认知能力的影响。血糖生成指数低的食物能提高注意力、记忆和认知能力,而摄入大量富含单糖的食物则易导致注意力难以集中[44]。大脑需要连续不断的氨基酸来合成神经递质,特别是血清素和儿茶酚胺。低水平血清素与学习、推理、记忆能力下降有关。膳食脂肪含量和类型也会影响智力。高饱和脂肪的摄入会导致认知能力下降,而多不饱和脂肪酸(如二十二碳六烯酸)的摄入能预防认知能力下降。补充Omega-3和姜黄素已被证明对健康老年人和疾病状态认知功能下降有积极的改善作用,可提高记忆能力并降低认知功能退化。维生素B1、B6、B9、B12和D,叶酸、胆碱、铁、碘能发挥神经保护作用,改善脑功能。与此同时,抗氧化剂(如维生素C、E、A、锌、硒、叶黄素和玉米黄质等)在防治与氧化应激有关的精神退化和提高认知能力方面具有重要作用。合理的、充分的营养是优化大脑功能和防止认知衰退的必要条件[45]。
5. 总结与展望
长期处于密闭环境中会出现睡眠障碍、情绪功能失调、认知功能受损、内分泌失调、代谢失调等异常心理和生理反应。人在密闭环境中感受到的心理压力会造成海马神经元减少、单胺类神经递质功能障碍等问题,最终产生烦躁、焦虑、抑郁等负面情绪,影响工作状态和身体健康。
当前关于密闭环境对人的身体机能等各方面影响的研究还不够深入和系统,但是长期处于密闭环境会给身体健康带来许多潜在或慢性的危害是已知的,这些危害往往不易被察觉但会影响长期处于密闭空间中作业人员的生活和工作质量。因此深入研究密闭环境对人尤其是脑的影响及有效干预方法意义重大。
目前临床常用的抗焦虑、抗抑郁小分子,其化学药副作用和不良反应多,不适于密闭环境所致负面情绪的治疗。建议应以预防为主,以天然产物搭配合理饮食、适当体育锻炼达到防患于未然的目的。同时,除了口服给药之外,拓展经皮、鼻腔等其他给药途径将会大大提高顺应性。未来应更加深入探讨密闭环境对认知的影响机制,寻找新的作用靶点,拓展防治药物种类,为地震掩埋、长航长潜等特殊环境下人群身心健康提供更优选择。
-
表 1 雷公藤甲素的加样回收率试验结果(n=6)
样品量(m/mg) 加入量(m/mg) 测得量(m/mg) 回收率(%) 平均回收率(%) RSD
(%)0.097 6 0.097 9 0.188 7 92.98 98.12 8.25 0.097 6 0.097 9 0.181 8 85.92 0.097 6 0.097 9 2.050 5 109.71 0.097 6 0.097 9 1.937 0 98.11 0.097 6 0.097 9 1.972 9 101.78 0.097 6 0.097 9 1.957 8 100.23 表 2 21批次昆仙胶囊中雷公藤甲素的含量测定结果
批号 平均含量(mg/粒) 批号 平均含量(mg/粒) S1 0.010 3 S12 0.011 7 S2 0.009 2 S13 0.011 2 S3 0.009 1 S14 0.013 3 S4 0.005 9 S15 0.008 8 S5 0.011 7 S16 0.012 6 S6 0.009 0 S17 0.012 2 S7 0.006 5 S18 0.007 0 S8 0.007 6 S19 0.009 8 S9 0.011 6 S20 0.008 8 S10 0.010 2 S21 0.011 8 S11 0.008 4 -
[1] 崔莉莉, 许春芳, 鄢红霞, 等. 昆仙胶囊临床应用的研究进展[J]. 世界中医药, 2021, 16(11):1754-1758. doi: 10.3969/j.issn.1673-7202.2021.11.023 [2] TANG Y J, ZHANG Y, LI L, et al. Kunxian capsule for rheumatoid arthritis: inhibition of inflammatory network and reducing adverse reactions through drug matching[J]. Front Pharmacol,2020,11:485. doi: 10.3389/fphar.2020.00485 [3] 刘枚, 潘文友, 孟德钎, 等. 昆仙胶囊联合糖皮质激素治疗狼疮性肾炎的临床研究[J]. 中国中西医结合杂志, 2020, 40(8):919-922. doi: 10.7661/j.cjim.20200627.074 [4] LI Q X, LI L, BI L Q, et al. Kunxian capsules in the treatment of patients with ankylosing spondylitis: a randomized placebo-controlled clinical trial[J]. Trials,2016,17(1):337. doi: 10.1186/s13063-016-1438-6 [5] LI Q, LI L, HE D, et al. Efficacy and safety of Kunxian capsule for treatment of spondyloarthropathy (spa) and ankylosing spondylitis (as): results of a multi-center randomized placebo-controlled trial[J]. Clin Exp Rheumatol,2014,32(5):790. [6] 谢晨琼, 周萍, 李祥, 等. 昆明山海棠化学成分及药理作用和临床应用研究进展[J]. 中草药, 2015, 46(13):1996-2010. doi: 10.7501/j.issn.0253-2670.2015.13.024 [7] CHEN X J, TANG Z H, LI X W, et al. Chemical constituents, quality control, and bioactivity of epimedii folium (Yinyang-huo)[J]. Am J Chin Med,2015,43(5):783-834. doi: 10.1142/S0192415X15500494 [8] DONNAPEE S, LI J, YANG X, et al. Cuscuta chinensis Lam. : a systematic review on ethnopharmacology, phytochemistry and pharmacology of an important traditional herbal medicine[J]. J Ethnopharmacol,2014,157:292-308. doi: 10.1016/j.jep.2014.09.032 [9] CHENG J, ZHOU Z W, SHENG H P, et al. An evidence-based update on the pharmacological activities and possible molecular targets of Lycium barbarum polysaccharides[J]. Drug Des Devel Ther,2015,9:33-78. [10] ZHOU Z L, YANG Y X, DING J, et al. Triptolide: structural modifications, structure-activity relationships, bioactivities, clinical development and mechanisms[J]. Nat Prod Rep,2012,29(4):457-475. doi: 10.1039/c2np00088a [11] XI C, PENG S J, WU Z P, et al. Toxicity of triptolide and the molecular mechanisms involved[J]. Biomedecine Pharmacother,2017,90:531-541. doi: 10.1016/j.biopha.2017.04.003 [12] 国家药典委员会. 中华人民共和国药典(一部)2020年版[S]. 北京: 中国医药科技出版社, 2020: 322. -





 下载:
下载:
 下载:
下载: