-
近红外光响应的肿瘤光热治疗因具有组织穿透性强、生物安全性好等优点,已引起广泛关注。作为新兴的光敏剂,八丁氧基酞菁钯具有成本低、易合成、毒性低等优点,在肿瘤光动力治疗(PDT)领域表现出巨大潜力。由于高渗透强滞留效应(EPR),脂质体作为药物载体可靶向集中于肿瘤组织,同时ROS可氧化破坏脂质双层膜,促进包载药物在肿瘤组织的精准释放。本实验以雷帕霉素为模型药物,采用课题组合成的八丁氧基酞菁钯为光敏剂,制备近红外光触发的ROS响应型雷帕霉素脂质体,并对其理化性质及体外释放特性进行考察。
-
R206D旋转蒸发仪(上海申生科技有限公司);730 nm/1500 mW激光器(长春市亮丽光电有限公司);U3000高效液相色谱仪(Thermo Fisher公司);JY92.IIDN超声波细胞粉碎机(宁波新芝生物科技股份有限公司);马尔文激光粒度仪(英国Malvern公司)。
-
二硬脂酰磷脂酰胆碱(DSPC,Avanti公司);1,2-二亚油酰基-sn-甘油基-3-磷酸胆碱(DLPC,Avanti公司);二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(DSPE-mPEG2000,Lipoid 公司);胆固醇、雷帕霉素(MCE公司)、八丁氧基酞菁钯[PdPC(OBu)8,实验室自制];磷酸盐缓冲液(PBS,HyClone 公司)。
-
采用薄膜分散法制备脂质体。精密称取DSPC、DLPC、胆固醇、DSPE-mPEG2000、雷帕霉素、八丁氧基酞菁钯置于250 ml圆底烧瓶中,加入适量氯仿溶解。65 ℃水浴,65 r/min减压旋转蒸发形成均匀薄膜,取PBS溶液4 ml水化。吸出脂质体,用PBS稀释至5 ml,200 W探头超声5 min,即得近红外光触发ROS响应型雷帕霉素脂质体。空白脂质体除不加雷帕霉素、八丁氧基酞菁钯外,制备方法相同。
-
以脂质体成膜及水化效果、药物包封率及载药量、包载药物光敏释放效率为指标,从DLPC、胆固醇、DSPE-mPEG2000处方量及PdPC(OBu)8投药量对光敏ROS脂质体处方进行单因素考察。
-
取少量脂质体溶液,用去离子水稀释,使用马尔文激光粒度仪测量脂质体粒径、PDI及Zeta电位。
-
色谱柱:Agilent TC-C18(2)(4.6 mm×250 mm,5 μm);流动相:甲醇-水(84∶16);流速1.0 ml/min;检测波长:278 nm;柱温:50 ℃;进样量:20 μl。
-
精密称取雷帕霉素2.50 mg置于10 ml容量瓶中,用甲醇定容至刻度,得到浓度为250 μg/ml储备液。精密吸取储备液800、400、200、100、40、20、10、4 μl,分别于5 ml容量瓶中用甲醇定容。制成浓度为40、20、10、5、2、1、0.5、0.2 μg/ml的对照品溶液。HPLC仪检测并记录峰面积A,绘制出峰面积A与对照品质量浓度C的标准曲线并进行线性回归分析。
-
吸取雷帕霉素脂质体溶液500 μl加入5 ml容量瓶中,甲醇定容至刻度。超声20 min破乳后,以10 000 r/min进行超速离心10 min。取适量上清液过0.45 μm有机膜,制得供试品溶液。吸取空白脂质体按同法制备阴性对照品溶液。分别取对照品、阴性对照品、供试品按照“1.6.1”项下方法进样,记录HPLC图。
-
选取低、中、高3个浓度的对照品溶液,1 d内重复进样考察日内精密度,连续3 d每天测定一次,考察日间精密度。
-
吸取用于制备选定的低、中、高3个浓度对照品溶液的储备液于不同的5 ml容量瓶中,同一浓度共制备3个样品。向每个容量瓶中加入100 μl空白脂质体溶液,再用甲醇定容至刻度。超声20 min破乳后,进行超速离心,10 000 r/min,10 min。取适量上清液过0.45 μm有机膜,进行HPLC检测。
-
包封率与载药量是评价脂质体的重要指标。包封率是脂质体中包封药物量与脂质体中药物总量的百分比。载药量是脂质体中药物量与脂质体总量的百分比。
精密吸取脂质体500 μl置于5 ml容量瓶中,甲醇稀释至刻度。超声20 min破乳后,再进行超速离心,10 000 r/min,10 min。取适量上清液过0.45 μm有机膜,进行HPLC检测,计算得出脂质体中药物总量。
精密吸取适量脂质体溶液,先进行低速离心[3],3 000 r/min,15 min。取上层液体500 μl置于5 ml容量瓶中用甲醇稀释至刻度。超声20 min破乳后,再进行超速离心,10 000 r/min,10 min。取适量上清液过0.45 μm有机膜,进行HPLC检测,计算出脂质体中包封药物量。
-
采用反向透析法测定雷帕霉素脂质体光敏释放特性。以30 ml 20%乙醇为释放介质,加入50 ml离心管内;另吸取1 ml释放介质并加入透析袋内,将透析袋两端扎紧后放入离心管中;取300 μl雷帕霉素脂质体,用730 nm,1 W/cm2近红外光照射5 min后,转移至释放介质;将离心管移至摇床内,设置摇床条件为37 ℃,180 r/min。分别在1、2、4、8、12 h从透析袋内取样200 μl,用于样品测定和累积释放率的计算。取样后即补加新鲜释放介质200 μl,保持释放介质总量不变。以时间(t)为横坐标,以累积释放率(Q%)为纵坐标,绘制释放曲线。
-
回归方程为A = 0.6240 C-0.1738 (r = 0.999 5)。雷帕霉素在0.2~40 μg/ml浓度范围内线性关系良好。
-
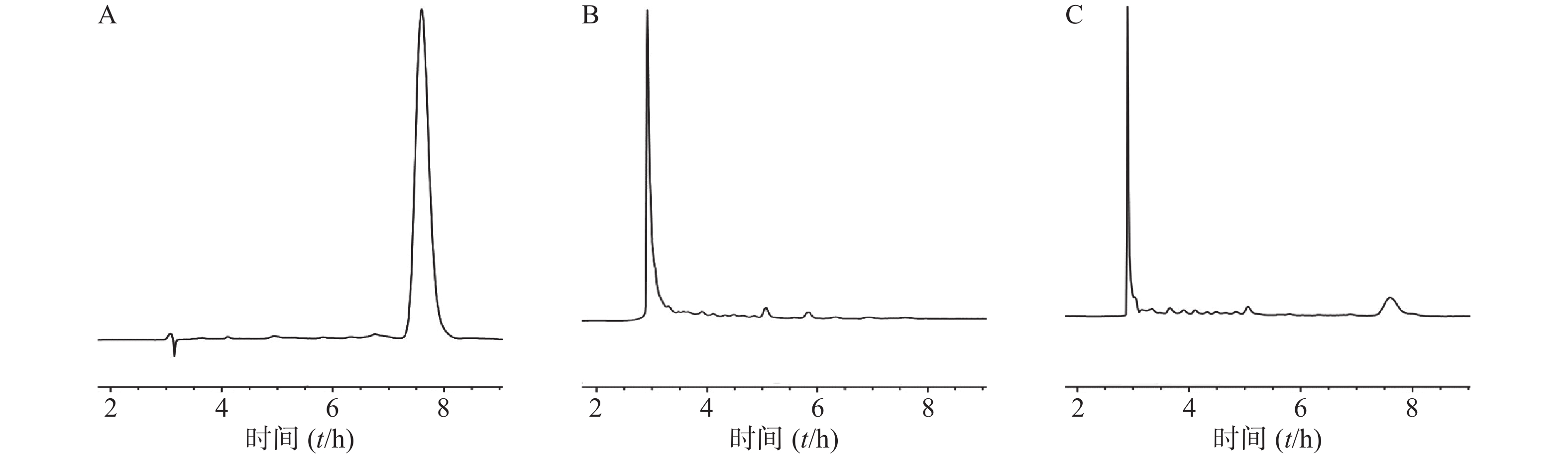
按照“1.6.1”项下色谱条件测定,雷帕霉素出峰良好,保留时间为7.8 min。表明此方法专属性良好(图1)。
-
由表1可知,雷帕霉素在低、中、高3个浓度都具有较好的准确度,日间精密度和日内精密度值均小于5%,表明该方法可用于雷帕霉素的含量测定。
表 1 雷帕霉素 HPLC 分析的精密度(
$\overline x \; $ ±s,n=3)浓度(μg/ml) 日内精密度 日间精密度 检测值(μg/ml) RSD(%) 检测值(μg/ml) RSD(%) 0.50 0.58±0.01 1.62 0.58±0.01 1.13 2.00 1.95±0.02 0.56 1.96±0.01 0.49 10.00 9.36±0.04 0.40 10.02±0.09 0.87 -
由表2可知,雷帕霉素在低、中、高3个浓度的回收率为97.64%~98.62%,符合95%~105%的范围,且RSD值均小于1%,表明该提取方法稳定可靠。
表 2 雷帕霉素 HPLC 分析的提取回收率(
$\overline x \; $ ±s,n=3)浓度(μg/ml) 检测值(μg/ml) 回收率(%) RSD(%) 0.50 0.57±1.54 113.47 1.69 2.00 1.93±0.02 96.48 0.82 10.00 9.82±0.05 98.21 0.52 -
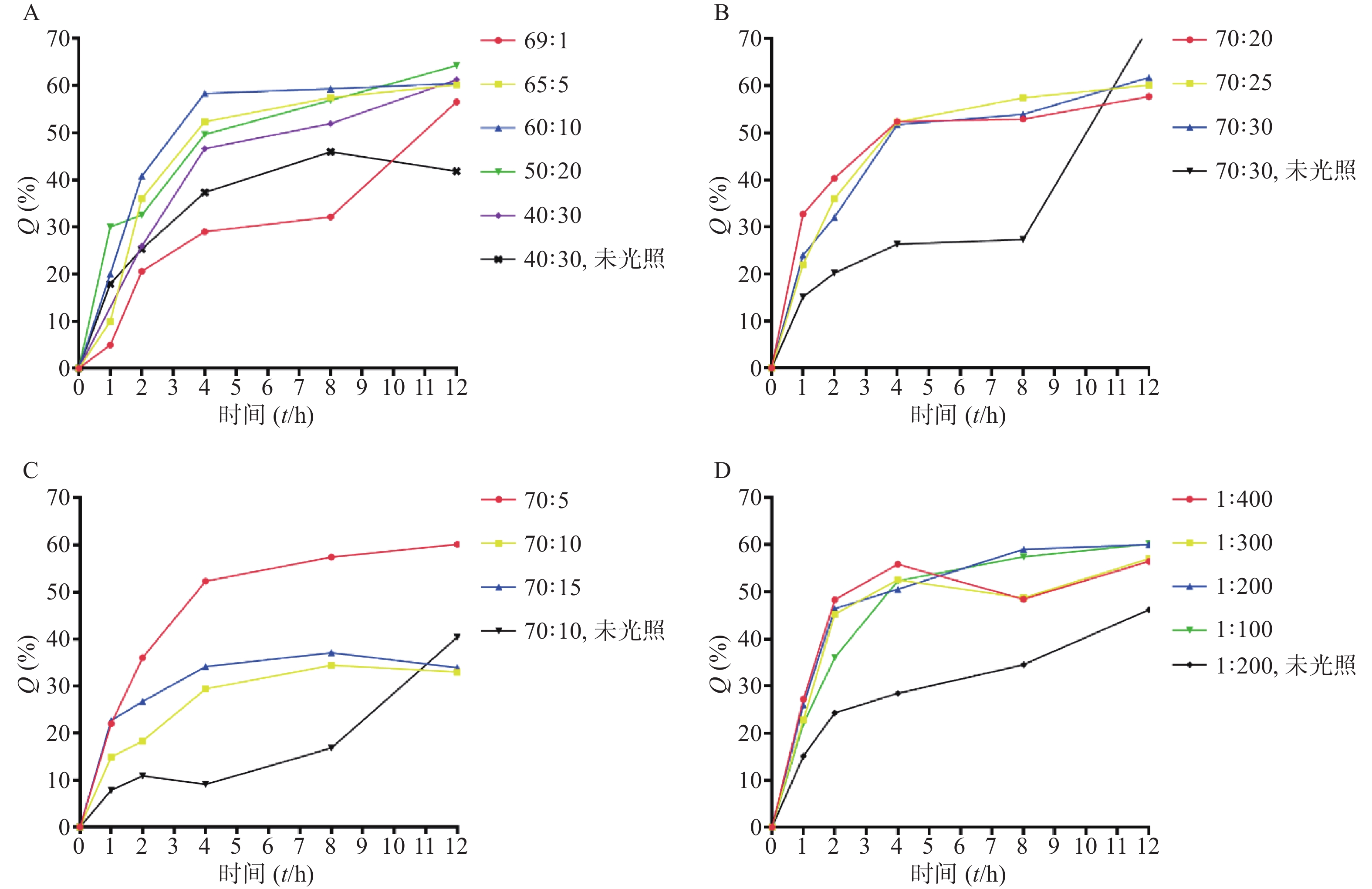
由表3可知,包含不同摩尔量DLPC的处方制得的脂质体,成膜及水化效果较好,粒径<200 nm,PDI<0.2,雷帕霉素包封率>90%,载药量>1%;脂质体体外释放试验,光照12 h后,测得雷帕霉素药物累积释放率>60%(图2A)。当DLPC含量较低时(DSPC∶DLPC=69∶1),雷帕霉素释放速率明显低于其他处方。随着DLPC含量的增加,雷帕霉素释放速率及12 h内累积释放率并无明显增加。
表 3 不同摩尔量DLPC脂质体的表征
DSPC:DLPC
(mol:mol)成膜 水化 粒径(l/nm) PDI Zeta电位(mV) 包封率(%) 载药量(%) 69∶1 均匀 无沉淀 139.7 0.051 −12.1 98.71 1.11 65∶5 均匀 无沉淀 173.2 0.194 −12.5 94.20 1.23 60∶10 均匀 无沉淀 143.4 0.035 −13.0 98.43 1.15 50∶20 均匀 无沉淀 126.7 0.165 −14.9 92.64 2.27 40∶30 均匀 无沉淀 120.5 0.173 −14.6 92.94 2.22 -
由表4可知,PC(DSPC+DLPC)与胆固醇之比过大(70∶10)或过小(70∶40),脂质体都不能成膜。当PC与胆固醇之比为70∶20、70∶25、70∶30时,所得脂质体成膜及水化效果较好,粒径<200 nm,PDI<0.2,雷帕霉素包封率>90%,载药量在1%左右。在进行脂质体体外释放实验中,测得12 h后雷帕霉素药物累积释放率>60%(图2B)。
表 4 不同摩尔量胆固醇脂质体的表征
PC∶胆固醇
(mol∶mol)成膜 水化 粒径(l/nm) PDI Zeta电位(mV) 包封率(%) 载药量(%) 70∶10 不均匀 — — — — — — 70∶20 均匀 无沉淀 119.4 0.108 −11.0 96.69 0.96 70∶25 均匀 无沉淀 173.2 0.194 −12.5 94.20 1.23 70∶30 均匀 无沉淀 147.7 0.095 −12.7 94.56 0.88 70∶40 不成膜 — — — — — — -
由表5可知,当DSPE-PEG2000用量较小时,脂质体不能成膜。当PC与DSPE-PEG2000之比为70∶5、70∶10、70∶15时,所得脂质体成膜及水化效果较好,粒径<200 nm,PDI<0.2,雷帕霉素包封率>90%,载药量>1%。在进行的12 h脂质体体外释放实验中,摩尔比70∶5组测得雷帕霉素药物累积释放率>60%,其余两组药物累积释放率在33%左右(图2C)。
表 5 不同摩尔量DSPE-PEG2000脂质体的表征
PC: DSPE-PEG2000
(mol:mol)成膜 水化 粒径(l/nm) PDI Zeta电位(mV) 包封率(%) 载药量(%) 70∶0 不成膜 — — — — — — 70∶1 不成膜 — — — — — — 70∶5 均匀 无沉淀 173.2 0.194 −12.5 94.20 1.23 70∶10 均匀 无沉淀 136.2 0.144 −12.1 98.13 1.37 70∶15 均匀 无沉淀 108.9 0.197 −11.0 97.07 1.34 -
由表6可知,当PdPC(OBu)8用量较大(质量比1∶50),脂质体不能成膜。当PdPC(OBu)8与PC质量之比为1∶100、1∶200、1∶300、1∶400,测得粒径<200 nm,PDI<0.2,雷帕霉素包封率>90%,载药量>1%。在进行的12 h脂质体体外释放实验中,质量比1∶100、1∶200组释放效率高于其余两组,在60%左右(图2D)。
表 6 不同用量PdPC(OBu)8脂质体的表征
PdPC(OBu)8 :PC
(m:m)成膜 水化 粒径(l/nm) PDI Zeta电位(mV) 包封率(%) 载药量(%) 1∶400 均匀 无沉淀 179.3 0.140 −12.3 93.92 1.15 1∶300 均匀 无沉淀 157.4 0.143 −11.5 94.23 1.16 1∶200 均匀 无沉淀 145.9 0.142 −14.3 93.26 1.19 1∶100 均匀 无沉淀 136.2 0.144 −12.1 98.13 1.23 1∶50 不均匀 沉淀 — — — — — -
DLPC是一种人工合成的不饱和磷脂,在制成的脂质体中,DLPC将均匀分散在脂质双分子层膜上。当有ROS存在时,DLPC结构中的不饱和碳碳双键可被氧化,使脂质膜结构遭到破坏,促进包载药物的释放。光敏剂可在特定波长光照射下产生ROS,在肿瘤疾病的光动力治疗中得到广泛应用。但光敏剂自身潜在的光毒性和溶解性差是其突出缺陷。本文将光敏剂包载在脂质体中可以减少潜在的细胞毒性,同时可增加其溶解度。在研究脂质体中雷帕霉素释放的释放介质确定上,文献[2,4-5]中提供了多种选择。预实验显示,20%乙醇溶液作为释放介质时,不仅克服了脂溶性药物雷帕霉素在水中溶解性差的缺点,同时也使得在进行HPLC检测时干扰峰较少。综上所述,本研究成功制备了光敏ROS响应型雷帕霉素脂质体,表征结果较好。在短时间特定波长照射后,可实现脂溶性药物的快速释放。
Preparation and characterization of photosensitive ROS-responsive rapamycin liposomes
-
摘要:
目的 研究光敏活性氧自由基(reactive oxygen species,ROS)响应型雷帕霉素脂质体的制备工艺及其性质,旨在开发一种稳定高效的刺激响应型脂质体载体。 方法 采用薄膜分散法制备雷帕霉素脂质体;马尔文激光粒度仪测定其粒径及Zeta电位;利用HPLC法建立雷帕霉素含量测定方法;经近红外光照射后,采用反向透析法考察雷帕霉素脂质体的体外释放特性。 结果 雷帕霉素脂质体粒径<200 nm,PDI值<0.200;雷帕霉素在0.2~40 μg/ml范围与峰面积呈良好的线性关系,相关系数r=0.9995;雷帕霉素脂质体包封率>94.20%;经730 nm近红外光照射5 min后,雷帕霉素脂质体12 h内体外释放率可达60%。 结论 成功制备了光敏ROS响应型雷帕霉素脂质体,具有较高的包封率和体外刺激响应效率。 Abstract:Objective To study the preparation process and properties of photosensitive ROS (Reactive oxygen species) responsive rapamycin liposome, and to develop a stable and efficient stimulus-responsive liposome carrier. Methods Rapamycin liposomes were prepared by thin film dispersion method. The particle size and Zeta potential were determined by Malvern laser particle size analyzer. An assay method for rapamycin was established by HPLC. In vitro release characteristics of rapamycin liposomes were investigated by reverse dialysis after irradiation with near-infrared light. Results The particle size of rapamycin liposome was less than 200 nm and the PDI value was less than 0.200. Rapamycin showed a good linear relationship with peak area in the range of 0.2-40 μg/ml, with the correlation coefficient of 0.9995. Encapsulation rate of rapamycin liposomes was > 94.20%. The release efficiency of rapamycin liposomes reached 60% within 12 h after irradiation with 730 nm near infrared light for 5 min. Conclusion Photosensitive ROS-responsive rapamycin liposomes were successfully prepared, which had high encapsulation rate and stimulation response efficiency in vitro. -
Key words:
- liposome /
- rapamycin /
- near infrared light /
- ROS /
- release in vitro
-
表 1 雷帕霉素 HPLC 分析的精密度(
$\overline x \; $ ±s,n=3)浓度(μg/ml) 日内精密度 日间精密度 检测值(μg/ml) RSD(%) 检测值(μg/ml) RSD(%) 0.50 0.58±0.01 1.62 0.58±0.01 1.13 2.00 1.95±0.02 0.56 1.96±0.01 0.49 10.00 9.36±0.04 0.40 10.02±0.09 0.87 表 2 雷帕霉素 HPLC 分析的提取回收率(
$\overline x \; $ ±s,n=3)浓度(μg/ml) 检测值(μg/ml) 回收率(%) RSD(%) 0.50 0.57±1.54 113.47 1.69 2.00 1.93±0.02 96.48 0.82 10.00 9.82±0.05 98.21 0.52 表 3 不同摩尔量DLPC脂质体的表征
DSPC:DLPC
(mol:mol)成膜 水化 粒径(l/nm) PDI Zeta电位(mV) 包封率(%) 载药量(%) 69∶1 均匀 无沉淀 139.7 0.051 −12.1 98.71 1.11 65∶5 均匀 无沉淀 173.2 0.194 −12.5 94.20 1.23 60∶10 均匀 无沉淀 143.4 0.035 −13.0 98.43 1.15 50∶20 均匀 无沉淀 126.7 0.165 −14.9 92.64 2.27 40∶30 均匀 无沉淀 120.5 0.173 −14.6 92.94 2.22 表 4 不同摩尔量胆固醇脂质体的表征
PC∶胆固醇
(mol∶mol)成膜 水化 粒径(l/nm) PDI Zeta电位(mV) 包封率(%) 载药量(%) 70∶10 不均匀 — — — — — — 70∶20 均匀 无沉淀 119.4 0.108 −11.0 96.69 0.96 70∶25 均匀 无沉淀 173.2 0.194 −12.5 94.20 1.23 70∶30 均匀 无沉淀 147.7 0.095 −12.7 94.56 0.88 70∶40 不成膜 — — — — — — 表 5 不同摩尔量DSPE-PEG2000脂质体的表征
PC: DSPE-PEG2000
(mol:mol)成膜 水化 粒径(l/nm) PDI Zeta电位(mV) 包封率(%) 载药量(%) 70∶0 不成膜 — — — — — — 70∶1 不成膜 — — — — — — 70∶5 均匀 无沉淀 173.2 0.194 −12.5 94.20 1.23 70∶10 均匀 无沉淀 136.2 0.144 −12.1 98.13 1.37 70∶15 均匀 无沉淀 108.9 0.197 −11.0 97.07 1.34 表 6 不同用量PdPC(OBu)8脂质体的表征
PdPC(OBu)8 :PC
(m:m)成膜 水化 粒径(l/nm) PDI Zeta电位(mV) 包封率(%) 载药量(%) 1∶400 均匀 无沉淀 179.3 0.140 −12.3 93.92 1.15 1∶300 均匀 无沉淀 157.4 0.143 −11.5 94.23 1.16 1∶200 均匀 无沉淀 145.9 0.142 −14.3 93.26 1.19 1∶100 均匀 无沉淀 136.2 0.144 −12.1 98.13 1.23 1∶50 不均匀 沉淀 — — — — — -
[1] 卢光照, 侯成, 张翮, 等. 光敏活性氧自由基响应脂质体的制备和评价[J]. 药学学报, 2017, 52(12):1942-1950. doi: 10.16438/j.0513-4870.2017-0864 [2] MIAO Z L, DENG Y J, DU H Y, et al. Preparation of a liposomal delivery system and its in vitro release of rapamycin[J]. Exp Ther Med,2015,9(3):941-946. doi: 10.3892/etm.2015.2201 [3] ABUD M B, LOUZADA R N, ISAAC D L C, et al. In vivo and in vitro toxicity evaluation of liposome-encapsulated sirolimus[J]. Int J Retina Vitreous,2019,5(1):1-10. doi: 10.1186/s40942-018-0153-8 [4] 王婷. 基于纳米脂质体的药物载体开发研究[J]. 科学技术创新, 2020(19):16-18. doi: 10.3969/j.issn.1673-1328.2020.19.008 [5] WANG J, GUO F, YU M, et al. Rapamycin/DiR loaded lipid-polyaniline nanoparticles for dual-modal imaging guided enhanced photothermal and antiangiogenic combination therapy[J]. J Control Release,2016,237:23-34. doi: 10.1016/j.jconrel.2016.07.005 -





 下载:
下载: