-
在高原低氧环境下,会出现消化系统不适症状,如上腹疼痛、消化不良、腹泻等,症状严重时可导致胃肠出血(GIB)甚至器官器质性损伤[1],对进入高原的人群身体有严重的危害。因此讨论进入高原人群胃肠道损伤的原因及保护十分必要。
-
胃肠运动为食物消化吸收提供条件,胃肠道内部的胃酸、胆汁、消化酶的减少导致胃肠道运动减缓[2],引起胃肠道功能受损。急进高原后,胃肠运动减慢主要与胃肠道激素的分泌及Cajal间质细胞(Interstitial cells of Cajal, ICC)有关。
-
胃肠激素对胃肠运动有一定的调节作用,主要包括胃泌素(GAS)、胃动素(MTL)、生长抑素等[3]。胃泌素主要由胃及十二指肠黏膜开放型G细胞分泌,具有促进胃肠蠕动的作用,分泌过多则会导致胃肠黏膜损伤,影响胃肠道功能。胃动素由Mo细胞分泌,分布于小肠,能够促进和影响胃肠运动及胃肠道对水及电解质的运输,胃动素升高,肠蠕动加快,可能会导致腹痛、腹泻等症。高原低氧环境下胃肠运动紊乱表现为激素分泌紊乱和胃肠运动收缩的频率的改变。李红[4]对急进高原个体胃肠激素进行检测,包括GAS、P物质(SP)及MTL,发现MTL、SP显著降低,GAS显著升高,说明急进高原后机体胃肠运动受到抑制,上述研究表明,急进高原后腹痛可能是GAS分泌增加引起。高原低氧环境会引起个体胃肠动力激素改变,进而导致胃肠运动缓慢,胃肠道分泌化学物质减少,化学屏障被破坏,从而引起急性胃肠黏膜损伤。
-
ICC是胃肠道慢波的启动细胞,在消化道电活动的传播及介导神经信号转导中发挥重要作用, ICC细胞受损,会导致慢波传导异常,影响胃肠道运动[5]。ICC特异性表达酪氨酸激酶受体 (C-kit) , 干细胞因子 (SCF) 是C-kit的天然配体,SCF/C-kit信号通路关系着ICC的生长、发育及增殖的过程[6]。在急进一定海拔高原后,小肠推进率与 C-kit mRNA表达呈正相关[7],C-kit mRNA、SCF mRNA的表达和小肠推进率均降低[8],表明急进高原导致胃肠道运动功能紊乱与SCF/C-kit机制有关。高原低氧条件下,SCF以及C-kit mRNA及蛋白表达水平均下降,说明高原低氧环境抑制SCF/C-kit信号通路,同时SCF 与C-kit结合减少,影响ICC的生长、发育及繁殖,进而影响小肠推进功能,SCF/C-kit信号通路图如图1所示。
缝隙连接又称为通讯连接,是细胞间跨膜信号传导的重要方式之一,缝隙连接蛋白43 (Cx43) 作为重要的连接蛋白之一,大量存在于胃肠道壁中, 发挥信号传导作用。急进高原后大鼠小肠ICC细胞间缝隙连接受损,而且Cx43的表达出现异常[9]。说明急进高原后胃肠道运动功能受到影响与ICC以及缝隙连接蛋白有关,ICC细胞与消化道平滑肌间物质及电信号传递障碍,导致胃肠道运动功能障碍。
-
胃肠黏膜屏障对维持机体内环境稳态有着至关重要的作用,高原低氧环境会对机体胃黏膜屏障产生不同程度的破坏,低氧刺激肥大细胞释放组织胺和胃窦G细胞释放胃泌素,使血清胃泌素浓度显著升高。升高的胃泌素促进H+分泌,导致组织胺浓度上升,毛细血管扩张,通透性增加[10],引起血浆渗入胃腔, 使血液黏稠度增加, 同时缺氧导致红细胞增多,加剧了血液黏稠程度,导致血栓以及出血的形成,即胃黏膜层细胞因缺血而糜烂、溃疡、出血等。在这个过程中,氧自由基、炎症因子、自噬和细胞因子发挥重要作用。
-
在高原低氧刺激下,胃肠黏膜产生大量的氧自由基(ROS)。产生的自由基数量过多会导致胃肠黏膜的损伤。低氧暴露可使大鼠小肠绒毛长度和数量均显著减少, 氧自由基生成增多,导致小肠黏膜的结构和功能发生损伤[11]。ROS上调 HIF-1α的水平,ROS介导的 HIF-1α信号转导可能是高原条件下胃功能受损的相关机制[12]。
缺氧后机体炎症也会导致胃肠黏膜损伤,Wang等人[13]发现将大鼠置于低压氧舱后,其血清中 Zonulin、TNF-α、IL-1β 和 IL-6 水平升高,CD4+/CD8+ T 细胞比值和小肠 NK 细胞数量增加,小肠 NK 细胞的 mRNA 和蛋白表达水平升高。肠道 TLR4、NF-κB、HIF-1α 和 iNOS mRNA 和蛋白表达水平均有所升高。急进高原后肠组织炎症因子有所上升,原因可能是在机体缺氧情况下,为了保证脑以及心脏等重要器官的血流供应,机体对血流进行重新分配,胃肠道在受到低张性以及循环性双重缺氧下,黏膜产生明显的损伤,引起机体炎症,炎症因子表达上升又反作用于胃肠道,使胃肠道损伤进一步加重。
-
自噬是由溶酶体介导的吞噬自身衰老或损伤的细胞器、蛋白质以及细胞内病原体的过程,从而实现细胞的自我更新[14],其能增强肠黏膜屏障,减轻肠道炎症,在维持肠黏膜稳态中发挥重要作用[15]。大鼠急进高原后使用自噬抑制剂会使肠组织的病理性损伤明显加重,无抑制剂时损伤减轻[16],说明自噬可能是缺氧肠上皮细胞损伤过程中的保护因素之一。高原急性暴露导致肠上皮细胞的时间依赖性损伤,观察急性高原暴露肠功能衰竭大鼠自噬体的表达,发现Beclin1和LC3B蛋白的表达明显升高[17],表明自噬可能有助于清除肠上皮组织中受损的细胞和蛋白,在修复受损细胞中发挥着重要作用。
-
三叶因子(TFF)家族是一种参与胃肠道黏膜愈合的重要因子,该家族由TFF1、TFF2和TFF3多肽组成[18],TFFs有影响胃黏膜黏液的黏度和弹性及促进黏膜创面愈合[19]的作用,高原缺氧环境条件下肠上皮组织中TFF mRNA表达量明显升高[20],说明高原缺氧环境导致胃肠黏膜损伤后,机体会启动损伤修复的相关机制,TFF家族在此过程中会发挥一定的保护作用。
-
人肠道内寄生着10万亿个细菌,其参与了人体内许多生理过程,包括消化和代谢功能、上皮屏障的调节、发育和免疫系统的调节等,是影响人胃肠道功能的重要因素。急进高原除了会对胃、肠黏膜有损伤作用,对人体内肠道菌群的数量和组成也有影响。肠道菌群是人体肠道的正常微生物,如双歧杆菌,乳酸杆菌等,能够合成机体所必需的维生素以及利用蛋白质残渣合成氨基酸,在缺氧情况下,随着时间的延长,肠黏膜受到严重破坏,肠道菌群发生转移,破坏肠系膜淋巴结的结构,加剧氧化应激,进而影响肠道自身免疫功能的完整性[21]。
肠道菌群包含了极为多样的微生物群落,每个个体约有500种细菌,其中拟杆菌门(Bacteroidetes)最为丰富和多样,而高原环境会导致拟杆菌门组成显著增加[22],Han等人运用基因敲除法敲除Hif-1β,发现拟杆菌门在Hif-1β缺失小鼠中比高原空白组小鼠中的数量更多[23],这表明拟杆菌门不仅对氧含量敏感,而且可能能够感知氧相关基因的变化。与拟杆菌门相同,肠杆菌门(Enterobacteriaceae)与γ变形菌门(Gammaproteobacteria)有相同的变化。缺氧后,肠杆菌门丰度增加,肠杆菌门的过度生长促使细菌易位,从而导致内毒素的扩散[24],这表明缺氧会引起机体内肠道菌群紊乱,进而引起胃肠道功能被破坏。
短链脂肪酸(SCFAs)作为结肠细胞的能量来源,具有调节葡萄糖代谢、调控肝脏甘油三酯和胆固醇的生物合成、抑制病原体生长及减轻肠道炎症等作用。其中丁酸在肠上皮细胞增殖,分化,功能方面有重要作用。丁酸盐能通过营养功能及保护细胞内信号传导作用保护猪结肠上皮免受缺氧诱导的损伤,同时降低炎症因子的表达[25]。肠道菌群能通过调节嗜中性粒细胞的迁移和功能影响T细胞分化,有利于调节性T细胞(Tregs)的分化和扩增,而调节性T细胞是介导免疫耐受的关键组成部分[26]。在T淋巴细胞中 SCFAs刺激G蛋白偶联受体(GPR41),抑制炎症细胞因子如白介素10(IL-10)和干扰素(IFN)的生成等[27]。在体内和体外,丁酸盐通过抑制组蛋白脱乙酰基酶(HDAC)的活性,改变CYP1A1的表达及活性,减少了吲哚代谢物的清除,并增加了吲哚代谢物进入固有层的途径,在固有层中,它们通过刺激IL-C3和Th17细胞分泌IL-22和IL-17来增强肠道免疫力。这些细胞因子能增加黏蛋白和抗菌肽的产生,从而改善肠道屏障功能。丁酸盐对肠道保护作用如图2。
高原低氧环境会导致肠道菌群的组成和比例发生改变,例如肠杆菌门的增加会导致机体内毒素扩散,影响肠屏障功能以及导致肠道炎症。厚壁菌门减少会导致SCFAs生成减少,低温低氧环境会导致肠道菌群产生的SCFAs减少[28],丁酸盐产生量降低,致丁酸盐对肠道保护作用降低,进而影响肠道功能以及完整性,说明高原低氧条件会通过肠道菌群的改变破环肠道屏障功能以及导致肠道损伤,同时降低SCFAs对肠道的保护作用,影响肠功能。
高原低氧环境可造成急性胃黏膜损伤甚至急性上消化道大出血等严重情况。目前对于急进高原病的研究较多,但急进高原导致的胃肠道损伤具体机制尚不明确,因此,研究急进高原个体胃肠损伤对防治应激损伤、加快疾病恢复具有重要的意义。
-
中药复方擅于从整体出发,主张辨证论治,标本兼治,治疗多种疾病成效显著。急进高原导致胃肠运动减慢,除了使用常用的促胃动力药物治疗以外,使用中药复方等也能达到促进胃肠道运动的作用,如表1所示。
表 1 保护胃肠道功能的药物及相关机制
改善胃肠道功能的
药物类型复方名(药物名称) 作用效果及机理 改善胃肠道运动
功能的药物丹皮-蒲公英配伍[31] 提升小肠推进率,降低胃残留率,改善胃肠动力障碍。 大承气汤改良方[32] 促进MTL释放,改善肠梗阻小鼠的胃肠道运动功能,减轻炎症反应,调节肠道菌群。 胃理气方[33] 升高C-kit、SCF的mRNA及蛋白的表达水平,上调SCF/C-kit信号通路相关蛋白表达。 白术内酯I(Atractylenolide-1)[34] 激活SCF/C-kit信号通路,调节氧化应激反应,抑制Cajal间质细胞的凋亡,改善胃运动功能。 阿奇霉素[35] 激动胃动素受体,诱发大幅度的胃推进型收缩,且药物相互作用及副作用少。 普鲁卡必利[36] 高选择性 5-羟色胺4 (5-HT4) 受体激动剂,与受体结合后,抑制环状平滑肌松弛和胆碱能传递,增强乙酰胆碱的释放,促进胃肠蠕动和黏液分泌。 改善胃肠道黏膜
屏障功能的药物肠黏膜抗氧化活性肽[37] 清除自由基,提升超氧化物歧化酶(SOD)活性,降低丙二醛(MDA)活性,保护肠黏膜。 香连丸[38] 促进DSS诱导的溃疡性结肠炎小鼠的自噬作用,抑制炎症反应,保护肠上皮屏障。 阿菠萝素[39] 调节自噬途径,抑制肠上皮细胞凋亡,改善肠上皮屏障及屏障稳态。 微囊化阿霉素(NLC-DOX)[40] 改善绒毛高度和隐窝深度,降低炎症因子表达,保持肠道通透性,增加紧密连接蛋白跨膜蛋白(ZO-1)和胞浆附着蛋白(Occludin)的表达。 Emu Oil Combined with Lyprinol™[41] 小肠中部的隐窝深度标准化,降低了肠 髓过氧化物酶(MPO)水平,减轻肠道炎症,保护肠黏膜。 Dissotis rotundifolia[42] 减少出血、水肿和白细胞浸润以及提升谷胱甘肽(GSH)水平,降低MDA 水平,增强过氧化氢酶 (CAT) 和SOD 酶水平,保护胃黏膜。 Rosmarinic Acid[43] 降低溃疡指数、减少胃液分泌量和降低酸度,通过抗炎和抗凋亡机制保护胃黏膜。 维持肠道菌群稳定
的药物多酚(绿茶多酚、姜黄素、白藜芦醇和槲皮素)[44] 促进有益细菌种的产生和生长,对抗胃肠道损伤。 益生菌[45] 防止胃肠道应激反应和肠道菌群失调的发生,减轻胃肠道反应的症状。 粪便菌群移植[46] 调节肠道菌群的组成与稳定及SCFAs的生成。 rhein[47] 调节肠道微生物群,间接改变肠道中的嘌呤代谢,从而缓解肠道炎症,保护肠道。 -
急进高原后,导致胃肠道黏膜的损伤,可以给予平原常用黏膜保护药,例如米索前列醇、硫糖铝、枸橼酸铋钾等。同时也应使用降低氧自由基、提升SOD活性的药物。自噬是维持抗微生物防御,上皮屏障完整性和黏膜免疫的重要作用机制[29],许多自噬调节剂正被研究作为治疗肠道炎症的潜在药物。如表1所示。
-
急进高原后导致肠道菌群发生改变,影响SCFAs对肠道的保护作用,因此调节肠道菌群种类,进而调节SCFAs的生成,能促进宿主整体的健康状态,具体药物如表1所示。益生菌是一类可对机体产生有益作用的微生物,具有改善胃肠道内微生物平衡、胃肠道内激素释放以及细胞因子水平的作用,植入胃肠道益生菌能通过抑制致病菌达到治疗胃肠道疾病、保护胃肠道的目的,因此急进高原人群可以通过益生菌制剂达到改善胃肠道损伤的作用,除益生菌外,使用针刺及服用中医药制剂等均被证明有一定调节肠道菌群、保护胃肠道的作用,可用于肠道菌群失调导致的胃肠道损伤保护。除此之外,将菌群从健康供体的粪便转移至接受患者的肠道,即粪菌移植,也能够重编肠道微生物群,该方法被认为是在胃肠道的炎症性疾病中使肠道菌群正常化的有效方法,在治疗或预防腹泻等胃肠道疾病[30]有发展前景,但当前此方法并未用于高原致胃肠道损伤,未来可能成为一个新的治疗手段。
-
除以上保护方法外,同时应该注重饮食[48],高原喜食生冷食品者胃肠道损伤程度更大,表明急进高原后应减少食用生冷食品,减轻胃肠道损伤。同时运动会增加缺氧程度,进而增加胃肠道黏膜损伤程度,因此应注意休息,减少运动。急进高原后会引起炎症因子上调,应合并使用抗炎药物,减轻炎症因子对胃肠道的进一步损伤。
-
急进高原导致的胃肠道损伤如不及时治疗,会引发严重的胃出血甚至器质性损伤,对合适的治疗药物选择问题以及对高原低氧导致的胃肠功能改变的机制问题等进行深入探讨十分必要,这对我们深入了解高原低氧导致胃肠功能改变的根本原因有重要意义,也对保护急进高原人群胃肠道损伤具有重要的研究意义。此外, 利用中药复方改善胃肠道运动已有很多研究,但中药复方制备成适宜推广的剂型需要进一步探讨。相信随着对高原低氧导致的胃肠功能改变的研究和探讨的深入,必将为高原消化系统疾病的预防和治疗提供更有效的治疗手段。
Progress on factors affecting gastrointestinal function and drug protection in high altitude hypoxia environment
-
摘要: 由于高原环境具有低压、低氧和寒冷等因素,急进高原人群易患消化系统疾病,如上腹疼痛、食欲减退及恶心呕吐等胃肠道功能障碍,严重影响了急进高原人群的身体健康及高原作业能力。急进高原引起的胃肠道功能障碍主要体现在胃肠道运动功能障碍、黏膜屏障功能受损及肠道菌群失调3个方面。目前胃肠道功能障碍发病机制仍不十分明确,针对性预防和治疗的药物较少。笔者对近年来胃肠道激素、氧自由基与炎症因子和肠道菌群等影响因素及药物保护作用等方面的研究做出归纳总结,以期为防治急进高原引起的胃肠道应急反应提供治疗方案和理论依据。Abstract: Due to factors such as low pressure, low oxygen and cold in the plateau environment, people who enter the plateau rapidly are susceptible to digestive system diseases, such as upper abdominal pain, loss of appetite, nausea and vomiting and other gastrointestinal dysfunction, which seriously affect the health and work ability of people who enter the plateau rapidly. The gastrointestinal dysfunction caused by the rapid advance to the plateau is mainly reflected in three aspects: gastrointestinal motility dysfunction, impaired mucosal barrier function, and intestinal flora imbalance. At present, the pathogenesis of gastrointestinal dysfunction is still not very clear, and there are fewer drugs for targeted prevention and treatment. Gastrointestinal hormones, oxygen free radicals, inflammatory factors, intestinal flora and other factors, as well as the protective effects of related drugs were reviewed in this paper to provide treatment options and theoretical basis for the prevention and treatment of the gastrointestinal emergency response caused by entering the plateau.
-
神经损伤是世界范围内致残和导致死亡的主要原因,神经损伤疾病患病率的大幅增加导致了全社会的健康负担加重[1]。神经损伤主要包括颅脑损伤(TBI)和缺血性脑卒中(CI)等,其中TBI是最常见的神经损伤类型[2],分为急性和慢性两个阶段,炎症是这两个阶段的共同特征,目前还没有有效治疗TBI的药物和方法,迫切需要寻找具有更广泛作用的药物,以缓解TBI后炎症反应[3]。脑缺血是神经损伤患者死亡的最常见病因之一[4],大脑因供血中断而致脑缺血,进而导致中风等神经损伤性疾病[5]。CI诱导了多种细胞死亡形式,如兴奋性毒性、酸毒性和离子失衡、氧化/氧化应激、炎症[6]、凋亡和梗死周围去极化等。目前CI最有效的治疗手段是静脉溶栓和血管内取栓以达到快速再灌注,这两者都能降低患者致残率,但都需要在发病4小时内尽快完成[4],目前尚无有效的药物治疗CI患者。
中药具有多途径、多靶点的特点,已有2000多年的发展历史和临床用药经验[7],如唐·孙思邈所著《备急千金方》中“小续命汤治卒中风欲死”和“大秦艽汤(金·刘完素)治中风”等。因此,阐明在临床上广泛使用的中药的作用机制是本文关注的重点。益母草来自唇形科植物益母草(Leonurus japonicus Houtt)的新鲜或干燥地上部分,临床上主要用于子宫收缩和镇静[8]。现代药理学研究发现其具有子宫收缩、抗炎、镇痛和抗氧化作用等[9]。值得引起关注的是,益母草对神经损伤也有保护作用[10]。然而,关于益母草治疗神经损伤的物质基础和作用机制的研究还未见报道。因此有必要阐明益母草治疗神经损伤的物质基础和作用机制。
本研究旨在利用网络药理学预测益母草的活性成分、靶点及相关通路来探讨其治疗神经损伤的潜在分子机制,为益母草的药理机制深入研究和临床应用提供参考。
1. 材料与方法
1.1 数据库及软件
中药系统药理学分析平台(TCMSP)和中药分子机制的生物信息学分析工具(BATMAN-TCM);活性成分靶标预测数据库(SwissTargetPrediction, STP);人类基因注释数据库(GeneCards);疾病靶点标准化数据库(Uniprot);京都基因与基因组百科全书; 蛋白-蛋白相互作用网络平台(STRING 11.0);Venny2.1软件、Cytoscape 3.6.0软件和在线作图工具微生信。
1.2 益母草活性成分的筛选
通过TCMSP和BATMAN-TCM数据库输入“yimucao”,搜索得到益母草的活性成分, 然后,在TCMSP中设置口服生物利用度(OB)≥30%及药物相似性(DL)≥0.18;在BATMAN-TCM中设置“药物-靶点”相似性模型阀值≥20,调节P值≤0.05,筛选活性成分。
1.3 活性成分靶点的预测和筛选
在获得益母草活性成分的基础上,检索TCMSP和STP数据库,限定种属为“Homo sapiens(人类)”,获取活性成分的作用靶点。通过PubChem数据库来确证收集到的活性成分,将其标准化并下载 SMILES序列。再通过TCMSP数据库搜索确证后的活性成分的靶点,将搜索的靶点按照度值从大到小排列后得到益母草的潜在靶点。在数据库STP中,搜索SMILE式,筛选条件为“概率>0”,删除重复值后预测得到药物的潜在靶点。此外,由于益母草中葫芦巴碱已被证实具有较好的治疗神经损伤作用,故将该化合物也纳入活性成分范围内[11],并通过TCMSP和STP数据库获取其成分靶点。
1.4 疾病相关靶点的筛选
通过GeneCards、DisGenet、OMIM数据库以疾病名称“cerebral ischemia”和“traumatic brain injury”进行检索,获得神经损伤相关靶标。
1.5 药物靶点与疾病靶点标准化及PPI网络构建
利用疾病靶点标准化数据库Uniprot,分别上传上述得到的益母草潜在靶点与神经损伤相关靶点名,获取其靶点的标准基因名以及Uniprot ID。为明确益母草治疗神经损伤疾病的潜在靶点,将二者的靶点上传至Venny 2.1 软件绘制韦恩图,并导出交集的基因。再将筛选得到的共有靶标蛋白上传至STRING平台,选择“multiple proteins”模式,建立药物靶蛋白-疾病靶蛋白相互作用网络,结合分值取中等“medium confidence(≥0.4)”,其余参数默认,利用 Cytoscape3.6.0软件构建益母草治疗神经损伤的PPI网络。利用cytoHubba插件计算 PPI网络每个节点的度值,筛选益母草治疗神经损伤的核心靶点。
1.6 富集分析
在上述STRING中的结果下,选择“Analysis”,点击下载“Biological Process(GO)”“Molecular Function(GO)”“Cellular Component(GO)”“KEGG Pathways”。阈值设置为P≤0.01, 并按照涉及的靶点数目多少进行排序,得到GO气泡图和 KEGG 信号通路条形图。
2. 结果
2.1 益母草活性成分的筛选
通过TCMSP数据库检索到益母草已报道的化学成分,以ADME参数OB≥30%、DL≥0.18进行筛选,得到益母草活性成分8个;BATMAN-TCM数据库检索到10个益母草活性成分;加上文献检索的1个化合物共19个(表1)。再将这19个活性成分输入TCMSP以及STP数据库,搜索的结果经过筛选去除重复项后共得到654个益母草潜在靶点。
表 1 益母草筛选所得活性成分序号 化合物 来源数据库 1 没食子酸 BATMAN-TCM 2 水苏糖 BATMAN-TCM 3 芦丁 BATMAN-TCM 4 月桂酸 BATMAN-TCM 5 水苏碱 BATMAN-TCM 6 益母草素 BATMAN-TCM 7 西班牙夏罗草酮 BATMAN-TCM 8 鸟嘌呤 BATMAN-TCM 9 益母草碱 BATMAN-TCM 10 4-胍基丁醇 BATMAN-TCM 11 鼬瓣花二萜 TCMSP 12 ZINC04073977 TCMSP 13 前益母草二萜 TCMSP 14 异前益母草二萜 TCMSP 15 槲皮苷 TCMSP 16 花生四烯酸 TCMSP 17 异鼠李素 TCMSP 18 山奈酚 TCMSP 19 葫芦巴碱 文献 2.2 疾病靶点的筛选
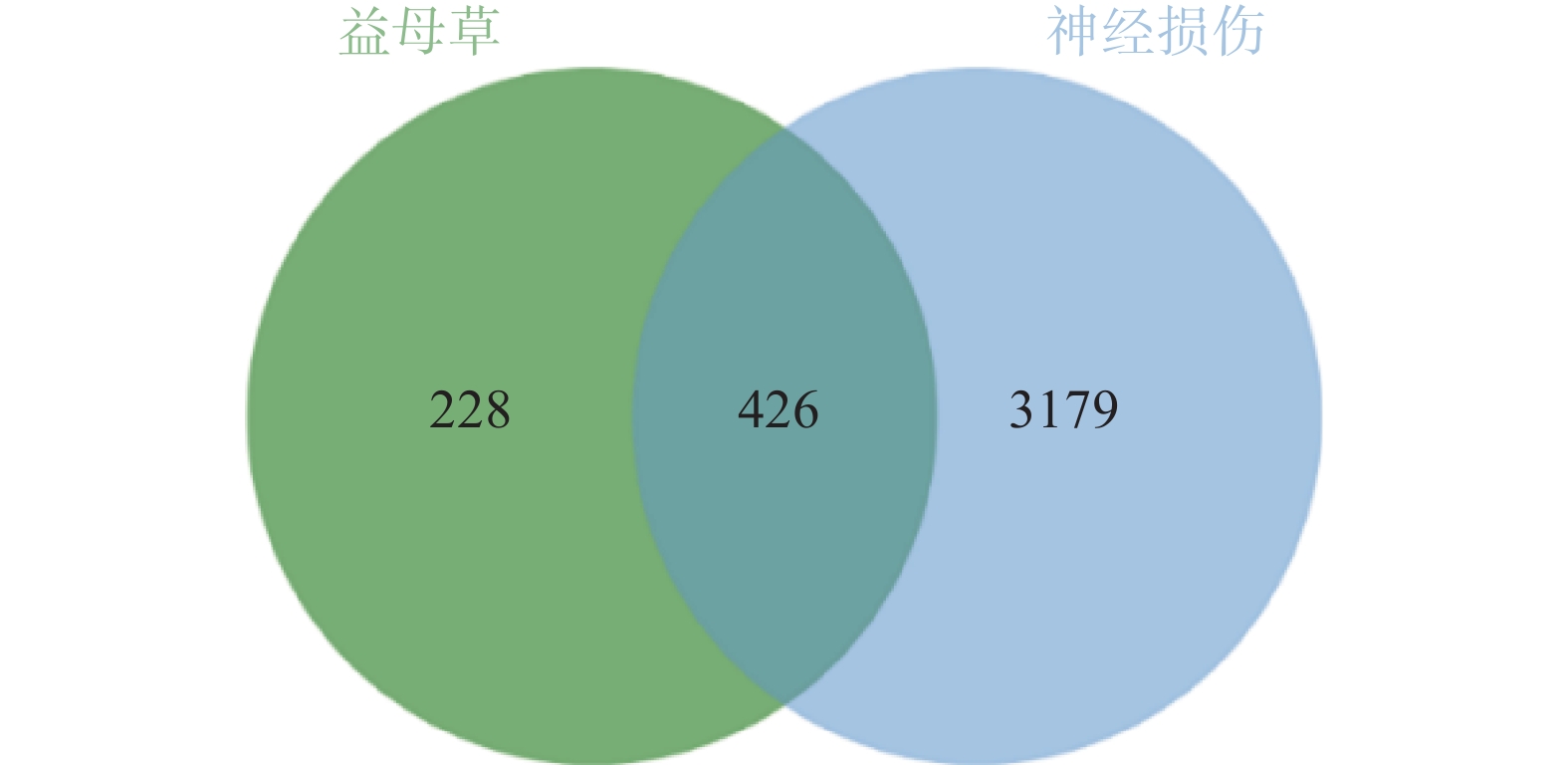
通过GeneCards、DisGenet和OMIM数据库以疾病名称为“cerebral ischemia”和“traumatic brain injury”分别进行检索,在DisGenet数据库中没有检测到TBI靶点,删除重复值后,得到神经损伤的靶点3605个,将疾病相关的靶点与益母草靶点进行Venn交集分析,筛选得到益母草治疗神经损伤的潜在靶点426个,并获得药物-疾病共同靶点基因韦恩图(图1)。
2.3 PPI 网络分析
将益母草治疗神经损伤的426个潜在靶点,导入STRING数据库,将相互作用靶点的结果导入Cytoscape 3.6.0进行可视化分析,得到由331个节点、6955条边共同组成的网络(图2),同时得到网络中关键靶点的度值(表2)。如图2所示,与神经损伤相关度较高的靶点(度值≥139)为丝氨酸/苏氨酸蛋白激酶1(AKT1)、白细胞介素6(IL-6)受体、血管内皮生长因子A(VEGFA)、半胱氨酸蛋白酶3(CASP3)、肿瘤蛋白P53(TP53)、基质金属蛋白酶-9 (MMP9)。度值大的靶点提示在网络调控中起关键作用,这些度值大的靶点很可能是益母草治疗神经损伤的关键靶点。
表 2 益母草治疗神经损伤相关靶点信息基因 度值 靶点名称 数据库中代码 AKT1 225 丝氨酸/苏氨酸蛋白激酶 P31749 IL6 217 白介素6 P05231 VEGFA 196 血管内皮生长因子A P15692 TNF 187 肿瘤生长因子 P01375 TP53 186 细胞肿瘤抗原P53 P04637 SRC 165 原癌基因酪氨酸受体激酶 P12931 CASP3 163 胱天蛋白酶-3 P42574 MAPK1 160 丝裂原活化蛋白激酶1 P28482 CXCL8 157 白介素8 P10145 EGFR 153 表皮生长因子受体 P00533 EGF 150 前表皮生长因子 P01133 PTGS2 146 牛前列腺素G/H合成酶2 P35354 MAPK8 146 丝裂原活化蛋白激酶8 P45983 MYC 146 原癌基因蛋白Myc P01106 JUN 145 转录因子AP-1 P05412 STAT3 143 信号传导及转录激活子3 P40763 FOS 143 原癌基因c-Fos P01100 MMP9 139 基质金属蛋白酶9 P14780 IL-1β 133 白介素1β P01584 2.4 GO生物过程和KEGG通路富集分析
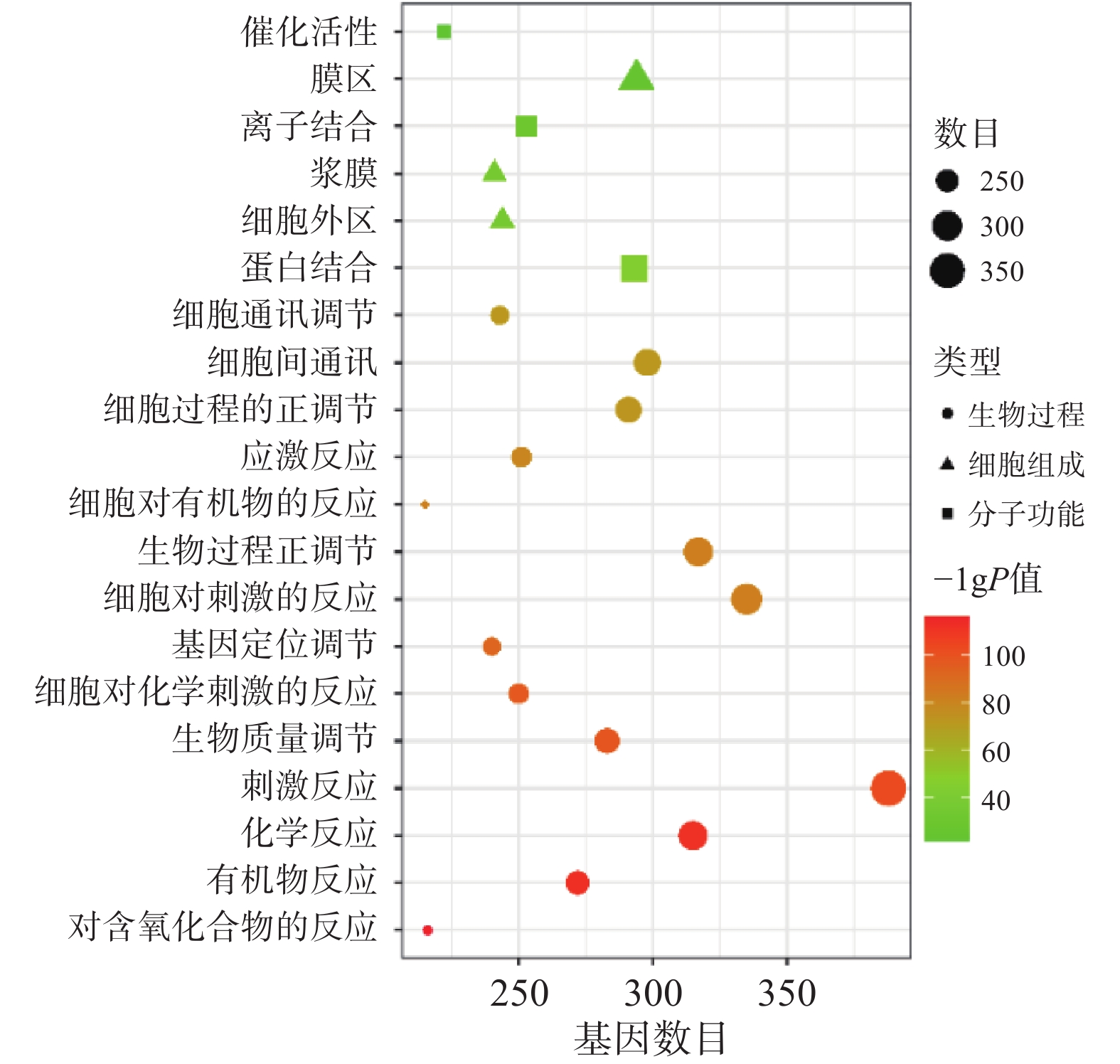
将“2.2” 项下获取的426个潜在的治疗神经损伤的靶点通过STRING进行生物过程(BP)、细胞组分(CC)和分子功能(MF)分析,以 P<0.01为条件,筛选靠前的GO富集分析,如图3所示。图中纵坐标表示富集条目,横坐标表示基因计数,颜色深浅代表-log10(p)值大小。其中 GO-BP 主要为应激反应、生物调节和细胞通讯等;GO-CC主要为细胞膜等;GO-MF主要为蛋白质结合、离子结合和催化还原活性等。
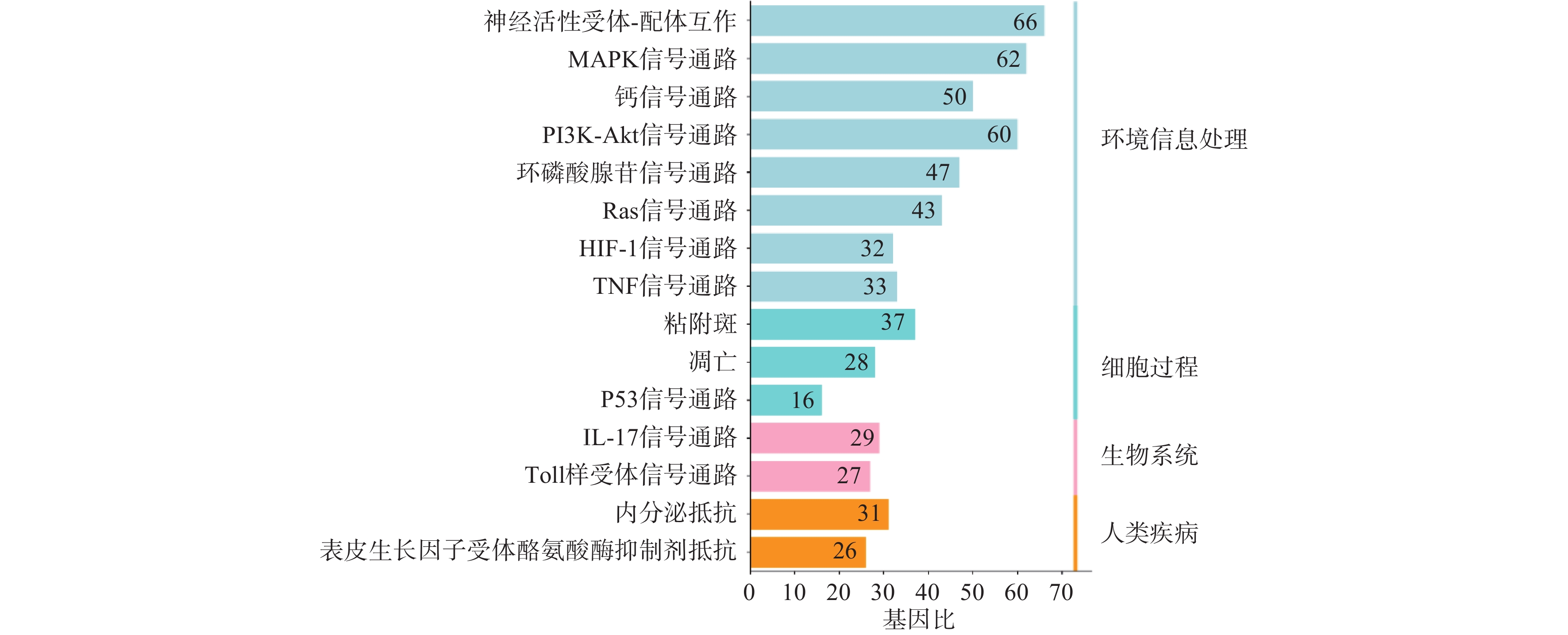
利用STRING数据库对益母草治疗神经损伤的潜在的426个靶点进行富集分析,筛选出显著的前16条信号通路(P<0.01),主要涉及的信号通路为MAPK、Toll样受体、PI3K-Akt、肿瘤坏死因子、IL-17和凋亡等信号通路(图4)。
2.5 药物“活性成分-靶点”网络的构建与分析
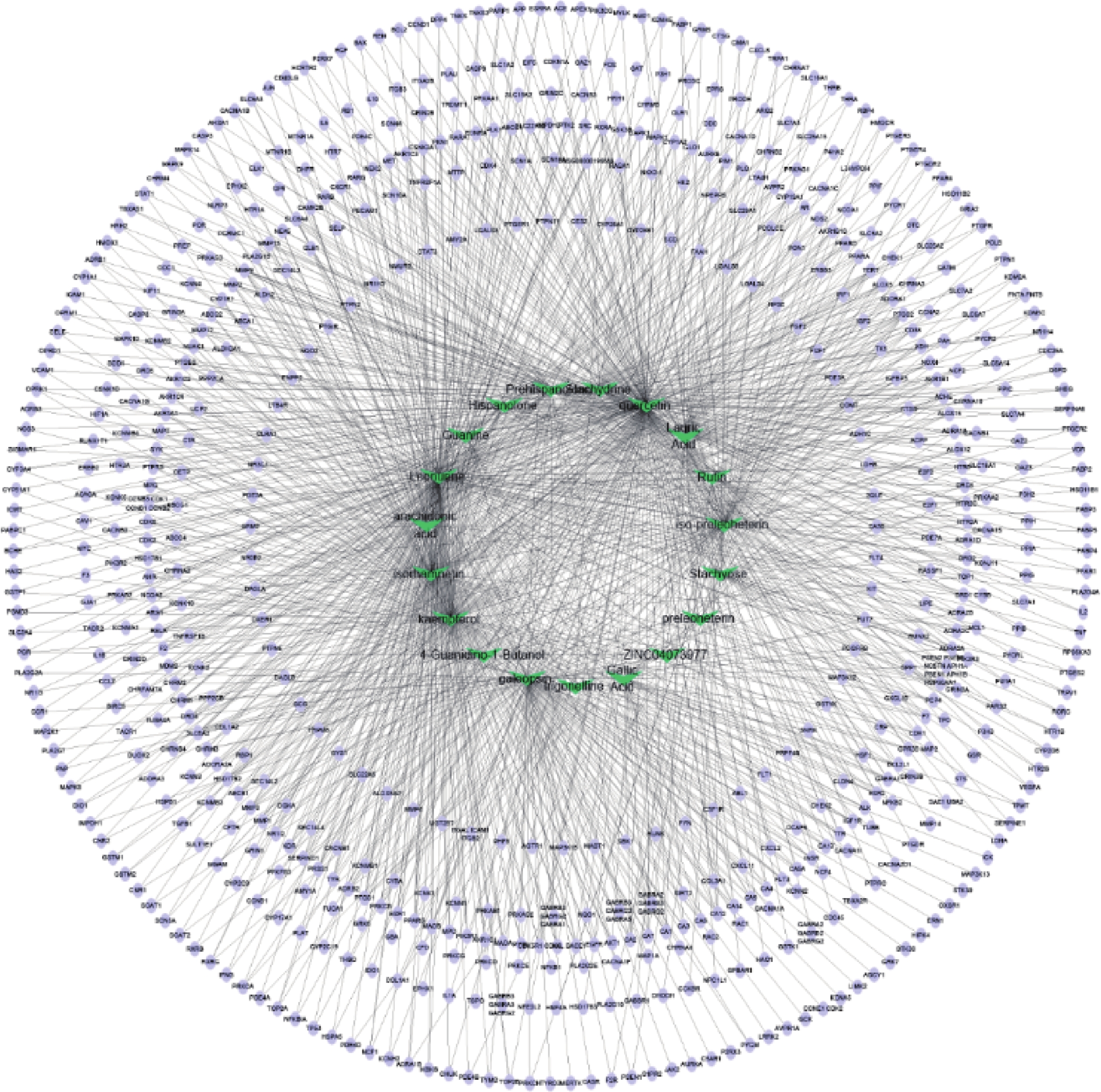
通过Cytoscape3.6.0软件得到药物“活性成分-靶点”的网络(图5)。网络中化合物19个,靶点426个。在图5中,箭头节点代表益母草中化合物,椭圆形节点代表靶点,结果可以明显看出益母草中度值相对较高的化合物有槲皮素、益母草碱、山奈酚、异鼠李素、水苏碱、葫芦巴碱等,这些化合物可能是益母草治疗神经损伤的关键化合物。
3. 讨论
本研究采用网络药理学方法,借助相关数据库以及各种绘图软件对益母草治疗神经损伤的物质基础和作用机制进行研究。共筛选出益母草有效活性成分19个,对应活性成分靶点654个。其中,益母草与神经损伤的共同基因有426个,“药物活性成分-共同靶点”网络与PPI网络结合分析,结果发现,益母草治疗神经损伤的关键活性成分有槲皮素、益母草碱、山奈酚、异鼠李素、水苏碱、葫芦巴碱等,其中槲皮素对脑缺血的作用最为突出。槲皮素通过发挥抗氧化[12]、抗炎和抗凋亡作用[13]对脑缺血的病理学改变产生了积极的治疗作用。益母草碱通过抗氧化、抗凋亡、保护线粒体和激活Nrf-2/HO-1信号通路发挥血脑屏障保护作用[14]。山萘酚具有抗氧化、抗炎、抗癌和预防心血管疾病等多种药理活性[15]。异鼠李素具有保护心脑血管、抗肿瘤、抗炎、抗氧化、保护器官、预防肥胖等作用[16]。水苏碱通过多种分子机制(包括TGF-β、ers介导的细胞凋亡、MMPs/TIMPs、NF-κB和JAK/STAT)抑制细胞外基质(ECM)沉积、降低炎症和氧化应激,以及血管生成保护血管等发挥神经保护作用[17]。葫芦巴碱具有抗凋亡、抗炎、抗氧化、神经保护等多种药理作用,具有改善认知能力的潜力。
根据益母草靶蛋白互作网络图分析可知,益母草治疗神经损伤的核心靶点主要为:AKT1,IL-6,VEGFA,CASP3, TP53,MMP-9。AKT1能够通过丝氨酸和/或苏氨酸磷酸化介导调节细胞代谢、增殖、细胞存活、胰岛素信号传导、生长和血管生成过程。据报道[18]阿托伐他汀通过抑制JNK3/cJun/caspase-3,增强Akt-nNOS信号通路,抑制脑缺血大鼠脑内细胞凋亡,对脑缺血再灌注有保护作用。IL-6可调节多种细胞的生长与分化,具有调节免疫应答、急性期反应及造血功能,并在机体的抗感染免疫反应中起重要作用。IL-6作为促炎细胞因子在脑缺血中的作用可能是通过NF-κB通路来实现的[19]。据报道,LncRNA MEG8通过miR-130a-5p/VEGFA信号靶向减轻缺血性中风后的脑缺血[20],通过靶向VEGFA,下调microRNA-195促进血管生成[21]。Caspase-3(CASP3)是细胞凋亡途径中最关键的酶类之一,与癌症的发生、衰老、心脑血管疾病的发生等有着重要联系。Nahid等[22]研究发现通过降低Bax/Bcl-2比值和caspase-3活化,可减轻脑缺血后海马CA1神经元损伤,改善脑缺血损伤引起的功能和记忆丧失。TP53是神经元凋亡的主要调节因子,任何降低TP53稳定性及其向线粒体迁移的方法都可以减轻缺血性脑区的神经元损失[23]。MMP-9是一种明胶酶,大脑中许多细胞都能分泌MMP-9。MMP-9降解细胞外基质成分,从而引发中风,Zinnhardt等[24]研究发现脑缺血的发生会促进基质金属蛋白酶(MMPs)的产生,尤其是MMP-9,另外MMP-9的激活又可引起血脑屏障受损。
GO功能富集分析发现,益母草治疗神经损伤的基因功能主要体现在生物调节、氧化应激反应、细胞通讯等生物学过程以及蛋白质结合、离子结合和催化还原等。KEGG信号通路富集分析显示,益母草治疗神经损伤所涉及的TNF信号通路、MAPK信号通路、TP53信号通路、PI3K-Akt信号通路的P值较小,被显著富集。TNF具有促进细胞生长、分化、凋亡及诱发炎症等生物学效应。TNF-α可以激活JNK,Caspase蛋白酶和转录因子NF-kB这三条信号通路,实现其免疫调节和细胞凋亡的生物学功能,从而对脑缺血产生影响。级联p38-MAPK的转导通路位于中枢神经系统,在缺血、缺氧等条件刺激下可被激活。可通过p38 MAPK和c-Jun抑制炎症反应,对损伤后的神经有保护作用[25]。Yao等[26]发现通过抑制MAPK信号通路的激活,恢复神经功能,减轻血脑屏障通透性破坏,对脑缺血产生保护作用。缺血神经元释放的内源性配体激活TLR信号通路,导致大量炎症细胞因子TNF-α、IL-1β、iNOS的产生,从而引起脑缺血后继发性炎症损伤。TLRs介导的缺血耐受可作为预防和治疗脑缺血的重要靶点[27]。TP53是一个肿瘤抑制蛋白,调节各种各样基因的表达,包括细胞凋亡等,此外TP53可不依赖其活性,仅作为一个转录因子来引发凋亡通路。抑制NF-κB及下游TP53可显著减轻神经元自噬和凋亡,具有显著的神经保护作用。NF-κB、TP53及其介导的自噬和凋亡在脑缺血再灌注损伤恶化中也起关键作用[28]。PI3K/AKT信号通路是一条与增殖,分化和凋亡相关的信号通路[29]。
综上所述,本研究应用网络药理学的方法预测了益母草治疗神经损伤的主要活性成分和潜在分子机制,但由于所使用平台的数据收录,更新相对滞后,中药活性成分筛选条件口服生物利用度与类药性并不是唯一的标准,因而,研究预测的结果有其局限性。需要在今后的实验研究中进一步阐明和验证益母草中活性成分的作用靶点,从而完善其治疗神经损伤的有效化学成分及作用机制。
-
表 1 保护胃肠道功能的药物及相关机制
改善胃肠道功能的
药物类型复方名(药物名称) 作用效果及机理 改善胃肠道运动
功能的药物丹皮-蒲公英配伍[31] 提升小肠推进率,降低胃残留率,改善胃肠动力障碍。 大承气汤改良方[32] 促进MTL释放,改善肠梗阻小鼠的胃肠道运动功能,减轻炎症反应,调节肠道菌群。 胃理气方[33] 升高C-kit、SCF的mRNA及蛋白的表达水平,上调SCF/C-kit信号通路相关蛋白表达。 白术内酯I(Atractylenolide-1)[34] 激活SCF/C-kit信号通路,调节氧化应激反应,抑制Cajal间质细胞的凋亡,改善胃运动功能。 阿奇霉素[35] 激动胃动素受体,诱发大幅度的胃推进型收缩,且药物相互作用及副作用少。 普鲁卡必利[36] 高选择性 5-羟色胺4 (5-HT4) 受体激动剂,与受体结合后,抑制环状平滑肌松弛和胆碱能传递,增强乙酰胆碱的释放,促进胃肠蠕动和黏液分泌。 改善胃肠道黏膜
屏障功能的药物肠黏膜抗氧化活性肽[37] 清除自由基,提升超氧化物歧化酶(SOD)活性,降低丙二醛(MDA)活性,保护肠黏膜。 香连丸[38] 促进DSS诱导的溃疡性结肠炎小鼠的自噬作用,抑制炎症反应,保护肠上皮屏障。 阿菠萝素[39] 调节自噬途径,抑制肠上皮细胞凋亡,改善肠上皮屏障及屏障稳态。 微囊化阿霉素(NLC-DOX)[40] 改善绒毛高度和隐窝深度,降低炎症因子表达,保持肠道通透性,增加紧密连接蛋白跨膜蛋白(ZO-1)和胞浆附着蛋白(Occludin)的表达。 Emu Oil Combined with Lyprinol™[41] 小肠中部的隐窝深度标准化,降低了肠 髓过氧化物酶(MPO)水平,减轻肠道炎症,保护肠黏膜。 Dissotis rotundifolia[42] 减少出血、水肿和白细胞浸润以及提升谷胱甘肽(GSH)水平,降低MDA 水平,增强过氧化氢酶 (CAT) 和SOD 酶水平,保护胃黏膜。 Rosmarinic Acid[43] 降低溃疡指数、减少胃液分泌量和降低酸度,通过抗炎和抗凋亡机制保护胃黏膜。 维持肠道菌群稳定
的药物多酚(绿茶多酚、姜黄素、白藜芦醇和槲皮素)[44] 促进有益细菌种的产生和生长,对抗胃肠道损伤。 益生菌[45] 防止胃肠道应激反应和肠道菌群失调的发生,减轻胃肠道反应的症状。 粪便菌群移植[46] 调节肠道菌群的组成与稳定及SCFAs的生成。 rhein[47] 调节肠道微生物群,间接改变肠道中的嘌呤代谢,从而缓解肠道炎症,保护肠道。 -
[1] 廉国锋, 徐森鹏, 白维超, 等. 驻高原官兵消化系统疾病发病特点及预防[J]. 人民军医, 2019, 62(12):1162-1165. [2] 赫玉宝, 张方信, 杜倩楠, 等. 高原缺氧与肠黏膜屏障损伤研究[J]. 中国微生态学杂志, 2018, 30(12):1470-1474. doi: 10.13381/j.cnki.cjm.201812024 [3] 施铁英, 冯丽. 厚朴排气合剂对老年2型糖尿病胃轻瘫患者胃肠激素、胃动力和氧化应激的影响[J]. 中国现代医学杂志, 2021, 31(8):7-11. doi: 10.3969/j.issn.1005-8982.2021.08.002 [4] 李红, 郑必海, 郑建保, 等. 高原缺氧对急进高原个体胃肠动力激素及其黏膜屏障的影响[J]. 激光杂志, 2010, 31(3):78-79. doi: 10.3969/j.issn.0253-2743.2010.03.044 [5] JOUNG J Y, CHOI S H, SON C G. Interstitial cells of Cajal: potential targets for functional dyspepsia treatment using medicinal natural products[J]. Evid Based Complement Alternat Med, 2021, 2021:9952691. [6] NAM J H, KIM W K, KIM B J. Sphingosine and FTY720 modulate pacemaking activity in interstitial cells of Cajal from mouse small intestine[J]. Mol Cells, 2013, 36(3):235-244. doi: 10.1007/s10059-013-0091-0 [7] 陈嘉屿, 刘德科, 马强, 等. 急进高原对Wistar大鼠胃肠运动功能的影响及其机制研究[J]. 西北国防医学杂志, 2015, 36(5):307-310. doi: 10.16021/j.cnki.1007-8622.2015.05.009 [8] 刘德科, 吴红梅, 马强, 等. 生白术对急进高原大鼠小肠推进率以及C-kit和SCF mRNA表达的影响[J]. 兰州大学学报(医学版), 2015, 41(2):32-36. [9] 朱琳, 贺巍, 范兴爱, 等. 快速进入高海拔地区对大鼠小肠Cajal间质细胞和缝隙连接蛋白43的表达影响[J]. 胃肠病学和肝病学杂志, 2017, 26(9):1048-1051. doi: 10.3969/j.issn.1006-5709.2017.09.021 [10] HILL G W, GILLUM T L, LEE B J, et al. Prolonged treadmill running in normobaric hypoxia causes gastrointestinal barrier permeability and elevates circulating levels of pro- and anti-inflammatory cytokines[J]. Appl Physiol Nutr Metab, 2020, 45(4):376-386. doi: 10.1139/apnm-2019-0378 [11] 金其贯, 佘奇, 金爱娜, 等. 模拟高原训练对大鼠小肠黏膜屏障的影响及其小麦肽的干预作用[J]. 西安体育学院学报, 2014, 31(2):225-230. [12] LI K, HE C H. Gastric mucosal lesions in tibetans with high-altitude polycythemia show increased HIF-1A expression and ROS production[J]. Biomed Res Int, 2019, 2019:6317015. [13] WANG Y P, HUO L L. Role of TLR4/NF-κB pathway in the damage of acute hypobaric hypoxia to small intestinal mucosa in rats[J]. Gen Physiol Biophys, 2021, 40(1):79-88. doi: 10.4149/gpb_2020042 [14] FOERSTER E G, MUKHERJEE T, CABRAL-FERNANDES L, et al. How autophagy controls the intestinal epithelial barrier[J]. Autophagy, 2022, 18(1):86-103. doi: 10.1080/15548627.2021.1909406 [15] POTT J, KABAT A M, MALOY K J. Intestinal epithelial cell autophagy is required to protect against TNF-induced apoptosis during chronic colitis in mice[J]. Cell Host Microbe, 2018, 23(2): 191-202. [16] 郑晓凤, 张久聪, 邓尚新, 等. 3-甲基腺嘌呤对急进高原缺氧大鼠肠上皮细胞损伤的自噬影响研究[J]. 实用药物与临床, 2016, 19(7):797-802. doi: 10.14053/j.cnki.ppcr.201607002 [17] ZHANG F X, DENG Z Y, LI W X, et al. Activation of autophagy in rats with plateau stress-induced intestinal failure[J]. Int J Clin Exp Pathol, 2015, 8(2):1816-1821. [18] FABISIAK A, BARTOSZEK A, KARDAS G, et al. Possible application of trefoil factor family peptides in gastroesophageal reflux and Barrett's esophagus[J]. Peptides, 2019, 115:27-31. doi: 10.1016/j.peptides.2019.02.007 [19] GE H F, GARDNER J, WU X S, et al. Trefoil factor 3 (TFF3) is regulated by food intake, improves glucose tolerance and induces mucinous Metaplasia[J]. PLoS One, 2015, 10(6):e0126924. doi: 10.1371/journal.pone.0126924 [20] 李康, 李启杰, 付祥胜. 高原缺氧对肠黏膜屏障的影响及TFF1表达变化的研究[J]. 西藏科技, 2020(2):60-62. doi: 10.3969/j.issn.1004-3403.2020.02.019 [21] CHEN Q C, WANG H Y, DONG A Y, et al. Effects of intermittent hypoxia intestinal bacterial translocation on mesenteric lymph node injury[J]. Zhonghua Jie He He Hu Xi Za Zhi, 2021, 44(1):32-37. [22] SUN Y M, ZHANG J H, ZHAO A P, et al. Effects of intestinal flora on the pharmacokinetics and pharmacodynamics of aspirin in high-altitude hypoxia[J]. PLoS One, 2020, 15(3):e0230197. doi: 10.1371/journal.pone.0230197 [23] HAN N, PAN Z Y, HUANG Z Y, et al. Effects of myeloid hif-1β deletion on the intestinal microbiota in mice under environmental hypoxia[J]. Infect Immun, 2020, 89(1):e00474-e00420. [24] NAGPAL R, YADAV H. Bacterial translocation from the gut to the distant organs: an overview[J]. Ann Nutr Metab, 2017, 71(Suppl 1):11-16. [25] DENGLER F, KRAETZIG A, GÄBEL G. Butyrate protects porcine colon epithelium from hypoxia-induced damage on a functional level[J]. Nutrients, 2021, 13(2):305. doi: 10.3390/nu13020305 [26] YEHUALASHET A S, YIKNA B B. Microbial ecosystem in diabetes mellitus: consideration of the gastrointestinal system[J]. Diabetes Metab Syndr Obes, 2021, 14:1841-1854. doi: 10.2147/DMSO.S304497 [27] DURAZZO M, FERRO A, GRUDEN G. Gastrointestinal microbiota and type 1 diabetes mellitus: the state of art[J]. J Clin Med, 2019, 8(11):1843. doi: 10.3390/jcm8111843 [28] RAMOS-ROMERO S, SANTOCILDES G, PIÑOL-PIÑOL D, et al. Implication of gut microbiota in the physiology of rats intermittently exposed to cold and hypobaric hypoxia[J]. PLoS One, 2020, 15(11):e0240686. doi: 10.1371/journal.pone.0240686 [29] HAQ S, GRONDIN J, BANSKOTA S, et al. Autophagy: roles in intestinal mucosal homeostasis and inflammation[J]. J Biomed Sci, 2019, 26(1):19. doi: 10.1186/s12929-019-0512-2 [30] LI Y X, XIA S T, JIANG X H, et al. Gut microbiota and diarrhea: an updated review[J]. Front Cell Infect Microbiol, 2021, 11:625210. doi: 10.3389/fcimb.2021.625210 [31] 李晓潇, 黎璇, 黄继杰, 等. 丹皮-蒲公英及其配伍对慢性应激小鼠胃肠动力的影响[J]. 右江医学, 2021, 49(4):246-249. doi: 10.3969/j.issn.1003-1383.2021.04.002 [32] 李敏, 林思思, 刘胜远, 等. 中药大承气汤改良方对术后肠梗阻小鼠胃肠功能的影响及机制研究[J]. 中国病理生理杂志, 2021, 37(3):466-474. doi: 10.3969/j.issn.1000-4718.2021.03.011 [33] 姜巍, 周剑杰, 程寒, 等. 基于干细胞因子(SCF)/C-kit信号通路探讨和胃理气方治疗功能性消化不良胃肠运动功能障碍的作用机制[J]. 广州中医药大学学报, 2021, 38(4):766-773. doi: 10.13359/j.cnki.gzxbtcm.2021.04.021 [34] LI H, CAO W, ZHANG X B, et al. Atractylenolide-1 alleviates gastroparesis in diabetic rats by activating the stem cell factor/c-kit signaling pathway[J]. Mol Med Rep, 2021, 24(4):691. doi: 10.3892/mmr.2021.12331 [35] MOUGEY E B, SAUNDERS M, FRANCIOSI J P, et al. Comparative effectiveness of intravenous azithromycin versus erythromycin stimulating antroduodenal motility in children[J]. J Pedi Gast Nutr, 2021, 74(1):25-32. [36] HONG J T. Current opinion on prucalopride in gastroparesis and chronic constipation treatment: a focus on patient selection and safety[J]. Ther Clin Risk Manag, 2021, 17:601-615. doi: 10.2147/TCRM.S269330 [37] 丁琪琪. 肠黏膜抗氧化活性肽的制备、分离纯化及鉴定[D]. 扬州: 扬州大学, 2017. [38] WANG B Y, GONG Z Q, ZHAN J Y, et al. Xianglian pill suppresses inflammation and protects intestinal epithelial barrier by promoting autophagy in DSS induced ulcerative colitis mice[J]. Front Pharmacol, 2021, 11:594847. doi: 10.3389/fphar.2020.594847 [39] MIAO Y M, LV Q, QIAO S M, et al. Alpinetin improves intestinal barrier homeostasis via regulating AhR/suv39h1/TSC2/mTORC1/autophagy pathway[J]. Toxicol Appl Pharmacol, 2019, 384:114772. doi: 10.1016/j.taap.2019.114772 [40] PINTO C M, HORTA L S, SOARES A P, et al. Nanoencapsulated doxorubicin prevents mucositis development in mice[J]. Pharmaceutics, 2021, 13(7):1021. doi: 10.3390/pharmaceutics13071021 [41] MASHTOUB S, LAMPTON L S, EDEN G L, et al. Emu oil combined with lyprinol™ reduces small intestinal damage in a rat model of chemotherapy-induced mucositis[J]. Nutr Cancer, 2016, 68(7):1171-1180. doi: 10.1080/01635581.2016.1208829 [42] ADINORTEY M B, ANSAH C, ABOAGYE B, et al. Flavonoid-rich extract of Dissotis rotundifolia whole plant protects against ethanol-induced gastric mucosal damage[J]. Biochem Res Int, 2020, 2020:7656127. [43] KANGWAN N, PINTHA K, LEKAWANVIJIT S, et al. Rosmarinic acid enriched fraction from Perilla frutescens leaves strongly protects indomethacin-induced gastric ulcer in rats[J]. Biomed Res Int, 2019, 2019:9514703. [44] CHIU H F, VENKATAKRISHNAN K, GOLOVINSKAIA O, et al. Gastroprotective effects of polyphenols against various gastro-intestinal disorders: a mini-review with special focus on clinical evidence[J]. Molecules, 2021, 26(7):2090. doi: 10.3390/molecules26072090 [45] SIMON E, C\U0103LINOIU L F, MITREA L, et al. Probiotics, prebiotics, and synbiotics: implications and beneficial effects against irritable bowel syndrome[J]. Nutrients, 2021, 13(6):2112. doi: 10.3390/nu13062112 [46] EL-SALHY M, PATCHARATRAKUL T, GONLACHANVIT S. Fecal microbiota transplantation for irritable bowel syndrome: an intervention for the 21 st century[J]. World J Gastroenterol, 2021, 27(22):2921-2943. doi: 10.3748/wjg.v27.i22.2921 [47] WU J W, WEI Z H, CHENG P, et al. Rhein modulates host purine metabolism in intestine through gut microbiota and ameliorates experimental colitis[J]. Theranostics, 2020, 10(23):10665-10679. doi: 10.7150/thno.43528 [48] RUEDA-ROBLES A, RUBIO-TOMÁS T, PLAZA-DIAZ J, et al. Impact of dietary patterns on H. pylori infection and the modulation of microbiota to counteract its effect. A narrative review[J]. Pathogens, 2021, 10(7):875. doi: 10.3390/pathogens10070875 -





 下载:
下载:


 下载:
下载:



