-
心力衰竭具有高发病率和病死率,是绝大多数终末期心脏病的最终归宿[1]。近几十年来,HF的治疗在医疗和设备方面有了很大的创新,但其发病率仍在不断增加,HF患者的生活质量和预期寿命依然出现不同程度的损害[2]。心脏能量需求是非常高的,需要源源不断消耗ATP来维持收缩舒张的功能。研究发现,HF患者会出现严重的能量代谢紊乱,包括底物吸收和利用、氧化磷酸化和ATP穿梭障碍,最终,导致心脏能量供应不足[3]。目前,关于HF疗法主要是通过降低心率、前负荷和后负荷来减轻心脏负荷,从而治疗和延缓疾病进展。关于影响心脏能量代谢的药物有很多基础研究,而能用于临床治疗的却少之又少。本综述将简单概述健康心脏和HF期间的心脏能量代谢,及通过调节能量代谢降低HF的潜在药物。
-
心脏可利用葡萄糖、脂质、氨基酸和酮体等各种底物来提供能量以维持正常的工作,它对底物的利用随生命周期生理、病理和外部环境的变化而变化[4]。胎儿由于在缺氧和低脂肪酸的环境中生存,此时,心肌主要依靠葡萄糖和乳酸代谢来产能[5]。出生后的新生儿不仅心脏血流动力学负荷和氧分压增加,且线粒体数量也在快速增加,这样会显著提高心脏的氧化能力。此时,心脏对葡萄糖的依赖减少,血乳酸水平开始下降。随着三酰甘油含量的增加,脂肪酸氧化成为心脏能量的主要来源[6]。脂肪酸是成人心脏主要的能量来源,占60%~90%,其余10%~40%来源于葡萄糖、氨基酸、丙酮酸、乳酸、酮体等[7]。其中,线粒体的氧化磷酸化可供给约95%的心肌所需的ATP,剩下的5%由糖酵解提供[8]。
-
在正常情况下,脂肪酸和葡萄糖能否得到充分利用,取决于代谢底物和氧气的浓度。1 mol的20碳脂肪酸完全氧化产生的ATP量(约134 mol)远大于1 mol葡萄糖产生的ATP量(约30 mol)。研究发现,当它们产生相同数量的ATP时,脂肪酸氧化比葡萄糖氧化需要更多的氧气。而在氧气缺少的情况下,脂肪酸氧化的生产效率明显低于葡萄糖氧化[9]。HF后的低氧环境将心脏的能量代谢逆转为胎儿期的能量代谢,葡萄糖代谢将是主要的能量来源[10]。在HF期间,葡萄糖摄入量和糖酵解速率显著增加,以补偿脂肪酸氧化以提供能量。由于HF期间,心肌细胞对游离脂肪酸的利用显著降低,血浆中游离脂肪酸浓度升高,这样可能会进一步加重能量代谢紊乱和心肌损伤[11]。
正常成人心脏中90%的能量是由线粒体的氧化磷酸化提供的。许多研究证实,心血管疾病,如心律失常、心肌病和HF,与线粒体功能和结构的改变有关[12]。研究表明,HF时心肌细胞线粒体基因突变率显著增加,引起线粒体畸变,从而影响线粒体氧化呼吸链相关酶复合物的活性和线粒体蛋白的合成[13]。这些变化导致线粒体功能障碍,影响线粒体能量代谢,耗尽心肌细胞中的能量,加快HF的进程。
-
激素是人体必需的物质,在调节新陈代谢、生长、发育、繁殖等过程中发挥着重要作用。一些激素类药物,包括甲状腺素、松弛肽和雌激素,已被用于治疗心脑血管疾病。甲状腺素是体内不可或缺的激素,与生长、细胞凋亡和能量代谢息息相关。最近的研究表明,甲状腺素可通过LKB1/AMPK/mTOR 通路来减少心肌细胞凋亡、减少能量损失和预防多柔比星引起的心脏损伤[14]。因此,甲状腺素有望成为临床预防多柔比星化疗所致心脏损害的新药。临床研究表明,怀孕期间给予松弛肽-2,可以延长急性HF患者的生存期[15]。松弛肽抗HF的分子机制目前尚不清楚,可能与内源性长链多不饱和脂肪酸的合成、氨基酸修饰中的能量代谢和心血管结构调节有关[16]。雌激素促进女性副性器官的发育、成熟和第二性征的出现,帮助维持正常的性欲和生殖功能。研究表明,雌激素可以通过保护线粒体含量和氧化能力来保护肺动脉高压模型小鼠的右心室功能。
-
有临床观察表明,二甲双胍可提高非糖尿病HF患者的心肌效率,降低耗氧量,改善心功能[17]。研究表明,二甲双胍可在一定程度上恢复左心室舒张功能,并降低免疫和炎症反应[18]。它还可以增加梗死后心力衰竭小鼠的收缩功能,同时减少心肌细胞的凋亡[19]。二甲双胍改善心功能的机制可能与调节葡萄糖吸收、线粒体功能和氧化应激有关。二甲双胍通过刺激活化 PI3K–PKB/AKT和AMPK的通路来增加葡萄糖摄取,这种积极作用已在胰岛素抵抗心肌细胞和正常胰岛素敏感心肌细胞中得到了验证[20]。二甲双胍还可以通过调节SIRT3降低PGC-1α乙酰化水平、降低受损的线粒体膜电位和增加线粒体呼吸功能来改善小鼠的心脏功能[19]。
-
钠-葡萄糖转运蛋白2(SGLT2)抑制剂是最近研发的一类抗糖尿病药物,如达格列净、卡格列净和恩格列净。有研究发现SGLT2抑制剂是潜在的心血管保护药物,在临床评估心血管安全性时可用于治疗HF[21]。临床研究表明,达格列净可降低2型糖尿病和HF患者的糖尿病性心肌病的风险,并有利于改善左心室功能。此外,达格列净还可以减轻HF患者的症状,改善身体功能和生活质量,降低心血管疾病HF进展和病死率[22]。此外,还观察到卡格列净和恩格列净也可改善HF患者的状况[23]。
-
吡格列酮是一种胰岛素增敏的噻唑烷二酮和PPARγ激动剂。研究发现,吡格列酮可逆转严重肺动脉高压和血管重构,预防右心室HF,这与通过 miRNA/mRNA 网络调节心脏肥大、纤维化、心肌收缩力、脂肪酸转运/氧化和转化生长因子信号转导有关[24]。
-
辛伐他汀是一种羟甲基戊二酰辅酶A(HMG-CoA)抑制剂,常用于高血脂的治疗,主要用于降低胆固醇。临床观察发现,服用辛伐他汀20 d可显着降低慢性HF患者的促炎标志物IL-6和C反应蛋白水平[25]。它还可以诱导脂滴积累,为维持线粒体功能提供能量,并抑制线粒体损伤和心肌细胞凋亡[26]。此外,辛伐他汀还通过降低心房诱导的一氧化氮合酶、钠钙交换剂来降低缺血性HF大鼠的氧化应激、内皮血栓形成和心房颤动[27]。
-
非诺贝特属于苯氧芳酸类降脂药,主要用于降低三酰甘油。它是一种高度选择性PPARα配体,可降低低密度脂蛋白、总胆固醇和三酰甘油的水平,并增加高密度脂蛋白[28]。研究发现,非诺贝特可防止HF模型犬心脏代谢底物的转化,并适度改善心脏功能[29]。还有研究发现,在异丙肾上腺素诱导的HF大鼠身上,非诺贝特可增加线粒体中的脂肪酸氧化,增加心肌能量代谢和氧化应激,从而保护心脏功能[30]。
-
曲美他嗪常用于治疗心绞痛,是代谢治疗中研究最广泛的药物之一。临床研究发现,它可以改善 HF患者的心脏功能、运动耐量、生活质量、左心室射血分数和心脏容量[31]。它还可以通抑制脂肪酸氧化,促进葡萄糖代谢,并维持细胞中的 PCr/ATP 比率[32]。
-
卡维地洛是一种α 1和β受体阻断剂,具有扩张血管的作用。常用于治疗轻度或中度高血压,或肾功能不全和糖尿病患者。一项临床研究表明,长期使用卡维地洛可以提高非缺血性HF患者的生存率,而更高剂量(7.5 mg/d)的卡维地洛可以提高低心率和低射血分数HF患者的生存率,但对射血分数保留的患者无效[33]。卡维地洛可降低充血性HF患者的心肌脂肪酸利用,但对葡萄糖利用没有影响[34]。它还可以增加射血分数,降低纽约心脏协会的心脏分级,增加PCr/ATP比率和代谢当量,并维持心肌高能磷酸盐水平[35]。此外,它可以增加心肌缺血模型大鼠的线粒体能量电荷,减少磷酸化滞后阶段的长度,改善心肌缺血期间的线粒体功能[36]。
已经发现这些治疗HF的合成药物在治疗其他疾病时可以改善能量代谢并保护心肌,而不是专门开发用于改善HF的能量代谢。这表明我们可以通过这些药物在体内的作用机制找到新的或最佳的HF治疗靶点,为临床药物开发治疗HF的药物提供了可能。同时,需要进一步研究这些合成药物及其衍生物治疗不同因素所致HF的特异性和安全性,为其临床应用提供更多参考。
-
多酚是一大类植物化学物质,存在于各种食物中,例如,水果、蔬菜、豆类、谷物、可可或巧克力,以及红酒、咖啡和茶等饮料。按其结构特点,大致可分为黄酮类、酚酸类、木脂素类和芪类。白藜芦醇、槲皮素、姜黄素和表没食子儿茶素没食子酸酯等多酚类物质对动脉粥样硬化、高血压、心肌梗死、蒽环类药物引起的心肌病、血管生成和HF有明显的保护作用[37]。大量多酚已被证明可有效通过能量代谢减少心血管疾病,但只有白藜芦醇进入了系统化、标准化的临床试验。此外,一些富含多酚的提取物值得关注。例如,长期使用绿茶提取物可以改善正常心肌细胞的细胞力学性能和细胞内钙动力学,提高能量利用率,并消除受磷蛋白对肌浆网Ca2+依赖性ATPase 2a的抑制作用。
-
目前,人参皂苷是用于治疗HF的主要皂苷,又称三萜皂苷。人参总皂苷通过激活TCA循环中的特定蛋白来增加心脏能量代谢[38]。阿江榄仁酸是一种天然存在的手性三萜皂苷,可以降低心肌细胞中的氧化磷酸化活性、活性氧水平和氧化应激,以减少线粒体功能障碍和增加糖酵解速率。此外,它还可以上调PPARα,降低TAK1的磷酸化水平,抑制p38 MAPK和NF-κB P65的活化,减少胶原合成和心脏肥大,从而保护心脏[39]。黄芪甲苷是黄芪提取物。它可以增加PPARα、中链酰基辅酶A脱氢酶(MCAD)和肌肉肉碱棕榈酰转移酶-1(MCP1)的表达,并增加慢性HF大鼠对游离脂肪酸的利用,从而改善心脏功能和抑制心室重构[40]。同时,它还能刺激脂肪酸β氧化并改善HF动物的线粒体功能,是一种抑制HF进展的潜在药物[41]。
-
从植物中提取的多糖对心血管疾病具有治疗作用,这与其抗炎和抗氧化作用有关[42]。但关于多糖是否调节心脏能量代谢的报道有限,仅有麦冬多糖、枸杞多糖和黄芪多糖有报道。麦冬多糖可显著降低转氨酶、乳酸脱氢酶、肌酸激酶和肌酸激酶同工酶水平,提高ATP酶活性,对缺血性心肌损伤具有保护作用[43]。枸杞的提取物枸杞多糖可以通过上调线粒体生物基因调节因子促进肌肉分化和能量代谢,通过减少HF小鼠的炎性细胞因子和脂质过氧化来发挥心脏保护作用[44]。有报道,黄芪多糖可以调节TNF -α/PGC-1信号通路介导的能量生物合成,降低ANP的mRNA和蛋白表达,增加ATP/ADP和ATP/AMP的比值,降低游离脂肪酸含量和抑制心肌细胞肥大[45]。
-
猪毛菜酚是一种来自乌头植物的生物碱。它可降低多柔比星诱导的慢性HF,降低血清心肌损伤标志物水平,减少对心脏的组织损伤,并增加TCA循环下游关键酶的mRNA 表达水平,从而增加心脏能量代谢[46]。和乌胺是一种典型的β2-肾上腺素选择性受体激动剂,也是乌头植物中的一种生物碱,可显着增加心肌收缩力[47]。川芎嗪又名四甲基吡嗪,是从川芎中分离得到的生物碱。它可以促进BCL-2向线粒体的转移,改善线粒体功能,从而防止脂多糖引起的心肌损伤[48]。它还可以通过下调miR-499a、上调SIRT1和激活 PI3K/AKT通路来减轻缺氧诱导的H9c2细胞凋亡[49]。
-
中药中,不同机制的天然产物,甚至几种药材,按照一定的规律进行组合,可以最大限度地发挥药效,减少毒副作用。这种做法即为临床补充和替代疗法。临床研究发现,口服参附颗粒可显著改善慢性HF患者的生活质量[50]。参附注射液通过刺激抗氧化剂和改变磷脂水平、分布以及牛磺酸、谷胱甘肽和磷脂的水平来减少心肌梗死的面积并保护心肌[51]。此外,临床观察发现,由十一味草药(黄芪、人参、附子、丹参、葶苈子、泽泻、玉竹、桂枝、红花、香加皮、陈皮)提取物组成的芪苈强心胶囊可以改善HF患者的生活质量,降低了心血管疾病的发生率和再住院率[52]。目前,一些天然成分和草药的联合使用和安全性仍在研究中,但它们为HF的替代和补充治疗以及HF药物的开发提供了可能。
我们对上述激素、合成药物和天然药物(表1)研究发现,大多数药物或成分可以作用于多种途径或靶点,并调节多种底物代谢。这表明我们可以考虑不同药物的组合,特别是一些大剂量、安全窗口窄的药物,可以减少剂量、耐药性和副作用。这些组成部分应进一步研究,并为其开发和应用提供可靠的数据。此外,我们还应该专注于利用这些药物的体内机制来寻找新的或最佳的HF治疗靶点。然后,应将研究结果应用于临床实践,开发更有效的治疗HF的药物和合理的治疗策略。
表 1 药物的已知途径、靶点和代谢途径摘要
药物类别 药物名称 已知通路或靶点 已知的代谢途径 激素 甲状腺素 LKB1/AMPK/mTOR 脂肪酸代谢 松弛素 – 脂肪酸合成、氨基酸代谢 雌激素 – 线粒体功能 合成药物 二甲双胍 PI3K-PKB/AKT、AMPK、PGC-1α 葡萄糖代谢、线粒体功能、氧化应激 SGLT2抑制剂 AMPK、 Na+/H+ 交换剂、NLRP3 炎症小体 酮代谢、线粒体功能、细胞内钠稳态、胰岛素信号传导、氧化应激 吡格列酮 PPAR γ 脂肪酸氧化,线粒体功能 辛伐他汀 iNOSitol、INCX、Rac1 线粒体功能,氧化应激 非诺贝特 PPARα 脂肪酸代谢 曲美他嗪 长链3-酮酰基辅酶A硫溶酶 葡萄糖代谢、脂肪酸代谢 卡维地洛 α1、β受体 脂肪酸代谢,线粒体功能 天然药物 白藜芦醇 SIRT1、CYP1B2 葡萄糖代谢、脂肪酸代谢、线粒体功能、胰岛素信号、钙2+浓度 人参皂苷Rb1 TGF-β1/SMAD ERK、AKT 葡萄糖代谢 人参皂苷Rb3 PPARα 脂肪酸代谢,线粒体功能 阿江榄仁酸 P47phox、ERK、PPARα、TAK1、p38 MAPK、NF-κB P65 葡萄糖代谢、线粒体功能、氧化应激 黄芪甲苷 PPARα、MCAD、MCP1 脂肪酸代谢,线粒体功能 麦冬多糖 AST、 LDH、CK、CK-MB、ATPase 线粒体功能 枸杞多糖 线粒体生物基因调控因子 脂肪酸代谢,线粒体功能 黄芪多糖 TNF-α/PGC-1 脂肪酸代谢 猪毛菜酚 – 线粒体功能 和乌胺 PPAR α/PGC-1α/SIRT3 线粒体功能 川芎嗪 miR-499a、SIRT1、PI3K/AKT 线粒体功能 -
大量证据表明,优化心肌能量代谢,尤其是调节底物代谢,可以保持或改善心肌机械功能,延缓HF进展,改善心功能分级、运动耐量、生活质量、左心室射血评分甚至存活率。然而,如何根据不同的病理情况选择合适的底物进行充分代谢,促进心肌代谢物的活性,增加整体供能,是HF药物的研究方向,也是亟待解决的问题。此外,大多数治疗HF的药物的开发通过能量代谢仍处于基础研究阶段,这些药物的疗效和应用变化也缺乏临床数据支持。研究人员应进一步探索HF发病机制与心肌能量代谢变化的关系,阐明影响HF能量代谢的信号通路和关键调控因素,研发有效的新方法,包括天然药物,以预防HF的发生和发展。
Advances in potential drugs for improvement of energy metabolism in heart failure
-
摘要: 心力衰竭(HF)是一个全球性的公共卫生问题,发病率和死亡率都很高。研究表明,HF是由严重的能量代谢紊乱引起的,导致心脏能量供应不足。这种能量缺乏会导致心脏泵血功能障碍和全身其他器官能量代谢的衰竭。针对HF的疗法主要通过降低心率和心脏前负荷和后负荷、对症治疗或延缓疾病的发展来发挥作用。然而,针对心脏能量代谢的药物却尚未研发出来。本文概述健康心脏中能量代谢的主要特征、HF期间的代谢变化,并讨论通过能量代谢来改善心脏功能的药物,为治疗HF药物的研发和应用提供新的研究方向。Abstract: Heart failure (HF) is a global public health problem with high morbidity and mortality. Numerous studies have shown that HF is caused by severe disturbance of energy metabolism, resulting in insufficient cardiac energy supply. This lack of energy could lead to a failure of the heart to pump blood and a failure of energy metabolism in other organs throughout the body. Currently, therapeutics of HF work by reducing heart rate and cardiac preload and afterload, symptomatic treatment, or delaying the progression of the disease. However, drugs targeting heart energy metabolism have not been developed. the main characteristics of cardiac energy metabolism, metabolic changes during HF were summarized and drugs that improve cardiac function through energy metabolism were discussed, which could provide a new research direction for the development and application of drugs in treatment of heart failure.
-
Key words:
- heart failure /
- energy metabolism /
- anti-heart failure drugs
-
近年来,慢病患病率和死亡率呈持续上升趋势,部分慢病管理现况不容乐观[1-2]。哮喘和慢性阻塞性肺疾病(COPD)作为常见的慢性呼吸系统疾病,其发病率和死亡率呈上升趋势[3-5]。据流行病学调查统计,COPD在全球人群发病率约10% ,而在我国40岁以上人群患病率高达13.7% ,位居全球死亡原因第三位[6]。支气管哮喘(简称哮喘)目前有近3.58亿人[7] ,亚洲成人哮喘患病率为0.7%~11.9%[3]。按2015年全国人口普查数据推算,我国20岁以上约有4570万人罹患哮喘[8],病死率居全球之首[9] 。随着我国老龄化人口的不断增加,哮喘和COPD 已成为我国疾病防控的重大挑战之一[10]。哮喘和COPD患者长期规范化药物治疗可以帮助患者预防急性发病,改善生活质量,减少医疗费用支出,降低死亡风险。
药学服务在一定程度上可帮助慢病患者规范药物治疗,逐步实现自我管理。近年来,药物治疗管理被广泛用于临床实践,并成为全球药学服务的主流模式[11]。药物治疗管理其服务对象以慢病患者为主,通过与医师协同工作等方式,对患者的药物治疗和生活方式进行管理。我院结合医院实际,借鉴药物治疗管理模式,以咳喘(哮喘和COPD)患者为服务对象,通过开设咳喘医药联合门诊,探索我院药学服务模式转型及咳喘医药联合门诊的规范化工作模式。
1. 咳喘医药联合门诊工作模式
1.1 药师人员资质与继续教育
参考《医疗机构药学门诊服务规范》(2021版)[12],我院对参与咳喘医药联合门诊药师资质进行了严格规定,出诊药师应具有主管药师及以上专业技术职务任职资格、经临床药师规范化培训并获得临床药师岗位培训证书或从事临床药学工作3年及以上;具有副主任药师及以上专业技术职务任职资格、从事临床药学工作2年及以上。且完成咳喘药学规范化培训,并获得《咳喘药学规范化培训结业证书》,掌握咳喘疾病的临床诊断、药物治疗、用药教育等内容,具备咳喘医药联合门诊药物治疗管理能力。此外,出诊药师需定期参加咳喘医药相关培训和学术会议,提高专业技能;并在本单位开展医护人员和患者用药宣讲,提高合理用药意识。
1.2 服务对象、服务内容及服务流程
我院以中国药学会药学服务专业委员会发起的“PCCM(Pulmonary and Critical Care Medicine)咳喘药学服务门诊”项目为依托,结合我院实际,建立了咳喘医药联合门诊。服务对象包括咳喘疾病需长期用药患者、初次使用或使用数种吸入药物患者、高龄或难以正确掌握吸入药物使用方法患者及需要咨询咳喘疾病相关药物信息患者。服务内容包括:咳喘患者治疗方案评估、建立用药记录卡、药物咨询与指导、治疗干预、个体化用药教育、指导吸入制剂正确使用、咨询与指导其他合并用药问题、正确认识疾病、不良反应防范、生活方式指导、定期随访与复诊等。工作流程具体如下:对于首诊患者,收集患者基本信息—对治疗方案进行评估—用药干预—用药教育—核实患者接受度—后期随访。对于非首诊患者,核实患者接受程度—对治疗方案进行评估—用药干预—用药教育—后期随访。
1.3 结果评估与分析
制作药学服务卡片,帮助药师归整药学服务工作。制作并使用一系列咳喘疾病评估量表,帮助患者了解疾病和药物相关知识;帮助医师、药师评估患者病情严重程度、药物接受度和疗效,为调整治疗方案提供依据。通过加大宣教力度,再次预约就诊和定期电话随访等方式,对比分析患者治疗方案可行性和远期获益。定期归纳总结患者用药过程中易出现的问题,积累实践经验。
2. 咳喘医药联合门诊实践工作初探
咳喘疾病需长期用药,药物疗效与患者对疾病的认识、吸入装置和其他治疗药物的使用及用药依从性密切相关。药师通过宣教、指导和随访等,帮助患者实现慢病的自我管理。
2.1 一般资料
选取2021年6月至2021年12月在我院呼吸消化内科咳喘医药联合门诊就诊的110名咳喘患者。纳入标准:符合中华医学会呼吸病学分会的COPD/哮喘的诊断标准,既往有COPD/哮喘反复发作病史,未进行规范化治疗和药学管理,具备基本读写能力,自愿参加本研究的患者。排除标准:处于急性发作期患者;近6个月存在不稳定心绞痛或心肌梗死者;肺癌;合并其他严重脏器疾病;认知障碍或精神类疾病;严重全身性感染。
本研究中建档患者共110例,其中男性77例,女性33例,年龄22~85岁,年龄中位数为71岁,吸烟人数中男性34人(占30.9%),女性2人(占1.82%),戒烟人数中男性7人(占6.4%),女性0人,肺功能监测患者中男性46人(占41.8%),女性18人(占16.36%)。采取电话随访、定期复诊的方式对患者进行3个月的药学干预,有效回访的患者有68例。
2.2 方法
2.2.1 填写基本信息登记表
对符合入组标准的患者进行建档管理,填写《咳喘药学服务门诊用药服务卡》,收集患者基本信息、疾病发作特点、既往用药及现用药物诊疗方案、检查检验、疾病的自我认知和既往接受医务人员干预情况。
2.2.2 评估患者吸入装置操作正确性
吸入疗法是咳喘患者治疗的基石[13],对控制患者病情起到了至关重要的作用。在诊室内辅以各种吸入装置宣教视频,反复多次指导患者操作吸入装置,当场纠正操作错误,要求患者学会后能自主操作。对其装置操作进行评分,根据制作的技术评估表进行打分,满分18分,操作正确1项得1分,不正确得0分。0~8分为差,9~12分为中等,13~17分为好,18分为良好。
2.2.3 评估患者用药依从性
对患者吸入装置、祛痰药、激素类等药物使用依从性的评价采用MMAS-8量表[14]。量表满分为8分。得分<6分表示依从性差,得分6~7分表示依从性中等,得分8分表示依从性好。
2.2.4 评估患者疾病临床有效控制情况
哮喘采用支气管哮喘控制测试(ACT)评分[15],ACT总分为25分,<20分为无效,20~24分为有效,25分为显效。COPD 采用COPD评估测试(CAT)评分[16],CAT评分总分为40分,0~10分为轻微影响,11~20分为中等影响,21~30分为严重影响,31~40分为非常严重影响。
2.2.5 安全性评价
通过电话随访记录患者治疗过程中所有药物相关的不良反应,计算不良反应发生率,用于评估用药安全性。不良反应发生率= 不良反应发生例数/总例数×100%。
2.2.6 满意度评分
设计满意度评分问卷,对患者进行满意度评分。满意度评分问卷由8个条目组成,第1~7条目,回答“是”得1分,回答“否”得0分,第8个条目为患者对药学服务模式的建议[17]。
2.2.7 用药干预与指导及科普宣教
针对不同咳喘患者治疗方案进行个体化用药指导,包括联合用药(如祛痰药、激素类药等)的使用、用药注意事项、用药教育等,制作个体化用药清单。每两周开展用药知识讲座,包括疾病科普知识、致病因素和常用治疗方法、吸入制剂和其他治疗药物的正确使用、常见用药错误和不良反应、生活方式及运动宣教指导等,并发放宣传资料,提升患者病情自我控制技巧和护理能力。
2.3 统计学方法
采用SPSS 19.0统计学软件进行分析。计量资料先进行正态分析,服从正态分布数据以均数±标准差(
$ \bar{x}\pm s $ ) 表示,两样本比较采用t检验,非正态分布数据以中位数M( P25,P75)表示,各组总体水平差异采用秩和检验(Kruskal-Wallis H检验),有统计学意义采用Bonferroni法进行两两比较。以P<0.05表示差异有统计学意义。3. 结果
3.1 吸入装置操作正确使用情况
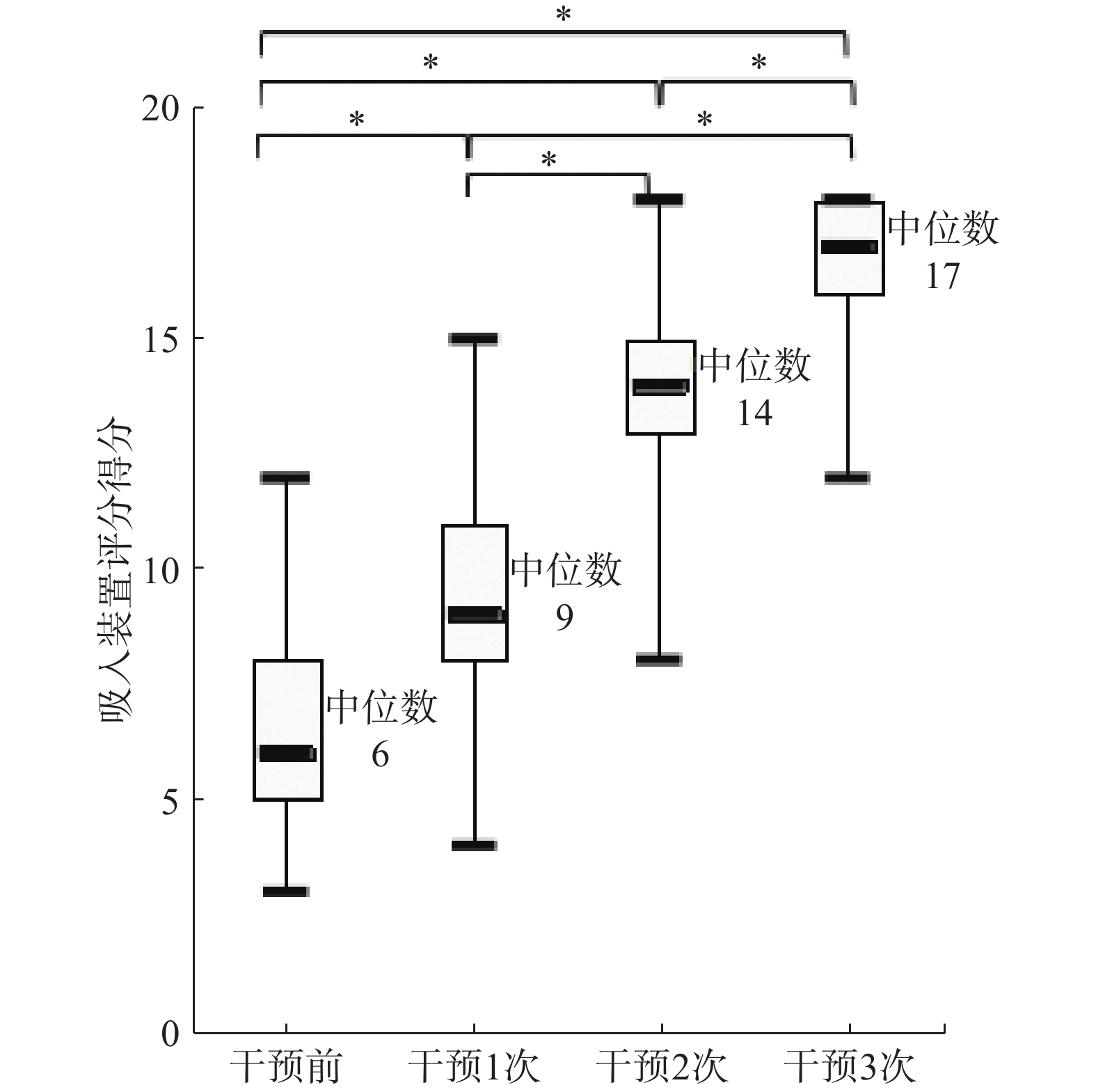
经3次用药指导,采用Kruskal-Wallis H检验分别比较68例患者干预前与干预1、2、3次后吸入装置操作评分。结果显示,干预前与干预后各组装置操作评分存在统计学差异(H=214.240,P<0.05)。经多重两两成对比较结果显示,干预次数各组间的装置评分均有显著性差异(P<0.05),见图1。
3.2 用药依从性评价
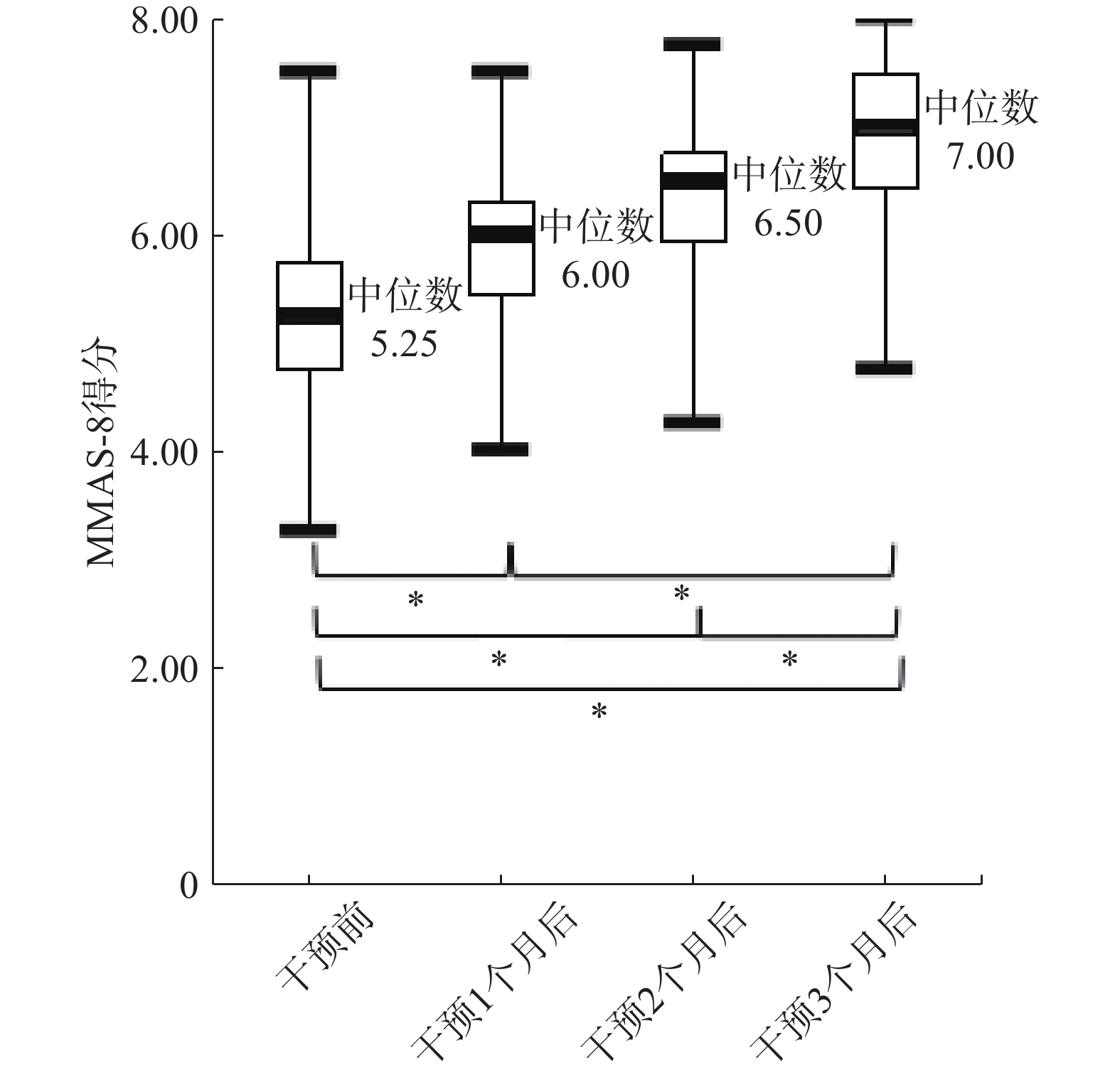
经3个月规范化治疗,采用Kruskal-Wallis H检验分别比较68例患者干预前、干预1、2、3月后的用药依从性评分。结果显示,干预前与干预后各组MMAS-8评分均存在统计学差异(H=94.005,P<0.05)。经多重两两成对比较结果显示,干预1个月后与干预2个月后的MMAS-8评分无显著性差异(P>0.05),其它各组间的MMAS-8评分均有显著性差异(P<0.05),见图2。
3.3 临床有效控制情况
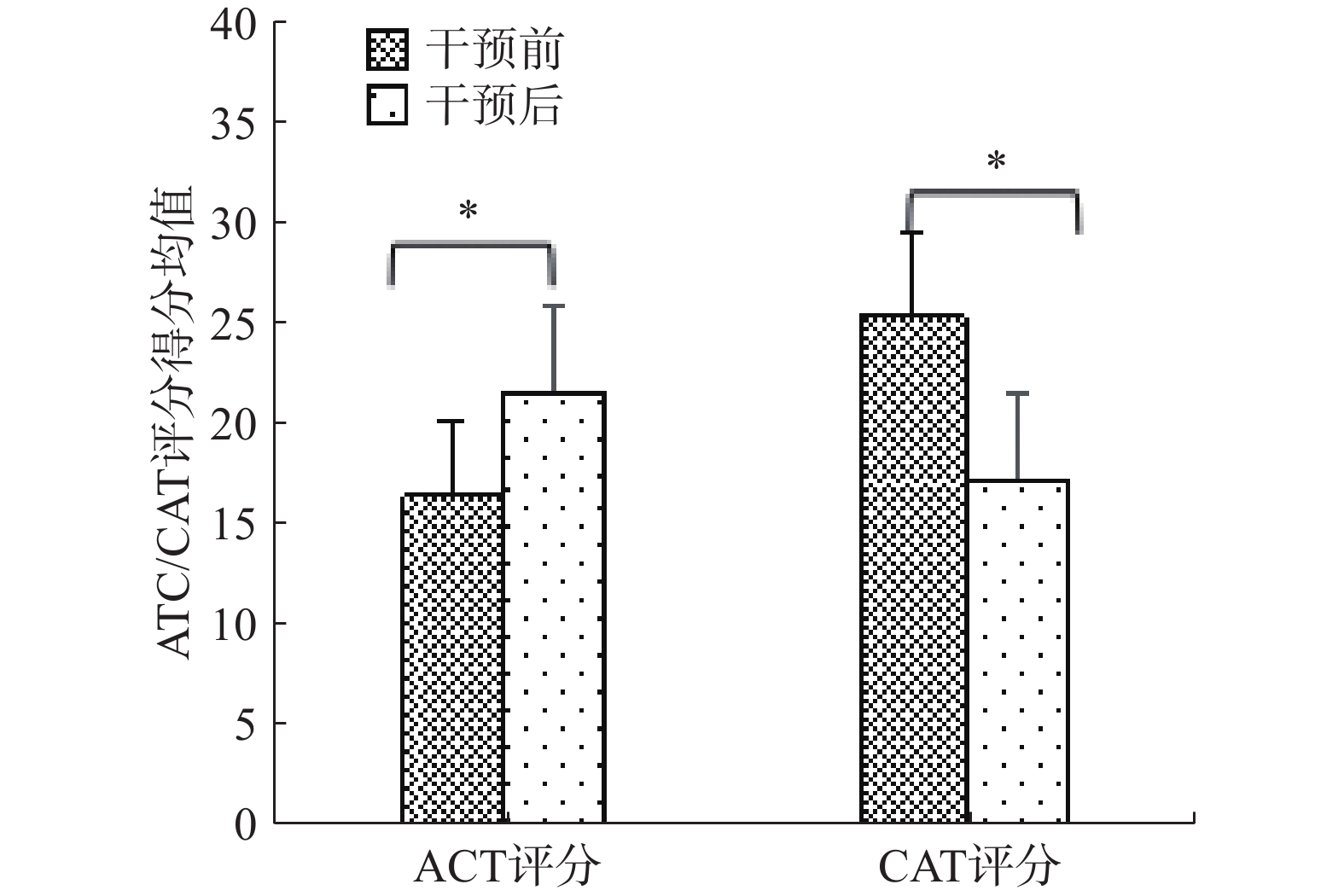
68例有效随访患者中哮喘患者共30人,COPD患者共38人,采用配对样本t检验统计干预前和干预3个月后患者临床效果评估指标评分。结果显示,干预后ACT评分显著升高,干预前后评分比较均有显著性差异(t=25.54,P<0.05);CAT评分显著下降,干预前后评分有显著性差异(t=−26.71,P<0.05),见图3。
3.4 不良反应发生情况
68例咳喘患者干预前后均未发生严重不良反应,干预前发生的不良反应主要有口干(5.88%)、声音嘶哑(4.41%)、咽喉不适(2.94%)、口腔溃疡(2.94%)、白假丝酵母菌感染(1.47%)等,总不良反应发生率17.65%;经3个月的用药干预,总不良反应发生率降为4.41%,主要有口干2例(2.94%)、声音嘶哑 1 例(1.47%)。
3.5 满意度调查情况
通过电话随访对患者进行满意度评分,结果显示:除第1、5、8条外,患者的满意度均在97%以上(表1)。
表 1 患者满意度调查表项目 占比 1.从未在门诊接受过这种药学服务 60/68(88.24%) 2.对药师提供的药学服务感到满意 67/68(98.53%) 3.与药师交流非常舒服 67/68(98.53%) 4.对药师解答的有关问题感到满意 66/68(97.06%) 5.接受药学服务后,对哮喘、COPD 和
药物治疗的认识有所提高58/68(85.29%) 6.向使用吸入器的朋友和家人推荐这项药学服务 66/68(97.06%) 7.希望接受其他疾病的这种药学服务 67/68(98.53%) 8.对该药学服务有一些建议 23/68(33.82%) 4. 讨论
随着药师工作职能的转型,药师在慢病管理方面的作用正在逐渐显现[18]。我院药师借鉴药物治疗管理模式,在实践中以咳喘慢病管理为切入点,开展咳喘医药联合门诊,将药物治疗与疾病管理有机结合,以期达成医师-药师-患者疾病管理共识。医药联合门诊一方面为患者提供了更全面、优质、规范化服务,使患者远期获益;一方面让医师更专注于疾病诊治,更好地发挥临床优势;另一方面药师以此为契机,提升专业能力,实现药师专业价值。
长期规范的吸入用药是咳喘患者治疗的核心,药师在工作中发现,患者吸入装置使用不当,用药依从性低(如吸入技术不规范、自行增/减给药剂量、停药等)[18],会造成疗效降低,甚至导致患者肺功能下降,疾病急性加重次数/再次入院风险增加,死亡风险增加[19]。在联合门诊内,药师结合患者病情及用药情况,开展个体化药学监护、干预和指导、疾病和用药知识宣教等,以提高患者用药依从性,开展不良反应监测和定期随访,以实现对患者疗效、安全性及疾病控制情况的持续管理,为疗效评估、治疗方案的调整提供依据。从干预结果看,经药师反复指导干预后,大部分患者吸入装置使用和其他合并治疗药物(如祛痰药、激素类等)能正确使用。随着干预时间的延长,3个月后用药依从性有所增加,但总体依从性为中等水平,仅部分患者达到良好。在比较干预1个月后与2个月后依从性时发现其MMAS-8得分虽有增加,但无统计学差异。可能与部分患者存在经济、生活方式改变、偶有漏服、症状缓解自主减量或停药、对疾病认识不足、未按时复诊、对药师信任度不够等因素有关。针对患者存在的不同问题,随访后期药师加强了与患者线上沟通,提醒患者按时服药,对无法按时复诊患者提供线上用药咨询与宣教指导,提高干预时效性,以提高用药依从性。满意度调查显示,患者对疾病和药物治疗的认识有所提高。随着患者依从性和用药知识的提高,干预3个月后咳喘患者临床症状控制情况有所改善。干预后不良反应发生率有所降低,用药安全性也有所提高。从调查结果看,通过医药联合门诊对咳喘患者进行长期、规范化管理,可使患者获得较好的临床疗效。
医药联合门诊在一定程度上可以提高临床疗效、用药依从性和用药安全,但因各种原因所致患者的流失在实践中普遍存在。国外文献报道,经健康管理患者流失率达73%[20]。患者的流失,严重影响患者规范化治疗。后期通过加强实时监护和陪伴宣教与患者建立信任关系[21],通过医联体、科普公众号等多种形式加强与患者沟通交流,以减少患者流失。此外,实践中还存在医师、药师观点不一致,沟通不畅等问题,加强与医师沟通交流,提升自身各项药学服务技能,达成团队共识也至关重要。
受开设时间、工作经验不足、信息技术等因素限制,本研究仅对部分临床疗效进行了初步评价,患者肺功能变化、年急性发病/住院次数、就诊花费等内容尚未评价分析。患者长期用药依从性、症状有效控制情况、药物安全性仍需加强宣教及随访监护,药学服务内容和患者满意度调查内容有待优化。后期将继续积累实践经验,优化工作模式,进一步探索评价各项指标,最终实现患者慢病自我管理。医药联合门诊在慢病长期规范化管理方面具有一定可行性,药师仍需在长期实践中优化管理和积累经验,为发展“以病人为中心”的优质化慢病药学服务提供参考。
-
表 1 药物的已知途径、靶点和代谢途径摘要
药物类别 药物名称 已知通路或靶点 已知的代谢途径 激素 甲状腺素 LKB1/AMPK/mTOR 脂肪酸代谢 松弛素 – 脂肪酸合成、氨基酸代谢 雌激素 – 线粒体功能 合成药物 二甲双胍 PI3K-PKB/AKT、AMPK、PGC-1α 葡萄糖代谢、线粒体功能、氧化应激 SGLT2抑制剂 AMPK、 Na+/H+ 交换剂、NLRP3 炎症小体 酮代谢、线粒体功能、细胞内钠稳态、胰岛素信号传导、氧化应激 吡格列酮 PPAR γ 脂肪酸氧化,线粒体功能 辛伐他汀 iNOSitol、INCX、Rac1 线粒体功能,氧化应激 非诺贝特 PPARα 脂肪酸代谢 曲美他嗪 长链3-酮酰基辅酶A硫溶酶 葡萄糖代谢、脂肪酸代谢 卡维地洛 α1、β受体 脂肪酸代谢,线粒体功能 天然药物 白藜芦醇 SIRT1、CYP1B2 葡萄糖代谢、脂肪酸代谢、线粒体功能、胰岛素信号、钙2+浓度 人参皂苷Rb1 TGF-β1/SMAD ERK、AKT 葡萄糖代谢 人参皂苷Rb3 PPARα 脂肪酸代谢,线粒体功能 阿江榄仁酸 P47phox、ERK、PPARα、TAK1、p38 MAPK、NF-κB P65 葡萄糖代谢、线粒体功能、氧化应激 黄芪甲苷 PPARα、MCAD、MCP1 脂肪酸代谢,线粒体功能 麦冬多糖 AST、 LDH、CK、CK-MB、ATPase 线粒体功能 枸杞多糖 线粒体生物基因调控因子 脂肪酸代谢,线粒体功能 黄芪多糖 TNF-α/PGC-1 脂肪酸代谢 猪毛菜酚 – 线粒体功能 和乌胺 PPAR α/PGC-1α/SIRT3 线粒体功能 川芎嗪 miR-499a、SIRT1、PI3K/AKT 线粒体功能 -
[1] VIRANI S S, ALONSO A, APARICIO H J, et al. Heart disease and stroke statistics-2021 update: a report from the American heart association[J]. Circulation,2021,143(8):e254-e743. [2] PONIKOWSKI P, VOORS A A, ANKER S D, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC[J]. Eur J Heart Fail,2016,18(8):891-975. doi: 10.1002/ejhf.592 [3] GUPTA A, HOUSTON B. A comprehensive review of the bioenergetics of fatty acid and glucose metabolism in the healthy and failing heart in nondiabetic condition[J]. Heart Fail Rev,2017,22(6):825-842. doi: 10.1007/s10741-017-9623-6 [4] RITTERHOFF J, TIAN R. Metabolism in cardiomyopathy: every substrate matters[J]. Cardiovasc Res,2017,113(4):411-421. doi: 10.1093/cvr/cvx017 [5] SANO H I, TOKI T, NAITO Y, et al. Developmental changes in the balance of glycolytic ATP production and oxidative phosphorylation in ventricular cells: a simulation study[J]. J Theor Biol,2017,419:269-277. doi: 10.1016/j.jtbi.2017.02.019 [6] LOPASCHUK G D, JASWAL J S. Energy metabolic phenotype of the cardiomyocyte during development, differentiation, and postnatal maturation[J]. J Cardiovasc Pharmacol,2010,56(2):130-140. doi: 10.1097/FJC.0b013e3181e74a14 [7] DE CARVALHO A E T S, BASSANEZE V, FORNI M F, et al. Early postnatal cardiomyocyte proliferation requires high oxidative energy metabolism[J]. Sci Rep,2017,7(1):15434. doi: 10.1038/s41598-017-15656-3 [8] HEGGERMONT W A, PAPAGEORGIOU A P, HEYMANS S, et al. Metabolic support for the heart: complementary therapy for heart failure? Eur J Heart Fail,2016,18(12):1420-1429. doi: 10.1002/ejhf.678 [9] WISNESKI J A, STANLEY W C, NEESE R A, et al. Effects of acute hyperglycemia on myocardial glycolytic activity in humans[J]. J Clin Invest,1990,85(5):1648-1656. doi: 10.1172/JCI114616 [10] MURTHY M S, PANDE S V. Malonyl-CoA binding site and the overt carnitine palmitoyltransferase activity reside on the opposite sides of the outer mitochondrial membrane[J]. Proc Natl Acad Sci USA,1987,84(2):378-382. doi: 10.1073/pnas.84.2.378 [11] PETERZAN M A, LYGATE C A, NEUBAUER S, et al. Metabolic remodeling in hypertrophied and failing myocardium: a review[J]. Am J Physiol Heart Circ Physiol,2017,313(3):H597-H616. doi: 10.1152/ajpheart.00731.2016 [12] DOENST T, NGUYEN T D, ABEL E D. Cardiac metabolism in heart failure: implications beyond ATP production[J]. Circ Res,2013,113(6):709-724. doi: 10.1161/CIRCRESAHA.113.300376 [13] AERNI-FLESSNER L, ABI-JAOUDE M, KOENIG A, et al. GLUT4, GLUT1, and GLUT8 are the dominant GLUT transcripts expressed in the murine left ventricle[J]. Cardiovasc Diabetol,2012,11:63. doi: 10.1186/1475-2840-11-63 [14] WANG Y, ZHU S, LIU H T, et al. Thyroxine alleviates energy failure, prevents myocardial cell apoptosis, and protects against doxorubicin-induced cardiac injury and cardiac dysfunction via the LKB1/AMPK/mTOR axis in mice[J]. Dis Markers,2019,2019:7420196. [15] MIRÓ Ò, HERRERO-PUENTE P, PRIETO B, et al. The subset of patients with acute heart failure able to secrete relaxin-2 at pregnancy concentrations could have a longer survival: a pilot study[J]. Biomarkers,2018,23(6):573-579. doi: 10.1080/1354750X.2018.1463564 [16] ARAGÓN-HERRERA A, FEIJÓO-BANDÍN S, ABELLA V, et al. Serelaxin (recombinant human relaxin-2) treatment affects the endogenous synthesis of long chain poly-unsaturated fatty acids and induces substantial alterations of lipidome and metabolome profiles in rat cardiac tissue[J]. Pharmacol Res,2019,144:51-65. doi: 10.1016/j.phrs.2019.04.009 [17] LARSEN A H, JESSEN N, NØRRELUND H, et al. A randomised, double-blind, placebo-controlled trial of metformin on myocardial efficiency in insulin-resistant chronic heart failure patients without diabetes[J]. Eur J Heart Fail,2020,22(9):1628-1637. doi: 10.1002/ejhf.1656 [18] JO W, KANG K K, CHAE S, et al. Metformin alleviates left ventricular diastolic dysfunction in a rat myocardial ischemia reperfusion injury model[J]. Int J Mol Sci,2020,21(4):1489. doi: 10.3390/ijms21041489 [19] SUN D, YANG F. Metformin improves cardiac function in mice with heart failure after myocardial infarction by regulating mitochondrial energy metabolism[J]. Biochem Biophys Res Commun,2017,486(2):329-335. doi: 10.1016/j.bbrc.2017.03.036 [20] BERTRAND L, GINION A, BEAULOYE C, et al. AMPK activation restores the stimulation of glucose uptake in an in vitro model of insulin-resistant cardiomyocytes via the activation of protein kinase B[J]. Am J Physiol Heart Circ Physiol,2006,291(1):H239-H250. doi: 10.1152/ajpheart.01269.2005 [21] CUSTODIO J S Jr, DURAES A R, ABREU M, et al. SGLT2 inhibition and heart failure-current concepts[J]. Heart Fail Rev,2018,23(3):409-418. doi: 10.1007/s10741-018-9703-2 [22] KOSIBOROD M N, JHUND P S, DOCHERTY K F, et al. Effects of dapagliflozin on symptoms, function, and quality of life in patients with heart failure and reduced ejection fraction: results from the DAPA-HF trial[J]. Circulation,2020,141(2):90-99. doi: 10.1161/CIRCULATIONAHA.119.044138 [23] DE BOER R A, NÚÑEZ J, KOZLOVSKI P, et al. Effects of the dual sodium-glucose linked transporter inhibitor, licogliflozin vs placebo or empagliflozin in patients with type 2 diabetes and heart failure[J]. Br J Clin Pharmacol,2020,86(7):1346-1356. doi: 10.1111/bcp.14248 [24] LEGCHENKO E, CHOUVARINE P, BORCHERT P, et al. PPARγ agonist pioglitazone reverses pulmonary hypertension and prevents right heart failure via fatty acid oxidation[J]. Sci Transl Med,2018,10(438):eaao0303. doi: 10.1126/scitranslmed.aao0303 [25] CHONG C R, CLARKE K, LEVELT E. Metabolic remodelling in diabetic cardiomyopathy[J]. Cardiovasc Res,2017,113(4):422-430. doi: 10.1093/cvr/cvx018 [26] HSIEH C C, LI C Y, HSU C H, et al. Mitochondrial protection by simvastatin against angiotensin II-mediated heart failure[J]. Br J Pharmacol,2019,176(19):3791-3804. doi: 10.1111/bph.14781 [27] CHO K I, KOO S H, CHA T J, et al. Simvastatin attenuates the oxidative stress, endothelial thrombogenicity and the inducibility of atrial fibrillation in a rat model of ischemic heart failure[J]. Int J Mol Sci,2014,15(8):14803-14818. doi: 10.3390/ijms150814803 [28] LI P, LUO S K, PAN C J, et al. Modulation of fatty acid metabolism is involved in the alleviation of isoproterenol-induced rat heart failure by fenofibrate[J]. Mol Med Rep,2015,12(6):7899-7906. doi: 10.3892/mmr.2015.4466 [29] LABINSKYY V, BELLOMO M, CHANDLER M P, et al. Chronic activation of peroxisome proliferator-activated receptor-alpha with fenofibrate prevents alterations in cardiac metabolic phenotype without changing the onset of decompensation in pacing-induced heart failure[J]. J Pharmacol Exp Ther,2007,321(1):165-171. doi: 10.1124/jpet.106.116871 [30] DHYANI N, SAIDULLAH B, FAHIM M, et al. Fenofibrate ameliorates neural, mechanical, chemical, and electrical alterations in the murine model of heart failure[J]. Hum Exp Toxicol,2019,38(10):1183-1194. doi: 10.1177/0960327119860173 [31] UNNO K, ISOBE S, IZAWA H, et al. Relation of functional and morphological changes in mitochondria to myocardial contractile and relaxation reserves in asymptomatic to mildly symptomatic patients with hypertrophic cardiomyopathy[J]. Eur Heart J,2009,30(15):1853-1862. doi: 10.1093/eurheartj/ehp184 [32] DALAL J J, MISHRA S. Modulation of myocardial energetics: an important category of agents in the multimodal treatment of coronary artery disease and heart failure[J]. Indian Heart J,2017,69(3):393-401. doi: 10.1016/j.ihj.2017.04.001 [33] NAGARA K, SUZUKI A, SHIGA T, et al. Long-term outcome of carvedilol therapy in Japanese patients with nonischemic heart failure[J]. Heart Vessels,2020,35(7):957-966. doi: 10.1007/s00380-020-01560-w [34] PODBREGAR M, VOGA G. Effect of selective and nonselective beta-blockers on resting energy production rate and total body substrate utilization in chronic heart failure[J]. J Card Fail,2002,8(6):369-378. doi: 10.1054/jcaf.2002.130238 [35] SPOLADORE R, FRAGASSO G, PERSEGHIN G, et al. Beneficial effects of beta-blockers on left ventricular function and cellular energy reserve in patients with heart failure[J]. Fundam Clin Pharmacol,2013,27(4):455-464. doi: 10.1111/j.1472-8206.2012.01029.x [36] CARAFA V, ROTILI D, FORGIONE M, et al. Sirtuin functions and modulation: from chemistry to the clinic[J]. Clin Epigenetics,2016,8:61. doi: 10.1186/s13148-016-0224-3 [37] SANTOS C N, GOMES A, OUDOT C, et al. Pure polyphenols applications for cardiac health and disease[J]. Curr Pharm Des,2018,24(19):2137-2156. doi: 10.2174/1381612824666180608102344 [38] WANG J R, ZHOU H, YI X Q, et al. Total ginsenosides of Radix Ginseng modulates tricarboxylic acid cycle protein expression to enhance cardiac energy metabolism in ischemic rat heart tissues[J]. Molecules,2012,17(11):12746-12757. doi: 10.3390/molecules171112746 [39] BANSAL T, CHATTERJEE E, SINGH J, et al. Arjunolic acid, a peroxisome proliferator-activated receptor α agonist, regresses cardiac fibrosis by inhibiting non-canonical TGF-β signaling[J]. J Biol Chem,2017,292(40):16440-16462. doi: 10.1074/jbc.M117.788299 [40] TANG B, ZHANG J G, TAN H Y, et al. Astragaloside IV inhibits ventricular remodeling and improves fatty acid utilization in rats with chronic heart failure[J]. Biosci Rep,2018,38(3):BSR20171036. doi: 10.1042/BSR20171036 [41] DONG Z W, ZHAO P, XU M, et al. Astragaloside IV alleviates heart failure via activating PPARα to switch glycolysis to fatty acid β-oxidation[J]. Sci Rep,2017,7:2691. doi: 10.1038/s41598-017-02360-5 [42] ZHANG R, XU Y, NIU H F, et al. Lycium barbarum polysaccharides restore adverse structural remodelling and cardiac contractile dysfunction induced by overexpression of microRNA-1[J]. J Cell Mol Med,2018,22(10):4830-4839. doi: 10.1111/jcmm.13740 [43] FAN S R, ZHANG J F, XIAO Q, et al. Cardioprotective effect of the polysaccharide from Ophiopogon japonicus on isoproterenol-induced myocardial ischemia in rats[J]. Int J Biol Macromol,2020,147((1):233-240. [44] MA J N, MENG X L, KANG S Y, et al. Regulatory effects of the fruit extract of Lycium chinense and its active compound, betaine, on muscle differentiation and mitochondrial biogenesis in C2C12 cells[J]. Biomed Pharmacother,2019,118:109297. doi: 10.1016/j.biopha.2019.109297 [45] LUAN A, TANG F, YANG Y, et al. Astragalus polysaccharide attenuates isoproterenol-induced cardiac hypertrophy by regulating TNF-α/PGC-1α signaling mediated energy biosynthesis[J]. Environ Toxicol Pharmacol,2015,39(3):1081-1090. doi: 10.1016/j.etap.2015.03.014 [46] VAKHRUSHEVA O, SMOLKA C, GAJAWADA P, et al. Sirt7 increases stress resistance of cardiomyocytes and prevents apoptosis and inflammatory cardiomyopathy in mice[J]. Circ Res,2008,102(6):703-710. doi: 10.1161/CIRCRESAHA.107.164558 [47] ZHANG N N, LIAN Z Q, PENG X Y, et al. Applications of higenamine in pharmacology and medicine[J]. J Ethnopharmacol,2017,196:242-252. doi: 10.1016/j.jep.2016.12.033 [48] HUANG B W, YOU J G, QIAO Y, et al. Tetramethylpyrazine attenuates lipopolysaccharide-induced cardiomyocyte injury via improving mitochondrial function mediated by 14-3-3γ[J]. Eur J Pharmacol,2018,832:67-74. doi: 10.1016/j.ejphar.2018.05.019 [49] QI D K, YOUNG L H. AMPK: energy sensor and survival mechanism in the ischemic heart[J]. Trends Endocrinol Metab,2015,26(8):422-429. doi: 10.1016/j.tem.2015.05.010 [50] WEI H M, WU H J, YU W, et al. Shenfu Decoction as adjuvant therapy for improving quality of life and hepatic dysfunction in patients with symptomatic chronic heart failure[J]. J Ethnopharmacol,2015,169:347-355. doi: 10.1016/j.jep.2015.04.016 [51] RUSSELL R R 3rd, LI J, COVEN D L, et al. AMP-activated protein kinase mediates ischemic glucose uptake and prevents postischemic cardiac dysfunction, apoptosis, and injury[J]. J Clin Invest,2004,114(4):495-503. doi: 10.1172/JCI19297 [52] SUN J, ZHANG K, XIONG W J, et al. Clinical effects of a standardized Chinese herbal remedy, Qili Qiangxin, as an adjuvant treatment in heart failure: systematic review and meta-analysis[J]. BMC Complement Altern Med,2016,16:201. doi: 10.1186/s12906-016-1174-1 -






 下载:
下载:
 下载:
下载: 

