-
水飞蓟素(SM)是从菊科植物水飞蓟[Silybum marianum (L.) Gaertn.]的果实中提取的一种黄酮木脂素类混合物,主要成分为花旗松素(TF)、水飞蓟宁(SD)、水飞蓟亭(SC)、水飞蓟宾(SB)和异水飞蓟宾(ISB) [1-4]。现代药理学研究表明,水飞蓟素具有多种药理活性,除保肝护肝脏作用外[5],其对肿瘤、糖尿病、阿尔兹海默症(AD)也有一定的治疗效果[6-8]。然而,水飞蓟素在水中的溶解度低,导致其口服生物利用度达不到要求,极大地限制了其临床应用。
磷脂复合物(PC)是指药物和磷脂分子在非质子溶剂中反应,通过电荷迁移而形成稳定的化合物(或络合物),形成复合物后能显著改变母体药物的理化性质,进而提高药物的生物利用度[9]。当前,对天然药物磷脂复合物的研究已有较多报道,如根皮素磷脂复合物[10]、鼠李素磷脂复合物[11]、鞣花酸磷脂复合物[12]。然而,对SM-PC的制备工艺研究较少 [13],且针对其体外溶出行为研究主要以水飞蓟宾为指标进行评价,难以反映水飞蓟素原料药(SM-API)中多成分的情况。基于此,笔者拟采用星点设计-效应面法[10]优化SM-PC的制备工艺,并对其5种主要活性成分的体外溶出行为进行考察,以期解决水飞蓟素溶解性差、生物利用度低的问题,为后续水飞蓟素的进一步开发应用提供依据。
-
DHG-9145A型电热恒温鼓风干燥机(上海一恒科技有限公司);Agilent1200高效液相色谱系统(DAD检测器,美国Agilent公司);DZF-6051型真空干燥箱(上海一恒科技有限公司);AL204型分析天平(梅特勒-托利多仪器有限公司);RE-52A旋转蒸发仪(上海亚荣生化仪器厂);RCZ-6BZ型药物溶出仪(上海黄海药检仪器有限公司);KQ-800KDE型超声波清洗器(昆山市超声仪器有限公司);DK-S24型电热恒温水浴器(上海精密试验设备有限公司)。
-
SM-API(辽宁盘锦华成制药厂,批号:120508,含量48 %);水飞蓟素胶囊(德国马博士制药厂,批号:B1101616,规格140 mg);TF、SC、SD、SB和ISB对照品(上海同田生物技术股份有限公司,纯度约为98.5%,批号:120115);大豆卵磷脂(江苏曼氏生物科技有限公司,批号:130201,其中,磷脂酰胆碱含量约为70 %);蛋黄卵磷脂(德国Lipoid®公司,批号:120920,其中,磷脂酰胆碱含量约为70 %);十二烷基硫酸钠(湖南尔康制药有限公司);甲醇为色谱纯,乙醇、丙酮、氯仿、磷酸、氢氧化钠等为分析纯,水为蒸馏水。
-
取SM-API 5.0 g,加入丙酮溶液500 ml,充分搅拌使其溶解,加入大豆磷脂10.0 g,在40 ℃水浴条件下持续搅拌1 h,反应液减压蒸干,加入500 ml氯仿溶解,将溶液过滤,取续滤液减压浓缩至约50 ml,将浓缩液置于45 ℃的条件下真空干燥24 h,铲下得淡黄色磷脂复合物,粉碎过80目筛避光保存。根据SM-API不溶于氯仿,而SM-PC和PC均易溶解于氯仿,将制备的SM-PC溶解于氯仿当中,溶液用0.45 μm微孔滤膜过滤,收集沉淀,干燥称重,计算复合率,公式如下:
Y =(W−W1)/ W×100 %
其中,Y为复合率,W为SM-API的质量,W1为产生沉淀的质量。
-
Agilent1200高效液相色谱系统(DAD检测器,美国Agilent公司),色谱柱为Kromasil C18柱(4.6 mm ×250 mm ,5 μm),流速为1 ml/min,柱温40 ℃,检测波长为288 nm,进样量为20 μl,以甲醇(A)-0.05 %磷酸(B)为流动相,梯度洗脱(0~4 min,35% A;4~16 min,35% A→40 % A; 16~23 min,40% A→45% A; 23~40 min,45% A→50% A)[2]。
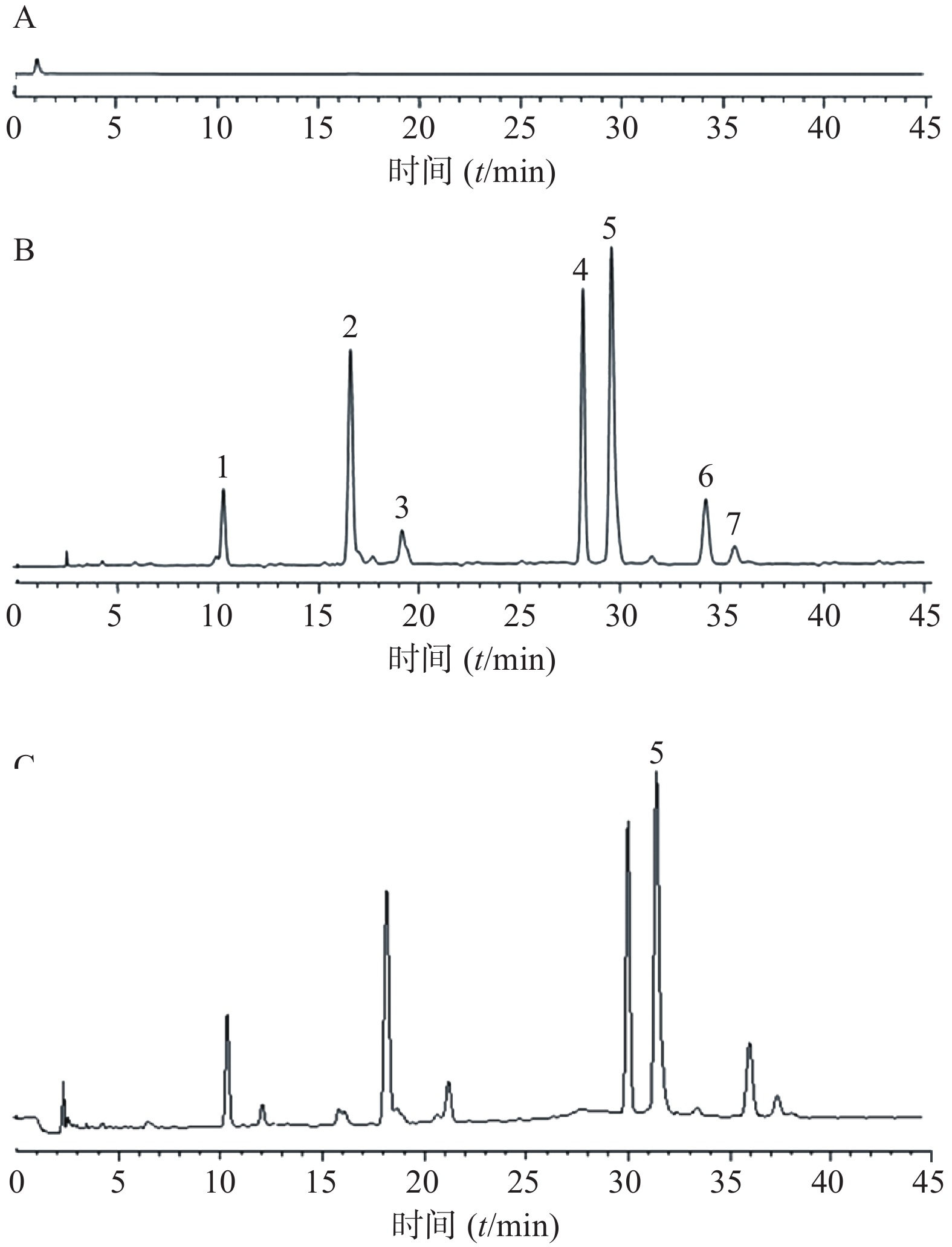
在上述色谱条件下,水飞蓟素5种成分的分离度均>1.5,结果见图1。
-
分别取TF、SC、SD、SB和ISB对照品适量,用分析天平精密称定,置于100 ml量瓶中,加甲醇轻微振摇使溶解,并稀释至刻度,得浓度为75.0、80.2、74.5、168.0、93.2 μg/ml的混合对照品溶液,保存备用。
-
取SM-PC适量(含水飞蓟素约20 mg),精密称定,置100 ml量瓶中,加甲醇轻微振摇使溶解,加65 %甲醇稀释至刻度,摇匀,0.45 μm微孔滤膜滤过,取续滤液作为供试品溶液。
-
精密量取对照品混合液0.2、0.4、0.8、1.6、2.0、2.4、4.0 ml于10 ml量瓶中,加65 %甲醇稀释至刻度,配制成TF浓度为1.5、3.0、6.0、12.0、15.0、18.0、30.0 μg/ml;SC浓度为1.6、3.2、6.4、12.8、16.0、19.2、32.1 μg/ml;SD浓度为1.5、3.0、6.0、11.9、14.9、17.9、29.8 μg/ml;SB浓度为3.4、6.7、13.4、26.9、33.6、40.3、67.2 μg/ml;ISB浓度为1.9、3.7、7.5、14.9、18.6、22.4、37.3 μg/ml的混合对照品溶液,取混合对照品溶液20 μl进样,计算峰面积。以进样浓度X(μg/ml)为横坐标,峰面积Y为纵坐标,经线性回归得回归方程,结果见表1。
表 1 水飞蓟素5种有效成分的线性方程
有效成分 线性方程 相关系数r 线性范围(μg/ml) TF Y=66.273X+3.921 0.9999 1.5~30.0 SC Y=42.952X−7.056 0.9999 1.6~32.1 SD Y=37.610 X+6.686 0.9998 1.5~29.8 SB Y=37.627X+6.684 0.9998 3.4~84.0 ISB Y=48.892X−4.681 0.9998 1.9~37.3 取SM-PC适量,按“2.2.3”项下方法平行制备 6 份供试品溶液,在“2.2.1”项下色谱条件进样测定,测得TF、SC、SD、SB和ISB峰面积RSD分别为0.86%、1.12%、0.65%、2.13%、1.87%,表明该方法重复性良好。 取同一份供试品溶液,于 0、2、4、8、12、24 h 在 “2.2.1”项下色谱条件进样测定,测得TF、SC、SD、SB和ISB峰面积RSD为 2.21%、0.98%、1.57%、2.76%、2.12%,表明溶液在 24 h 内稳定性良好。取“2.2.2”项下混合对照品溶液,在“2.2.1”项色谱条件下进样测定 6 次,测得TF、SC、SD、SB和ISB峰面积RSD分别为 0. 88%、0. 62%、0. 78%、1.05%、0.93%,表明仪器精密度良好。回收率试验结果表明,TF、SC、SD、SB和ISB的平均加样回收率分别为100.55%、99.64%、100.51%、100.13%、104.63%,RSD分别为0.95%、0.68%、1.15%、1.22%、1.05%。
-
固体药物载体比1∶2,反应温度40 ℃,反应时间1 h,药物浓度为10 mg/ml,考察反应溶剂为无水乙醇、丙酮、甲醇时药物的复合率,结果见表2。
表 2 溶剂对复合率的影响(n=3)
溶剂 介电常数 复合率(%) 无水乙醇 26.8 71.5±2.3 丙酮 19.5 75.6±2.0 甲醇 33.2 65.8±0.8 以丙酮为反应溶剂的复合率高于无水乙醇和甲醇,这可能是由于乙醇和甲醇均为质子性溶剂,不利于磷脂复合物的形成。
-
固定反应溶剂为丙酮,药物载体比1∶2、反应温度40 ℃,药物浓度为10 mg/ml,考察反应时间为0.5、1、2 、3 h时药物的复合率,结果见表3。
表 3 反应时间对复合率的影响(n=3)
反应时间(t/h) 复合率(%) 0.5 46.1±1.0 1 76.4±1.4 2 85.1±1.2 3 86.6±0.5 4 87.3±1.2 试验表明,随着反应时间的延长,则复合率也增大,当反应时间大于2 h后,复合率受时间影响较小。
-
固定反应时间为2 h,反应溶剂为丙酮,药物载体比1∶2,药物浓度为10 mg/ml,考察磷脂复合物制备温度在30、40、50和60 ℃时的复合率,结果见表4。
表 4 反应温度对复合率的影响(n=3)
温度(T/ ℃) 复合率(%) 30 68.2±0.8 40 86.7±2.2 50 90.8±0.8 60 92.4±1.3 试验表明,随着反应温度的升高,复合率也增大,在60 ℃时,复合率达到最高,考虑到磷脂在60 ℃以上时容易变性,因此未做更高温度的考察。
-
固定反应温度为60 ℃,反应溶剂为丙酮,反应时间为2 h,药物载体比1∶2,考察药物浓度为5、10、20、30 mg/ml的复合率,结果见表5。
表 5 药物浓度对复合率的影响(n=3)
药物浓度(ρB/mg·ml−1) 复合率(%) 5 92.5±1.2 10 91.5±2.2 20 88.7±0.8 30 75.8±1.3 从上表可见,药物浓度对药物的复合率有一定的影响,随着药物浓度的增加,水飞蓟素磷脂复合物的复合率降低。
-
固定药物浓度为10 mg/ml,反应温度为60 ℃,反应溶剂为丙酮,反应时间为2 h,考察水飞蓟素原料药与大豆磷脂的比例分别为1∶0.5,1∶1,1∶1.5,1∶2,1∶2.5时药物的复合率,结果见表6。
表 6 反应物投料比例对复合率的影响(n=3)
药物载体比(g/g) 复合率(%) 外观 1∶0.5 57.1±1.2 松脆 1∶1 83.0±2.2 松脆 1∶1.5 87.5±0.7 松脆 1∶2 92.2±1.2 松脆 1∶2.5 93.5±1.8 黏稠 由上表可以看出,随着磷脂用量的升高,复合率也增大,原因可能为磷脂的量增大,对水飞蓟素的增溶作用也增大,溶液分子间碰撞形成复合物的几率增大,但试验中我们发现,磷脂比例为1∶2.5时形成的复合物较黏稠,不易干燥,故选用药物载体比为1∶2。
-
固定反应温度为60 ℃,反应溶剂为丙酮,反应时间为2 h,药物浓度为10 mg/ml,水飞蓟素与磷脂的比例为1:2,考察载体采用蛋黄卵磷脂和大豆卵磷时对复合率的影响,结果见表7。
表 7 磷脂种类对复合率的影响(n=3)
磷脂种类 磷磷脂酰胆碱含量(%) 复合率(%) 外观 大豆卵磷脂 70 91.8±0.3 松脆 蛋黄卵磷脂 70 92.2±0.2 黏稠 由上表可以看出,采用大豆卵磷脂和蛋黄卵磷脂作为载体时,其复合率并没有显著区别,但采用蛋黄卵磷脂制备得到的SM-PC较为黏稠,不易干燥,因此选用大豆卵磷脂作为复合载体。
-
在单因素考察的基础上,选择对复合率影响较大的几个因素为自变量,即脂药比(X1)、反应浓度(X2)、反应温度(X3),以复合率(Y1)为因变量,采用三因素、五水平的星点试验设计,各因素的水平代码和具体的试验操作值见表8,具体的试验安排见表9。
表 8 各因素水平代码及试验操作值
因素 −1.682 −1 0 +1 +1.682 脂药比 1 1.20 1.5 1.80 2 药物浓度(ρB/mg·ml−1) 5 8.04 12.5 16.96 20 反应温度(T/ ℃) 40 44.05 50.0 55.95 60 表 9 试验设计及测定结果(n=3)
序号 X1 X2 X3 Y1 1 1.20 8.04 44.05 75.4±3.0 2 1.80 8.04 44.05 85.2±1.9 3 1.20 16.96 44.05 76.9±1.9 4 1.80 16.96 44.05 81.4±1.2 5 1.20 8.04 55.95 81.8±1.8 6 1.80 8.04 55.95 93.5±1.9 7 1.20 16.96 55.95 80.9±1.9 8 1.80 16.96 55.95 83.7±2.3 9 1.00 12.50 50.00 79.6±2.2 10 2.00 12.50 50.00 86.7±1.9 11 1.50 5.00 50.00 86.8±1.8 12 1.50 20.00 50.00 80.7±1.9 13 1.50 12.50 40.00 78.6±1.8 14 1.50 12.50 60.00 91.9±2.2 15 1.50 12.50 50.00 84.2±1.8 16 1.50 12.50 50.00 84.1±1.8 17 1.50 12.50 50.00 84.4±2.5 18 1.50 12.50 50.00 85.7±3.1 19 1.50 12.50 50.00 85.3±0.8 20 1.50 12.50 50.00 84.5±1.2 -
根据试验结果,应用SPSS 16.0统计软件,以评价指标(复合率)分别对各因素进行多元线性回归和二项式方程拟合,对二项式方程中的各系数进行t检验,删除P>0.2的项,以达到简化模型的目的。所得多元线性回归方程如下:Y=46.5846+10.034 2X1−0.381 9X2+0.534 1X3(r=0.8921),二项式方程如下:Y=75.3603+2.925 1X1+0.530 3X2−0.823 9X3−0.396 0X1X2+0.712 5 X1X3+7.039 1X2X3−7.180 2X12−0.0212 X22+2.845 9X32 (r=0.965 0)。
由以上方程可知,二项式方程拟合的回归系数r高于多元线性回归,故选择二项式拟合模型进行预测。
-
由“2.4.2”项下所得二项式方程,应用Design Expert 8.0软件绘制指标(复合率)与影响显著的两个自变量的三维效应面和二维等高图(另一个自变量设为中心点值),结果见图2、图3和图4。
由图2~4可以看出,在一定范围内,水飞蓟素与大豆卵磷脂的复合率随磷脂与水飞蓟素比例的增大而增高,随反应浓度的增高而降低,随反应温度的增高而增高。每个效应面都有其较优区域,以复合率为指标,软件给出最佳工艺是水飞蓟素与大豆卵磷脂比例为1∶1.8,反应温度55.95 ℃,反应物的浓度为8.04 mg/ml。综合考虑技术的可行性和经济的合理性,确定制备SM-PC的最优工艺条件为水飞蓟素与大豆卵磷脂的比例为1∶1.8,反应温度56 ℃,反应物的浓度8.0 mg/ml。
-
将上述优选的最佳工艺制备3批SM-PC进行验证性试验,测定水飞蓟素与磷脂的复合率,将所得结果与二项式拟合方程的预测值相比较,结果见表10。
表 10 最佳工艺条件验证试验(%)
批次 预测值 实测值 偏差 1 93.70 94.85 1.23 2 93.70 94.12 1.52 3 93.70 96.48 2.97 平均数 93.70 95.15 1.55 由表10可知,复合率的预测值和实测值的偏差小于3 %,证明试验所建立的数学模型预测性较好。
-
采用桨法测定SM-API、SM-PC、市售水飞蓟素胶囊在蒸馏水(pH5.6)和pH7.5的磷酸盐缓冲液(含0.5 % SDS)中的体外溶出度,桨转速为100 r/min,水浴温度为37 ℃。每次取含水飞蓟素150 mg的磷脂复合物粉末装入胶囊,分别于10、20、30、40、50、60 min 取样,每次10 ml,并及时补充等温度等体积的溶出介质,用0.45 μm微孔滤膜过滤后,取续滤液进样分析[14]。试验结果见图5和图6。SM-API、SM-PC和水飞蓟素胶囊在pH5.6的蒸馏水中溶出均不完全,SM-API各组分的溶出显示出较大差异,其中,水溶性成分TF溶出最高,达60%,而SB溶出不到20%。在pH7.5的磷酸盐缓冲液(含0.5 %SDS)中,SM-API的溶出度有了一定的提高,但仍溶出不完全,SM-PC各组分在60 min的溶出接近90%,主要成分SB的溶出行为与市售水飞蓟素胶囊相似,远高于原料药。
-
在制备磷脂复合物的过程中,真空干燥必须控制一定的温度条件,温度太低,则磷脂复合物无法充分干燥,制备的磷脂复合物较黏稠,不利于后续制剂的制备;而温度太高,发现所制备的磷脂复合物颜色加深,这可能是由于大豆卵磷脂在高温条件下变性所致。结合预实验,本研究最终确定制备SM-PC的真空干燥温度为45 ℃。
通常选择溶出度试验的溶剂应该接近生理条件,对于难溶性药物而言, 可根据药物的理化性质(如溶解度数据)添加适量的表面活性剂。文献报道[15],将水飞蓟素制备成磷脂复合物后,药物的脂溶性提升较大,生物利用度在人体提高了2~ 3倍,而水溶性提升相对不明显,其在水、人工肠液和人工胃液中难以完全溶出。参考市售水飞蓟素磷脂复合物制剂的溶出条件,采用溶出介质为pH7.5的磷酸盐缓冲液(含0.5 %的SDS),桨转数为100 r/min[16]。
虽然采用磷脂复合物技术有效提高了水飞蓟素的体外溶出度,但由于磷脂复合物本身具有较强的黏性,分散性较差,因而也会限制其溶出速率和溶出度提高的幅度。从本文的研究结果也可以看出,仅采用磷脂复合物技术对水飞蓟素的体外溶出度提高有限,后续可与固体分散体、微球、微丸以及自微乳给药系统等制剂新技术联合应用来进一步改善溶出行为。需要注意的是,磷脂复合物联合其它制剂新技术虽能提高其自身的分散性,加快药物的溶出,但由于采用不同制剂新技术所制备药物的微粒载药方式、释药方式和速率、粒径大小等不同,其溶出速率、跨膜方式、作用部位也可能存在差异,也会影响药物的疗效[17]。因此,实际研究过程中,应该基于药物自身的性质以及循证药学的证据去探索合适的制剂新技术。
Preparation and in vitro dissolution behaviors evaluation of silymarin phospholipid complex
-
摘要:
目的 将水飞蓟素和磷脂复合以研制水飞蓟素磷脂复合物(silymarin phospholipids complex,SM-PC),并考察其基本理化性质。 方法 采用溶剂挥发法制备SM-PC。通过前期的单因素考察,选择脂药比、药物浓度以及反应温度作为星点设计-效应面法的考察因素,以SM-PC的复合率为衡量指标筛选最佳研制工艺,并测定SM-PC的体外溶出度。 结果 SM-PC的最优制备条件如下:以丙酮为反应溶剂,水飞蓟素与大豆卵磷脂的比例为1∶1.8,反应温度56 ℃,反应物的浓度8.0 mg/ml。在此条件下制备3批样品得到SM-PC的复合率为(95.15±1.55)%,偏差<3%。体外溶出试验表明,SM-PC各组分在60 min的溶出接近90 %,主要成分水飞蓟宾的溶出行为与市售水飞蓟素胶囊相似,远高于原料药。 结论 采用星点设计-效应面法成功制备SM-PC,明显提高了溶出度,为后续制剂的研究奠定基础。 Abstract:Objective To prepare silymarin phospholipids complex(SM-PC) and investigate its physicochemical properties. Methods On the basis of single-factor tests, the drug-lipid ratio, drug concentration and reaction temperature were selected as the factors of the central composite design and response surface methodology in the preparation of SM-PC by solvent volatilization, and the best process was optimized with the compound rate as the index. And its in vitro dissolution was measured. Results The optimum preparation technology of SM-PC was as follows: acetone was used as compound solvent, the concentration of SM was 8.0 mg/ml, the mass ratio of SM to phospholipid was 1∶1.8, the reaction temperature was 56 ℃ and the recombination rate was(95.15±1.55)% with deviation of less than 3%. The in vitro dissolution test showed that the dissolution of SM-PC was close to 90% in 60 min. The dissolution behavior of main component of silybin was similar to that of silymarin capsules(Legalon ®), which was higher than SM-API. Conclusion SM-PC was successfully prepared by central composite design response surface method, which significantly improved the dissolution and laid a foundation for the study of subsequent preparations. -
水飞蓟素(SM)是从菊科植物水飞蓟[Silybum marianum (L.) Gaertn.]的果实中提取的一种黄酮木脂素类混合物,主要成分为花旗松素(TF)、水飞蓟宁(SD)、水飞蓟亭(SC)、水飞蓟宾(SB)和异水飞蓟宾(ISB) [1-4]。现代药理学研究表明,水飞蓟素具有多种药理活性,除保肝护肝脏作用外[5],其对肿瘤、糖尿病、阿尔兹海默症(AD)也有一定的治疗效果[6-8]。然而,水飞蓟素在水中的溶解度低,导致其口服生物利用度达不到要求,极大地限制了其临床应用。
磷脂复合物(PC)是指药物和磷脂分子在非质子溶剂中反应,通过电荷迁移而形成稳定的化合物(或络合物),形成复合物后能显著改变母体药物的理化性质,进而提高药物的生物利用度[9]。当前,对天然药物磷脂复合物的研究已有较多报道,如根皮素磷脂复合物[10]、鼠李素磷脂复合物[11]、鞣花酸磷脂复合物[12]。然而,对SM-PC的制备工艺研究较少 [13],且针对其体外溶出行为研究主要以水飞蓟宾为指标进行评价,难以反映水飞蓟素原料药(SM-API)中多成分的情况。基于此,笔者拟采用星点设计-效应面法[10]优化SM-PC的制备工艺,并对其5种主要活性成分的体外溶出行为进行考察,以期解决水飞蓟素溶解性差、生物利用度低的问题,为后续水飞蓟素的进一步开发应用提供依据。
1. 仪器与试药
1.1 仪器
DHG-9145A型电热恒温鼓风干燥机(上海一恒科技有限公司);Agilent1200高效液相色谱系统(DAD检测器,美国Agilent公司);DZF-6051型真空干燥箱(上海一恒科技有限公司);AL204型分析天平(梅特勒-托利多仪器有限公司);RE-52A旋转蒸发仪(上海亚荣生化仪器厂);RCZ-6BZ型药物溶出仪(上海黄海药检仪器有限公司);KQ-800KDE型超声波清洗器(昆山市超声仪器有限公司);DK-S24型电热恒温水浴器(上海精密试验设备有限公司)。
1.2 试药
SM-API(辽宁盘锦华成制药厂,批号:120508,含量48 %);水飞蓟素胶囊(德国马博士制药厂,批号:B1101616,规格140 mg);TF、SC、SD、SB和ISB对照品(上海同田生物技术股份有限公司,纯度约为98.5%,批号:120115);大豆卵磷脂(江苏曼氏生物科技有限公司,批号:130201,其中,磷脂酰胆碱含量约为70 %);蛋黄卵磷脂(德国Lipoid®公司,批号:120920,其中,磷脂酰胆碱含量约为70 %);十二烷基硫酸钠(湖南尔康制药有限公司);甲醇为色谱纯,乙醇、丙酮、氯仿、磷酸、氢氧化钠等为分析纯,水为蒸馏水。
2. 方法与结果
2.1 SM-PC的制备及复合率的测定
取SM-API 5.0 g,加入丙酮溶液500 ml,充分搅拌使其溶解,加入大豆磷脂10.0 g,在40 ℃水浴条件下持续搅拌1 h,反应液减压蒸干,加入500 ml氯仿溶解,将溶液过滤,取续滤液减压浓缩至约50 ml,将浓缩液置于45 ℃的条件下真空干燥24 h,铲下得淡黄色磷脂复合物,粉碎过80目筛避光保存。根据SM-API不溶于氯仿,而SM-PC和PC均易溶解于氯仿,将制备的SM-PC溶解于氯仿当中,溶液用0.45 μm微孔滤膜过滤,收集沉淀,干燥称重,计算复合率,公式如下:
Y =(W−W1)/ W×100 %
其中,Y为复合率,W为SM-API的质量,W1为产生沉淀的质量。
2.2 分析方法的建立
2.2.1 色谱条件
Agilent1200高效液相色谱系统(DAD检测器,美国Agilent公司),色谱柱为Kromasil C18柱(4.6 mm ×250 mm ,5 μm),流速为1 ml/min,柱温40 ℃,检测波长为288 nm,进样量为20 μl,以甲醇(A)-0.05 %磷酸(B)为流动相,梯度洗脱(0~4 min,35% A;4~16 min,35% A→40 % A; 16~23 min,40% A→45% A; 23~40 min,45% A→50% A)[2]。
在上述色谱条件下,水飞蓟素5种成分的分离度均>1.5,结果见图1。
2.2.2 对照品溶液的制备
分别取TF、SC、SD、SB和ISB对照品适量,用分析天平精密称定,置于100 ml量瓶中,加甲醇轻微振摇使溶解,并稀释至刻度,得浓度为75.0、80.2、74.5、168.0、93.2 μg/ml的混合对照品溶液,保存备用。
2.2.3 供试品溶液的制备
取SM-PC适量(含水飞蓟素约20 mg),精密称定,置100 ml量瓶中,加甲醇轻微振摇使溶解,加65 %甲醇稀释至刻度,摇匀,0.45 μm微孔滤膜滤过,取续滤液作为供试品溶液。
2.2.4 线性关系及方法学考察
精密量取对照品混合液0.2、0.4、0.8、1.6、2.0、2.4、4.0 ml于10 ml量瓶中,加65 %甲醇稀释至刻度,配制成TF浓度为1.5、3.0、6.0、12.0、15.0、18.0、30.0 μg/ml;SC浓度为1.6、3.2、6.4、12.8、16.0、19.2、32.1 μg/ml;SD浓度为1.5、3.0、6.0、11.9、14.9、17.9、29.8 μg/ml;SB浓度为3.4、6.7、13.4、26.9、33.6、40.3、67.2 μg/ml;ISB浓度为1.9、3.7、7.5、14.9、18.6、22.4、37.3 μg/ml的混合对照品溶液,取混合对照品溶液20 μl进样,计算峰面积。以进样浓度X(μg/ml)为横坐标,峰面积Y为纵坐标,经线性回归得回归方程,结果见表1。
表 1 水飞蓟素5种有效成分的线性方程有效成分 线性方程 相关系数r 线性范围(μg/ml) TF Y=66.273X+3.921 0.9999 1.5~30.0 SC Y=42.952X−7.056 0.9999 1.6~32.1 SD Y=37.610 X+6.686 0.9998 1.5~29.8 SB Y=37.627X+6.684 0.9998 3.4~84.0 ISB Y=48.892X−4.681 0.9998 1.9~37.3 取SM-PC适量,按“2.2.3”项下方法平行制备 6 份供试品溶液,在“2.2.1”项下色谱条件进样测定,测得TF、SC、SD、SB和ISB峰面积RSD分别为0.86%、1.12%、0.65%、2.13%、1.87%,表明该方法重复性良好。 取同一份供试品溶液,于 0、2、4、8、12、24 h 在 “2.2.1”项下色谱条件进样测定,测得TF、SC、SD、SB和ISB峰面积RSD为 2.21%、0.98%、1.57%、2.76%、2.12%,表明溶液在 24 h 内稳定性良好。取“2.2.2”项下混合对照品溶液,在“2.2.1”项色谱条件下进样测定 6 次,测得TF、SC、SD、SB和ISB峰面积RSD分别为 0. 88%、0. 62%、0. 78%、1.05%、0.93%,表明仪器精密度良好。回收率试验结果表明,TF、SC、SD、SB和ISB的平均加样回收率分别为100.55%、99.64%、100.51%、100.13%、104.63%,RSD分别为0.95%、0.68%、1.15%、1.22%、1.05%。
2.3 SM-PC处方筛选的单因素考察
2.3.1 反应溶剂的影响
固体药物载体比1∶2,反应温度40 ℃,反应时间1 h,药物浓度为10 mg/ml,考察反应溶剂为无水乙醇、丙酮、甲醇时药物的复合率,结果见表2。
表 2 溶剂对复合率的影响(n=3)溶剂 介电常数 复合率(%) 无水乙醇 26.8 71.5±2.3 丙酮 19.5 75.6±2.0 甲醇 33.2 65.8±0.8 以丙酮为反应溶剂的复合率高于无水乙醇和甲醇,这可能是由于乙醇和甲醇均为质子性溶剂,不利于磷脂复合物的形成。
2.3.2 反应时间的影响
固定反应溶剂为丙酮,药物载体比1∶2、反应温度40 ℃,药物浓度为10 mg/ml,考察反应时间为0.5、1、2 、3 h时药物的复合率,结果见表3。
表 3 反应时间对复合率的影响(n=3)反应时间(t/h) 复合率(%) 0.5 46.1±1.0 1 76.4±1.4 2 85.1±1.2 3 86.6±0.5 4 87.3±1.2 试验表明,随着反应时间的延长,则复合率也增大,当反应时间大于2 h后,复合率受时间影响较小。
2.3.3 反应温度的影响
固定反应时间为2 h,反应溶剂为丙酮,药物载体比1∶2,药物浓度为10 mg/ml,考察磷脂复合物制备温度在30、40、50和60 ℃时的复合率,结果见表4。
表 4 反应温度对复合率的影响(n=3)温度(T/ ℃) 复合率(%) 30 68.2±0.8 40 86.7±2.2 50 90.8±0.8 60 92.4±1.3 试验表明,随着反应温度的升高,复合率也增大,在60 ℃时,复合率达到最高,考虑到磷脂在60 ℃以上时容易变性,因此未做更高温度的考察。
2.3.4 药物浓度的影响
固定反应温度为60 ℃,反应溶剂为丙酮,反应时间为2 h,药物载体比1∶2,考察药物浓度为5、10、20、30 mg/ml的复合率,结果见表5。
表 5 药物浓度对复合率的影响(n=3)药物浓度(ρB/mg·ml−1) 复合率(%) 5 92.5±1.2 10 91.5±2.2 20 88.7±0.8 30 75.8±1.3 从上表可见,药物浓度对药物的复合率有一定的影响,随着药物浓度的增加,水飞蓟素磷脂复合物的复合率降低。
2.3.5 水飞蓟素与大豆磷脂的比例
固定药物浓度为10 mg/ml,反应温度为60 ℃,反应溶剂为丙酮,反应时间为2 h,考察水飞蓟素原料药与大豆磷脂的比例分别为1∶0.5,1∶1,1∶1.5,1∶2,1∶2.5时药物的复合率,结果见表6。
表 6 反应物投料比例对复合率的影响(n=3)药物载体比(g/g) 复合率(%) 外观 1∶0.5 57.1±1.2 松脆 1∶1 83.0±2.2 松脆 1∶1.5 87.5±0.7 松脆 1∶2 92.2±1.2 松脆 1∶2.5 93.5±1.8 黏稠 由上表可以看出,随着磷脂用量的升高,复合率也增大,原因可能为磷脂的量增大,对水飞蓟素的增溶作用也增大,溶液分子间碰撞形成复合物的几率增大,但试验中我们发现,磷脂比例为1∶2.5时形成的复合物较黏稠,不易干燥,故选用药物载体比为1∶2。
2.3.6 磷脂的种类
固定反应温度为60 ℃,反应溶剂为丙酮,反应时间为2 h,药物浓度为10 mg/ml,水飞蓟素与磷脂的比例为1:2,考察载体采用蛋黄卵磷脂和大豆卵磷时对复合率的影响,结果见表7。
表 7 磷脂种类对复合率的影响(n=3)磷脂种类 磷磷脂酰胆碱含量(%) 复合率(%) 外观 大豆卵磷脂 70 91.8±0.3 松脆 蛋黄卵磷脂 70 92.2±0.2 黏稠 由上表可以看出,采用大豆卵磷脂和蛋黄卵磷脂作为载体时,其复合率并没有显著区别,但采用蛋黄卵磷脂制备得到的SM-PC较为黏稠,不易干燥,因此选用大豆卵磷脂作为复合载体。
2.4 星点设计-效应面法优化处方
2.4.1 试验设计
在单因素考察的基础上,选择对复合率影响较大的几个因素为自变量,即脂药比(X1)、反应浓度(X2)、反应温度(X3),以复合率(Y1)为因变量,采用三因素、五水平的星点试验设计,各因素的水平代码和具体的试验操作值见表8,具体的试验安排见表9。
表 8 各因素水平代码及试验操作值因素 −1.682 −1 0 +1 +1.682 脂药比 1 1.20 1.5 1.80 2 药物浓度(ρB/mg·ml−1) 5 8.04 12.5 16.96 20 反应温度(T/ ℃) 40 44.05 50.0 55.95 60 表 9 试验设计及测定结果(n=3)序号 X1 X2 X3 Y1 1 1.20 8.04 44.05 75.4±3.0 2 1.80 8.04 44.05 85.2±1.9 3 1.20 16.96 44.05 76.9±1.9 4 1.80 16.96 44.05 81.4±1.2 5 1.20 8.04 55.95 81.8±1.8 6 1.80 8.04 55.95 93.5±1.9 7 1.20 16.96 55.95 80.9±1.9 8 1.80 16.96 55.95 83.7±2.3 9 1.00 12.50 50.00 79.6±2.2 10 2.00 12.50 50.00 86.7±1.9 11 1.50 5.00 50.00 86.8±1.8 12 1.50 20.00 50.00 80.7±1.9 13 1.50 12.50 40.00 78.6±1.8 14 1.50 12.50 60.00 91.9±2.2 15 1.50 12.50 50.00 84.2±1.8 16 1.50 12.50 50.00 84.1±1.8 17 1.50 12.50 50.00 84.4±2.5 18 1.50 12.50 50.00 85.7±3.1 19 1.50 12.50 50.00 85.3±0.8 20 1.50 12.50 50.00 84.5±1.2 2.4.2 模型拟合
根据试验结果,应用SPSS 16.0统计软件,以评价指标(复合率)分别对各因素进行多元线性回归和二项式方程拟合,对二项式方程中的各系数进行t检验,删除P>0.2的项,以达到简化模型的目的。所得多元线性回归方程如下:Y=46.5846+10.034 2X1−0.381 9X2+0.534 1X3(r=0.8921),二项式方程如下:Y=75.3603+2.925 1X1+0.530 3X2−0.823 9X3−0.396 0X1X2+0.712 5 X1X3+7.039 1X2X3−7.180 2X12−0.0212 X22+2.845 9X32 (r=0.965 0)。
由以上方程可知,二项式方程拟合的回归系数r高于多元线性回归,故选择二项式拟合模型进行预测。
2.4.3 效应面优化与预测
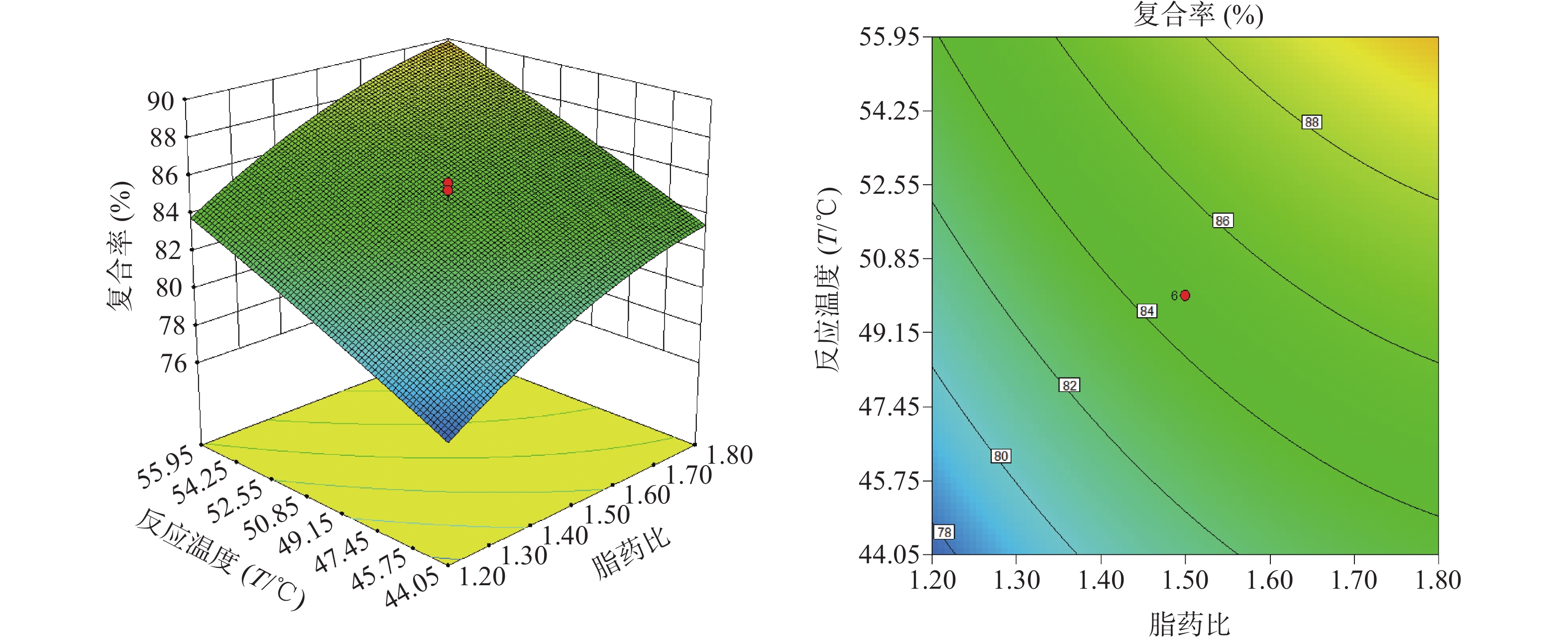
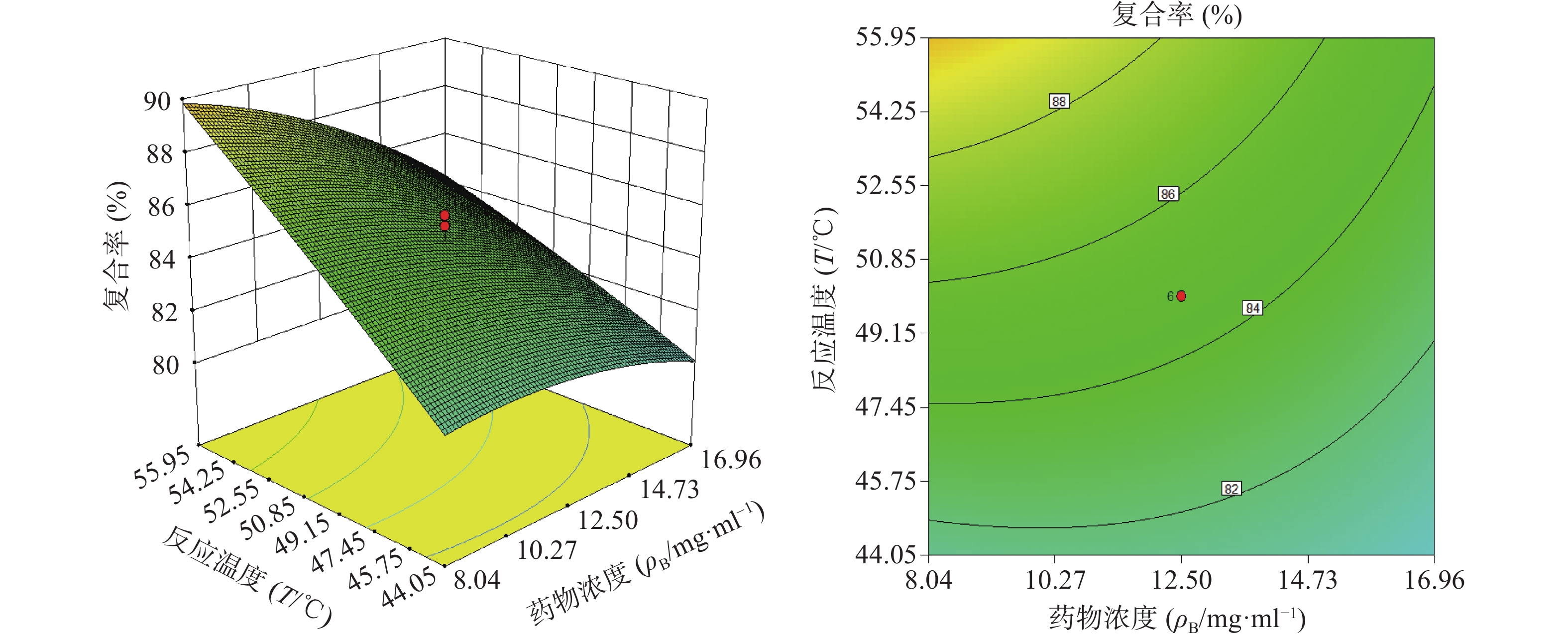
由“2.4.2”项下所得二项式方程,应用Design Expert 8.0软件绘制指标(复合率)与影响显著的两个自变量的三维效应面和二维等高图(另一个自变量设为中心点值),结果见图2、图3和图4。
由图2~4可以看出,在一定范围内,水飞蓟素与大豆卵磷脂的复合率随磷脂与水飞蓟素比例的增大而增高,随反应浓度的增高而降低,随反应温度的增高而增高。每个效应面都有其较优区域,以复合率为指标,软件给出最佳工艺是水飞蓟素与大豆卵磷脂比例为1∶1.8,反应温度55.95 ℃,反应物的浓度为8.04 mg/ml。综合考虑技术的可行性和经济的合理性,确定制备SM-PC的最优工艺条件为水飞蓟素与大豆卵磷脂的比例为1∶1.8,反应温度56 ℃,反应物的浓度8.0 mg/ml。
2.5 优化工艺的验证
将上述优选的最佳工艺制备3批SM-PC进行验证性试验,测定水飞蓟素与磷脂的复合率,将所得结果与二项式拟合方程的预测值相比较,结果见表10。
表 10 最佳工艺条件验证试验(%)批次 预测值 实测值 偏差 1 93.70 94.85 1.23 2 93.70 94.12 1.52 3 93.70 96.48 2.97 平均数 93.70 95.15 1.55 由表10可知,复合率的预测值和实测值的偏差小于3 %,证明试验所建立的数学模型预测性较好。
2.6 体外溶出试验
采用桨法测定SM-API、SM-PC、市售水飞蓟素胶囊在蒸馏水(pH5.6)和pH7.5的磷酸盐缓冲液(含0.5 % SDS)中的体外溶出度,桨转速为100 r/min,水浴温度为37 ℃。每次取含水飞蓟素150 mg的磷脂复合物粉末装入胶囊,分别于10、20、30、40、50、60 min 取样,每次10 ml,并及时补充等温度等体积的溶出介质,用0.45 μm微孔滤膜过滤后,取续滤液进样分析[14]。试验结果见图5和图6。SM-API、SM-PC和水飞蓟素胶囊在pH5.6的蒸馏水中溶出均不完全,SM-API各组分的溶出显示出较大差异,其中,水溶性成分TF溶出最高,达60%,而SB溶出不到20%。在pH7.5的磷酸盐缓冲液(含0.5 %SDS)中,SM-API的溶出度有了一定的提高,但仍溶出不完全,SM-PC各组分在60 min的溶出接近90%,主要成分SB的溶出行为与市售水飞蓟素胶囊相似,远高于原料药。
3. 讨论
在制备磷脂复合物的过程中,真空干燥必须控制一定的温度条件,温度太低,则磷脂复合物无法充分干燥,制备的磷脂复合物较黏稠,不利于后续制剂的制备;而温度太高,发现所制备的磷脂复合物颜色加深,这可能是由于大豆卵磷脂在高温条件下变性所致。结合预实验,本研究最终确定制备SM-PC的真空干燥温度为45 ℃。
通常选择溶出度试验的溶剂应该接近生理条件,对于难溶性药物而言, 可根据药物的理化性质(如溶解度数据)添加适量的表面活性剂。文献报道[15],将水飞蓟素制备成磷脂复合物后,药物的脂溶性提升较大,生物利用度在人体提高了2~ 3倍,而水溶性提升相对不明显,其在水、人工肠液和人工胃液中难以完全溶出。参考市售水飞蓟素磷脂复合物制剂的溶出条件,采用溶出介质为pH7.5的磷酸盐缓冲液(含0.5 %的SDS),桨转数为100 r/min[16]。
虽然采用磷脂复合物技术有效提高了水飞蓟素的体外溶出度,但由于磷脂复合物本身具有较强的黏性,分散性较差,因而也会限制其溶出速率和溶出度提高的幅度。从本文的研究结果也可以看出,仅采用磷脂复合物技术对水飞蓟素的体外溶出度提高有限,后续可与固体分散体、微球、微丸以及自微乳给药系统等制剂新技术联合应用来进一步改善溶出行为。需要注意的是,磷脂复合物联合其它制剂新技术虽能提高其自身的分散性,加快药物的溶出,但由于采用不同制剂新技术所制备药物的微粒载药方式、释药方式和速率、粒径大小等不同,其溶出速率、跨膜方式、作用部位也可能存在差异,也会影响药物的疗效[17]。因此,实际研究过程中,应该基于药物自身的性质以及循证药学的证据去探索合适的制剂新技术。
-
表 1 水飞蓟素5种有效成分的线性方程
有效成分 线性方程 相关系数r 线性范围(μg/ml) TF Y=66.273X+3.921 0.9999 1.5~30.0 SC Y=42.952X−7.056 0.9999 1.6~32.1 SD Y=37.610 X+6.686 0.9998 1.5~29.8 SB Y=37.627X+6.684 0.9998 3.4~84.0 ISB Y=48.892X−4.681 0.9998 1.9~37.3 表 2 溶剂对复合率的影响(n=3)
溶剂 介电常数 复合率(%) 无水乙醇 26.8 71.5±2.3 丙酮 19.5 75.6±2.0 甲醇 33.2 65.8±0.8 表 3 反应时间对复合率的影响(n=3)
反应时间(t/h) 复合率(%) 0.5 46.1±1.0 1 76.4±1.4 2 85.1±1.2 3 86.6±0.5 4 87.3±1.2 表 4 反应温度对复合率的影响(n=3)
温度(T/ ℃) 复合率(%) 30 68.2±0.8 40 86.7±2.2 50 90.8±0.8 60 92.4±1.3 表 5 药物浓度对复合率的影响(n=3)
药物浓度(ρB/mg·ml−1) 复合率(%) 5 92.5±1.2 10 91.5±2.2 20 88.7±0.8 30 75.8±1.3 表 6 反应物投料比例对复合率的影响(n=3)
药物载体比(g/g) 复合率(%) 外观 1∶0.5 57.1±1.2 松脆 1∶1 83.0±2.2 松脆 1∶1.5 87.5±0.7 松脆 1∶2 92.2±1.2 松脆 1∶2.5 93.5±1.8 黏稠 表 7 磷脂种类对复合率的影响(n=3)
磷脂种类 磷磷脂酰胆碱含量(%) 复合率(%) 外观 大豆卵磷脂 70 91.8±0.3 松脆 蛋黄卵磷脂 70 92.2±0.2 黏稠 表 8 各因素水平代码及试验操作值
因素 −1.682 −1 0 +1 +1.682 脂药比 1 1.20 1.5 1.80 2 药物浓度(ρB/mg·ml−1) 5 8.04 12.5 16.96 20 反应温度(T/ ℃) 40 44.05 50.0 55.95 60 表 9 试验设计及测定结果(n=3)
序号 X1 X2 X3 Y1 1 1.20 8.04 44.05 75.4±3.0 2 1.80 8.04 44.05 85.2±1.9 3 1.20 16.96 44.05 76.9±1.9 4 1.80 16.96 44.05 81.4±1.2 5 1.20 8.04 55.95 81.8±1.8 6 1.80 8.04 55.95 93.5±1.9 7 1.20 16.96 55.95 80.9±1.9 8 1.80 16.96 55.95 83.7±2.3 9 1.00 12.50 50.00 79.6±2.2 10 2.00 12.50 50.00 86.7±1.9 11 1.50 5.00 50.00 86.8±1.8 12 1.50 20.00 50.00 80.7±1.9 13 1.50 12.50 40.00 78.6±1.8 14 1.50 12.50 60.00 91.9±2.2 15 1.50 12.50 50.00 84.2±1.8 16 1.50 12.50 50.00 84.1±1.8 17 1.50 12.50 50.00 84.4±2.5 18 1.50 12.50 50.00 85.7±3.1 19 1.50 12.50 50.00 85.3±0.8 20 1.50 12.50 50.00 84.5±1.2 表 10 最佳工艺条件验证试验(%)
批次 预测值 实测值 偏差 1 93.70 94.85 1.23 2 93.70 94.12 1.52 3 93.70 96.48 2.97 平均数 93.70 95.15 1.55 -
[1] 李颖, 吴茵, 李倩, 等. 水飞蓟素胶囊化学成分的UPLC-Q-TOF-MS快速鉴定与分析[J]. 中国医院药学杂志, 2017, 37(22): 2259-2265. [2] 曾棋平, 黄爱文, 张敏新, 等. 水飞蓟素多组分同步释放微孔渗透泵控释片的制备及体外释放特性研究[C]. 中国药学大会暨第十四届中国药师周论文集, 2014, 2827-2840. [3] 王伊宁, 张甜甜, 李玮萱, 等. 水飞蓟素的药理学研究进展[J]. 药学研究, 2021, 40(6): 397-399, 405. [4] ZENG Q P, LIU Z H, HUANG A W, et al. Preparation and characterization of silymarin synchronized-release microporous osmotic pump tablets[J]. Drug Des Devel Ther, 2016, 10: 519-531. [5] MASTRON J K, SIVEEN K S, SETHI G, et al. Silymarin and hepatocellular carcinoma: a systematic, comprehensive, and critical review[J]. Anticancer Drugs, 2015, 26(5): 475-486. doi: 10.1097/CAD.0000000000000211 [6] KIM S H, CHOO G S, YOO E S, et al. Silymarin induces inhibition of growth and apoptosis through modulation of the MAPK signaling pathway in AGS human gastric cancer cells[J]. Oncol Rep, 2019, 42(5): 1904-1914. [7] KUMAR J, PARK K C, AWASTHI A, et al. Silymarin extends lifespan and reduces proteotoxicity in C. elegans Alzheimer's model[J]. CNS Neurol Disord Drug Targets, 2015, 14(2): 295-302. doi: 10.2174/1871527314666150116110212 [8] ATAIHIRE J U, NWANGWA E K, IGWEH J C. Modulations in anti-oxidant activities of selected gastro-intestinal tissues in alloxan-induced, silymarin treated diabetic wistar rats[J]. OJGas, 2019, 9(5): 73-90. doi: 10.4236/ojgas.2019.95010 [9] 王帅, 李超英, 董婉. 星点设计-效应面法优选丹皮酚-β-环糊精包合物制备工艺[J]. 吉林中医药, 2017, 37(3): 307-309, 313. [10] 黄珊, 翟秉涛, 杨洁, 等. 根皮素磷脂复合物的制备、表征及体内外溶出行为评价[J]. 中草药, 2021, 52(18): 5543-5551. [11] 陈晓敏, 曹伶俐, 崔伟峰. 鼠李素磷脂复合物的处方工艺优化、表征及体外溶出度考察[J]. 中国医院药学杂志, 2022, 42(4): 399-403. [12] 张留超, 刘勇华. 鞣花酸磷脂复合物的制备及其口服生物利用度研究[J]. 中成药, 2021, 43(7): 1685-1690. [13] 周永刚, 魏玮. 水飞蓟素-磷脂酰胆碱复合物的制备及体外溶出速率评价[J]. 中药材, 2008, 31(3): 447-449. [14] 孙欣荣, 张敏新, 杨海跃, 等. 水飞蓟素固体分散体的制备及5种成分的溶出度[J]. 中成药, 2018, 40(1): 87-92. [15] 王启帅, 李二永, 孙艳, 等. 口服固体制剂溶出方法的开发与展望[J]. 抗感染药学, 2019, 16(12): 2025-2029. [16] 任晓文, 徐为人, 连潇嫣, 等. 水飞蓟宾卵磷脂分散体胶囊剂溶出度测定方法的研究[J]. 天津中医药, 2004, 21(1): 65-67. [17] 郝海军, 张红芹, 贾幼智, 等. 采用制剂新技术提高中药磷脂复合物的溶出度和生物利用度研究进展[J]. 中草药, 2013, 44(17): 2474-2479. -





 下载:
下载:



 下载:
下载:


