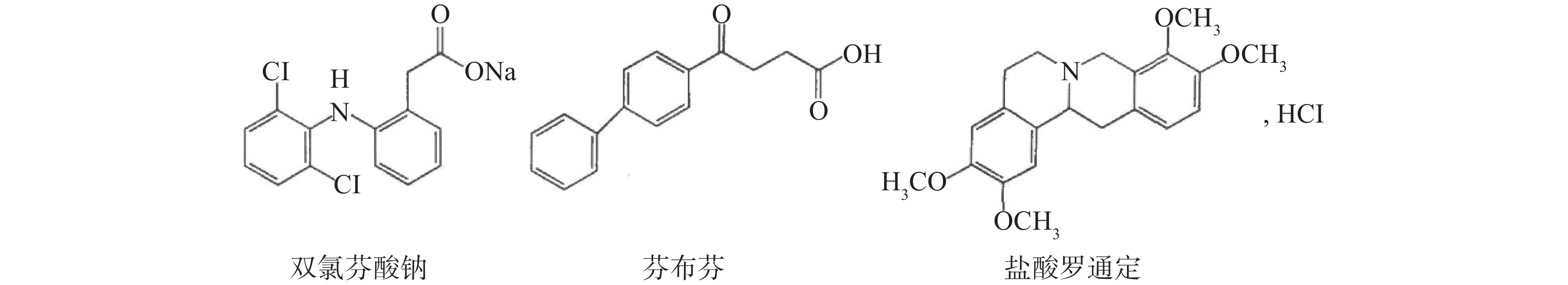
-
银黄软胶囊是一种清热、解毒、消炎作用的中成药。因中药起效慢、副作用少,一些不良商家为了寻求暴利,在中成药中添加西药成分,短时间内提高中成药的疗效,误导消费者以寻求高利润。因双氯芬酸钠有消炎镇痛作用、芬布芬有抗炎作用、盐酸罗通定有镇痛作用,就成了不良商家非法添加的成分之列,据报道有30%的抗风湿类健康产品中非法添加了双氯芬酸钠[1],多种抗风湿镇痛类中药制剂中非法添加双氯芬酸钠、芬布芬等此类化学药物[2]。因此,建立一种快速有效的检测方法,对可能非法添加了西药成分的中成药进行现场检测具有重要的意义。
近几年,薄层色谱-表面增强拉曼光谱(TLC-SERS)联用技术广泛地应用于各种领域[3-4],尤其是在药物非法添加研究领域被逐渐认可[5-8]。本研究应用TLC-SERS联用技术,探索双氯芬酸钠、芬布芬、盐酸罗通定在中成药银黄软胶囊中非法添加的鉴别方法,以期为进一步的中成药快速检验提供实验依据。
-
便携式拉曼光谱仪(BWS415,B&W Tek Inc., U.S.A),激光发射波长785 nm,分辨率5 cm–1;WFH-203B型三用紫外分析仪(上海精科实业有限公司);离心机(TG16-WS,上海卢湘仪离心机有限公司);KQ-250DB型数控超声波清洗器(昆山超声仪器有限公司);薄层板HSGF254(烟台市化学工业研究所)。
双氯芬酸钠(批号:100334-200302,供含量测定用)、芬布芬(批号:100415-201102,纯度99.4%)、盐酸罗通定(批号:100222-200702,供鉴别用)均购自中国食品药品检定研究院。实验所用阴性样品由山东省食品药品检验所提供,银黄软胶囊(批号:359161004,石药集团欧意药业有限公司)。乙酸乙酯(国药集团化学试剂有限公司,批号:20150410)、石油醚(天津市富宇精细化工有限公司,批号:12589-2007);硝酸银(批号:20140320,国药集团化学试剂有限公司),柠檬酸钠(分析纯,批号:20120429,国药集团化学试剂有限公司);实验用水为蒸馏水。
-
对照品溶液:精密称取对照品双氯芬酸钠、芬布芬、盐酸罗通定对照品2 mg,置EP管中,加入甲醇2 ml溶解,制成浓度为1 mg/ml的溶液,作为对照品溶液,冷藏保存,备用。
模拟假阳性样品溶液:取中成药银黄软胶囊(经山东省食品药品检验院薄层色谱-质谱联用法检测,不含以上3种对照品,可作为阴性样品)一次剂量,置EP管中,并精密量取双氯芬酸钠、芬布芬、盐酸罗通定对照品溶液加入EP管中,与银黄软胶囊样品溶液混匀,甲醇溶解,振荡,超声(40 kHz,250 W)30 min,10 000 r/min离心10 min,收集上清液,微孔滤膜滤过,作为假阳性样品,冷藏保存,备用。
阴性样品溶液:取中成药银黄软胶囊一次剂量,置EP管中,加入甲醇2 ml溶解,振荡,超声(40 kHz,250 W)30 min,10 000 r/min离心10 min,取上清液,微孔滤膜滤过,作为阴性样品,冷藏保存,备用。
-
精密称取45 mg的硝酸银,加入少量去离子水使其溶解。溶解后移至250 ml的容量瓶中,用去离子水定容。用电磁搅拌加热器不断搅拌并将其加热至微沸,逐滴加入5 ml浓度为1 %柠檬酸钠溶液并继续加热,保持微沸60 min,继续搅拌至溶液冷却,得灰绿色银溶胶,避光保存[8]。
-
分别取1 mg/ml双氯芬酸钠、芬布芬、盐酸罗通定对照品溶液,以点样点胶比为变量,激光功率,积分时间为定值,检测出峰效果,筛选3种成分的最佳点样点胶比;同理筛选3种成分的最佳激光功率、积分时间。
-
以对照品溶液与阴性样品溶液作为对照,将配制的添加不同浓度对照品的模拟阳性样品点在同一块硅胶薄层板上,按优选的最佳光谱条件设置点样点胶比、激光功率、积分时间,根据信噪比(S/N=3)评价出峰效果,确定各个对照品的检测限。
-
将配置好的各种样品、对照品溶液置于薄曼联用仪内对应位置,高效硅胶薄层板置于仪器平台上,设置点样量与点样位置,由联用仪完成点样操作。取出点样后的薄层板,以选定的石油醚-乙酸乙酯(3:5)展开系统,室温下展开80 mm,取出晾干,放回联用仪,于内置254 nm紫外灯下检视定位以确定点胶位置,设置合适的点胶量、激光强度与积分时间,由联用仪完成点胶操作后,随即进行拉曼检测。
-
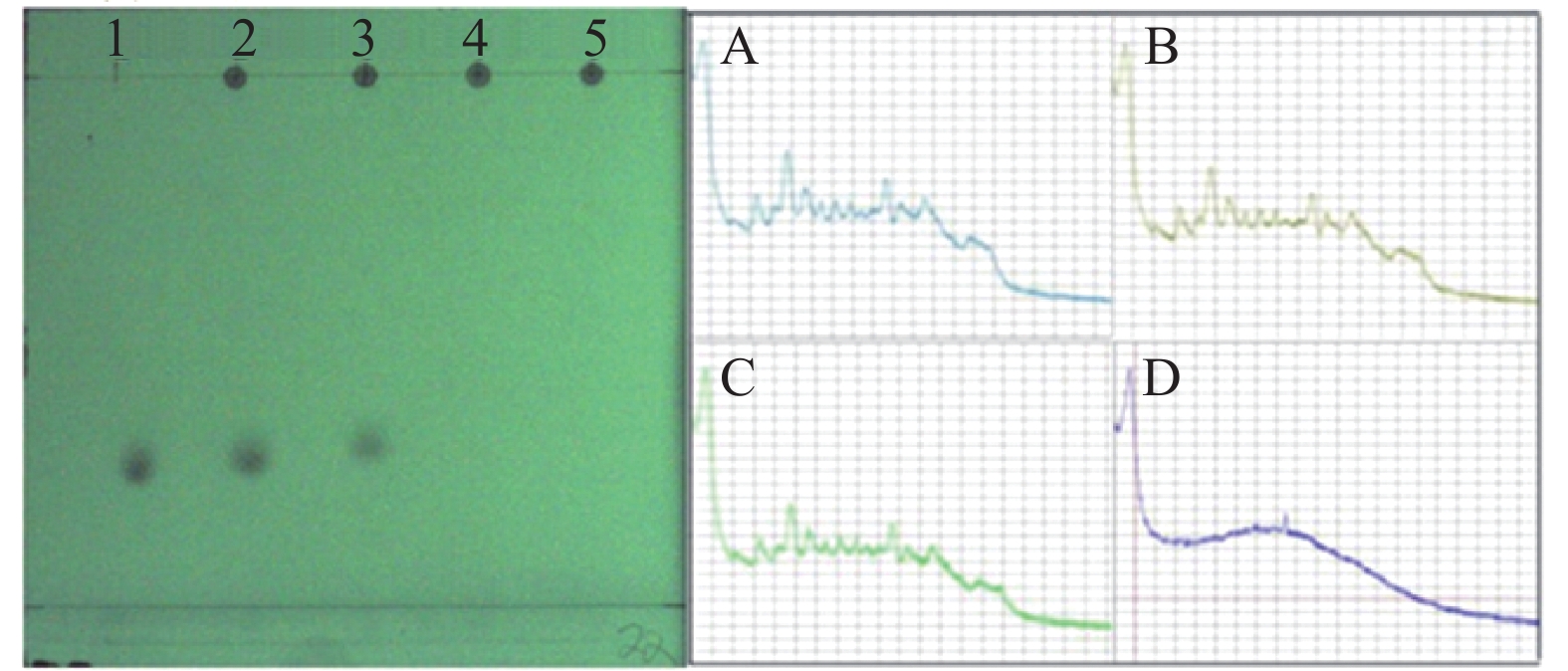
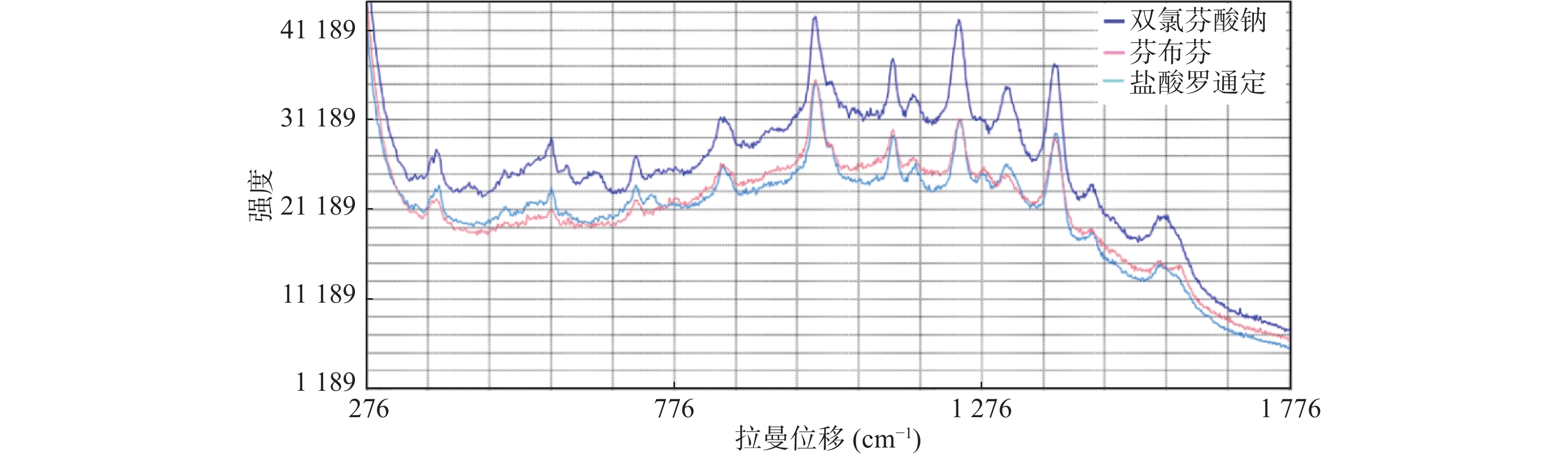
对照品双氯芬酸钠、芬布芬、盐酸罗通定最佳出峰条件分别是:双氯芬酸钠点样点胶比2:3,激光功率30%,积分时间30 s;芬布芬点样点胶比2:2,激光功率40%,积分时间30 s;盐酸罗通定点样点胶比1:2,激光功率50%,积分时间30 s。拉曼图谱如图1所示。
-
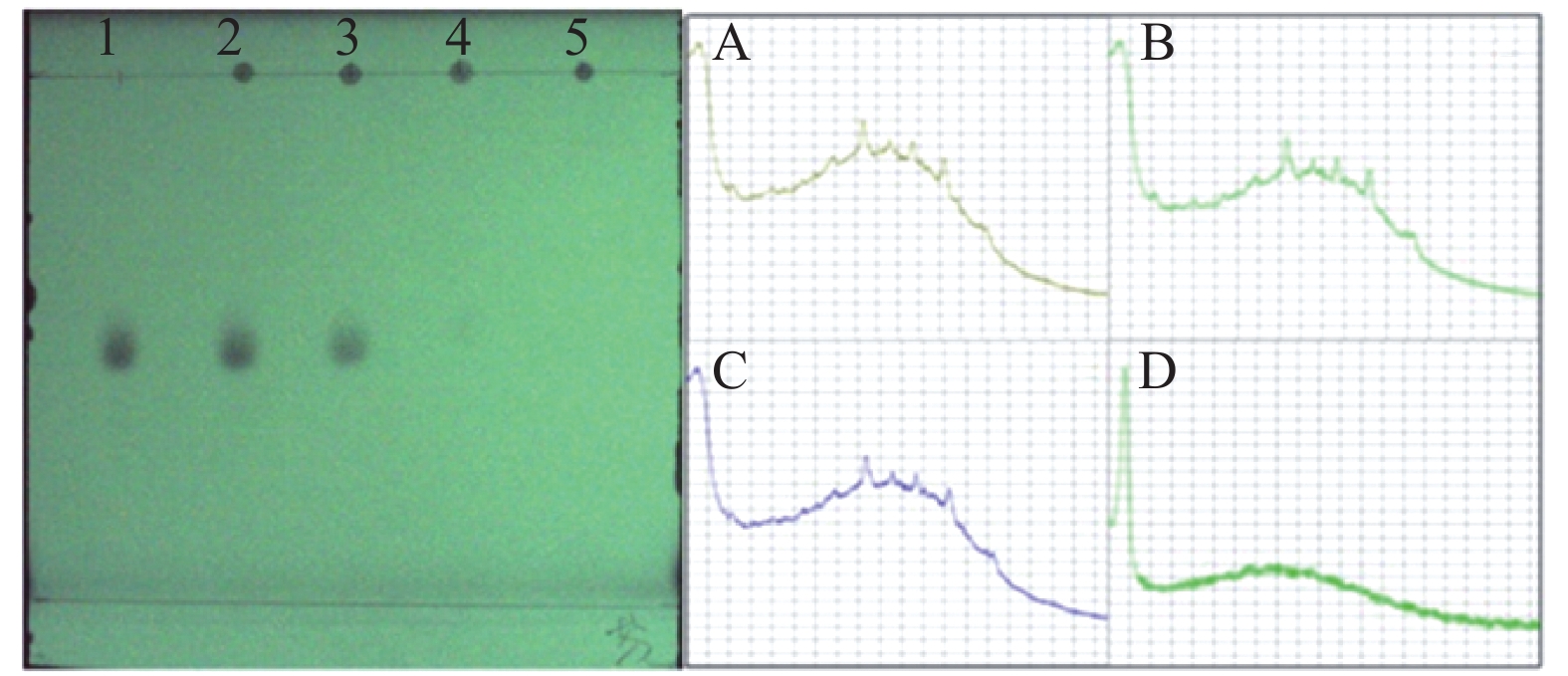
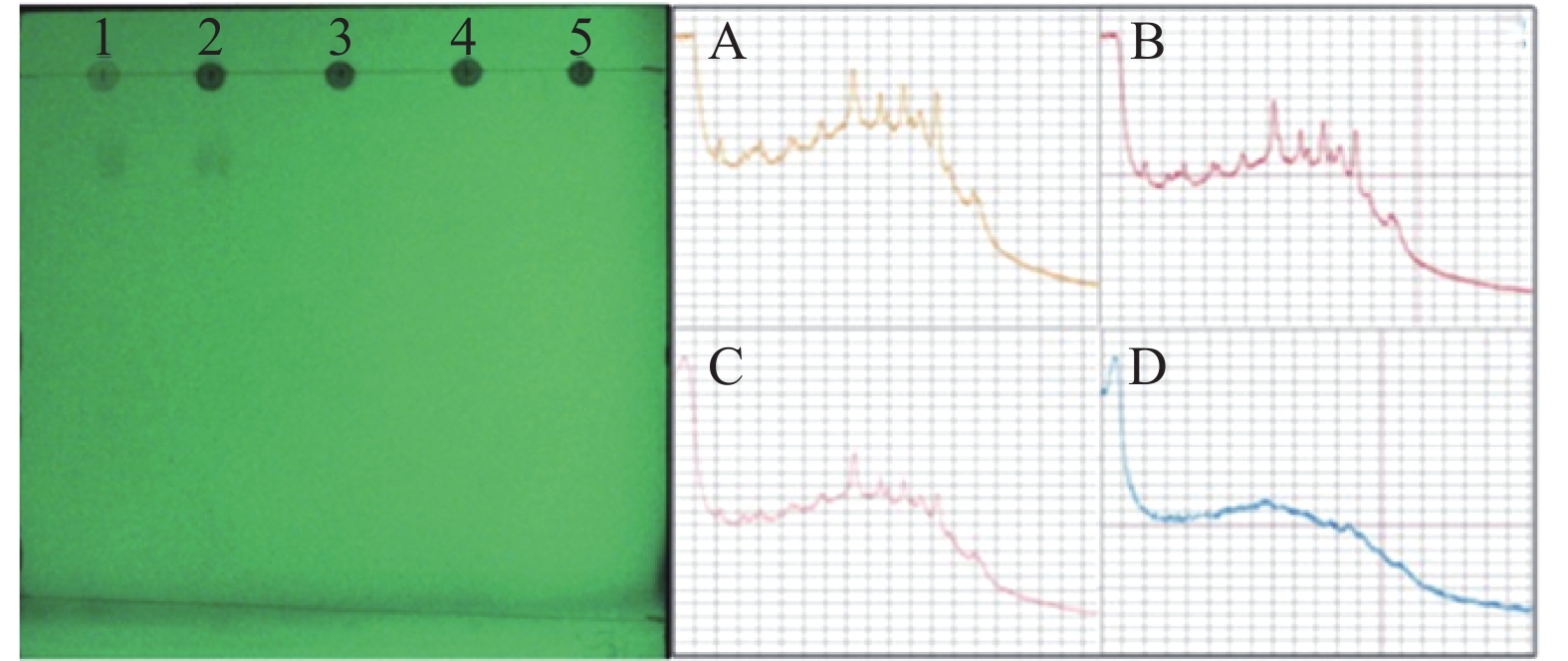
从图2、图3、图4中可以看出,3种对照品在薄层色谱中分离程度高,双氯芬酸钠的比移植(Rf)值为0.75,芬布芬Rf值为0.54,盐酸罗通定Rf值为0.21。由“2.1”项可知,双氯芬酸钠、芬布芬、盐酸罗通定最佳点样点胶比分别为2:3、2:2、1:2(即点样量分别为2 μl、2 μl、1 μl,故银黄软胶囊中添加的双氯芬酸钠、芬布芬、盐酸罗通定最低检测限对应的点样沉积量分别为0.2 μg、0.2 μg、0.1 μg。
-
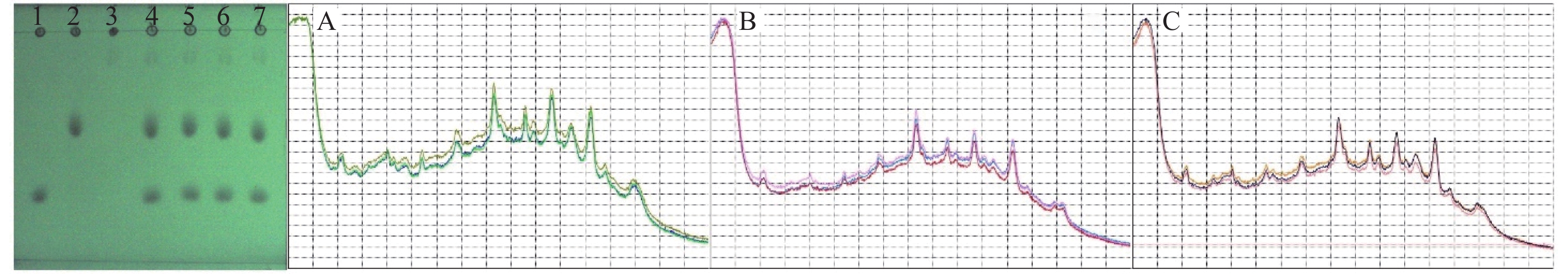
从图5薄层板中可以看出,同时添加了3种对照品的银黄软胶囊模拟的假阳性样品溶液4、5、6、7号中出现了与双氯芬酸钠、芬布芬、盐酸罗通定相同Rf值的斑点,可初步确定4、5、6、7中添加了双氯芬酸钠、芬布芬、盐酸罗通定。为进一步确证,对各斑点进行SERS检测,在拉曼仪数据处理系统中与相应对照品色谱斑点的SERS光谱进行比对,结果表明4、5、6、7号中对应斑点的SERS图谱与双氯芬酸钠、芬布芬、盐酸罗通定对照品的SERS图谱相同,见图5中SERS图谱。
-
由图6可知,双氯芬酸钠、芬布芬、盐酸罗通定3种成分的分子结构中均含有苯环、C—C、C=O基团,故3种成分的拉曼光谱特征峰有9个共有峰,在576、712、1 004、1 130、1 240、1 316、1 394、1 454、1 564 cm–1左右,同一共有峰的强度有所不同,取代基不同拉曼位移略有变化(见表1)。此外,由于3种成分的分子结构含有不同的基团,也有相应的差异峰,如740 cm–1为盐酸罗通定特有峰。共有峰、差异峰以及峰强度共同组成了区别于其他成分的特征峰群,这为TLC-SERS专属性鉴别提供了依据。
表 1 3种成分的拉曼光谱特征峰(cm–1)
成分 特征峰 1 2 3 4 5 6 7 8 9 10 11 12 13 双氯芬酸钠 390 576 712 854 1 004 1 130 1 162 1 238 1 316 1 394 1 454 1 570 – 芬布芬 384 576 712 854 1 004 1 130 1 240 1 276 1 316 1 394 1 454 1 564 – 盐酸罗通定 394 576 712 740 1 005 1 132 1 168 1 240 1 278 1 320 1 395 1 456 1 564 -
本研究通过反复试验,确定了TLC展开剂为石油醚-乙酸乙酯(3:5),得到了较好的展开效果。在展开的TLC薄层板上,3种对照品对应的斑点处,模拟假阳性样品与3种对照品有相同斑点;经过进一步的SERS检测,模拟假阳性样品的斑点拉曼光谱特征峰与对照品斑点拉曼光谱特征峰一致,且重复性良好,说明TLC-SERS联用技术简便、准确、可靠,可同时检测银黄软胶囊中非法添加的双氯芬酸钠、芬布芬、盐酸罗通定3种成分。
本研究采用TLC-SERS联用技术所建立的检测方法,对中成药银黄软胶囊中非法添加西药双氯芬酸钠、芬布芬、盐酸罗通定3种成分的,能满足同时、快速检测的要求。该方法实用性强,对人员技术要求低,尤其适合现场快速检测。
Simultaneously detect three illegal additive components in Yinhuang soft capsule by TLC-SERS
-
摘要:
目的 建立薄层色谱-表面增强拉曼光谱(TLC-SERS)联用技术同时检测中成药银黄软胶囊中非法添加的西药化学成分双氯芬酸钠、芬布芬、盐酸罗通定。 方法 将待测样品点于硅胶板,用石油醚-乙酸乙酯(3:5)进行薄层展开,在254 nm紫外光灯下进行定位检测,在分离的各个斑点处按优选的最佳条件喷加纳米银胶溶液,用表面增强拉曼光谱(SERS)进行定性鉴别。 结果 本研究建立了TLC-SERS联用技术同时检测银黄软胶囊中非法添加的双氯芬酸钠、芬布芬、盐酸罗通定的方法,并确定了3种化学成分的最低检测限。 结论 TLC-SERS联用技术快速、准确、灵敏度高,可同时快速检测银黄软胶囊中非法添加的双氯芬酸钠、芬布芬和盐酸罗通定3种成分。 -
关键词:
- 银黄软胶囊 /
- 非法添加 /
- 薄层色谱-表面增强拉曼光谱
Abstract:Objective To establish a simultaneous detection of diclofenac sodium, fenbufen and rotundine hydrochloride illegally added in Yinhuang soft capsules by TLC-SERS. Methods The samples to be measured were placed on the silica gel plate, and the thin layer was developed with petroleum ether-ethyl acetate (3:5). Location detection was carried out under 254 nm ultraviolet lamp. Nano-silver colloidal solution was sprayed at each spot of separation according to the optimum conditions, and then qualitative identification was done by TLC-SERS. Results A method for simultaneous determination of diclofenac sodium, fenbufen and rotundine hydrochloride illegally added in Yinhuang soft capsule by TLC-SERS was established. And the minimum detection limits of three chemical constituents were determined. Conclusion TLC-SERS was a rapid, accurate and sensitive method for the simultaneous and rapid detection of diclofenac sodium, fenbufen and rotundine hydrochloride illegally added into Yinhuang soft capsule. -
Key words:
- Yinhuang soft capsule /
- illegal addition /
- TLC-SERS
-
转录因子ZNF24(也称KOX17或ZNF191 )是类Krüppel锌指转录因子家族的成员,N端有一SCAN结构域(也称LeR结构域),该区域不仅含有亮氨酸[1],还有选择性的异型或同型寡聚物[2];C端有四个连续的锌指模体且都是典型的类Krüppel样[2]。我们通过小鼠胚胎干细胞基因打靶,获得了ZF-12+/-(又称Zfp191,与ZNF24同源)ES细胞,并将细胞注射入小鼠的囊胚腔,得到了正常发育的ZF-12+/-小鼠,然而得到的ZF-12 −/-小鼠胚胎发育缓慢且在7.5 d左右胚胎致死[2]。最近研究表明,ZNF24通过调控微血管内皮细胞的增殖、迁移和侵袭,在内皮细胞的血管生成中起重要作用[3]。我们前期研究发现ZNF24作为一个因子拥有多种功能,比如参与激酶转录活性调控、血管增殖、大脑发育以及DNA损伤应答等[4]。
ZNF24基因最初由上海交通大学医学院的陈竺院士科研团队与复旦大学的余龙教授科研团队合作从造血细胞中克隆获得,定位于18q12.1[5]。该区域的缺失与人类多种肿瘤相关,如浸润性乳腺癌[6]、结直肠癌[7]等。余龙教授科研团队报道了ZNF24在肝癌中的不同作用:其在肝癌组织中表达上调,可通过与β-连环蛋白基因的启动子结合,激活β-连环蛋白基因转录,进而激活其下游靶基因如细胞周期蛋白 D1 (cyclin D1)基因,促进肝癌细胞的增殖[8];也可直接与DNA甲基转移酶1(DNMT1)启动子结合,激活DNMT1基因转录,引起肝癌细胞DNA甲基化改变,进而激活PI3K-AKT途径促进肝癌细胞增殖[9],提示ZNF24在肝癌中是癌基因。而在转移肝癌组织中ZNF24表达下调,ZNF24通过与DGL1(Discs Large 1) 启动子结合,激活DGL1基因转录,通过Yes相关蛋白(Yes-associated protein, YAP)信号通路抑制肝癌细胞的转移,提示ZNF24在肝癌转移中是抑癌基因[10]。此外,前列腺癌中ZNF24表达上调,通过调控Twist1促进肿瘤细胞上皮间质转换(EMT)、增殖、侵袭和转移,提示ZNF24在前列腺癌中是癌基因[11]。但是,ZNF24在甲状腺癌中表达下调,通过竞争性结合β-连环蛋白,抑制它与辅助因子LEF1/TCF1形成功能性复合物,从而抑制Wnt信号通路,进而抑制肿瘤增生与转移[12],提示ZNF24在甲状腺癌中是抑癌基因。令人感兴趣的是,研究miRNA-940(microRNA-940)在肿瘤中的作用,发现ZNF24是其调控的靶基因,在三阴乳腺癌(TNBC)中miRNA-940靶向下调ZNF24,抑制三阴乳腺癌(TNBC)细胞的增殖和转移[13],提示ZNF24促进TNBC细胞的增殖和转移是癌基因。但是,在人胃癌组织中miRNA-940 通过靶向抑制 ZNF24 表达,促进癌细胞的侵袭和转移[14],提示ZNF24抑制胃癌细胞的侵袭和转移是抑癌基因。这些结果表明,ZNF24通过调控不同的靶基因,在多种不同肿瘤的发生发展、侵袭和转移中起着重要复杂的两面性作用(促进或抑制)。
结直肠癌是一种常见的恶性肿瘤,在我国拥有较高的发病率和较低的生存率[15]。目前,结直肠癌与ZNF24的关系仍不明确。因此,我们构建ZNF24基因过表达的慢病毒载体,包装成病毒并转染结直肠癌细胞HCT116,获得了ZNF24基因过表达的HCT116细胞株,为后续研究的开展提供物质基础。
1. 实验材料
1.1 细胞及载体
293T细胞、人结直肠癌HCT116细胞、大肠杆菌感受态DH5α均来自本实验室,质粒pMT406、包装质粒pCMV-dR8.9、pCMV-VSV-G均购自上海Sangon Biotech公司。
1.2 主要试剂
限制性内切酶BamHI(R6021)、限制性内切酶XhoI(RK21100)、DNA胶回收试剂盒(AK1001)、逆转录试剂盒(RR037A)、荧光定量PCR试剂盒(RR420L)(Takara公司,日本);质粒小提试剂盒(PD1211,Promega公司,美国);无缝克隆试剂盒(C5891)、 AxyPrep 总RNA小量提取试剂盒(AP-MN-MS-RNA-250G)、兔抗ZNF24多克隆抗体(D324009)、兔抗GAPDH多克隆抗体(D110016)、山羊抗兔IgG(D111018)(Sangon Biotech公司,中国);BCA蛋白浓度测定试剂盒(P0012A)、胰酶(C0202)(碧云天生物科技公司,中国);DMEM细胞培养基(SH30022,赛默飞世尔生物科技公司,美国);胎牛血清(6170-078, Ausbian公司,澳大利亚)。
2. 实验方法
2.1 ZNF24基因过表达慢病毒载体的构建
2.1.1 目的片段获取
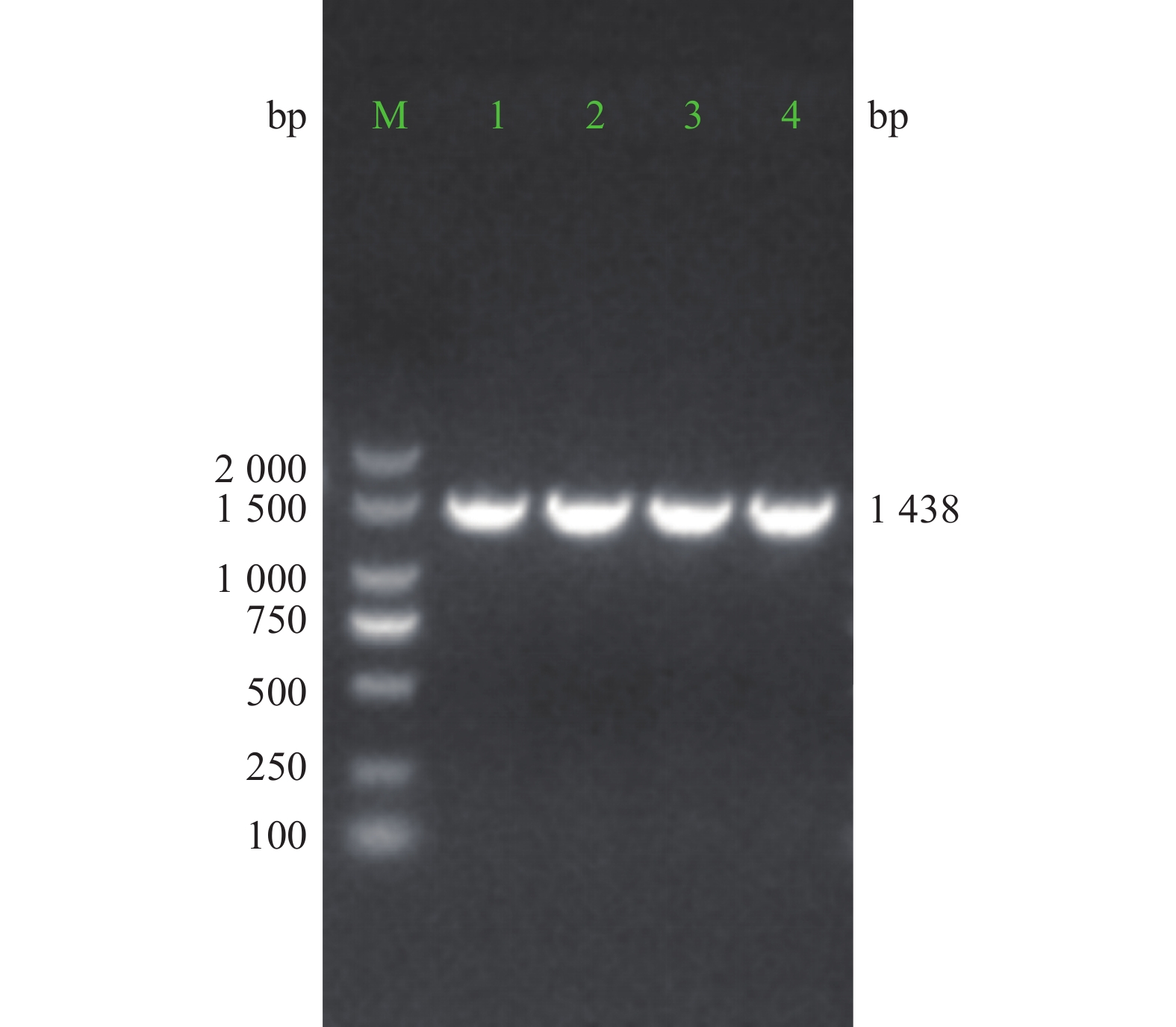
ZNF24基因、3FLAG和相关引物均由上海Sangon Biotech公司合成。Primer 1和Primer 2用于PCR扩增ZNF24,产物大小为1 128 bp;Primer 3和Primer 4用于PCR扩增3FLAG,产物大小为111 bp; Primer 5和Primer 6用于菌落PCR鉴定,阳性产物大小为1 438 bp。引物序列见表1。
表 1 ZNF24基因、3FLAG的特异性引物序列以及相关引物序列片段名称 序列 Primer 1 TGGCAAAGAATTGGATCCGCC
ACCATGTCTGCACAGTCAGTGGAAGPrimer 2 AACTTTCACAACATTCAGAAGTTTT Primer 3 CTGAATGTTGTGAAAGTTGACTACAAGGATGA Primer 4 CATAATACTAGTCTCGAGTTATTTGTCGTCATCATC Primer 5 CGGCTCTAGAGCCTCTGCTA Primer 6 CGTGAGTCAAACCGCTATCCAC ZNF24(或3FLAG)的PCR反应条件:98 ℃预变性3 min;98 ℃变性10 s,55 ℃退火15 s,72 ℃延伸1 min(或10 s),共 30个循环;72 ℃延伸10 min。
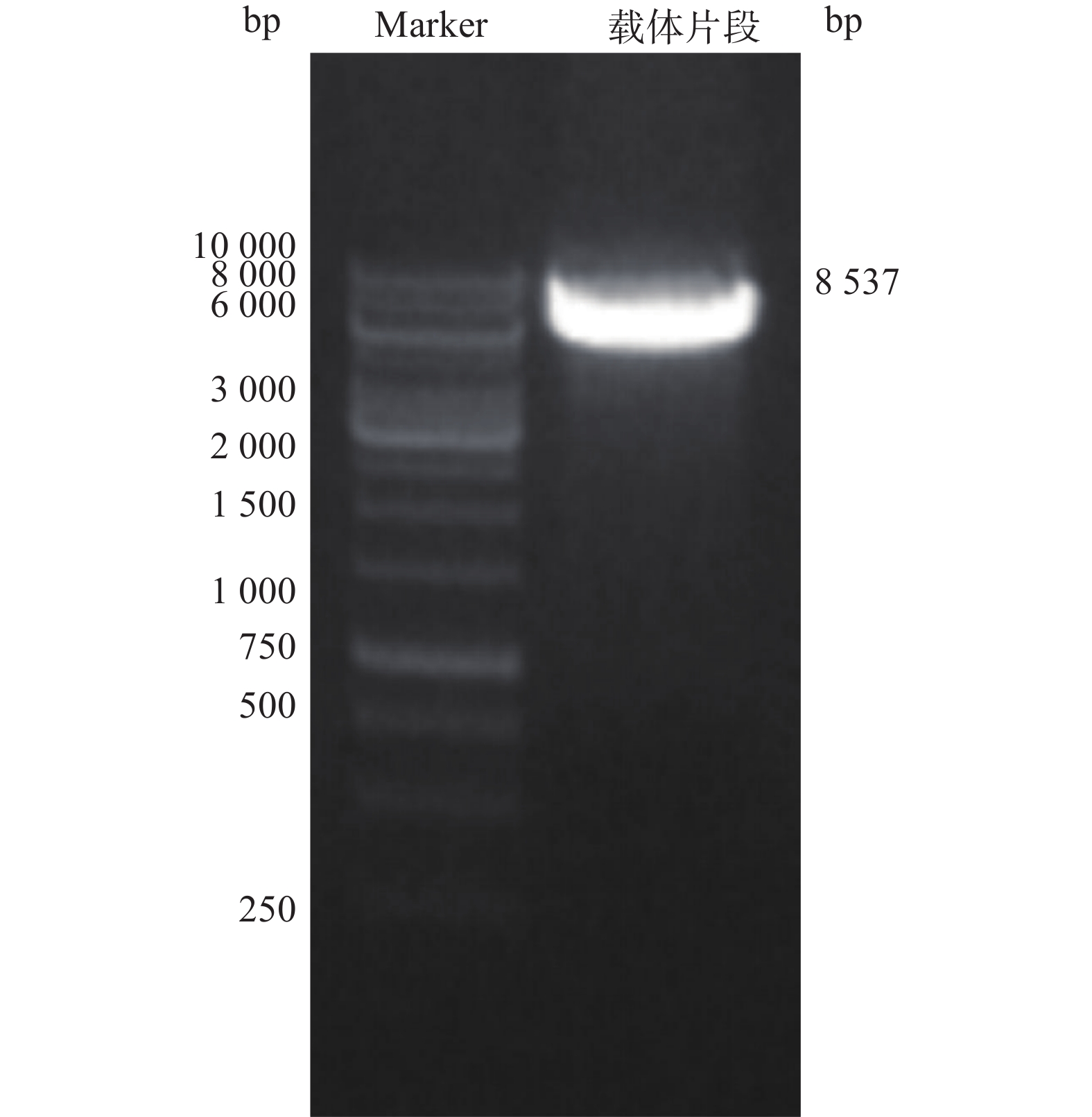
2.1.2 载体线性化、重组质粒的构建与鉴定
用限制性内切酶BamHI和XhoI酶切pMT406,胶回收线性化载体(大小约8 537 bp)。线性化的载体、PCR扩增的ZNF24与3FLAG产物,通过同源重组(无缝克隆)反应,将10 μl反应产物转化至DH5α。平皿培养过夜,挑取单克隆进行菌落PCR鉴定, 阳性克隆产物预期为1 438 bp。PCR阳性的克隆进一步测序鉴定,测序正确的重组质粒命名为pMT-ZNF24。
2.2 慢病毒载体包装、滴度测定
转染前24 h,胰酶消化并重悬293T细胞,取10个10 cm的培养皿,以1×107个/皿的细胞密度铺板。细胞贴壁后将原有培养基更换为Opti-MEM®培养基,体积为9 ml。取100 μg pMT-ZNF24(或pMT406)、65 μg pCMV-dR8.9、35 μg pCMV-VSV-G和适量Opti-MEM®培养基加入至15 ml无菌离心管中混匀,总体积为5 ml。再取500 μl细胞转染液和4.5 ml Opti-MEM®培养基混匀后滴加至上述离心管中,轻柔摇晃至均匀,室温孵育20 min。孵育完成后,将混合液分装到293T细胞中,每皿1 ml,轻轻摇晃混匀后放回培养箱。细胞培养6 h后弃上清液,加入10 ml DMEM培养基继续培养,2 d后收集细胞上清液。用60 ml 0.22 μm PVDF过滤装置过滤上清液, 4 ℃,25 000 r/min离心2 h,然后分装保存于−80 ℃冰箱。采用孔稀释法测定病毒滴度:准备5个EP管,各加入90 μl含10%FBS的高糖DMEM。EP管1中添加10 μl的待测病毒原液,EP管2中添加EP管1混合液10 μl,依次操作至EP管5。293T细胞接种到96孔板的 5个孔中,每孔约5×104个细胞,待细胞贴壁后去掉原液,依次加入EP管中的病毒液继续培养,24 h后换液,观察并记录3 d后稀释率最大孔中的荧光细胞数量。病毒滴度=荧光细胞数/病毒原液量。
2.3 慢病毒转染HCT116细胞
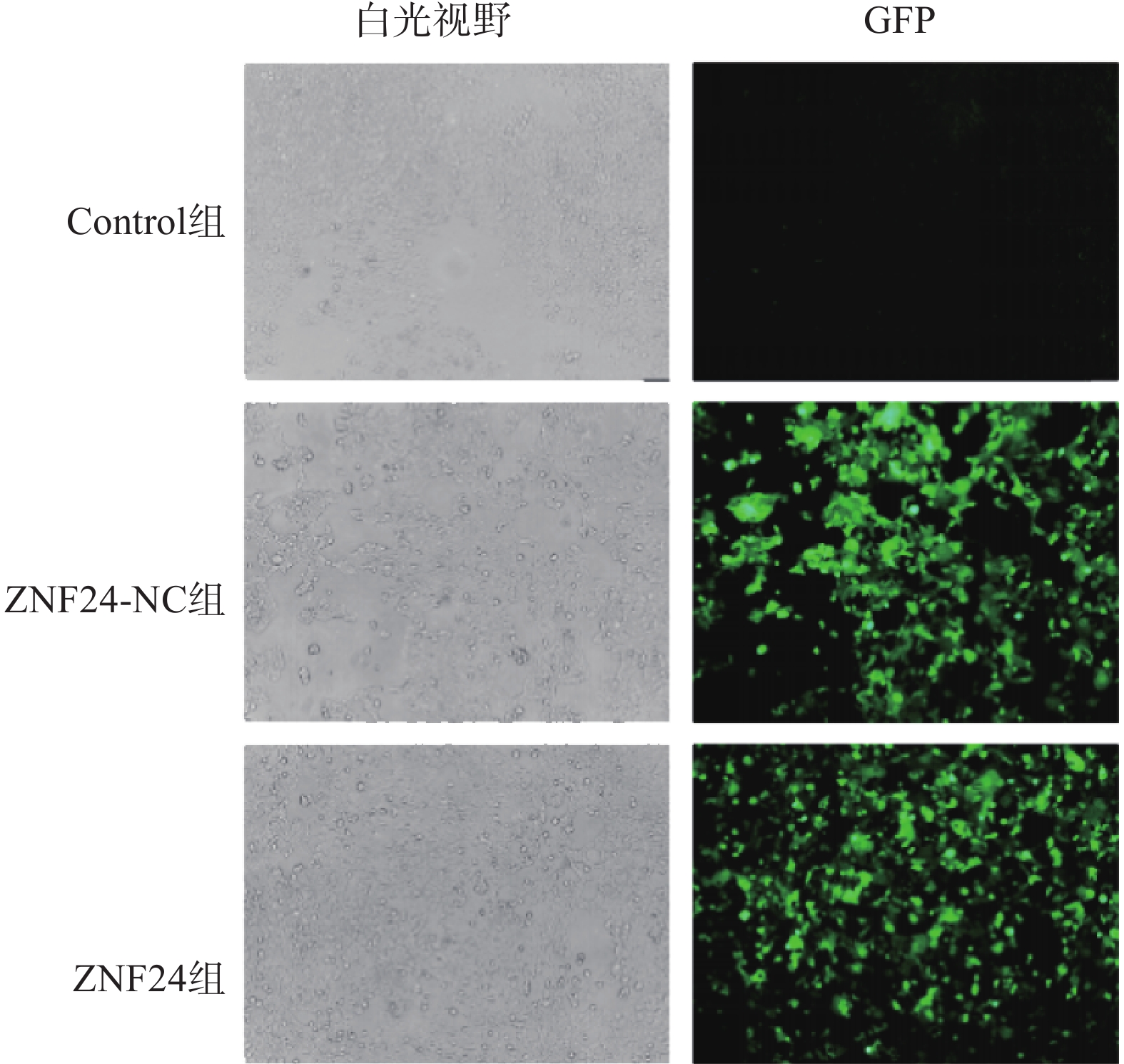
胰酶消化HCT116细胞,重悬后接种于24孔板中,每孔细胞约为3×105个,待细胞融合达30%时以细胞感染指数(MOI)=10计算病毒浓缩液体积并转染细胞。将HCT116细胞分为3组:空白对照组(HCT116细胞不转染病毒)、阴性对照组(HCT116细胞转染不含ZNF24的空载体慢病毒)和ZNF24组(HCT116细胞转染ZNF24过表达慢病毒)。转染72 h后,在ZNF24组和阴性对照组中加入 4 μg / ml嘌呤霉素,继续培养72 h后得到稳定表达细胞株。
2.4 实时荧光定量PCR检测ZNF24 mRNA的表达
慢病毒转染HCT116细胞,TRIzol法裂解细胞并提取RNA,mRNA反转录成cDNA后扩增ZNF24。ZNF24引物序列上游为CATTCCCTAAGGCACTGTGAT,下游为TTGAGGAACACCCATACTGAGA;GAPDH引物序列上游为TGACTTCAACAGCGACACCCA,下游为CACCCTGTTGCTGTAGCCAAA。2−ΔΔCt法分析ZNF24 mRNA的表达量。
2.5 蛋白印迹法检测ZNF24蛋白的表达
慢病毒转染HCT116细胞,裂解液(含蛋白酶抑制剂)裂解细胞,提取总蛋白并测定浓度。SDS-PAGE电泳后转模,脱脂牛奶封闭1 h,室温一抗孵育3 h,室温荧光素标记二抗孵育2 h,Odyssey双色红外激光成像系统检测荧光信号。
2.6 统计学分析
实验数据以3个独立试验的(
$\bar{x} \text{±} s$ )表示,采用 GraphPad Prism 5.0软件中单因素方差分析或t检验进行分析。3. 结果
3.1 PCR扩增及电泳结果
电泳结果显示,分别获得了大小约1 128 bp的ZNF24扩增产物与大小约111 bp的3FLAG扩增产物(图1)。
3.2 载体pMT406线性化
电泳结果显示,得到大小约8 537 bp线性化载体条带(图2)。
3.3 重组慢病毒载体pMT-ZNF24菌落PCR与测序鉴定
重组质粒经PCR扩增,电泳结果显示,获得约1 438 bp大小的阳性克隆PCR产物条带(图3)。对PCR产物进行测序比对分析,结果与目标序列完全一致。
3.4 病毒滴度检测结果及荧光显微镜下绿色荧光表达
ZNF24过表达慢病毒的滴度为3.25×109 TU/ml,ZNF24-NC慢病毒的滴度为6.19×109 TU/ml。以MOI=10计算病毒体积并转染HCT116细胞,4 μg /ml 嘌吟霉素筛选,荧光显微镜下约85%的细胞呈现绿色荧光蛋白(GFP)表达(图4)。
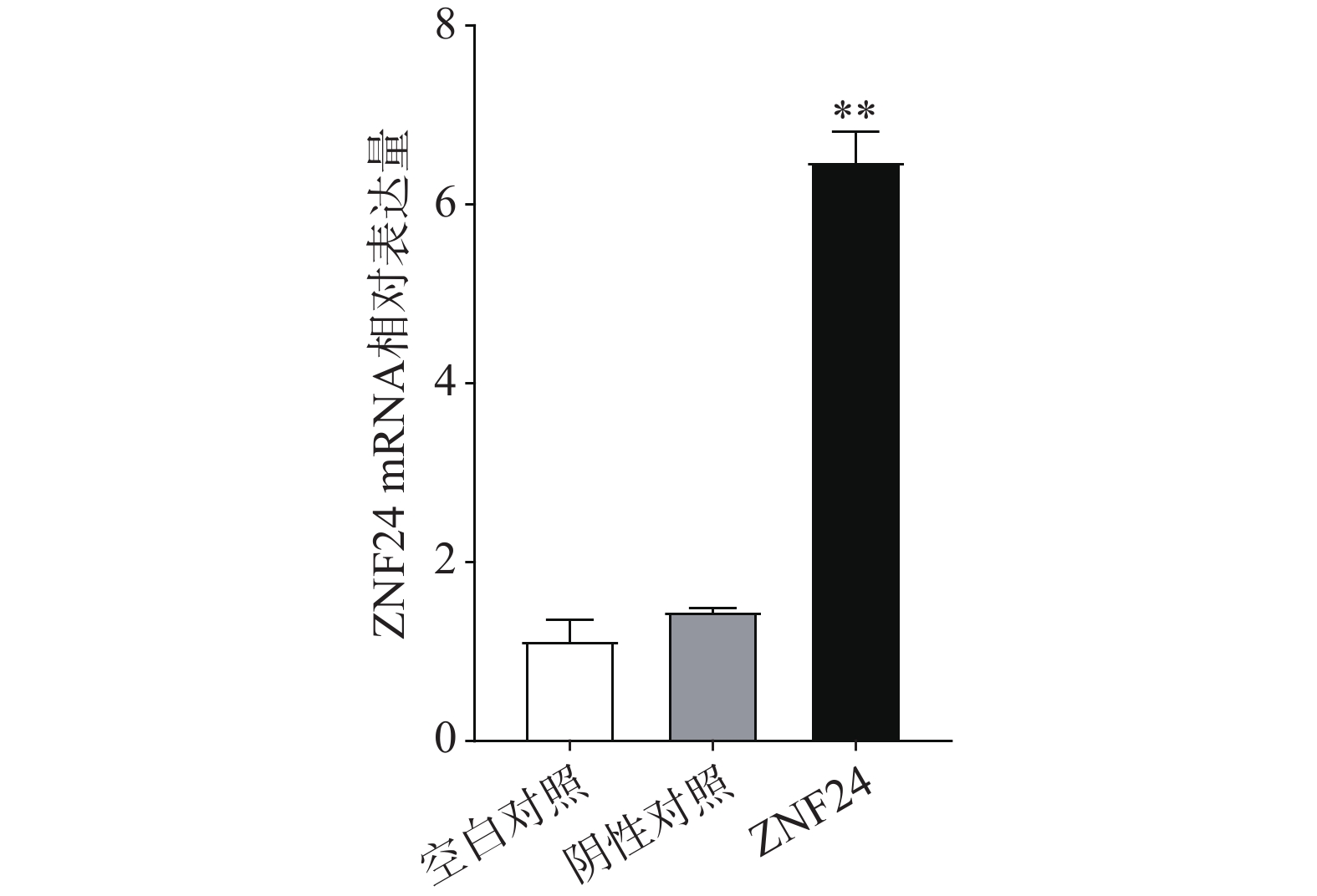
3.5 HCT116细胞中ZNF24 mRNA相对表达量比较
qRT-PCR结果表明,转染ZNF24过表达慢病毒的细胞组中ZNF24的mRNA表达显著高于阴性对照组和空白对照组(图5)。
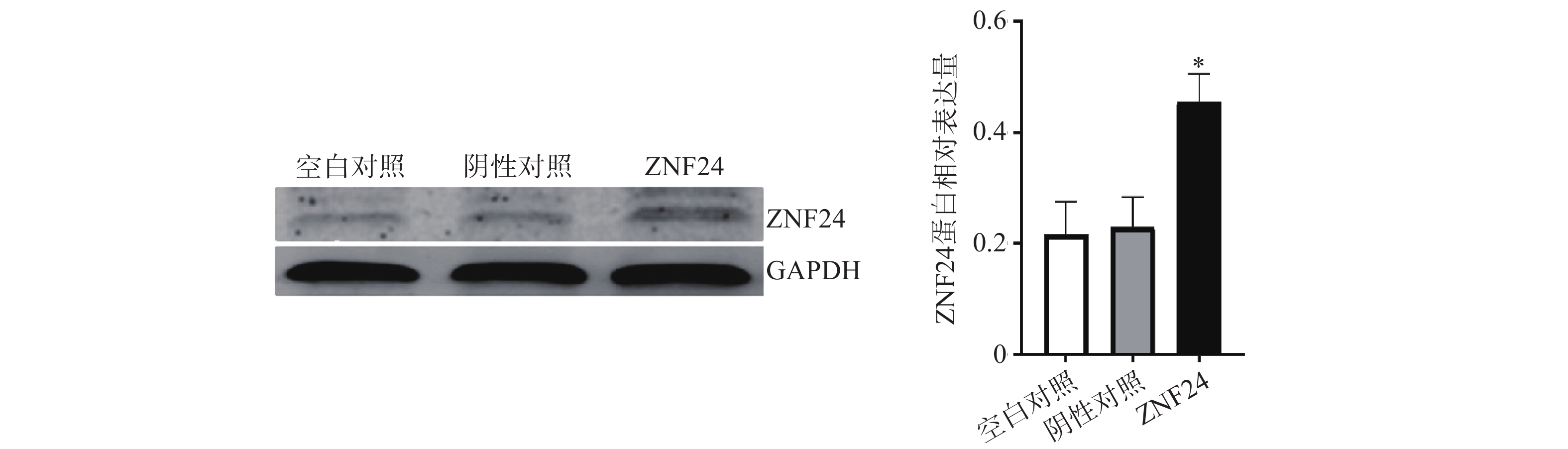
3.6 HCT116细胞中ZNF24蛋白相对表达量比较
蛋白印迹检测结果显示,转染ZNF24过表达慢病毒的细胞组中ZNF24表达水平明显高于阴性对照组和空白对照组 (图6)。
4. 讨论
结直肠癌是癌症致死的一个主要原因[16],致死的关键要素是其高水平的复发和转移[17]。结肠癌的发病机制十分复杂,涉及多种癌基因、抑癌基因的异常表达。因此,研究结直肠癌的发病机制,特别是结直肠癌复发转移的机制极其重要。研究表明,多种转录因子在结直肠癌等肿瘤中异常表达,参与结直肠癌的发病、转移和侵袭,如在肿瘤微环境参与VEGF表达调控的 STAT3转录因子已成为新的抗肿瘤药物的作用靶点[18]。
体外与乳腺癌细胞肿瘤动物模型的研究表明,ZNF24通过与血管内皮生长因子(VEGF)启动子上游序列(−144/−134, 非(TCAT) n重复序列)直接结合抑制VEGF基因转录,从而抑制血管增生达到抑制肿瘤生长[19]。然而,敲减人微血管内皮细胞中的ZNF24导致细胞迁移,侵袭和增殖减弱,暗示ZNF24具有促进人微血管内皮细胞的血管生成潜力[3]。多项研究表明ZNF24通过调控不同靶基因(如Twist1[11]、β-连环蛋白[8]和DGL1[10]等)的转录表达以及竞争性结合蛋白因子[8],在多种不同肿瘤的发生发展、侵袭和转移中起着重要复杂的两面性作用(促进或抑制)。
本研究成功构建了ZNF24过表达慢病毒载体,获得相应的病毒。转染HCT116细胞,获得稳定过表达ZNF24的HCT116细胞株,为开展后续研究提供了物质基础。
-
表 1 3种成分的拉曼光谱特征峰(cm–1)
成分 特征峰 1 2 3 4 5 6 7 8 9 10 11 12 13 双氯芬酸钠 390 576 712 854 1 004 1 130 1 162 1 238 1 316 1 394 1 454 1 570 – 芬布芬 384 576 712 854 1 004 1 130 1 240 1 276 1 316 1 394 1 454 1 564 – 盐酸罗通定 394 576 712 740 1 005 1 132 1 168 1 240 1 278 1 320 1 395 1 456 1 564 -
[1] 蓝献泉, 黄义纯, 黄红雯, 等. 抗风湿类中成药及保健品中非法添加双氯芬酸钠的快速筛查方法研究[J]. 中南药学, 2014, 12(9):902-905. doi: 10.7539/j.issn.1672-2981.2014.09.020 [2] 吴小红, 李焕德, 朱荣华, 等. HPLC-MS/MS法鉴别中药制剂中非法添加的多种解热镇痛类化学药物[J]. 中南药学, 2010, 8(10):724-729. doi: 10.3969/j.issn.1672-2981.2010.10.002 [3] ZHANG J N, MA X Y, WANG Z P. Real-time and in situ monitoring of abrin induced cell apoptosis by using SERS spectroscopy[J]. Talanta,2019,195:8-16. doi: 10.1016/j.talanta.2018.11.015 [4] LI D W, QU L L, ZHAI W L, et al. Facile on-site detection of substituted aromatic pollutants in water using thin layer chromatography combined with surface-enhanced Raman spectros- copy[J]. Environ Sci Technol,2011,45(9):4046-4052. doi: 10.1021/es104155r [5] 王磊, 陈梦云, 李晓, 等. TLC-SERS法快速分析抗精神失常类中药的化药成分[J]. 实验室研究与探索, 2016, 35(5):22-26. doi: 10.3969/j.issn.1006-7167.2016.05.006 [6] 张彬彬, 史毅, 陈辉, 等. 薄层色谱-表面增强拉曼光谱法快速检测染色掺伪的西红花[J]. 药学实践杂志, 2017, 35(3):215-218. doi: 10.3969/j.issn.1006-0111.2017.03.006 [7] 赵瑜, 尹利辉, 胡昌勤. 拉曼光谱法在快速筛查紫杉醇脂质体制剂中的应用[J]. 中国医药导报, 2018, 15(19):24-29. [8] 张中湖, 李军, 谢强胜, 等. TLC-SERS高通量筛查中成药与保健食品中添加的降糖化学物质[J]. 药物分析杂志, 2019, 39(3):467-476. -





 下载:
下载:


 下载:
下载: