-
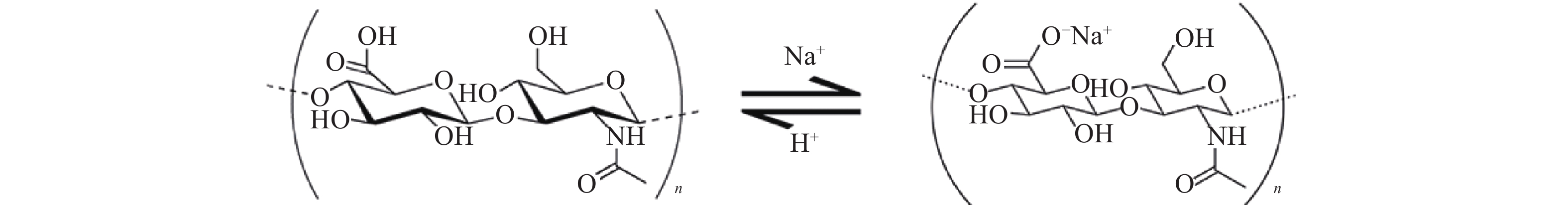
透明质酸钠(图1)又称玻璃酸钠,是由交替的N-乙酰葡糖胺(GlcNAc)和葡糖醛酸(GlcA)单元组成[1]的聚合物,聚合度最大的相对分子质量(Mr)可以达到107。具有高度黏弹性、可塑性、渗透性、独特的流变学特性以及良好的生物相容性等特点[2]。透明质酸钠广泛存在于人体,是构成人体细胞间质、眼玻璃体、关节滑液等结缔组织的主要成分,在体内具有保水、维持细胞外空间、调节渗透压、润滑、促进细胞修复等重要生理功能[3]。医用透明质酸钠凝胶(HA)为无色透明黏稠液体,主要成分为透明质酸钠。HA常用于肿瘤患者术后的抗粘连,其广泛的生理学活性有可能使得肿瘤细胞易于扩增和转移,文献报道内源性的透明质酸能促进肿瘤增殖[4-6]。因此,本研究考察外源性HA是否会促进肿瘤的生长和转移,以明确HA是否可用于肿瘤患者的术后防粘连。为HA用于肿瘤患者腹、盆腔手术术后防粘连提供实验依据。
-
医用透明质酸钠凝胶(HA,10 mg/ml,上海昊海生物科技股份有限公司,批号:18052122,Mr≥1.0×106),氟尿嘧啶注射液(5-Fu,上海旭东海普药业有限公司,批号:FA1800416),胎牛血清(FBS,Gibco,批号:1932595),McCoy’s 5A Medium(Gibco,批号:1967679),RPMI Medium 1640(Gibco,批号:1967664),MEM(Minimum Eagle’s Medium,HyClone,批号:AD20532472),胰酶(Trypsin,上海博光生物科技有限公司),磷酸盐缓冲液(PBS,上海博光生物科技有限公司),MTT(上海博光生物科技有限公司),无水甲醇、二甲基亚砜(DMSO,国药集团化学试剂有限公司),生物胶(批号:217201N2)、小鼠结肠癌细胞(CT26,上海中西医结合医院),人宫颈癌细胞(Hela)、人结肠癌细胞(HCT116,中国科学院上海生命科学研究院)。
-
裸鼠:88只,上海斯莱克实验动物有限公司,SPF级,SCXK(沪)2017-0005;64只,上海灵畅生物科技有限公司,SPF级,SCXK(沪)2018-0003),动物饲养于同济大学沪北校区(SYXK(沪)2018-0034)。所有动物实验过程均符合实验动物伦理学要求。
-
酶标仪1510-00411C(Thermo),坤宏BMB224分析天平(南京伯尼塔科学仪器有限公司),ECLIPSE TE100 显微镜(Nikon),细胞培养箱(Thermo)。
-
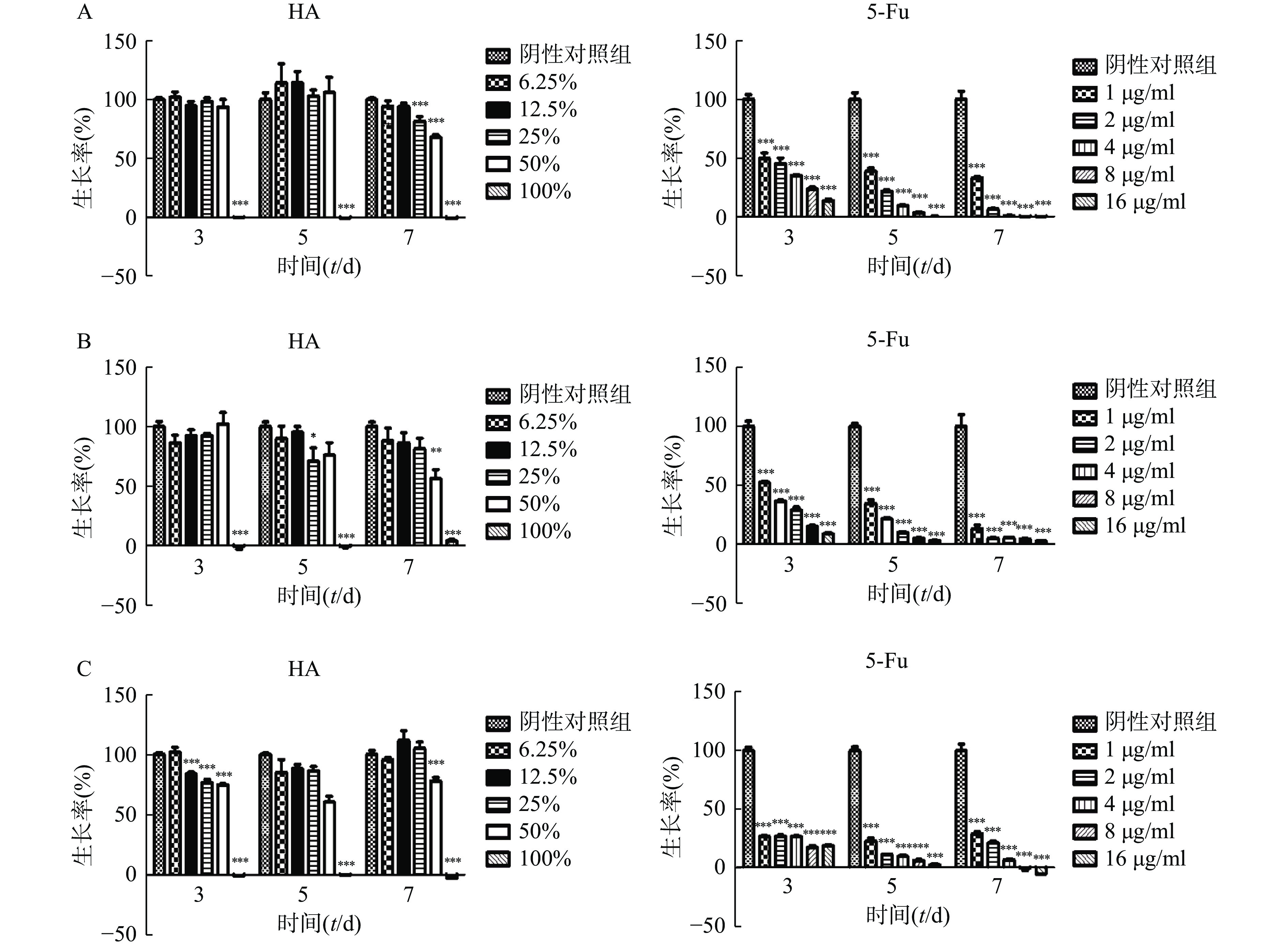
将状态良好的肿瘤细胞用胰酶消化后离心,弃上清液,分别用对应培养液重悬成单个肿瘤细胞悬液,显微镜下计数,然后分别稀释成以下浓度:Hela(2×104个/ml),CT26(5×103个/ml),HCT116(104个/ml)。取96孔板,空白对照孔接入100 μl培养液,其余各孔接入肿瘤细胞混悬液,每孔100 μl,将96孔板置于37 ℃、5%CO2培养箱培养。24 h后吸弃培养液,空白对照和阴性对照孔分别加入200 μl培养液,测试孔分别加入100%HA、50%HA+50%培养液、25%HA+75%培养液、12.5%HA+87.5%培养液、6.25%HA+93.75%培养液,每孔200 μl;阳性对照孔分别加入5-Fu浓度为 16、8、4、2、1 μg/ml培养液,每孔200 μl,将加药96孔板放回培养箱培养。分别培养3、5和7 d 后,吸弃上层液体,加入含0.5 mg/ml MTT的培养液100 μl,培养4 h。避光处吸弃上层液体,每孔加入100 μl DMSO,避光反应10 min,振荡1 min,在酶标仪波长570 nm处(630 nm校准)测量各孔的吸光值。细胞存活率=(实验孔吸光值—空白对照孔吸光值)/(阴性对照孔吸光值—空白对照孔吸光值)×100%。
-
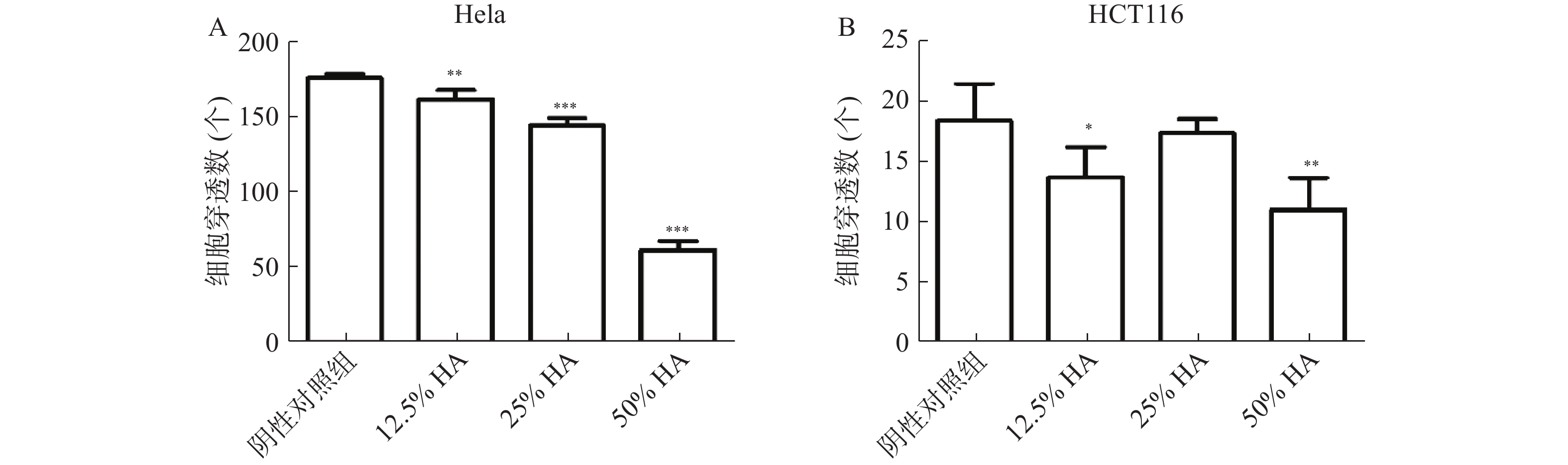
将状态良好的肿瘤细胞胰酶消化、离心后,分别用对应空白培养液重悬成单个肿瘤细胞悬液,显微镜下计数,然后分别稀释成以下浓度:Hela(1.5×105 个/ml),HCT116(5×105个/ml)。分别将肿瘤细胞混悬液和HA混匀,配成50%HA+50%肿瘤细胞悬液、25%HA+50%肿瘤细胞悬液+25%空白培养液、12.5%HA+50%肿瘤细胞悬液+37.5%空白培养液、50%肿瘤细胞悬液+50%空白培养液。将肿瘤细胞和HA混合液加入Transwell上层小室中,每个小室200 μl,Transwell下层腔室分别加入含10% FBS 对应培养液 600 μl。将Transwell培养板放入培养箱,培养24 h。取出Transwell小室,轻轻吸弃小室内培养液,用PBS洗1遍,甲醇固定15 min。用棉签轻轻擦去小室内层细胞,PBS洗2遍,加入结晶紫(0.1%)染色,室温放置20 min,PBS洗3遍。显微镜10倍物镜下观察、拍照和记数。
-
PBS重悬HCT116细胞,调浓度至107个/ml,将细胞接种于裸鼠皮下,每只动物0.2 ml,共12只,作为供瘤体。视肿瘤生长情况将裸鼠处死,取出瘤块,选取瘤块实质性部分,用生理盐水冲洗干净,剪成约1 mm×1 mm×1 mm 瘤块备用。
实验动物腹腔麻醉,取腹部正中切口,逐层开腹,找到盲肠位置。假手术组:将盲肠拉出后放回腹腔,逐层缝合伤口。其余组:轻轻划破结肠浆膜,用生物胶将瘤块固定在浆膜破损处。模型组和阳性对照组在瘤块接种处涂抹生理盐水0.07 ml,HA组涂抹HA 0.02 ml。逐层缝合伤口,观察记录裸鼠状态,5-Fu组腹腔注5-Fu 20 mg/kg,隔天给药,持续3周。
瘤块接种4周后将裸鼠处死,打开腹腔,用游标卡尺测量瘤块的长短径,按公式(V=ab2/2,a:瘤体最长直径;b:瘤体最短直径)计算体积,剥离瘤块,瘤块称重。
-
建立裸鼠结肠原位种植结肠癌CT26模型,方法同“2.3”项。瘤块接种4 d后,5-Fu组腹腔注射氟尿嘧啶注射液50 mg/kg,隔3 d给药一次,共4次。
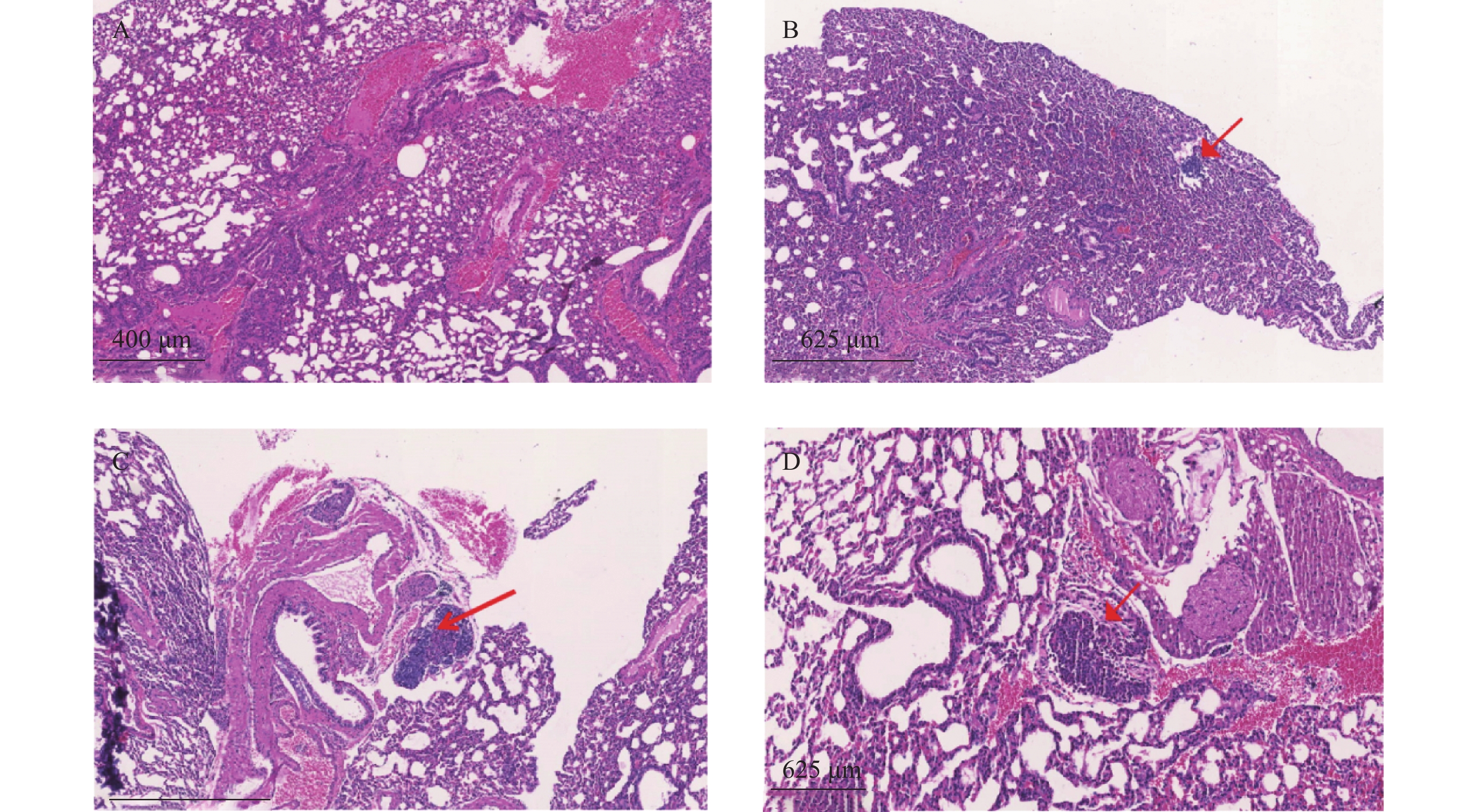
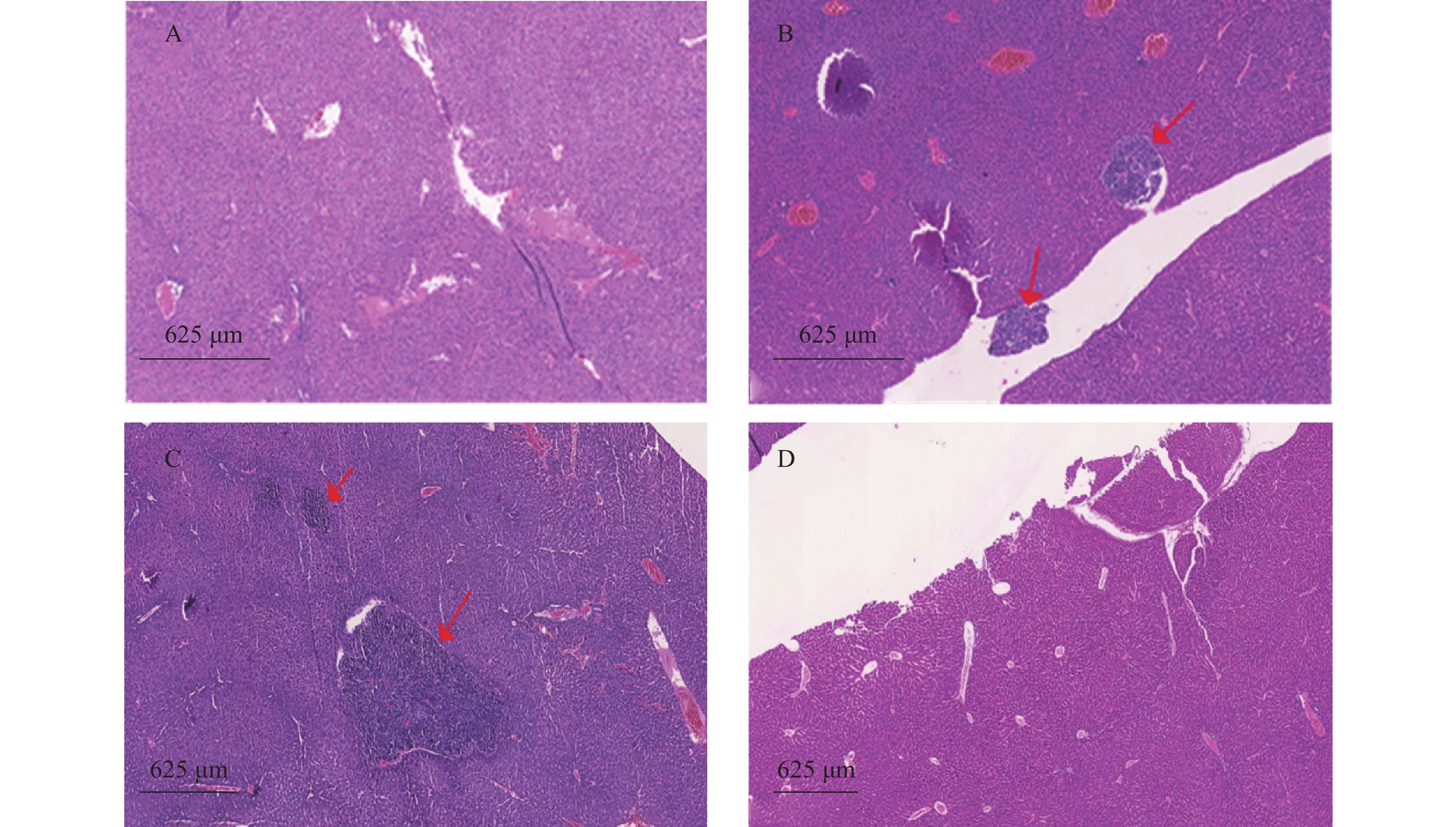
瘤块接种3周后将裸鼠脱颈处死,打开腹腔,观察肿瘤转移情况,取肺和肝脏,4%多聚甲醛固定、切片、HE染色,统计肿瘤转移率和转移病灶数。
-
实验数据用(
${\overline x}\pm s $ )表示,应用SPSS 21.0软件,数据进行正态性检验。符合正态分布采用one-way ANOVA统计方法进行显著性检验;不符合正态分布采用Friedman M 统计方法进行显著性检验。肿瘤转移率采用卡方检验。以P<0.05为差异有统计学意义。 -
在体外实验中,肿瘤细胞Hela、HCT116和CT26在100% HA中均不能生长(图2)。Hela细胞在培养3 d和5 d时不同含量HA均不影响细胞的生长,7 d时25%HA和50%HA细胞生长率低于阴性对照组(P<0.001)。HCT116细胞培养7 d时,50%HA细胞生长率低于阴性对照组(P<0.01)。CT26细胞培养3 d时12.5%HA、25% HA和50%HA细胞生长率低于阴性对照组(P<0.001);培养5 d和7 d时,50%HA细胞生长率低于阴性对照组(P<0.001)。不同浓度5-Fu,培养3 d、5 d和7 d均抑制肿瘤细胞Hela、HCT116和CT26的生长,呈剂量相关性。
-
Transwell实验结果显示,高浓度HA体外抑制肿瘤细胞迁移。50%HA、25%HA和12.5%HA组Hela细胞穿透数均低于阴性对照组(P<0.01),HA含量越高,Hela细胞穿透数越少;50%HA和12.5%HA组HCT116细胞穿透数均低于阴性对照组(P<0.05),25%HA组HCT116细胞穿透数低于阴性对照组,无统计学差异(图3)。
-
裸鼠结肠原位接种HCT116瘤块后,HA组与模型组成瘤率均为100%,结果无差异。模型组裸鼠的瘤体体积达(339.1±258.0)mm3,5-Fu组裸鼠的瘤体体积为(128.5±111.9)mm3,小于模型组(P<0.01),HA组裸鼠的瘤体体积为(293.2±190.6)mm3,与模型组比较,差异无统计学意义;模型组裸鼠的瘤重为(0.359±0.219)g,5-Fu组裸鼠的瘤重为(0.149±0.105)g,小于模型组(P<0.001),HA组裸鼠的瘤重为(0.330±0.187)g,与模型组比较,差异无统计学意义。使用一定剂量的HA在裸鼠体内不影响HCT116的成瘤率,同时也不影响HCT116肿瘤的生长(表1)。
表 1 HA在裸鼠体内对HCT116肿瘤生长的影响(
$\bar{ x}\pm { s}$ )组别 动物数(只) 成瘤数(只) 成瘤率(%) 瘤体积(V/mm3) 瘤重(m/g) 假手术组 16 0 0 0.0 ± 0.0 0.000 ± 0.000 模型组 16 16 100 339.1 ± 258.0 0.359 ± 0.219 HA组 16 16 100 293.2 ± 190.6 0.330 ± 0.187 5-Fu组 16 14 87.5 128.5 ± 111.9** 0.149 ± 0.105*** **P<0.01、***P<0.001,与模型组比较 -
裸鼠结肠原位接种CT26瘤块,观察16 d后出现动物死亡,第18天处死存活裸鼠。模型组存活率为62.5%,HA组存活率68.8%,5-Fu组存活率100%,体内使用一定剂量的HA不影响裸鼠的存活率。模型组肝脏转移率90%,平均病灶数(2.2±1.7);5-Fu组肝脏转移率0.0%,低于模型组(P<0.001);平均病灶数(0.0±0.0),低于模型组(P<0.001)。HA组肝脏转移率36.4%,低于模型组(P<0.05);平均病灶数(0.6±1.0),低于模型组(P<0.01)。模型组肺转移率为40%,平均病灶数(0.5±0.7);5-Fu肺转移率6.3%,低于模型组(P<0.05);平均病灶数(0.1±0.3),低于模型组(P<0.05)。HA组肺转移率为18.2%,平均病灶数(0.2±0.4),与模型组均无统计学差异,见表2、图4和图5。
表 2 HA在裸鼠体内对CT26肿瘤转移的影响(
$\bar{ x}\pm { s}$ )组别 动物数(只) 成活率(%) 肝转移 肺转移 转移率(%) 病灶数 转移率(%) 病灶数 假手术组 15 100.0 0.0 0.0 ± 0.0 0.0 0.0 ± 0.0 模型组 16 62.5 90.0 2.2 ± 1.7 40.0 0.5 ± 0.7 HA 组 16 68.8 36.4* 0.6 ± 1.0** 18.2 0.2 ± 0.4 5-Fu 16 100.0 0.0*** 0.0 ± 0.0*** 6.3* 0.1 ± 0.3* *P<0.05、**P<0.01、***P<0.001,与模型组比较 -
很多胚胎迁移和增殖速率与胚胎组织中高浓度的透明质酸有关,而肿瘤组织和胚胎发育很相似,几十年前已经提出透明质酸可能对肿瘤生长很重要[7-9]。然而,本研究的HA为外源性高分子量HA,结果与内源性透明质酸结果不一致。在体外实验中,Hela、CT26和HCT116的细胞无法在100% HA中生长,表明HA不能作为肿瘤细胞培养基。此外,细胞生长速率随着HA的增加而不同程度的降低,说明高浓度HA可以抑制肿瘤生长,在低浓度时虽然没有明显的抑制作用,但也未促进肿瘤的增殖。体内结果证明,外源性HA对肿瘤细胞的生长无促进作用。
内源性低分子质量透明质酸(low molecular weight hyaluronan,LMWHA)可诱导细胞运动[10-11],促进血管生成,增加炎症免疫刺激和诱导高尔基体应激的能力[12],从而能促进肿瘤的迁移。而Aikaterini等[13-14]研究显示,透明质酸酶2(Hyal-2)低表达同时透明质酸合成酶(HAS1和HAS2)表达增高,导致产生高分子量透明质酸(high molecular weight hyaluronan,HMWHA)并在HT1080细胞的周围基质中沉积蓄积,结果HT1080细胞迁移能力显著降低,同时外源性HMWHA显著抑制HT1080细胞的迁移,当加入透明质酸酶后,HT1080细胞运动性显著增加。外源性透明质酸会促进透明质酸合成酶高表达[15],促进内源性HA合成作用,使机体合成HMWHA。本研究建立裸鼠原位种植瘤转移模型,结果HA组结肠癌的肝转移率在体内低于模型组(P<0.05)。HA在体内能抑制肿瘤的转移,可能与外源性HA能促使机体合成HMWHA有关。
本研究的主要目的是探讨HA是否会对腹部和盆腔肿瘤患者产生不良影响。结果表明,外源性HA未见对上述肿瘤的增殖有促进作用,在转移模型中HA表现出一定的抑制肿瘤迁移的作用,符合HA在肿瘤患者中应用的要求,但其机制还需进一步研究。
The effects of medical sodium hyaluronate gel on the tumor proliferation and metastasis
-
摘要:
目的 考察医用透明质酸钠凝胶(medical sodium hyaluronate gel,HA)在体外和裸鼠体内对腹、盆腔相关肿瘤生长和转移的影响。 方法 利用Hela、CT26和HCT116等3株肿瘤细胞,通过MTT法和Transwell实验分别考察不同浓度HA体外对肿瘤细胞生长和迁移的影响;建立裸鼠结肠原位种植瘤模型,比较瘤块接种4周后不同实验组的瘤块体积和瘤重,考察HA体内对结肠癌HCT116增殖的影响;通过比较接种3周后不同实验组裸鼠的肺和肝脏的肿瘤转移率和转移病灶数,考察HA对结肠癌CT26体内转移的影响。 结果 不同浓度HA在体外均未促进Hela、CT26和HCT116细胞的生长和转移,且在5 mg/ml HA浓度下,显示出一定的抑制作用。体内结果显示,HA未促进结肠癌HCT116肿瘤的生长,却显示出明显抑制CT26肿瘤的转移。 结论 在本实验条件下,HA在体内、外均未促进腹、盆腔相关肿瘤细胞Hela、CT26和HCT116的生长、迁移和转移。 Abstract:Objective To investigate the effect of medical sodium hyaluronate gel (HA) on the growth and metastasis of abdominal and pelvic tumor cells in vitro and in nude mice. Methods Three tumor cells, Hela, CT26 and HCT116, were used to investigate the effects of different HA concentrations on the growth and migration of tumor cells in vitro by MTT assay and Transwell assay. An orthotopic transplantation model of colonic tumor in nude mice was established to investigate the effect on the proliferation of cell HCT116 by comparing the tumor volume and tumor mass 4 weeks after inoculation. The effects on the metastasis of cell CT26 were investigated by comparing the tumor metastasis rate and the number of metastatic lesions of lung and liver in nude mice among the different experimental groups 3 weeks after inoculation. Results HA did not promote the growth and metastasis of Hela, CT26 and HCT116 cells in vitro at different concentrations. Actually, HA exhibited a certain inhibitory activity at the concentration of 5 mg/ml. In the orthotopic transplantation model of colonic tumor-HCT116, HA did not promote the growth of cell HCT116. In the orthotopic transplantation model of colonic tumor-CT26, HA inhibited CT26 tumor metastasis. Conclusion Under the experimental conditions, HA did not promote the growth, migration or metastasis of abdominal and pelvic related tumor cells including Hela, CT26 and HCT116 in vitro and in vivo. -
2型糖尿病(T2DM)是一种以持续性高血糖为主要症状,以胰岛素抵抗为病理生理特征的异质性疾病。近年来,尽管一些研究显示糖尿病发病率逐渐放缓,但T2DM的患病率持续上升。目前全球糖尿病患者超过4.25亿,其中90%为T2DM[1],我国糖尿病患者超1.4亿,位居世界首位[2]。胰高糖素样肽-1(GLP-1)是一种主要由肠道L细胞所产生的激素。艾塞那肽是一种GLP-1受体激动剂(GLP‐1RA),它以葡萄糖浓度依赖的方式增强胰岛素分泌同时抑制胰高糖素分泌,并能够延缓胃排空,通过中枢性的食欲抑制减少进食量,从而达到降低血糖作用[3]。艾塞那肽属于短效GLP-1RA,其半衰期只有2.4 h,需每天2次注射给药,在一定程度上影响患者的用药依从性[4]。艾塞那肽微球(商品名为Bydureon®)是一种长效GLP‐1RA,每周一次给药,与短效GLP‐1RA相比,可提高患者的依从性和生活质量。
美国食品药品监督管理局(FDA)于2012年1月2日批准艾塞那肽微球上市,用于改善T2DM患者的血糖控制。2018年1月4日,原中国食品药品监督管理总局(CFDA)批准该药正式在中国上市,国内获批适应证为用于改善T2DM患者的血糖水平,适用于单用二甲双胍、磺脲类以及二甲双胍合用磺脲类血糖仍控制不佳的患者。2020年《中国2型糖尿病防治指南》[5]和2021年美国糖尿病学会(ADA)指南[6]推荐:GLP-1RA 类药物在合并动脉粥样硬化性心血管疾病(ASCVD)及其高风险的患者、慢性肾病的部分患者中可无须考虑患者的HbA1c水平和二甲双胍的使用而直接使用。2022年ADA/EASD共识报告[7]中指出,在ASCVD或其高风险人群中,GLP-1RA类药物优先于钠-葡萄糖协同转运蛋白2抑制剂。
作为国内首个每周给药一次的GLP-1药物,艾塞那肽微球通过缓释微球技术持续提供稳态艾塞那肽血液浓度水平,从而大大降低给药频率,降低胃肠道不良作用,并增加药物的稳定性和提高患者依从性,为广大T2DM患者提供全新的治疗选择。随着艾塞那肽微球的广泛使用,药物不良事件(ADE)报告也逐渐增多。本文通过对FDA不良事件报告系统(FAERS)收集到的数据进行挖掘和筛选,分析艾塞那肽微球可疑的ADE信号,为国内临床合理安全用药提供参考。
1. 资料和方法
1.1 资料来源
本研究全部资料来源于FAERS收集的艾塞那肽微球相关ADE报告。本研究提取数据为艾塞那肽微球上市时间(2012年1月2日)至2023年3月31日。
1.2 数据提取和统计
以“艾塞那肽微球”为目标药物,检索关键词为“exenatide microspheres for injection”、“LY05006”、“AC
2993 LAR”及“bydureon”。采用Excel表格统计患者基本信息,包括性别、年龄、ADE上报国家和上报人员、ADE 严重程度和类型等。采用《监管活动医学词(26.0版本)》中的首选系统器官分类(SOC)和首选术语(PT)对ADE进行描述、分类和统计。1.3 数据挖掘
采用比值失衡测量法的报告比值比法(ROR)和综合标准法(MHRA)对艾塞那肽微球相关ADE 进行数据挖掘[8-9],其具体计算公式及阈值见表1。
表 1 ROR和MHRA法的计算公式及相应阈值方法
名称计算公式 阈值 ROR法 ROR=a/c/(b/d) a≥3,ROR值的95%CI下限>1,则提示生成1个
信号ROR 95%CI=
${\mathrm{e}}^{\left[{\mathrm{ln}}({\mathrm{ROR}})\pm 1.96\sqrt {\frac{1}{a} + \frac{1}{b} + \frac{1}{c} + \frac{1}{d}}\right]} $MHRA法 PRR=a/(a+b)/[c/(c+d)] a≥3,PRR值>2,χ2值>4,则提示生成1个信号 χ2 =(ad−bc)2(a+b+c+d)/[(a+b)(c+d)(a+c)(b+d)] 注:a:目标药物的目标事件报告数;b:目标药物的其他事件报告数;c:其他药物的目标事件报告数;d:其他药物的其他事件报告数;95%CI:95%置信区间;PRR:比例报告比值比。 2. 结果
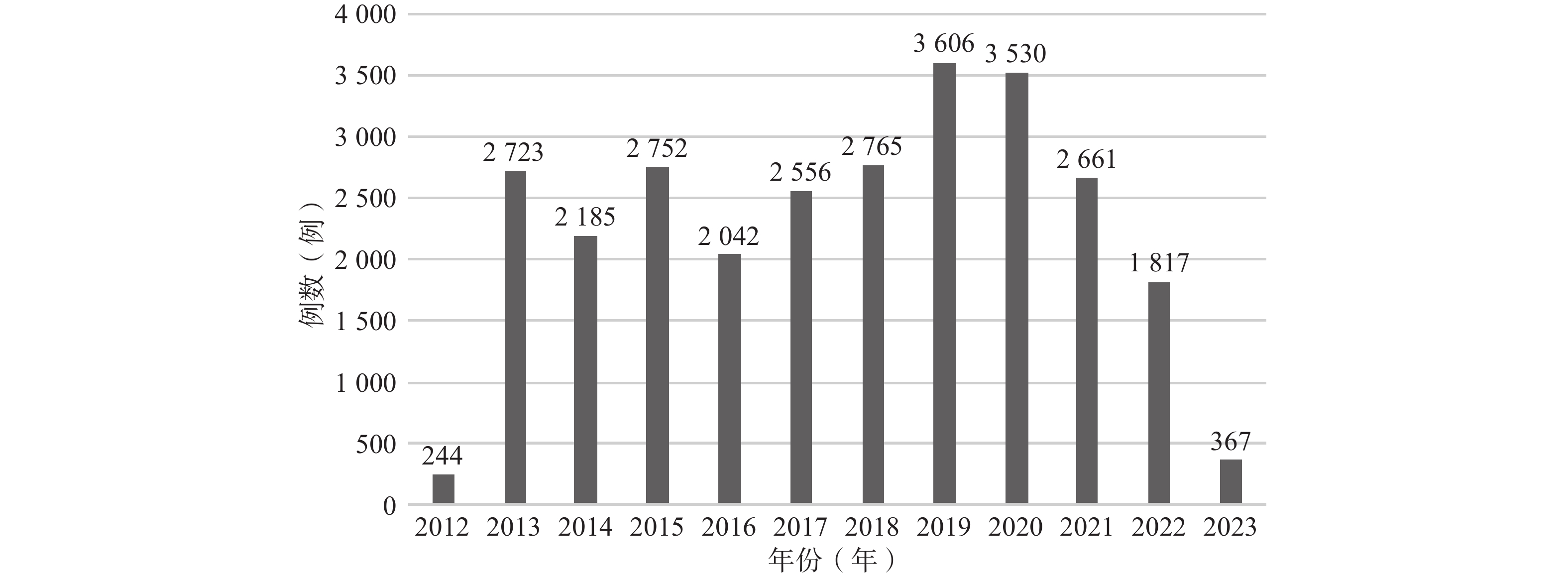
2.1 艾塞那肽微球相关ADE报告年度分布
2012年1月2日至2023年3月31日,FDA共收到艾塞那肽微球相关ADE报告27 248 份,具体年度份数的分布如图1所示。
2.2 艾塞那肽微球相关ADE报告相关患者性别和年龄分布
艾塞那肽微球相关ADE报告27 248份共涉及27 248例患者,患者的性别和年龄分布情况见表2。
表 2 艾塞那肽微球相关ADE涉及患者性别及年龄分布参数 分类 例数(例) 占比(%) 性别 男 11 814 43.36 女 14 328 52.58 未知 1 106 4.06 合计 27 248 100.00 年龄 18-64岁 186 0.68 ≥65岁 339 1.24 未知 26 723 98.07 合计 27 248 100.00 2.3 艾塞那肽微球相关ADE报告上报人员和上报国家分布
统计结果显示,艾塞那肽微球相关ADE报告上报人员以消费者为主(18 435例,占67.66%)。上报国家共 51个,报告数以美国最高(26 295例,占96.5%),其次为日本(117例,占0.4%),具体见表3。
表 3 艾塞那肽微球相关ADE报告上报人员和上报国家分布参数 分类 例数(例) 占比(%) 上报人员 消费者 18 435 67.66 医务人员 2 947 10.82 其他 1 237 4.54 未知 4 629 16.99 合计 27 248 100.00 上报国家 美国 26 295 96.50 日本 117 0.43 英国 114 0.42 法国 104 0.38 澳大利亚 74 0.27 其他 514 1.89 未知 30 0.11 合计 27 248 100.00 2.4 艾塞那肽微球相关ADE中的严重不良事件
在上报的27 248份报告中,报告了4 719例次严重ADE,包括住院、死亡、危及生命、残疾等,具体见表4。
表 4 艾塞那肽微球严重不良事件分布严重不良事件类型 例数(例) 占比(%) 住院 1 462 30.98 死亡 246 5.21 危及生命 146 3.10 残疾 112 2.37 其他 12 56.33 未知 95 2.01 合计 4 719 100.00 2.5 艾塞那肽微球相关ADE中累及的系统和器官
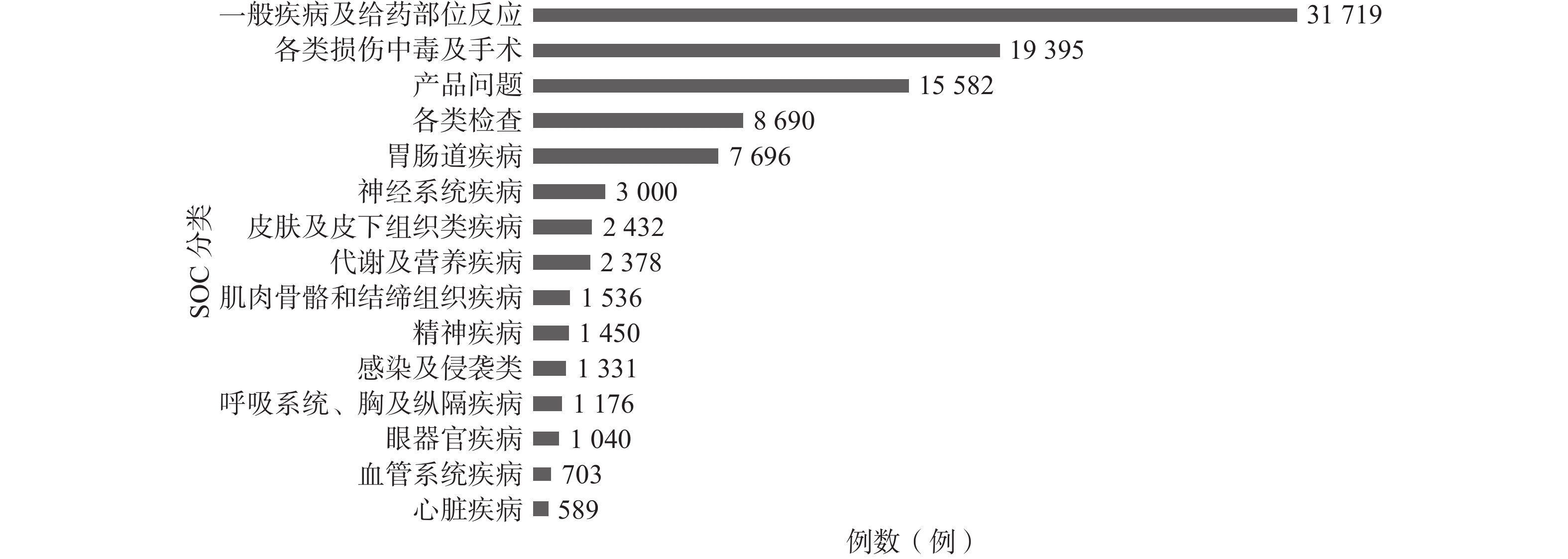
在上报的27 248份报告中,共发生101 469例次ADE。ADE共涉及27个SOC,以给药部位反应为主,具体见图2。
2.6 基于PT术语的信号挖掘
对以艾塞那肽微球为首要怀疑药物的ADE报告进行筛选,PT 报告总数为2 474个,较为常见的 ADE报告数为注射部位不适、血糖升高、体质量降低等,结果见表5。
表 5 艾塞那肽微球相关ADE报告数排序(前50位)序号 PT 报告数/例(个) 序号 PT 报告数/例(个) 1 注射部位出血 5 262 26 注射部位硬结 164 2 注射部位痛 4 586 27 注射部位发热 159 3 注射部位肿块 3 529 28 肿块 156 4 注射部位结节 2 869 29 注射部位不适 146 5 血葡萄糖升高 2 572 30 注射部位疤痕 104 6 体质量降低 2 269 31 皮肤肿块 104 7 注射部位瘙痒 1 590 32 糖化血红蛋白异常 100 8 注射部位瘀青 1 239 33 饥饿感 98 9 注射部位红斑 1 061 34 胃排空障碍 94 10 注射部位肿胀 743 35 体质量波动 94 11 糖化血红蛋白升高 682 36 注射部位刺激 86 12 血葡萄糖降低 553 37 注射部位炎症 79 13 胰腺炎 416 38 挫折承受力降低* 79 14 血葡萄糖异常 391 39 糖化血红蛋白降低 73 15 糖尿病控制不佳 347 40 脂肪酶升高* 68 16 注射部位反应 342 41 食欲障碍 52 17 注射部位损伤 322 42 注射部位血肿 52 18 结节 305 43 注射部位脓肿 50 19 注射部位变色 300 44 注射部位感染 49 20 血葡萄糖波动 221 45 注射部位分泌物 48 21 注射部位皮疹 202 46 超重 43 22 身高降低* 198 47 注射部位结痂 39 23 嗳气 195 48 注射部位蜂窝织炎 37 24 注射部位荨麻疹 193 49 注射部位囊泡 32 25 注射部位凹陷 178 50 血胆固醇异常* 28 注:*表示说明书未列入的ADE。 经ROR法和MHRA法双重筛选,最终获得阳性信号163个。按信号强度( ROR值的 95% CI下限)对前50位PT进行排序,结果见表6。相关性较高的ADE为注射部位不适、获得性混合型高脂血症、糖化血红蛋白异常等。另外,挖掘到未列入药品说明书的ADE共7种。
表 6 艾塞那肽微球相关ADE信号强度排序(前50位)序号 PT 报告数/
例(个)PRR ROR(95% CI) 序号 PT 报告数/
例(个)PRR ROR(95% CI) 1 注射部位结节 2 869 247.06 254.22(242.57-266.43) 26 注射部位脓肿 50 14.02 14.03(10.58-18.60) 2 注射部位凹陷 178 76.69 76.82(65.44-90.19) 27 血葡萄糖波动 221 13.75 13.78(12.05-15.76) 3 获得性混合型高脂血症* 3 71.01 71.02(20.81-242.33) 28 结节 305 13.59 13.63(12.16-15.28) 4 糖化血红蛋白异常 100 66.40 66.47(53.79-82.14) 29 注射部位蜂窝织炎 37 13.49 13.49(9.72-18.72) 5 注射部位囊肿 27 62.44 62.46(41.64-93.69) 30 糖尿病控制不佳 347 13.29 13.33(11.98-14.84) 6 注射部位肿块 3 529 60.93 63.09(60.86-65.40) 31 注射部位肉芽肿 5 12.73 12.73(5.23-31.02) 7 血胰高血糖素增高 4 55.50 55.51(19.51-157.89) 32 胃肿块* 18 12.71 12.71(7.95-20.32) 8 注射部位变形 8 53.65 53.66(25.66-112.21) 33 血葡萄糖异常 391 12.15 12.20(11.03-13.49) 9 注射部位损伤 322 49.86 50.01(44.54-56.16) 34 血管损伤* 23 10.53 10.53(6.96-15.93) 10 注射部位出血 5 262 46.12 48.59(47.19-50.03) 35 注射部位炎症 79 10.17 10.18(8.14-12.72) 11 给药部位结节 3 36.58 36.58(11.22-119.29) 36 注射部位痛 4 586 10.03 10.46(10.15-10.78) 12 注射部位关节痛 5 35.30 35.30(14.15-88.07) 37 注射部位感染 49 9.63 9.63(7.26-12.79) 13 给药部位凹陷 3 33.53 33.53(10.33-108.90) 38 身高降低* 198 9.36 9.38(8.14-10.80) 14 腹壁肿块* 5 32.45 32.45(13.05-80.72) 39 注射部位瘀青 1 239 9.06 9.16(8.65-9.69) 15 身高异常* 7 30.62 30.62(14.20-66.03) 40 注射部位不适 146 8.97 8.98(7.62-10.58) 16 糖化血红蛋白降低 73 29.73 29.75(23.46-37.74) 41 注射部位刺激 86 8.95 8.96(7.23-11.09) 17 注射部位结痂 39 25.44 25.45(18.41-35.17) 42 血葡萄糖升高 2 572 8.78 8.99(8.64-9.35) 18 注射部位疤痕 104 22.78 22.80(18.71-27.79) 43 皮肤肿块 104 8.76 8.77(7.22-10.65) 19 腹部脂肪堆积* 3 21.56 21.56(6.75-68.87) 44 嗳气 195 7.90 7.91(6.86-9.12) 20 糖化血红蛋白升高 682 16.99 17.10(15.83-18.47) 45 血葡萄糖降低 553 7.71 7.75(7.12-8.43) 21 注射部位腐烂 11 16.96 16.96(9.28-31.01) 46 注射部位硬结 164 7.66 7.67(6.57-8.96) 22 注射部位分泌物 48 16.02 16.02(12.01-21.38) 47 胃排空障碍 94 7.53 7.54(6.15-9.25) 23 注射部位瘙痒 1 590 15.25 15.48(14.72-16.28) 48 注射部位肿胀 743 6.51 6.55(6.09-7.05) 24 注射部位变色 300 14.67 14.71(13.10-16.51) 49 肿块 156 6.28 6.29(5.37-7.37) 25 体质量指数异常 4 14.12 14.12(5.21-38.27) 50 注射部位红斑 1 061 5.54 5.58(5.25-5.93) 注:*表示说明书未列入的ADE。 3. 讨论
本研究利用FAERS数据库中艾塞那肽微球的ADE报表数据,应用比值失衡法对艾塞那肽微球上市后发生的ADE进行分析和挖掘,为减少结果偏倚,本研究采用ROR法与MHRA法两种方法进行数据挖掘。艾塞那肽微球相关ADE信号较强且较多地集中在给药部位反应、血糖控制不佳、胃肠道系统反应等方面,与药品说明书中ADE大致相同。
本研究结果显示,艾塞那肽微球较强的ADE为注射部位反应包括结节、凹陷、肿块,关联较强的ADE为胃肠道药物不良反应、血糖控制不佳,提示临床使用艾塞那肽微球时应重点关注注射部位反应、胃肠道反应如嗳气、胃排空障碍以及血糖波动等相关ADE。GLP-1RA一方面通过增加胰岛β细胞胰岛素分泌和减少α细胞胰高血糖素分泌来改善糖代谢[10];另一方面通过抑制食欲和减少食物摄入来减轻体质量[11]。由此造成胃排空障碍、嗳气等一系列ADE,并同时作用于中枢神经系统,造成食欲下降。既往研究结果显示,相比其他半衰期较短的GLP-1RA(如艾塞那肽、利拉鲁肽等),艾塞那肽微球不仅在持续血糖控制和减轻体重各方面具有更好的疗效[12-14],而且胃肠道相关ADE的发生率显著降低[15]。
艾塞那肽微球是长效制剂,每周给药1次。艾塞那肽微球从微球中逐渐释放药物可以帮助患者减少皮下注射次数。由于缓释制剂的便利性,可以改善患者的依从性和提高生活质量,与短效GLP-1 RA相比,可以更好地控制血糖。这可能与艾塞那肽微球制剂中血浆艾塞那肽的浓度在白天更稳定有关,可能有助于患者胰岛β细胞功能的改善[13, 16]。
注射用艾塞那肽微球给药前需要混合药物和填充注射器,对使用方法有一定的要求,如注射给药应在腹部、大腿或上臂区域皮下注射,在同一区域注射时,每周应选择不同的部位,减少注射部位ADE的发生[17]。注射部位反应如结节、凹陷、肿块、出血等 ADE的报告数与信号强度均排在前列。提示在临床使用艾塞那肽微球时,专业医疗人员应当注意加强对患者药物注射的用药教育,保障患者用药的有效性和安全性。
本研究经ROR法和MHRA法双重筛选,最终获得阳性信号163个,其中发现有10个未在说明书中出现的ADE信号。说明书中提示急性胰腺炎包括致死性和非致死性出血或坏死性胰腺炎的发生与使用艾塞那肽有关[18]。本研究发现了胰腺炎阳性信号,提醒医务人员应注意使用该药应密切关注患者是否发生急性胰腺炎的症状和体征,包括持续性严重腹痛并可放射到背部或伴有恶心和呕吐。如果怀疑出现胰腺炎应立即停药。对确诊胰腺炎患者,则不应重新开始注射用艾塞那肽微球治疗。
本研究属于上市后ADE信号研究,即使有大样本量的数据,仍然存在一定局限性。首先FAERS是自发上报系统,因此存在重复报告、错报、漏报等情况[19]。如在本研究中,超过90%的患者年龄信息未知,对于ADE年龄的分布估计有一定的影响。其次尽管同时使用ROR法与MHRA法两种方法,但是仍然不能排除假阳性信号出现,而且FAERS数据库中ADE项的信息填写可能过于主观,如对于同一个ADE,不同的报告者可能采用不同的描述,即使通过术语标准化仍然无法消除这一问题,导致单个PT的ROR、PRR值的计算可能存在误差。最后FAERS数据库中数据来源主要是欧美国家,而亚洲人群的数据,尤其是中国患者的数据少,因此需要考虑研究发现的ADE信号是否符合中国人群现状。本研究虽然用 2 种方法进行综合评价,检出阳性信号并非必然的因果关系,仍需进一步临床研究加以证实。
-
表 1 HA在裸鼠体内对HCT116肿瘤生长的影响(
$\bar{ x}\pm { s}$ )组别 动物数(只) 成瘤数(只) 成瘤率(%) 瘤体积(V/mm3) 瘤重(m/g) 假手术组 16 0 0 0.0 ± 0.0 0.000 ± 0.000 模型组 16 16 100 339.1 ± 258.0 0.359 ± 0.219 HA组 16 16 100 293.2 ± 190.6 0.330 ± 0.187 5-Fu组 16 14 87.5 128.5 ± 111.9** 0.149 ± 0.105*** **P<0.01、***P<0.001,与模型组比较 表 2 HA在裸鼠体内对CT26肿瘤转移的影响(
$\bar{ x}\pm { s}$ )组别 动物数(只) 成活率(%) 肝转移 肺转移 转移率(%) 病灶数 转移率(%) 病灶数 假手术组 15 100.0 0.0 0.0 ± 0.0 0.0 0.0 ± 0.0 模型组 16 62.5 90.0 2.2 ± 1.7 40.0 0.5 ± 0.7 HA 组 16 68.8 36.4* 0.6 ± 1.0** 18.2 0.2 ± 0.4 5-Fu 16 100.0 0.0*** 0.0 ± 0.0*** 6.3* 0.1 ± 0.3* *P<0.05、**P<0.01、***P<0.001,与模型组比较 -
[1] EVANKO S P, TAMMI M I, TAMMI R H, et al. Hyaluronan-dependent pericellular matrix[J]. Adv Drug Deliv Rev,2007,59(13):1351-1365. doi: 10.1016/j.addr.2007.08.008 [2] LAURENT T C, FRASER J R. Hyaluronan[J]. FASEB J,1992,6(7):2397-2404. doi: 10.1096/fasebj.6.7.1563592 [3] ABBRUZZESE F, BASOLI F, COSTANTINI M, et al. Hyaluronan: an overview[J]. J Biol Regul Homeost Agents,2017,31(4 Suppl 2):9-22. [4] TOOLE B P. Hyaluronan in morphogenesis[J]. Semin Cell Dev Biol,2001,12(2):79-87. doi: 10.1006/scdb.2000.0244 [5] BHARADWAJ A G, RECTOR K, SIMPSON M A. Inducible hyaluronan production reveals differential effects on prostate tumor cell growth and tumor angiogenesis[J]. J Biol Chem,2007,282(28):20561-20572. doi: 10.1074/jbc.M702964200 [6] TAMMI R H, KULTTI A, KOSMA V M, et al. Hyaluronan in human tumors: pathobiological and prognostic messages from cell-associated and stromal hyaluronan[J]. Semin Cancer Biol,2008,18(4):288-295. doi: 10.1016/j.semcancer.2008.03.005 [7] THEOCHARIS A D, VYNIOS D H, PAPAGEORGAKOPOULOU N, et al. Altered content composition and structure of glycosaminoglycans and proteoglycans in gastric carcinoma[J]. Int J Biochem Cell Biol,2003,35(3):376-390. doi: 10.1016/S1357-2725(02)00264-9 [8] GARCÍA I, VIZOSO F, SUÁREZ C, et al. Relationship of tumoral hyaluronic acid and cathepsin D contents with histological type of gastric carcinoma[J]. Int J Biol Markers,2000,15(3):215-218. doi: 10.1177/172460080001500302 [9] LLANEZA A, VIZOSO F, RODRÍGUEZ J C, et al. Hyaluronic acid as prognostic marker in resectable colorectal cancer[J]. Br J Surg,2000,87(12):1690-1696. doi: 10.1046/j.1365-2168.2000.01586.x [10] SUGAHARA K N, MURAI T, NISHINAKAMURA H, et al. Hyaluronan oligosaccharides induce CD44 cleavage and promote cell migration in CD44-expressing tumor cells[J]. J Biol Chem,2003,278(34):32259-32265. doi: 10.1074/jbc.M300347200 [11] SUGAHARA K N, HIRATA T, HAYASAKA H, et al. Tumor cells enhance their own CD44 cleavage and motility by generating hyaluronan fragments[J]. J Biol Chem,2006,281(9):5861-5868. doi: 10.1074/jbc.M506740200 [12] STERN R, ASARI A A, SUGAHARA K N. Hyaluronan fragments: an information-rich system[J]. Eur J Cell Biol,2006,85(8):699-715. doi: 10.1016/j.ejcb.2006.05.009 [13] BERDIAKI A, ZAFIROPOULOS A, FTHENOU E, et al. Regulation of hyaluronan and versican deposition by growth factors in fibrosarcoma cell lines[J]. Biochim Biophys Acta,2008,1780(2):194-202. doi: 10.1016/j.bbagen.2007.10.005 [14] BERDIAKI A, NIKITOVIC D, TSATSAKIS A, et al. bFGF induces changes in hyaluronan synthase and hyaluronidase isoform expression and modulates the migration capacity of fibrosarcoma cells[J]. Biochim Biophys Acta,2009,1790(10):1258-1265. doi: 10.1016/j.bbagen.2009.06.013 [15] 郭群英, 叶任高, 黄文生, 等. 不同分子量透明质酸对人腹膜间皮细胞透明质酸合成酶mRNA表达的影响[J]. 中国中西医结合肾病杂志, 2002, 3(6):320-322. doi: 10.3969/j.issn.1009-587X.2002.06.003 -





 下载:
下载:
 下载:
下载: