舒肝安乐宁浸膏对小鼠急性酒精性肝损伤保护作用的研究
Protective effect of Shugananlening extract on acute alcohol hepatic injury in mice
-
摘要: 目的 研究舒肝安乐宁浸膏对小鼠急性酒精性肝损伤的保护作用。 方法 以白酒灌胃法建立小鼠急性酒精性肝损伤模型,观察血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、肝组织中超氧化物歧化酶(SOD)、丙二醛(MDA)、甘油三酯(TG)指标的变化,并进行病理组织学检测。 结果 各剂量舒肝安乐宁浸膏能显著降低小鼠血清ALT、AST活性和肝组织MDA、TG含量(P<0.05或P<0.01),提高肝组织SOD活性,减轻肝脏的病理损伤。 结论 舒肝安乐宁浸膏对急性酒精性肝损伤有保护作用。其作用机制可能为减少自由基的产生,抑制脂质过氧化反应,减少脂肪在肝脏的沉积。Abstract: Objective To study the protective effect of Shugananlening extract on acute alcoholic hepatic injury in mice. Methods The model of hepatic injury was prepared by intragastric infusion of alcohol, the change of alanine transaminase (ALT), aspartate transaminase (AST) in serum and liver superoxide dismutase (SOD), malondialdehyde (MDA) and triglyceride (TG) were observed. HE staining was used to observe the pathological changes in liver. Results The level of ALT, AST, TG and MDA were significantly reduced and the activity of SOD was enhanced by different doses of Shugananlening Extract. Furthermore, the pathological injury was also significantly abated by high-dose and middle-dose of Shugananlening Extract. Conclusion Shugananlening extract had a good protective effect on acute alcoholic hepatic injury in mice. The mechanisms probably contributed to the decrease of lipid peroxide and fatty sediment in liver.
-
Key words:
- Shugananlening extract /
- alcohol /
- hepatic injury
-
免疫介导的炎性眼前段疾病(immune-mediated inflammatory anterior ocular diseases,IIAODs)如春季结膜炎、前葡萄膜炎等是临床上较常见的眼科疾病。局部或全身性使用类固醇是控制这类疾病炎症的主要手段。然而,长期使用类固醇可能会导致白内障、青光眼等,从而存在失明的可能。因此,眼科临床越来越频繁地局部使用免疫抑制剂来治疗这类疾病。
他克莫司(tacrolimus,FK506)作为第二代免疫抑制剂代表性药物,是治疗IIAODs的主要方式之一[1-3]。目前国内上市的FK506眼用制剂为日本千寿药业生产的Talymus®,其药效容易受到泪液冲刷的影响而降低。因此,本研究研制了他克莫司阳离子微乳凝胶(FK506-loaded cationic nanoemulsion-based in-situ gel, FK506 CNE GEL),旨在利用该剂型的特性,延长药物在眼部的滞留时间,提高生物利用度,减少给药频次。本文通过HE染色处理的兔眼组织病理切片观察FK506 CNE GEL的眼部刺激性,并通过建立HPLC-MS测定兔眼房水药物浓度的方法,考察其房水药动学。
1. 材料
1.1 仪器
Agilent 1100型高效液相色谱系统(美国安捷伦公司);AL204 电子天平(梅特勒托利多仪器有限公司);DF-101S集热式恒温加热磁力搅拌器(上海精密试验设备有限公司);NS1001L型高压均质机(意大利Niro Soavi公司);85-1型磁力搅拌器(上海志成电器有限公司);CX31光学显微镜(Olympus Corporation);JY92-2D超声波细胞粉碎机(宁波新芝生物科技股份有限公司);H1850R型台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司);SCIEX QTRAP® 5500 型高压快速液相色谱-三重串联四级杆质谱联用仪(美国AB SCIEX公司)。
1.2 药物与试剂
他克莫司对照品(含量99.3%,福建科瑞药业有限公司);子囊霉素对照品(含量99.5%,上海齐奥化工有限公司);蓖麻油(湖南宏康制药股份有限公司);中链脂肪酸甘油酯(铁岭北亚药用油有限公司);吐温-80(四川金山制药有限公司);泊洛沙姆407、泊洛沙姆188(德国BASF提供);西他氯胺(Sigma-Aldrich);甘油(湖南尔康制药有限公司);注射用水(明澈D24UV);甲醇(上海科丰实业有限公司);他克莫司滴眼液(Talymus®,日本千寿制药株式会社);0.9%氯化钠注射液(国药集团化学试剂有限公司);戊巴比妥钠(Merck 分装);盐酸丙美卡因滴眼液(爱尔凯因®,美国爱尔康眼药厂比利时分厂);其他药品和试剂均为药用规格或分析纯。
1.3 动物
新西兰白兔,雌雄兼用,2.5~3.0 kg,上海斯莱克实验动物有限公司。实验前24 h自由进食、饮水,进行眼部检查以确保无任何眼病。
2. 方法与结果
2.1 FK506 CNE GEL的配制
根据本研究前期报道制备FK506 CNE GEL[4]。首先以蓖麻油(4 %,W/V)、中链脂肪酸甘油酯(6 %,W/V)作为混合油相,西他氯胺(0.02 %,W/V)作为阳离子表面活性剂,吐温−80(1 %,W/V)、泊洛沙姆188(0.1 %,W/V)作为非离子表面活性剂,甘油(2.2 %,W/V)作为渗透压调节剂,通过高压均质制得FK506 CNE(0.1 %,W/V)。而后以26 %泊洛沙姆407和12 %泊洛沙姆188共同作为凝胶基质,将FK506 CNE进一步制备成FK506 CNE GEL(0.1 %,W/V)。
2.2 FK506 CNE GEL的眼部刺激性考察[5-6]
2.2.1 分组给药设计
取实验兔8只,随机分为A、B两组。采用动物同体左右侧自身对比法,A组实验兔左眼滴入FK506 CNEGEL 50 μl,右眼滴入生理盐水50 μl作为对照。B组实验兔左眼滴入市售Talymus® 50 μl,右眼滴入生理盐水50 μl作为对照。给药后使兔眼被动闭合10 s,使药液与局部有充分接触。每日给药3次,连续给药2周。
2.2.2 眼球组织病理切片
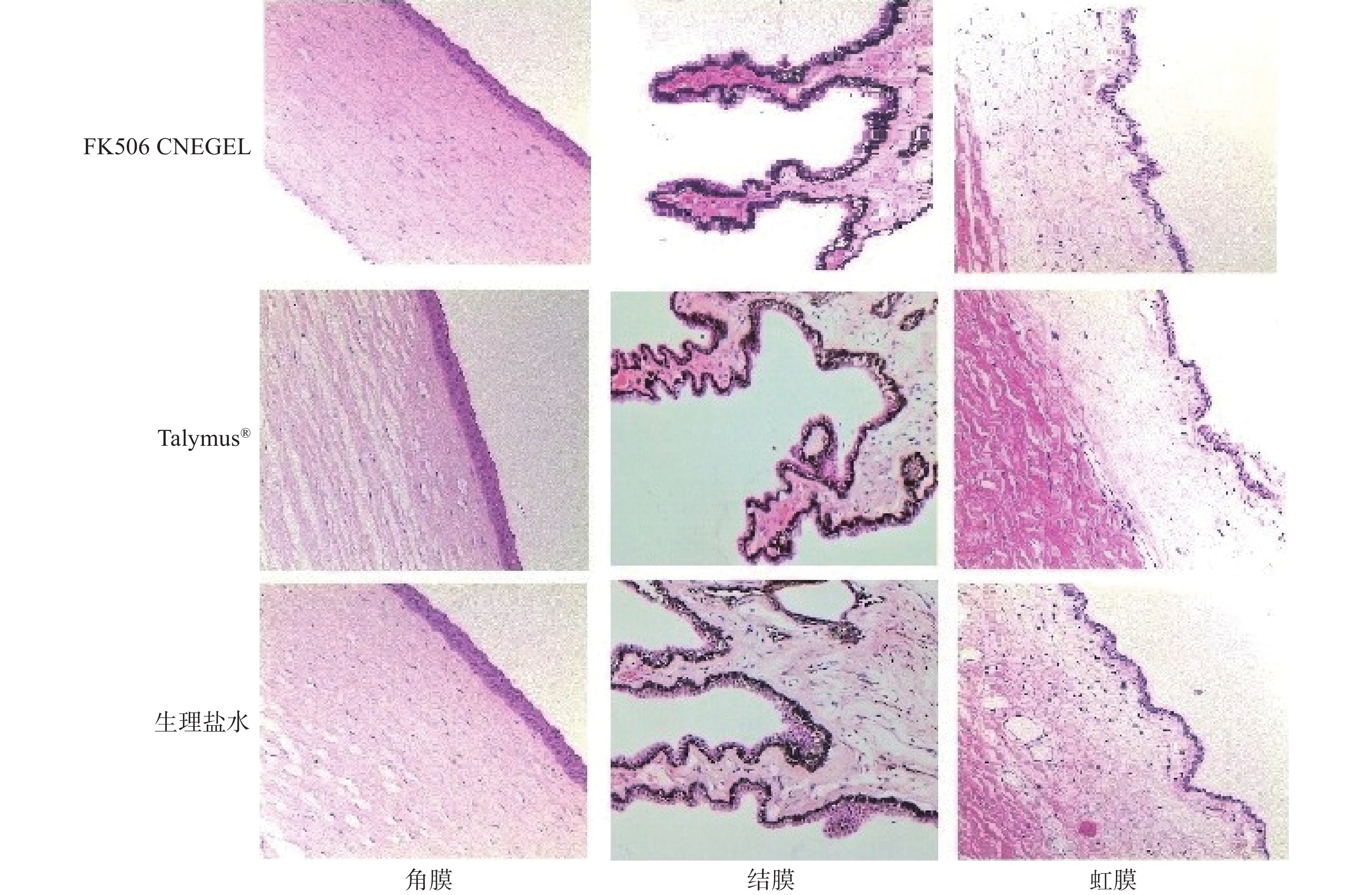
通过耳缘静脉注入空气处死实验兔后取出眼球,进行病理组织切片,详细步骤如下:① 10 %中性福尔马林固定;② 流水冲洗;③ 组织修切平面;④ 组织脱水、石蜡包埋;⑤ 石蜡组织切片;⑥ 二甲苯-无水乙醇脱蜡;⑦ 苏木素-伊红染色;⑧ 小浓度氨水返蓝;⑨ 脱水、复染、洗涤;⑩ 继续脱水后封片。光学显微镜下观察兔眼角膜,虹膜,结膜并拍照,试验结果见图1。
一般情况下,兔眼较人眼对刺激反应更为敏感。图1为显微镜下滴入FK506 CNE GEL、Talymus®及生理盐水后的兔眼角膜、虹膜及结膜结构。对比可见,滴入FK506 CNE GEL后兔眼角膜组织排列规则有序、纹理清晰;虹膜各层组织结构清晰,无明显异常;结膜组织清晰可见,未见坏死及炎性细胞浸润,与生理盐水组及Talymus®组对比无明显差异。结果表明,FK506 CNE GEL对兔眼角膜、虹膜及结膜均无明显刺激性。
2.3 FK506 CNE GEL房水药动学研究[7-10]
2.3.1 色谱条件
采用Agilent 1100型高效液相色谱仪,色谱柱为Agilent Poroshell 120 EC-C18 (2.1 mm×50 mm, 2.7 μm),流动相为甲醇-水(2 mmol/L醋酸铵)(90∶10, v/v),柱温为40 ℃,流速为0.3 ml/min,进样量为1 μl。
2.3.2 质谱条件
采用SCIEX QTRAP® 5500 型高压快速液相色谱-三重串联四级杆质谱联用仪以ESI正离子电离方式检测,扫描方式为多反应监测(MRM),扫描时间为100 ms,离子源电离电压为5 500 V,离子源温度为550 ℃,雾化气流流速为7 L/min。以上述质谱条件对FK506及子囊霉素(ascomycin ,FK520)进行离子扫描,结果如表1所示。根据扫描结果,选择m/z 821.5→768.4 作为 FK506 定量分析离子对,m/z 821.5→576.3 作为其定性分析离子对;选择m/z 809.5→756.5作为FK520定量分析离子对,m/z 809.5→564.3 作为其定性分析离子对。
表 1 FK506和FK520的质谱行为分析参数 FK506 FK520 分子量 804.2 792.4 定性分析的离子反应(m/z) 821.5→576.3 809.5→564.3 碎裂能量(CE, V) 31.2 29.0 定量分析的离子反应(m/z) 821.5→768.4 809.5→756.5 碎裂能量(CE, V) 28.0 26.1 解簇电压(DP, V) 120 45 2.3.3 房水样品的制备
精密移取房水样品30 μl置于2 ml离心管中,加入50 μl FK520内标液(100 ng/ml)及120 μl甲醇,涡旋混合,12 000 r/min离心15 min,取上清液进样分析。
2.3.4 方法专属性考察
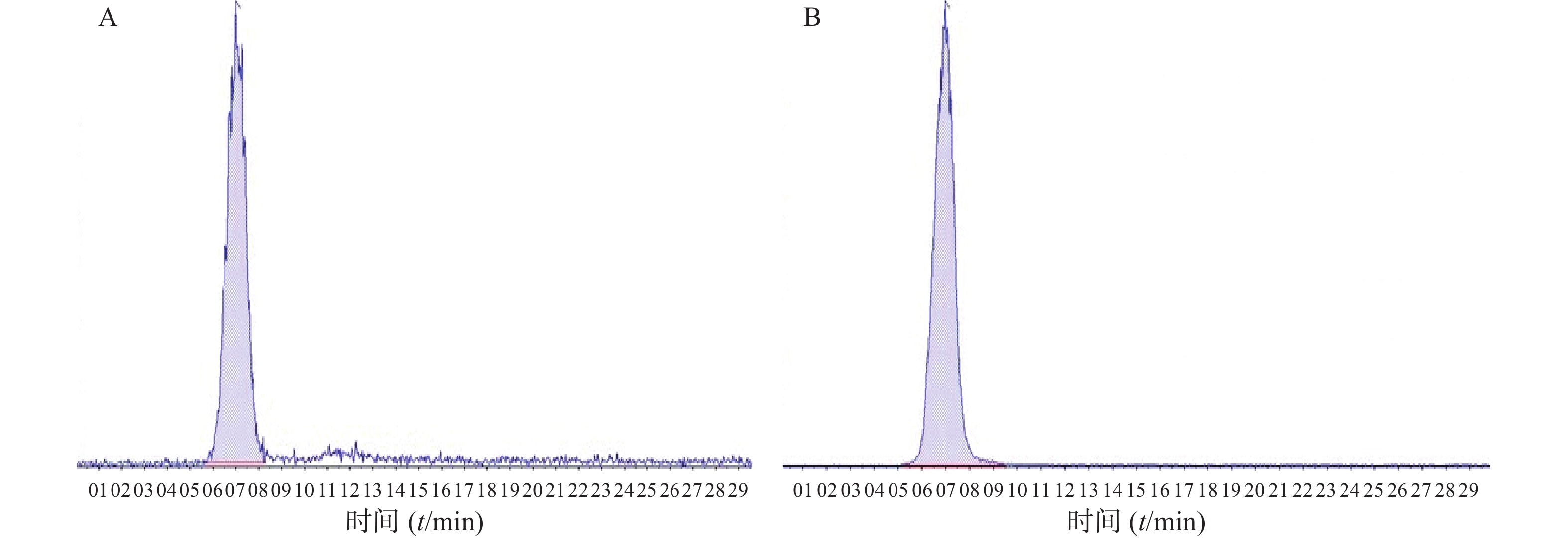
取空白房水30 μl,将一定浓度的FK506和FK520标准溶液分别加入空白房水中,按照“2.3.3”项下方法处理,记录谱图。结果如图2所示,表明房水中内源性物质对FK506的测定无干扰,方法专属性良好。
2.3.5 标准曲线和定量限
精密移取空白房水 30 μl置于2 ml离心管中,加入不同量的100 ng/ml FK506标准溶液及50 μl FK520内标液(100 ng/ml),加入甲醇使总量达200 μl制成系列浓度50、25、10、5、2.5、1、0.5 ng/ml的FK506溶液,12 000 r/min离心15 min,液质联用仪进样分析,记录对应图谱。以FK506峰面积Ai与FK520峰面积As的比值Ai/As作为纵坐标,以FK506浓度C(ng/ml)为横坐标进行线性回归,得线性回归方程:A=0.324 75C+0.05577,r=0.999 96。结果表明FK506在0.5~50 ng/ml浓度范围内线性关系良好,定量限为0.5 ng/ml。
2.3.6 方法精密度考察
配制浓度为1、10、30 ng/ml的FK506样品,按照“2.3.3”项下方法处理,于1 d内重复测定5次,连续测定5 d,考察方法的日内、日间精密度。根据测得浓度与理论浓度比值计算方法回收率,结果见表2。结果表明,日内、日间精密度RSD<2%,精密度良好。
表 2 方法精密度试验结果时间 浓度
(ng/ml)序号 平均值 RSD
(%)1 2 3 4 5 日内 1 1.00 0.97 0.98 0.98 0.96 0.98 1.52 10 9.91 9.98 9.92 9.97 9.94 9.94 0.31 30 29.96 29.95 29.96 29.87 29.98 29.94 0.09 日间 1 0.99 0.98 1.97 0.96 1.01 1.18 0.37 10 9.96 9.98 9.95 9.97 9.98 9.97 0.13 30 29.98 29.96 29.96 30.01 29.95 29.97 0.05 2.3.7 方法重复性考察
配制浓度为1、10、30 ng/ml的房水样品各3份,按照“2.3.3”项下方法处理,1 d内测定。结果见表3,表明3个样品浓度RSD<2%,重复性良好。
表 3 方法重复性试验结果浓度
(ng/ml)序号 平均值 RSD
(%)1 2 3 1 0.98 0.96 0.97 0.97 1.03 10 9.97 9.93 9.96 9.95 0.21 30 29.93 29.98 29.92 29.94 0.06 2.3.8 回收率试验
取FK506浓度为1、10、30 ng/ml样品各3份,按照“2.3.3”项下方法处理并测定,记录FK506峰面积为A1;取空白房水同法萃取,于分离的上清液中加入对应浓度等量的FK506和FK520,测定并记录FK506峰面积A2。按提取回收率公式(A1/A2)×100 %算得FK506的提取回收率。结果表明,FK506在各个浓度的提取回收率分别为(78.14±4.21)%、(78.32±4.55)%、(76.56±4.35)%,符合体内药动学研究的相关指标。
2.3.9 分组给药设计
将实验兔随机分成A、B两组,每组6只,共12只。A组实验兔(A1~A6)左眼给予Talymus®,右眼给予自制FK506 CNE;B组实验兔(B1~B6)左眼给予FK506 CNE GEL,右眼给予FK506 CNE。实验前24 h自由进食、饮水,并进行眼部检查,以确保无任何疾病。于给药点用开睑器撑开实验兔眼睑,使用移液枪往实验兔左、右眼分别滴入等量药液50 μl,按压实验兔眼睑使之被动闭合约10 s使药物分布均匀。
2.3.10 统计学分析
采用SPSS统计软件进行独立样本t检验分析,当P<0.05时,统计学有显著性差异。实验数据均以(
$ \bar x \pm s $ )表示。2.3.11 样品采集
提前给予实验兔1 %戊巴比妥钠(0.6 ml/kg)进行耳缘静脉麻醉,并于采样前使用盐酸丙美卡因滴眼液进行局麻。接着,用镊子固定眼球后采用角膜穿刺术抽取房水,分别于给药后0.5、1、1.5、2、2.5、3、4、6、8、10 h时间点采样。A1~A3实验兔于给药后0.5、1.5、2.5、4、8 h各抽取房水30 μl,A4~A6实验兔于给药后1、2、3、6、10 h各抽取房水30 μl。B1~B3实验兔于给药后0.5、1.5、2.5、4、8 h各抽取房水30 μl,B4~B6实验兔于给药后1、2、3、6、10 h各抽取房水30 μl。
2.3.12 数据处理分析
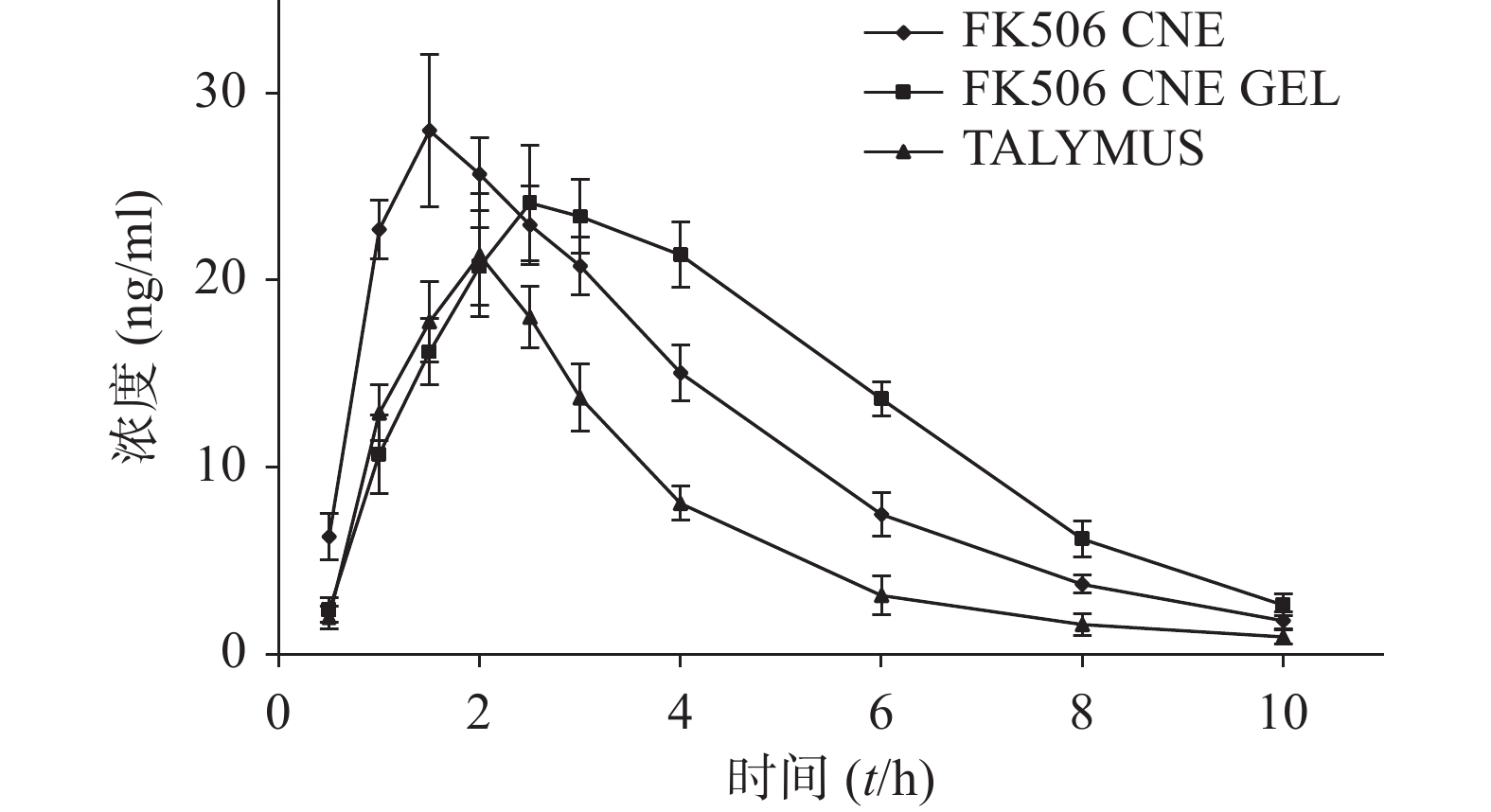
以房水样品中FK506浓度C(ng/ml)为纵坐标,以时间T(h)为横坐标作图,得药-时曲线图3及对应药动学参数表4。
表 4 给予FK506三种制剂后的房水药动学参数(n=3)药动学参数 FK506 CNE Talymus® FK506 CNE GEL AUC(ng·h /ml) 113.61±12.36* 68.25±10.82 128.34±13.09*# c max (ng/ml) 28.02±4.07 21.34±3.31 24.14±3.10 t max (t/h) 1.50±0.20* 2.00±0.17 2.50±0.25*# ka (h-1) 2.16±0.51* 1.14±0.90 0.94±0.08*# ke (h-1) 0.34±0.02* 0.41±0.05 0.32±0.02*# MRT (t/h) 3.46±0.28* 3.23±0.24 4.23±0.34*# *P<0.05,与Talymus®比较;#P<0.05,与FK 506 CNE比较 由表4可见,MRT(CNE GEL)>MRT(CNE)>MRT(Talymus®),即FK506 CNE GEL的平均滞留时间最长,表明FK506 CNE GEL在角膜的滞留时间最长。此外,AUC(Talymus®)为(68.25±10.82) ng·h /ml,AUC(CNE)为(113.61±12.36)ng·h /ml,AUC(CNE GEL)为(128.34±13.09)ng·h /ml。三者对比得AUC(CNE GEL)是AUC(CNE)的1.13倍,是AUC(Talymus®)的1.88倍,说明FK506 CNE GEL的生物利用度较高。
3. 讨论
3.1 FK506 CNE GEL的辅料
FK506 CNE GEL所采用的辅料都是安全、无刺激的,例如采用的阳离子材料为阳离子表面活性剂西他氯胺(CKC)。CKC作为眼药水中常用的防腐剂苯扎氯胺的一个组分,其安全性已得到保证,且CKC在市售产品空白阳离子纳米乳Cationorm®和口腔软膏Bonjela®中广泛使用,其临床安全性得到进一步证实。此外,采用的凝胶基质为P407/P188。由于非离子型表面活性剂泊洛沙姆无毒、无刺激,不仅可以通过空间位阻效应稳定纳米乳而且具有模拟黏膜的性质,是温敏型原位凝胶最常用的凝胶基质,同样安全性也能得到保证。其他辅料如蓖麻油、MCT、吐温-80和甘油均是常用的眼用制剂辅料之一。
3.2 FK506 CNE GEL的药动学参数
药动学参数t max (CNE GEL)>t max (Talymus®)>t max (CNE),说明FK506 CNE GEL的达峰时间最长。这是因为FK506 CNE GEL在角膜表面形成一层凝胶且其所带正电荷能与带负电荷的角膜发生静电吸引作用,从而延长其在眼部的滞留时间,缓慢而持续地释放药物,使药物作用时间延长,达峰时间延迟。而ka (CNE)>ka (Talymus®)>ka (CNE GEL)同样证实了这一点,由于FK506 CNE和Talymus®是水溶性滴眼液,相较于FK506 CNE GEL,释放药物透过角膜被吸收的速度相对较快,故FK506 CNE GEL被吸收的速度最慢。而Talymus®的粒径(1671.5±66.3)nm较FK506 CNE的粒径(178.8±2.7)nm大,故FK506 CNE相较而言吸收快、达峰时间短。
由于泪液冲刷及鼻泪管排泄,房水药物浓度随时间延长而降低。由药时曲线可见,在给药后2~4 h,Talymus®的消除曲线下降趋势最为陡峭,FK506 CNE次之,而FK506 CNE GEL的消除曲线最为平缓。ke (Talymus®)>ke (CNE)>ke (CNE GEL)同样说明FK506 CNE GEL在眼部被消除的速度最慢,相较另外两种制剂而言,明显延缓了药物从前房的消除。
综上所述,FK506 CNE GEL对兔眼无明显刺激性,给药后能黏附于黏膜表面,延长药物作用时间,提高药物生物利用度,减少给药频次。有望成为一种眼部安全性高、滞留时间长的FK506眼用制剂,其研发成功将为眼科临床提供更多选择,为IIAODs患者的临床治疗提供帮助。
-
[1] 夏爱军,韦少宣,蔡文娥,等. 舒肝安乐宁浸膏对肝纤维化大鼠肝脏组织的影响[J].解放军药学学报, 2009, 25(3): 196. [2] 赵 敏,黄俊明,谭剑斌,等. 小鼠急性酒精性肝损伤模型的动态研究[J]. 毒理学杂志,2001, 27(6) :378. [3] 赵 敏,池莉平,王凤岩,等. 小鼠急性酒精性肝损伤模型的建立及应用[J],华南预防医学,2005,31(1):14. [4] Walch K, Alexander G. Alcoholic liver disease[J]. Postgrad Med J,2000, 76(895): 280. [5] 杜施霖,迟宝荣.龙牙葱木皂苷对大鼠酒精性肝病的防治作用[J].吉林大学学报,2005,31(1) : 64. [6] 王金萍,曾 明.可舒胶囊对小鼠酒精性肝损伤的影响[J].中国实验方剂学杂志,2004,10(6) : 64. [7] 裴凌鹏,金宗濂. 葛根黄酮改善小鼠抗氧化功能的研究[J]. 营养学报,2005,26(6): 505. [8] 于淑娥. 鳖甲软肝片抗肝纤维化的疗效观察[J]. 现代中西医结合杂志, 2007, 19(16): 2685. [9] 秦华珍,郑作文,邓家刚,等. 广西桂郁金对小鼠急性肝损伤的保护作用[J]. 广西中医学院学报, 2008, 11(1) : 1. [10] 孙玉凤,冯志杰,孙泽明,等. 黄芪抗肝纤维化的实验研究[J]. 河北中医药学报, 2008, 23(1): 9. [11] 陈纯馨,陈 忻,刘爱文,等. 绞股蓝抗自由基成分的提取和性能测定[J]. 食品科学, 2008, 29(9): 239 [12] Syamasundar KV, Singh B, Thakur RS, et al. Antihepato toxic principles of Phyllantus niruri herbs[J]. Ethnoparmacol, 1985, 14(1): 41. [13] 玉顺子. 叶下珠及其制剂药理作用及临床应用研究进展[J]. 中国药业. 2010, 19(7): 87. [14] 丘 辉. 黄芪多糖药理作用的研究进展[J]. 牡丹江医学院学报, 2011, 32(1): 60. [15] 黄雪萍. 绞股蓝总苷与辛伐他汀治疗原发性高脂血症的疗效比较[J]. 中国药业,2006,15(6): 46. [16] 于 新,杜志坚,陈悦娇,等. 白花蛇舌草提取物抗氧化作用的研究[J]. 食品与发酵工业,2002,28(3): 10. -

 点击查看大图
点击查看大图
计量
- 文章访问数: 2618
- HTML全文浏览量: 201
- PDF下载量: 491
- 被引次数: 0




 下载:
下载:
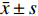

 下载:
下载:
