-
非酒精性脂肪性肝病(NAFLD)是临床常见的肝脏疾病之一,其中,非酒精性脂肪性肝炎(NASH)是非酒精性脂肪肝(NAFL)向非酒精性脂肪性肝硬化转化过程中一个非常重要的环节[1]。非酒精性脂肪性肝炎发展到晚期将导致肝硬化的发生,最终进展为肝细胞癌(HCC),从而影响整体肝功能。因此,NASH的防治具有重要意义。七味脂肝方由垂盆草、豨莶草、牡蛎等七味药组成,处方源于岐黄学者、中医临床肝病专家季光教授临床经验的总结,长期临床应用显示对NASH具有很好的效果。本研究参考常用的NASH动物模型[2-4],选用蛋氨酸和胆碱缺乏(MCD)饮食诱导以及胆碱缺乏的高脂高胆固醇饮食(CDAHFHC)诱导的2个经典NASH的动物模型,研究七味脂肝方对NASH的药效作用,为临床用药提供科学的理论依据。
-
七味脂肝方供试品(江苏康缘药业股份有限公司提供,批号:Z201001),根据项目组前期制定的提取工艺,将七味脂肝方制备成每1 g含6.19 g生药的浸膏粉;维生素E(VE)软胶囊(上海信谊延安药业有限公司,国药准字H31020237,批号:03210202);罗格列酮片(成都恒瑞制药有限公司,国药准字H20030569,批号:210601);丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、甘油三酯(TG)、胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)测定试剂盒(上海惠中生物科技有限公司,批号:01ALT210107、01AST210329、01ALP210222、02TG210330、01CHOL210226、01HDL210525、01LDL210302);乳酸脱氢酶(LDH)测定试剂盒(上海执诚生物科技有限公司,批号:ZCJULT019);游离脂肪酸(FFA)、总胆红素(TBIL)测定试剂盒(美康生物科技股份有限公司,批号:210609101、190731101);苏木素、伊红染色液(珠海贝索生物技术有限公司,批号:719041、719033);F4/80抗体,(Abcam,批号:1004577-2)。
-
全自动生化分析仪(日本东芝,型号:TBA-40R);全自动样品快速研磨仪(上海净信,型号:Tissuelyser-24);轮转式石蜡切片机、冷冻切片机、组织包埋机(徕卡显微系统(上海)贸易有限公司,型号:RM2235、CM1950、Histocore Amber);正置显微镜(日本OLYMPUS,型号:CX31RTSF)。
-
Sprague-Dawley大鼠(SD大鼠),雄性,6周龄,体重200~250 g,48只,购自上海市计划生育科学研究所实验动物经营部,生产许可证号:SCXK(沪)2018-0006。C57BL/J小鼠,雌雄各半,6周龄,体重(24±2)g,96只,购置于上海吉辉实验动物饲养有限公司,生产许可证号:SCXK(沪)2017-0012。通过上海中医药大学实验动物中心实验动物伦理(伦理号:PZSHUTCM210625020)审查,实验动物使用许可证号:SYXK(沪)2018-0006,SPF级环境饲养。
-
48只雄性SD大鼠,饲养于上海中医药大学实验动物中心,正常饮食,自由食水,观察7 d。第8天,根据动物体重按随机数字法随机分为对照组和模型组,除对照组外,其余动物饲料梯度替换为MCD饲料(正常饲料喂养;25%MCD饲料喂养2 d;50%MCD饲料喂养2 d;75%MCD饲料喂养2 d;100%MCD饲料喂养2周),自由食水。造模2周后,对模型组动物根据体重随机分组,分为模型组、七味脂肝方低剂量组(2.8 g/kg生药)、七味脂肝方中剂量组(5.6 g/kg生药)、七味脂肝方高剂量组(11.2 g/kg生药)、阳性对照VE组(40 mg/kg),每组8只。各给药组每天灌胃1次,连续28 d,对照组及模型组灌胃等量的生理盐水。
-
96只C57BL/J小鼠,雌雄各半,饲养于上海中医药大学实验动物中心,正常饮食,自由食水,观察7 d。第8天,根据动物体重按随机数字法随机分为对照组和模型组,除对照组外,其余动物饲料梯度替换为CDAHFHD饲料(正常饲料喂养;25%CDAHFHC饲料喂养2 d;50%CDAHFHC饲料喂养2 d;75%CDAHFHC饲料喂养2 d;100%CDAHFHC饲料喂养2周),自由食水。造模2周后,对模型组动物根据体重随机分组,分为模型组、七味脂肝方低剂量组(4 g /kg生药)、七味脂肝方中剂量组(8 g/kg生药)、七味脂肝方高剂量组(16 g/kg生药)、阳性对照罗格列酮组(RSG,1.14 mg/kg),每组16只。各给药组每天灌胃1次,连续28 d,对照组及模型组灌胃等量的生理盐水。
-
使用全自动生化分析仪测定ALT、AST、ALP、LDH、TG、TC、HDL-C、LDL-C、TBIL、FFA在血清中的水平。
-
取新鲜肝脏组织样本,加入1∶9(质量体积比)的匀浆介质(乙醇∶丙酮=1∶1),冰浴条件下匀浆,置于冰箱4 ℃过夜,4 000 r/min离心15 min,收集上清液样本,使用全自动生化分析仪测定TG、TC、HDL-C、LDL-C在肝脏组织中的水平。
-
肝脏左叶样本固定后,经组织脱水,石蜡包埋,将其切成4 μm的石蜡切片。
(1)HE染色
取肝脏石蜡切片样本,经HE染色,用正置显微镜拍照并评价肝脏病理变化。NASH病理诊断标准采用NAFLD活动度积分(NAS)进行评估(具体评判标准见表1)。
表 1 NAFLD活动度积分(NAS)组织学评分判断标准
评分 肝细胞脂肪变(%) 小叶内炎症 肝细胞气球样变 0 <5 无病灶 无 1 5~33 <2 少量气球样细胞 2 34~66 2~4 较多/显著气球样变 3 >66 >4 注:NAS≥5分可明确NASH的诊断;NAS<3分则可排除NASH;两者之间者为NASH可能。 (2)Masson染色
取肝脏石蜡切片样本,经Masson三色染色,通过正置显微镜观察并拍照记录,评价肝组织纤维化程度。Masson染色纤维化诊断评分参照以下评分标准(表2)。
表 2 肝纤维化分期评分判断标准
评分 纤维化程度 0 无 1 窦周或汇管区纤维化 2 窦周和汇管区周围纤维化 3 桥接纤维化 4 肝硬化 (3)免疫组织化学染色
取肝脏石蜡切片样本,经F4/80抗体免疫组织化学染色,通过正置显微镜观察并拍照记录,评价肝组织中Kupffer细胞的活化程度。
-
所有计量资料采用平均值±标准偏差(
$ \bar{x}\pm s $ )表示。计量资料采用单因素方差分析(one-sample Kolmogorov-Smirnov test)进行数据分布判断,正态分布时采用参数检验的单因素方差分析(ANOVA),偏态分布时采用非参数检验(Mann-Whitney test)。所有数据均使用GraphPad Prism 8软件进行统计并进行图表制作。 -
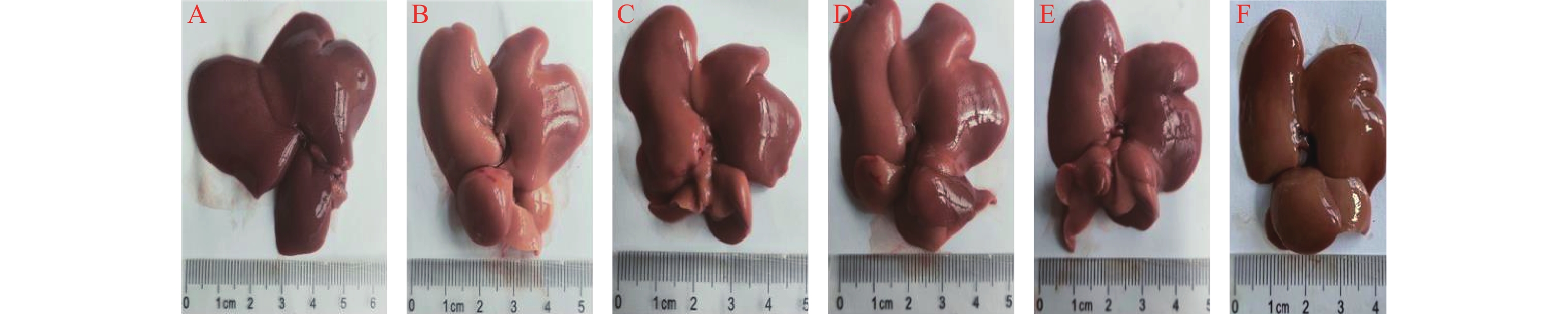
对照组肝脏表面光滑,色深红,质地软,有弹性,肝叶边缘锐利。与对照组相比,模型组肝脏体积增大,颜色变浅;与模型组相比,七味脂肝方各剂量组和阳性对照VE组可以观察到肝脏颜色稍红,各组均可一定程度改善肝脏形态,结果见图1和表3。
表 3 大鼠体重、肝脏重量及肝脏指数(
$ \bar{{x}}\pm {s} $ )组别 动物数(n) 体重(m/g) 肝重(m/g) 肝指数(%) 对照组 8 397.28±31.15 10.46±1.15 2.63±0.14 模型组 8 202.19±15.56## 6.91±1.10## 3.41±0.42## 七味脂肝方低剂量组 8 202.75±14.72 7.31±1.08 3.59±0.34 七味脂肝方中剂量组 8 202.98±17.39 7.90±1.54 3.88±0.57 七味脂肝方高剂量组 8 201.83±16.04 7.82±0.90 3.88±0.43* 阳性对照VE组 8 201.83±11.16 7.22±0.57 3.59±0.34 *P<0.05,与模型组比较; ##P<0.01,与对照组比较。 -
对照组肝脏表面光滑,色深红,质地软,有弹性,肝叶边缘锐利;与对照组相比,模型组肝脏体积增大,颜色变浅;与模型组相比,七味脂肝方各剂量组和阳性对照RSG组可以观察到肝脏颜色稍红,各组均可一定程度改善肝脏形态,结果见图2。
与对照组相比,模型组肝脏重量、肝脏指数显著升高(P<0.01);与模型组相比,七味脂肝方的各剂量组和阳性对照RSG组均能显著降低肝脏重量(P<0.05或P<0.01),七味脂肝方的中、高剂量组和阳性对照RSG组能显著降低肝脏指数(P<0.01),结果见表4。
表 4 小鼠体重、肝脏重量及肝脏指数(
$ \bar{x}\pm {s} $ )组别 动物数(n) 体重(m/g) 肝重(m/g) 肝指数(%) 对照组 16 22.12±2.00 0.91±0.16 4.11±0.47 模型组 16 18.91±1.36## 1.69±0.15## 8.96±0.62## 七味脂肝方低剂量组 16 18.59±1.01 1.56±0.20* 8.41±1.06 七味脂肝方中剂量组 16 18.48±1.08 1.51±0.18** 8.17±0.72** 七味脂肝方高剂量组 16 18.32±1.03 1.54±0.13** 8.38±0.53** 阳性对照RSG组 16 19.14±1.34 1.56±0.18* 8.16±0.68** *P<0.05,**P<0.01,与模型组比较; ##P<0.01,与对照组比较。 -
与对照组相比,模型组血清ALT水平显著升高(P<0.01);与模型组相比,七味脂肝方中剂量组血清ALT水平显著降低(P<0.05),七味脂肝方中、高剂量组可改善血清ALP、LDH、HDL水平,结果见表5、表6。
表 5 大鼠血清肝功能数据(
$ \bar{x}\pm {s}$ )组别 动物数(n) ALT(U/L) AST(U/L) ALP(U/L) LDH(U/L) 对照组 8 45.50±3.38 165.38±24.80 88.50±15.73 1547.50 ±243.04模型组 8 107.25±32.84## 187.50±24.36 93.75±32.65 1250.00 ±235.02#七味脂肝方低剂量组 8 107.00±37.80 195.88±25.90 87.25±24.54 1263.00 ±451.90七味脂肝方中剂量组 8 69.38±16.33* 171.25±19.91 63.13±18.76* 886.88±304.48* 七味脂肝方高剂量组 8 114.13±51.86 177.88±44.05 89.75±34.65 855.88±375.75* 阳性对照VE组 8 111.00±15.76 165.75±16.61 128.50±58.52 1219.63 ±368.75*P<0.05,与模型组比较;#P<0.05,##P<0.01,与对照组比较。 表 6 大鼠血脂4项数据(
$ \bar{x}\pm {s} $ )组别 动物数(n) TG(mmol/L) TC(mmol/L) HDL(mmol/L) LDL(mmol/L) 对照组 8 0.32±0.10 1.12±0.22 0.28±0.03 0.15±0.02 模型组 8 0.23±0.05# 0.83±0.18# 0.32±0.06 0.14±0.04 七味脂肝方低剂量组 8 0.29±0.07 0.93±0.12 0.38±0.07 0.15±0.03 七味脂肝方中剂量组 8 0.32±0.19 1.25±0.51* 0.49±0.19* 0.21±0.08 七味脂肝方高剂量组 8 0.23±0.06 1.20±0.26** 0.48±0.10** 0.21±0.08 阳性对照VE组 8 0.23±0.05 0.84±0.23 0.33±0.12 0.15±0.04 *P<0.05,**P<0.01,与模型组比较;#P<0.05,与对照组比较。 -
与对照组相比,模型组血清ALT、AST、ALP、LDH、TG、TC、LDL水平显著升高(P<0.01),HDL水平显著降低(P<0.01);与模型组相比,七味脂肝方低剂量组血清ALP、TG水平显著降低(P<0.05或P<0.01),七味脂肝方中剂量组血清LDH、TG水平显著降低(P<0.05),七味脂肝方高剂量组血清ALT、AST、ALP、LDH、TG水平显著降低(P<0.05或P<0.01),阳性对照RSG组血清ALT水平显著降低(P<0.05),结果见表7和表8。
表 7 小鼠血清肝功能数据(
$\bar{x}\pm {s}$ )组别 动物数(n) ALT(U/L) AST(U/L) ALP(U/L) LDH(U/L) 对照组 16 35.13±6.08 146.06±43.63 88.31±9.41 653.94±145.10 模型组 16 606.06±111.12## 486.31±69.39## 216.19±28.30## 1390.25 ±128.14##七味脂肝方低剂量组 16 561.44±98.43 440.69±67.29 179.06±46.80* 1347.19 ±150.78七味脂肝方中剂量组 16 553.00±116.35 442.94±72.95 198.06±32.64 1261.69 ±122.55*七味脂肝方高剂量组 16 486.63±88.90** 406.25±75.39** 189.94±34.09* 1161.00 ±134.22**阳性对照RSG组 16 513.56±91.17* 441.81±70.00 273.94±43.98** 1328.75 ±160.91*P<0.05,**P<0.01,与模型组比较;##P<0.01,与对照组比较。 表 8 小鼠血脂4项数据(
$\bar{x}\pm {s}$ )组别 动物数(n) TG(mmol/L) TC(mmol/L) HDL(mmol/L) LDL(mmol/L) 对照组 16 0.82±0.39 2.70±0.42 1.64±0.35 0.18±0.03 模型组 16 1.27±0.26## 3.45±0.55## 0.93±0.29## 0.57±0.17## 七味脂肝方低剂量组 16 1.01±0.25** 3.29±0.61 0.91±0.19 0.55±0.18 七味脂肝方中剂量组 16 1.01±0.31* 3.46±0.52 0.99±0.26 0.59±0.13 七味脂肝方高剂量组 16 1.01±0.29* 3.37±0.34 0.99±0.13 0.57±0.10 阳性对照RSG组 16 1.10±0.28 3.33±0.79 0.94±0.32 0.56±0.15 *P<0.05,**P<0.01,与模型组比较; ##P<0.01,与对照组比较。 与对照组相比,模型组血清TBIL、FFA水平显著升高(P<0.01);与模型组相比,七味脂肝方高剂量组和阳性对照RSG组血清TBIL水平显著降低(P<0.05)。结果见表9。
表 9 小鼠血清TBIL、FFA数据(
$\bar{x}\pm {s}$ )组别 动物数(n) TBIL(μmol/L) FFA(mmol/L) 对照组 16 3.59±0.55 1.41±0.31 模型组 16 7.77±1.52## 2.16±0.46## 七味脂肝方低剂量组 16 6.95±1.78 2.01±0.43 七味脂肝方中剂量组 16 7.79±3.97 1.98±0.49 七味脂肝方高剂量组 16 6.37±1.72* 2.16±0.49 阳性对照RSG组 16 9.09±1.69* 2.20±0.55 *P<0.05,与模型组比较; ##P<0.01,与对照组比较。 -
与对照组相比,模型组肝脏TG水平显著升高(P<0.01),HDL水平显著降低(P<0.01);与模型组相比,阳性对照VE组肝脏HDL水平显著升高(P<0.01),结果见表10。
表 10 大鼠肝脏脂质水平(
$\bar{x}\pm {s}$ )组别 动物数(n) TG(mmol/g) TC(mmol/g) HDL(mmol/g) LDL(mmol/g) 对照组 8 3.93±0.56 1.49±0.16 0.11±0.03 0.67±0.08 模型组 8 5.97±0.53## 1.14±0.13## 0.03±0.02## 0.25±0.13## 七味脂肝方低剂量组 8 5.73±0.82 1.03±0.12 0.02±0.02 0.27±0.10 七味脂肝方中剂量组 8 5.57±0.93 1.14±0.12 0.03±0.03 0.31±0.07 七味脂肝方高剂量组 8 5.93±0.81 1.10±0.14 0.02±0.01 0.27±0.08 阳性对照VE组 8 7.25±1.40* 1.21±0.15 0.08±0.02** 0.34±0.09 *P<0.05,**P<0.01,与模型组比较; ##P<0.01,与对照组比较。 -
与对照组相比,模型组肝脏TG、TC水平显著升高(P<0.01);与模型组相比,七味脂肝方高剂量组肝脏TG水平显著降低(P<0.01),结果见表11。
表 11 小鼠肝脏脂质水平(
$\bar{x}\pm {s}$ )组别 动物数(n) TG(mmol/g) TC(mmol/g) HDL(mmol/g) LDL(mmol/g) 对照组 16 3.54±1.98 1.04±0.15 0.20±0.07 0.35±0.11 模型组 16 8.78±0.89## 2.29±0.21## 0.47±0.13## 0.42±0.21 七味脂肝方低剂量组 16 8.54±1.04 2.20±0.20 0.47±0.08 0.36±0.16 七味脂肝方中剂量组 16 8.69±1.54 2.28±0.31 0.49±0.09 0.43±0.17 七味脂肝方高剂量组 16 7.85±0.79** 2.12±0.39 0.45±0.14 0.39±0.24 阳性对照RSG组 16 8.44±0.97 2.12±0.26 0.47±0.09 0.36±0.16 **P<0.01,与模型组比较; ##P<0.01,与对照组比较。 -
对照组大鼠肝小叶结构完整,肝细胞排列整齐,肝板以中央静脉为中心呈放射状排列,未见明显病理性改变。
模型组镜下可见广泛的肝细胞空泡变性,中央静脉及汇管区周围可见肝细胞坏死,小叶间炎症细胞浸润,肝小叶结构被破坏。与对照组相比,模型组脂肪变性、小叶内炎症及NAS评分显著升高(P<0.01)。
与模型组相比,七味脂肝方的各给药组和阳性对照VE组可明显减轻小叶内炎症程度。与模型组相比,七味脂肝方低、中、高剂量组和阳性对照VE组小叶内炎症评分显著降低(P<0.05或P<0.01),七味脂肝方的中剂量组和阳性对照VE组NAS评分显著降低,结果见表12。
表 12 大鼠肝脏NAS评分(
$\bar{x}\pm {s}$ )组别 动物数(n) 脂肪变性 小叶内炎症 气球样变 NAS 对照组 8 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 模型组 8 2.88±0.35## 1.63±0.52## 0.00±0.00 4.50±0.76## 七味脂肝方低剂量组 8 3.00±0.00 1.00±0.00* 0.38±0.52 4.38±0.52 七味脂肝方中剂量组 8 3.00±0.00 0.88±0.35* 0.00±0.00 3.88±0.35* 七味脂肝方高剂量组 7 3.00±0.00 0.86±0.38* 0.00±0.00 3.86±0.38 阳性对照VE组 8 3.00±0.00 0.63±0.52** 0.00±0.00 3.63±0.52* *P<0.05,**P<0.01,与模型组比较; ##P<0.01,与对照组比较。 -
对照组肝小叶结构完整,肝细胞排列整齐,肝板以中央静脉为中心呈放射状排列,未见明显病理性改变。
模型组镜下可见广泛的肝细胞空泡变性,中央静脉及汇管区周围可见肝细胞点状或灶状坏死,小叶间炎性细胞浸润,肝小叶结构被破坏,较多个肝细胞呈气球样变。与对照组相比,模型组脂肪变性、小叶内炎症、气球样变及NAS评分显著升高。
与模型组相比,七味脂肝方中、高剂量组可有效减轻炎性灶数量和肝细胞气球样变,显著降低小叶内炎症程度评分、气球样变评分及NAS评分(P<0.01),阳性对照RSG组可减轻小叶内炎症程度,显著降低小叶内炎症程度评分及NAS评分(P<0.01),结果见表13。
表 13 小鼠肝脏NAS评分(
$\bar{x}\pm {s}$ )组别 动物数(n) 脂肪变性 小叶内炎症 气球样变 NAS 对照组 16 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 模型组 16 3.00±0.00## 2.81±0.40## 1.88±0.34## 7.69±0.48## 七味脂肝方低剂量组 16 3.00±0.00 2.56±0.51 1.69±0.48 7.25±0.86 七味脂肝方中剂量组 16 3.00±0.00 2.13±0.34** 1.38±0.50** 6.50±0.73** 七味脂肝方高剂量组 16 3.00±0.00 1.88±0.34** 1.31±0.48** 6.19±0.66** 阳性对照VE组 16 3.00±0.00 2.19±0.40** 1.56±0.51 6.75±0.68** **P<0.01,与模型组比较; ##P<0.01,与对照组比较。 -
CDAHFHC诱导的小鼠NASH模型Masson染色结果显示,对照组肝小叶结构完整,肝细胞排列整齐,汇管区结构清晰,被染成蓝色的纤维结缔组织分布在肝小叶间血管和胆管周围,汇管区周围的纤维结缔组织呈围管状包绕血管及胆管分支。
模型组可见肝细胞点状或灶状坏死,炎症细胞浸润,镜下多个视野可见小叶内和汇管区周围被染成蓝色的胶原纤维增生。与对照组相比,模型组纤维化评分显著升高(P<0.01)。
与模型组相比,七味脂肝方的中、高剂量组可观察到肝小叶内和汇管区周围胶原纤维增生情况明显减轻,并呈现一定程度的剂量梯度效应;阳性对照RSG组在肝小叶和汇管区周围的胶原纤维增生情况也可得到一定程度的改善。与模型组相比,七味脂肝方的高剂量组纤维化评分显著降低(P<0.05),结果见表14。
表 14 小鼠肝脏纤维化分期评分(
$\bar{x}\pm {s}$ )组别 动物数(n) 纤维化分期评分 对照组 16 0.00±0.00 模型组 16 1.56±0.51## 七味脂肝方低剂量组 16 1.75±0.45 七味脂肝方中剂量组 16 1.44±0.51 七味脂肝方高剂量组 16 1.19±0.40* 阳性对照RSG组 16 1.25±0.45 *P<0.05,与模型组比较; ##P<0.01,与对照组比较。 -
MCD诱导的大鼠和CDAHFHC诱导的小鼠NASH模型F4/80免疫组织化学染色结果显示,对照组大鼠肝脏Kupffer细胞处于静息状态,为不规则或树枝状分布。
模型组可观察到在肝小叶炎性灶及汇管区周围大量的被激活的Kupffer细胞,呈现花冠状分布,被F4/80标记的阳性细胞数明显增加。
与模型组相比,七味脂肝方的中、高剂量组显示被F4/80标记的阳性细胞数密度降低,Kupffer细胞活化程度明显减弱,花冠状分布程度明显减轻,呈一定程度的浓度依赖;阳性对照VE组和RSG组同样可减轻Kupffer细胞活化程度,与文献报道一致,结果见图3、图4。
-
NASH是在非酒精性肝脂肪变基础上形成的,出现血清生化酶学超过正常值上限,肝穿刺病理组织学显示肝细胞脂肪变>5%,伴有炎症及肝细胞损伤(如气球样变),并除外导致肝脂肪变的其他原因,如大量饮酒、长期应用促脂肪形成药物或单基因遗传紊乱等的疾病[1]。近年来,关于NASH发病机制的研究已取得很大进展,但目前治疗选择非常有限[5-6],FDA、SFDA尚未批准针对该疾病的有效药物。权威指南中推荐使用的药物有维生素E、吡格列酮等,但这些药物的有效性和安全性存在争议[7-8]。目前,防治NASH的主要方法以生活方式干预为主,其他方法包括降糖、降脂和保肝的间接对症治疗,降低导致NASH的高危因素的相关疾病,使患者间接获益。
中医药因具有多因子、多靶点和多环节的协同药理效应,在治疗该类疾病具有独特的优势,在治NASH方面取得了一定进展[9-11]。非酒精性脂肪性肝炎并无确切中医学病名[12],根据其临床表现可归属于“肝癖”、“胁痛”、“黄疸”等范畴。病位主要涉及肝脾,病久及肾。由于过食肥甘厚味,运化失职,使谷精不能尽化气血而凝为膏脂,导致肝失疏泄、脾失健运,痰浊淤积于肝;脾胃为气机升降之枢,湿浊困脾,脾气不升,一身气机运化失常,加剧肝气郁结和肝络失养。
七味脂肝方中酒豨莶草、垂盆草清热解毒、利湿退黄,二药合为君药;煅牡蛎软坚散结,《珍珠囊》谓其可“软痞积”,《本草纲目》谓“化痰软坚,清热除湿”,山楂消食积,散淤血,《本草纲目》认为其可“化饮食,消肉积,癥瘕,痰饮痞满吞酸,滞血痛胀”,海藻消痰软坚散结,利水消肿,三药共为臣药;虎杖协同加强解毒、化瘀、退黄之功效,为佐药;醋五味子收敛固涩、益气生津、补肾宁心,可补五脏气,为使药。全方七味药物相辅相成,达到湿、痰、瘀、毒兼顾,利湿解毒,消痰散结,用于NASH湿热痰瘀互结证。现代药理学表明,方中垂盆草中的槲皮素[13]、虎杖中的虎杖苷等成分均对NASH有一定治疗作用[14-15]。
NASH是一种更严重的NAFLD病理类型,NASH的特征是存在肝细胞损伤、肝脂肪变性、炎症和纤维化,进而发生肝硬化并增加肝细胞癌的风险[16]。在NASH发展过程中,肝脏内脂肪合成量不断上升,代谢功能逐渐下降,肝脏对脂质的摄取和代谢能力随之减弱,导致脂质代谢过程中TC、TG和LDL-c含量升高,同时受损的肝细胞还会释放AST、ALT活力到血液中,导致AST、ALT活力升高,这些指标的异常变化可作为NASH的标志[17]。肝内过量的脂质沉积可导致炎症反应,促使单纯性脂肪肝向NASH的病理进展[18]。肝纤维化是肝细胞外基质的弥漫性过度沉积与异常分布,是肝脏对慢性损伤的病理性修复反应。目前,肝组织病理学检查仍是肝纤维化诊断的“金标准”。目前的科学研究普遍认为,Kupffer细胞对NAFLD的发生和发展至关重要,如果它们被适度激活,可以发挥防御作用,但如果它们被过度激活,将释放大量的促炎细胞因子,这对肝组织和其他细胞会造成一定程度的损伤。已有文献表明,活化的肝脏巨噬细胞可以促进NASH的进展[19]。
本研究在MCD诱导的大鼠和CDAHFD诱导的小鼠两个经典NASH模型的实验结果显示,经过2周的诱导后,模型组的肝脏质量以及ALT、AST、ALP、LDH、TG、TC、LDL、TBIL及FFA水平显著高于对照组,HE、Masson及免疫组化染色显示,肝脏组织炎症和肝细胞脂肪变性严重,NAS评分显著增加,肝小叶内和汇管区周围胶原纤维增生及Kupffer细胞活化程度加重,说明建立NASH模型成功。经4周的给药后,七味脂肝方能显著降低上述指标,此外,HE、Masson及免疫组化染色显示,七味脂肝方能显著减轻肝脏组织炎症程度,降低肝脏组织病理NAS评分,减轻肝纤维化及Kupffer细胞活化程度。说明七味脂肝方能有效降低血脂、调节肝脏脂质代谢紊乱,改善NASH小鼠肝脏炎症损伤向肝纤维化发展的趋势,改善肝脏组织病理损伤,从而有效减缓并改善NASH的进展程度。
NASH的发病机制尚未完全阐明,目前公认的是“多重打击”理论,其认为胰岛素抵抗、脂肪毒性、炎症、氧化应激等多种致病因素共同导致了NASH的发生发展,而炎症在NASH的恶化过程中扮演着至关重要的角色[18]。肝脏具有密集的吞噬细胞网络,在非炎症条件下维持耐受性,并快速感知肝细胞损伤和氧化应激信号,导致促炎级联反应的激活。在损伤后,白细胞迅速渗入肝实质,通过产生可溶性介质激活其他免疫细胞和非实质细胞群,从而促进炎症和纤维化的发生。炎症介质可以激活肝星状细胞(HSCs),HSCs是肝纤维化形成过程中的主要效应细胞,导致细胞外基质过度沉积,形成创伤愈合或瘢痕反应,进一步促进纤维化发展。活化的HSCs产生促炎介质,进而使肝脏炎症持续存在,导致炎症的慢性循环和瘢痕组织的形成,最终导致器官衰竭[20]。因此,抑制炎症对于NASH的预防和治疗具有重要意义,深入理解NASH相关的炎症信号通路(NF-κB和MAPK等),并找到能够有效靶向特定炎症的靶点,将为治疗NASH提供更多的思路和新的策略。已有多次报道NF-κB信号通路参与NASH中炎症反应,损伤相关分子模式(DAMPs)激活Kupffer细胞,诱导细胞内的NF-κB信号激活[21]。本研究病理染色结果证明,七味脂肝方可减少炎性浸润,减轻肝纤维化程度,改善NASH动物肝脏的病理表现,后续将继续探究七味脂肝方药效物质基础作用的炎症通路,进一步阐明其治疗NASH的机制。
本研究结果初步提示,七味脂肝方可能是通过改善NASH肝脏炎症损伤,继而阻碍其向肝纤维化发展的趋势来发挥药效,为其后续机制探究提供研究方向。针对目前的NASH临床需求,七味脂肝方具有较好的临床价值。
Pharmacodynamic effects of Qiwei Zhigan prescription on non-alcoholic steatohepatitis in animal model
-
摘要:
目的 探讨七味脂肝方对两种经典的非酒精性脂肪性肝炎(NASH)动物模型的药效作用。 方法 采用蛋氨酸-胆碱缺乏(MCD)饲料饮食诱导大鼠模型和胆碱缺乏的高脂饮食(CDAHFHC)诱导小鼠非酒精性脂肪性肝炎模型,将48只大鼠和96只小鼠均随机分为6组:对照组、模型组、七味脂肝方组(低、中、高剂量组)、阳性药组,造模2周后,连续干预28 d。通过检测各组动物血清肝功能、血脂生化指标以及肝组织脂质水平,并进行肝脏组织病理学评价,以评估七味脂肝方治疗非酒精性脂肪性肝炎的药效作用。 结果 七味脂肝方以临床等效剂量及以上剂量在两种试验动物模型灌胃给药后,能改善肝脏大体解剖形态,降低NASH小鼠肝脏重量及肝脏指数;降低NASH大鼠血清ALT、ALP、LDH,升高HDL水平;降低NASH小鼠血清ALT、AST、TBIL、ALP、LDH及TG水平,并降低肝脏TG含量。其还可改善肝脏组织病理损伤,减轻肝脏组织炎症程度,减轻肝细胞气球样变程度,降低肝脏NAS评分,且各剂量组间呈一定量效关系趋势;有效减轻NASH小鼠肝小叶内和汇管区周围胶原纤维增生情况;降低被F4/80标记的阳性细胞数密度,减轻Kupffer细胞活化程度。 结论 七味脂肝方可有效改善两种经典NASH模型的进展程度,改善NASH肝脏炎症损伤向肝纤维化发展的趋势。 Abstract:Objective To investigate the therapeutic effect of Qiwei Zhigan prescription on two classic animal models of non-alcoholic steatohepatitis(NASH). Methods Methionine-choline-deficient(MCD)rat model and choline-deficient, L-amino acid-defined, high-fat and high cholesterol diet(CDAHFHC)mouse model were used. 48 rats and 96 mice were randomly divided into 6 groups: control group, model group, Qiwei Zhigan prescription group(low, medium and high dose group), positive drug group. After 2 weeks of modeling, the drugs were administrated continuously for 28 days. The efficacy of Qiwei Zhigan prescription in the treatment of non-alcoholic steatohepatitis was evaluated by detecting the serum liver function, blood lipid biochemical index and liver tissue lipid levels of each group of animals, as well as by evaluating the liver histopathological changes. Results The gross anatomical morphology of the liver was improved by Qiwei Zhigan after oral administration of clinical equivalent dose or higher doses in two experimental animal models. The liver weight and liver index of NASH mice were reduced by the prescription. The levels of ALT, ALP and LDH in serum of NASH rats were decreased, and the level of HDL was increased. The levels of ALT, AST, TBIL, ALP, LDH and TG in serum of NASH mice were decreased, and the content of TG in liver was also decreased. The pathological damage of liver tissue was ameliorated, the inflammation of liver tissue was reduced, as well as the degree of ballooning of liver cells and the NAS score of the liver, and there was a certain dose-effect relationship between the groups; the proliferation of collagen fibers in the hepatic lobules and around the portal area of NASH mice was significantly reduced; the density of positive cells labeled by F4/80 was decreased, and the activation of Kupffer cells was alleviated. Conclusion Qiwei Zhigan prescription could effectively ameliorate the progression of two classic NASH models, and decrease the development trend from liver inflammation to liver fibrosis in NASH. -
社区获得性肺炎(CAP)是指在院外由于多种微生物引起的肺实质的急性感染,临床表现以发热、咳嗽、咯痰、气短、胸闷或胸痛等症状为主[1-2]。2019年全球疾病负担研究(GBD)的数据显示,包括肺炎和细支气管炎在内的下呼吸道感染影响了全球4.89亿人[3]。全球估计每年约有320万人死于CAP,超过了包括结核病、艾滋病毒感染和疟疾在内的所有其他感染,使其成为全球传染病死亡的主要原因,其中小于5岁的儿童及大于70岁的成年人是受影响最大的人群[4]。
近年来,有大量的临床研究、实验观察以及医学报道表明,中西医联合治疗CAP取得了较好的疗效。在使用抗菌药物的基础上,加用中药能够缩短病程,尽量减少细菌耐药性的发生。同时中药在治疗过程中有着多靶点、多环节的作用机制。金芪清疏颗粒(备案号:沪药制备字Z20200011001)是上海中医药大学附属岳阳中西医结合医院呼吸科专家在长期临床治疗肺脾气虚证呼吸道疾病基础上所得出的经验效方,以玉屏风散和四君子汤经典名方为基础加减化裁而成。它由金银花、黄芪、黄芩、柴胡、太子参、茯苓、白术、佩兰、防风和甘草10味药组成,具有益气清疏,健脾补肺固表,培土生金之效。现代药理学研究表明[5-15],方中所用诸药具有广泛抗炎、调节氧化应激、解热、抗菌、调节免疫等多种功效。但由于中药成分治疗靶点的复杂性,目前有关金芪清疏颗粒治疗CAP的具体机制尚不明确。本研究基于网络药理学、分子对接等方法探究其潜在作用机制,拟为后续实验研究提供理论基础。
1. 材料和方法
1.1 金芪清疏颗粒活性成分的筛选及作用靶点的获取
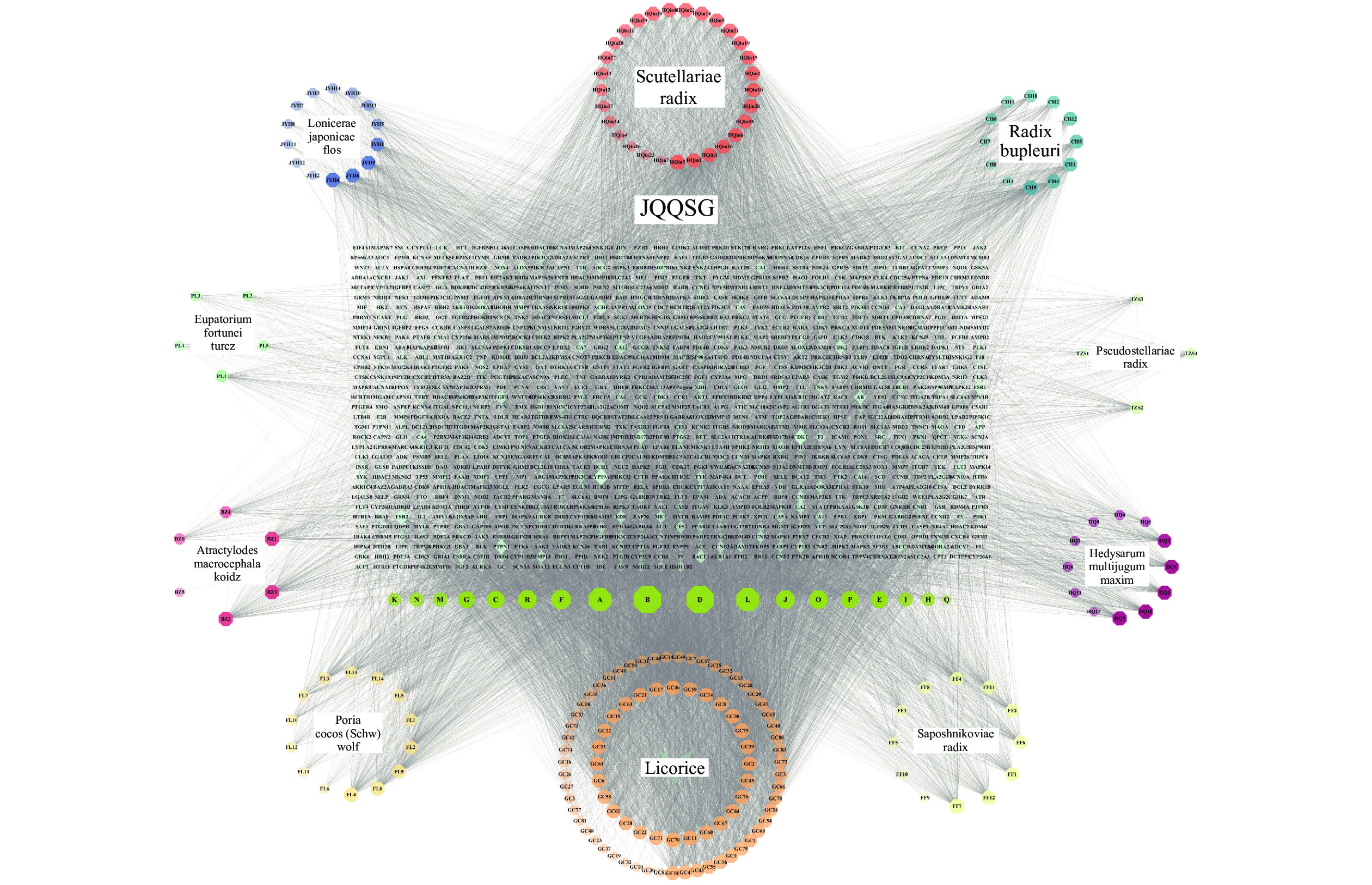
本研究利用TCMSP数据库[16],以金银花、黄芪、黄芩、柴胡、太子参、茯苓、白术、佩兰、防风、甘草为关键词检索药物成分,设置口服生物利用度(OB)≥30%、类药性(DL)≥0.18,其他参数为默认值,进行药物成分筛选,通过查阅文献对不满足筛选要求,但含量高或者相关药物活性强的予以手动筛选添加。最终获取金芪清疏颗粒的活性成分,并通过PubChem数据库[17]获取活性成分SMILE号。若PubChem数据库未能检索出的活性成分,则通过TCMSP平台下载相关的活性成分的mol2文件,在novopro平台上将mol2文件转换为SMILE号。将所有活性成分的SMILE号导入SwissTargetPrediction数据库中获取各个化学成分的预测作用靶点,其中物种参数设置为Homo sapiens,置信度阈值(Probability>0)。利用Cytoscape3.10.0软件[18]构建金芪清疏颗粒活性成分与作用靶点网络,预测金芪清疏颗粒核心成分。
1.2 社区获得性肺炎相关靶点获取
以“Community acquired pneumonia”为检索词,分别在OMIM、TTD[19]、DisGeNET和GeneCards 4个数据库中检索CAP作用靶点,种属选择“Homo sapiens”,重复靶点仅保留1个。
1.3 网络构建及分析
通过JVEEN(www.bioinformatics.com.cn) [20]将金芪清疏颗粒活性成分的预测靶点与CAP相关靶点进行映射,获得金芪清疏颗粒作用于CAP的潜在靶点。利用String平台构建金芪清疏颗粒作用于CAP的靶点蛋白相互作用(PPI)网络。再利用Cytoscape3.10.0软件的“Centiscape2.2”插件对PPI网络进行拓扑分析,以度数(Degree)、中介性(Betweenness)、接近中心性(Closeness)筛选出该网络的关键靶点,按Degree值进行排序,得出TOP9靶点为核心靶点,并通过Cytoscape3.10.0进行可视化分析。
1.4 GO功能注释及KEGG通路富集分析
将“1.3”项中得到的金芪清疏颗粒-CAP的关键靶点的编码基因导入DAVID 数据库,DAVID 数据库的基因列表中,选择 “OFFICIAL GENE SYM-BOL”, 选定物种为“Homo sapiens”,进行GO功能及KEGG通路富集分析,利用JVEEN制作富集气泡图,进行数据可视化。
1.5 分子对接
从 TCMSP数据库查询“1.1”项中关键成分结构,并保存为 mol2 格式。从 PDB 数据库下载“1.3”项核心靶点的 3D 结构,保存为 PDB 格式,使用 PyMol软件删除蛋白结构的水分子和小分子配体,并导入 AutoDockTools 进行加氢等预处理。将活性成分和靶点蛋白均转换成 pdbqt 格式文件。最后运行 AutoDockTools 对活性成分和靶点蛋白分别进行对接,保存最低结合能数据作为分子对接的结果。
2. 结果
2.1 金芪清疏颗粒活性成分及靶点的筛选
根据筛选得到金银花23个、黄芪21个、黄芩36个、柴胡17个、太子参8个、茯苓15个、白术7个、佩兰11个、防风18个和甘草92个活性成分,删去重复值及没有作用靶点的成分,共得到金芪清疏颗粒活性成分209个,通过Swiss Target Predic-tion数据库预测相应作用靶点,删去重复值共得到
1041 个作用靶点。通过Cytoscape3.10.0软件将活性成分-靶点进行可视化,得到“活性成分-靶点”相互作用网络。该网络共有1291 个节点和16408 条边,见图1。通过软件分析得出Degree值,Degree值越高,作用关系越密切,重要性越大,按Degree值排序,得出top 9的成分为:Quercetin、Kaempferol、Luteolin、Isorhamnetin、Mandenol、Jaranol、Wogonin、Acacetin和Sitosterol,见表1。表 1 金芪清疏颗粒TOP9活性成分表化合物 分子结构 度值 中介中心性 接近中心性 口服生物利用度(%) 类药性 中药名称
成分代号(ID)Quercetin(槲皮素) 
420 0.00350184 0.37422037 46.43 0.28 金银花、黄芪、
太子参、甘草B Kaempferol(山柰酚) 
420 0.00343999 0.37422037 41.88 0.24 金银花、黄芪、
柴胡、甘草D Luteolin(木犀草素) 
315 0.00386583 0.37377633 31.16 0.25 金银花、太子参、佩兰 A Isorhamnetin
(异鼠李素)
315 0.0031137 0.37377633 49.60 0.31 黄芪、柴胡、
甘草L Mandenol
(亚麻油酸乙酯)
230 0.02557745 0.37223043 42.00 0.19 金银花、防风 F Jaranol(华良姜素) 
210 0.00361453 0.3735547 50.83 0.29 黄芪、甘草 J Wogonin(汉黄芩素) 
210 0.00350745 0.37399822 30.68 0.23 黄芩、防风 O Acacetin(金合欢素) 
210 0.00355992 0.37311223 34.97 0.24 黄芩、太子参 R Sitosterol(谷甾醇) 
180 0.00218402 0.35502959 36.91 0.75 黄芩、防风、
佩兰、甘草P 2.2 CAP疾病相关靶点获取结果
以“Community acquired pneumonia”为检索词分别从OMIM、DisGeNET、GeneCards(评分>3.6)、TTD 4个数据库得到645、73、
1566和 3个疾病靶点,删去重复值后共得到2149 个CAP相关靶点。2.3 网络构建及分析结果
将
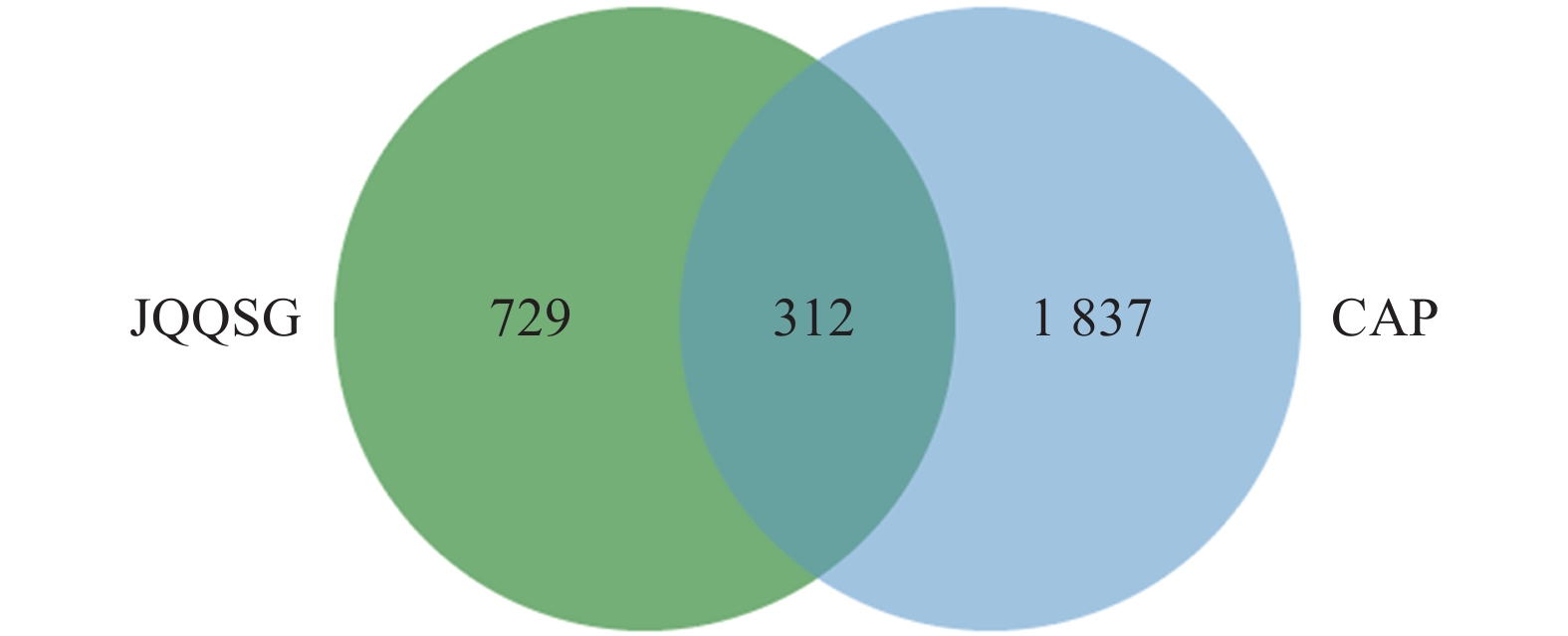
1041 个金芪清疏颗粒活性成分作用靶点与2149 个CAP相关靶点进行映射,得到312个共同靶点,绘制VEEN图,见图2。这些靶点被认为是金芪清疏颗粒治疗CAP的潜在靶点。2.4 PPI网络图
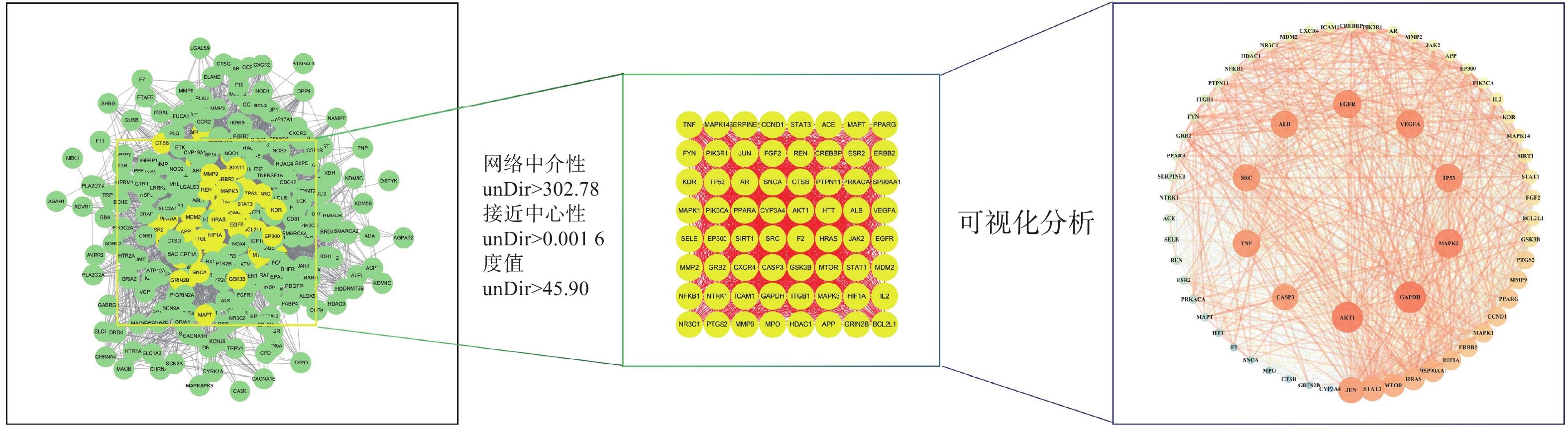
将312个作用靶点导入STRING,构建PPI网络。利用Centiscape2.2插件分析,得到该网络中介性unDir:302.778,接近中心性unDir:0.002,度值unDir:45.910,取大于这三个条件筛选出该网络关键靶点64个,利用Cytoscape3.10.0进行可视化分析(图3),结果得到TOP10靶点为:GAPDH、AKT1、MAPK3、TP53、EGFR、VEGFA、ALB、TNF、SRC和JUN,见表2。
表 2 PPI 网络TOP10 靶点表名称 度值 中介中心性 接近中心性 GAPDH 61 0.0185 0.9692 AKT1 61 0.0195 0.9692 MAPK3 59 0.0167 0.9402 TP53 58 0.0146 0.9265 EGFR 58 0.0149 0.9265 VEGFA 58 0.0145 0.9265 ALB 57 0.0168 0.9130 TNF 57 0.0133 0.9130 SRC 57 0.0127 0.9130 JUN 56 0.0101 0.9000 2.5 GO富集分析及KEGG通路分析
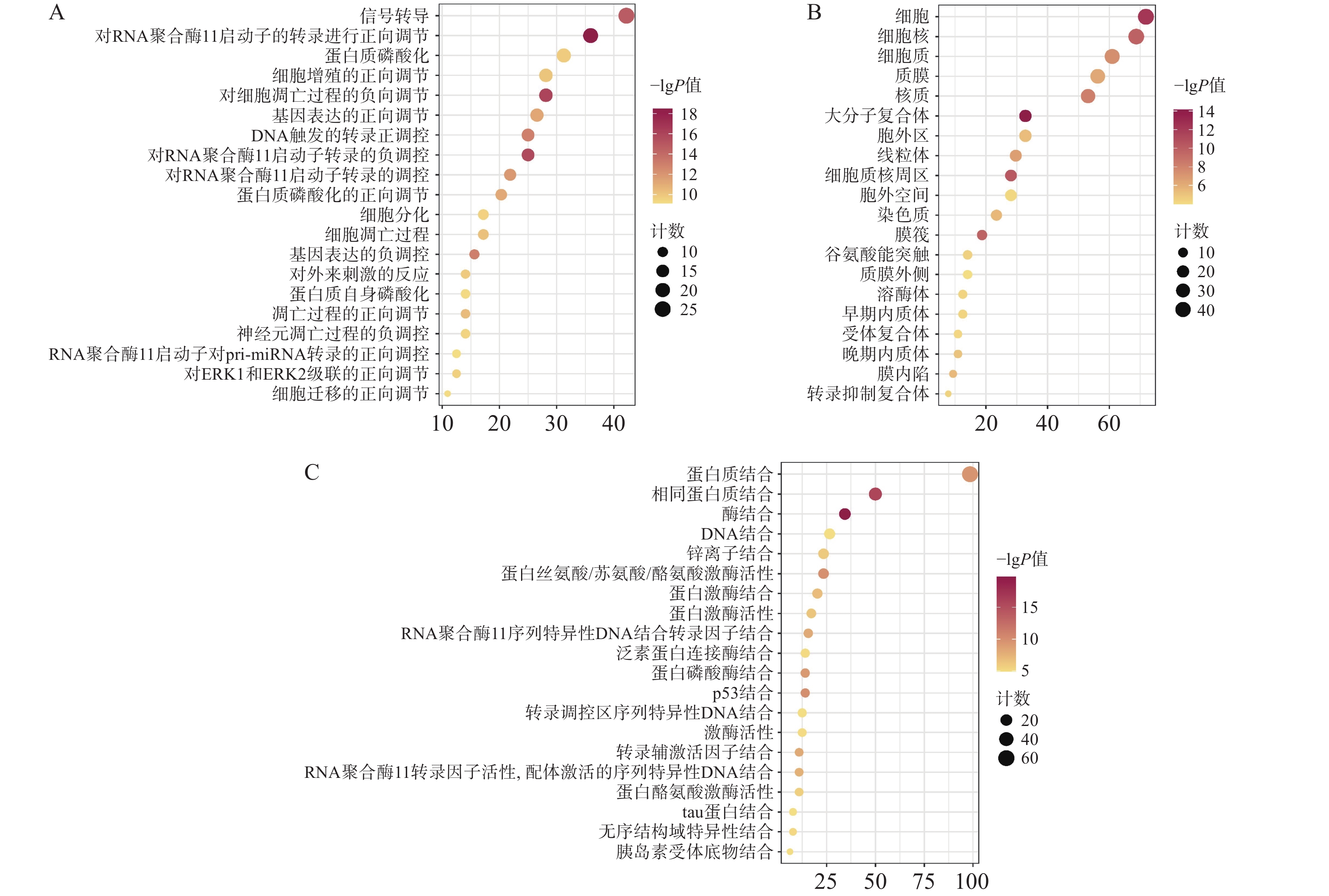
通过David数据库对64个核心靶点进行GO富集分析及KEGG分析。用Bioinformatics[21]制作富集气泡图。结果显示,共有571个生物过程、68个细胞组分、199个分子功能显示富集。据P<0.01进行筛选后排序,选择前20的结果。GO富集分析主要涉及在正向调节RNA聚合酶Ⅱ启动子转录,凋亡过程的负调控、信号转导、蛋白磷酸化等生物过程,见图4A;细胞质、细胞核、大分子复合物等细胞组分,见图4B;蛋白质结合、酶结合、蛋白质丝氨酸/苏氨酸/酪氨酸激酶活性,转录因子结合等分子功能,见图4C。
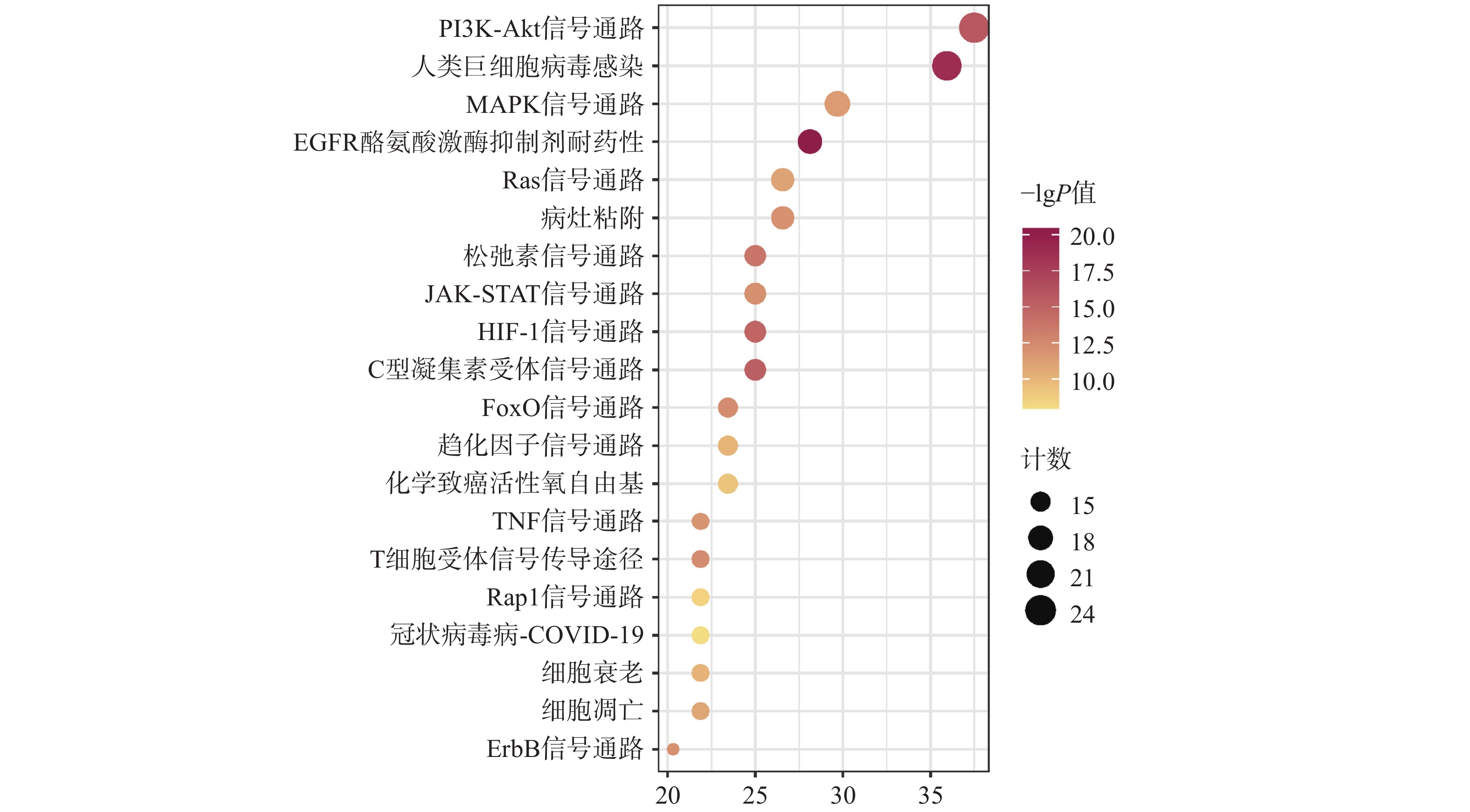
KEGG共富集到165条信号通路,选择与CAP密切相关的前20条,见图5。主要是PI3K/Akt信号通路、MAPK信号通路、趋化因子信号通路、TNF信号通路及细胞凋亡信号通路等。
2.6 分子对接
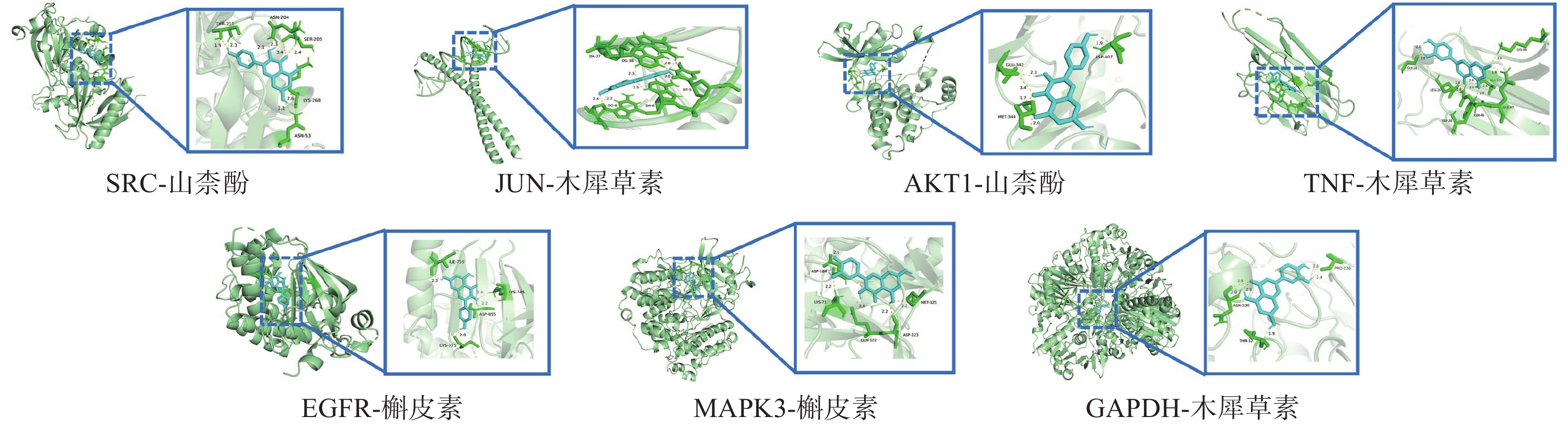
将“2.4”项中筛选得到部分核心靶点(GAPDH、AKT1、MAPK3、EGFR、TNF、SRC、JUN)与“2.1”项中筛选得到的部分核心成分(Quercetin, Kaempferol, Luteolin)进行分子对接。一般认为结合能<0 kJ/mol表明配体分子可以与受体分子自发结合,结合能<−20.92 kJ/mol则表示具有较好的结合能力,分子对接显示所有核心活性成分与关键靶点对接的结合能均<−20.92 kJ/mol,见表3。可视化分析结果见图6。
表 3 部分核心成分与核心靶点分子对接结果受体蛋白 PDB入口 配位基 亲和力(kJ/mol) GAPDH 8P5F 槲皮素 −30.79 山柰酚 −29.16 木犀草素 −30.92 AKT1 7NH5 槲皮素 −31.67 山柰酚 −32.47 木犀草素 −31.46 MAPK3 4QTB 槲皮素 −29.37 山柰酚 −27.36 木犀草素 −29.29 EGFR 8A2A 槲皮素 −34.56 山柰酚 −36.40 木犀草素 −32.05 TNF 5UUI 槲皮素 −26.94 山柰酚 −26.40 木犀草素 −27.32 SRC 7NG7 槲皮素 −28.45 山柰酚 −30.04 木犀草素 −28.66 JUN 5T01 槲皮素 −26.40 山柰酚 −26.28 木犀草素 −26.57 3. 讨论
社区获得性肺炎的发展在很大程度上取决于宿主对气道中微生物的反应,失调的宿主反应因人而异,并对生存和其他结果产生负面影响,会诱导肺部局部和全身炎症反应[22]。有研究表明出院后的3个月高炎症标志物、死亡率也随之增加。因此,调节机体的免疫及炎症反应对治疗CAP是其关键之一[4]。
炎症是由不同病原体、刺激物或细胞损伤引起的血管组织中最重要的生物反应之一。被认为是生物体对抗病原体诱导的组织损伤的保护机制。在炎症过程中,吞噬细胞的活化会导致NADPH氧化酶的组装,急剧增加ROS的产生。内源性中和系统的活性饱和会导致ROS积累,同时,由于ROS的高化学反应性,会导致针对病原体和宿主生物系统的直接非特异性毒性。增加的ROS也可通过上调参与炎症反应的几个基因来引发和放大炎症。因此ROS通路可能成为炎症治疗的潜在靶点[23]。
本研究通过网络药理学方法,筛选后得到Degree值较高的靶点为GAPDH、AKT1、MAPK3、EGFR、SRC和TNF,这些靶点能通过调节炎症反应和ROS,在治疗CAP的过程中发挥重要作用。其中GAPDH能通过影响糖酵解,阻碍巨噬细胞活化,降低促炎细胞因子的产生来抑制炎症反应[24-25]。Akt是一种多功能激酶,通过调节血管通透性,导致水肿和白细胞外渗,影响炎症反应[26-27]。炎症相关基因的表达受到转录因子的严格调控,其中NF-κB是参与免疫和炎症反应的众多基因的多效性调节因子。氧化物质能导致其易位到细胞核中,通过上调各种促炎细胞因子和酶的产生来放大炎症反应,如白介素、TNF-α和诱导型NOS,增强ROS的细胞毒性作用。MAPK参与NF-κB 转录活性的调节,影响炎症反应和凋亡介质的合成。激活的EGFR也依赖于NF-κB信号传导途径,进一步调节促炎因子表达[28-30]。酪氨酸激酶(Src)作为NF-κB 和MAPKs的主要调节蛋白酪氨酸激酶之一,它可控制NADPH氧化酶活化和ROS产生,是ROS产生和细胞内稳态的主要调节因子,通过调节Src可抑制氧化应激及改善肺损伤中的炎症级联反应[31-33]。
GO及KEGG通路富集分析显示主要涉及蛋白结合、蛋白磷酸化、细胞凋亡及PI3K/Akt信号通路、MAPK信号通路等发挥关键作用。金芪清疏颗粒的核心活性成分主要为槲皮素、山柰酚、木犀草素,皆为黄酮类药物,具有广泛的抗炎、抗氧化、抗微生物作用。其中槲皮素通过激活细胞内MAPK通路,增加细胞内GSH水平,并在清除自由基反应中提供氢供体来源,从而提高细胞的抗氧化能力,抑制氧化应激[34]。还可通过清除NF-κB活化所必需的ROS,阻断TNF-α依赖的NF-κB核转移,降低IL-1β、IL-6、TNF-α水平和NF-κB表达来减轻早期炎症[23]。 此外还有研究表明槲皮素可减轻中性粒细胞气道炎症,抑制铁细胞凋亡和M1巨噬细胞极化[35]。山柰酚能减少ROS形成,抑制iNOS、环氧合酶和一氧化氮表达水平,降低炎症反应,并抑制MAPK途径的表达,减少趋化因子和IL-8的产生而降低炎症负荷[36-37]。木犀草素则能通过抑制NO及ROS产生、清除ROS和活化抗氧化酶、抑制促炎细胞因子表达、调节NF-κB通路、AKT和MAPK通路等途径发挥抗炎抗氧化作用[38-40]。在分子对接过程中核心靶点与核心活性成分均具有较好的结合能力,与当前研究相符。
综上所述,本研究通过网络药理学探讨了金芪清疏颗粒治疗CAP的作用机制,发现金芪清疏颗粒可能通过槲皮素、山柰酚、木犀草素等多种活性成分,作用多个疾病靶点,通过调控Akt、MAPK信号通路、改善氧化应激,发挥抗炎、抗氧化作用,从而明显改善肺部感染的炎症反应及肺部损伤,发挥保护作用。本研究证明金芪清疏颗粒具有多成分、多靶点、多通路的作用特点,为后续进一步深入研究其具体作用机制奠定基础。但仍缺乏相关实验验证,后续应进一步围绕氧化应激与炎症作用机制开展实验设计。
-
表 1 NAFLD活动度积分(NAS)组织学评分判断标准
评分 肝细胞脂肪变(%) 小叶内炎症 肝细胞气球样变 0 <5 无病灶 无 1 5~33 <2 少量气球样细胞 2 34~66 2~4 较多/显著气球样变 3 >66 >4 注:NAS≥5分可明确NASH的诊断;NAS<3分则可排除NASH;两者之间者为NASH可能。 表 2 肝纤维化分期评分判断标准
评分 纤维化程度 0 无 1 窦周或汇管区纤维化 2 窦周和汇管区周围纤维化 3 桥接纤维化 4 肝硬化 表 3 大鼠体重、肝脏重量及肝脏指数(
$ \bar{{x}}\pm {s} $ )组别 动物数(n) 体重(m/g) 肝重(m/g) 肝指数(%) 对照组 8 397.28±31.15 10.46±1.15 2.63±0.14 模型组 8 202.19±15.56## 6.91±1.10## 3.41±0.42## 七味脂肝方低剂量组 8 202.75±14.72 7.31±1.08 3.59±0.34 七味脂肝方中剂量组 8 202.98±17.39 7.90±1.54 3.88±0.57 七味脂肝方高剂量组 8 201.83±16.04 7.82±0.90 3.88±0.43* 阳性对照VE组 8 201.83±11.16 7.22±0.57 3.59±0.34 *P<0.05,与模型组比较; ##P<0.01,与对照组比较。 表 4 小鼠体重、肝脏重量及肝脏指数(
$ \bar{x}\pm {s} $ )组别 动物数(n) 体重(m/g) 肝重(m/g) 肝指数(%) 对照组 16 22.12±2.00 0.91±0.16 4.11±0.47 模型组 16 18.91±1.36## 1.69±0.15## 8.96±0.62## 七味脂肝方低剂量组 16 18.59±1.01 1.56±0.20* 8.41±1.06 七味脂肝方中剂量组 16 18.48±1.08 1.51±0.18** 8.17±0.72** 七味脂肝方高剂量组 16 18.32±1.03 1.54±0.13** 8.38±0.53** 阳性对照RSG组 16 19.14±1.34 1.56±0.18* 8.16±0.68** *P<0.05,**P<0.01,与模型组比较; ##P<0.01,与对照组比较。 表 5 大鼠血清肝功能数据(
$ \bar{x}\pm {s}$ )组别 动物数(n) ALT(U/L) AST(U/L) ALP(U/L) LDH(U/L) 对照组 8 45.50±3.38 165.38±24.80 88.50±15.73 1547.50 ±243.04模型组 8 107.25±32.84## 187.50±24.36 93.75±32.65 1250.00 ±235.02#七味脂肝方低剂量组 8 107.00±37.80 195.88±25.90 87.25±24.54 1263.00 ±451.90七味脂肝方中剂量组 8 69.38±16.33* 171.25±19.91 63.13±18.76* 886.88±304.48* 七味脂肝方高剂量组 8 114.13±51.86 177.88±44.05 89.75±34.65 855.88±375.75* 阳性对照VE组 8 111.00±15.76 165.75±16.61 128.50±58.52 1219.63 ±368.75*P<0.05,与模型组比较;#P<0.05,##P<0.01,与对照组比较。 表 6 大鼠血脂4项数据(
$ \bar{x}\pm {s} $ )组别 动物数(n) TG(mmol/L) TC(mmol/L) HDL(mmol/L) LDL(mmol/L) 对照组 8 0.32±0.10 1.12±0.22 0.28±0.03 0.15±0.02 模型组 8 0.23±0.05# 0.83±0.18# 0.32±0.06 0.14±0.04 七味脂肝方低剂量组 8 0.29±0.07 0.93±0.12 0.38±0.07 0.15±0.03 七味脂肝方中剂量组 8 0.32±0.19 1.25±0.51* 0.49±0.19* 0.21±0.08 七味脂肝方高剂量组 8 0.23±0.06 1.20±0.26** 0.48±0.10** 0.21±0.08 阳性对照VE组 8 0.23±0.05 0.84±0.23 0.33±0.12 0.15±0.04 *P<0.05,**P<0.01,与模型组比较;#P<0.05,与对照组比较。 表 7 小鼠血清肝功能数据(
$\bar{x}\pm {s}$ )组别 动物数(n) ALT(U/L) AST(U/L) ALP(U/L) LDH(U/L) 对照组 16 35.13±6.08 146.06±43.63 88.31±9.41 653.94±145.10 模型组 16 606.06±111.12## 486.31±69.39## 216.19±28.30## 1390.25 ±128.14##七味脂肝方低剂量组 16 561.44±98.43 440.69±67.29 179.06±46.80* 1347.19 ±150.78七味脂肝方中剂量组 16 553.00±116.35 442.94±72.95 198.06±32.64 1261.69 ±122.55*七味脂肝方高剂量组 16 486.63±88.90** 406.25±75.39** 189.94±34.09* 1161.00 ±134.22**阳性对照RSG组 16 513.56±91.17* 441.81±70.00 273.94±43.98** 1328.75 ±160.91*P<0.05,**P<0.01,与模型组比较;##P<0.01,与对照组比较。 表 8 小鼠血脂4项数据(
$\bar{x}\pm {s}$ )组别 动物数(n) TG(mmol/L) TC(mmol/L) HDL(mmol/L) LDL(mmol/L) 对照组 16 0.82±0.39 2.70±0.42 1.64±0.35 0.18±0.03 模型组 16 1.27±0.26## 3.45±0.55## 0.93±0.29## 0.57±0.17## 七味脂肝方低剂量组 16 1.01±0.25** 3.29±0.61 0.91±0.19 0.55±0.18 七味脂肝方中剂量组 16 1.01±0.31* 3.46±0.52 0.99±0.26 0.59±0.13 七味脂肝方高剂量组 16 1.01±0.29* 3.37±0.34 0.99±0.13 0.57±0.10 阳性对照RSG组 16 1.10±0.28 3.33±0.79 0.94±0.32 0.56±0.15 *P<0.05,**P<0.01,与模型组比较; ##P<0.01,与对照组比较。 表 9 小鼠血清TBIL、FFA数据(
$\bar{x}\pm {s}$ )组别 动物数(n) TBIL(μmol/L) FFA(mmol/L) 对照组 16 3.59±0.55 1.41±0.31 模型组 16 7.77±1.52## 2.16±0.46## 七味脂肝方低剂量组 16 6.95±1.78 2.01±0.43 七味脂肝方中剂量组 16 7.79±3.97 1.98±0.49 七味脂肝方高剂量组 16 6.37±1.72* 2.16±0.49 阳性对照RSG组 16 9.09±1.69* 2.20±0.55 *P<0.05,与模型组比较; ##P<0.01,与对照组比较。 表 10 大鼠肝脏脂质水平(
$\bar{x}\pm {s}$ )组别 动物数(n) TG(mmol/g) TC(mmol/g) HDL(mmol/g) LDL(mmol/g) 对照组 8 3.93±0.56 1.49±0.16 0.11±0.03 0.67±0.08 模型组 8 5.97±0.53## 1.14±0.13## 0.03±0.02## 0.25±0.13## 七味脂肝方低剂量组 8 5.73±0.82 1.03±0.12 0.02±0.02 0.27±0.10 七味脂肝方中剂量组 8 5.57±0.93 1.14±0.12 0.03±0.03 0.31±0.07 七味脂肝方高剂量组 8 5.93±0.81 1.10±0.14 0.02±0.01 0.27±0.08 阳性对照VE组 8 7.25±1.40* 1.21±0.15 0.08±0.02** 0.34±0.09 *P<0.05,**P<0.01,与模型组比较; ##P<0.01,与对照组比较。 表 11 小鼠肝脏脂质水平(
$\bar{x}\pm {s}$ )组别 动物数(n) TG(mmol/g) TC(mmol/g) HDL(mmol/g) LDL(mmol/g) 对照组 16 3.54±1.98 1.04±0.15 0.20±0.07 0.35±0.11 模型组 16 8.78±0.89## 2.29±0.21## 0.47±0.13## 0.42±0.21 七味脂肝方低剂量组 16 8.54±1.04 2.20±0.20 0.47±0.08 0.36±0.16 七味脂肝方中剂量组 16 8.69±1.54 2.28±0.31 0.49±0.09 0.43±0.17 七味脂肝方高剂量组 16 7.85±0.79** 2.12±0.39 0.45±0.14 0.39±0.24 阳性对照RSG组 16 8.44±0.97 2.12±0.26 0.47±0.09 0.36±0.16 **P<0.01,与模型组比较; ##P<0.01,与对照组比较。 表 12 大鼠肝脏NAS评分(
$\bar{x}\pm {s}$ )组别 动物数(n) 脂肪变性 小叶内炎症 气球样变 NAS 对照组 8 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 模型组 8 2.88±0.35## 1.63±0.52## 0.00±0.00 4.50±0.76## 七味脂肝方低剂量组 8 3.00±0.00 1.00±0.00* 0.38±0.52 4.38±0.52 七味脂肝方中剂量组 8 3.00±0.00 0.88±0.35* 0.00±0.00 3.88±0.35* 七味脂肝方高剂量组 7 3.00±0.00 0.86±0.38* 0.00±0.00 3.86±0.38 阳性对照VE组 8 3.00±0.00 0.63±0.52** 0.00±0.00 3.63±0.52* *P<0.05,**P<0.01,与模型组比较; ##P<0.01,与对照组比较。 表 13 小鼠肝脏NAS评分(
$\bar{x}\pm {s}$ )组别 动物数(n) 脂肪变性 小叶内炎症 气球样变 NAS 对照组 16 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 模型组 16 3.00±0.00## 2.81±0.40## 1.88±0.34## 7.69±0.48## 七味脂肝方低剂量组 16 3.00±0.00 2.56±0.51 1.69±0.48 7.25±0.86 七味脂肝方中剂量组 16 3.00±0.00 2.13±0.34** 1.38±0.50** 6.50±0.73** 七味脂肝方高剂量组 16 3.00±0.00 1.88±0.34** 1.31±0.48** 6.19±0.66** 阳性对照VE组 16 3.00±0.00 2.19±0.40** 1.56±0.51 6.75±0.68** **P<0.01,与模型组比较; ##P<0.01,与对照组比较。 表 14 小鼠肝脏纤维化分期评分(
$\bar{x}\pm {s}$ )组别 动物数(n) 纤维化分期评分 对照组 16 0.00±0.00 模型组 16 1.56±0.51## 七味脂肝方低剂量组 16 1.75±0.45 七味脂肝方中剂量组 16 1.44±0.51 七味脂肝方高剂量组 16 1.19±0.40* 阳性对照RSG组 16 1.25±0.45 *P<0.05,与模型组比较; ##P<0.01,与对照组比较。 -
[1] 中华医学会肝病学分会脂肪肝和酒精性肝病学组, 中国医师协会脂肪性肝病专家委员会. 非酒精性脂肪性肝病防治指南(2018更新版)[J]. 中华肝脏病杂志, 2018, 26(3):195-203. [2] 蔡江帆, 陈民利. 非酒精性脂肪肝炎动物模型的研究概况[J]. 中国实验动物学报, 2021, 29(1):128-136. [3] 王福根, 梁伟峰, 席建军, 等. 非酒精性脂肪性肝炎动物模型的建立与应用[J]. 中国临床药理学与治疗学, 2015, 20(7):835-840. [4] 马富超, 张泉洋, 王帅, 等. 非酒精性脂肪性肝病动物模型研究进展[J]. 国际药学研究杂志, 2017, 44(5):409-414. [5] 刘玉嫣, 朱邗枝, 贾步云, 等. 治疗非酒精性脂肪性肝炎药物研究进展[J]. 中国新药杂志, 2023, 32(20):2044-2050. [6] STEFAN N, HÄRING H U, CUSI K. Non-alcoholic fatty liver disease: causes, diagnosis, cardiometabolic consequences, and treatment strategies[J]. Lancet Diabetes Endocrinol, 2019, 7(4):313-324. doi: 10.1016/S2213-8587(18)30154-2 [7] EUROPEAN Association for the Study of the Liver(EASL), EUROPEAN Association for the Study of Diabetes(EASD), EUROPEAN Association for the Study of Obesity(EASO). EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease[J]. J Hepatol, 2016, 64(6):1388-1402. doi: 10.1016/j.jhep.2015.11.004 [8] CHALASANI N, YOUNOSSI Z, LAVINE J E, et al. The diagnosis and management of nonalcoholic fatty liver disease: practice guidance from the American Association for the Study of Liver Diseases[J]. Hepatology, 2018, 67(1):328-357. doi: 10.1002/hep.29367 [9] 郑丁. 加味茵陈五苓散治疗非酒精性脂肪性肝炎(湿热蕴结证)的临床观察及机制研究[D]. 湖北: 武汉: 湖北中医药大学, 2021. [10] 曹羽涵. 泽泻白术汤改善非酒精性脂肪肝病的药效学评价[D]. 北京: 中国科学院大学, 2022. [11] 谭利婷. 毛氏降脂方加味治疗非酒精性脂肪性肝炎的临床疗效观察[D]. 广西: 南宁: 广西中医药大学, 2023. [12] 赵文霞, 许二平, 王宪波, 等. 非酒精性脂肪性肝炎中医诊疗指南[J]. 中西医结合肝病杂志, 2022, 32(11):1059-1062. [13] 梅桂斌, 陈力, 姜纯杰, 等. 槲皮素对T2DM小鼠代谢相关脂肪性肝损伤的保护[J]. 华中科技大学学报(医学版), 2021, 50(5):561-565,573. [14] 吉秋霞, 许晓乐. 虎杖苷对高脂喂养的中年LDLr−/-小鼠非酒精性脂肪肝炎的作用及机制研究[J]. 中草药, 2021, 52(12):3602-3610. [15] 黄冠华. 虎杖苷对非酒精性脂肪肝大鼠炎症反应、胰岛素敏感性及信号转导的调节作用[J]. 数理医药学杂志, 2022, 35(5):701-704. [16] VERNON G, BARANOVA A, YOUNOSSI Z M. Systematic review: the epidemiology and natural history of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis in adults[J]. Aliment Pharmacol Ther, 2011, 34(3):274-285. doi: 10.1111/j.1365-2036.2011.04724.x [17] 栾凯, 黄菊, 李江怡, 等. 健肝乐颗粒对高脂和高胆固醇饮食诱导小鼠非酒精性脂肪性肝炎的保护作用[J/OL]. 中药药理与临床. 1-19.(2024-05-20)[2024-06-03]. https://doi.org/10.13412/j.cnki.zyyl.20240520.002. [18] 刘鑫, 罗娅, 徐敏轩, 等. 探索炎症相关靶点: 非酒精性脂肪性肝炎治疗的研究进展[J/OL]. 中国药学杂志: 1-28.(2024-05-30)[2024-06-03]. http://kns.cnki.net/kcms/detail/11.2162.R.20240529.1553.007.html. [19] 周天智, 何堃, 龚建平. Kupffer细胞与肝脏脂质代谢紊乱的研究进展[J]. 世界华人消化杂志. 2015, 23(13): 2071-2076. [20] HAMMERICH L, TACKE F. Hepatic inflammatory responses in liver fibrosis[J]. Nat Rev Gastro Hepat, 2023, 20(10):633-646. doi: 10.1038/s41575-023-00807-x [21] 王星星, 李沫, 高川月, 等. 白杨素减轻非酒精性脂肪性肝炎小鼠脂肪变性及血脂异常[J]. 中国病理生理杂志, 2024, 40(5):899-907. 期刊类型引用(1)
1. 邢信昊,王欣荣,陈莉,仲华,韩蕾,王彦. MIR1基因影响白念珠菌对唑类药物的敏感性. 中南药学. 2023(05): 1125-1129 .  百度学术
百度学术其他类型引用(0)
-





 下载:
下载:
 下载:
下载:


















